Было проведено исследование эффективности и безопасности лечения пациентов с различными формами цереброваскулярной недостаточности с использованием Кавинтона в различных дозировках и формах выпуска. Исследование проходило в 7 центрах Москвы, Санкт–Петербурга, Ярославля и Самары под руководством академиков РАМН Е.И. Гусева, А.А. Скоромца, З.А. Суслиной, чл.–корр. РАМН В.И. Скворцовой, профессоров Я.И. Левина, Н.Н. Спирина и И.Е. Поверенновой.
Кавинтон назначался в течение 90 дней. Терапия начиналась с парентерального (внутривенного капельного) введения препарата в течение 7 дней (по 20, 30, 40, 50, 50, 50 и 50 мг Кавинтона для инфузий в разведении 500 мл физиологического раствора) с последующим переходом на пероральный прием Кавинтона форте в дозе 10 мг/сут. три раза в сутки после еды в течение 11 недель. Первичным параметром эффективности исследования была шкала MMSE, вторичными параметрами оценки были шкалы SF–36 и CGIC–PGIC. Выборку составили 159 пациентов (46 мужчин и 113 женщин), в возрасте от 35 до 75 лет. В соответствии с данными статистического анализа отмечена достоверно значимая разница по выраженности балльной оценки шкал MMSE и SF–36 до и после окончания курса лечения, а также по шкалам CGIC–PGIC на 8 и 90–й день наблюдения. В соответствии с исследуемыми параметрами безопасности лечение Кавинтоном, назначаемым парентерально и перорально, подтвердило данные о его безопасности и хорошей переносимости.
Во всем мире отмечается рост числа сосудистых заболеваний, в том числе сосудистых заболеваний мозга. Россия выделяется среди промышленно развитых стран мира высокой частотой развития инсульта и высокими показателями смертности от инсульта. В среднем в России ежегодно регистрируется около 400–450 тысяч мозговых инсультов. Инвалидизация после перенесенного инсульта достигает 3,2 на 10 тысяч населения, занимая первое место среди всех причин первичной инвалидности. Все это делает проблему инсульта одной из самых острых в условиях современного здравоохранения. Значимость инсульта как медико–социальной проблемы растет с каждым годом, что связывают со старением населения, а также с увеличением в популяции числа людей с факторами риска сердечно–сосудистых заболеваний. В 1998 году в мире от мозгового инсульта умерли 5,1 млн. человек и у 15 млн. был зарегистрирован несмертельный инсульт. Ожидаемый к 2020 году уровень смертности от мозгового инсульта, по прогнозам ВОЗ, составит 7,6 млн. человек [3,5,11].
В конце 70–х годов XX века были сделаны первые попытки раскрыть механизмы последовательного изменения функционального состояния и морфологии ткани мозга, возникших на фоне ишемии. Изучение патоморфологических и биохимических изменений, формирующихся в центральной нервной системе в результате цереброваскулярной недостаточности, в последние годы получило дальнейшее развитие. Показано, что одной из составляющих патогенеза повреждения мозговой ткани является трофическая дисрегуляция, приводящая к биохимической и функциональной дедифференциации нейронов с инициированием каскада патобиохимических реакций, которые ведут к гибели нейронов по механизмам некроза и апоптоза [1,2,33]. Предполагают, что процесс программированной гибели нейронов играет ключевую роль в регуляции клеточного гомеостаза зрелой мозговой ткани. Еще больше оснований предполагать наличие нейронального апоптоза в случаях безинсультного течения церебрального сосудистого заболевания, кратковременной ишемии при ангиоспазме или тромбоэмболии, проявляющихся обратимым или ремиттирующим неврологическим дефицитом. В условиях гипоперфузии мозга механизмы компенсации могут истощаться, энергетическое обеспечение мозга становится недостаточным, в результате чего сначала развиваются функциональные расстройства, а затем и необратимые морфологические изменения мозга.
При хронической гипоперфузии мозга выявляются: замедление мозгового кровообращения (МК), уменьшение содержания кислорода и глюкозы в крови, сдвиг метаболизма глюкозы в сторону анаэробного гликолиза, лактат–ацидоз, гиперосмолярность, капиллярный стаз, склонность к тромбообразованию, деполяризация клеток и клеточных мембран, активация микроглии, которая начинает вырабатывать нейротоксины, что наряду с другими патофизиологическими процессами приводит к гибели клеток [1–3,6]. В то же время доказано, что улучшение микроциркуляции, ликвидация гипоксии, оптимизация метаболизма могут уменьшить выраженность нарушения функций и способствовать сохранению мозговой ткани. В связи с этим весьма актуальным является своевременная диагностика дисциркуляторной энцефалопатии (ДЭ) и адекватное лечение данного синдрома.
К настоящему времени в целом сформировано представление о многофакторном механизме развития сосудистой мозговой недостаточности. Однако ни один из факторов риска не может сполна объяснить ни выраженность неврологических нарушений, ни характер течения заболевания, что подтверждает сложность механизмов возникновения и прогрессирования острой и хронической сосудистой мозговой недостаточности.
Первые позиции среди причин, приводящих к хронической гипоперфузии мозга, занимают артериальная гипертония в сочетании с атеросклеротическим поражением сосудов, ишемической болезнью сердца, сопровождающейся хронической сердечной недостаточностью; гемостатические нарушения; выраженная венозная недостаточность; сахарный диабет, курение, злоупотребление алкоголем.
Не будет преувеличением сказать, что в настоящее время здоровью населения также угрожает эпидемия артериальной гипертонии (АГ). По данным Центра профилактической медицины, среди женщин старше 18 лет страдают АГ 41,1%, среди мужчин – 39,2%. Коварством повышенного АГ является то, что, не обнаруживая себя клинически, оно приводит к развитию серьезных сердечно–сосудистых осложнений – инфаркта миокарда и мозгового инсульта. По данным мета–анализа 7 проспективных исследований, установлено, что с ростом артериального давления (АД) относительный риск развития мозгового инсульта возрастает. АГ приводит к ряду морфофункциональных изменений в сердечно–сосудистой системе в виде ремоделирования артерий, гипертрофии левого желудочка сердца, концентрическому ремоделированию миокарда, приводящих к развитию сердечной недостаточности [12,19].
Совершенствование подходов терапии больных АГ с сопутствующей цереброваскулярной патологией ведет к поиску новых эффективных схем лечения препаратами, широко применяемыми в неврологической практике.
Препарат Кавинтон имеет 50–летнюю историю клинического и экспериментального изучения. Только препарат, обладающий высокой клинической эффективностью и безопасностью применения, может так длительно и успешно конкурировать с постоянно возрастающим количеством новых лекарственных средств, существующих сегодня на фармакологическом рынке. Широкий спектр проводимых экспериментальных исследований на основе современных иммунологических, биохимических и цитохимических технологий выявил молекулярные механизмы терапевтической активности Кавинтона. Уникальность механизма действия Кавинтона состоит в том, что он способен одинаково воздействовать на три патологических звена, характерных для развития цереброваскулярной недостаточности: расстройства мозгового обмена, кровотока и микроциркуляции. Под патронажем Gedeon Richter препарат прошел свыше 100 экспериментальных и клинических испытаний с участием более 30 тыс. пациентов. Эти исследования проводились в таких странах, как Япония, Россия (СССР), США, Великобритания, Германия, Франция, Италия, Португалия. Кавинтон продемонстрировал преимущества перед традиционно использующимися лекарственными средствами [6–10,12–34].
Кавинтон улучшает мозговой метаболизм, увеличивая потребление и утилизацию глюкозы и кислорода тканями мозга, улучшая переносимость гипоксии мозговыми клетками; переводит обмен глюкозы в энергетически более выгодное аэробное направление; увеличивает концентрацию АТФ и отношение АТФ/АМФ; усиливает внутримозговой обмен норадреналина и серотонина; стимулирует восходящую норадренергическую систему; обладает антиоксидантными эффектом. Данные механизмы действия обеспечивают нейропротективный эффект этого препарата [7–9,23–26,27–32].
Кавинтон ингибирует агрегацию тромбоцитов, снижает патологически увеличенную вязкость крови, особенно при малых скоростях сдвига, нормализует деформируемость эритроцитов, способствует внутритканевому транспорту кислорода [8].
Помимо этого, Кавинтон избирательно повышает мозговой кровоток, уменьшает сопротивление мозговых сосудов без воздействия на системное кровообращение (практически не влияя на артериальное давление, минутный объем, частоту сердечных сокращений, общее периферическое сопротивление). Он не вызывает феномена «обкрадывания», а наоборот, улучшает кровоснабжение прежде всего пораженной области, причем кровоток в интактной зоне мозга сохраняется неизменным.
Достоинства препарата заключаются в сочетании высокой эффективности, хорошей переносимости, безопасности лечения пациентов пожилого возраста (даже при длительном применении), избирательности действия на центральную нервную систему и отсутствии синдрома «обкрадывания», взаимодействия с другими лекарственными средствами, влияния на функции других органов, токсического действия и кумуляции.
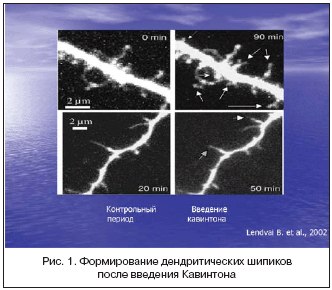
После стольких лет существования Кавинтона на фармакологическом рынке, не угасает интерес к изучению механизмов его действия, так как с каждым годом открываются новые свойства данного препарата, показывающие новые возможности его применения. В последнее время были выявлены новые аспекты его фармакологического действия: мембраностабилизирующий эффект, стимуляция норадренергической системы восходящей ретикулярной формации, участие в модуляции пластичности. В исследовании, проведенном B. Lendvai c соавт. в 2002 году [28], доказано, что введение Кавинтона вызывает активное формирование дендритических шипиков нейронов (рис. 1).
Отдельно следует отметить положительное влияние Кавинтона на способность к обучению и сохранению информации. В ходе проведенных исследований в 1988 году Coleston D.M. с соавт. [14] и в 1991 году Hindmarch L. с соавт. [22] отметили достоверное улучшение кратковременной памяти после перорального приема 40 мг Кавинтона в сутки. Кавинтон уменьшает, а порой и нормализует различные по происхождению расстройства обучения, а также снижение памяти, вследствие чего он относится к группе так называемых «когнитивных усилителей» (ноотропов). Авторы рекомендуют назначение препарата для улучшения когнитивных функций, в первую очередь в случае нарушений памяти у людей пожилого возраста. Исследователи провели рандомизированное двойное слепое плацебо–контролируемое исследование эффективности перорального приема Кавинтона в различных дозировках (15, 30 и 60 мг/сут.) у 685 больных в возрасте старше 60 лет с психосиндромом легкой или средней степени тяжести, диагностированных по критериям органических психосиндромов. Было выявлено улучшение состояния у 85% больных, в том числе в 51% случаев – значительное. По выводам исследователей, лечение Кавинтоном достоверно улучшает внимание и память, настроение и поведение, улучшает повседневную активность и удовлетворенность жизнью. Diodo N. с соавт. [13] провели исследование эффективности применения Кавинтона у пациентов с болезнью Альцгеймера [13,14], где было подтверждено положительное влияние Кавинтона на динамику когнитивных функций.
Особо следует сказать о положительных особенностях эффективности применения Кавинтона у пациентов, составляющих особые категории:
– у пожилых пациентов не наблюдается изменений фармакокинетики Кавинтона;
– в проведенных исследованиях не получено данных о клинически значимых лекарственных взаимодействиях Кавинтона с препаратами, входящими в другие фармакологические группы;
– применение Кавинтона у пациентов с печеночной и почечной недостаточностью не требует коррекции дозы данного препарата;
– в ходе многочисленных клинических исследований подтверждена безопасность длительного применения Кавинтона (до 2–х лет).
Однако следует признать, что лечебный эффект Кавинтона зависит от дозы. Внутривенное введение Кавинтона в малых дозах оказалось менее эффективным. Дальнейшее изучение препарата по новым показаниям дозы и продолжительности лечения могли бы способствовать правильному выбору тактики лечения. В последние годы препарат Кавинтон, ввиду его хорошей переносимости и практическом отсутствии побочных нежелательных явлений, назначается в дозах 30–50 мг/сут. как при парентеральном, так и пероральном приеме. Поэтому было предпринято мультицентровое исследование эффективности и безопасности применения препарата Кавинтон у пациентов с цереброваскулярной недостаточностью. Была предложена схема парентерального назначения данного препарата с титрованием дозы от 20 до 50 мг/сут. в течение 7 дней с последующим переходом на пероральный прием Кавинтона форте по 30 мг/сут. в три приема.
Цель работы. Исследование эффективности курса лечения (3 месяца) Кавинтоном когнитивных нарушений и качества жизни у больных цереброваскулярными заболеваниями и оценка безопасности проводимой терапии.
Материал и методы
Исследование проводилось в течение 3 месяцев. Исследуемую группу составили 159 пациентов (46 мужчин и 113 женщин) с цереброваскулярной недостаточностью в возрасте от 35 до 75 лет, находившихся на амбулаторном лечении и получавших препарат Кавинтон, назначавшийся в течение первой недели в/в капельно в дозах 20, 30, 40, 50, 50, 50, 50 мг/сут. в разведении 500 мл физиологического раствора. В дальнейшем пациенты получали перорально 30 мг/сут. Кавинтона форте, разделенных на 3 приема в течение 11 недель. Помимо этого, больные исследуемой группы получали терапию, которая была максимально унифицирована.
Критерии включения. В исследование вошли пациенты с диагностированным цереброваскулярным заболеванием, подтвержденным КТ/МРТ с показателями по краткой шкале оценки психического статуса (MMSE) от 24 до 28 баллов и индексом массы тела 18 кг/м≥ BMI ≤35.
Критериями исключения явились:
– диагностированное острое нарушение мозгового кровообращения;
– прием препарата Кавинтон (винпоцетин) за месяц до включения в исследование;
– в исследование не включались пациенты, получавшие лечение препаратами, обладающими влиянием на мнестико–интеллектуальные функции за две недели до включения в данное исследование;
– некорригированная артериальная гипертония (систолическое >180 мм рт.ст. и диастолическое >100 мм рт.ст.);
– увеличение интервала QTс>500 мс;
– тяжелая сопутствующая соматическая патология, приводящая к клинически значимым изменениям данных клинико–лабораторных исследований.
Оценочные шкалы
С целью детальной оценки неврологического статуса и возможности последующей обработки данных применялись следующие шкалы:
– Скрининг–оценка умственного состояния (Mini Mental State Examination MMSE),
– шкалы CGIC–PGIC (Шкалы оценки общего клинического впечатления и общего впечатления пациента об изменениях). PGIC представляет собой самооценку пациента по изменению общих показателей состояния организма больного (от начала исследования), оцениваемого по семибалльной шкале. CGIC представляет собой клиническую оценку общих изменений состояния пациента от начала исследования, оцениваемых также по семибальной шкале.
– шкала SF–36 является многоцелевым опросником для определения общего состояния здоровья по 36 вопросам.
Проведение исследования
Неврологический статус пациентов фиксировался до включения в исследование, а затем в конце первой недели наблюдения и в конце курса лечения (90–й день).
Безопасность лечения оценивалась посредством наблюдений за изменениями в физическом состоянии, изменениями в основных показателях жизнедеятельности организма, оценки показателей электрокардиограммы и результатов лабораторных исследований. Также проводился анализ неблагоприятных явлений.
Статистический анализ клинических данных выполнялся с использованием программного продукта «SAS System for Windows» (Выпуск 9.1 TS, уровень I М3 США), специалистами Группы биологической статистики компании Гедеон Рихтер. Все статистические тесты оценивались при уровне значимости в 95% (α=0,05).
Результаты исследования
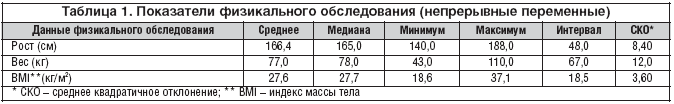
Все больные, включенные в исследование, в течение всего периода наблюдения имели корригированные цифры АД. Результаты проведенных гематологических и лабораторных исследований находились в пределах определенных граничных показателей. В таблице 1 приведены показатели физикального обследования.
Средний вес пациентов составлял 77 кг, средний рост 166 см и средний индекс массы тела 27,6 кг/м2.
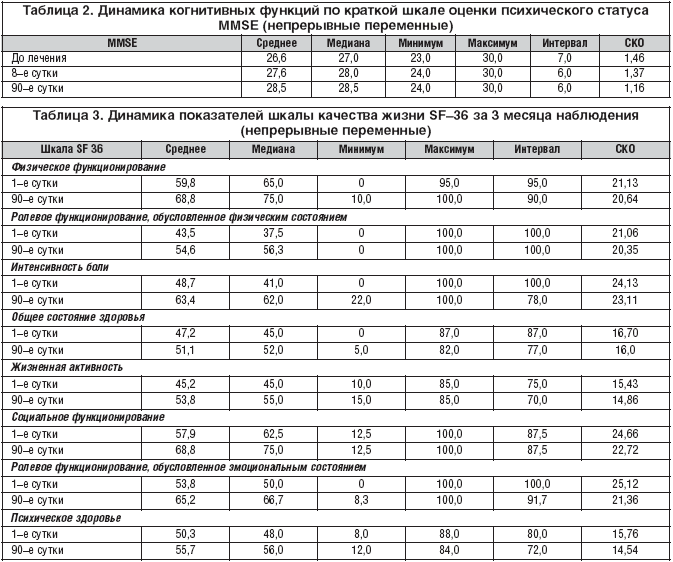
В таблице 2 приведены показатели балльной оценки по шкале MMSE у пациентов, вошедших в исследование, на 1, 8 и 90–e сутки наблюдения.
Наблюдалась статистически значимая разница между начальным уровнем и конечной точкой исследования (90–е сутки) по шкале MMSE (медиана при врачебном осмотре 1:27,0 и среднее при врачебном осмотре 1:26,6, медиана при врачебном осмотре 3:28,5 и среднее при врачебном осмотре 3:28,5, p<0,0001).
Исследователи обнаружили статистически значимую разницу балльной оценки MMSE между данными первого врачебного осмотра и клинического тестирования уже на 8–е сутки наблюдения – окончания парентерального приема препарата Кавинтон (медиана при врачебном осмотре 1:27,0 и среднее при врачебном осмотре 1:26,6, медиана при врачебном осмотре 2:28,0 и среднее при врачебном осмотре 2:27,6 (p<0,0001), а также между данными второго и третьего врачебного осмотра (медиана при врачебном осмотре 2:28,0 и среднее при врачебном осмотре 2:27,6, медиана при врачебном осмотре 3:28,5 и среднее при врачебном осмотре 3:28,5 (p<0,0001).
Среднее улучшение по шкале MMSE составило 2 пункта. Клиницисты отмечают, что минимальным значимым изменением у больных с деменцией являются 3 пункта. Однако в исследование Кавинтона включались больные с мягкими когнитивными нарушениями, что подразумевает боʹльшие сложности в оценке достигнутого улучшения.
В таблице 3 представлена динамика балльной оценки шкалы качества жизни SF–36 за период наблюдения (3 месяца).
Шкала SF–36 (Краткая версия опросника здоровья) отражает общую самооценку здоровья в динамике за год наблюдения. В нашем исследовании при анализе динамики балльной оценки всех 8 пунктов данного опросника за 3 месяца наблюдения была отмечена статистическая достоверная положительная динамика (p<0,0001), что говорит о выраженном улучшении качества жизни пациентов, определяемом ими самостоятельно.
Наибольшая эффективность курсового лечения Кавинтоном была отмечена по шкале «физического функционирования», шкалам «ролевого функционирования, связанным с физическим и эмоциональным состоянием», шкале «жизненной активности и социального функционирования «общего состояния здоровья», «психического здоровья» и «жизненной активности». Из всех пунктов Краткой версии опросника здоровья наименьшие показатели эффективности получены по пункту «интенсивность боли».
В таблице 4 приведены результаты тестирования по шкалам общего клинического и общего впечатления пациента о динамике состояния до и после проведения трехмесячного курса лечения препаратом Кавинтон.
Исследователи обнаружили статистически значимую разницу по шкалам CGIC и PGIC. Выявлено статистически достоверно значимое улучшение балльной оценки по шкалам оценки общего клинического впечатления и общего впечатления пациента об изменениях (p<0,0001).
Для CGIC: среднее при врачебном осмотре 2 составило 2,7, среднее при врачебном осмотре 3 составило 2,2. Для PGIC: среднее при врачебном осмотре 2 составило 2,6, при врачебном осмотре 3 – 2,2. Данный факт сопоставимости данных по изменению общего клинического состояния, выявленных с позиций как клиницистов, так и собственно пациентов, участвующих в исследовании, является критерием объективности полученных данных об улучшении качества жизни больных, вошедших в данное исследование.
Безопасность и нежелательные
явления
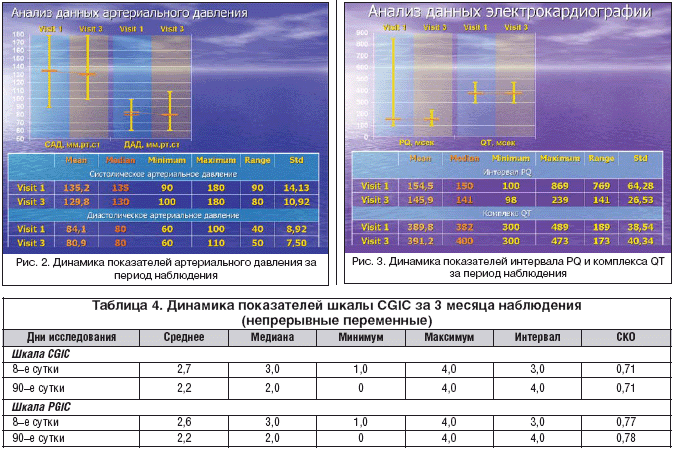
Проведенный анализ динамики цифр АД не выявил статистически значимой динамики уровня систолического и диастолического АД между визитами 1 и 3 (рис. 2).
Анализ данных электрокардиографического обследования также не выявил статистически значимых отличий динамики показателей интервала PQ и комплекса QT (рис. 3). Таким образом, применение Кавинтона не приводило к достоверному снижению или повышению артериального давления, не изменялась также электрическая активность сердца и не наблюдалось аритмогенной активности.
У 14 пациентов (8,8%), вошедших в исследование, зафиксированы неблагоприятные побочные эффекты. Наиболее частыми были жалобы на головную боль, головокружение несистемного характера (20%), отмечались тошнота, тахикардия, нарушения координации, появление высыпаний на коже. В трех случаях лечение Кавинтоном было прекращено из–за головной боли, головокружения, аллергической реакции.
За весь период наблюдения у пациентов, вошедших в исследование, не отмечалось серьезных нежелательных явлений и смертельных случаев. При проведении анализа данных лабораторно–инструментальных обследований не отмечено клинически значимых изменений.
Таким образом, при проведении исследования по изучению эффективности и безопасности Кавинтона и Кавинтона форте, применяемых в более высоких терапевтических дозах, отмечено статистически достоверное улучшение когнитивных функций, общего состояния и качества жизни у пациентов с цереброваскулярной недостаточностью.
• Так, при лечении Кавинтоном и Кавинтоном форте среднее улучшение по шкале MMSE составило 2 пункта.
• При лечении Кавинтоном и Кавинтоном форте по всем 8 пунктам Краткой версии опросника здоровья за 3 месяца наблюдения была отмечена статистическая достоверная положительная динамика (p<0,0001), что говорит о выраженном улучшении качества жизни пациентов. Наибольшая эффективность курсового лечения Кавинтоном была отмечена по шкалам «физического функционирования», шкалам «ролевого функционирования, связанного с физическим и эмоциональным состоянием», шкале «жизненной активности и социального функционирования; «общего состояния здоровья», «психического здоровья» и «жизненной активности».
• Проведенное исследование выявило статистически достоверно значимое улучшение по шкалам оценки общего клинического впечатления и общего впечатления пациента об изменениях (p<0,0001). Сам факт сопоставимости данных по изменению общего клинического состояния, выявленных с позиций как клиницистов, так и собственно пациентов, участвующих в исследовании, является критерием объективности полученных результатов, свидетельствующих об улучшении качества жизни участников исследования.
• Применение Кавинтона и Кавинтона форте не приводило к достоверному снижению или повышению артериального давления, а также не изменяло электрической активности сердца и не обладало аритмогенной активностью.
Литература
1. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. М. Медицина 2001.
2. Скворцова В.И. Участие апоптоза в формировании инфаркта мозга./Журнал неврологии и психиатрии им.Корсакова. Приложение «Инсульт». 2001. Вып.2; 12–19.
3. Скворцова В.И. и др. Хроническая ишемия мозга./Журнал Болезни сердца и сосудов. 2006. № 3; 4–8.
4. Кавинтон в эксперименте и клинической практике. Метод. Рекомендации. Под ред. Гусева Е.И.. Москва. 1998.
5. Фритас Г.Р., Богуславский Дж. Первичная профилактика инсульта./Журнал неврологии и психиатрии им. Корсакова. Приложение Инсульт 2001 вып. 1,С. 7–21.
6. Хаджиев Д. Нейропротективная терапия при латентных формах недостаточности мозгового кровообращения как первичная профилактика ишемического инсульта./Журн. «Качественная клиническая практика». 2003. № 2; 1–5.
7. Хорват Ш. Кавинтон в терапии хронической недостаточности мозгового кровообращения./Orvosi Hetilap. 2001. 8: 383–389.
8. Суслина З.А. с соавт. Кавинтон в лечении больных с ишемическими нарушениями мозгового кровообращения./Русский медицинский журнал. 2003. Т. 10; № 25: 1170–1174.
9. Эниня Г.И., Пуриня И.В., Тимофеева Т.Н. Влияние кавинтона, трентала, сермиона и курантила на скорость кровотока в отдельных участках мозговых артерий. / Журн. невропатол. и психиатр. им. С.С.Корсакова – 1992 – т.94(1) – стр.13–15.
10. Bereczki D., Fekete I.: A systematic review of vinpocetine therapy in acute ischemic stroke / Europ. J. Clin. Pharmacol. – 1999 – Vol.55(5) – P.349–352.
11. Bogousslavsky J. On behalf of the European Stroke Initiative. Stroke prevention by the practitioner. // Cerebrovasc Dis 1999;9:Suppl 4:1–68.
12 Dahlolof B., Devereux R., Kjeldsen S. et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised study against atenolol. // Lancet, 2002, 359, 1003.
13. Diogo N., et al.: The safety and lack of efficacy of vinpocetine in Alzheimer’s disease / J. Amer. Geriatr. Soc. – 1989 – Vol.37(6) – p.515–520.
14. Coleston D.M., Hindmarch I.: Possible memory–enhancing properties of vinpocetine / Drug Dev. Res. – 1988 – Vol.14 – р.191–193.
15. Ebi O. Jpen–labeled phase III clinical trials with vinpocetine in Japan. Ther. Hung., 1985, 33, 41–49.
16. Erdo S.L., Molnar P., Lakics V., et al.: Vincamine and vincanol are potent blockers of voltage–gated Nа+ channels / Europ. J. Pharmacol. – 1996 – Vol.314(1–2) – p.69–73.
17. Erdo S.L., Cai N.S., Wolff J.R., Kiss B.: Vinocetine protects against excitotoxic cell death in primary cultures of rat cerebral cortex / Europ. J. Pharmacol. – 1990 –Vol.187(3) – p.551–553.
18. Gaal L., Molnar P.: Effect of vinpocetine on noradrenergic neurons in rat locus coerulеus / Europ. J. Pharmacol. – 1990 –Vol.187(3) – p.537–539.
19. Goldstein L.B., Adams R., Becker K. et al. Primary prevention of ischemic stroke: a statement for healthcare professionals from the Stroke Council of the American Heart Association. // Stroke 2001; 32: 280–299.
20. Gulyas B., Haldin C., Karlsson P.: Brain uptake and plasma metabolism of (11C) vinpocetine: a prеilimanary PET study in a cynomolgus monkey / J. Neuroimaging – 1999 – Vol.9(4) – P.217–222.
21. Hayakawa M.: Effect on vinpocetine on red blood cell deformability in stroke patients / Arzneim.–Forsch. – 1992 – Vol.42(4) – р.425–427.
22. Hindmarch I.: Calcium antagonist activity of vinpocetine and vincamine in several models of cerebral ischemia / Drug Dev. Res. – 1988 – Vol.14(3–4) – p.297–304.
23. Kiss B., Karpati E.: Mechanism of action of vinpocetine / Acta Pharm. Hung. – 1996 – Vol.66(5) – р.213–224.
24. Kiss B., Szporny L.: On the possible role of central monoaminergic systems in the central nervous system actions of vinpocetine / Drug Dev. Res. – 1988 – Vol.14 – р
25. Santos M.S., Duarte A.I., Moreira P.I. et al.: Synaptosomal response to oxidative stress: effect of vinpocetine / Free Radic. Res. – 2000 – Vol.32(1) – p.57–66.
26. Shibota M., Kakihana M., Nagaoka A.: The effect of vinpocetine on brain glucose uptake in mice // Nippon Yakurigaku Zasshi – 1982 – Vol.80(3) – р.221–224.
27. Lаkics V., Sebestyen M.G., Erdo S.L.: Vinpocetine is a highly potent neuroprotectant against veratridin–induced cell death in primary cultures of rat cerebral cortex / Neirosci. Lett. – 1995 – Vol.185(2) – p.127–130.
28. Lendvai B, Zelles T, Rozsa B, Vizi ES. A vinca alkaloid enhances morphological dynamics of dendritic spines of neocortical layer 2/3 pyramidal cells. Brain Res Bull. 2003 Jan 15;59(4):257–60.
29. Ley Beth M.: Vinpocetine: revitalize your brain with periwinkle extract / BL Publications, Detroit Lakes, MN, 2000, p.17.
30. Miyazaki M.: The effect of a cerebral vasodilatator vinpocetine on cerebral vascular resistance evaluated by the Doppler ultrasonic technique in patients with cerebrovascular diseases / Angiology – 1995 – Vol.46(1) – р.53–58.
31. Moldvai I., Temesvari–Major E., Szantay C.Jr., et al.: Synthesis of vinca alkaloids and related compounds. Part 84. Sulfonamide derivatives of some vinca alkaloids with cardiovascular activity – 1997 – Vol.330(6) – p.190–198.
32. Molnar P., Erdo S.L.: Vinpocetine is potent as phenytoin to block voltage–gated Na+ channels in rat cortical neurons / Europ. J. Pharmacol. – 1995 – Vol.273(3) – p.303–306.
33. Warach S. Measurement of the penumbra with MRI: It is about time. Stroke 2003: 34:10:2533–2534.












