Для цитирования. Титова Н.В. Пациент с неспецифической болью в нижней части спины: алгоритм диагностики и терапии // РМЖ. 2016. No 12. С. 775–781.
Актуальность проблемы боли в нижней части спины (БНЧС) не вызывает сомнения, ибо с ней сталкиваются в тот или иной момент жизни большинство людей. Ежегодная распространенность этого состояния в общей популяции достигает 15–20% [1]. Среди опрошенных людей трудоспособного возраста 50% признают, что боль в спине они испытывают ежегодно [2, 3]. Боль в спине – наиболее частая причина снижения трудоспособности у лиц моложе 45 лет [4]. Одномоментно в США примерно 1% популяции постоянно инвалидизирован из-за хронической боли в спине и 1% временно инвалидизирован [1]. Высокая общая стоимость заболевания также свидетельствует о немаловажности названной проблемы. Многие исследования демонстрируют весьма существенные социоэкономические издержки, связанные с этим заболеванием. БНЧС является 2-й по частоте причиной обращения к специалистам первичного звена, наиболее частым поводом для обращения к ортопеду, нейрохирургу и физиотерапевту, а также 3-й по частоте причиной хирургического вмешательства [5]. Косвенные затраты, связанные с нетрудоспособностью таких пациентов, превышают стоимость лечения в 3 раза. Кроме того, значительное место занимают и нематериальные затраты – связанные с болью, страданиями, дискомфортом, которые испытывает больной [6].К сожалению, большое количество пациентов с БНЧС получают неадекватные диагностические подходы и ненадлежащую или субоптимальную помощь. Зачастую лечение приводит к ухудшению симптоматики. Яркими примерами этого могут быть неверная рекомендация длительного постельного режима или усиление симптомов после хирургического вмешательства. Важность темы БНЧС подтверждает нарастающее количество исследований эффективности и безопасности лечебных подходов и адекватности назначения диагностических тестов.
Подходы к диагностике неспецифической БНЧС
Работа с пациентом, страдающим БНЧС, предполагает четкое понимание врачом алгоритма действий (рис. 1).
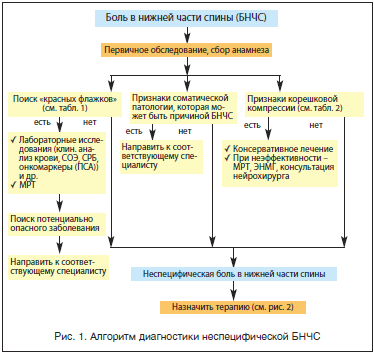
Оценивая результаты осмотра и тщательного сбора анамнеза, необходимо понять, к какой из 4-х клинических категорий можно отнести проблему БНЧС у конкретного больного:
– потенциально «опасное» состояние: спинальная опухоль, инфекция, перелом, синдром конского хвоста;
– боль, связанная с соматической патологией;
– радикулопатия;
– неспецифическая БНЧС.
Подобная классификация представляется наиболее полезной, поскольку позволяет определить правильную тактику дальнейшей диагностики и лечения.
При первичном осмотре важно получить информацию о возрасте пациента, длительности боли и описательных характеристиках симптомов, влиянии симптомов на повседневную активность, ответе на предшествующее лечение.
Заподозрить связь боли в спине с заболеваниями, представляющими опасность и требующими специфического лечения, можно выявив так называемые «красные флажки» (табл. 1) [7].
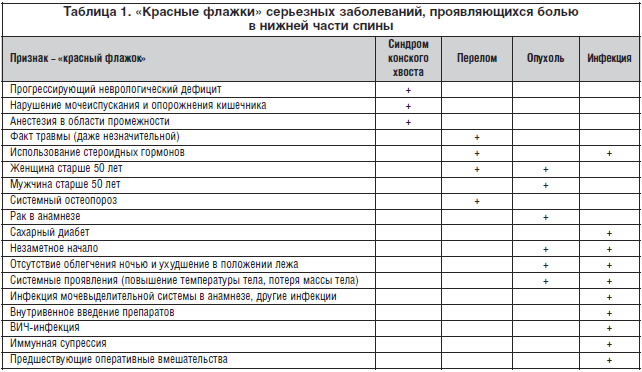
Признаками, настораживающими в отношении опухолевого процесса, являются постоянные боли, не зависящие от положения или движения, боли усиливающиеся при ношении тяжестей или ночью, возраст старше 50 лет, злокачественная опухоль в анамнезе, неэффективность предшествующего консервативного лечения (отсутствие улучшения в течение 30 дней), необъяснимая потеря веса.
«Красными флажками» инфекционного процесса (гнойный или туберкулезный остеомиелит, спинальный эпидуральный абсцесс) являются недавние инфекции (например, мочевыводящих путей или кожи), внутривенное использование лекарственных препаратов или наркотических средств, сопутствующее иммуносупрессивное состояние, лихорадка и недомогание.
Сведения о значимой травме с учетом возраста, например падение с высоты, прямой удар или дорожно-транспортное происшествие у молодого пациента или незначительные падения, подъем тяжести у пациентов с возможным остеопорозом (возраст старше 50 лет, длительное применение глюкокортикостероидов), а также точечная (локальная) болезненность в предполагаемой области перелома, усиление боли при ношении тяжестей позволяют вовремя диагностировать компрессионный перелом.
Опрос в отношении серьезного неврологического дефекта, такого как недержание мочи, кала, анестезия в области промежности, сенсорный или моторный дефицит в нижних конечностях (области, соответствующие иннервации L4, L5, S1), необходим для выявления «красных флажков» синдрома конского хвоста.
У 2% пациентов БНЧС может быть обусловлена соматической патологией: заболевания органов таза (простатит, эндометриоз, хронические воспалительные заболевания органов малого таза), заболевания почек (нефролитиаз, пиелонефрит, перинефритический абсцесс), аневризма аорты, заболевания ЖКТ, панкреатит, холецистит, язва желудка, заболевания сердца и перикарда, легких и плевры [8]. Среди этих состояний отдельно нужно выделить боль в спине, обусловленную аневризмой брюшного отдела аорты (более 4 см). Заподозрить это состояние поможет наличие сопутствующей боли в животе или паху, шум при аускультации в области центрального эпигастрия, пальпация усиленной аортальной пульсации, наличие заболевания периферических сосудов или ишемической болезни сердца и связанные с ними факторы риска (возраст старше 50 лет, продолжительный период курения, гипертония, сахарный диабет), отсутствие усиления боли при двигательном напряжении, положительный семейный анамнез.
Как «красный флажок» должно интерпретироваться отсутствие положительной динамики на фоне лечения в течение 4–6 нед., что может свидетельствовать о неверном диагнозе.
Таким образом, выявление «красных флажков» должно насторожить клинициста в отношении возможного серьезного заболевания, лежащего в основе боли в спине, и направить пациента к узкому специалисту. К счастью, частота подобных состояний не высока.
При отсутствии «красных флажков» и явных признаков соматических заболеваний, которые могут быть причиной болевого синдрома, проводится дальнейшая категоризация на корешковый синдром (радикулопатию) и так называемую неспецифическую боль в спине. У пациента без «симптомов опасности» в течение 1 мес. после появления симптомов специальные диагностические тесты не требуются. Это связано с тем, что большинство больных восстанавливают свою активность в течение 1-го месяца лечения. Лишь при наличии «красных флажков» требуется проведение клинического анализа крови с измерением СОЭ [7].
В отношении нейровизуализации надо сказать, что патологические изменения при рентгенологических и МРТ-исследованиях обнаруживаются у большинства пациентов без болевого синдрома в пояснично-крестцовой области. При обследовании людей, ни разу в жизни не испытавших боли в спине, было показано, что на МР-томограммах могут обнаруживаться грыжи дисков у 9–76%, протрузии у 20–81%, дегенеративные изменения дисков у 46–93% [9]. Шанс выявить грыжу на МРТ увеличивается с возрастом. Поэтому к интерпретации МРТ-данных надо подходить с осторожностью, принимая во внимание возраст и клиническую картину.
Для выявления корешкового поражения при неврологическом осмотре у пациента с БНЧС надо сфокусироваться на исследовании коленных и ахилловых рефлексов, силе дорзальной и подошвенной флексии большого пальца стопы и распространении чувствительных нарушений (табл. 2). Симптомы выпадения функций корешка позволяют определить уровень компрессии.

Корешковая компрессия проявляется типичной болью с иррадиацией в конечность и может иметь характер нейропатической боли. Надо отметить, что у пациентов, у которых боль не иррадиирует ниже колена, симптомная грыжа диска маловероятна (0,2%), в то время как у 95% пациентов с грыжей диска и компрессией корешка имеется подобное распространение боли [10]. При радикулопатии боль провоцируется движением в поясничном отделе позвоночника, кашлем, чиханием, натуживанием.
Характерным для поражения корешка на поясничном уровне являются истинные симптомы натяжения. С нижних конечностей наиболее значимый симптом натяжения – это симптом Ласега. Для истинного симптома Ласега свойственна интенсивная боль в пояснице с иррадиацией по ходу пораженного корешка, вплоть до стопы. Если же в положении больного лежа на спине при подъеме ноги, выпрямленной в коленном суставе, боль возникает только локально в пояснице или бедре, или под коленом, или в голени – это свидетельствует о наличии псевдосимптома Ласега и связано с растяжением спазмированных мышц (паравертебральных или задних мыщц бедра или голени).
Наличие корешковой компрессии требует особой внимательности со стороны врача и мониторинга состояния пациента на фоне консервативной терапии. Если возникший выраженный нейромоторный дефицит (например, парез стопы, слабость мышц-сгибателей бедра или слабость четырехглавой мышцы бедра) носит стойкий или прогрессирующий характер, а также в случае некупируемых корешковых болей (при подтверждении соответствующего уровня компрессии по данным МРТ) необходима консультация нейрохирурга для решения вопроса о дальнейшей тактике ведения пациента.
При оценке боли нужно исключить наличие нейрогенной перемежающейся хромоты, которая является патогномоничным симптомом, позволяющим еще до проведения дополнительных методов обследования предположить наличие стеноза позвоночного канала. Для нее характерно появление боли при ходьбе, которая регрессирует при присаживании либо наклонении туловища вперед. Окончательный диагноз стеноза позвоночного канала ставится при сочетании клинических проявлений и данных дополнительных методов обследования: МРТ, КТ и рентгенографии позвоночника (переднезадний размер менее 12 мм). Зачастую эффективность консервативного лечения является недостаточной, что требует проведения хирургического лечения.
При исключении 1–3-й категорий причин БНЧС можно предполагать наличие неспецифической боли в спине. В клинической практике она встречается наиболее часто – в 85% случаев. В ее основе лежит нарушение функциональной стабильности позвоночного столба, которая обеспечивается динамическим взаимодействием костных и хрящевых элементов, связочного аппарата, а также паравертебральных мышц. Это могут быть изменения в межпозвонковых суставах (остеоартроз фасеточных или дугоотростчатых суставов), гипертрофия и оссификация связочного аппарата позвоночника, миофасциальный синдром или вторичный мышечно-тонический синдром. Чаще всего определить конкретный источник боли не представляется возможным.
Сопутствующие при дорсалгии рефлекторные мышечно-тонические синдромы замыкают порочный круг: боль – мышечный спазм – боль. Они могут формироваться в паравертебральных и экстравертебральных мышцах (грушевидной, средней ягодичной и др.). При этом боль ограничена пределами спазмированной мышцы и провоцируется работой этой мышцы или ее растяжением. Наблюдаются псевдосимптомы натяжения. Напряжение мышцы определяется пальпаторно.
Подходы к терапии неспецифической БНЧС
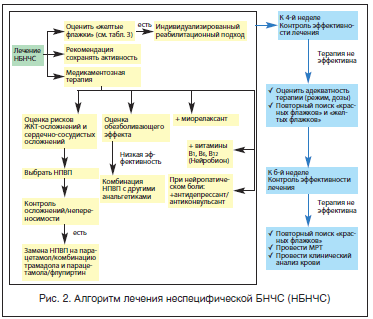
Алгоритм лечения пациента с неспецифической БНЧС представлен на рис. 2.
При первичном осмотре нужно постараться установить взаимопонимание с пациентом, оговорить его ожидания и сфокусировать внимание на психологических и социоэкономических особенностях его жизни, поскольку эти факторы могут осложнять оценку клинической картины и дальнейшее лечение. В исследованиях было показано, что психосоциальные факторы – наиболее важные прогностические индикаторы длительной дезадаптации [11, 12]. Рекомендуется как можно раньше выявить «желтые флажки», способствующие хронизации боли. Термин «желтые флажки» стал использоваться в литературе, чтобы отдельно выделить психосоциальные факторы риска персистенции боли. Другими словами, это психосоциальные барьеры на пути пациента к восстановлению (табл. 3).
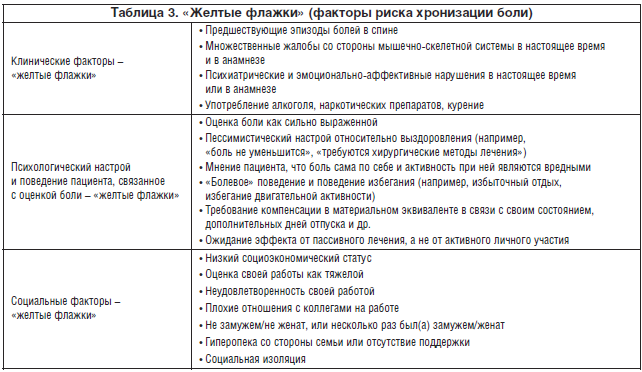
Пациенту с положительными «желтыми флажками» требуется изменение реабилитационного подхода: более активная реабилитация, постепенное расширение комплекса упражнений, положительное эмоциональное подкрепление функциональных достижений и постепенное введение специфических видов активности, которые у пациента вызывают наибольшие трудности и которых он избегает.
Опыт работы с пациентами с БНЧС показывает, что при выраженном болевом синдроме они очень часто испытывают страх усиления боли или развития хронической боли. Независимо от используемых групп препаратов при лечении неспецифической боли в спине важно с пациентом провести разъяснительную работу в позитивном ключе: рассказать, что он имеет очень высокий шанс избавиться от боли и что большинство пациентов полностью восстанавливаются, что проведенный тщательный сбор анамнеза и осмотр не выявили признаков серьезного процесса, поэтому радиологическое обследование не требуется, что движение и активность не причиняют вреда и что ему важно оставаться максимально активным.
Действительно, в настоящее время рекомендация продолжать вести активный образ жизни и работать считается доказанно эффективной. Возможно, в первое время потребуется несколько модифицировать активность и избегать занятий тяжелыми видами спорта. Однако поддержание привычного образа жизни, даже несмотря на дискомфорт и боль, приводит к более быстрому исчезновению симптомов, меньшей хронизации процесса и ускоренному восстановлению полной трудоспособности [13].
Согласно исследованиям, 30–60% пациентов полностью избавляются от боли в спине в течение 1 нед., 60–90% – в течение 6 нед. и 95% – в течение 12 нед. [8, 14]. Однако рецидивы боли возникают достаточно часто: примерно у 40% больных в течение первых 6 мес. [15].
До начала лечения полезным инструментом является использование визуальной аналоговой шкалы (ВАШ), которая позволит оценивать динамику боли на фоне проводимой терапии.
Лечение острой БНЧС рекомендуется начинать с нестероидных противовоспалительных препаратов (НПВП). Это связано с тем, что в основе появления боли лежит процесс воспаления. В систематическом обзоре 51 рандомизированного контролируемого исследования НПВП доказана эффективность этой группы препаратов по сравнению с плацебо по выраженному влиянию на боль. Также было показано, что различные НПВП имеют примерно одинаковую эффективность [16].
Группа НПВП представлена очень широкой линейкой препаратов с разной химической структурой. Однако для практикующего врача более важно представлять, к какой из двух следующих групп относится препарат: к неселективным НПВП (блокирующим, помимо ЦОГ-2, и «полезную» для слизистой желудка ЦОГ-1) или к селективным НПВП, которые в значительно меньшей степени блокируют ЦОГ-1. В России используется огромный спектр препаратов из группы НПВП: ацетилсалициловая кислота, ацеклофенак, декскетопрофен, диклофенак, ибупрофен, индометацин, кетопрофен, кетопрофена лизиновая соль, кеторолак, лорноксикам, мелоксикам, метамизол, напроксен, нимесулид, пироксикам, теноксикам, целекоксиб, эторикоксиб. Очень распространенная в нашей стране практика при острой боли в обязательном порядке использовать инъекционную форму НПВП не имеет под собой доказательной базы. Современные пероральные формы НПВП обладают сопоставимым анальгетическим эффектом, что объясняется их высокой биодоступностью. Инъекционные формы можно использовать в первые дни острой БНЧС. К препаратам, имеющим помимо таблетированной еще и форму для парентерального введения (внутримышечного и внутривенного), относятся: декскетопрофен, диклофенак (только для внутримышечного введения), кетопрофена лизиновая соль, кетопрофен, кеторолак, лорноксикам, мелоксикам (только для внутримышечного введения), метамизол, теноксикам. Даже при выборе в качестве старт-терапии острой боли парентеральный путь введения НПВП желательно через 2–3 дня перевести пациента на пероральный прием препарата. Закономерный вопрос: в каких дозах и как долго нужно и можно использовать НПВП при лечении БНЧС? Тезисно можно это обозначить следующим образом: необходим прием НПВП в полной терапевтической дозе непрерывным курсом длительностью, которая определяется эффективностью лечения в каждом конкретном случае. Использование неадекватных низких доз НПВП или прием только «по требованию» приводит к низкой эффективности и является ошибкой. Важна не только величина разовой дозы препарата, но и кратность приема, что должно обеспечивать эффективную концентрацию препарата в течение суток. В реальной клинической практике невролога и ревматолога пациенты нередко принимают НПВП длительно. Это сопряжено с риском развития осложнений от самой терапии [16, 17].
К наиболее частым НПВП-ассоциированным осложнениям относится диспепсия, которая проявляется болью и тяжестью в эпигастрии, тошнотой. Эти симптомы обычно появляются после очередного приема препарата и связаны с контактным действием на слизистую желудка. Более серьезным осложнением со стороны ЖКТ является НПВП-гастропатия. Это развитие язв желудка, двенадцатиперстной кишки, которые могут осложниться кровотечением и перфорацией. В патогенезе язвообразования лежит блокада ЦОГ-1 и, как следствие, снижение защитного потенциала слизистой в результате уменьшения в ней простагландинов. Этот же механизм может приводить к развитию НПВП-энтеропатии. Наиболее грозным ее проявлением являются кишечное кровотечение и непроходимость. Заподозрить развитие энтеропатии на фоне лечения можно при появлении у больного железодефицитной анемии и гипоальбуминемии. Факторами риска развития осложнений со стороны ЖКТ являются наличие язв в анамнезе, в особенности осложненных и рецидивирующих, прием глюкокортикостероидов, препаратов для разжижения крови (например, аспирина), инфицированность Helicobacter pylori. Пациенту из группы высокого риска по ЖКТ-осложнениям следует назначать селективные ингибиторы ЦОГ-2, а также рекомендовать прием НПВП с ингибитором протонной помпы, например эзомепрозолом. При этом препарат из группы ингибиторов протонной помпы должен назначаться на весь срок приема НПВП. Прием же только «по требованию» или с перерывами не гарантирует защиты от развития ЖКТ-осложнений. На фоне лечения НПВП на каждом приеме необходимо активно выяснять субъективные жалобы пациента со стороны ЖКТ, и при появлении клинических симптомов проводить эндоскопическое исследование, общий анализ крови и анализ кала на скрытую кровь [17].
Длительный прием НПВП также ассоциирован с повышенным риском осложнений со стороны сердечно-сосудистой системы. Наиболее часто можно встретить развитие артериальной гипертензии и снижение эффективности антигипертензивных препаратов. Механизм развития объясняется блокадой ЦОГ-2 в почках. При дестабилизации артериального давления у пациента, длительно получающего НПВП, необходимо в первую очередь провести суточное мониторирование артериального давления. Важное обстоятельство при приеме НПВП – появление или усиление отеков. Отеки могут быть обусловлены снижением клубочковой фильтрации (НПВП-нефропатия), в основе которой лежит тот же механизм блокады ЦОГ-2 в почках. Однако наибольшую опасность представляют собой кардиоваскулярные катастрофы (коронарная смерть, инфаркт миокарда, ишемический инсульт). Их развитие связано с усилением тромбообразования в результате появляющегося дисбаланса между синтезом тромбоксана А2 и простациклина. Показано, что этот дисбаланс возникает за счет блокады ЦОГ-2 (что более характерно для селективных НПВП), которая регулирует образование простациклина. Блокада же ЦОГ-1-зависимого процесса образования тромбоксана А2 (в основном неселективными НПВП) может, наоборот, проявляться антитромботическим действием. Это приводит к повышению риска послеоперационных кровотечений и повышенной кровоточивости даже после незначительных вмешательств. Подтверждает наличие этого осложнения увеличение времени свертываемости крови. Факторами высокого и максимального риска нежелательных явлений со стороны сердечно-сосудистой системы являются некомпенсированные артериальная гипертензия и сердечная недостаточность, ИБС в сочетании с перенесенными инфарктом миокарда, оперативными вмешательствами на сердце (аорто-коронарное шунтирование, эндоваскулярное стентирование и др.) или ишемическим инсультом. Осведомление пациента о возможных факторах риска сердечно-сосудистых осложнений является обязательным до начала терапии препаратами группы НПВП. Важно уточнить не только наличие ИБС, артериальной гипертензии и сердечной недостаточности, но и выяснить, принимает ли пациент какие-либо препараты для снижения свертываемости крови. Пациенту из группы риска по кардиоваскулярным осложнениям предпочтительнее назначать наиболее «кардиобезопасный» неселективный НПВП – напроксен, кетопрофен, ибупрофен. Такого больного в процессе лечения для контроля безопасности нужно не только активно опрашивать на предмет субъективных жалоб (боль за грудиной, одышка, отеки, нарушение ритма сердца), но и не реже чем 1 раз в месяц проводить контроль АД и ЭКГ. При высоком риске кардиоваскулярных осложнений показано назначение низких доз аспирина [17].
Усилить лечебный потенциал НПВП можно добавив к терапии центральный миорелаксант. Точкой их приложения является мышечный спазм, который патогенетически связан с болью в спине, хотя есть данные, что препараты этой группы обладают и собственным умеренным обезболивающим эффектом. Эффективность использования миорелаксантов при неспецифической боли в спине четко показана в двух крупных метаанализах [18, 19]. Причем добавление миорелаксанта к НПВП дает преимущество в плане аналгезии по сравнению с монотерапией НПВП [19, 20]. Выбор обычно делается между толперизоном, тизанидином или баклофеном. В случае острой боли в спине наибольший эффект эти препараты оказывают при назначении в первые 1–2 нед. после появления симптомов.
При отсутствии улучшения на фоне приема НПВП наиболее рациональным будет не смена одного НПВП на другой, а использование комплекса анальгетиков с разным механизмом действия. Это связано с тем, что анальгетический потенциал у разных препаратов из группы НПВП при приеме средних и высоких терапевтических доз признан одинаковым [17]. Рекомендованными могут быть комбинации: 1) НПВП и парацетамола; 2) НПВП, парацетамола и трамадола; 3) НПВП, парацетамола и флупиртина; 4) НПВП, парацетамола, трамадола и флупиртина.
При непереносимости НПВП или при развитии серьезного побочного эффекта требуется отмена препарата. Альтернативой могут быть следующие назначения.
1. Парацетамол (ацетаминофен). Это «простой анальгетик», эффективный для купирования слабой и умеренной боли. Хотя он и уступает по эффективности НПВП, но отличается хорошей переносимостью и низким риском осложнений со стороны ЖКТ, сердечно-сосудистой системы и почек [21]. Во избежание гепатотоксичности не рекомендуется превышать максимальную дозу 4 г в сутки. Препарат может назначаться в режиме монотерапии.
2. Комбинированный препарат атипичного опиоидного анальгетика трамадола (37,5 мг) и парацетамола (325 мг). Парацетамол повышает эффективность трамадола, что позволяет использовать меньшие дозы его и соответственно снизить побочные эффекты. К частым нежелательным явлениям трамадола относятся головокружение, сонливость, слабость, психическая заторможенность или возбуждение, снижение артериального давления, тошнота. Нельзя забывать и о риске формирования зависимости при приеме опиоидных анальгетиков с развитием абстинентного синдрома на фоне его отмены. Способ применения – по 1–2 таблетки до 4-х раз в сутки.
При наличии в клинической картине нейропатической окраски хронической боли в комплексную терапию необходимо включать препараты, эффективные для лечения нейропатической боли. Наиболее часто с этой целью используют 2 группы лекарственных средств – антидепрессанты и антиконвульсанты. Из антидепрессантов наиболее популярными с точки зрения аналгезии является амитриптилин (из группы трициклических антидепрессантов) и дулоксетин (из группы селективных ингибиторов захвата серотонина и норадреналина), а из противоэпилептических препаратов – габапентин и прегабалин.
Уже традиционным в неврологической практике при дорсалгии стало назначение нейротропных витаминов группы В, что имеет под собой хорошую доказательную базу. Тиамин, пиридоксин и цианокобаламин (витамины В1, В6 и В12) выполняют функции коэнзимов во многих биохимических реакциях, метаболизме белков, жиров и углеводов, а также в процессах формирования ДНК, РНК и миелина и обладают нейропротективным действием. Роль витаминов В1, В6 и В12 в терапии боли уже давно установлена. В экспериментальных условиях их назначение уменьшало нейропатическую боль у животных [23–32]. В эксперименте также был показан синергетический эффект с НПВП [33–36]. В клинической практике дополнительное назначение витамина В12 позволяло снизить дозы НПВП при болях в спине [37–39]. В исследованиях у пациентов с полинейропатиями метилкобаламин (одна из активных форм витамина В12) уменьшал нейропатическую боль [40, 41]. Было показано, что витамин В12 в высоких дозах реализует анальгетический эффект за счет усиления активности норадреналина и 5-гидрокситриптамина, которые работают в ноцицептивной системе как ингибирующие нейротрансмиттеры [42]. Эффективность парентерального введения витамина В12 для лечения боли в спине была доказана в рандомизированных двойных слепых клинических исследованиях [43, 44]. Считается, что анальгетический эффект витаминов группы В реализуется не только путем усиления антиноцицептивной активности за счет влияния на норадренергическую и серотонинергическую биохимические системы, но в т. ч. и за счет ингибирующего влияния на задние рога спинного мозга и таламус, нейроны которых участвуют в механизмах ноцицепции.
Следующим шагом стало изучение преимуществ сочетанного назначения НПВП и комбинированного препарата, содержащего фиксированную дозу витаминов В1, В6 и В12. Синергетическое действие комплекса витаминов группы В и диклофенака было показано на животных моделях воспаления и боли. Одновременное назначение НПВП и витаминного комплекса потенцировало анальгетический эффект диклофенака [33, 35, 36]. Также и в рандомизированном двойном слепом клиническом исследовании у пациентов с острой болью в спине было показано преимущество комбинированного назначения витаминного комплекса (В1, В6, В12) и диклофенака по сравнению с монотерапией этим НПВП. Это выражалось в более быстром наступлении обезболивающего эффекта и возможности достижения этого эффекта при меньших дозах НПВП [38]. Важность максимально раннего использования витаминов группы В также была показана в рандомизированном двойном слепом контролируемом исследовании DOLOR c параллельными группами, в котором участвовали 372 пациента с острой болью в нижней части спины. Одновременное назначение диклофенака и комплекса витаминов группы В уже через 3 дня достоверно превышало по обезболивающему эффекту монотерапию диклофенаком. Кроме этого, у пациентов из группы комбинированной терапии через 3 дня после начала лечения отмечено значимо большее улучшение подвижности и функциональных возможностей [45].
Препаратом, содержащим оптимальное соотношение трех водорастворимых витаминов группы В, является Нейробион, выпускающийся как в форме раствора в ампулах по 3 мл, так и в виде таблеток. В одной ампуле содержится 100 мг тиамина, 100 мг пиридоксина и 1 мг цианокобаламина. С внутримышечного введения препарата рекомендуется начинать в случае выраженного болевого синдрома (3 мл в сутки ежедневно) или в случае болевого синдрома умеренной степени тяжести (3 мл 2–3 раза в неделю). После уменьшения боли также рекомендовано перейти с ежедневных на более редкие инъекции (2–3 раза в неделю). Парентеральное введение препарата не должно превышать 2–3-х недель, а для продолжения лечения удобной формой является таблетированная. В каждой таблетке Нейробиона содержится 100 мг тиамина, 200 мг пиридоксина и 240 мкг цианокобаламина. Стандартная суточная доза составляет 3 таблетки (по 1 таблетке 3 раза в день), а средняя длительность курса – 1,0–1,5 мес. Таким образом, усиление лечебного потенциала НПВП с помощью добавления витаминов группы В (Нейробион) позволяет сократить сроки терапии и снизить риски побочных эффектов от приема обезболивающих препаратов.
Если в течение 4-х недель на фоне лечения пациент из-за сохранения боли не возвращается к своей привычной деятельности, необходимо удостовериться в правильности приема препаратов (кратность приема в течение суток, адекватные разовые дозы, отсутствие перерывов в лечении) и повторно провести поиск «красных» и «желтых» флажков. При отсутствии эффекта к 6–й неделе – повторить поиск «симптомов опасности». Даже если у пациента не выявляются «красные флажки» серьезных заболеваний и неврологический статус в норме, рекомендуется проведение клинического анализа крови (включая показатель СОЭ), а также рентгенологического и МРТ-исследования [46].












