В патогенезе деменции при БП решающее значение в настоящее время придается развитию ацетилхолинергической недостаточности. При этом многие исследователи сообщают о более значительной выраженности ацетилхолинергического дефицита при БП с деменцией, чем при болезни Альцгеймера [15]. По данным патоморфологических исследований, у больных с БП и деменцией обнаруживается значительное уменьшение числа клеток в базальном ядре Мейнерта, где располагаются нейроны, продуцирующие ацетилхолин [17,31]. Результаты некоторых исследований свидетельствуют о том, что определенный вклад в патогенез деменции при БП вносят альцгеймеровские изменения (нейрофибриллярные клубочки, сенильные бляшки) [5,9,26]. По данным патоморфологических исследований, при длительной блокаде мускариновых рецепторов (например, при приеме холинолитиков) в 2,5 раза увеличивается плотность сенильных бляшек и нейрофибриллярных клубочков в коре головного мозга у пациентов с БП [12]. Это позволяет предположить, что холинергические препараты способны оказывать нейропротективный эффект у пациентов с БП.
Концентрация уровня ацетилхолина в головном мозге регулируется ферментами – холинацетилтрансферазой (участвует в образовании ацетилхолина), ацетилхолинэстеразой и бутирилхолинэстеразой (разрушают ацетилхолин). У пациентов с БП и деменцией обнаруживается снижение активности холинацетилтрансферазы в корковых отделах всех долей головного мозга, при этом степень снижения ее активности в области височных долей коррелирует с выраженностью когнитивных расстройств [27]. О роли дефицита ацетилхолина в генезе когнитивных нарушений при БП также свидетельствуют данные позитронно–эмиссионной томографии (ПЭТ), выявляющие снижение активности корковой ацетилхолинэстеразы [15]. С ацетилхолинергической недостаточностью при БП с деменцией связывают развитие психотических расстройств и, в частности, галлюцинаций [6].
С целью восполнения ацетилхолинергического дефицита в настоящее время используются препараты из группы ингибиторов ацетилхолинэстеразы. Эффективность данных препаратов первоначально была доказана при деменции альцгеймеровского типа легкой и умеренной выраженности, после чего ацетилхолинергические препараты составили стандарт терапии этого заболевания [2,8].
Ривастигмин (Экселон) – это препарат группы ингибиторов ацетилхолинэстеразы, специфическим отличием которого является селективное ингибирование ацетилхолинэстеразы и бутирилхолинэстеразы – ферментов, ответственных за разрушение ацетилхолина в холинергическом синапсе [8,12]. Считается, что на фоне терапии ривастигмином редко возникает нарастание двигательных расстройств, что связывают с избирательным влиянием препарата на G1–изоформу ацетилхолинэстеразы, которой больше в гиппокампе и коре и меньше в хвостатом ядре [16]. Результаты ряда исследований позволяют предположить, что применение Экселона способствует достоверному улучшению когнитивных функций и снижению выраженности поведенческих и психотических расстройств у пациентов с БП [21,30]. Наибольший интерес представляют собой результаты недавнего рандомизированного плацебо–контролируемого исследования эффективности Экселона при БП с деменцией (исследование EXPRESS). Эффективность Экселона оценивалась в 68 центрах в 12 странах. В исследовании участвовал 541 пациент. Через 6 месяцев терапии Экселоном в дозе 3–12 мг в сутки был получен положительный эффект, превышающий плацебо, в отношении когнитивных и поведенческих нарушений, а также психотических расстройств. Анализ двигательных нарушений показал отсутствие отрицательного влияния Экселона на основные симптомы БП [19]. В дальнейшем исследования эффективности Экселона подтвердили, что уменьшение выраженности когнитивных нарушений при БП сохраняется и при длительных курсах терапии [28]. Таким образом, проведенные к настоящему времени международные исследования показали, что Экселон является эффективным препаратом при БП с деменцией. Мы проанализировали собственный опыт применения Экселона у данной категории пациентов.
Целью настоящего исследования явилось дальнейшее изучение влияния Эселона на когнитивные и двигательные функции при БП с деменцией, а также оценка безопасности применения и переносимости данного препарата.
Пациенты и методы исследования
В основную группу были включены 15 пациентов с БП и деменцией (8 мужчин и 7 женщин) в возрасте от 54 до 80 лет (средний возраст 71,3±6,6 год). Диагноз БП устанавливался в соответствии с критериями A. Hughes и соавт. и Банка мозга Великобритании [23]. У 14 пациентов было высшее образование, у 1 – среднее специальное. Средняя длительность заболевания составила 7,8±4,3 лет. Распределение пациентов по форме заболевания было следующим: акинетико–ригидная форма отмечалась у 8 пациентов, у 5 – ригидно–дрожательная, у 2 – дрожательно–ригидная. Стадия заболевания по шкале Хен и Яра в среднем составила 3,0±0,5 (2,5 – у 4, стадия 3,0 у 9, стадия 4,0 у 2 пациентов). Экселон назначался по следующей схеме: с 1 по 4–ю неделю: 1,5 мг два раза в сутки, с 4–й недели – 3,0 мг два раза в сутки. Длительность лечения составила 6 месяцев. Одновременно с исследуемым препаратом пациенты основной группы получали препараты леводопы.
В группу сравнения (контроль) были включены 15 пациентов с БП (9 мужчин и 6 женщин, средний возраст 70,0±7,4 лет, средняя длительность заболевания – 9,5±5,8 лет), которые получали только стандартную противопаркинсоническую терапию. Пациенты основной группы и группы сравнения были сопоставимы по возрасту, полу, уровню образования, тяжести когнитивных и двигательных расстройств.
В основной группе у 1 (6,7%) пациента наблюдались яркие сновидения, у 5 (33,3%) иллюзии и галлюцинации с сохранением критического отношения к ним, у 1 (6,7%) – галлюцинации с нарушением критики. У пациентов контрольной группы на момент обследования психотические нарушения отсутствовали.
Всем пациентам проводилось клиническое неврологическое и нейропсихологическое исследование до начала приема Экселона и через 3 и 6 месяцев от начала лечения. Для оценки двигательных нарушений использовали унифицированную шкалу оценки болезни Паркинсона (УШОБП) и шкалу Хен и Яра. Нейропсихологическое исследование включало следующие методики: краткую шкалу оценки психического статуса (КШОПС) [20], батарею тестов для оценки лобной дисфункции (БТЛД) [18], шкалу деменции Маттиса (ШДМ) [25], тест рисования часов, тест вербальных ассоциаций (литеральные и категориальные), тест повторения рядов цифр в прямом и обратном порядке по методу Векслера, тест слежения, тест на символьно–цифровое замещение [24], тест «12 слов» [22]. Для оценки выраженности психотических расстройств использовали шкалу УШОБП (I часть – «Психические расстройства»). Для оценки безопасности и переносимости исследуемого препарата фиксировали все нежелательные явления состояния здоровья, которые происходили с пациентом после приема первой дозы Экселона и до окончания наблюдения.
Диагностика деменции проводилась в соответствии с критериями деменции МКБ–10 и DSM–IV [7,14]. Обработка полученных результатов проводилась с использованием статистического пакета SPSS, версия 10.0 c применением методов непараметрической статистики Вилкоксона–Манна–Уитни.
Результаты
Повторное клинико–нейропсихологическое исследование по окончании 6–месячного срока наблюдения было проведено у 13 пациентов; 2 пациента прекратили лечение Экселоном до окончания наблюдения. В 1 случае прекращение лечения было связано с возникновением нежелательных явлений (см. ниже); другой пациент прекратил терапию самостоятельно по причинам, не связанным с побочными явлениями. Средняя доза Экселона составила 5,8±0,7 мг в сутки. 12 пациентов получали препарат в дозе 3 мг 2 раза в день, у 1 пациентки доза Экселона составила 1,5 мг 2 раза в день.
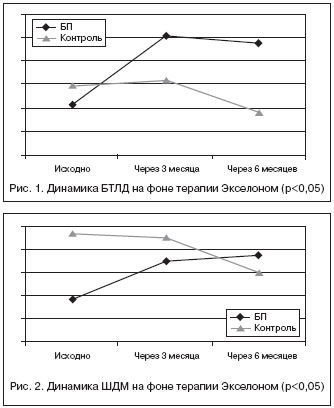
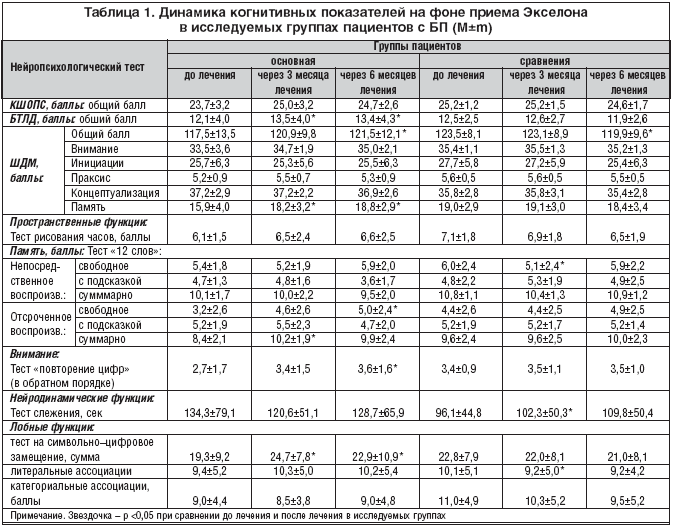
На фоне терапии Экселоном отмечалось достоверное уменьшение выраженности когнитивных нарушений, о чем свидетельствовала положительная динамика результатов основных нейропсихологических шкал в основной группе пациентов с БП: БТЛД и ШДМ (табл. 1, рис. 1 и 2). В контрольной группе была отмечена отрицательная динамика (достоверное снижение общего балла ШДМ).
Лечение Экселоном способствовало уменьшению выраженности дизрегуляторных нарушений. Об этом свидетельствовало достоверное улучшение суммарного показателя теста на символьно–цифровое замещение (табл. 1, рис. 3). В то же время не было отмечено значимой динамики по показателям беглости речи (литеральные и категориальные ассоциации). В контрольной группе через 3 месяца наблюдения наблюдалось достоверное снижение ассоциативной беглости (табл. 1).
На фоне терапии Экселоном наблюдалось достоверное улучшение субтеста «память» ШДМ, в котором наряду с исследованием запоминания и воспроизведения отдельных слов и рисунков исследуется память на предложения и общая память (ориентация в месте, времени и текущих событиях). Следует отметить, что данный субтест задействует механизмы долговременного запоминания и удержания информации и требует устойчивости следов памяти по отношению к интерференции. Также на фоне лечения отмечалось достоверное увеличение объема свободного отсроченного воспроизведения в тесте «12 слов» и суммарного показателя отсроченного воспроизведения в том же тесте. Вместе с тем не претерпели статистически значимой динамики показатели непосредственного воспроизведения (как свободного, так и с подсказкой) и отсроченного воспроизведения с подсказкой (табл. 1, рис. 4). Таким образом, по нашим данным, Экселон способствует повышению устойчивости следа памяти к интерференции. В контрольной группе через 3 месяца было отмечено достоверное снижение объема свободного непосредственного воспроизведения.
Терапия Экселоном способствовала улучшению концентрации внимания: нами была отмечена достоверная положительная динамика в тесте «повторение цифр» (табл. 1). В то же время лечение препаратом не оказало значимого влияния на время выполнения теста слежения. Мы не отметили значимой динамики выполнения теста рисования часов, что может свидетельствовать о незначительном влиянии Экселона на пространственные функции (табл. 1).
На фоне лечении препаратом отмечалось уменьшение выраженности психотических нарушений, о чем свидетельствовало достоверное снижение суммарного показателя раздела «психотические расстройства» УШОБП (часть I) (рис. 5). У 4 пациентов был отмечен полный регресс психотических расстройств, у 2 – уменьшилась выраженность и частота галлюцинаций, у 1 пациента терапия способствовала исчезновению ярких сновидений.
Анализ динамики двигательных нарушений показал, что терапия Экселоном не приводит к нарастанию выраженности симптомов паркинсонизма. Не было отмечено достоверного снижения как суммарных показателей раздела «моторные функции» УШОБП (часть III, оценка в периоде «включения») (р>0,05), так и отдельных его показателей (брадикинезии, ригидности, тремора покоя, постуральных нарушений). В контрольной группе через 3 месяца наблюдения было выявлено достоверное увеличение выраженности брадикинезии (исходно – 16,31±5,76; через 3 месяца наблюдения 17,23±5,34; р<0,05). Остальные показатели раздела «моторные функции» были стабильны и не претерпели существенных изменений в последующие 3 месяца наблюдения за пациентами.
На фоне терапии Экселоном были зафиксированы 3 нежелательных явления, в 1 случае потребовалась отмена исследуемого препарата. В одном случае нежелательное явление заключалось в возникновении на 1–й неделе терапии тошноты, которая прошла самостоятельно и не повторялась с увеличением дозы препарата. В 2 случаях отмечалось усиление тревоги и беспокойства, что, однако, нельзя было однозначно связать с исследуемым препаратом, так как подобные явления имели место у пациентов и прежде. У одного из этих пациентов препарат был отменен. На фоне терапии не было также отмечено клинически значимой динамики показателей жизненно важных функций (изменений артериального давления, пульса, частоты сердечных сокращений).
Обсуждение
Таким образом, результаты проведенного исследования свидетельствуют об эффективности и безопасности использования Экселона при БП с деменцией. Полученные данные согласуются с результатами крупного многоцентрового исследования, в котором доказана высокая эффективность Экселона в лечении тяжелых когнитивных нарушений при БП [19]. В группе пациентов, получавших препарат, было отмечено достоверное уменьшение выраженности когнитивных нарушений, в то время как в группе сравнения было выявлено нарастание выраженности когнитивных расстройств. Терапия Экселоном способствовала уменьшению выраженности дизрегуляторных расстройств, улучшению внимания, памяти. Полученные данные позволяют предположить, что при БП с деменцией препарат в основном оказывает влияние на когнитивные симптомы лобной дисфункции и нейродинамические нарушения, которые являются основными в структуре характерного для БП когнитивного дефекта. Аналогичные результаты были получены и другими исследователями [19,30].
Проведенное исследование показало, что терапия Экселоном сопровождается достоверным уменьшением выраженности психотических нарушений. Для коррекции психотических расстройств при БП обычно применяются атипичные нейролептики, но их прием сопряжен с негативным влиянием на двигательные функции. Кроме того, свойственный данным препаратам холинолитический эффект может усилить когнитивные нарушения и вызвать осложнения со стороны сердечно–сосудистой системы [6,12]. Проведенное исследование свидетельствует, что применение Экселона может позволить снизить потребность в нейролептиках у пациентов с БП и деменцией.
Важное практическое значение имеет отсутствие отрицательного влияния Экселона на основные симптомы БП. Согласно результатам проведенных к настоящему времени исследований при приеме препарата не было отмечено существенного ухудшения двигательных расстройств [19,21,30] (только в некоторых случаях незначительно нарастал тремор) [19]. В литературе приводится описание одного случая нарастания гипокинезии у пациента, страдающего БП с когнитивными нарушениями на фоне однократного приема 3 мг ривастигмина. Однако отмеченный негативный эффект на двигательную сферу не фиксировался с применением унифицированной шкалы оценки БП [29].
Следует отметить, что в нашем исследовании мы использовали меньшие дозы Экселона, чем в международных исследованиях – в среднем 5,8 мг в сутки, в то время как в исследовании EXPRESS, например, средняя доза Экселона составляла 8,6 мг в сутки. Таким образом, Экселон может быть эффективен при БП с деменцией при его назначении в минимальной терапевтической дозе. Между тем согласно данным международных исследований клинический эффект ингибиторов АХЭ на когнитивные функции имеет дозозависимый характер. Лечение проводят до оптимально переносимой дозы, которая может составлять – 12 мг в сутки [19]. Учитывая, что холинергический дефицит определяется даже при БП без деменции [15], важным является оценка эффективности холинергических средств и у пациентов с умеренными когнитивными нарушениями [8].
Проведенное исследование подтвердило хорошую переносимость Экселона. Нежелательное явление только в 1 случае было связано с дисфункцией желудочно–кишечного тракта и не требовало уменьшения дозы препарата или назначения дополнительной терапии. Каких–либо изменений показателей, отражающих состояние витальных функций, отмечено не было. По данным исследования EXPRESS, у пациентов, получавших Экселон, достоверно чаще, чем у получавших плацебо, развивались тошнота и рвота. Это соответствует профилю безопасности и переносимости этого препарата при болезни Альцгеймера [19].
Таким образом, результаты исследования показали, что Экселон является эффективным и безопасным препаратом при БП с деменцией. Применение данного препарата способствует регрессу выраженности когнитивных и поведенческих расстройств, не влияя на двигательные симптомы паркинсонизма. Учитывая несомненное негативное влияние психических расстройств на качество жизни пациентов с БП и их родственников, полученный положительный эффект Экселона имеет большое клиническое значение.