Введение
Инсульт является самой частой причиной инвалидизации: 40% пациентов, переживших инсульт, испытывают затруднения в повседневной жизни, а у 15–30% развивается выраженная инвалидность [1]. В результате общество в целом несет тяжелые экономические потери [2].
Целью реабилитации пациентов после инсульта является уменьшение выраженности функциональных ограничений. Как известно, у значительной части пациентов полное восстановление утраченных функций невозможно [3]. Однако эффективные реабилитационные мероприятия в раннем восстановительном периоде инсульта способствуют минимизации функциональных ограничений [4]. Теоретической базой реабилитационных мероприятий являются современные данные нейронаук о процессах репарации в центральной нервной системе [5,6].
В основе восстановления и сохранения сенсомоторных функций после инсульта прежде всего лежит феномен нейрональной пластичности, который зависит от поступающей в головной мозг проприоцептивной и экстероцептивной информации [7]. Кроме того, играют роль замещение клеток в периинфарктных ишемизированных зонах и нейрогенез [8]. Для достижения наилучших результатов процесс реабилитации следует начинать как можно раньше [9], используя междисциплинарный подход [4,10], с применением двигательных [1,12], когнитивных [13], фармакологических [14–17], активирующих [18,19] и нейрорегенеративных [20,21] методик.
Как известно, гиперлипидемия играет важную роль в патогенезе повреждения головного мозга при ряде заболеваний нервной системы; липиды вовлечены в клеточные сигнальные механизмы, а нарушения липидного метаболизма играют важную роль в гибели нейронов при церебральной ишемии [22,23]. Препаратом, воздействующим на метаболизм фосфолипидов в головном мозге, а также на нейротрасмиттерную передачу, является цитиколин. Данный препарат доказал свои нейропротективные и нейрорепаративные свойства при ишемии головного мозга [24]. В данной статье будет рассмотрена роль цитиколина в реабилитации пациентов после инсульта.
Экспериментальные данные
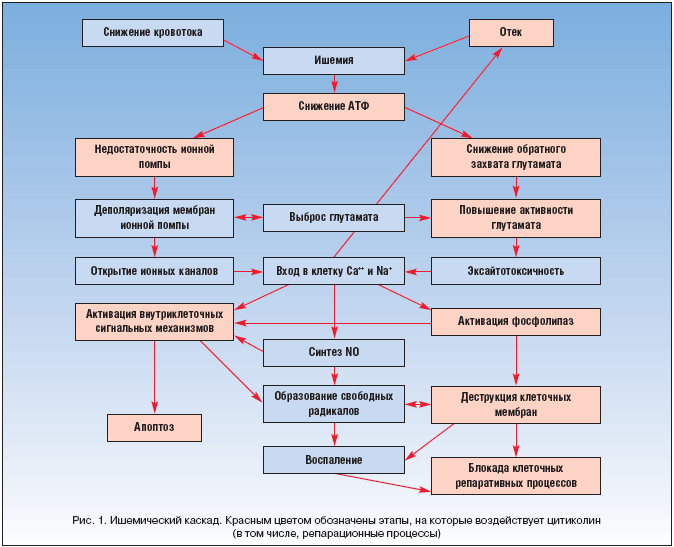
Цитиколин влияет на различные звенья ишемического каскада (рис. 1) и, помимо прочих своих эффектов, увеличивает нейрональную пластичность. Нейропротективный эффект цитиколина хорошо известен и многократно описывался в литературе [24]. Показано, что цитиколин уменьшает объем поражения мозга при экспериментальной ишемии и гипоксии, повышает способность к обучаемости и благоприятно влияет на память у экспериментальных животных с возрастными изменениями головного мозга. Кроме того, на разных экспериментальных моделях цитиколин продемонстрировал способность восстанавливать активность митохондриальной АТФ–азы и мембранной Na+/K+АТФ–азы, подавлять активацию некоторых фосфолипаз и уменьшать выраженность отека мозга. Ниже будут приведены наиболее значимые экспериментальные данные, свидетельствующие о нейрорепаративных эффектах цитиколина.
В работе Hurtado O. et al. [25] изучалось влияние длительного применения цитиколина на функциональный исход и морфологические изменения после инсульта. Для оценки функционального восстановления и сенсомоторных функций использовался тест со ступеньками (экспериментальному животному нужно подняться на 7 ступеней, чтобы добраться до еды) и тест со скручиванием поднятого тела (экспериментальное животное удерживается за хвост, и регистрируется направление скручивания тела). Цитиколин назначался через 24 ч после окклюзии средней мозговой артерии в течение 28 дней, что привело к улучшению функционального исхода как в тесте со ступеньками, так и в тесте со скручиванием тела по сравнению с контрольной группой (p<0,05). Для уточнения морфологических основ улучшения функции исследовались морфологические характеристики пирамидных клеток в V слое неповрежденной моторной коры с помощью окраски по Гольджи–Коксу. На фоне применения цитиколина отмечалась большая плотность дендритов по сравнению с физиологическим раствором. Эти результаты свидетельствуют о том, что использование цитиколина начиная с 24 ч после развития инсульта способствует увеличению пластичности нейронов, а также способствует восстановлению функций.
Функционирование нервной системы, как в норме, так и при различных патологических состояниях, обеспечивается тесным взаимодействием между нейронами и глиальными клетками [26]. Важную роль в активации нейроглии играет ацетилхолин. Bramanti V. et al. [27] изучали влияние ацетилхолина и его предшественников (холина, цитиколина и α–глицерил–фосфорилхолина) на экспрессию трансглутаминазы и циклина D1 в культурах астроцитов. Использовались метод конфокальной лазерной микроскопии с захватом монодансил–кадаверина (маркера ферментной активности) и иммунохимические методы (Вестерн–блоттинг).
С помощью конфокальной лазерной микроскопии было выявлено повышение уровня цитофлюоресценции в астроцитах на фоне применения 0,1 мкмоль холина. Введение цитиколина приводило к увеличению трансглутаминазы, причем данный эффект имел дозозависимый характер. Воздействие цитиколина в суммарной дозе 1 мкмоль в течение 14 дней на культуру астроцитов in vitro приводило к увеличение уровня цитофлюоресценции. После воздействия суммарной дозы α–глицерил–фосфорилхолина 1 мкмоль в течение 24 ч отмечалось повышение цитофлюоресценции как в цитозоле, так и в ядрах.
Вестерн–блоттинг выявлял повышенную экспрессию трансглутаминазы при воздействии 1 мкмоль холина или и α–глицерил–фосфорилхолина в течение 24 ч. В то же время применение 1 мкмоль цитиколина и ацетилхолина в течение 24 ч не повлияло на уровень экспрессии трансглутаминазы. Воздействие 1 мкмоль ацетилхолина вызывало снижение экспрессии трансглутаминазы на 21–й день in vitro. Введение предшественника ацетилхолина in vitro в течение 24 ч привело к выраженному подавлению экспрессии циклина D1 и снижению экспрессии циклина D1 в астроцитах спустя 14 и 35 дней. Эти данные свидетельствуют о влиянии предшественников ацетилхолина на процессы развития и дифференцировку астроглии in vitro. Исходя из полученных результатов, авторы сделали вывод, что применение исследуемых веществ может способствовать восстановлению неврологических функций после церебральных повреждений, в том числе сосудистой этиологии.
Как известно, хроническая ишемия головного мозга приводит к формированию изменений белого вещества (лейкоареоз), клиническим проявлением которых являются когнитивные нарушения. Lee H. et al. [28] исследовали профилактический эффект цитиколина в отношении лейкоареоза и связанных с ним когнитивных расстройств на модели хронической церебральной гипоперфузии у крыс. Экспериментальным животным проводилась двусторонняя окклюзия сонных артерий. Цитиколин (500 мг/кг/сут.) или фосфатно–солевой буферный раствор назначался внутрибрюшинно в острейшем периоде церебральной ишемии или отсроченно (с 8–го дня после операции) в течение 21 дня. Для оценки когнитивных способностей использовался тест с лабиринтом. Тестирование проводилось начиная с 17–го дня терапии. После завершения терапии проводилось морфологическое исследование. В группе с более ранним началом терапии когнитивные функции оставались относительно сохранными, не было отмечено также значительных изменений белого вещества. Отсроченная терапия не влияла на выраженность изменений белого вещества, однако способствовала меньшей выраженности когнитивных расстройств по сравнению с фосфатно–солевым буферным раствором. Авторы пришли к выводу, что цитиколин оказывает профилактический эффект в отношении развития лейкоареоза и когнитивных расстройств, в том числе и при отсроченном применении.
Известно, что стимуляция эндогенных нейротрофических факторов или введение экзогенных мезенхимальных стволовых клеток благоприятно влияют на нейрональные репаративные процессы и способствуют более значительному восстановлению функций после ишемического инсульта. Gutierrez M. et al. [29] исследовали воздействие цитиколина, мезенхимальных стволовых клеток и их комбинации на репаративные процессы и восстановление неврологических функций после инфаркта головного мозга у крыс. В проведенном исследовании [25] самцы крыс линии «Спраг Доули» были распределены на 5 групп:
1. Симуляция: операция без инфаркта.
2. Контроль: операция + инфаркт.
3. Цитиколин: операция + инфаркт + цитиколин внутрибрюшинно (500 мг/кг).
4. Мезенхимальные стволовые клетки: операция + инфаркт + мезенхимальные стволовые клетки внутривенно (2 x 106 клеток).
5. Комбинация: операция + инфаркт + мезенхимальные стволовые клетки внутривенно (2 x 106 клеток) + цитиколин внутрибрюшинно (500 мг/кг).
Эффективность терапии оценивалась через 24 ч и 14 дней на основании неврологического исследования, магнитно–резонансной томографии (МРТ), морфологического исследования с окраской гематоксилином–эозином, а также иммуногистохимических методов. В группах цитиколина, мезенхимальных стволовых клеток и комбинированной терапии отмечалась меньшая выраженность неврологических нарушений по сравнению с контрольными группами (p<0,05). Различий между терапевтическими группами не отмечалось. Также не было отмечено уменьшения объема инфаркта мозга на фоне какой–либо терапии. В то же время иммуногистохимические методы исследования свидетельствовали о повышении активности нейрогенеза и ангиогенеза и в периинфарктной зоне на фоне терапии. Использование цитиколина способствовало также снижению воспалительного ответа. На основании полученных результатов авторы сделали вывод, что цитиколин и мезенхимальные стволовые клетки обладают сопоставимой эффективностью в отношении восстановления неврологических функций после инфаркта мозга. В основе данного эффекта лежит уменьшение гибели нейронов и стимуляции репаративных процессов головного мозга. Комбинированная терапия (цитиколин + мезенхимальные стволовые клетки) оказалась наиболее эффективной.
Цитиколин прошел многочисленные исследования на здоровых добровольцах и пациентах с церебральной ишемией. Показано, что препарат обладает удовлетворительным профилем переносимости и безопасности [24,30]. Данные результаты имеют важное практическое значение, поскольку расширяют терапевтические возможности реабилитации пациентов после инсульта. Проведенные исследования свидетельствуют о целесообразности использования цитиколина при ишемическом инсульте, а также при хронической церебральной ишемии, сопровождающейся когнитивными нарушениями.
Клинические данные
Клинические исследования цитиколина свидетельствуют о безопасности данного препарата при различных неврологических заболеваниях [24]. Препарат показал свою эффективность при ишемическом инсульте, о чем свидетельствует мета–анализ 10 исследований с участием 2279 пациентов [30,31]. Показано, что у пациентов, получавших цитиколин, уровни смертности и инвалидизации были достоверно меньшими (табл. 1), что оказывало, в том числе, благоприятный экономический эффект [32].
Проведенный объединенный анализ данных [30] свидетельствует, что восстановление через 3 мес. было достигнуто у 25,2% пациентов, получавших цитиколин, и у 20,2% пациентов, получавших плацебо (отношение рисков (ОР) 1,33; 95% доверительный интервал (ДИ): 1,10–1,62; p=0,0034). Эффективность цитиколина отмечалась также при длительности терапии 6 нед. Однако предполагается, что более длительная терапия оказывает больший эффект [33].
В основе благоприятного эффекта цитиколина в отношении неврологических функций лежит увеличение числа эндотелиальных стволовых клеток в результате влияния препарата на репаративные процессы [34].
Согласно Кохрановскому обзору [35] цитиколин оказывает положительный эффект при когнитивных и поведенческих расстройствах, связанных с хроническими заболеваниями головного мозга, особенно ишемического генеза, у пожилых пациентов.
Недавно было завершено клиническое исследование эффективности цитиколина при постинсультных когнитивных нарушениях [36]. Критерием включения в исследование был первичный характер инсульта. Нейропсихологическое тестирование проводилось через 6 нед. (±3 дня), 6 мес. (±7 дней) и 12 мес. (±14 дней) после инсульта. Все пациенты получали лечение цитиколином в дозе 2 г/сут. до 6–й нед., а половина выборки получала терапию цитиколином (1 г/сут.) в течение 12 мес. Связь проводимой терапии и когнитивных функций оценивалась методом логистической регрессии. В исследовании участвовало 347 пациентов, средний возраст составил 67,2 года, 186 (56,6%) мужчин, средний уровень образования – 5,70±3,97 лет. 172 пациента (49,6%) получали цитиколин в течение 12 мес. Сравниваемые группы были сопоставимы по полу, возрасту и уровню образования. За время наблюдения умерли 38 пациентов, у 49 больных отмечались повторные сосудистые события. 54 пациента вышли из наблюдения. Достоверной разницы между сравниваемыми группами по указанным параметрам не отмечалось. У 4 пациентов (2,33%) имелись нежелательные явления, связанные с цитиколином, что привело к отмене терапии в 2 случаях. Через 6 мес. после инсульта у 43,5% пациентов отмечались нарушения памяти, у 31,5% – нарушения восприятия и зрительно–пространственных функций, у 40,5% – нарушения внимания и управляющих функций, у 54,8% – психомоторная замедленность, у 34,5% – расстройства речи и у 24,5% – нарушения ориентировки во времени.
У пациентов, не получавших лечение цитиколином, распространенность нарушений внимания, управляющих функций и ориентировки во времени была достоверно большей (ОР 1,725; 95% ДИ: 1,090 – 2,729; p=0,019 и ОР 1,728; 95 ДИ: 1,021 – 2,927; p=0,042 соответственно). Через 12 мес. после инсульта у 40,5% пациентов сохранялись нарушения памяти, у 29,5% – нарушения восприятия и зрительно–пространственных функций, у 39,5% – нарушения внимания и управляющих функций, у 52,0% – психомоторная заторможенность, у 33,0% – нарушения речи и у 20,0% – нарушения ориентировки во времени. При этом различия между группой цитиколина и контрольной группой оставались достоверными. Авторы пришли к выводу, что у пациентов с первичным ишемическим инсультом лечение цитиколином в течение 12 мес. является безопасным и эффективным в отношении когнитивных нарушений, что объясняется нейрорепаративными свойствами цитиколина и его влиянием на ацетилхолинергическую систему. При этом влияние цитиколина на когнитивные функции сохраняется спустя 1 год наблюдения (уровень доказательности В).
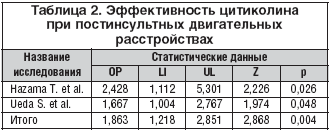
Активно изучается также эффект цитиколина в отношении двигательных нарушений после инсульта. В 1980 г. Hazama T. et al. [37] опубликовали результаты рандомизированного двойного слепого плацебо– контролируемого исследования эффективности цитиколина при постинсультной гемиплегии. В исследовании участвовали 165 пациентов с инсультом давностью от 3 до 51 мес. (в среднем 6 мес.). Все пациенты проходили необходимые реабилитационные мероприятия. Помимо этого, 55 пациентов получали высокую дозу цитиколина (1 г/сут. в течение 8 нед.), 56 пациентов – меньшую дозу цитиколина (250 мг/сут. в течение 8 нед.), а 54 пациента получали плацебо. Улучшение не менее чем на 1 балл по шкале двигательных нарушений на 4 и 8 нед. наблюдения отмечались у 44,4 и 53,3% пациентов соответственно, получавших высокую дозу цитиколина, и у 29,3 и 54,8% пациентов, получавших меньшую дозу цитиколина. В группе плацебо улучшение было отмечено у 29,3 и 31,8% больных соответственно. Различие между активной терапией и контрольной группой достигало статистической значимости на 8–й нед. наблюдения (p=0,006). Авторы сделали вывод, что цитиколин способствует восстановлению двигательных функций у пациентов с гемиплегией.
Влияние терапии цитиколином на двигательные функции исследовалось также Ueda S. et al. [38]. В рандомизированном двойном слепом плацебо–контролируемом исследовании участвовали 258 пациентов, перенесших инсульт в сроки от 4 нед. до одного года до включения. Пациенты получали цитиколин (1 г/сут. в течение 8 нед.) или плацебо наряду со стандартными реабилитационными мероприятиями. На фоне применения цитиколина улучшение функции верхней конечности не менее чем на 1 балл по 12–балльной шкале двигательных нарушений отмечалось в 67,8%, а на фоне плацебо – в 55,4% случаев (p=0,047). Препарат продемонстрировал удовлетворительный уровень безопасности и переносимости. Авторы пришли к выводу, что цитиколин способствует улучшению двигательных функций у пациентов с постинсультной гемиплегией при использовании одновременно с традиционными реабилитационными мероприятиями.
Мета–анализ цитируемых выше исследований эффективности цитиколина при двигательных расстройствах свидетельствует о высокой эффективности его применения в дозе 1 г/сут. в течение 8 нед. (уровень доказательности А, ОР 1,863; 95% ДИ: 1,218–2,851; p=0,004) (табл. 2) для восстановления двигательных функций в верхней конечности. Влияние на восстановление двигательных функций в нижней конечности не достигало статистической значимости (ОР 1,036; 95% ДИ: 0,681–1,563; p=0,864), что может быть связано с относительно малым числом пациентов.
Iranmanesh F. и Vakilian A. [39] исследовали эффективность цитиколина при двигательных нарушениях вследствие нетравматического внутримозгового кровоизлияния. В двойном слепом рандомизированном клиническом исследовании участвовали 32 пациента с геморрагическим нетравматическим супратенториальным кровоизлиянием. Они были разделены на 2 группы по 16 человек. Первая группа получала лечение цитиколином (250 мг внутривенно 2 раза в сут.) в течение 14 сут.; а вторая получала плацебо. У пациентов измеряли мышечную силу до лечения и через 3 мес. терапии. Группы были сопоставимы по возрасту, полу и объему гематомы. Статистический анализ проводился по методу Манна–Уитни. Половина пациентов были мужского пола. Средняя мышечная сила в обеих группах до лечения составила 2,5 балла (диапазон от 0 до 4,5 баллов), а на фоне терапии – 4 балла в группе цитиколина и 3,12 – в группе плацебо. Различия между терапевтическими группами были достоверны (p=0,019). Таким образом, цитиколин может быть эффективным в отношении двигательных расстройств у пациентов с внутримозговым кровоизлиянием (уровень доказательности В).
Заключение. Цитиколин продемонстрировал свое нейропротективное и нейрорепаративное действие в экспериментальных моделях острой ишемии и старения головного мозга. Проведенные клинические исследования у пациентов с ишемическим инсультом показали что цитиколин улучшает функциональное восстановление и ускоряет реабилитацию этих пациентов. Показано, что препарат обладает удовлетворительным профилем безопасности и переносимости. Проведенные исследования свидетельствуют о целесообразности использования цитиколина при ишемическом инсульте, а также при хронической церебральной ишемии, сопровождающейся когнитивными нарушениями.
Таким образом, применение цитиколина имеет важное практическое значение, поскольку расширяет терапевтические возможности реабилитации пациентов после инсульта.
Реферат подготовлен проф. В.В. Захаровым
по материалам статьи Secades J.J. Probably role of citicoline in stroke rehabilitation: review of
the literature // Rev. Neurol. – 2012. – 54. – 173–9.
![Таблица 1. Летальность и инвалидизация после инсульта: эффективность цитиколина. Результаты метаанализа исследований при ишемическом инсульте, внутримозговом кровоизлиянии и неуточненном типе инсульта [31]](/data/articles/Image/t20/n19/978-2.gif)
Литература
1. World Health Organization: The World Health Report. Geneva: WHO; 1999.
2. Demaerschalk BM, Hwang HM, Leung G. US cost burden of ischemic stroke: a systematic literature review. Am J Manag Care 2010; 16: 525–33.
3. Dobkin BH. Rehabilitation after stroke. N Engl J Med 2005; 352: 1677–84.
4. Duncan PW, Zorowitz R, Bates B, Choi JY, Glasberg JJ, Graham GD, et al. Management of adult stroke rehabilitation care: a clinical practice guideline. Stroke 2005; 36: e100–e43.
5. Carter AR, Connor LT, Dromerick AW. Rehabilitation after stroke: current state of the science. Curr Neurol Neurosci Rep 2010; 10: 158–66.
6. Cramer SC. Brain repair after stroke. N Engl J Med 2010; 362: 1827–9.
7. Diaz–Arribas MJ, Pardo–Hervas P, Tabares–Lavado M,
Rios–Lago M, Maestu F. Plasticidad del sistema nervioso central y estrategias de tratamiento para la reprogramacion sensoriomotora: comparacion de dos casos de accidente cerebrovascular isquemico en el territorio de la arteria cerebral media. Rev Neurol 2006; 42: 153–8.
8. Hurtado O, Pradillo JM, Alonso–Escolano D, Lorenzo P, Sobrino T, Castillo J, et al. Neurorepair versus neuroprotection in stroke. Cerebrovasc Dis 2006; 21 (Suppl 2): S54–63.
9. Martinez–Vila E, Irimia P. Challenges of neuroprotection and neurorestoration in ischemic stroke treatment. Cerebrovasc Dis 2005; 20 (Suppl 2): S148–58.
10. Marsden D, Quinn R, Pond N, Golledge R, Neilson C, White J, et al. A multidisciplinary group programme in rural settings for community–dwelling chronic stroke survivors and their careers: a pilot randomized controlled trial. Clin Rehabil 2010; 24: 328–41.
11. Platz T, Eickhof C, Van Kaick S, Engel U, Pinkowski C, Kalok S, et al. Impairment–oriented training or Bobath therapy for severe arm paresis after stroke: a single–blind, multicentre randomized controlled trial. Clin Rehabil 2005; 19: 714–24.
12. Xue J, Bai L, Guo QR, Yang CR, Lu J. Efficacy of early intervention of motor relearning program on post–stroke hemiplegia: a randomized controlled observation. Neural Regeneration Research 2006; 1: 277–9.
13. Hoffmann T, Bennett S, Koh CL, McKenna K. A systematic review of cognitive interventions to improve functional ability in people who have cognitive impairment following stroke. Top Stroke Rehabil 2010; 17: 99–107.
14. Rekand T. Clinical assessment and management of spasticity: a review. Acta Neurol Scand Suppl 2010; 190: 62–6.
15. Beltran EJ, Papadopoulos CM, Tsai SY, Kartje GL, Wolf WA. Long–term motor improvement after stroke is enhanced by short–term treatment with the alpha–2 antagonist, atipamezole. Brain Res 2010; 1346: 174–82.
16. Santamato A, Panza F, Filoni S, Ranieri M, Solfrizzi V, Frisardi V, et al. Effect of botulinum toxin type A, motor imagery and motor observation on motor function of hemi– paretic upper limb after stroke. Brain Inj 2010; 24: 1108–12.
17. Lokk J, Salman Roghani R, Delbari A. Effect of methylphenidate and/or levodopa coupled with physiotherapy on functional and motor recovery after stroke –a randomized, double–blind, placebo–controlled trial. Acta Neurol Scand 2011; 123: 266–73.
18. Levy R, Ruland S, Weinand M, Lowry D, Dafer R, Bakay R. Cortical stimulation for the rehabilitation of patients with hemiparetic stroke: a multicenter feasibility study of safety and efficacy. J Neurosurg 2008; 108: 707–14.
19. Lim JY, Kang EK, Paik NJ. Repetitive transcranial magnetic stimulation to hemispatial neglect in patients after stroke: an open–label pilot study. J Rehabil Med 2010; 42: 447–52.
20. Kalra L, Ratan RR. Advances in stroke regenerative medicine 2007. Stroke 2008; 39: 273–5.
21. Dobrossy M, Busse M, Piroth T, Rosser A, Dunnett S, Nikkhah G. Neurorehabilitation with neural transplantation. Neurorehabil Neural Repair 2010; 24: 692–701.
22. Adibhatla RM, Hatcher JF. Role of lipids in brain injury and diseases. Future Lipidol 2007; 2: 403–22.
23. Saver JL. Target brain: neuroprotection and neurorestoration in ischemic stroke. Rev Neurol Dis 2010; 7 (Suppl 1): S14–21.
24. Secades JJ. Citicolina: revision farmacologica y clinica, actualizacion 2010. Rev Neurol 2011; 52 (Supl 2): S1–62.
25. Hurtado O, Cardenas A, Pradillo JM, Morales JR, Ortego F, Sobrino T, et al. A chronic treatment with CDP–choline improves functional recovery and increases neuronal plasticity after experimental stroke. Neurobiol Dis 2007; 26: 105–11.
26. Carnevale D, De Simone R, Minghetti L. Microglia–neuron interaction in inflammatory and degenerative diseases: role of cholinergic and noradrenergic systems. CNS Neurol Disord Drug Targets 2007; 6: 388–97.
27. Bramanti V, Campisi A, Tomassoni D, Li Volti G, Caccamo D, Cannavo G, et al. Effect of acetylcholine precursors on proliferation and differentiation of astroglial cells in primary cultures. Neurochem Res 2008; 33: 2601–8.
28. Lee HJ, Kang JS, Kim YI. Citicoline protects against cognitive impairment in a rat model of chronic cerebral hypoperfusion. J Clin Neurol 2009; 5: 33–8.
29. Gutierrez M, Rodriguez B, Alvarez J, Exposito M, Vallejo M, Merino J, et al. Effects of citicoline and mesenchymal stem cells in acute cerebral infarct. Experimental study in rats. Cerebrovasc Dis 2010; 29 (Suppl 2): S1–341.
30. Davalos A, Castillo J, Alvarez–Sabin J, Secades JJ, Mercadal J, Lopez S, et al. Oral citicoline in acute ischemic stroke: an individual patient data pooling analysis of clinical trials. Stroke 2002; 33: 2850–7.
31. Saver JL. Citicoline: update on a promising and widely available agent for neuroprotection and neurorepair. Rev Neurol Dis 2008; 5: 167–77.
32. Casado A, Secades JJ, Ibarz R, Herdman M, Brosa M. Costeffectiveness of citicoline versus conventional treatment in acute ischemic stroke. Expert Rev Pharmacoecon Outcomes Res 2008; 8: 151–7.
33. Cho HJ, Kim YJ. Efficacy and safety of oral citicoline in acute ischemic stroke: drug surveillance study in 4,191 cases. Methods Find Exp Clin Pharmacol 2009; 31: 171–6.
34. Sobrino T, Rodriguez–Gonzalez R, Blanco M, Brea D, Perez–Mato M, Rodriguez–Yanez M, et al. CDP–choline treatment increases circulating endothelial progenitor cells in acute ischemic stroke. Neurol Res 2011; 33: 572–7.
35. Fioravanti M, Yanagi M. Cytidinediphosphocholine for cognitive and behavioural disturbances associated with chronic cerebral disorders in the elderly. Cochrane Database Syst Rev 2005; 2: CD000269. www.neurologia.com Rev Neurol 2012; 54 (3): 173–179 179 Probably role of citicoline in stroke rehabilitation
36. Alvarez–Sabin J, Roman G. Citicoline in vascular cognitive impairment and vascular dementia after stroke. Stroke 2011; 42 (Suppl 1): S40–3.
37. Hazama T, Hasegawa T, Ueda S, Sakuma A. Evaluation of the effect of CDP–choline on post–stroke hemiplegia employing a double–blind controlled trial. Int J Neurosci 1980; 11: 211–25.
38. Ueda S, Hasegawa T, Ando K, Okawa T, Chino N, Ogata H, et al. Evaluation of the pharmacological effect of CDP–choline injection in post–stroke hemiplegia. Double–blind comparative study using the Hemiplegia Function Test (12–grade evaluation method). Strides of Medicine 1994; 170: 297–314.
39. Iranmanesh F, Vakilian A. Efficiency of citicoline in increasing muscular strength of patients with nontraumatic cerebral hemorrhage: a double–blind randomized clinical trial. J Stroke Cerebrovasc Dis 2008; 17: 153–5.












