Степень повреждающего действия ишемии определяется прежде всего глубиной и длительностью снижения мозгового кровотока. Кратковременное (до 1–1,5 мин.) и «мягкое» его снижение, наблюдающееся при хорошо развитой сети коллатералей и сохранной реактивности сосудов, может не вызывать гипоксию–ишемию. В этой ситуации функциональная сохранность нейронов обеспечивается компенсаторным повышением экстракции кислорода из крови. Однако при отсроченной реперфузии тканевые приспособительные механизмы истощаются и развивается ишемия. Понимание этих факторов позволило укрепить отношение к инсульту, как к неотложному состоянию, требующему патогенетически обоснованной терапии в первые часы заболевания, соответственно видоизменялись и подходы к лечению. Эти изменения относятся к разработке принципов так называемой нейропротективной терапии, суть которой – сократить объем очага поражения ткани головного мозга при острых цереброваскулярных событиях и при хронической прогрессирующей энцефалопатии [Wahlgren NG, Ahmed N., 2004].
В «идеальном» варианте при инсульте цель нейропротекции заключается в предотвращении прогрессировании ишемического каскада, происходящего в клетках головного мозга (рис. 1), а при хронической сосудистой энцефалопатии – в поддержании жизнедеятельности клеток в условиях длительной гипоксии.
Финалом такого каскада в любой ситуации является апоптоз клеток головного мозга, который происходит вследствие резкого энергетического дефицита клетки.
Таким образом, основная задача нейропротективной терапии – воспрепятствование прогрессирующему энергетическому дефициту. Центральный биохимический механизм энергетического дефицита клетки – это перестройка с аэробного пути окисления глюкозы (с выгодным количеством энергии) на анаэробный (с дефицитом энергии, рис. 2).
Все нейропротекторы по своим фармакологическим особенностям разделены на следующие группы:
• антагонисты глутамата и различных модуляторных участков глутаматных рецепторов (глицин, рилузол, лубелузол);
• антагонисты кальция (нимодипин);
• антиоксиданты и их предшественники (Актовегин, мексидол, эмоксипин, a–токоферол и др.);
•ингибиторы ферментов (аллопуринол, тормозящий активность ксантинолоксидазы, депренил – ингибитор МАО–В, нитро–L–аргинин – блокатор NO–синтетазы);
•энергокорректоры (Актовегин, реамберин, цитофлавин).
Вспомогательной «системой координат» для выбора нейропротекции может служить принцип оп¬ределения приоритетных терапевтических задач и патогенетически обоснованной медицинской помощи, начиная с догоспитального этапа ее оказания.
Так, если в острей¬шем периоде приоритетными являются остановка прогрессирования некроза и купирование бурно развивающихся вегетативных реакций, то в «подострую» фазу и в периоде раннего восстановления более важным представляется сохра¬нение и восстановление функциональной интеграции внутримозговых структур. Соответственно, в первом случае необходимы пре¬параты, способные обеспечить эффективную микроциркуляцию и со¬хранить структуру гематоэнцефалического барьера (ГЭБ), предотвратить разрушение мембранных образований нейронов и противостоять разрушительным адренергическим ре¬акциям, сопутствующим сосудистой катастрофе.
Для решения последующей задачи целесообразно использовать средства, стимулирующие нейромедиаторную активность нейронов. Преодоление феномена «полимедиаторной недостаточности» (гипофункции мотор¬ных зон, базальных ядерных образований, ретикулярной формации и др.), связанного с локальным и генерализо¬ванным гипоксическим повреждением, позволяет зна¬чительно снизить степень выраженности сопутствующих осложнений, а в некоторых случаях избежать их. Такая «система координат» позволяет при полном сохранении страте¬гически направленной терапии учитывать индивидуальные особенности течения заболевания.
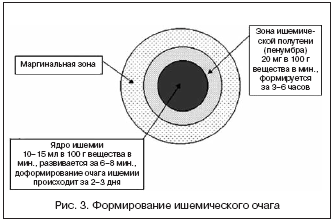
Церебральная ишемия – это динамический процесс. Вызванные изменения, как правило, потенциально обратимы. В работах 1979–1981 гг. J. Astrup и соавт. показали, что степень повреждающего действия ишемии зависит от глубины и длительности снижения мозгового кровотока (рис. 3).
В течение первых 3 ч с момента возникновения инсульта максимально представлен энергетический дефицит в ишемизированной ткани; через 3–6 ч – глутаматная «эксайтотоксичность», нарушения кальциевого гомеостаза и лактат–ацидоз, угасающие к концу первых суток. Отдаленные последствия ишемии начинают проявляться на 2–3–м часу, достигают максимума через 12–36 ч (оксидантный стресс и локальное воспаление) и на 2–3–и сутки (апоптоз), но сохраняются длительно (в течение нескольких месяцев), способствуя в постинсультном периоде прогрессированию процессов атерогенеза и диффузного повреждения ткани головного мозга (сосудистой энцефалопатии).
В настоящее время разработана и функционирует система поэтапного оказания медицинской помощи больным мозговым инсультом (рис. 4).
Лечение инсульта на догоспитальном этапе включает два основных направления: базисную терапию и нейропротекцию. Первая направлена на коррекцию нарушений дыхания и сердечно–сосудистой деятельности, профилактику и лечение повышенного внутричерепного давления, отека мозга и осложнений острого инсульта. Вторая должна быть начата как можно раньше – в периоде «терапевтического окна» (дома или в машине скорой помощи) и продолжаться до конца острейшего периода инсульта, т.е. не менее 5–7 дней с момента развития заболевания. Проведение нейропротекции возможно без уточнения характера инсульта, что выгодно отличает этот вид терапии от дифференцированных реперфузионных направлений лечения инсульта.
По данным экспериментальных и клинических исследований раннее применение нейропротекторов позволяет увеличить долю транзиторных ишемических атак и «малых» инсультов среди острых нарушений мозгового кровообращения по ишемическому типу; значительно уменьшить размеры инфаркта мозга; удлинить период «терапевтического окна», расширяя возможности для реперфузионной терапии (тромболизиса); осуществлять защиту от дополнительного реперфузионного (гиперосмолярного и оксидантного) повреждения при ишемическом инсульте.
Условно выделяют два вида нейропротекции: первичную и вторичную. Первичная – направлена на прерывание быстрых механизмов глутамат–кальциевого каскада. С этой целью используют магния сульфат в виде внутривенных капельных вливаний, семакс и глицин. Вторичная нейропротекция направлена на прерывание механизмов отсроченной смерти клеток в зоне пенумбры. Она может быть начата отсроченно, спустя 3–6 часов после развития инсульта, и должна продолжаться минимум 7—10 дней. Вторичная нейропротекция включает применение антиоксидантов, препаратов, блокирующих локальную воспалительную реакцию, улучшающих трофическое обеспечение и предотвращающих апоптоз. Одновременно проводится репаративная терапия, направленная на улучшение пластичности здоровой ткани, окружающей инфаркт головного мозга, активацию образования полисинаптических связей, увеличение плотности рецепторов.
Одним из наиболее эффективных актиоксидантов и энергокорректров, способствующих активации церебральных и мультиорганных реституционных механизмов, является Актовегин – высокоочищенный гемодиализат, получаемый методом ультрафильтрации крови телят. Помимо неорганических электролитов и других микроэлементов он содержит 30% органических веществ, таких как олигопептиды, аминокислоты, нуклеозиды, промежуточные продукты углеводного и жирового обмена, липиды и олигосахариды. Магний входит в Актовегин как компонент нейропептидных фрагментов и ферментов, являясь их каталитическим центром.
Под действием Актовегина в клетке повышается обмен высокоэнергетических фосфатов (особенно АТФ), активируются ферменты окислительного фосфорилирования, такие как сукцинатдегидрогеназа, пируваткиназа, цитохром–С–оксидаза, ускоряется процесс распада продуктов анаэробного гликолиза, прежде всего лактата и гидроксибутирата.
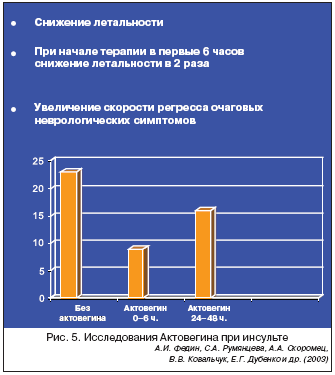
Показано, что Актовегин обладает значимой супероксиддисмутазной активностью, что укладывается в основную концепцию фармакодинамики препарата. Результаты, полученные на фоне применения Актовегина у больных с инсультом [А.И. Федин, С.А. Румянцева; А.А. Скоромец, В.В. Ковальчук; Е.Г. Дубенко и др.], продемонстрировали снижение летальности, активацию состояния сознания и скорости регресса очаговых неврологических симптомов (рис. 5). Авторами отмечено, что более раннее начало лечения Актовегином (до 6 часов от начала заболевания) позволяет в 2 раза снизить летальность в сравнении с отсроченным началом терапии (более суток от момента возникновения инсульта).
Следует заметить, что улучшение окислительно–восстановительных процессов (в частности, увеличение образования макроэргов) под влиянием Актовегина носит дозозависимый характер.
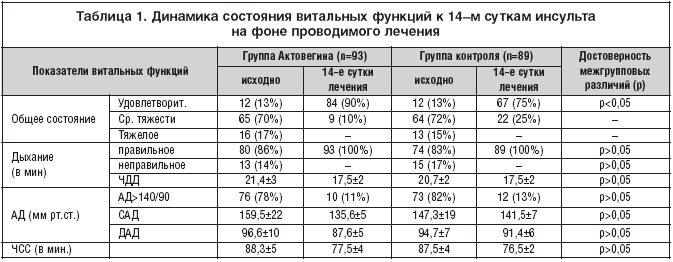
По нашим данным, к 14–м суткам от развития ОНМК у достоверно большего числа пациентов в группе Актовегина по сравнению с группой контроля нормализовалось общее состояние (табл. 1).
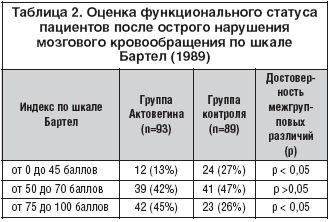
При оценке функционального статуса пациентов в соответствии со шкалой Бартел в группе Актовегина оказалось достоверно большее число пациентов с индексом в пределах 75–100 баллов, то есть больных, практически полностью восстановивших свои функциональные возможности по сравнению с группой контроля (табл. 2).
Результаты тестирования по шкале Бартел в целом подтвердились при клинической оценке исхода острого нарушения мозгового кровообращения лечащим врачом (табл. 3). Так, полное восстановление функций и нормализация неврологического статуса произошли у 45% пациентов в группе Актовегина в отличие от 25% случаев в группе сравнения (p<0,05).
Актовегин отличает универсальный механизм антигипоксического действия, большое количество форм выпуска, практически полное отсутствие противопоказаний и побочных эффектов при применении при различных нозологиях у разных групп пациентов. Кроме того, ряд дополнительных преимуществ Актовегина – экономическая составляющая и стандартизация доз препарата – позволяет рекомендовать его широкому кругу пациентов. Именно поэтому Актовегин вошел в стандарт медицинской помощи при инсульте на догоспитальном этапе. Стандарт был утвержден приказом № 643 Минсоцздравразвития от 5 сентября 2006 года.
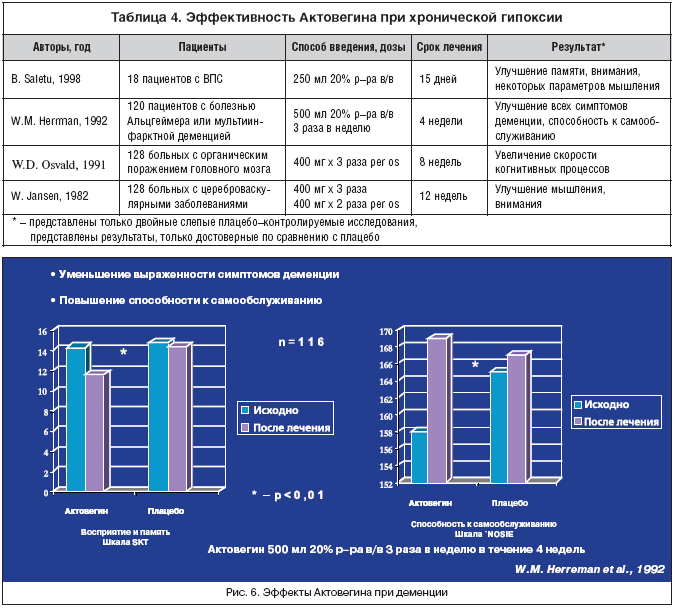
Как уже было отмечено ранее возникший в результате гипоксии энергетический дефицит способствует появлению в более поздних стадиях диффузных нарушений мозгового кровообращения. В таблице 4 представлены некоторые обобщающие сведения об эффективности Актовегина при хронической гипоксии.
В других исследованиях также подтверждается способность Актовегина при хронической декомпенсации мозгового кровообращения значительно улучшать способность к самообслуживанию и снижать выраженность симптомов деменции (рис. 6)
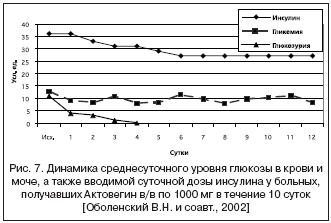
Немаловажной отличительной чертой Актовегина является его доказанное инсулиноподобное действие. Так, в рандомизированном двойном слепом исследовании, проведенным Heidrich и соавт. (1979), у 20 пациентов с сахарным диабетом и у 20 лиц с нормальным метаболизмом углеводов через 14 дней Актовегин значительно улучшал толерантность к глюкозе, не влияя на концентрацию сывороточного инсулина. По данным В.Н. Оболенского и соавт. (2002), у 21 пациента с «диабетической стопой», которым проводилось внутривенное введение 1000 мг Актовегина, было отмечено снижение среднесуточного уровня гликемии с первых суток применения препарата, повлекшее за собой уменьшение суточной потребности в инсулине, а также купирование глюкозурии на 3 сутки (рис. 7).
По данным Saltiel A.R. et al. (1986), Актовегин при инсулинзависимом сахарном диабете обеспечивает снижение потребности в инсулине, замедление прогрессирования диабетической ангиопатии и улучшение транспорта глюкозы. Более того, известно, что при СД нервные структуры регенерируют медленно, поэтому при уже имеющейся нейропатии даже в случае достижения идеальной компенсации СД улучшение может наступить через значительный промежуток времени (до 2 лет). В то же время в патогенезе диабетической нейропатии участвует множество разных факторов. Важную роль играют микроангиопатии, вызывающие ишемическое повреждение нервов, и метаболические нарушения в нейронах, возникающие вследствие гипергликемии, накопления сорбитола и дефицита миозитола в результате полиольного пути утилизации глюкозы. Эндоневральная гипоксия в сочетании с расстройством углеводного обмена тормозит процессы биологического окисления, при этом активируются оксидативные процессы, снижается антиоксидантная защита и образование NO. В этой связи важную роль может играть антиоксидантное действие Актовегина, обусловленное наличием у него высокой супероксиддисмутазной активности, подтвержденной атомно–эмиссионной спектрометрией. Эти эффекты связывают с наличием в препарате магния и микроэлементов, входящих в простетическую группу супероксиддисмутазы. Супероксиддисмутаза активно участвует в каскадах ферментативных метаболических реакций, уменьшая проявления «окислительного стресса» и способствуя регенерации тканей.
Наиболее значимый эффект Актовегина наблюдается у больных с диабетической периферической дистальной нейропатией. В исследовании Яворской В.А., Гребенюк А.В. (2000) применение Актовегина (200 мл 5% раствора в сутки) у 10 пациентов с диабетической полинейропатией, преимущественно периферической формой на 7–е сутки приводило к значительному уменьшению болевого синдрома, у 4 пациентов отмечено объективное улучшение чувствительности проксимальных отделов, у 3 пациентов – оживление сухожильных рефлексов по сравнению с исходным уровнем. В то же время авторы отмечают, что нормализация параметров электромиографии была незначительной, что может быть связано с невысокими дозами применявшегося препарата.
Poremba и Krott (1984) исследовали влияние Актовегина (250 мл 20% раствора в сутки в течение 30 дней) на клинические и электрофизиологические параметры 18 пациентов с инсулинзависимым сахарным диабетом. По окончании лечения у 13 пациентов отмечено клиническое улучшение с исчезновением симптомов нарушенной чувствительности и парестезий, у 7 больных выявлено значительное улучшение показателей электромиографии.
В двойное слепое плацебо–контролируемое исследование эффективности Актовегина у больных с диабетической невропатией, проведенное W. Jansen с соавт. (1987), было включено 70 пациентов с СД 2 типа. Терапия Актовегином (600 мг внутрь 3 раза в сутки в течение 24 недель) приводила к достоверному увеличению скорости проведения по нерву, улучшению общего состояния и самочувствия больных. Четкое наступление терапевтического эффекта наступило на 8–й неделе лечения, оптимальное действие препарата зафиксировано на 16–й неделе лечения. К 16–й неделе лечения дозировка препарата уменьшилась до 400 мг 3 раза в сутки у 13 пациентов (1/3 получавших препарат). За время приема препарата существенных побочных эффектов обнаружено не было. Авторы подчеркивают, что у Актовегина присутствует целый комплекс дополнительных эффектов, которые обеспечивают его выраженный эффект при диабетической полинейропатии. К ним относятся увеличение скорости проведения возбуждения по нервам, оживление сухожильных рефлексов, улучшение болевой, вибрационной и тактильной чувствительности, уменьшение болевого синдрома, увеличение прогулочного расстояния, улучшение самочувствия.
Показано, что после прохождения гематоэнцефалического барьера глюкоза попадает в артериальную кровь головного мозга посредством транспортного механизма с участием одного из переносчиков глюкозы – GLUT 1. ИФО–фракция стимулирует транспорт глюкозы в результате активации GLUT 1. Таким образом, Актовегин усиливает перенос глюкозы в головной мозг независимо от инсулина и инсулиновых рецепторов [F. Machiсao, 1990, Obermaer–Kusser et al., 1989]. Результаты исследования S. Jacob et al. (2002) показали, что после 10–дневного курса парентеральной терапии Актовегином у больных сахарным диабетом 2 типа захват глюкозы в головном мозге увеличился на 85%, а уровень глюкозы в крови снизился без изменения уровня инсулина.
В заключение следует подчеркнуть, что представленная в обзоре «система координат» свидетельствует в пользу выбора для коррекции сосудистых нарушений Актовегина. Его антигипоксическое действие, реализующееся посредством активации аэробного обмена, способствует улучшению микроциркуляции и, как следствие, высвобождению биологических вазодилататоров – простациклина и оксида азота. Это, вероятно, и является объяснением столь высокой эффективности Актовегина при разных клинических ситуациях. Системное патогенетическое действие Актовегина особенно важно в терапии пожилых больных с распространенным атеросклерозом, т.к. позволяет одновременно уменьшить выраженность симптоматики, вызванной нарушением кровоснабжения головного мозга, нижних конечностей, миокарда и т.д. Таким образом, Актовегин позволяет лечить больного, а не отдельное заболевание и значительно улучшает качество жизни пациентов. Большое значение имеет высокая степень безопасности Актовегина, позволяющая применять его в особых группах больных и при различной сопутствующей патологии, что, в конечном итоге, делает лечение более эффективным и комфортным для больного и удобным для врача. Высокая степень безопасности и особенности механизма действия Актовегина позволяют нам рекомендовать удобную схему его клинического применения, которая подходит для большинства пациентов. В основу данной схемы положены не нозологии, по которым применяется Актовегин, а тяжесть состояния пациента.
Так, при состояниях небольшой степени тяжести доза Актовегина составляет 160–400 мг парентерально, при состояниях средней степени тяжести – 400–800 мг парентерально, при тяжелых, жизнеугрожающих состояниях – 1000–2000 мг в/в в сутки и более. Продолжительность парентерального введения препарата – 10–20 дней. При необходимости лечение может быть продолжено таблетками: по 1–2 т. (200–400 мг) 3 раза в сутки, общая продолжительность лечения – 4–8 недель.