–í–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ
–£–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –Ņ—Ä–ĺ–ī–ĺ–Ľ–∂–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł –∂–ł–∑–Ĺ–ł –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź –≤ –†–ĺ—Ā—Ā–ł–Ļ—Ā–ļ–ĺ–Ļ –§–Ķ–ī–Ķ—Ä–į—Ü–ł–ł ‚ÄĒ –ĺ–ī–Ĺ–ĺ –ł–∑ –ľ–Ĺ–ĺ–≥–ĺ—á–ł—Ā–Ľ–Ķ–Ĺ–Ĺ—č—Ö –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł–Ļ –Ņ–ĺ—Ā–Ľ–Ķ–ī–Ĺ–ł—Ö –ī–Ķ—Ā—Ź—ā–ł–Ľ–Ķ—ā–ł–Ļ, –ļ–ĺ—ā–ĺ—Ä–ĺ–≥–ĺ —É–ī–į–Ľ–ĺ—Ā—Ć –ī–ĺ–Ī–ł—ā—Ć—Ā—Ź –≤ —ā–ĺ–ľ —á–ł—Ā–Ľ–Ķ –Ī–Ľ–į–≥–ĺ–ī–į—Ä—Ź —Ä–į–∑–≤–ł—ā–ł—é –ľ–Ķ–ī–ł—Ü–ł–Ĺ—Ā–ļ–ĺ–Ļ –Ĺ–į—É–ļ–ł. –ü—Ä–ł —ć—ā–ĺ–ľ –Ĺ–Ķ —Ā–Ľ–Ķ–ī—É–Ķ—ā –∑–į–Ī—č–≤–į—ā—Ć –ĺ —ā–ĺ–ľ, —á—ā–ĺ —Ā—ā–į—Ä–Ķ–Ĺ–ł–Ķ –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –ĺ–ī–Ĺ–ł–ľ –ł–∑ –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ –≤–į–∂–Ĺ—č—Ö –ī–Ķ–ľ–ĺ–≥—Ä–į—Ą–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–ĺ–≤ —Ā–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ľ–ł—Ä–į. –ü—Ä–ł—á–ł–Ĺ—č ¬ę–ī–Ķ–ľ–ĺ–≥—Ä–į—Ą–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ā—ā–į—Ä–Ķ–Ĺ–ł—Ź¬Ľ –ľ–Ĺ–ĺ–≥–ĺ–ĺ–Ī—Ä–į–∑–Ĺ—č, –ĺ–ī–Ĺ–į–ļ–ĺ —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –ī–ĺ–Ľ–ł –Ľ–ł—Ü –Ņ–ĺ–∂–ł–Ľ–ĺ–≥–ĺ –ł —Ā—ā–į—Ä—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į –≤ –ĺ–Ī—Č–Ķ–Ļ —á–ł—Ā–Ľ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź –ł–≥—Ä–į–Ķ—ā –∑–ī–Ķ—Ā—Ć –Ĺ–Ķ –Ņ–ĺ—Ā–Ľ–Ķ–ī–Ĺ—é—é —Ä–ĺ–Ľ—Ć [1].–ö —Ā–ĺ–∂–į–Ľ–Ķ–Ĺ–ł—é, –≤ –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–Ķ –≤—Ä–Ķ–ľ—Ź —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –Ņ—Ä–ĺ–ī–ĺ–Ľ–∂–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł –∂–ł–∑–Ĺ–ł –Ĺ–Ķ —Ā–ĺ–Ņ—Ä–ĺ–≤–ĺ–∂–ī–į–Ķ—ā—Ā—Ź —Ā—ā–ĺ–Ľ—Ć –∂–Ķ –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–ĺ–ľ —Ö–ĺ—Ä–ĺ—ą–Ķ–≥–ĺ –∑–ī–ĺ—Ä–ĺ–≤—Ć—Ź. –Ď–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–ĺ –Ľ–ł—Ü –Ņ–ĺ–∂–ł–Ľ–ĺ–≥–ĺ –ł —Ā—ā–į—Ä—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į –∂–ł–≤—É—ā –≤ —É—Ā–Ľ–ĺ–≤–ł—Ź—Ö –ľ—É–Ľ—Ć—ā–ł–ľ–ĺ—Ä–Ī–ł–ī–Ĺ–ĺ—Ā—ā–ł, —á—ā–ĺ –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –ĺ–≥—Ä–į–Ĺ–ł—á–ł–≤–į–Ķ—ā –į–ī–į–Ņ—ā–į—Ü–ł–ĺ–Ĺ–Ĺ—č–Ķ —Ä–Ķ–∑–Ķ—Ä–≤—č –ĺ—Ä–≥–į–Ĺ–ł–∑–ľ–į, —Ā–Ĺ–ł–∂–į—Ź –ļ–į—á–Ķ—Ā—ā–≤–ĺ –∂–ł–∑–Ĺ–ł —á–Ķ–Ľ–ĺ–≤–Ķ–ļ–į. –ü—Ä–ł —ć—ā–ĺ–ľ –ł–∑–≤–Ķ—Ā—ā–Ĺ–ĺ, —á—ā–ĺ –ĺ–ī–Ĺ–ł –ł–∑ —Ā–ĺ—á–Ķ—ā–į—é—Č–ł—Ö—Ā—Ź –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –≤–Ņ–ĺ–Ľ–Ĺ–Ķ –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ –Ņ—Ä–Ķ–ī–ĺ—ā–≤—Ä–į—ā–ł—ā—Ć –ł–Ľ–ł –ĺ—ā—Ā—Ä–ĺ—á–ł—ā—Ć –ł—Ö —Ä–į–∑–≤–ł—ā–ł–Ķ –Ņ—É—ā–Ķ–ľ –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ—č—Ö –ľ–Ķ—Ä –Ņ—Ä–ĺ—Ą–ł–Ľ–į–ļ—ā–ł–ļ–ł. –Ē—Ä—É–≥–ł–Ķ –∂–Ķ –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ –Ņ—Ä–Ķ–ĺ–ī–ĺ–Ľ–Ķ—ā—Ć –ł –ī–Ķ—Ä–∂–į—ā—Ć –Ņ–ĺ–ī —Ā—ā—Ä–ĺ–≥–ł–ľ —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ—č–ľ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ–Ķ–ľ –Ņ—Ä–ł —É—Ā–Ľ–ĺ–≤–ł–ł –ł—Ö —Ä–į–Ĺ–Ĺ–Ķ–≥–ĺ –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź [2].
–ď–Ľ–ĺ–Ī–į–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć —ć—ā–ĺ–Ļ –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ—č –ł –Ķ–Ķ –∑–Ĺ–į—á–ł–ľ–ĺ—Ā—ā—Ć –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź—é—ā—Ā—Ź –ł —ā–Ķ–ľ, —á—ā–ĺ –í—Ā–Ķ–ľ–ł—Ä–Ĺ–į—Ź –ĺ—Ä–≥–į–Ĺ–ł–∑–į—Ü–ł—Ź –∑–ī—Ä–į–≤–ĺ–ĺ—Ö—Ä–į–Ĺ–Ķ–Ĺ–ł—Ź (–í–ě–ó) –Ņ—Ä–ĺ–≤–ĺ–∑–≥–Ľ–į—ą–į–Ķ—ā –ł —Ä–Ķ–≥–Ľ–į–ľ–Ķ–Ĺ—ā–ł—Ä—É–Ķ—ā –ļ–ĺ–Ĺ—Ü–Ķ–Ņ—Ü–ł—é –∑–ī–ĺ—Ä–ĺ–≤–ĺ–≥–ĺ —Ā—ā–į—Ä–Ķ–Ĺ–ł—Ź ‚ÄĒ —Ā–ĺ–∑–ī–į–Ĺ–ł–Ķ —É—Ā–Ľ–ĺ–≤–ł–Ļ, –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–ł–≤–į—é—Č–ł—Ö –ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ—É—é –ł–Ĺ–ī–ł–≤–ł–ī—É–į–Ľ—Ć–Ĺ—É—é –ł —Ą—É–Ĺ–ļ—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ—É—é –∂–ł–∑–Ĺ–Ķ—Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ—Ā—ā—Ć –Ľ—é–ī–Ķ–Ļ –Ņ–ĺ–∂–ł–Ľ–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į, —ā. –Ķ. —Ā–ĺ—Ö—Ä–į–Ĺ–Ķ–Ĺ–ł–Ķ –ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ–ĺ –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ–≥–ĺ –Ņ–ĺ—ā–Ķ–Ĺ—Ü–ł–į–Ľ–į –ł—Ö –Ņ–ĺ–≤—Ā–Ķ–ī–Ĺ–Ķ–≤–Ĺ–ĺ–Ļ –ł —Ā–ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł, –į–ī–Ķ–ļ–≤–į—ā–Ĺ–ĺ–Ļ ¬ę—Ā–ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –į–ī–į–Ņ—ā–į—Ü–ł–ł¬Ľ –ł –ł–Ĺ—ā–Ķ–≥—Ä–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ—Ā—ā–ł –≤ —Ā–ĺ—Ü–ł—É–ľ [1, 2].
–•—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–į—Ź –ł—ą–Ķ–ľ–ł—Ź –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į (–•–ė–ď–ú) ‚ÄĒ –ĺ–ī–Ĺ–ĺ –ł–∑ –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ—č—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ, –≤–Ķ–ī—É—Č–ł—Ö –ļ —Ā–Ķ—Ä—Ć–Ķ–∑–Ĺ–ĺ–ľ—É —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—é –ļ–į—á–Ķ—Ā—ā–≤–į –∂–ł–∑–Ĺ–ł –ł —ā—Ź–∂–Ķ–Ľ–ĺ–Ļ –ł–Ĺ–≤–į–Ľ–ł–ī–ł–∑–į—Ü–ł–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā—ā–į—Ä—ą–Ķ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į. –Ę–į–ļ, –Ņ–ĺ –ī–į–Ĺ–Ĺ—č–ľ –Ņ—Ä–ĺ—Ą–ł–Ľ–į–ļ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ĺ—Ā–ľ–ĺ—ā—Ä–ĺ–≤ –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź, –≤ –†–ĺ—Ā—Ā–ł–Ļ—Ā–ļ–ĺ–Ļ –§–Ķ–ī–Ķ—Ä–į—Ü–ł–ł —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–į—Ź –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć –ľ–ĺ–∑–≥–ĺ–≤–ĺ–≥–ĺ –ļ—Ä–ĺ–≤–ĺ–ĺ–Ī—Ä–į—Č–Ķ–Ĺ–ł—Ź –≤—č—Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —É –Ľ–ł—Ü —ā—Ä—É–ī–ĺ—Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į –≤ 20‚Äď30% —Ā–Ľ—É—á–į–Ķ–≤ –ł —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ—ā –Ĺ–Ķ –ľ–Ķ–Ĺ–Ķ–Ķ 700 –Ĺ–į 100 —ā—č—Ā. –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź, –Ņ—Ä–ł —ć—ā–ĺ–ľ –Ķ–∂–Ķ–≥–ĺ–ī–Ĺ–ĺ —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä—É—é—ā—Ā—Ź 3‚Äď5 —Ā–Ľ—É—á–į–Ķ–≤ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –Ĺ–į 1 —ā—č—Ā. –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź [3]. –ü—Ä–ł–Ī–Ľ–ł–∑–ł—ā–Ķ–Ľ—Ć–Ĺ–į—Ź –∂–Ķ —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć —Ā–ľ–Ķ—Ä—ā–Ĺ–ĺ—Ā—ā–ł –ĺ—ā –•–ė–ď–ú –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ķ—ā—Ā—Ź –ļ–į–ļ 70,69 –Ĺ–į 100 —ā—č—Ā. –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź [4].
–ė–∑–≤–Ķ—Ā—ā–Ĺ–ĺ, —á—ā–ĺ –ĺ–≥—Ä–ĺ–ľ–Ĺ–ĺ–Ķ –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –ī–Ľ—Ź —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ–Ļ –ļ–ĺ—Ä—Ä–Ķ–ļ—Ü–ł–ł –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ –•–ė–ď–ú, –į —ā–į–ļ–∂–Ķ –Ņ—Ä–Ķ–ī—É–Ņ—Ä–Ķ–∂–ī–Ķ–Ĺ–ł—Ź –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –ł–ľ–Ķ–Ķ—ā –ļ–į–ļ –ľ–ĺ–∂–Ĺ–ĺ –Ī–ĺ–Ľ–Ķ–Ķ —Ä–į–Ĺ–Ĺ—Ź—Ź –Ķ–Ķ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–į, —á—ā–ĺ –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ—Ź–Ķ—ā –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–Ĺ—č–Ķ —ā—Ä—É–ī–Ĺ–ĺ—Ā—ā–ł. –í—č—Ā–ĺ–ļ–ł–Ļ —É—Ä–ĺ–≤–Ķ–Ĺ—Ć –Ľ–į—ā–Ķ–Ĺ—ā–Ĺ–ĺ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź, –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –į–Ī—Ā–ĺ–Ľ—é—ā–Ĺ–ĺ —á–Ķ—ā–ļ–ł—Ö –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –≥—Ä–į–Ĺ–ł—Ü –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź —Ā–Ķ—Ä—Ć–Ķ–∑–Ĺ–ĺ –∑–į—ā—Ä—É–ī–Ĺ—Ź—é—ā –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ—É –•–ė–ď–ú [5]. –ü—Ä–ł —ć—ā–ĺ–ľ –Ĺ–į–Ľ–ł—á–ł–Ķ —á–į—Ā—ā–ĺ–≥–ĺ —Ā–ĺ—á–Ķ—ā–į–Ĺ–ł—Ź –•–ė–ď–ú —Ā –ł—ą–Ķ–ľ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ī–ĺ–Ľ–Ķ–∑–Ĺ—Ć—é —Ā–Ķ—Ä–ī—Ü–į (–ė–Ď–°), –≥–ł–Ņ–Ķ—Ä—ā–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ī–ĺ–Ľ–Ķ–∑–Ĺ—Ć—é (–ď–Ď), —Ā–į—Ö–į—Ä–Ĺ—č–ľ –ī–ł–į–Ī–Ķ—ā–ĺ–ľ (–°–Ē) –≤—č–Ĺ—É–∂–ī–į–Ķ—ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ĺ–Ī—Ä–į—Č–į—ā—Ć—Ā—Ź –∑–į –Ņ–ĺ–ľ–ĺ—Č—Ć—é –ļ —Ā–Ņ–Ķ—Ü–ł–į–Ľ–ł—Ā—ā–į–ľ —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ā–Ľ—É–∂–Ī—č, –≤ –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–Ķ —Ā–Ľ—É—á–į–Ķ–≤ ‚ÄĒ –Ķ–Ķ –į–ľ–Ī—É–Ľ–į—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ –∑–≤–Ķ–Ĺ–į. –ó–į–Ĺ–ł–ľ–į—Ź—Ā—Ć ¬ę—Ā–≤–ĺ–Ķ–Ļ¬Ľ –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–Ķ–Ļ –ł –Ĺ–Ķ –ł–ľ–Ķ—Ź ¬ę–Ĺ–Ķ–≤—Ä–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ĺ–į—Ā—ā–ĺ—Ä–ĺ–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł¬Ľ, —Ā–Ņ–Ķ—Ü–ł–į–Ľ–ł—Ā—ā—č —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ā–Ľ—É–∂–Ī—č –ł–Ľ–ł –Ĺ–Ķ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—Ä—É—é—ā –•–ė–ď–ú, –ł–Ľ–ł –∑–į–Ņ–ł—Ā—č–≤–į—é—ā –Ķ–Ķ –≤ —Ä–į–∑–ī–Ķ–Ľ –ĺ—Ā–Ľ–ĺ–∂–Ĺ–Ķ–Ĺ–ł–Ļ, –≤ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ —á–Ķ–≥–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č –Ĺ–Ķ –Ņ–ĺ–Ľ—É—á–į—é—ā —Ā—ā–ĺ–Ľ—Ć –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ–Ļ –ł–ľ –į–ī–Ķ–ļ–≤–į—ā–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł [6]. –†–į–∑–≤–ł—ā–ł–Ķ –∂–Ķ –ĺ—á–Ķ–≤–ł–ī–Ĺ–ĺ–Ļ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ā–ł–ľ–Ņ—ā–ĺ–ľ–į—ā–ł–ļ–ł –•–ė–ď–ú, –ļ–į–ļ –Ņ—Ä–į–≤–ł–Ľ–ĺ, —Ā–ĺ—á–Ķ—ā–į–Ķ—ā—Ā—Ź —Ā –Ī–ĺ–Ľ–Ķ–Ķ —ā—Ź–∂–Ķ–Ľ—č–ľ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ–ľ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –ł —Ā–Ķ—Ä—Ć–Ķ–∑–Ĺ—č–ľ –ĺ–≥—Ä–į–Ĺ–ł—á–Ķ–Ĺ–ł–Ķ–ľ —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ł—Ö –≤–ĺ–∑–ī–Ķ–Ļ—Ā—ā–≤–ł–Ļ.
–ė–ľ–Ķ–Ĺ–Ĺ–ĺ –Ņ–ĺ—ć—ā–ĺ–ľ—É –≤—Ä–į—á–į–ľ —Ä–į–∑–Ĺ—č—Ö —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ł—Ö —Ā–Ņ–Ķ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ—Ā—ā–Ķ–Ļ, —á–į—Ā—ā–ĺ —Ā—ā–į–Ľ–ļ–ł–≤–į—é—Č–ł—Ö—Ā—Ź —Ā –Ņ–ĺ–ī–ĺ–Ī–Ĺ—č–ľ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į–ľ–ł, –ĺ—á–Ķ–Ĺ—Ć –≤–į–∂–Ĺ–ĺ –Ņ—Ä–ĺ—Ź–≤–Ľ—Ź—ā—Ć —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤—É—é—Č—É—é –Ĺ–į—Ā—ā–ĺ—Ä–ĺ–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –ł –ł–ľ–Ķ—ā—Ć –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–ł–Ķ –ĺ–Ī –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ź—Ö –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ –•–ė–ď–ú, –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ –Ĺ–į —Ä–į–Ĺ–Ĺ–ł—Ö —Ā—ā–į–ī–ł—Ź—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź, –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ź—Ö –Ķ–≥–ĺ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł –ł —Ā—É—Č–Ķ—Ā—ā–≤—É—é—Č–ł—Ö —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ–ĺ–ī—Ö–ĺ–ī–į—Ö –ī–Ľ—Ź —Ā–≤–ĺ–Ķ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź –į–ī–Ķ–ļ–≤–į—ā–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –ł —É–Ľ—É—á—ą–Ķ–Ĺ–ł—Ź –ļ–į—á–Ķ—Ā—ā–≤–į –∂–ł–∑–Ĺ–ł –≤ —Ü–Ķ–Ľ–ĺ–ľ.
–≠—ā–ł–ĺ–Ľ–ĺ–≥–ł—Ź –•–ė–ď–ú
–ė–∑–≤–Ķ—Ā—ā–Ĺ–ĺ, —á—ā–ĺ –≤ –ú–ö–Ď-10 —ā–Ķ—Ä–ľ–ł–Ĺ ¬ę–•–ė–ď–ú¬Ľ –Ĺ–Ķ –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ. –í –ĺ—ā–Ķ—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ļ –Ľ–ł—ā–Ķ—Ä–į—ā—É—Ä–Ķ –Ņ–ĺ–ī –•–ė–ď–ú –≤ –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–Ķ —Ā–Ľ—É—á–į–Ķ–≤ –Ņ–ĺ–Ĺ–ł–ľ–į—é—ā –ī–ł—Ā—Ü–ł—Ä–ļ—É–Ľ—Ź—ā–ĺ—Ä–Ĺ—É—é —ć–Ĺ—Ü–Ķ—Ą–į–Ľ–ĺ–Ņ–į—ā–ł—é (–Ē–≠–ü), –≤–ĺ–∑–Ĺ–ł–ļ–į—é—Č—É—é –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤ —Ü–Ķ—Ä–Ķ–Ī—Ä–į–Ľ—Ć–Ĺ–ĺ–Ļ —Ü–ł—Ä–ļ—É–Ľ—Ź—Ü–ł–ł (–ļ—Ä–ĺ–≤–ĺ—Ā–Ĺ–į–Ī–∂–Ķ–Ĺ–ł—Ź), –ļ–ĺ—ā–ĺ—Ä–į—Ź —ā–į–ļ–∂–Ķ –ĺ—ā—Ā—É—ā—Ā—ā–≤—É–Ķ—ā –≤ –ú–ö–Ď-10. –Ě–į–ł–Ī–ĺ–Ľ–Ķ–Ķ –Ī–Ľ–ł–∑–ļ–ł–ľ–ł –Ņ–ĺ —Ā–ľ—č—Ā–Ľ—É, —Ā–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –ú–ö–Ď-10, —Ź–≤–Ľ—Ź—é—ā—Ā—Ź —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł—Ź, –ĺ–Ī–ĺ–∑–Ĺ–į—á–Ķ–Ĺ–Ĺ—č–Ķ –ļ–į–ļ I67.8. –Ē—Ä—É–≥–ł–Ķ —É—ā–ĺ—á–Ĺ–Ķ–Ĺ–Ĺ—č–Ķ –Ņ–ĺ—Ä–į–∂–Ķ–Ĺ–ł—Ź —Ā–ĺ—Ā—É–ī–ĺ–≤ –ľ–ĺ–∑–≥–į, –ł—ą–Ķ–ľ–ł—Ź –ľ–ĺ–∑–≥–į (—Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–į—Ź) [7].–ö –ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č–ľ —ć—ā–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–ľ —Ą–į–ļ—ā–ĺ—Ä–į–ľ –•–ė–ď–ú –ĺ—ā–Ĺ–ĺ—Ā—Ź—ā –į—Ä—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ—É—é –≥–ł–Ņ–Ķ—Ä—ā–Ķ–Ĺ–∑–ł—é (–ź–ď), –į—ā–Ķ—Ä–ĺ—Ā–ļ–Ľ–Ķ—Ä–ĺ–∑ –ł –ł—Ö —Ā–ĺ—á–Ķ—ā–į–Ĺ–ł–Ķ, –į —ā–į–ļ–∂–Ķ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ –≤–Ķ–Ĺ–ĺ–∑–Ĺ–ĺ–≥–ĺ –ĺ—ā—ā–ĺ–ļ–į, –°–Ē, –ī—Ä—É–≥–ł–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —Ä–Ķ–∂–Ķ —Ź–≤–Ľ—Ź—é—ā—Ā—Ź –Ņ—Ä–ł—á–ł–Ĺ–ĺ–Ļ —Ä–į–∑–≤–ł—ā–ł—Ź –•–ė–ď–ú. –í —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź —Ü–Ķ—Ä–Ķ–Ī—Ä–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ļ—Ä–ĺ–≤–ĺ—Ā–Ĺ–į–Ī–∂–Ķ–Ĺ–ł—Ź (–≥–ł–Ņ–ĺ–ļ—Ā–Ķ–ľ–ł—Ź, –ĺ–ļ—Ā–ł–ī–į—ā–ł–≤–Ĺ—č–Ļ —Ā—ā—Ä–Ķ—Ā—Ā) –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–ī–ł—ā —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –ľ–ł–ļ—Ä–ĺ–Ľ–į–ļ—É–Ĺ–į—Ä–Ĺ—č—Ö –ł—ą–Ķ–ľ–ł—á–Ķ—Ā–ļ–ł—Ö –∑–ĺ–Ĺ, –ł—Ö –ĺ–Ī—ä–Ķ–ľ, –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–ĺ –ł –Ľ–ĺ–ļ–į–Ľ–ł–∑–į—Ü–ł—Ź –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź—é—ā —Ö–į—Ä–į–ļ—ā–Ķ—Ä –ł –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ –•–ė–ď–ú [3, 6].
–ö–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–į—Ź –ļ–į—Ä—ā–ł–Ĺ–į –ł –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–į –•–ė–ď–ú
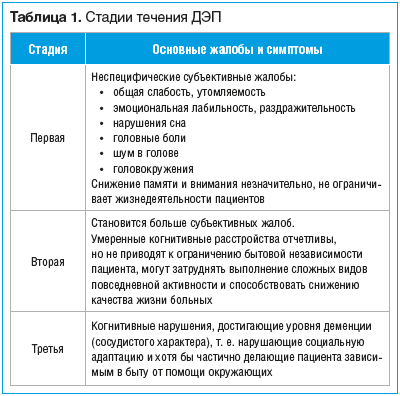
–ě—Ā–Ĺ–ĺ–≤–Ĺ—č–ľ–ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ–ł –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź–ľ–ł, —ā–į–ļ –Ĺ–į–∑—č–≤–į–Ķ–ľ—č–ľ ¬ę–ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ —Ź–ī—Ä–ĺ–ľ¬Ľ –•–ė–ď–ú (–Ē–≠–ü), —Ź–≤–Ľ—Ź—é—ā—Ā—Ź —Ā–ĺ—Ā—É–ī–ł—Ā—ā—č–Ķ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č–Ķ —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤–į, –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –ļ–ĺ—ā–ĺ—Ä—č—Ö –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –ļ–ĺ–Ľ–Ķ–Ī–Ľ–Ķ—ā—Ā—Ź –ĺ—ā –Ľ–Ķ–≥–ļ–ł—Ö –ł —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ—č—Ö –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ –Ĺ–į —Ä–į–Ĺ–Ĺ–ł—Ö —Ā—ā–į–ī–ł—Ź—Ö –ī–ĺ –≤–Ķ—Ā—Ć–ľ–į –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ—č—Ö –Ĺ–į –Ņ–ĺ–∑–ī–Ĺ–Ķ–Ļ —Ā—ā–į–ī–ł–ł (—ā–į–Ī–Ľ. 1). –Ē–Ľ—Ź –ĺ–Ī–ĺ–∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ –Ĺ–į —ć—ā–ĺ–Ļ —Ā—ā–į–ī–ł–ł –≤ –ĺ—ā–Ķ—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ļ –ł –∑–į—Ä—É–Ī–Ķ–∂–Ĺ–ĺ–Ļ –Ľ–ł—ā–Ķ—Ä–į—ā—É—Ä–Ķ –ł—Ā–Ņ–ĺ–Ľ—Ć–∑—É–Ķ—ā—Ā—Ź —ā–Ķ—Ä–ľ–ł–Ĺ ¬ę—Ā–ĺ—Ā—É–ī–ł—Ā—ā–į—Ź –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł—Ź¬Ľ [3, 5].
–Ę–į–ļ, —Ä–į–Ĺ–Ĺ–ł–Ķ —Ā—ā–į–ī–ł–ł –•–ė–ď–ú, —Ā–ĺ–Ņ—Ä–ĺ–≤–ĺ–∂–ī–į—é—Č–ł–Ķ—Ā—Ź –Ľ–Ķ–≥–ļ–ł–ľ–ł –ł–Ľ–ł —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ—č–ľ–ł –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č–ľ–ł –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź–ľ–ł –ł –Ĺ–Ķ –Ņ—Ä–ł–≤–ĺ–ī—Ź—Č–ł–Ķ –ļ —Ā–Ķ—Ä—Ć–Ķ–∑–Ĺ—č–ľ –ĺ–≥—Ä–į–Ĺ–ł—á–Ķ–Ĺ–ł—Ź–ľ —Ā–ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –ł –į–ī–į–Ņ—ā–į—Ü–ł–ł, –ļ–į–ļ –Ņ—Ä–į–≤–ł–Ľ–ĺ, —Ā–ĺ—á–Ķ—ā–į—é—ā—Ā—Ź —Ā–ĺ —Ā–Ľ–į–Ī–ĺ–≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ—č–ľ–ł –Ņ–į—ā–ĺ–ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–ľ–ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź–ľ–ł –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į, —á—ā–ĺ —Ā–Ķ—Ä—Ć–Ķ–∑–Ĺ–ĺ –ĺ–≥—Ä–į–Ĺ–ł—á–ł–≤–į–Ķ—ā –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā–ł —Ā–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č—Ö –ľ–Ķ—ā–ĺ–ī–ĺ–≤ –Ĺ–Ķ–Ļ—Ä–ĺ–≤–ł–∑—É–į–Ľ–ł–∑–į—Ü–ł–ł –ł –∑–į—ā—Ä—É–ī–Ĺ—Ź–Ķ—ā —Ä–į–Ĺ–Ĺ—é—é –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ—É –•–ė–ď–ú [5].
–Ě–į—Ä—É—ą–Ķ–Ĺ–ł—Ź –≤—č—Ā—ą–ł—Ö –ľ–ĺ–∑–≥–ĺ–≤—č—Ö —Ą—É–Ĺ–ļ—Ü–ł–Ļ –Ņ—Ä–ł –ź–ď —ā—Ä–į–ī–ł—Ü–ł–ĺ–Ĺ–Ĺ–ĺ –ĺ—ā–Ĺ–ĺ—Ā—Ź—ā –ļ —ā–į–ļ –Ĺ–į–∑—č–≤–į–Ķ–ľ–ĺ–ľ—É ¬ę–Ņ–ĺ–ī–ļ–ĺ—Ä–ļ–ĺ–≤–ĺ–ľ—ɬĽ —ā–ł–Ņ—É –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ. –≠—ā–ĺ—ā —ā–ł–Ņ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ –ĺ–Ņ–ł—Ā—č–≤–į–Ķ—ā —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ—č–Ļ –ļ–Ľ–ł–Ĺ–ł–ļ–ĺ-–Ĺ–Ķ–Ļ—Ä–ĺ–Ņ—Ā–ł—Ö–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ļ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ, –ļ–ĺ—ā–ĺ—Ä—č–Ļ —á–į—Ā—ā–ĺ –≤—Ā—ā—Ä–Ķ—á–į–Ķ—ā—Ā—Ź –Ņ—Ä–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź—Ö —Ā –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–ľ –Ņ–ĺ—Ä–į–∂–Ķ–Ĺ–ł–Ķ–ľ –Ņ–ĺ–ī–ļ–ĺ—Ä–ļ–ĺ–≤—č—Ö –Ī–į–∑–į–Ľ—Ć–Ĺ—č—Ö –≥–į–Ĺ–≥–Ľ–ł–Ķ–≤ –ł–Ľ–ł –Ī–Ķ–Ľ–ĺ–≥–ĺ –≤–Ķ—Č–Ķ—Ā—ā–≤–į –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į. –Ē–Ľ—Ź –Ĺ–Ķ–≥–ĺ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ—č —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł–Ķ —ā–Ķ–ľ–Ņ–į –Ņ–ĺ–∑–Ĺ–į–≤–į—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –ī–Ķ—Ź—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł (–Ī—Ä–į–ī–ł—Ą—Ä–Ķ–Ĺ–ł—Ź), –ļ–ĺ–Ľ–Ķ–Ī–į–Ĺ–ł—Ź –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł–ł –≤–Ĺ–ł–ľ–į–Ĺ–ł—Ź, –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ —É–Ņ—Ä–į–≤–Ľ—Ź—é—Č–ł—Ö —Ą—É–Ĺ–ļ—Ü–ł–Ļ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į, –ľ–Ĺ–Ķ—Ā—ā–ł—á–Ķ—Ā–ļ–ł–Ķ —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤–į –≤ –≤–ł–ī–Ķ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł –≤–ĺ—Ā–Ņ—Ä–ĺ–ł–∑–≤–Ķ–ī–Ķ–Ĺ–ł—Ź –ł –∑—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ-–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–Ķ –ī–ł—Ā–≥–Ĺ–ĺ–∑–ł—Ź –ł –ī–ł—Ā–Ņ—Ä–į–ļ—Ā–ł—Ź. –≠—ā–ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –Ņ—Ä–ĺ—Ź–≤–Ľ—Ź—é—ā—Ā—Ź –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ–ľ —Ä–ł—Ā–ĺ–≤–į–Ĺ–ł—Ź, —Ā—á–Ķ—ā–į –≤ —É–ľ–Ķ, –∑–į–ľ–Ķ–ī–Ľ–Ķ–Ĺ–ł–Ķ–ľ –ľ—č—ą–Ľ–Ķ–Ĺ–ł—Ź, –ļ–ĺ–Ľ–Ķ–Ī–į–Ĺ–ł—Ź–ľ–ł –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł–ł –≤–Ĺ–ł–ľ–į–Ĺ–ł—Ź –ł –Ņ–Ķ—Ä–Ķ–Ņ–į–ī–į–ľ–ł –Ĺ–į—Ā—ā—Ä–ĺ–Ķ–Ĺ–ł—Ź. –ü–ĺ—Ź–≤–Ľ—Ź—é—ā—Ā—Ź –ł–ľ–Ņ—É–Ľ—Ć—Ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć, —Ā–ļ–Ľ–ĺ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –ļ –ļ–ĺ–Ĺ—Ā–Ķ—Ä–≤–į—ā–ł–∑–ľ—É –ł —Ä–Ķ–∑–ĺ–Ĺ–Ķ—Ä—Ā—ā–≤—É. –í —ā–ĺ –∂–Ķ –≤—Ä–Ķ–ľ—Ź —É–ľ–Ķ–Ĺ—Ć—ą–į—é—ā—Ā—Ź –ł–Ĺ—ā–Ķ–Ľ–Ľ–Ķ–ļ—ā—É–į–Ľ—Ć–Ĺ–į—Ź –≥–ł–Ī–ļ–ĺ—Ā—ā—Ć –ł —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ—Ā—ā—Ć –į–ī–į–Ņ—ā–ł—Ä–ĺ–≤–į—ā—Ć—Ā—Ź –ļ –ľ–Ķ–Ĺ—Ź—é—Č–ł–ľ—Ā—Ź —É—Ā–Ľ–ĺ–≤–ł—Ź–ľ, —Ā–Ĺ–ł–∂–į–Ķ—ā—Ā—Ź –ļ—Ä–ł—ā–ł–ļ–į –ļ —Ā–ĺ–Ī—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–ľ –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź–ľ –ł —á—É–≤—Ā—ā–≤–ĺ –ī–ł—Ā—ā–į–Ĺ—Ü–ł–ł. –ü—Ä–ł —ć—ā–ĺ–ľ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź –Ņ–į–ľ—Ź—ā–ł –Ņ—Ä–ł —Ā–ĺ—Ā—É–ī–ł—Ā—ā—č—Ö –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤–į—Ö –≤—č—Ä–į–∂–Ķ–Ĺ—č –Ĺ–Ķ—Ä–Ķ–∑–ļ–ĺ, —Ā –Ņ—Ä–ł–ľ–Ķ—Ä–Ĺ–ĺ –ĺ–ī–ł–Ĺ–į–ļ–ĺ–≤—č–ľ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ–ľ –ļ—Ä–į—ā–ļ–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ –ł –ī–ĺ–Ľ–≥–ĺ—Ā—Ä–ĺ—á–Ĺ–ĺ–Ļ –Ņ–į–ľ—Ź—ā–ł. –° –Ņ–ĺ–ľ–ĺ—Č—Ć—é –Ņ–ĺ–ī—Ā–ļ–į–∑–ĺ–ļ –Ī–ĺ–Ľ—Ć–Ĺ—č–Ķ —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ—č –≤—Ā–Ņ–ĺ–ľ–ł–Ĺ–į—ā—Ć –∑–į–Ī—č—ā—É—é –ł–Ĺ—Ą–ĺ—Ä–ľ–į—Ü–ł—é [8].
–° —Ü–Ķ–Ľ—Ć—é –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź –ľ–ł–Ĺ–ł–ľ–į–Ľ—Ć–Ĺ—č—Ö –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź—é—ā –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—á–Ķ—Ā–ļ–ł–Ķ —ą–ļ–į–Ľ—č ‚ÄĒ –Ĺ–Ķ–Ļ—Ä–ĺ—ā–Ķ—Ā—ā—č, –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–ĺ –ł–∑ –ļ–ĺ—ā–ĺ—Ä—č—Ö –ł—Ā–Ņ–ĺ–Ľ—Ć–∑—É–Ķ—ā—Ā—Ź –≤ –Ņ–ĺ–≤—Ā–Ķ–ī–Ĺ–Ķ–≤–Ĺ–ĺ–Ļ –Ĺ–Ķ–≤—Ä–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ņ—Ä–į–ļ—ā–ł–ļ–Ķ, –Ĺ–ĺ –ł—Ö –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ķ –∑–į—ā—Ä—É–ī–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –≤ –Ķ–∂–Ķ–ī–Ĺ–Ķ–≤–Ĺ–ĺ–Ļ –Ņ—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ī–Ķ—Ź—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł –≤—Ä–į—á–į-—ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–į (–ú–ĺ–Ĺ—Ä–Ķ–į–Ľ—Ć—Ā–ļ–į—Ź —ą–ļ–į–Ľ–į –ĺ—Ü–Ķ–Ĺ–ļ–ł –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ą—É–Ĺ–ļ—Ü–ł–Ļ ‚ÄĒ Montreal Cognitive Assessment (MoCA), –ö—Ä–į—ā–ļ–į—Ź —ą–ļ–į–Ľ–į –ĺ—Ü–Ķ–Ĺ–ļ–ł –Ņ—Ā–ł—Ö–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ā—ā–į—ā—É—Ā–į ‚ÄĒ Mini-Mental State Examination (MMSE)), –®–ļ–į–Ľ–į –ĺ—Ü–Ķ–Ĺ–ļ–ł –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł –ź–Ľ—Ć—Ü–≥–Ķ–Ļ–ľ–Ķ—Ä–į ‚ÄĒ –ö–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ–į—Ź —Ā—É–Ī—ą–ļ–į–Ľ–į (ADAS-Cog)). –Ě–į–ł–Ī–ĺ–Ľ–Ķ–Ķ –Ņ—Ä–ĺ—Ā—ā—č–ľ –ł —É–ī–ĺ–Ī–Ĺ—č–ľ –ī–Ľ—Ź –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł—Ź –≤ —Ä—É—ā–ł–Ĺ–Ĺ–ĺ–Ļ –Ņ—Ä–į–ļ—ā–ł–ļ–Ķ –≤—Ä–į—á–į-—ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–į —ā–Ķ—Ā—ā–ĺ–ľ –ī–Ľ—Ź –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —ā–Ķ—Ā—ā ¬ęMini-Cog¬Ľ, –Ņ—Ä–Ķ–ī–Ľ–ĺ–∂–Ķ–Ĺ–Ĺ—č–Ļ S. Borson et al. –ü—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ —ā–Ķ—Ā—ā–į, –ļ–į–ļ –Ņ—Ä–į–≤–ł–Ľ–ĺ, –∑–į–Ĺ–ł–ľ–į–Ķ—ā –Ĺ–Ķ –Ī–ĺ–Ľ–Ķ–Ķ 3‚Äď5 –ľ–ł–Ĺ, –į –Ņ—Ä–ĺ—Ā—ā–ĺ—ā–į –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ł—Ź, –ł–Ĺ—Ą–ĺ—Ä–ľ–į—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ł —á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć (99%), –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź—é—Č–ł–Ķ –≤—č—Ź–≤–ł—ā—Ć –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł—é —Ä–į–∑–Ľ–ł—á–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–∂–ī–Ķ–Ĺ–ł—Ź –ł —Ä–į–∑–Ĺ–ĺ–Ļ —Ā—ā–Ķ–Ņ–Ķ–Ĺ–ł –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł, –ľ–ĺ–≥—É—ā –Ņ–ĺ–ľ–ĺ—á—Ć –Ņ—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ĺ–ľ—É –≤—Ä–į—á—É –≤ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–Ķ –•–ė–ď–ú [9].
–ú–Ķ—ā–ĺ–ī –≤–ļ–Ľ—é—á–į–Ķ—ā –≤ —Ā–Ķ–Ī—Ź –ĺ—Ü–Ķ–Ĺ–ļ—É –ļ—Ä–į—ā–ļ–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ –Ņ–į–ľ—Ź—ā–ł (–∑–į–Ņ–ĺ–ľ–ł–Ĺ–į–Ĺ–ł–Ķ –ł –≤–ĺ—Ā–Ņ—Ä–ĺ–ł–∑–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ 3-—Ö —Ā–Ľ–ĺ–≤) –ł –∑—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ-–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ļ –ļ–ĺ–ĺ—Ä–ī–ł–Ĺ–į—Ü–ł–ł (—ā–Ķ—Ā—ā ¬ę—Ä–ł—Ā–ĺ–≤–į–Ĺ–ł–Ķ —á–į—Ā–ĺ–≤¬Ľ).
–ü—Ä–į–≤–ł–Ľ–į —ā–Ķ—Ā—ā–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź:
–Ď–ĺ–Ľ—Ć–Ĺ–ĺ–ľ—É –Ĺ–į–∑—č–≤–į—é—ā –ł –Ņ—Ä–Ķ–ī–Ľ–į–≥–į—é—ā –∑–į–Ņ–ĺ–ľ–Ĺ–ł—ā—Ć 3 —Ā–Ľ–ĺ–≤–į: ¬ę–Ľ–ł–ľ–ĺ–ŬĽ, ¬ę–ļ–Ľ—é—ᬼ, ¬ę—ą–į—ĬĽ.
–ó–į—ā–Ķ–ľ –Ņ—Ä–ĺ—Ā—Ź—ā –Ĺ–į—Ä–ł—Ā–ĺ–≤–į—ā—Ć —Ü–ł—Ą–Ķ—Ä–Ī–Ľ–į—ā —á–į—Ā–ĺ–≤ –ł –ĺ—ā–ľ–Ķ—ā–ł—ā—Ć —Ā–į–ľ–ĺ—Ā—ā–ĺ—Ź—ā–Ķ–Ľ—Ć–Ĺ–ĺ –≤—Ä–Ķ–ľ—Ź: 8 —á 20 –ľ–ł–Ĺ.
–í –ļ–ĺ–Ĺ—Ü–Ķ —ā–Ķ—Ā—ā–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –Ņ—Ä–ĺ—Ā—Ź—ā –≤—Ā–Ņ–ĺ–ľ–Ĺ–ł—ā—Ć –ł –Ĺ–į–∑–≤–į—ā—Ć 3 —Ā–Ľ–ĺ–≤–į –ł–∑ –Ņ—É–Ĺ–ļ—ā–į 1.
–†–Ķ–∑—É–Ľ—Ć—ā–į—ā —ā–Ķ—Ā—ā–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź: –Ķ—Ā–Ľ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā –Ĺ–Ķ –Ĺ–į–∑–≤–į–Ľ
3 —Ā–Ľ–ĺ–≤–į –Ľ–ł–Ī–ĺ –Ĺ–į–∑–≤–į–Ľ —ā–ĺ–Ľ—Ć–ļ–ĺ 1‚Äď2 —Ā–Ľ–ĺ–≤–į, —ā–ĺ –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–į–≥–į—é—ā –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł—é. –ē—Ā–Ľ–ł –ī–ĺ–Ņ—É—Č–Ķ–Ĺ—č –ĺ—ą–ł–Ī–ļ–ł –≤ —ā–Ķ—Ā—ā–Ķ ¬ę—Ä–ł—Ā–ĺ–≤–į–Ĺ–ł–Ķ —á–į—Ā–ĺ–≤¬Ľ, —ā–ĺ –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–į–≥–į—é—ā –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł—é. –ē—Ā–Ľ–ł —á–į—Ā—č –ł —Ā—ā—Ä–Ķ–Ľ–ļ–ł –Ĺ–į—Ä–ł—Ā–ĺ–≤–į–Ĺ—č –Ņ—Ä–į–≤–ł–Ľ—Ć–Ĺ–ĺ, —ā–ĺ –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł–ł –Ĺ–Ķ—ā. –Ē–Ľ—Ź –Ī–ĺ–Ľ–Ķ–Ķ –ī–Ķ—ā–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź—é—ā –ī—Ä—É–≥–ł–Ķ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—á–Ķ—Ā–ļ–ł–Ķ —ā–Ķ—Ā—ā—č: MMSE, MoAC –ł ¬ę–Ď–į—ā–į—Ä–Ķ—é –Ľ–ĺ–Ī–Ĺ–ĺ–Ļ
–ī–ł—Ā—Ą—É–Ĺ–ļ—Ü–ł–ł¬Ľ.
–ü—Ä–ł –Ľ—é–Ī—č—Ö –ĺ—ą–ł–Ī–ļ–į—Ö –Ņ—Ä–ł –Ņ—Ä–ĺ—Ö–ĺ–∂–ī–Ķ–Ĺ–ł–ł —ā–Ķ—Ā—ā–į —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī—É–Ķ—ā—Ā—Ź –Ĺ–į–Ņ—Ä–į–≤–ł—ā—Ć –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –ļ –Ņ—Ä–ĺ—Ą–ł–Ľ—Ć–Ĺ–ĺ–ľ—É —Ā–Ņ–Ķ—Ü–ł–į–Ľ–ł—Ā—ā—É –ł–Ľ–ł –Ņ—Ä–ĺ–≤–Ķ—Ā—ā–ł –ī–Ķ—ā–į–Ľ—Ć–Ĺ–ĺ–Ķ —ā–Ķ—Ā—ā–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ —Ā –Ņ–ĺ–ľ–ĺ—Č—Ć—é –Ī–ĺ–Ľ–Ķ–Ķ —Ā–Ľ–ĺ–∂–Ĺ—č—Ö —ą–ļ–į–Ľ ‚ÄĒ MMSE, –ú–ĺ–°–ź –ł –ī—Ä. [10].
–Ě–Ķ–ī–ĺ—Ā—ā–į—ā–ļ–ĺ–ľ –ľ–Ķ—ā–ĺ–ī–į —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —ā–ĺ, —á—ā–ĺ –ĺ–Ĺ –≤—č—Ź–≤–Ľ—Ź–Ķ—ā —ā–ĺ–Ľ—Ć–ļ–ĺ –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł–ł –ł –ľ–į–Ľ–ĺ–Ņ—Ä–ł–≥–ĺ–ī–Ķ–Ĺ –ī–Ľ—Ź –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź –Ľ–Ķ–≥–ļ–ł—Ö –ł–Ľ–ł —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ—č—Ö —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤ –Ņ–į–ľ—Ź—ā–ł. –ü–ĺ—ć—ā–ĺ–ľ—É –Ņ—Ä–ł –Ī–Ķ—Ā–Ķ–ī–Ķ —Ā –Ī–ĺ–Ľ—Ć–Ĺ—č–ľ –≤–į–∂–Ĺ–ĺ –≤—č—Ź–≤–Ľ—Ź—ā—Ć —Ā–ł–ľ–Ņ—ā–ĺ–ľ—č –Ľ–Ķ–≥–ļ–ł—Ö –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤, –Ĺ–į–Ņ—Ä–ł–ľ–Ķ—Ä —Ā–Ľ–ĺ–∂–Ĺ–ĺ—Ā—ā–ł –Ņ—Ä–ł –∑–į–Ņ–ĺ–ľ–ł–Ĺ–į–Ĺ–ł–ł –Ĺ–ĺ–≤–ĺ–Ļ –ł–Ĺ—Ą–ĺ—Ä–ľ–į—Ü–ł–ł, –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł–ł –≤–Ĺ–ł–ľ–į–Ĺ–ł—Ź, –∑–į—ā—Ä—É–ī–Ĺ–Ķ–Ĺ–ł—Ź –Ņ—Ä–ł –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ł–ł —Ā–Ľ–ĺ–∂–Ĺ—č—Ö –∑–į–ī–į—á, –∑–į–Ī—č–≤—á–ł–≤–ĺ—Ā—ā—Ć. –≠–Ņ–ł–∑–ĺ–ī–ł—á–Ķ—Ā–ļ–ł–Ķ —ā—Ä—É–ī–Ĺ–ĺ—Ā—ā–ł –≤ –Ņ–ĺ–ī–Ī–ĺ—Ä–Ķ —Ā–Ľ–ĺ–≤ –Ņ—Ä–ł –Ī–Ķ—Ā–Ķ–ī–Ķ –Ņ—Ä–ĺ—Ź–≤–Ľ—Ź—é—ā—Ā—Ź –≤ –≤–ł–ī–Ķ —Ā–Ľ–ĺ–∂–Ĺ–ĺ—Ā—ā–Ķ–Ļ –≤ –Ņ–ĺ–ī–Ī–ĺ—Ä–Ķ –Ĺ—É–∂–Ĺ–ĺ–≥–ĺ —Ā–Ľ–ĺ–≤–į, –Ņ–ĺ–≤—ā–ĺ—Ä–Ķ —Ā–Ľ–ĺ–≤. –°–Ľ–ĺ–∂–Ĺ–ĺ—Ā—ā–ł –≤ –∑–į–Ņ–ĺ–ľ–ł–Ĺ–į–Ĺ–ł–ł –ł–ľ–Ķ–Ĺ –ł —Ą–į–ľ–ł–Ľ–ł–Ļ, –į —ā–į–ļ–∂–Ķ –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ —Ź—Ā–Ĺ–ĺ—Ā—ā–ł –ľ—č—ą–Ľ–Ķ–Ĺ–ł—Ź –ľ–ĺ–≥—É—ā –Ī—č—ā—Ć —Ā–ł–ľ–Ņ—ā–ĺ–ľ–į–ľ–ł –Ĺ–į—á–ł–Ĺ–į—é—Č–ł—Ö—Ā—Ź –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤ –Ĺ–į —Ą–ĺ–Ĺ–Ķ –•–ė–ď–ú.
–Ě–Ķ–Ļ—Ä–ĺ–≤–ł–∑—É–į–Ľ–ł–∑–į—Ü–ł—Ź (–Ņ—Ä–Ķ–ī–Ņ–ĺ—á—ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –ľ–į–≥–Ĺ–ł—ā–Ĺ–ĺ-—Ä–Ķ–∑–ĺ–Ĺ–į–Ĺ—Ā–Ĺ–į—Ź —ā–ĺ–ľ–ĺ–≥—Ä–į—Ą–ł—Ź) ‚ÄĒ –ĺ–Ī—Ź–∑–į—ā–Ķ–Ľ—Ć–Ĺ–į—Ź —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź—é—Č–į—Ź –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ, –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–į—Ź –ī–Ľ—Ź –≤–Ķ—Ä–ł—Ą–ł–ļ–į—Ü–ł–ł –ĺ—Ä–≥–į–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ–ĺ—Ä–į–∂–Ķ–Ĺ–ł—Ź –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į. –¶–Ķ–Ľ—Ć –Ĺ–Ķ–Ļ—Ä–ĺ–≤–ł–∑—É–į–Ľ–ł–∑–į—Ü–ł–ł ‚ÄĒ –≤—č—Ź–≤–ł—ā—Ć –į—ā—Ä–ĺ—Ą–ł—á–Ķ—Ā–ļ–ł–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –≤ –≥–ł–Ņ–Ņ–ĺ–ļ–į–ľ–Ņ–Ķ –ł –≤–ł—Ā–ĺ—á–Ĺ–ĺ–Ļ –ī–ĺ–Ľ–Ķ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į, –Ľ–į–ļ—É–Ĺ–į—Ä–Ĺ—č–Ķ –ł–Ĺ—Ą–į—Ä–ļ—ā—č, –Ņ–Ķ—Ä–ł–≤–Ķ–Ĺ—ā—Ä–ł–ļ—É–Ľ—Ź—Ä–Ĺ—č–Ļ –ł —Ā—É–Ī–ļ–ĺ—Ä—ā–ł–ļ–į–Ľ—Ć–Ĺ—č–Ļ –Ľ–Ķ–Ļ–ļ–ĺ–į—Ä–Ķ–ĺ–∑, –Ņ–ĺ—Ā—ā–ł–Ĺ—Ā—É–Ľ—Ć—ā–Ĺ—č–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź, –į —ā–į–ļ–∂–Ķ –ł—Ā–ļ–Ľ—é—á–ł—ā—Ć –Ņ–ĺ—ā–Ķ–Ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ –ĺ–Ī—Ä–į—ā–ł–ľ—č–Ķ –Ņ—Ä–ł—á–ł–Ĺ—č –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ–ĺ–≥–ĺ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź: –ĺ–Ņ—É—Ö–ĺ–Ľ–ł, —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ—É—é —Ā—É–Ī–ī—É—Ä–į–Ľ—Ć–Ĺ—É—é –≥–Ķ–ľ–į—ā–ĺ–ľ—É –ł —ā. –Ņ. [11].
–ě–Ī—Č–Ķ—ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ĺ–Ķ –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ –•–ė–ď–ú
–ě—Ā–Ĺ–ĺ–≤–Ĺ–ĺ–Ķ –ľ–Ķ—Ā—ā–ĺ –≤ –Ī–ĺ—Ä—Ć–Ī–Ķ —Ā –•–ė–ď–ú –∑–į–Ĺ–ł–ľ–į–Ķ—ā –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ –ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į ‚ÄĒ –ź–ď –ł –°–Ē. –ü—Ä–ł—á–Ķ–ľ –≤ –Ľ–Ķ—á–Ķ–Ĺ–ł–ł –ź–ď –≤–į–∂–Ĺ–ĺ –≤—č–Ī–ł—Ä–į—ā—Ć –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ, –Ņ—Ä–Ķ–ī–Ņ–ĺ—á—ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ 24-—á–į—Ā–ĺ–≤–ĺ–≥–ĺ –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź, —ā. –ļ. –Ņ—Ä–ł –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–ł —ā–į–ļ–ł—Ö –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö —Ā—Ä–Ķ–ī—Ā—ā–≤ —Ä–Ķ–∂–Ķ –≤—Ā—ā—Ä–Ķ—á–į–Ķ—ā—Ā—Ź –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–Ĺ–į—Ź –≤–į—Ä–ł–į–Ī–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –ī–į–≤–Ľ–Ķ–Ĺ–ł—Ź, –ļ–ĺ—ā–ĺ—Ä–į—Ź —Ā–≤—Ź–∑–į–Ĺ–į —Ā —É—Ā–ļ–ĺ—Ä–Ķ–Ĺ–Ĺ—č–ľ–ł —ā–Ķ–ľ–Ņ–į–ľ–ł –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ. –Ě–Ķ –ľ–Ķ–Ĺ–Ķ–Ķ –≤–į–∂–Ĺ–ĺ –ł–∑–Ī–Ķ–≥–į—ā—Ć —Ź—ā—Ä–ĺ–≥–Ķ–Ĺ–Ĺ–ĺ–Ļ –≥–ł–Ņ–ĺ—ā–Ķ–Ĺ–∑–ł–ł, –ļ–ĺ—ā–ĺ—Ä–į—Ź –Ĺ–Ķ—Ä–Ķ–ī–ļ–ĺ –≤–ĺ–∑–Ĺ–ł–ļ–į–Ķ—ā —É –Ņ–ĺ–∂–ł–Ľ—č—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ĺ–į —Ą–ĺ–Ĺ–Ķ —Ä–Ķ–∑–ļ–ĺ–≥–ĺ –Ĺ–į—á–į–Ľ–į –Ņ—Ä–ł–Ķ–ľ–į –≥–ł–Ņ–ĺ—ā–Ķ–Ĺ–∑–ł–≤–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤ —Ā—Ä–Ķ–ī–Ĺ–ł—Ö –ł –≤—č—Ā–ĺ–ļ–ł—Ö —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ī–ĺ–∑–į—Ö. –≠—ā–ĺ–≥–ĺ —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł—Ź –ľ–ĺ–∂–Ĺ–ĺ –ł–∑–Ī–Ķ–∂–į—ā—Ć –Ņ—Ä–ł –Ņ–ĺ—Ā—ā–Ķ–Ņ–Ķ–Ĺ–Ĺ–ĺ–ľ –Ņ–ĺ–ī–Ī–ĺ—Ä–Ķ –≥–ł–Ņ–ĺ—ā–Ķ–Ĺ–∑–ł–≤–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤, —ā–ł—ā—Ä—É—Ź –ī–ĺ–∑—É –ĺ—ā –ľ–ł–Ĺ–ł–ľ–į–Ľ—Ć–Ĺ–ĺ–Ļ –ī–ĺ –ĺ–Ņ—ā–ł–ľ–į–Ľ—Ć–Ĺ–ĺ–Ļ. –ü—Ä–ł —ć—ā–ĺ–ľ —Ā–Ľ–Ķ–ī—É–Ķ—ā —Ā—ā—Ä–Ķ–ľ–ł—ā—Ć—Ā—Ź –ļ –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—é —Ü–Ķ–Ľ–Ķ–≤—č—Ö –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ –į—Ä—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ī–į–≤–Ľ–Ķ–Ĺ–ł—Ź (–ź–Ē) ‚ÄĒ –ľ–Ķ–Ĺ–Ķ–Ķ 140/90 –ľ–ľ —Ä—ā. —Ā—ā., –Ĺ–Ķ–∑–į–≤–ł—Ā–ł–ľ–ĺ –ĺ—ā –≤–ĺ–∑—Ä–į—Ā—ā–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į. –ė—Ā–ļ–Ľ—é—á–Ķ–Ĺ–ł–Ķ –ł–∑ —ć—ā–ĺ–≥–ĺ –Ņ—Ä–į–≤–ł–Ľ–į —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź—é—ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č —Ā –≥–Ķ–ľ–ĺ–ī–ł–Ĺ–į–ľ–ł—á–Ķ—Ā–ļ–ł –∑–Ĺ–į—á–ł–ľ—č–ľ —Ā—ā–Ķ–Ĺ–ĺ–∑–ĺ–ľ —Ü–Ķ—Ä–Ķ–Ī—Ä–į–Ľ—Ć–Ĺ—č—Ö –į—Ä—ā–Ķ—Ä–ł–Ļ, —É –ļ–ĺ—ā–ĺ—Ä—č—Ö –Ņ–ĺ–Ľ–Ĺ–į—Ź –Ĺ–ĺ—Ä–ľ–į–Ľ–ł–∑–į—Ü–ł—Ź –ź–Ē –ľ–ĺ–∂–Ķ—ā —É–≤–Ķ–Ľ–ł—á–ł–≤–į—ā—Ć —Ä–ł—Ā–ļ –ł—ą–Ķ–ľ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ł–Ĺ—Ā—É–Ľ—Ć—ā–į –≤ –Ī–į—Ā—Ā–Ķ–Ļ–Ĺ–Ķ —Ā—ā–Ķ–Ĺ–ĺ–∑–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–≥–ĺ —Ā–ĺ—Ā—É–ī–į. –°–Ľ–Ķ–ī—É–Ķ—ā –ĺ—ā–ľ–Ķ—ā–ł—ā—Ć, —á—ā–ĺ —ā–Ķ–ľ–Ņ—č –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—Ź —Ü–Ķ–Ľ–Ķ–≤—č—Ö –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ –ź–Ē —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č–ľ–ł –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź–ľ–ł –ī–ĺ–Ľ–∂–Ĺ—č –Ī—č—ā—Ć –ł–Ĺ–ī–ł–≤–ł–ī—É–į–Ľ—Ć–Ĺ—č–ľ–ł. –Ē–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–į—Ź –ź–ď –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—é –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ–ĺ–Ļ —Ä–Ķ–į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł —Ü–Ķ—Ä–Ķ–Ī—Ä–į–Ľ—Ć–Ĺ—č—Ö —Ā–ĺ—Ā—É–ī–ĺ–≤. –í –Ĺ–ĺ—Ä–ľ–Ķ –Ņ–ĺ–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –ź–Ē –≤–Ķ–ī–Ķ—ā –ļ –ļ–ĺ–ľ–Ņ–Ķ–Ĺ—Ā–į—ā–ĺ—Ä–Ĺ–ĺ–ľ—É —Ä–į—Ā—ą–ł—Ä–Ķ–Ĺ–ł—é —Ü–Ķ—Ä–Ķ–Ī—Ä–į–Ľ—Ć–Ĺ—č—Ö —Ā–ĺ—Ā—É–ī–ĺ–≤, —á—ā–ĺ –Ņ–ĺ–ī–ī–Ķ—Ä–∂–ł–≤–į–Ķ—ā –Ņ–ĺ—Ā—ā–ĺ—Ź–Ĺ—Ā—ā–≤–ĺ –ľ–ĺ–∑–≥–ĺ–≤–ĺ–≥–ĺ –ļ—Ä–ĺ–≤–ĺ—ā–ĺ–ļ–į. –°—Ä—č–≤ —É–ļ–į–∑–į–Ĺ–Ĺ–ĺ–≥–ĺ –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ–į –į—É—ā–ĺ—Ä–Ķ–≥—É–Ľ—Ź—Ü–ł–ł —Ü–Ķ—Ä–Ķ–Ī—Ä–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ļ—Ä–ĺ–≤–ĺ–ĺ–Ī—Ä–į—Č–Ķ–Ĺ–ł—Ź –ľ–ĺ–∂–Ķ—ā –≤—č–∑—č–≤–į—ā—Ć –ĺ–Ī—Č—É—é —Ā–Ľ–į–Ī–ĺ—Ā—ā—Ć, –≥–ĺ–Ľ–ĺ–≤–Ĺ—č–Ķ –Ī–ĺ–Ľ–ł, –ĺ–Ī–ľ–ĺ—Ä–ĺ—á–Ĺ—č–Ķ —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł—Ź –ł –ĺ–Ī–ľ–ĺ—Ä–ĺ–ļ–ł –Ņ—Ä–ł –Ī—č—Ā—ā—Ä–ĺ–Ļ –Ĺ–ĺ—Ä–ľ–į–Ľ–ł–∑–į—Ü–ł–ł –ź–Ē. –ü—Ä–ł –Ņ–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–ł —É–ļ–į–∑–į–Ĺ–Ĺ—č—Ö —Ā–ł–ľ–Ņ—ā–ĺ–ľ–ĺ–≤ –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ –∑–į–ľ–Ķ–ī–Ľ–ł—ā—Ć —ā–Ķ–ľ–Ņ—č –Ĺ–į—Ä–į—Č–ł–≤–į–Ĺ–ł—Ź –į–Ĺ—ā–ł–≥–ł–Ņ–Ķ—Ä—ā–Ķ–Ĺ–∑–ł–≤–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –≤–Ņ–Ľ–ĺ—ā—Ć –ī–ĺ –≤–ĺ—Ā—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–ł—Ź –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ —Ā–į–ľ–ĺ—á—É–≤—Ā—ā–≤–ł—Ź. –£–Ĺ–ł–≤–Ķ—Ä—Ā–į–Ľ—Ć–Ĺ—č—Ö —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł–Ļ –Ņ–ĺ —ā–Ķ–ľ–Ņ–į–ľ –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—Ź —Ü–Ķ–Ľ–Ķ–≤—č—Ö –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ –ź–Ē –Ĺ–Ķ —Ā—É—Č–Ķ—Ā—ā–≤—É–Ķ—ā, –≤ –∑–į–≤–ł—Ā–ł–ľ–ĺ—Ā—ā–ł –ĺ—ā –ł–Ĺ–ī–ł–≤–ł–ī—É–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ņ–Ķ—Ä–Ķ–Ĺ–ĺ—Ā–ł–ľ–ĺ—Ā—ā–ł —ć—ā–ĺ—ā –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā –ľ–ĺ–∂–Ķ—ā –ī–Ľ–ł—ā—Ć—Ā—Ź –ĺ—ā –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ł—Ö –Ĺ–Ķ–ī–Ķ–Ľ—Ć –ī–ĺ –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ł—Ö –ľ–Ķ—Ā—Ź—Ü–Ķ–≤ [8].–Ě–Ķ –ľ–Ķ–Ĺ–Ķ–Ķ –≤–į–∂–Ĺ–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ –°–Ē —Ā –Ņ–ĺ–ī–ī–Ķ—Ä–∂–į–Ĺ–ł–Ķ–ľ —É—Ä–ĺ–≤–Ĺ—Ź –≥–Ľ–ł–ļ–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–≥–ĺ –≥–Ķ–ľ–ĺ–≥–Ľ–ĺ–Ī–ł–Ĺ–į (HbA1c) –Ĺ–į —É—Ä–ĺ–≤–Ĺ–Ķ —Ü–Ķ–Ľ–Ķ–≤—č—Ö —Ü–ł—Ą—Ä, —É—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ—č—Ö —ć–Ĺ–ī–ĺ–ļ—Ä–ł–Ĺ–ĺ–Ľ–ĺ–≥–ĺ–ľ. –°–Ē 2-–≥–ĺ —ā–ł–Ņ–į —Ä–į—Ā—Ā–ľ–į—ā—Ä–ł–≤–į–Ķ—ā—Ā—Ź –≤ –ļ–į—á–Ķ—Ā—ā–≤–Ķ –≤–į–∂–Ĺ–Ķ–Ļ—ą–Ķ–Ļ –Ĺ–ĺ–∑–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ņ—Ä–ł—á–ł–Ĺ—č –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ–ĺ–≥–ĺ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź. –†—Ź–ī –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ —É—Ā—ā–į–Ĺ–ĺ–≤–ł–Ľ, —á—ā–ĺ –≥–ł–Ņ–Ķ—Ä–≥–Ľ–ł–ļ–Ķ–ľ–ł—Ź, –ł–Ĺ—Ā—É–Ľ–ł–Ĺ–ĺ—Ä–Ķ–∑–ł—Ā—ā–Ķ–Ĺ—ā–Ĺ–ĺ—Ā—ā—Ć –ł –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –°–Ē –į—Ā—Ā–ĺ—Ü–ł–ł—Ä–ĺ–≤–į–Ĺ—č —Ā –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č–ľ —É—Ö—É–ī—ą–Ķ–Ĺ–ł–Ķ–ľ –ł –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł–Ķ–Ļ. –í —Ā–≤–ĺ—é –ĺ—á–Ķ—Ä–Ķ–ī—Ć, –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ–ĺ–Ķ —É—Ö—É–ī—ą–Ķ–Ĺ–ł–Ķ –Ĺ–Ķ–≥–į—ā–ł–≤–Ĺ–ĺ –≤–Ľ–ł—Ź–Ķ—ā –Ĺ–į —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –°–Ē –ł –Ķ–≥–ĺ –ĺ—Ā–Ľ–ĺ–∂–Ĺ–Ķ–Ĺ–ł–Ļ, –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –∑–į—ā—Ä—É–ī–Ĺ—Ź—Ź –ĺ–Ī—É—á–Ķ–Ĺ–ł–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ņ—Ä–ł–Ķ–ľ–į–ľ –ł –ľ–Ķ—ā–ĺ–ī–į–ľ —Ā–į–ľ–ĺ–ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź, –į —ā–į–ļ–∂–Ķ —Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł—Ź–ľ –≤—Ä–į—á–į [12].
–° –ī—Ä—É–≥–ĺ–Ļ —Ā—ā–ĺ—Ä–ĺ–Ĺ—č, –ł–∑–≤–Ķ—Ā—ā–Ĺ–į —Ā–≤—Ź–∑—Ć –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ –ł –Ņ–ĺ–≤—ā–ĺ—Ä—Ź—é—Č–ł—Ö—Ā—Ź –≥–ł–Ņ–ĺ–≥–Ľ–ł–ļ–Ķ–ľ–ł—á–Ķ—Ā–ļ–ł—Ö —ć–Ņ–ł–∑–ĺ–ī–ĺ–≤. –ü—Ä–ł—á–ł–Ĺ–į –≥–ł–Ņ–ĺ–≥–Ľ–ł–ļ–Ķ–ľ–ł–ł ‚ÄĒ –Ĺ–Ķ–Ņ—Ä–į–≤–ł–Ľ—Ć–Ĺ–į—Ź –ī–ĺ–∑–ł—Ä–ĺ–≤–ļ–į —Ā–į—Ö–į—Ä–ĺ—Ā–Ĺ–ł–∂–į—é—Č–ł—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –ł–Ľ–ł –ł–Ĺ—Ā—É–Ľ–ł–Ĺ–į. –ď–ł–Ņ–ĺ–≥–Ľ–ł–ļ–Ķ–ľ–ł–ł –ľ–ĺ–≥—É—ā –Ņ—Ä–ł–≤–ĺ–ī–ł—ā—Ć –ļ –Ĺ–Ķ–Ļ—Ä–ĺ–≥–Ľ–ł–ļ–ĺ–Ņ–Ķ–Ĺ–ł–ł –ł –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź–ľ —Ą—É–Ĺ–ļ—Ü–ł–ł –ľ–ĺ–∑–≥–į, –Ĺ–Ķ–Ļ—Ä–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–ľ—É –Ĺ–Ķ–ļ—Ä–ĺ–∑—É, –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ –≤ –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ —É—Ź–∑–≤–ł–ľ—č—Ö –∑–ĺ–Ĺ–į—Ö –ľ–ĺ–∑–≥–į, —ā–į–ļ–ł—Ö –ļ–į–ļ –ļ–ĺ—Ä–į, –≥–ł–Ņ–Ņ–ĺ–ļ–į–ľ–Ņ, –ļ —Ä–į–∑–≤–ł—ā–ł—é –ł—ą–Ķ–ľ–ł–ł –ł –ī—Ä—É–≥–ł–ľ –Ņ–ĺ–≤—Ä–Ķ–∂–ī–Ķ–Ĺ–ł—Ź–ľ. –Ě–į–Ľ–ł—á–ł–Ķ —ć–Ņ–ł–∑–ĺ–ī–ĺ–≤ —ā—Ź–∂–Ķ–Ľ–ĺ–Ļ –≥–ł–Ņ–ĺ–≥–Ľ–ł–ļ–Ķ–ľ–ł–ł, –Ņ–ĺ—ā—Ä–Ķ–Ī–ĺ–≤–į–≤—ą–ł—Ö –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł–ł –ł–Ľ–ł –ĺ–Ī—Ä–į—Č–Ķ–Ĺ–ł—Ź –∑–į –Ĺ–Ķ–ĺ—ā–Ľ–ĺ–∂–Ĺ–ĺ–Ļ –Ņ–ĺ–ľ–ĺ—Č—Ć—é, —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –Ņ–ĺ–≤—č—ą–į–Ķ—ā —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł–ł [6]. –Ē–ĺ–ļ–į–∑–į–Ĺ–ĺ, —á—ā–ĺ –Ĺ–Ķ–≥–į—ā–ł–≤–Ĺ–ĺ–Ķ –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –≥–ł–Ņ–ĺ–≥–Ľ–ł–ļ–Ķ–ľ–ł–ł –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –Ņ—Ä–ĺ—Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —É –Ņ–ĺ–∂–ł–Ľ—č—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –ł–ľ–Ķ—é—Č–ł—Ö –Ī–ĺ–Ľ–Ķ–Ķ –Ĺ–ł–∑–ļ–ł–Ļ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č–Ļ —Ä–Ķ–∑–Ķ—Ä–≤ –ł –Ĺ–Ķ —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ—č—Ö –Ĺ–ł–≤–Ķ–Ľ–ł—Ä–ĺ–≤–į—ā—Ć –Ņ–ĺ—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł—Ź –Ņ–ĺ–≤—Ä–Ķ–∂–ī–Ķ–Ĺ–ł—Ź [6].
–ü–ĺ—ć—ā–ĺ–ľ—É —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –°–Ē –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ –Ĺ–Ķ —ā–ĺ–Ľ—Ć–ļ–ĺ –Ņ—Ä–ĺ–≤–ĺ–ī–ł—ā—Ć –≥–ł–Ņ–ĺ–≥–Ľ–ł–ļ–Ķ–ľ–ł—á–Ķ—Ā–ļ—É—é —ā–Ķ—Ä–į–Ņ–ł—é –ł –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ–ł—Ä–ĺ–≤–į—ā—Ć —É—Ä–ĺ–≤–Ķ–Ĺ—Ć HbA1c, –Ĺ–ĺ –ł –Ņ—Ä–ĺ–≤–ĺ–ī–ł—ā—Ć –ĺ–Ņ—Ä–ĺ—Ā —Ā —Ü–Ķ–Ľ—Ć—é –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź –Ņ—Ä–Ķ—Ö–ĺ–ī—Ź—Č–ł—Ö —Ā–ł–ľ–Ņ—ā–ĺ–ľ–ĺ–≤ –≥–ł–Ņ–ĺ–≥–Ľ–ł–ļ–Ķ–ľ–ł–ł. –°–ł–ľ–Ņ—ā–ĺ–ľ—č –≥–ł–Ņ–ĺ–≥–Ľ–ł–ļ–Ķ–ľ–ł–ł: –≤–Ĺ–Ķ–∑–į–Ņ–Ĺ–ĺ –Ĺ–į—Ā—ā—É–Ņ–ł–≤—ą–į—Ź —Ā–Ľ–į–Ī–ĺ—Ā—ā—Ć, ¬ę–≤–į—ā–Ĺ—č–Ķ –Ĺ–ĺ–≥–ł¬Ľ, –ī—Ä–ĺ–∂—Ć –ł –Ņ–ĺ—ā–Ľ–ł–≤–ĺ—Ā—ā—Ć, –Ī–Ľ–Ķ–ī–Ĺ–ĺ—Ā—ā—Ć, –≥–ĺ–Ľ–ĺ–≤–ĺ–ļ—Ä—É–∂–Ķ–Ĺ–ł–Ķ, –≥–ĺ–Ľ–ĺ–≤–Ĺ–į—Ź –Ī–ĺ–Ľ—Ć, –Ĺ–Ķ—á–Ķ—ā–ļ–ĺ—Ā—ā—Ć –∑—Ä–Ķ–Ĺ–ł—Ź, —Ä–į–∑–ī—Ä–į–∂–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć, –Ī–Ķ—Ā–Ņ–ĺ–ļ–ĺ–Ļ—Ā—ā–≤–ĺ, –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł–ł –≤–Ĺ–ł–ľ–į–Ĺ–ł—Ź, —É—á–į—Č–Ķ–Ĺ–Ĺ–ĺ–Ķ —Ā–Ķ—Ä–ī—Ü–Ķ–Ī–ł–Ķ–Ĺ–ł–Ķ, –ľ—É—Ä–į—ą–ļ–ł –Ņ–ĺ —ā–Ķ–Ľ—É, –ĺ—Ā—ā—Ä–ĺ–Ķ —á—É–≤—Ā—ā–≤–ĺ –≥–ĺ–Ľ–ĺ–ī–į.
–ü–ĺ–ľ–ł–ľ–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –ź–ď –ł –°–Ē –≤–į–∂–Ĺ—č –ĺ—ā–ļ–į–∑ –ĺ—ā –ļ—É—Ä–Ķ–Ĺ–ł—Ź, –∑–Ľ–ĺ—É–Ņ–ĺ—ā—Ä–Ķ–Ī–Ľ–Ķ–Ĺ–ł—Ź –į–Ľ–ļ–ĺ–≥–ĺ–Ľ–Ķ–ľ, —Ä–į—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ķ –Ņ–ł—ā–į–Ĺ–ł–Ķ –ł –į–ļ—ā–ł–≤–Ĺ—č–Ļ –ĺ–Ī—Ä–į–∑ –∂–ł–∑–Ĺ–ł, –ļ–ĺ—ā–ĺ—Ä—č–Ļ –Ĺ–į–Ņ—Ä—Ź–ľ—É—é —Ā–≤—Ź–∑–į–Ĺ —Ā –Ĺ–Ķ–ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ—č–ľ –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ–ľ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ –Ņ—Ä–ł –Ē–≠–ü.
–Ě–Ķ–ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ–ĺ–Ķ –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ
–Ě–Ķ–ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ—č–Ķ –ľ–Ķ—ā–ĺ–ī—č –ł–ľ–Ķ—é—ā –Ī–ĺ–Ľ—Ć—ą–ĺ–Ķ –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –≤ –Ī–ĺ—Ä—Ć–Ī–Ķ —Ā –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č–ľ–ł –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź–ľ–ł. –Ę–į–ļ–ł–Ķ –ľ–Ķ—ā–ĺ–ī—č –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ —Ā–ĺ—á–Ķ—ā–į—ā—Ć —Ā –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ—č–ľ –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ–ľ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤ –ī–Ľ—Ź –ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ–ĺ–Ļ —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł —ā–Ķ—Ä–į–Ņ–ł–ł.–§–ł–∑–ł—á–Ķ—Ā–ļ–į—Ź –Ĺ–į–≥—Ä—É–∑–ļ–į —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ–ĺ–Ļ –ł–Ĺ—ā–Ķ–Ĺ—Ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –ł –ł–Ĺ—ā–Ķ–Ľ–Ľ–Ķ–ļ—ā—É–į–Ľ—Ć–Ĺ—č–Ķ –Ĺ–į–≥—Ä—É–∑–ļ–ł, —ā–į–ļ –∂–Ķ –ļ–į–ļ –ł —Ā–ĺ—Ü–ł–į–Ľ—Ć–Ĺ–į—Ź –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć, —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É—é—ā —Ā–ĺ—Ö—Ä–į–Ĺ–Ķ–Ĺ–ł—é –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ą—É–Ĺ–ļ—Ü–ł–Ļ. –í —Ä–į–Ī–ĺ—ā–Ķ J. Siette et al. (2013) [13] –Ī—č–Ľ–ĺ –Ņ–ĺ–ļ–į–∑–į–Ĺ–ĺ, —á—ā–ĺ —Ą–ł–∑–ł—á–Ķ—Ā–ļ–ł–Ķ –Ĺ–į–≥—Ä—É–∑–ļ–ł –∑–į–ľ–Ķ–ī–Ľ—Ź–Ľ–ł —Ā—ā–į—Ä–Ķ–Ĺ–ł–Ķ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į –ļ—Ä—č—Ā. –£ –∂–ł–≤–ĺ—ā–Ĺ—č—Ö –≤–ĺ—Ā—Ā—ā–į–Ĺ–į–≤–Ľ–ł–≤–į–Ľ–ł—Ā—Ć –Ĺ–Ķ–Ļ—Ä–ĺ–Ĺ–į–Ľ—Ć–Ĺ—č–Ķ —Ā–≤—Ź–∑–ł –≥–ł–Ņ–Ņ–ĺ–ļ–į–ľ–Ņ–į, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –ī–ĺ —ć—ā–ĺ–≥–ĺ –ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–ł—Ä–ĺ–≤–į–Ľ–ł –ĺ—ā –ľ–į–Ľ–ĺ–Ņ–ĺ–ī–≤–ł–∂–Ĺ–ĺ–≥–ĺ –ĺ–Ī—Ä–į–∑–į –∂–ł–∑–Ĺ–ł –≤ –Ņ–Ķ—Ä–ł–ĺ–ī —Ā—ā–į—Ä–Ķ–Ĺ–ł—Ź. –£ —á–Ķ–Ľ–ĺ–≤–Ķ–ļ–į —Ą–ł–∑–ł—á–Ķ—Ā–ļ–į—Ź –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć —ā–į–ļ–∂–Ķ —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–į –∑–į–ľ–Ķ–ī–Ľ—Ź—ā—Ć —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ą—É–Ĺ–ļ—Ü–ł–Ļ, –≤ —ā. —á. –Ņ—Ä–ł –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł –ź–Ľ—Ć—Ü–≥–Ķ–Ļ–ľ–Ķ—Ä–į [14]. –ė–Ĺ—ā–Ķ–Ľ–Ľ–Ķ–ļ—ā—É–į–Ľ—Ć–Ĺ—č–Ķ –Ĺ–į–≥—Ä—É–∑–ļ–ł —ā–į–ļ–∂–Ķ —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ—č –∑–į–ľ–Ķ–ī–Ľ—Ź—ā—Ć —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ą—É–Ĺ–ļ—Ü–ł–Ļ. –í –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł J. Varghese et al. (2006) [15] –Ī—č–Ľ–ĺ –Ņ–ĺ–ļ–į–∑–į–Ĺ–ĺ, —á—ā–ĺ —É –Ľ—é–ī–Ķ–Ļ —Ā—ā–į—Ä—ą–Ķ 75 –Ľ–Ķ—ā –Ĺ–į–Ľ–ł—á–ł–Ķ —Ö–ĺ–Ī–Ī–ł –ł —É–≤–Ľ–Ķ—á–Ķ–Ĺ–ł–Ļ –Ĺ–į 1/3 —É–ľ–Ķ–Ĺ—Ć—ą–į–Ľ–ĺ —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź –į–Ĺ–į–ľ–Ĺ–Ķ—Ā—ā–ł—á–Ķ—Ā–ļ–ł—Ö —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤ –Ĺ–į —Ą–ĺ–Ĺ–Ķ —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ–ĺ–≥–ĺ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź.
–í —Ä—Ź–ī–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ –Ņ—Ä–ĺ–ī–Ķ–ľ–ĺ–Ĺ—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ĺ—č –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –Ĺ–Ķ–Ļ—Ä–ĺ—Ą–ł–∑–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ–į—Ä–į–ľ–Ķ—ā—Ä–ĺ–≤ –Ņ—Ä–ł –ī–ĺ–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ł–ł –ĺ–Ī—č—á–Ĺ–ĺ–Ļ —Ą–ł–∑–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ĺ–į–≥—Ä—É–∑–ļ–ł –ļ–į–ļ–ł–ľ-–Ľ–ł–Ī–ĺ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č–ľ –∑–į–ī–į–Ĺ–ł–Ķ–ľ [16], –Ņ–ĺ—ć—ā–ĺ–ľ—É –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ –Ņ–ĺ–Ľ–Ķ–∑–Ĺ—č –Ņ—Ä–ĺ–≥—É–Ľ–ļ–ł –Ņ–ĺ –Ĺ–ĺ–≤—č–ľ –ľ–į—Ä—ą—Ä—É—ā–į–ľ, –Ņ—Ä–ĺ–≥—É–Ľ–ļ–ł —Ā —Ā–ĺ–Ī–Ķ—Ā–Ķ–ī–Ĺ–ł–ļ–ĺ–ľ –ł–Ľ–ł –Ņ—Ä–ĺ–≥—É–Ľ–ļ–ł —Ā –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ł–Ķ–ľ –ļ–į–ļ–ĺ–≥–ĺ-–Ľ–ł–Ī–ĺ —É–ľ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –∑–į–ī–į–Ĺ–ł—Ź.
–ö–ĺ—Ä—Ä–Ķ–ļ—Ü–ł—Ź –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź —Ā–Ľ—É—Ö–į –ł –∑—Ä–Ķ–Ĺ–ł—Ź —ā–į–ļ–∂–Ķ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –≤–į–∂–Ĺ—č–ľ –Ņ–ĺ–ī—Ā–Ņ–ĺ—Ä—Ć–Ķ–ľ –≤ –Ī–ĺ—Ä—Ć–Ī–Ķ —Ā –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ–ľ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤, —ā. –ļ. —Ā–Ķ–Ĺ—Ā–ĺ—Ä–Ĺ–į—Ź –ī–Ķ–Ņ—Ä–ł–≤–į—Ü–ł—Ź —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É–Ķ—ā —É—Ā–ł–Ľ–Ķ–Ĺ–ł—é –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ–ĺ–≥–ĺ –ī–Ķ—Ą–ł—Ü–ł—ā–į –≤–Ņ–Ľ–ĺ—ā—Ć –ī–ĺ —Ä–į–∑–≤–ł—ā–ł—Ź –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł–ł. –ü–ĺ—ć—ā–ĺ–ľ—É —Ā–≤–ĺ–Ķ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–į—Ź –ļ–ĺ–Ĺ—Ā—É–Ľ—Ć—ā–į—Ü–ł—Ź —Ā—É—Ä–ī–ĺ–Ľ–ĺ–≥–į —Ā –Ņ–ĺ–ī–Ī–ĺ—Ä–ĺ–ľ —Ā–Ľ—É—Ö–ĺ–≤–ĺ–≥–ĺ –į–Ņ–Ņ–į—Ä–į—ā–į –ł –ĺ—Ą—ā–į–Ľ—Ć–ľ–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ķ –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ –ľ–ĺ–≥—É—ā –Ņ–ĺ–Ľ–ĺ–∂–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —Ā–ļ–į–∑–į—ā—Ć—Ā—Ź –Ĺ–į –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ–ĺ–Ļ —Ą—É–Ĺ–ļ—Ü–ł–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į [17].
–ü—Ä–ĺ—Ā—ā—č–Ķ —É–Ņ—Ä–į–∂–Ĺ–Ķ–Ĺ–ł—Ź –ī–Ľ—Ź –Ņ–ĺ–ī–ī–Ķ—Ä–∂–į–Ĺ–ł—Ź –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ą—É–Ĺ–ļ—Ü–ł–Ļ –ľ–ĺ–≥—É—ā –Ī—č—ā—Ć —Ā–Ľ–Ķ–ī—É—é—Č–ł–ľ–ł: –Ĺ–į—Ā—ā–ĺ–Ľ—Ć–Ĺ—č–Ķ –ł–≥—Ä—č, —Ā–ľ–Ķ–Ĺ–į —Ä—É–ļ–ł –Ņ—Ä–ł —á–ł—Ā—ā–ļ–Ķ –∑—É–Ī–ĺ–≤, —á—ā–Ķ–Ĺ–ł–Ķ –≤—Ā–Ľ—É—Ö, –į—É–ī–ł–ĺ–ļ–Ĺ–ł–≥–ł, –Ĺ–ĺ–≤–į—Ź –ĺ–Ī—Ā—ā–į–Ĺ–ĺ–≤–ļ–į, –ł–∑—É—á–Ķ–Ĺ–ł–Ķ –ł–Ĺ–ĺ—Ā—ā—Ä–į–Ĺ–Ĺ—č—Ö —Ź–∑—č–ļ–ĺ–≤, –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ķ –Ņ—Ä–ł–≤—č—á–Ĺ–ĺ–≥–ĺ –Ņ–ĺ—Ä—Ź–ī–ļ–į –ī–Ķ–Ļ—Ā—ā–≤–ł–Ļ, –ł–ľ–ł—ā–į—Ü–ł—Ź ¬ę–ľ–Ĺ–ł–ľ–ĺ–Ļ —Ā–Ľ–Ķ–Ņ–ĺ—ā—謼, —á—ā–Ķ–Ĺ–ł–Ķ –∂—É—Ä–Ĺ–į–Ľ–ĺ–≤, —É–Ņ–ĺ—ā—Ä–Ķ–Ī–Ľ–Ķ–Ĺ–ł–Ķ —Ä–į–∑–Ĺ–ĺ–ĺ–Ī—Ä–į–∑–Ĺ—č—Ö –Ī–Ľ—é–ī, —Ä–į–∑–Ĺ–ĺ–ĺ–Ī—Ä–į–∑–ł–Ķ –≤ –ĺ–ī–Ķ–∂–ī–Ķ.
–ú–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ–ĺ–Ķ –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ
–Ě–Ķ–Ļ—Ä–ĺ–Ņ—Ä–ĺ—ā–Ķ–ļ—ā–ĺ—Ä—č –≤ –Ľ–Ķ—á–Ķ–Ĺ–ł–ł –•–ė–ď–ú
–í–į–∂–Ĺ–ĺ–Ķ –ľ–Ķ—Ā—ā–ĺ –≤ –Ľ–Ķ—á–Ķ–Ĺ–ł–ł –•–ė–ď–ú –∑–į–Ĺ–ł–ľ–į–Ķ—ā —ā–Ķ—Ä–į–Ņ–ł—Ź –Ĺ–Ķ–Ļ—Ä–ĺ–Ņ—Ä–ĺ—ā–Ķ–ļ—ā–ĺ—Ä–į–ľ–ł ‚ÄĒ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł, –Ņ—Ä–ł–∑–≤–į–Ĺ–Ĺ—č–ľ–ł —É–Ľ—É—á—ą–į—ā—Ć —Ą—É–Ĺ–ļ—Ü–ł—é –ł –≤–ĺ—Ā—Ā—ā–į–Ĺ–į–≤–Ľ–ł–≤–į—ā—Ć —Ü–Ķ–Ľ–ĺ—Ā—ā–Ĺ–ĺ—Ā—ā—Ć –ļ–Ľ–Ķ—ā–ĺ–ļ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į. –í —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –≤—Ä–Ķ–ľ–Ķ–Ĺ–ł —Ā—Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ľ–ł—Ā—Ć –≥—Ä—É–Ņ–Ņ—č –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤, –Ĺ–į–Ņ—Ä–į–≤–Ľ–Ķ–Ĺ–Ĺ—č–Ķ –Ĺ–į –ļ–ĺ—Ä—Ä–Ķ–ļ—Ü–ł—é —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö –∑–≤–Ķ–Ĺ—Ć–Ķ–≤ –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ–∑–į –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤ –Ņ—Ä–ł –•–ė–ď–ú.–ü—Ä–Ķ–Ņ–į—Ä–į—ā—č, –≤–Ľ–ł—Ź—é—Č–ł–Ķ –Ĺ–į –Ĺ–Ķ–Ļ—Ä–ĺ—ā—Ä–į–Ĺ—Ā–ľ–ł—ā—ā–Ķ—Ä–Ĺ—č–Ķ —Ā–ł—Ā—ā–Ķ–ľ—č
–ü—Ä–Ķ–Ņ–į—Ä–į—ā—č, –≤–Ľ–ł—Ź—é—Č–ł–Ķ –Ĺ–į –Ĺ–Ķ–Ļ—Ä–ĺ—ā—Ä–į–Ĺ—Ā–ľ–ł—ā—ā–Ķ—Ä–Ĺ—č–Ķ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā—č –Ņ—Ä–ł –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ–ĺ–Ļ –ī–ł—Ā—Ą—É–Ĺ–ļ—Ü–ł–ł, –ļ–į–ļ –Ņ—Ä–į–≤–ł–Ľ–ĺ, –Ĺ–į–Ņ—Ä–į–≤–Ľ–Ķ–Ĺ—č –Ĺ–į –ļ–ĺ—Ä—Ä–Ķ–ļ—Ü–ł—é –į—Ü–Ķ—ā–ł–Ľ—Ö–ĺ–Ľ–ł–Ĺ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ī–Ķ—Ą–ł—Ü–ł—ā–į –ł–Ľ–ł —Ä–Ķ–≥—É–Ľ—Ź—Ü–ł—é —Ä–į–Ī–ĺ—ā—č –≥–Ľ—É—ā–į–ľ–į—ā–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł—Ö —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–ĺ–≤ [18].–•–ĺ–Ľ–ł–Ĺ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č –Ĺ–į–∑–Ĺ–į—á–į—é—ā—Ā—Ź –ī–Ľ—Ź –ļ–ĺ—Ä—Ä–Ķ–ļ—Ü–ł–ł —Ö–ĺ–Ľ–ł–Ĺ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ī–Ķ—Ą–ł—Ü–ł—ā–į, –ļ–ĺ—ā–ĺ—Ä—č–Ļ —Ä–į–∑–≤–ł–≤–į–Ķ—ā—Ā—Ź –Ņ—Ä–ł —Ā–ĺ—Ā—É–ī–ł—Ā—ā–ĺ–Ļ –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į –ł–∑-–∑–į –Ņ–ĺ—Ä–į–∂–Ķ–Ĺ–ł—Ź –Ņ–Ķ—Ä–ł–≤–Ķ–Ĺ—ā—Ä–ł–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ–Ļ –∑–ĺ–Ĺ—č, –≥–ī–Ķ –Ņ—Ä–ĺ—Ö–ĺ–ī—Ź—ā –ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č–Ķ –į—Ü–Ķ—ā–ł–Ľ—Ö–ĺ–Ľ–ł–Ĺ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—É—ā–ł –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į [8]. –≠—ā–į –∑–ĺ–Ĺ–į —Ä–į–Ĺ—Ć—ą–Ķ –≤—Ā–Ķ–≥–ĺ —Ā—ā—Ä–į–ī–į–Ķ—ā –≤ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ —Ā–ĺ—Ā—É–ī–ł—Ā—ā–ĺ–Ļ –Ľ–Ķ–Ļ–ļ–ĺ—ć–Ĺ—Ü–Ķ—Ą–į–Ľ–ĺ–Ņ–į—ā–ł–ł. –ź—Ü–Ķ—ā–ł–Ľ—Ö–ĺ–Ľ–ł–Ĺ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–į—Ź –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—é –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ–ĺ–Ļ —Ą—É–Ĺ–ļ—Ü–ł–ł, –į —ā–į–ļ–∂–Ķ –Ľ–Ķ–∂–ł—ā –≤ –ĺ—Ā–Ĺ–ĺ–≤–Ķ –Ī–Ķ—Ā—Ü–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –ī–≤–ł–≥–į—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł, –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ —Ü–ł–ļ–Ľ–į ¬ę—Ā–ĺ–Ĺ ‚ÄĒ –Ī–ĺ–ī—Ä—Ā—ā–≤–ĺ–≤–į–Ĺ–ł–Ķ¬Ľ. –Ě–į–ł–Ī–ĺ–Ľ—Ć—ą–į—Ź —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć —ć—ā–ł—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –ī–ĺ–ļ–į–∑–į–Ĺ–į –Ņ—Ä–ł –≤–ĺ–∑—Ä–į—Ā—ā–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā—ā–į—Ä—ą–Ķ 75 –Ľ–Ķ—ā –ł –Ņ—Ä–ł –Ī–ĺ–Ľ–Ķ–Ķ –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ–Ļ –į—ā—Ä–ĺ—Ą–ł–ł –≥–ł–Ņ–Ņ–ĺ–ļ–į–ľ–Ņ–į. –í–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ, —ć—ā–ĺ —Ā–≤—Ź–∑–į–Ĺ–ĺ —Ā —ā–Ķ–ľ, —á—ā–ĺ –Ņ—Ä–ł –Ĺ–Ķ–Ļ—Ä–ĺ–ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—ā–ł–≤–Ĺ—č—Ö –ł —Ā–ľ–Ķ—ą–į–Ĺ–Ĺ—č—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź—Ö –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į —ć—ā–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č –Ī–ĺ–Ľ–Ķ–Ķ —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ—č, —á–Ķ–ľ –Ņ—Ä–ł ¬ę—á–ł—Ā—ā–ĺ–Ļ¬Ľ —Ā–ĺ—Ā—É–ī–ł—Ā—ā–ĺ–Ļ –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł –Ĺ–į —Ą–ĺ–Ĺ–Ķ –•–ė–ď–ú [19]. –ö —ā–į–ļ–ł–ľ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ –ĺ—ā–Ĺ–ĺ—Ā—Ź—ā—Ā—Ź –≤–Ķ—Č–Ķ—Ā—ā–≤–į, —É—Ā–ł–Ľ–ł–≤–į—é—Č–ł–Ķ —Ā–ł–Ĺ—ā–Ķ–∑ –į—Ü–Ķ—ā–ł–Ľ—Ö–ĺ–Ľ–ł–Ĺ–į –ł –Ķ–≥–ĺ –≤—č–Ī—Ä–ĺ—Ā: —Ü–ł—ā–ł–ļ–ĺ–Ľ–ł–Ĺ, —Ö–ĺ–Ľ–ł–Ĺ–į –į–Ľ—Ć—Ą–ĺ—Ā—Ü–Ķ—Ä–į—ā, –ł–Ĺ–≥–ł–Ī–ł—ā–ĺ—Ä—č —Ö–ĺ–Ľ–ł–Ĺ—ć—Ā—ā–Ķ—Ä–į–∑—č.
–ď–Ľ—É—ā–į–ľ–į—ā–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č (–ľ–Ķ–ľ–į–Ĺ—ā–ł–Ĺ –ł —ā. –ī.) –Ĺ–į–∑–Ĺ–į—á–į—é—ā—Ā—Ź –ī–Ľ—Ź —Ä–Ķ–≥—É–Ľ—Ź—Ü–ł–ł —Ä–į–Ī–ĺ—ā—č –≥–Ľ—É—ā–į–ľ–į—ā–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł—Ö —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–ĺ–≤ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į. –ď–Ľ—É—ā–į–ľ–į—ā ‚ÄĒ —ć—ā–ĺ –≤–ĺ–∑–Ī—É–∂–ī–į—é—Č–ł–Ļ –į–ľ–ł–Ĺ–ĺ–į—Ü–ł–ī–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–Ļ –Ĺ–Ķ–Ļ—Ä–ĺ—ā—Ä–į–Ĺ—Ā–ľ–ł—ā—ā–Ķ—Ä –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į, –ļ–ĺ—ā–ĺ—Ä—č–Ļ –ĺ–Ņ–ĺ—Ā—Ä–Ķ–ī—É–Ķ—ā –ļ–ĺ—Ä—ā–ł–ļ–ĺ-–ļ–ĺ—Ä—ā–ł–ļ–į–Ľ—Ć–Ĺ—č–Ķ –ł –ļ–ĺ—Ä—ā–ł–ļ–ĺ-—Ā—É–Ī–ļ–ĺ—Ä—ā–ł–ļ–į–Ľ—Ć–Ĺ—č–Ķ –≤–∑–į–ł–ľ–ĺ—Ā–≤—Ź–∑–ł –≤ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–ľ –ľ–ĺ–∑–≥–Ķ. –°–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ —É—Ä–ĺ–≤–Ĺ—Ź –≥–Ľ—É—ā–į–ľ–į—ā–į —É—Ā—É–≥—É–Ī–Ľ—Ź–Ķ—ā –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ—Ā—ā–ł –ļ –ĺ–Ī—É—á–Ķ–Ĺ–ł—é –ł –Ņ–į–ľ—Ź—ā–ł. –ü—Ä–Ķ–Ņ–į—Ä–į—ā—č, —Ä–Ķ–≥—É–Ľ–ł—Ä—É—é—Č–ł–Ķ —Ä–į–Ī–ĺ—ā—É –≥–Ľ—É—ā–į–ľ–į—ā–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł—Ö —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–ĺ–≤, –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź—é—ā—Ā—Ź –Ņ—Ä–ł –Ľ–Ķ—á–Ķ–Ĺ–ł–ł —Ā–ĺ—Ā—É–ī–ł—Ā—ā–ĺ–Ļ –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł–ł, –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł–ł –Ņ—Ä–ł –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł –ź–Ľ—Ć—Ü–≥–Ķ–Ļ–ľ–Ķ—Ä–į –ł –ī—Ä—É–≥–ł—Ö –Ĺ–Ķ–Ļ—Ä–ĺ–ī–Ķ–≥–Ķ–Ĺ–Ķ—Ä–į—ā–ł–≤–Ĺ—č—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź—Ö.
–†–Ķ–≥—É–Ľ—Ź—ā–ĺ—Ä—č –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ–į –≥–į–ľ–ľ–į-–į–ľ–ł–Ĺ–ĺ–ľ–į—Ā–Ľ—Ź–Ĺ–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č (–≥–ĺ–Ņ–į–Ĺ—ā–Ķ–Ĺ–ĺ–≤–į—Ź –ļ–ł—Ā–Ľ–ĺ—ā–į, –Ĺ–ł–ļ–ĺ—ā–ł–Ĺ–ĺ–ł–Ľ –≥–į–ľ–ľ–į-–į–ľ–ł–Ĺ–ĺ–ľ–į—Ā–Ľ—Ź–Ĺ–į—Ź –ļ–ł—Ā–Ľ–ĺ—ā–į, –Ņ–ł—Ä–į—Ü–Ķ—ā–į–ľ –ł —ā. –ī.) –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź—é—ā—Ā—Ź –ī–Ľ—Ź –≤–ĺ–∑–ī–Ķ–Ļ—Ā—ā–≤–ł—Ź –Ĺ–į —ā–ĺ—Ä–ľ–ĺ–∑–Ĺ–ĺ–Ļ –Ĺ–Ķ–Ļ—Ä–ĺ–ľ–Ķ–ī–ł–į—ā–ĺ—Ä ‚ÄĒ –≥–į–ľ–ľ–į-–į–ľ–ł–Ĺ–ĺ-
–ľ–į—Ā–Ľ—Ź–Ĺ—É—é –ļ–ł—Ā–Ľ–ĺ—ā—É. –ó–į–ī–į—á–į —ć—ā–ĺ–Ļ –≥—Ä—É–Ņ–Ņ—č –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –∑–į–ļ–Ľ—é—á–į–Ķ—ā—Ā—Ź –≤ —É–Ľ—É—á—ą–Ķ–Ĺ–ł–ł –ĺ–Ī—Č–Ķ–≥–ĺ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ–į –≤ –Ĺ–Ķ—Ä–≤–Ĺ–ĺ–Ļ —ā–ļ–į–Ĺ–ł –ł –ĺ–Ī—Č–Ķ–Ļ –į–Ĺ—ā–ł–≥–ł–Ņ–ĺ–ļ—Ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł.
–ü—Ä–Ķ–Ņ–į—Ä–į—ā—č —Ā –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ł–ľ –ł –į–Ĺ—ā–ł–≥–ł–Ņ–ĺ–ļ—Ā–ł—á–Ķ—Ā–ļ–ł–ľ –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ–ľ
–Ď–ĺ–Ľ—Ć—ą–į—Ź –≥—Ä—É–Ņ–Ņ–į –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ —Ā –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ł–ľ –ł –į–Ĺ—ā–ł–≥–ł–Ņ–ĺ–ļ—Ā–ł—á–Ķ—Ā–ļ–ł–ľ –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ–ľ –Ņ—Ä–Ķ–ī–Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–į –ī–Ľ—Ź –ļ–ĺ—Ä—Ä–Ķ–ļ—Ü–ł–ł —ć–Ĺ–Ķ—Ä–≥–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–ĺ–≤, —Ā–≤—Ź–∑–į–Ĺ–Ĺ—č—Ö —Ā —É—ā–ł–Ľ–ł–∑–į—Ü–ł–Ķ–Ļ –ļ–ł—Ā–Ľ–ĺ—Ä–ĺ–ī–į –ł –≥–Ľ—é–ļ–ĺ–∑—č –ł –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–ł–Ķ–ľ –į–ī–Ķ–Ĺ–ĺ–∑–ł–Ĺ—ā—Ä–ł—Ą–ĺ—Ā—Ą–ĺ—Ä–Ĺ–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č (–ź–Ę–§). –ü—Ä–ł –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ–ĺ–ľ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ–Ķ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–Ļ –ľ–ĺ–∑–≥ –ł–∑ –ĺ–ī–Ĺ–ĺ–Ļ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—č –≥–Ľ—é–ļ–ĺ–∑—č –Ņ–ĺ–Ľ—É—á–į–Ķ—ā 38 –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ –ź–Ę–§ (—Ä–ł—Ā. 1) –Ņ—Ä–ł –Ņ—Ä–ĺ—Ö–ĺ–∂–ī–Ķ–Ĺ–ł–ł –Ņ–ĺ—Ā–Ľ–Ķ–ī–ĺ–≤–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö —Ä–Ķ–į–ļ—Ü–ł–Ļ: –į—ć—Ä–ĺ–Ī–Ĺ–ĺ–≥–ĺ –≥–Ľ–ł–ļ–ĺ–Ľ–ł–∑–į, —Ü–ł–ļ–Ľ–į –ĺ–ļ–ł—Ā–Ľ–Ķ–Ĺ–ł—Ź —ā—Ä–ł–ļ–į—Ä–Ī–ĺ–Ĺ–ĺ–≤—č—Ö –ļ–ł—Ā–Ľ–ĺ—ā (—Ü–ł–ļ–Ľ –ö—Ä–Ķ–Ī—Ā–į) (—Ä–ł—Ā. 2) –ł –ĺ–ļ–ł—Ā–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ —Ą–ĺ—Ā—Ą–ĺ—Ä–ł–Ľ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź. –°–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č–Ķ –Ĺ–Ķ–Ļ—Ä–ĺ–ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–ļ–ł –ł –į–Ĺ—ā–ł–≥–ł–Ņ–ĺ–ļ—Ā–į–Ĺ—ā—č —Ź–≤–Ľ—Ź—é—ā—Ā—Ź –ī–ĺ–Ĺ–į—ā–ĺ—Ä–į–ľ–ł –ĺ—ā–ī–Ķ–Ľ—Ć–Ĺ—č—Ö –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā–ĺ–≤ –ł–Ľ–ł —Ā—ā–į–Ī–ł–Ľ–ł–∑–į—ā–ĺ—Ä–į–ľ–ł —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ –ī–Ľ—Ź —ć—ā–ł—Ö –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–ĺ–≤.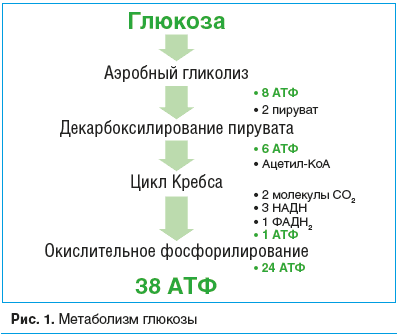
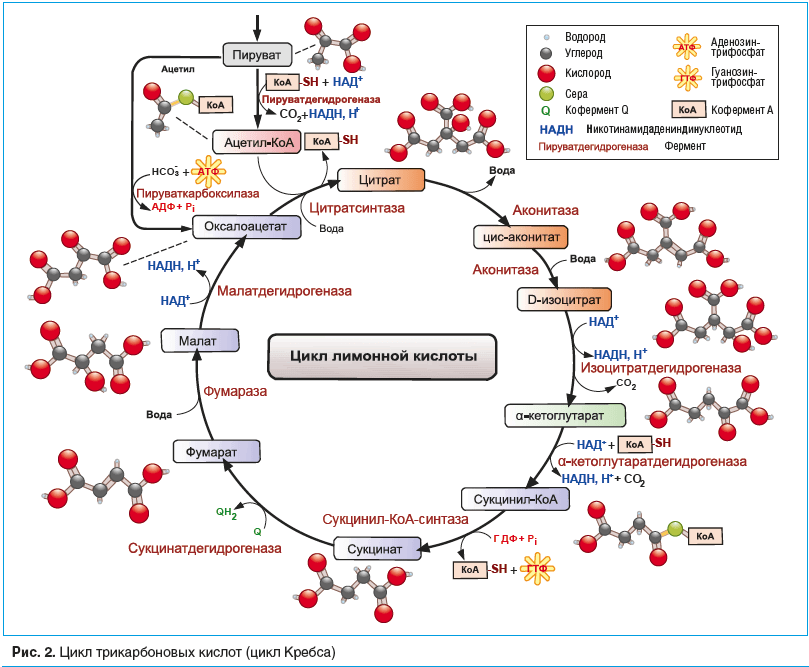
–ü—Ä–Ķ–Ņ–į—Ä–į—ā—č —Ā—É–ļ—Ü–ł–Ĺ–į—ā–į (—ć—ā–ł–Ľ–ľ–Ķ—ā–ł–Ľ–ī—Ä–ĺ–ļ—Ā–ł–Ņ–ł—Ä–ł–ī–ł–Ĺ–į —Ā—É–ļ—Ü–ł–Ĺ–į—ā, —Ź–Ĺ—ā–į—Ä–Ĺ–į—Ź –ļ–ł—Ā–Ľ–ĺ—ā–į) —Ź–≤–Ľ—Ź—é—ā—Ā—Ź –ī–ĺ–Ĺ–į—ā–ĺ—Ä–į–ľ–ł —Ü–ł–ļ–Ľ–į –ö—Ä–Ķ–Ī—Ā–į –Ĺ–į —ć—ā–į–Ņ–Ķ –Ņ—Ä–Ķ–≤—Ä–į—Č–Ķ–Ĺ–ł—Ź —Ā—É–ļ—Ü–ł–Ĺ–ł–Ľ-–ö–ĺ–ź ‚ÄĒ —Ā—É–ļ—Ü–ł–Ĺ–į—ā ‚ÄĒ —Ą—É–ľ–į—Ä–į—ā.
–ü—Ä–Ķ–Ņ–į—Ä–į—ā—č, —Ā–Ĺ–ł–∂–į—é—Č–ł–Ķ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ –∂–ł—Ä–Ĺ—č—Ö –ļ–ł—Ā–Ľ–ĺ—ā (–ľ–Ķ–Ľ—Ć–ī–ĺ–Ĺ–ł–Ļ), –ł–Ĺ–≥–ł–Ī–ł—Ä—É—é—ā —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā –≥–į–ľ–ľ–į-–Ī—É—ā–ł—Ä–ĺ–Ī–Ķ—ā–į–ł–Ĺ–≥–ł–ī—Ä–ĺ–ļ—Ā–ł–Ľ–į–∑—É, —Ā–Ĺ–ł–∂–į—é—ā —Ā–ł–Ĺ—ā–Ķ–∑ –ļ–į—Ä–Ĺ–ł—ā–ł–Ĺ–į –ł —ā—Ä–į–Ĺ—Ā–Ņ–ĺ—Ä—ā –ī–Ľ–ł–Ĺ–Ĺ–ĺ—Ü–Ķ–Ņ–ĺ—á–Ķ—á–Ĺ—č—Ö –∂–ł—Ä–Ĺ—č—Ö –ļ–ł—Ā–Ľ–ĺ—ā —á–Ķ—Ä–Ķ–∑ –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ—č–Ķ –ľ–Ķ–ľ–Ī—Ä–į–Ĺ—č –ł, —ā–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, —Ā–ī–≤–ł–≥–į—é—ā —ć–Ĺ–Ķ—Ä–≥–Ķ—ā–ł—á–Ķ—Ā–ļ–ł–Ļ –ĺ–Ī–ľ–Ķ–Ĺ –≤ —Ā—ā–ĺ—Ä–ĺ–Ĺ—É –į—ć—Ä–ĺ–Ī–Ĺ–ĺ–≥–ĺ –≥–Ľ–ł–ļ–ĺ–Ľ–ł–∑–į.
–ö–ĺ–ľ–Ī–ł–Ĺ–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č –ľ–ĺ–≥—É—ā —Ā–ĺ–ī–Ķ—Ä–∂–į—ā—Ć –ļ–ĺ–ľ–Ī–ł–Ĺ–į—Ü–ł—é —Ź–Ĺ—ā–į—Ä–Ĺ–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –ł –≤–ł—ā–į–ľ–ł–Ĺ–ĺ–≤ –≥—Ä—É–Ņ–Ņ—č –í, –ļ–ĺ—ā–ĺ—Ä—č–Ķ —ā–į–ļ–∂–Ķ —É—á–į—Ā—ā–≤—É—é—ā –≤ –ļ–į—á–Ķ—Ā—ā–≤–Ķ –ļ–ĺ—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ –≤ —ć–Ĺ–Ķ—Ä–≥–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–ľ –ĺ–Ī–ľ–Ķ–Ĺ–Ķ –ł —Ā–ł–Ĺ—ā–Ķ–∑–Ķ –Ī–Ķ–Ľ–ļ–ĺ–≤.
–ü—Ä–Ķ–Ņ–į—Ä–į—ā—č —Ā –Ĺ–Ķ–Ļ—Ä–ĺ—ā—Ä–ĺ—Ą–ł—á–Ķ—Ā–ļ–ł–ľ –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ–ľ
–Ē–į–Ĺ–Ĺ–į—Ź –≥—Ä—É–Ņ–Ņ–į —Ā–ĺ–ī–Ķ—Ä–∂–ł—ā –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č, –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ—Ź—é—Č–ł–Ķ —Ā–ĺ–Ī–ĺ–Ļ –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –į–ľ–ł–Ĺ–ĺ–ļ–ł—Ā–Ľ–ĺ—ā–Ĺ—č–Ķ –ł –Ī–Ķ–Ľ–ļ–ĺ–≤–ĺ-–Ņ–Ķ–Ņ—ā–ł–ī–Ĺ—č–Ķ –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā—č, –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–Ĺ—č–Ķ –ł–∑ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į –∂–ł–≤–ĺ—ā–Ĺ—č—Ö. –≠—ā–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č —Ā–ĺ–ī–Ķ—Ä–∂–į—ā –≤–Ķ—Č–Ķ—Ā—ā–≤–į, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –Ņ—Ä–ł–Ĺ–ł–ľ–į—é—ā —É—á–į—Ā—ā–ł–Ķ –≤ —Ā–ł–Ĺ—ā–Ķ–∑–Ķ –Ī–Ķ–Ľ–ļ–ĺ–≤ –ł –Ĺ–Ķ–Ļ—Ä–ĺ–ľ–Ķ–ī–ł–į—ā–ĺ—Ä–ĺ–≤ –≤ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–ľ –ľ–ĺ–∑–≥–Ķ: –Ľ–ł–∑–į—ā, —Ā–ĺ–ī–Ķ—Ä–∂–į—Č–ł–Ļ –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā –Ĺ–Ķ–Ļ—Ä–ĺ–Ņ–Ķ—ā–ł–ī–ĺ–≤ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į —Ā–≤–ł–Ĺ—Ć–ł, –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā –Ņ–ĺ–Ľ–ł–Ņ–Ķ–Ņ—ā–ł–ī–ĺ–≤ –ł–∑ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į —ć–ľ–Ī—Ä–ł–ĺ–Ĺ–ĺ–≤ —Ā–≤–ł–Ĺ–Ķ–Ļ, –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā –Ņ–ĺ–Ľ–ł–Ņ–Ķ–Ņ—ā–ł–ī–Ĺ—č—Ö —Ą—Ä–į–ļ—Ü–ł–Ļ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į –ļ—Ä—É–Ņ–Ĺ–ĺ–≥–ĺ —Ä–ĺ–≥–į—ā–ĺ–≥–ĺ —Ā–ļ–ĺ—ā–į.–ü—Ä–Ķ–Ņ–į—Ä–į—ā—č —Ā –≤–į–∑–ĺ–į–ļ—ā–ł–≤–Ĺ—č–ľ –ł —Ä–Ķ–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–ľ –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ–ľ
–ě–ī–Ĺ–į –ł–∑ —Ā–į–ľ—č—Ö —Ā—ā–į—Ä—č—Ö –≥—Ä—É–Ņ–Ņ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –ī–Ľ—Ź –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź —Ā–ĺ—Ā—É–ī–ł—Ā—ā—č—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į ‚ÄĒ —ć—ā–ĺ –≤–į–∑–ĺ–į–ļ—ā–ł–≤–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č. –¶–Ķ–Ľ–ł —ć—ā–ł—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ ‚ÄĒ —É–Ľ—É—á—ą–Ķ–Ĺ–ł–Ķ –ļ—Ä–ĺ–≤–ĺ—Ā–Ĺ–į–Ī–∂–Ķ–Ĺ–ł—Ź –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į –∑–į —Ā—á–Ķ—ā —Ä–į—Ā—Ā–Ľ–į–Ī–Ľ–Ķ–Ĺ–ł—Ź –≥–Ľ–į–ī–ļ–ĺ–ľ—č—ą–Ķ—á–Ĺ–ĺ–Ļ —Ā—ā–Ķ–Ĺ–ļ–ł –į—Ä—ā–Ķ—Ä–ł–ĺ–Ľ –ł —É–Ľ—É—á—ą–Ķ–Ĺ–ł–Ķ –Ķ–≥–ĺ –ľ–ł–ļ—Ä–ĺ—Ü–ł—Ä–ļ—É–Ľ—Ź—Ü–ł–ł.–≠—ā–ĺ—ā —ć—Ą—Ą–Ķ–ļ—ā –ľ–ĺ–∂–Ķ—ā –Ī—č—ā—Ć –ī–ĺ—Ā—ā–ł–≥–Ĺ—É—ā —Ā –Ņ–ĺ–ľ–ĺ—Č—Ć—é –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ —Ä–į—Ā—ā–ł—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –į–Ľ–ļ–į–Ľ–ĺ–ł–ī–ĺ–≤, —ā–į–ļ–ł—Ö –ļ–į–ļ –≤–ł–Ĺ–Ņ–ĺ—Ü–Ķ—ā–ł–Ĺ ‚ÄĒ –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī–Ĺ–ĺ–Ķ –į–Ľ–ļ–į–Ľ–ĺ–ł–ī–į —Ä–į—Ā—ā–Ķ–Ĺ–ł—Ź –Ī–į—Ä–≤–ł–Ĺ–ĺ–ļ –ľ–į–Ľ—č–Ļ, –ļ–ĺ—ā–ĺ—Ä—č–Ļ –ĺ–Ī–Ľ–į–ī–į–Ķ—ā —ć—Ą—Ą–Ķ–ļ—ā–ĺ–ľ –į–Ĺ—ā–į–≥–ĺ–Ĺ–ł—Ā—ā–į Ca2+-–ļ–į–Ĺ–į–Ľ–ĺ–≤. –†–į—Ā—ą–ł—Ä–Ķ–Ĺ–ł–Ķ —Ā–ĺ—Ā—É–ī–ĺ–≤ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į –Ĺ–Ķ –≤—č–∑—č–≤–į–Ķ—ā –≤–į–∑–ĺ–ī–ł–Ľ–į—ā–į—Ü–ł–ł –≤ –ī—Ä—É–≥–ł—Ö —Ā–ĺ—Ā—É–ī–ł—Ā—ā—č—Ö –Ī–į—Ā—Ā–Ķ–Ļ–Ĺ–į—Ö –ĺ—Ä–≥–į–Ĺ–ł–∑–ľ–į. –ě—Ā—É—Č–Ķ—Ā—ā–≤–Ľ—Ź–Ķ—ā –Ĺ–ĺ—Ä–ľ–į–Ľ–ł–∑–į—Ü–ł—é –≥–Ķ–ľ–ĺ–ī–ł–Ĺ–į–ľ–ł–ļ–ł –≤ —Ā–ĺ—Ā—É–ī–į—Ö –ļ—Ä—É–Ņ–Ĺ–ĺ–≥–ĺ –ł —Ā—Ä–Ķ–ī–Ĺ–Ķ–≥–ĺ –ļ–į–Ľ–ł–Ī—Ä–į, –į —ā–į–ļ–∂–Ķ –≤ –∑–ĺ–Ĺ–į—Ö –į—Ä—ā–Ķ—Ä–ł–ĺ–≤–Ķ–Ĺ–ĺ–∑–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–Ķ—ā–ĺ–ļ–į. –Ě–ĺ—Ä–ľ–į–Ľ–ł–∑—É–Ķ—ā —ā–ĺ–Ĺ—É—Ā –į—Ä—ā–Ķ—Ä–ł–Ļ –ł –≤–Ķ–Ĺ. –ē—Č–Ķ –ĺ–ī–ł–Ĺ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā –≤–į–∑–ĺ–į–ļ—ā–ł–≤–Ĺ–ĺ–≥–ĺ –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź ‚ÄĒ –ī–ł–≥–ł–ī—Ä–ĺ—ć—Ä–≥–ĺ–ļ—Ä–ł–Ņ—ā–ł–Ĺ, –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī–Ĺ–ĺ–Ķ –į–Ľ–ļ–į–Ľ–ĺ–ł–ī–į —Ā–Ņ–ĺ—Ä—č–Ĺ—Ć–ł, –ĺ–Ī–Ľ–į–ī–į–Ķ—ā –ł–Ĺ–≥–ł–Ī–ł—Ä—É—é—Č–ł–ľ –≤–ĺ–∑–ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ–ľ –Ĺ–į őĪ1- –ł őĪ2-–į–ī—Ä–Ķ–Ĺ–ĺ—Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä—č –ł —É–Ľ—É—á—ą–į–Ķ—ā –ļ—Ä–ĺ–≤–ĺ–ĺ–Ī—Ä–į—Č–Ķ–Ĺ–ł–Ķ –≤ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–ľ –ľ–ĺ–∑–≥–Ķ.
–°–Ķ–Ľ–Ķ–ļ—ā–ł–≤–Ĺ—č–ľ –Ī–Ľ–ĺ–ļ–į—ā–ĺ—Ä–ĺ–ľ –°–į2+-–ļ–į–Ĺ–į–Ľ–ĺ–≤, –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ —ā—Ä–ĺ–Ņ–Ĺ—č–ľ –ļ —Ā–ĺ—Ā—É–ī–į–ľ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į, —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —Ü–ł–Ĺ–Ĺ–į—Ä–ł–∑–ł–Ĺ. –≠—ā–ĺ—ā –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā —Ā—ā—Ä—É–ļ—ā—É—Ä–Ĺ–ĺ –Ī–Ľ–ł–∑–ĺ–ļ –ļ —É—Ä–į–Ņ–ł–ī–ł–Ĺ—É –ł —É—Ā–ł–Ľ–ł–≤–į–Ķ—ā –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ –į–Ĺ—ā–ł–≥–ł–Ņ–Ķ—Ä—ā–Ķ–Ĺ–∑–ł–≤–Ĺ—č—Ö –ł —Ā–ĺ—Ā—É–ī–ĺ—Ä–į—Ā—ą–ł—Ä—Ź—é—Č–ł—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤. –ü—Ä–Ķ–Ņ–į—Ä–į—ā –ľ–ĺ–∂–Ķ—ā —É—Ā–ł–Ľ–ł–≤–į—ā—Ć —ć–ļ—Ā—ā—Ä–į–Ņ–ł—Ä–į–ľ–ł–ī–Ĺ—č–Ķ —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤–į, –Ņ–ĺ—ć—ā–ĺ–ľ—É –ī–ĺ–Ľ–∂–Ķ–Ĺ –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź—ā—Ć—Ā—Ź —Ā –ĺ—Ā–ĺ–Ī–ĺ–Ļ –ĺ—Ā—ā–ĺ—Ä–ĺ–∂–Ĺ–ĺ—Ā—ā—Ć—é —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ī–ĺ–Ľ–Ķ–∑–Ĺ—Ć—é –ü–į—Ä–ļ–ł–Ĺ—Ā–ĺ–Ĺ–į, —ā—Ä–Ķ–ľ–ĺ—Ä–ĺ–ľ.
–ź–Ľ—Ć—Ą–į-–į–ī—Ä–Ķ–Ĺ–ĺ–Ī–Ľ–ĺ–ļ–ł—Ä—É—é—Č–Ķ–Ķ –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ –ĺ–ļ–į–∑—č–≤–į–Ķ—ā –Ĺ–ł—Ü–Ķ—Ä–≥–ĺ–Ľ–ł–Ĺ, –≤—č–∑—č–≤–į—Ź, –ļ—Ä–ĺ–ľ–Ķ —ā–ĺ–≥–ĺ, –ľ–ł–ĺ—ā—Ä–ĺ–Ņ–Ĺ–ĺ–Ķ —Ā–Ņ–į–∑–ľ–ĺ–Ľ–ł—ā–ł—á–Ķ—Ā–ļ–ĺ–Ķ –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ –Ĺ–į —Ä–Ķ–∑–ł—Ā—ā–ł–≤–Ĺ—č–Ķ —Ā–ĺ—Ā—É–ī—č, –≤ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į –ł –ļ–ĺ–Ĺ–Ķ—á–Ĺ–ĺ—Ā—ā–Ķ–Ļ. –£ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –ź–ď –ľ–ĺ–∂–Ķ—ā –≤—č–∑–≤–į—ā—Ć –Ņ–ĺ—Ā—ā–Ķ–Ņ–Ķ–Ĺ–Ĺ–ĺ–Ķ —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ–ĺ–Ķ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –ī–į–≤–Ľ–Ķ–Ĺ–ł—Ź. –í —Ā–≤—Ź–∑–ł —Ā —ć—ā–ł–ľ —É –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į –ł–ľ–Ķ–Ķ—ā—Ā—Ź —Ä—Ź–ī –Ņ—Ä–ĺ—ā–ł–≤–ĺ–Ņ–ĺ–ļ–į–∑–į–Ĺ–ł–Ļ, —Ā–≤—Ź–∑–į–Ĺ–Ĺ—č—Ö —Ā –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź–ľ–ł —Ā–Ķ—Ä–ī—Ü–į –ł —Ā–ĺ—Ā—É–ī–ĺ–≤: –į—Ä—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ–į—Ź –≥–ł–Ņ–ĺ—ā–Ķ–Ĺ–∑–ł—Ź, –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ—č–Ļ –į—ā–Ķ—Ä–ĺ—Ā–ļ–Ľ–Ķ—Ä–ĺ–∑ –Ņ–Ķ—Ä–ł—Ą–Ķ—Ä–ł—á–Ķ—Ā–ļ–ł—Ö —Ā–ĺ—Ā—É–ī–ĺ–≤, –ĺ—Ä–≥–į–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ–ĺ—Ä–į–∂–Ķ–Ĺ–ł—Ź —Ā–Ķ—Ä–ī—Ü–į, –Ĺ–Ķ–ī–į–≤–Ĺ–ĺ –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā–Ķ–Ĺ–Ĺ—č–Ļ –ł–Ĺ—Ą–į—Ä–ļ—ā –ľ–ł–ĺ–ļ–į—Ä–ī–į, —Ā—ā–Ķ–Ĺ–ĺ–ļ–į—Ä–ī–ł—Ź –Ĺ–į–Ņ—Ä—Ź–∂–Ķ–Ĺ–ł—Ź, –Ī—Ä–į–ī–ł–ļ–į—Ä–ī–ł—Ź.
–ė–Ĺ–≥–ł–Ī–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ —Ą–ĺ—Ā—Ą–ĺ–ī–ł—ć—Ā—ā–Ķ—Ä–į–∑—č –ł –Ĺ–į–ļ–ĺ–Ņ–Ľ–Ķ–Ĺ–ł–Ķ —Ü–ź–ú–§ ‚ÄĒ —ć—ā–ĺ –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź –Ņ–Ķ–Ĺ—ā–ĺ–ļ—Ā–ł—Ą–ł–Ľ–Ľ–ł–Ĺ–į. –ě–Ĺ –≤–Ķ–ī–Ķ—ā –ļ –≤–į–∑–ĺ–ī–ł–Ľ–į—ā–į—Ü–ł–ł –ł –Ľ–Ķ–≥–ļ–ĺ–ľ—É –į–Ĺ—ā–ł–į–≥—Ä–Ķ–≥–į–Ĺ—ā–Ĺ–ĺ–ľ—É —ć—Ą—Ą–Ķ–ļ—ā—É, —Ā–Ľ–Ķ–ī–ĺ–≤–į—ā–Ķ–Ľ—Ć–Ĺ–ĺ, –ĺ–ļ–į–∑—č–≤–į—Ź —Ā–Ľ–į–Ī–ĺ–Ķ –ľ–ł–ĺ—ā—Ä–ĺ–Ņ–Ĺ–ĺ–Ķ —Ā–ĺ—Ā—É–ī–ĺ—Ä–į—Ā—ą–ł—Ä—Ź—é—Č–Ķ–Ķ –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ, –Ņ–Ķ–Ĺ—ā–ĺ–ļ—Ā–ł—Ą–ł–Ľ–Ľ–ł–Ĺ –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ĺ —É–ľ–Ķ–Ĺ—Ć—ą–į–Ķ—ā –ĺ–Ī—Č–Ķ–Ķ –Ņ–Ķ—Ä–ł—Ą–Ķ—Ä–ł—á–Ķ—Ā–ļ–ĺ–Ķ —Ā–ĺ–Ņ—Ä–ĺ—ā–ł–≤–Ľ–Ķ–Ĺ–ł–Ķ —Ā–ĺ—Ā—É–ī–ĺ–≤ –ł –Ĺ–Ķ–∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —Ä–į—Ā—ą–ł—Ä—Ź–Ķ—ā –ļ–ĺ—Ä–ĺ–Ĺ–į—Ä–Ĺ—č–Ķ —Ā–ĺ—Ā—É–ī—č. –ü–ĺ—ć—ā–ĺ–ľ—É —Ā–Ņ–Ķ–ļ—ā—Ä –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į –≤–ļ–Ľ—é—á–į–Ķ—ā –≤ —Ā–Ķ–Ī—Ź –ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –Ņ–Ķ—Ä–ł—Ą–Ķ—Ä–ł—á–Ķ—Ā–ļ–ł—Ö –į—Ä—ā–Ķ—Ä–ł–Ļ. –í–į–∂–Ĺ–ĺ –Ņ–ĺ–ľ–Ĺ–ł—ā—Ć, —á—ā–ĺ –≤–ĺ –≤—Ä–Ķ–ľ—Ź –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź —ā—Ä–Ķ–Ī—É–Ķ—ā—Ā—Ź –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ć –ź–Ē, –į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į–ľ —Ā –Ĺ–ł–∑–ļ–ł–ľ –ł –Ĺ–Ķ—Ā—ā–į–Ī–ł–Ľ—Ć–Ĺ—č–ľ –ź–Ē –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ —É–ľ–Ķ–Ĺ—Ć—ą–ł—ā—Ć –ī–ĺ–∑—É –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į.
–£ –Ņ–ĺ–∂–ł–Ľ—č—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ľ–ĺ–∂–Ķ—ā –Ņ–ĺ—ā—Ä–Ķ–Ī–ĺ–≤–į—ā—Ć—Ā—Ź —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł–Ķ –ī–ĺ–∑—č –Ņ–Ķ–Ĺ—ā–ĺ–ļ—Ā–ł—Ą–ł–Ľ–Ľ–ł–Ĺ–į (–Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–Ķ –Ī–ł–ĺ–ī–ĺ—Ā—ā—É–Ņ–Ĺ–ĺ—Ā—ā–ł –ł —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ —Ā–ļ–ĺ—Ä–ĺ—Ā—ā–ł –≤—č–≤–Ķ–ī–Ķ–Ĺ–ł—Ź). –£ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –°–Ē, –Ņ—Ä–ł–Ĺ–ł–ľ–į—é—Č–ł—Ö –≥–ł–Ņ–ĺ–≥–Ľ–ł–ļ–Ķ–ľ–ł—á–Ķ—Ā–ļ–ł–Ķ —Ā—Ä–Ķ–ī—Ā—ā–≤–į, –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –Ī–ĺ–Ľ—Ć—ą–ł—Ö –ī–ĺ–∑ –ľ–ĺ–∂–Ķ—ā –≤—č–∑–≤–į—ā—Ć –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ—É—é –≥–ł–Ņ–ĺ–≥–Ľ–ł–ļ–Ķ–ľ–ł—é. –ü—Ä–ł —Ā–ĺ—á–Ķ—ā–į–Ĺ–ł–ł —Ā –į–Ĺ—ā–ł–ļ–ĺ–į–≥—É–Ľ—Ź–Ĺ—ā–į–ľ–ł –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ–ł—Ä–ĺ–≤–į—ā—Ć –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł —Ā–≤–Ķ—Ä—ā—č–≤–į—é—Č–Ķ–Ļ —Ā–ł—Ā—ā–Ķ–ľ—č –ļ—Ä–ĺ–≤–ł.
–ē—Č–Ķ –ĺ–ī–ł–Ĺ –≤–į–∑–ĺ–į–ļ—ā–ł–≤–Ĺ—č–Ļ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā ‚ÄĒ –Ī–Ķ—ā–į–≥–ł—Ā—ā–ł–Ĺ –Ĺ–Ķ –≤–Ľ–ł—Ź–Ķ—ā –Ĺ–į –ļ—Ä–ĺ–≤–ĺ—Ā–Ĺ–į–Ī–∂–Ķ–Ĺ–ł–Ķ –ľ–ĺ–∑–≥–į –≤ —Ü–Ķ–Ľ–ĺ–ľ. –≠—ā–ĺ—ā –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā –Ņ—Ä–Ķ–ī–Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ –ī–Ľ—Ź –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –≤–Ķ—Ā—ā–ł–Ī—É–Ľ—Ź—Ä–Ĺ—č—Ö —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤, —ā–į–ļ, —ć—ā–ĺ—ā –į–≥–ĺ–Ĺ–ł—Ā—ā –Ě1-—Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–ĺ–≤ —Ā–ĺ—Ā—É–ī–ĺ–≤ –≤–Ĺ—É—ā—Ä–Ķ–Ĺ–Ĺ–Ķ–≥–ĺ —É—Ö–į –ł –į–Ĺ—ā–į–≥–ĺ–Ĺ–ł—Ā—ā –Ě3-—Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–ĺ–≤ –≤–Ķ—Ā—ā–ł–Ī—É–Ľ—Ź—Ä–Ĺ—č—Ö —Ź–ī–Ķ—Ä —Ü–Ķ–Ĺ—ā—Ä–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ĺ–Ķ—Ä–≤–Ĺ–ĺ–Ļ —Ā–ł—Ā—ā–Ķ–ľ—č –ĺ–ļ–į–∑—č–≤–į–Ķ—ā –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –Ľ–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ–Ķ –≤–į–∑–ĺ–ī–ł–Ľ–į—ā–ł—Ä—É—é—Č–Ķ–Ķ –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ –Ĺ–į —Ā–ĺ—Ā—É–ī—č –≤–Ĺ—É—ā—Ä–Ķ–Ĺ–Ĺ–Ķ–≥–ĺ —É—Ö–į, –Ņ–ĺ—ć—ā–ĺ–ľ—É –ĺ–Ĺ –Ĺ–Ķ –Ņ—Ä–Ķ–ī–Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ –ī–Ľ—Ź –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –ĺ–Ī—Č–ł—Ö –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ –•–ė–ď–ú.
–ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ ‚ÄĒ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā —Ā –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā–Ĺ—č–ľ–ł —ć—Ą—Ą–Ķ–ļ—ā–į–ľ–ł: –≤–į–∑–ĺ–į–ļ—ā–ł–≤–Ĺ—č–ľ, –Ĺ–Ķ–Ļ—Ä–ĺ—ā—Ä–ĺ—Ą–ł—á–Ķ—Ā–ļ–ł–ľ –ł –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ł–ľ
–ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ ‚ÄĒ —ć—ā–ĺ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā, –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ—Ź—é—Č–ł–Ļ —Ā–ĺ–Ī–ĺ–Ļ –≥–Ķ–ľ–ĺ–ī–Ķ—Ä–ł–≤–į—ā –ļ—Ä–ĺ–≤–ł —ā–Ķ–Ľ—Ź—ā –ł —Ā–ĺ–ī–Ķ—Ä–∂–į—Č–ł–Ļ –≤ —Ā–Ķ–Ī–Ķ –Ī–ĺ–Ľ–Ķ–Ķ200 –į–ļ—ā–ł–≤–Ĺ—č—Ö –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā–ĺ–≤. –ö –Ĺ–ł–ľ –ĺ—ā–Ĺ–ĺ—Ā—Ź—ā—Ā—Ź –≤–ł—ā–į–ľ–ł–Ĺ—č,
–į–ľ–ł–Ĺ–ĺ–ļ–ł—Ā–Ľ–ĺ—ā—č, –Ľ–ł–Ņ–ł–ī—č, –ĺ–Ľ–ł–≥–ĺ—Ā–į—Ö–į—Ä–ł–ī—č, –Ņ–Ķ–Ņ—ā–ł–ī—č, –Ĺ—É–ļ–Ľ–Ķ–ĺ–∑–ł–ī—č, –ł–Ĺ–ĺ–∑–ł—ā–ĺ–Ľ—Ą–ĺ—Ā—Ą–ĺ–ĺ–Ľ–ł–≥–ĺ—Ā–į—Ö–į—Ä–ł–ī—č,
–į —ā–į–ļ–∂–Ķ —ć–Ľ–Ķ–ļ—ā—Ä–ĺ–Ľ–ł—ā—č (–Ĺ–į—ā—Ä–ł–Ļ, –ļ–į–Ľ—Ć—Ü–ł–Ļ, —Ą–ĺ—Ā—Ą–ĺ—Ä, –ľ–į–≥–Ĺ–ł–Ļ). –°–Ľ–ĺ–∂–Ĺ—č–Ļ –ł –ľ–Ĺ–ĺ–≥–ĺ—Ā—ā—É–Ņ–Ķ–Ĺ—á–į—ā—č–Ļ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–į –≤–ļ–Ľ—é—á–į–Ķ—ā 2 —ć—ā–į–Ņ–į —É–Ľ—Ć—ā—Ä–į—Ą–ł–Ľ—Ć—ā—Ä–į—Ü–ł–ł (–ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ—č–Ļ –≤–Ķ—Ā –ļ–ĺ–Ĺ–Ķ—á–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ–ī—É–ļ—ā–į ‚ȧ5000 –Ē–į), –≤ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ —á–Ķ–≥–ĺ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā –Ĺ–Ķ —Ā–ĺ–ī–Ķ—Ä–∂–ł—ā –Ī–Ķ–Ľ–ļ–ĺ–≤—č—Ö –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ –ł –Ĺ–Ķ –ĺ–Ī–Ľ–į–ī–į–Ķ—ā –į–Ĺ—ā–ł–≥–Ķ–Ĺ–Ĺ—č–ľ–ł –ł –Ņ–ł—Ä–ĺ–≥–Ķ–Ĺ–Ĺ—č–ľ–ł —Ā–≤–ĺ–Ļ—Ā—ā–≤–į–ľ–ł [20].
–ú–Ķ—ā–į–Ī–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ł–Ļ —ć—Ą—Ą–Ķ–ļ—ā –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ–į –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–ł–≤–į–Ķ—ā—Ā—Ź –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ł–ľ–ł —Ā–≤–ĺ–Ļ—Ā—ā–≤–į–ľ–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į. –ü–Ķ—Ä–≤–ĺ–Ķ ‚ÄĒ —ć—ā–ĺ —É–Ľ—É—á—ą–Ķ–Ĺ–ł–Ķ –Ņ–ĺ—Ā—ā—É–Ņ–Ľ–Ķ–Ĺ–ł—Ź –≤ –ļ–Ľ–Ķ—ā–ļ—É –≥–Ľ—é–ļ–ĺ–∑—č, –ļ–ĺ—ā–ĺ—Ä–į—Ź –≤ —É—Ā–Ľ–ĺ–≤–ł—Ź—Ö –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ–į —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –Ķ–ī–ł–Ĺ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–ľ –ł—Ā—ā–ĺ—á–Ĺ–ł–ļ–ĺ–ľ —ć–Ĺ–Ķ—Ä–≥–ł–ł –ī–Ľ—Ź –ľ–ĺ–∑–≥–į. –ė–Ĺ–ĺ–∑–ł—ā–ĺ–Ľ—Ą–ĺ—Ā—Ą–ĺ–ĺ–Ľ–ł–≥–ĺ—Ā–į—Ö–į—Ä–ł–ī—č, —Ā–ĺ–ī–Ķ—Ä–∂–į—Č–ł–Ķ—Ā—Ź –≤ –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ–Ķ, –į–ļ—ā–ł–≤–ł—Ä—É—é—ā –ł–Ĺ—Ā—É–Ľ–ł–Ĺ–ĺ–Ĺ–Ķ–∑–į–≤–ł—Ā–ł–ľ—č–Ķ –Ņ–Ķ—Ä–Ķ–Ĺ–ĺ—Ā—á–ł–ļ–ł –≥–Ľ—é–ļ–ĺ–∑—č (GLUT1, GLUT3) –ł —É—Ā–ł–Ľ–ł–≤–į—é—ā –Ņ–ĺ—Ā—ā—É–Ņ–Ľ–Ķ–Ĺ–ł–Ķ –≥–Ľ—é–ļ–ĺ–∑—č –≤ –ļ–Ľ–Ķ—ā–ļ—É [21, 22]. –Ě–į —Ą–ĺ–Ĺ–Ķ —É—Ā–ł–Ľ–Ķ–Ĺ–ł—Ź –Ņ–ĺ—Ā—ā—É–Ņ–Ľ–Ķ–Ĺ–ł—Ź –≥–Ľ—é–ļ–ĺ–∑—č –ł –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ–į –Ņ–ĺ–≤—č—ą–į–Ķ—ā—Ā—Ź –ł –Ņ–ĺ—ā—Ä–Ķ–Ī–Ľ–Ķ–Ĺ–ł–Ķ –ļ–Ľ–Ķ—ā–ļ–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—Ä–ĺ–ī–į [23]. –ö—Ä–ĺ–ľ–Ķ —ā–ĺ–≥–ĺ, —Ā–ĺ–ī–Ķ—Ä–∂–į—Č–ł–Ķ—Ā—Ź –≤ –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ–Ķ —Ā—É–Ī—Ā—ā—Ä–į—ā—č –ī—č—Ö–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö —Ü–Ķ–Ņ–Ķ–Ļ —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É—é—ā —Ā–ł–Ĺ—ā–Ķ–∑—É –ź–Ę–§ –≤ –ľ–ł—ā–ĺ—Ö–ĺ–Ĺ–ī—Ä–ł—Ź—Ö, –ļ–ĺ—ā–ĺ—Ä—č–Ļ —Ā–ļ–Ľ–į–ī—č–≤–į–Ķ—ā—Ā—Ź –ł–∑ –į—ć—Ä–ĺ–Ī–Ĺ–ĺ–≥–ĺ –≥–Ľ–ł–ļ–ĺ–Ľ–ł–∑–į, —Ü–ł–ļ–Ľ–į –ö—Ä–Ķ–Ī—Ā–į –ł –ĺ–ļ–ł—Ā–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ —Ą–ĺ—Ā—Ą–ĺ—Ä–ł–Ľ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź [24].
–ź–Ĺ–≥–ł–ĺ–Ņ—Ä–ĺ—ā–Ķ–ļ—ā–ł–≤–Ĺ—č–Ļ —ć—Ą—Ą–Ķ–ļ—ā –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ–į –∑–į–ļ–Ľ—é—á–į–Ķ—ā—Ā—Ź –≤ —É–Ľ—É—á—ą–Ķ–Ĺ–ł–ł –ľ–ł–ļ—Ä–ĺ—Ü–ł—Ä–ļ—É–Ľ—Ź—Ü–ł–ł –Ī–Ķ–∑ –≤–Ľ–ł—Ź–Ĺ–ł—Ź –Ĺ–į —Ā–ł—Ā—ā–Ķ–ľ–Ĺ—č–Ļ –ļ—Ä–ĺ–≤–ĺ—ā–ĺ–ļ –ł –ź–Ē. –≠—ā–ĺ —Ā–≤—Ź–∑–į–Ĺ–ĺ —Ā —ā–Ķ–ľ, —á—ā–ĺ –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ —É–Ľ—É—á—ą–į–Ķ—ā –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—á–Ķ—Ā–ļ—É—é –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ľ–ł–ļ—Ä–ĺ—Ā–ĺ—Ā—É–ī–ł—Ā—ā–ĺ–≥–ĺ —ć–Ĺ–ī–ĺ—ā–Ķ–Ľ–ł—Ź, –ĺ–ļ–į–∑—č–≤–į—Ź —ć–Ĺ–ī–ĺ—ā–Ķ–Ľ–ł–ĺ–Ņ—Ä–ĺ—ā–Ķ–ļ—ā–ĺ—Ä–Ĺ–ĺ–Ķ –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ –Ĺ–į —É—Ä–ĺ–≤–Ĺ–Ķ –≤—Ā–Ķ—Ö —Ā–ĺ—Ā—É–ī–ĺ–≤ –ľ–ł–ļ—Ä–ĺ—Ü–ł—Ä–ļ—É–Ľ—Ź—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ —Ä—É—Ā–Ľ–į. –í –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į—ā–Ķ–Ľ—Ć—Ā–ļ–ł—Ö —Ä–į–Ī–ĺ—ā–į—Ö –ź. –ź. –§–Ķ–ī–ĺ—Ä–ĺ–≤–ł—á–į [25, 26] –ĺ—ā–ľ–Ķ—á–į–Ľ–ĺ—Ā—Ć, —á—ā–ĺ –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ —Ā–Ĺ–ł–∂–į–Ķ—ā —ā–ĺ–Ĺ—É—Ā –Ņ—Ä–Ķ–ļ–į–Ņ–ł–Ľ–Ľ—Ź—Ä–Ĺ—č—Ö –į—Ä—ā–Ķ—Ä–ł–ĺ–Ľ, –į —ā–į–ļ–∂–Ķ —É–≤–Ķ–Ľ–ł—á–ł–≤–į–Ķ—ā —Ā–ļ–ĺ—Ä–ĺ—Ā—ā—Ć –ļ–į–Ņ–ł–Ľ–Ľ—Ź—Ä–Ĺ–ĺ–≥–ĺ –ļ—Ä–ĺ–≤–ĺ—ā–ĺ–ļ–į. –†–Ķ–∑—É–Ľ—Ć—ā–į—ā–į–ľ–ł —ć—ā–ĺ–≥–ĺ –≤–ĺ–∑–ī–Ķ–Ļ—Ā—ā–≤–ł—Ź —Ā—ā–į–Ľ–ł —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –Ņ–Ľ–ĺ—ā–Ĺ–ĺ—Ā—ā–ł –ļ–į–Ņ–ł–Ľ–Ľ—Ź—Ä–Ĺ–ĺ–≥–ĺ —Ä—É—Ā–Ľ–į –ł —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł–Ķ —ā–ĺ–Ľ—Č–ł–Ĺ—č –Ņ–Ķ—Ä–ł–ļ–į–Ņ–ł–Ľ–Ľ—Ź—Ä–Ĺ–ĺ–Ļ –∑–ĺ–Ĺ—č (—Ä–ł—Ā. 3).
![–†–ł—Ā. 3. –†–į–∑–ľ–Ķ—Ä –Ņ–Ķ—Ä–ł–ļ–į–Ņ–ł–Ľ–Ľ—Ź—Ä–Ĺ–ĺ–Ļ –∑–ĺ–Ĺ—č: –į ‚Äď –ł—Ā—Ö–ĺ–ī–Ĺ—č–Ļ; –Ī ‚Äď —á–Ķ—Ä–Ķ–∑ 2 —á –Ņ–ĺ—Ā–Ľ–Ķ –ĺ–ļ–ĺ–Ĺ—á–į–Ĺ–ł—Ź –ł–Ĺ—Ą—É–∑–ł–ł –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ–į [25] –†–ł—Ā. 3. –†–į–∑–ľ–Ķ—Ä –Ņ–Ķ—Ä–ł–ļ–į–Ņ–ł–Ľ–Ľ—Ź—Ä–Ĺ–ĺ–Ļ –∑–ĺ–Ĺ—č: –į ‚Äď –ł—Ā—Ö–ĺ–ī–Ĺ—č–Ļ; –Ī ‚Äď —á–Ķ—Ä–Ķ–∑ 2 —á –Ņ–ĺ—Ā–Ľ–Ķ –ĺ–ļ–ĺ–Ĺ—á–į–Ĺ–ł—Ź –ł–Ĺ—Ą—É–∑–ł–ł –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ–į [25]](/upload/medialibrary/10c/15-4.png)
–Ě–Ķ–Ļ—Ä–ĺ–Ņ—Ä–ĺ—ā–Ķ–ļ—ā–ł–≤–Ĺ—č–Ļ —ć—Ą—Ą–Ķ–ļ—ā –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ–į –≤—č—Ä–į–∂–į–Ķ—ā—Ā—Ź –≤ —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ—Ā—ā–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į —É–≤–Ķ–Ľ–ł—á–ł–≤–į—ā—Ć –≤—č–∂–ł–≤–į–Ķ–ľ–ĺ—Ā—ā—Ć –Ĺ–Ķ–Ļ—Ä–ĺ–Ĺ–ĺ–≤ –∑–į —Ā—á–Ķ—ā —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź —É—Ä–ĺ–≤–Ĺ—Ź –ľ–į—Ä–ļ–Ķ—Ä–ĺ–≤ –ł–Ĺ–ī—É–ļ—Ü–ł–ł –į–Ņ–ĺ–Ņ—ā–ĺ–∑–į (–ļ–į—Ā–Ņ–į–∑—č-3) –ł –ĺ–Ī—Ä–į–∑–ĺ–≤–į–Ĺ–ł—Ź –į–ļ—ā–ł–≤–Ĺ—č—Ö —Ą–ĺ—Ä–ľ –ļ–ł—Ā–Ľ–ĺ—Ä–ĺ–ī–į –≤ –ļ–Ľ–Ķ—ā–ļ–į—Ö, –Ņ—Ä–ł—á–Ķ–ľ —ć—ā–ł —ć—Ą—Ą–Ķ–ļ—ā—č –Ĺ–ĺ—Ā—Ź—ā —á–Ķ—ā–ļ–ł–Ļ –ī–ĺ–∑–ĺ–∑–į–≤–ł—Ā–ł–ľ—č–Ļ —Ö–į—Ä–į–ļ—ā–Ķ—Ä [27‚Äď29].
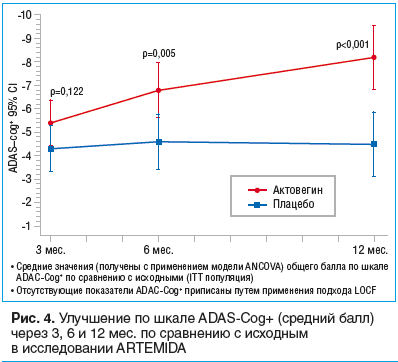
–≠—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ–į –≤ —Ä–į–Ī–ĺ—ā–į—Ö in vitro –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–į–Ķ—ā—Ā—Ź –ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ–ł –ī–į–Ĺ–Ĺ—č–ľ–ł. –Ę–į–ļ, –≤ –ļ—Ä—É–Ņ–Ĺ–ĺ–ľ –ľ—É–Ľ—Ć—ā–ł—Ü–Ķ–Ĺ—ā—Ä–ĺ–≤–ĺ–ľ —Ä–į–Ĺ–ī–ĺ–ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł ARTEMIDA –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ĺ—Ā—Ć —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł–Ķ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ–ĺ–Ļ —Ą—É–Ĺ–ļ—Ü–ł–ł —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö, –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā—ą–ł—Ö –ł–Ĺ—Ā—É–Ľ—Ć—ā –ł –Ņ–ĺ–Ľ—É—á–į–≤—ą–ł—Ö –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –Ņ–ĺ–Ľ—É–≥–ĺ–ī–į –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ –≤ –ī–ĺ–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ł–Ķ –ļ —Ā—ā–į–Ĺ–ī–į—Ä—ā–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł, –ł —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –Ņ–ĺ–Ľ—É—á–į–≤—ą–ł—Ö –Ņ–Ľ–į—Ü–Ķ–Ī–ĺ –ł —ā–Ķ—Ä–į–Ņ–ł—é –Ņ–ĺ —Ā—ā–į–Ĺ–ī–į—Ä—ā–Ĺ–ĺ–Ļ —Ā—Ö–Ķ–ľ–Ķ –Ī–Ķ–∑ –ī–ĺ–Ī–į–≤–Ľ–Ķ–Ĺ–ł—Ź –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ–į. –ü–ĺ—Ā–Ľ–Ķ 6 –ľ–Ķ—Ā. —ā–Ķ—Ä–į–Ņ–ł–ł –Ī—č–Ľ–ĺ —É—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–ĺ –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ–Ķ —É–Ľ—É—á—ą–Ķ–Ĺ–ł–Ķ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ–ĺ–Ļ —Ą—É–Ĺ–ļ—Ü–ł–ł –Ņ–ĺ —ą–ļ–į–Ľ–Ķ ADAS-Cog+ (p=0,005); —Ä–į–∑–Ĺ–ł—Ü–į –ľ–Ķ–∂–ī—É –≥—Ä—É–Ņ–Ņ–į–ľ–ł —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–į 2,3 –Ī–į–Ľ–Ľ–į –≤ –Ņ–ĺ–Ľ—Ć–∑—É –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ. –°–Ņ—É—Ā—ā—Ź –Ķ—Č–Ķ 6 –ľ–Ķ—Ā. –Ņ–ĺ—Ā–Ľ–Ķ –ĺ—ā–ľ–Ķ–Ĺ—č –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź —ć—ā–ł —Ä–į–∑–Ľ–ł—á–ł—Ź —Ā—ā–į–Ľ–ł –Ķ—Č–Ķ –Ī–ĺ–Ľ–Ķ–Ķ –∑–Ĺ–į—á–ł–ľ—č–ľ–ł (—Ä<0,001), —Ä–į–∑–Ĺ–ł—Ü–į –ľ–Ķ–∂–ī—É –≥—Ä—É–Ņ–Ņ–į–ľ–ł ‚ÄĒ 3,7 –Ī–į–Ľ–Ľ–į. –ü—Ä–ł–ľ–Ķ—á–į—ā–Ķ–Ľ—Ć–Ĺ–ĺ, —á—ā–ĺ –≤ –≥—Ä—É–Ņ–Ņ–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö, –Ņ–ĺ–Ľ—É—á–į–≤—ą–ł—Ö –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ, —É–Ľ—É—á—ą–Ķ–Ĺ–ł–Ķ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ–ĺ–Ļ —Ą—É–Ĺ–ļ—Ü–ł–ł –Ņ—Ä–ĺ–ī–ĺ–Ľ–∂–į–Ľ–ĺ—Ā—Ć –ł –Ņ–ĺ—Ā–Ľ–Ķ –Ņ—Ä–Ķ–ļ—Ä–į—Č–Ķ–Ĺ–ł—Ź —ā–Ķ—Ä–į–Ņ–ł–ł, —Ā–Ņ—É—Ā—ā—Ź 1 –≥–ĺ–ī –ĺ—ā –Ĺ–į—á–į–Ľ–į —ā–Ķ—Ä–į–Ņ–ł–ł –ĺ–Ĺ–ĺ –Ī—č–Ľ–ĺ –Ķ—Č–Ķ –Ī–ĺ–Ľ–Ķ–Ķ –∑–į–ľ–Ķ—ā–Ĺ—č–ľ –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā –≥—Ä—É–Ņ–Ņ–ĺ–Ļ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź (—Ä–ł—Ā. 4). –ö—Ä–ĺ–ľ–Ķ —ā–ĺ–≥–ĺ, –≤ —Ü–Ķ–Ľ–ĺ–ľ –ļ 6-–ľ—É –ł 12-–ľ—É –ľ–Ķ—Ā. –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –ī–ł–į–≥–Ĺ–ĺ–∑–ĺ–ľ ¬ę–ī–Ķ–ľ–Ķ–Ĺ—Ü–ł—Ź¬Ľ –Ī—č–Ľ–ĺ –Ĺ–į 30% –Ĺ–ł–∂–Ķ –≤ –≥—Ä—É–Ņ–Ņ–Ķ –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ–į, —á–Ķ–ľ –≤ –≥—Ä—É–Ņ–Ņ–Ķ –Ņ–Ľ–į—Ü–Ķ–Ī–ĺ (6-–Ļ –ľ–Ķ—Ā.: 10,5 –ł 7,3% —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ; 12-–Ļ –ľ–Ķ—Ā.: 12,7 –ł 8,7% —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ). –•–ĺ—ā—Ź –ī–į–Ĺ–Ĺ—č–Ķ –ł –Ĺ–Ķ –ī–ĺ—Ā—ā–ł–≥–Ľ–ł —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ—Ā—ā–ł, –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā –Ņ–ĺ–ļ–į–∑–į–Ľ —Ö–ĺ—Ä–ĺ—ą–ł–Ļ –Ņ–ĺ—ā–Ķ–Ĺ—Ü–ł–į–Ľ –≤ —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ—Ā—ā–ł –Ņ—Ä–Ķ–ī–ĺ—ā–≤—Ä–į—Č–į—ā—Ć –ī–Ķ–ľ–Ķ–Ĺ—Ü–ł—é —É —ć—ā–ĺ–Ļ –ļ–į—ā–Ķ–≥–ĺ—Ä–ł–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ [17].
–ü–ĺ–Ľ–ĺ–∂–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ–į –Ĺ–į –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č–Ķ —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ—Ā—ā–ł –ł —É—Ā—ā–ĺ–Ļ—á–ł–≤–ĺ—Ā—ā—Ć –≤–Ĺ–ł–ľ–į–Ĺ–ł—Ź –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –ď–Ď –ł –ė–Ď–° –Ī—č–Ľ–ĺ –Ņ–ĺ–ļ–į–∑–į–Ĺ–ĺ –≤ —Ä–į–Ī–ĺ—ā–Ķ –ź. –ź. –§–Ķ–ī–ĺ—Ä–ĺ–≤–ł—á–į –ł —Ā–ĺ–į–≤—ā. [30] –Ĺ–į –Ņ—Ä–ł–ľ–Ķ—Ä–Ķ —Ā–ļ–ĺ—Ä–ĺ—Ā—ā–ł —Ä–į–Ī–ĺ—ā—č –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā —ā–į–Ī–Ľ–ł—Ü–į–ľ–ł –®—É–Ľ—Ć—ā–Ķ. –í —Ä–į–Ī–ĺ—ā–Ķ –ě. –Ē. –ě—Ā—ā—Ä–ĺ—É–ľ–ĺ–≤–ĺ–Ļ [31] –ł —Ā–ĺ–į–≤—ā. —ā–Ķ—Ä–į–Ņ–ł—Ź –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ–ĺ–ľ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ, –≤–ĺ–∑–Ĺ–ł–ļ—ą–ł—Ö –Ĺ–į —Ą–ĺ–Ĺ–Ķ –ź–ď, –Ņ—Ä–ł–≤–ĺ–ī–ł–Ľ–į –ļ —Ā—É–Ī—ä–Ķ–ļ—ā–ł–≤–Ĺ–ĺ–ľ—É –ł –ĺ–Ī—ä–Ķ–ļ—ā–ł–≤–Ĺ–ĺ–ľ—É —É–Ľ—É—á—ą–Ķ–Ĺ–ł—é –Ņ–į–ľ—Ź—ā–ł –ł –≤–Ĺ–ł–ľ–į–Ĺ–ł—Ź, –ļ–ĺ—ā–ĺ—Ä–ĺ–Ķ —Ā–ĺ—Ö—Ä–į–Ĺ—Ź–Ľ–ĺ—Ā—Ć –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 6 –ľ–Ķ—Ā. –Ņ–ĺ—Ā–Ľ–Ķ –ĺ–ļ–ĺ–Ĺ—á–į–Ĺ–ł—Ź –Ņ—Ä–ł–Ķ–ľ–į –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į.
–ó–į–ļ–Ľ—é—á–Ķ–Ĺ–ł–Ķ
–Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ–į —Ā—ā–į—Ä–Ķ–Ĺ–ł—Ź –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź –ł —ą–ł—Ä–ĺ–ļ–ĺ–≥–ĺ —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–ł—Ź –ļ–ĺ–ľ–ĺ—Ä–Ī–ł–ī–Ĺ–ĺ—Ā—ā–ł, –≤ —ā. —á. —Ā –Ĺ–į–Ľ–ł—á–ł–Ķ–ľ –•–ė–ď–ú, —ā—Ä–Ķ–Ī—É–Ķ—ā –ľ—É–Ľ—Ć—ā–ł–ī–ł—Ā—Ü–ł–Ņ–Ľ–ł–Ĺ–į—Ä–Ĺ–ĺ–≥–ĺ –Ņ–ĺ–ī—Ö–ĺ–ī–į, –≥–ī–Ķ –≤–Ķ–ī—É—Č–į—Ź —Ä–ĺ–Ľ—Ć –ĺ—ā–≤–ĺ–ī–ł—ā—Ā—Ź —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–į–ľ, –≤—Ä–į—á–į–ľ –ĺ–Ī—Č–Ķ–Ļ –Ņ—Ä–į–ļ—ā–ł–ļ–ł –ł –Ĺ–Ķ–≤—Ä–ĺ–Ľ–ĺ–≥–į–ľ. –ü—Ä–ł—á–Ķ–ľ –Ĺ–Ķ—Ä–Ķ–ī–ļ–ĺ —Ā–≤–ĺ–Ķ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–į—Ź –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–į –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤ –ł –Ĺ–į—á–į–Ľ–ĺ —ā–Ķ—Ä–į–Ņ–ł–ł –≤—Ā–Ķ—Ü–Ķ–Ľ–ĺ –∑–į–≤–ł—Ā—Ź—ā –ĺ—ā –Ĺ–į—Ā—ā–ĺ—Ä–ĺ–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ĺ–≤ –ł –≤—Ä–į—á–Ķ–Ļ –ĺ–Ī—Č–Ķ–Ļ –Ņ—Ä–į–ļ—ā–ł–ļ–ł –≤ –ĺ—ā–Ĺ–ĺ—ą–Ķ–Ĺ–ł–ł –•–ė–ď–ú –≤ —á–į—Ā—ā–Ĺ–ĺ—Ā—ā–ł –ł –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤ –≤ —Ü–Ķ–Ľ–ĺ–ľ.–ü—Ä–ł —ć—ā–ĺ–ľ —ā–Ķ—Ä–į–Ņ–ł—Ź –Ņ–ĺ–ī–ĺ–Ī–Ĺ—č—Ö —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤ —Ā–ļ–Ľ–į–ī—č–≤–į–Ķ—ā—Ā—Ź –ł–∑ —ā—Ä–Ķ—Ö –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā–ĺ–≤: –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ –ĺ—Ā–Ĺ–ĺ–≤–Ĺ–ĺ–≥–ĺ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź, –Ĺ–Ķ–ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ–į—Ź —ā–Ķ—Ä–į–Ņ–ł—Ź, –Ĺ–į–Ņ—Ä–į–≤–Ľ–Ķ–Ĺ–Ĺ–į—Ź –Ĺ–į —É–Ľ—É—á—ą–Ķ–Ĺ–ł–Ķ –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č—Ö —Ą—É–Ĺ–ļ—Ü–ł–Ļ, –ł —ā–Ķ—Ä–į–Ņ–ł—Ź –Ĺ–Ķ–Ļ—Ä–ĺ–Ņ—Ä–ĺ—ā–Ķ–ļ—ā–ĺ—Ä–Ĺ—č–ľ–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł. –°—Ä–Ķ–ī–ł –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö —Ā—Ä–Ķ–ī—Ā—ā–≤ —Ā –Ĺ–Ķ–Ļ—Ä–ĺ–Ņ—Ä–ĺ—ā–Ķ–ļ—ā–ł–≤–Ĺ—č–ľ–ł —Ā–≤–ĺ–Ļ—Ā—ā–≤–į–ľ–ł –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —É–Ĺ–ł–ļ–į–Ľ—Ć–Ĺ—č–ľ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–ľ –Ī–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–∂–ī–Ķ–Ĺ–ł—Ź, –ļ–ĺ—ā–ĺ—Ä—č–Ļ –ľ–ĺ–∂–Ķ—ā –ĺ–ļ–į–∑—č–≤–į—ā—Ć –ľ–Ĺ–ĺ–∂–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ķ –≤–ĺ–∑–ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ –ļ–į–ļ –Ĺ–į –ľ–ł–ļ—Ä–ĺ—Ü–ł—Ä–ļ—É–Ľ—Ź—Ü–ł—é, —ā–į–ļ –ł –Ĺ–į –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ—č–Ķ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā—č –ł —Ä–Ķ–≥—É–Ľ—Ź—Ü–ł—é –į–Ņ–ĺ–Ņ—ā–ĺ–∑–į –Ĺ–Ķ–Ļ—Ä–ĺ–Ĺ–ĺ–≤, –≤ –ł—ā–ĺ–≥–Ķ —É–Ľ—É—á—ą–į—ā—Ć –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č–Ķ —Ą—É–Ĺ–ļ—Ü–ł–ł –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā —Ā–ĺ—Ā—É–ī–ł—Ā—ā—č–ľ–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź–ľ–ł –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į. –° —É—á–Ķ—ā–ĺ–ľ –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł—Ź –≤–Ľ–ł—Ź–Ĺ–ł—Ź –Ĺ–į –ź–Ē –ł –≤—č—Ā–ĺ–ļ–ł–ľ –Ņ—Ä–ĺ—Ą–ł–Ľ–Ķ–ľ –Ī–Ķ–∑–ĺ–Ņ–į—Ā–Ĺ–ĺ—Ā—ā–ł —ć—ā–ĺ —Ā–ĺ–∑–ī–į–Ķ—ā —ą–ł—Ä–ĺ–ļ–ł–Ķ –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā–ł –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –ź–ļ—ā–ĺ–≤–Ķ–≥–ł–Ĺ–į –≤ —ā–Ķ—Ä–į–Ņ–ł–ł –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –•–ė–ď–ú.
–° —É—á–Ķ—ā–ĺ–ľ –ł–∑–Ľ–ĺ–∂–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ —Ā—ā–į–Ĺ–ĺ–≤–ł—ā—Ā—Ź –Ņ–ĺ–Ĺ—Ź—ā–Ĺ–ĺ, —á—ā–ĺ —Ä–į–Ĺ–Ĺ—Ź—Ź –Ņ–ĺ–Ľ–Ĺ–ĺ—Ü–Ķ–Ĺ–Ĺ–į—Ź –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–į –•–ė–ď–ú –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–į –ł –ļ—Ä–į–Ļ–Ĺ–Ķ –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–į, —ā. –ļ. –ł–ľ–Ķ–Ĺ–Ĺ–ĺ –Ĺ–į —Ä–į–Ĺ–Ĺ–ł—Ö —Ā—ā–į–ī–ł—Ź—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –ł –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–Ķ–Ĺ–ł–Ķ –į–ī–Ķ–ļ–≤–į—ā–Ĺ–ĺ–Ļ —ā–į–ļ—ā–ł–ļ–ł –≤–Ķ–ī–Ķ–Ĺ–ł—Ź –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź—ā —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –Ņ—Ä–ĺ–ī–Ľ–ł—ā—Ć –Ņ–Ķ—Ä–ł–ĺ–ī –Ķ–≥–ĺ –ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ–ĺ–Ļ —Ā–ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –ł —É–Ľ—É—á—ą–ł—ā—Ć –ļ–į—á–Ķ—Ā—ā–≤–ĺ –∂–ł–∑–Ĺ–ł.












