–†–∞–Ј–≤–Є—В–Є–µ —Н—В–Є—Е —Н–Љ–±–Њ–ї–Є–є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ, —Г–ґ–µ –Є–Љ–µ—О—Й–Є–Љ—Б—П –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є –љ–∞ —Д–Њ–љ–µ —В—П–ґ–µ–ї—Л—Е —Д–Њ—А–Љ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, –Ї–Њ—В–Њ—А–∞—П –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Г –±–Њ–ї—М–љ—Л—Е —Б —Б–Є—Б—В–µ–Љ–љ—Л–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ, —В—П–ґ–µ–ї—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є –Р–У –Є –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ –°–Ф2. –Ф–ї—П —В–∞–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –Є—Б—В–Њ—Й–µ–љ–Є–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞ —Б–Є—Б—В–µ–Љ—Л –≥–µ–Љ–Њ—Б—В–∞–Ј–∞, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —З–µ–≥–Њ –Њ–љ–Є –µ—Й–µ –і–Њ —А–∞–Ј–≤–Є—В–Є—П –Є–љ—Б—Г–ї—М—В–∞ –Є–Љ–µ—О—В —В—П–ґ–µ–ї—Л–µ —Д–Њ—А–Љ—Л —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ф–Т–°. –Я—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ –љ–∞—З–∞—В–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Н—В–Њ –±—Л—Б—В—А–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–≤–Є—В–Є—О –Ґ–≠–Ы–Р. –Ю–і–љ–∞–Ї–Њ –љ–∞–Є–±–Њ–ї—М—И–µ–µ —З–Є—Б–ї–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤ –≤–Є–і–µ –Ґ–≠–Ы–Р –Є –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –і—А—Г–≥–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Њ—В–Љ–µ—З–∞–µ—В—Б—П –≤ –±–Њ–ї–µ–µ –њ–Њ–Ј–і–љ–Є–µ —Б—А–Њ–Ї–Є, –≤–Ї–ї—О—З–∞—П –Є –±–ї–Є–ґ–∞–є—И–Є–µ –Љ–µ—Б—П—Ж—Л –њ–Њ—Б–ї–µ –≤—Л–њ–Є—Б–Ї–Є –Є–Ј —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞. –Ґ–∞–Ї, –љ–∞ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ—Л–є –њ–µ—А–Є–Њ–і –Є–љ—Б—Г–ї—М—В–∞ –њ—А–Є—Е–Њ–і–Є—В—Б—П 19% —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –Є –Ґ–≠–Ы–Р. –Я–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П 2218 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —В—А–Њ–Љ–±–Њ–Ј–Њ–Љ –≥–ї—Г–±–Њ–Ї–Є—Е –≤–µ–љ (–Ґ–У–Т) –Є –Ґ–≠–Ы–Р, —Б–Љ–µ—А—В–љ–Њ—Б—В—М —З–µ—А–µ–Ј 30 —Б—Г—В. –њ–Њ—Б–ї–µ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 28%, –∞ —З–µ—А–µ–Ј 1 –≥–Њ–і – 36% [6, 7].
–Ч–љ–∞—З–Є—В–µ–ї—М–љ—Г—О –ї–µ–њ—В—Г –≤ —Н—В—Г –њ–µ—З–∞–ї—М–љ—Г—О —Б—В–∞—В–Є—Б—В–Є–Ї—Г –≤–љ–Њ—Б—П—В –Љ–љ–Њ–≥–Є–µ —Д–∞–Ї—В–Њ—А—Л, –Ї –Ї–Њ—В–Њ—А—Л–Љ –Љ–Њ–ґ–љ–Њ –Њ—В–љ–µ—Б—В–Є: –≤—Л–љ—Г–ґ–і–µ–љ–љ—Л–є –і–ї–Є—В–µ–ї—М–љ—Л–є –њ–Њ—Б—В–µ–ї—М–љ—Л–є —А–µ–ґ–Є–Љ, –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –Є–љ—Д—Г–Ј–Є–Є –Є —А–∞–љ–љ–µ–є –∞–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–Є, –Ї–ї–µ—В–Њ—З–љ—Л–є —Н–љ–µ—А–≥–Њ–і–µ—Д–Є—Ж–Є—В, —Е–∞—А–∞–Ї—В–µ—А–љ—Л–є –і–ї—П –±–Њ–ї—М–љ—Л—Е —Б —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –Ї–Њ–Љ–Њ—А–±–Є–і–љ–Њ—Б—В—М—О, –љ–∞ —Д–Њ–љ–µ –Ї–Њ—В–Њ—А–Њ–є –Њ–±—Л—З–љ–Њ –Є —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Є–љ—Б—Г–ї—М—В. –Ъ–∞–ґ–і—Л–є –Є–Ј —Н—В–Є—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤, –∞ —В–µ–Љ –±–Њ–ї–µ–µ –Є—Е —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В—М, —Г—Б—Г–≥—Г–±–ї—П–µ—В –њ—А–Њ—П–≤–ї–µ–љ–Є—П —Б–Є–љ–і—А–Њ–Љ–∞ –≥–Є–њ–µ—А–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є, —Е–∞—А–∞–Ї—В–µ—А–љ–Њ–≥–Њ –і–ї—П —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Љ–љ–Њ–≥–Њ—Д–Њ–Ї—Г—Б–љ—Л—Е –Љ–µ–ї–Ї–Њ–Њ—З–∞–≥–Њ–≤—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤.
–°–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Ґ–≠–Ы–Р —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–љ—Б—Г–ї—М—В–Њ–Љ –Њ—Б–ї–Њ–ґ–љ—П–µ—В—Б—П —В—П–ґ–µ—Б—В—М—О –Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П, —Г–≥–љ–µ—В–µ–љ–Є–µ–Љ —Б–Њ–Ј–љ–∞–љ–Є—П, —З–∞—Б—В—Л–Љ –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ–≥–Њ —Б–±–Њ—А–∞ –∞–љ–∞–Љ–љ–µ–Ј–∞ –Є –Њ—Ж–µ–љ–Ї–Є –ґ–∞–ї–Њ–± –љ–∞ —Д–Њ–љ–µ –∞—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤, –љ–Њ –≥–ї–∞–≤–љ–Њ–µ – –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –љ–∞—Б—В–Њ—А–Њ–ґ–µ–љ–љ–Њ—Б—В–Є –≤—А–∞—З–µ–є-–љ–µ–≤—А–Њ–ї–Њ–≥–Њ–≤ –≤ –њ–ї–∞–љ–µ –Њ–±—Б—Г–ґ–і–∞–µ–Љ–Њ–є –њ—А–Њ–±–ї–µ–Љ—Л. –Ш –µ—Б–ї–Є –Љ–∞—Б—Б–Є–≤–љ–∞—П —Н–Љ–±–Њ–ї–Є—П —Б—В–≤–Њ–ї–∞ –ї–µ–≥–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –±—Л—Б—В—А–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –ї–µ—В–∞–ї—М–љ–Њ–Љ—Г –Є—Б—Е–Њ–і—Г –Є –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П –і–∞–љ–љ—Л–Љ–Є —Б–µ–Ї—Ж–Є–Є, —В–Њ –Њ–Ї–Ї–ї—О–Ј–Є—П –µ–µ –Љ–µ–ї–Ї–Є—Е –≤–µ—В–≤–µ–є –Љ–Њ–ґ–µ—В –њ—А–Њ—В–µ–Ї–∞—В—М –њ–Њ–і —Б–∞–Љ—Л–Љ–Є —А–∞–Ј–љ—Л–Љ–Є –Љ–∞—Б–Ї–∞–Љ–Є, —Б–∞–Љ–Њ–є —З–∞—Б—В–Њ–є –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —Б—В–∞–љ–Њ–≤–Є—В—Б—П –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П –њ–љ–µ–≤–Љ–Њ–љ–Є—П.
–Ц–µ–ї–∞–љ–Є–µ–Љ –±–Њ–ї–µ–µ —В–Њ—З–љ–Њ –њ–Њ–љ—П—В—М –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —А–∞–Ј–≤–Є—В–Є—П –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ, –∞ —В–∞–Ї–ґ–µ –њ–Њ–Є—Б–Ї–Њ–Љ –њ—Г—В–µ–є —Г–ї—Г—З—И–µ–љ–Є—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Е –ї–µ—З–µ–љ–Є—П –Њ–±—К—П—Б–љ—П–µ—В—Б—П –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Љ–µ—В–Њ–і–Њ–Љ —Б–ї—Г—З–∞–є–љ–Њ–є –≤—Л–±–Њ—А–Ї–Є –∞–љ–∞–ї–Є–Ј–∞ 975 –Є—Б—В–Њ—А–Є–є –±–Њ–ї–µ–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Њ—Е–Њ–і–Є–≤—И–Є—Е –ї–µ—З–µ–љ–Є–µ –≤ –†–µ–≥–Є–Њ–љ–∞–ї—М–љ–Њ–Љ —Б–Њ—Б—Г–і–Є—Б—В–Њ–Љ —Ж–µ–љ—В—А–µ –і–ї—П –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б—В—А—Л–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ –љ–∞ –±–∞–Ј–µ –У–Ъ–С вДЦ 15 –Є–Љ. –Ю.–Ь. –§–Є–ї–∞—В–Њ–≤–∞ (–Ь–Њ—Б–Ї–≤–∞). –Р–љ–∞–ї–Є–Ј –Є—Б—В–Њ—А–Є–є –њ—А–Њ–≤–µ–і–µ–љ –Ј–∞ –њ–µ—А–Є–Њ–і 2011–2012 –≥–≥. –° —Г—З–µ—В–Њ–Љ —В–Њ–≥–Њ, —З—В–Њ —З–Є—Б–ї–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В—А—Л–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ, –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –≤ –У–Ъ–С вДЦ 15, —Б–Њ—Б—В–∞–≤–ї—П–ї–Њ –≤ 2011 –≥. 2008, –∞ –≤ 2012 – 2019 —З–µ–ї–Њ–≤–µ–Ї, —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –љ–∞ –і–∞–љ–љ—Л–є –Љ–Њ–Љ–µ–љ—В –љ–∞–Љ —Г–і–∞–ї–Њ—Б—М –њ—А–Њ–≤–µ—Б—В–Є –∞–љ–∞–ї–Є–Ј —В–Њ–ї—М–Ї–Њ 24,2% –Є—Б—В–Њ—А–Є–є, –Є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 6 –Љ–µ—Б. –љ–∞–Љ–Є –±—Л–ї–∞ –њ—А–Њ—Б–ї–µ–ґ–µ–љ–∞ —Б—Г–і—М–±–∞ 204 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤—Л–њ–Є—Б–∞–љ–љ—Л—Е –Є–Ј —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞ –њ–Њ—Б–ї–µ –Њ—Б—В—А–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞.
–Ш–Ј—Г—З–µ–љ–Є–µ –Ї–∞—В–∞–Љ–љ–µ–Ј–∞ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –њ–Њ –і–∞–љ–љ—Л–Љ –∞–љ–∞–ї–Є–Ј–∞ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е –Ї–∞—А—В, —В–µ–ї–µ—Д–Њ–љ–љ—Л—Е –Є–љ—В–µ—А–≤—М—О –Є –Є—Б—В–Њ—А–Є–є –±–Њ–ї–µ–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–Љ–µ—Й–µ–љ–љ—Л—Е –≤ —А–∞–Ј–љ—Л–µ —Б—А–Њ–Ї–Є –њ–Њ—Б–ї–µ –Є–љ—Б—Г–ї—М—В–∞ –≤ –њ–∞–љ—Б–Є–Њ–љ–∞—В –і–ї—П –≤–µ—В–µ—А–∞–љ–Њ–≤ —В—А—Г–і–∞ вДЦ 9 –≥. –Ь–Њ—Б–Ї–≤—Л. –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –±–Њ–ї—М–љ—Л—Е —Б –Є–љ—Б—Г–ї—М—В–Њ–Љ —Б–Њ—Б—В–∞–≤–Є–ї 71,1±12,3 –≥–Њ–і–∞. –£ –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –і–∞–љ–љ—Л—Е –∞–љ–∞–Љ–љ–µ–Ј–∞, –ґ–∞–ї–Њ–±, –Ї–ї–Є–љ–Є–Ї–Є –Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Ъ–Ґ –Љ–Њ–Ј–≥–∞, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–є –≤ –Љ–Њ–Љ–µ–љ—В –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є, –±—Л–ї –њ–Њ—Б—В–∞–≤–ї–µ–љ –і–Є–∞–≥–љ–Њ–Ј –Є–љ—Д–∞—А–Ї—В–∞ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ (I63.0 –њ–Њ –Ь–Ъ–С 10). –°—А–Њ–Ї–Є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –±–Њ–ї—М–љ—Л—Е –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –њ–Њ—П–≤–ї–µ–љ–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є–љ—Б—Г–ї—М—В–∞ —Б–Њ—Б—В–∞–≤–Є–ї–Є –Њ—В 4 –і–Њ 26 —З. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Њ–Ј–≥–∞ –њ–Њ–ї—Г—И–∞—А–љ—Л–є –Њ—З–∞–≥ –±—Л–ї —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ —Г 67% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –∞ –≤–µ—А—В–µ–±—А–∞–ї—М–љ–Њ-–±–∞–Ј–Є–ї—П—А–љ—Л–є, –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –≤ —Б–Є—Б—В–µ–Љ–µ –Ј–∞–і–љ–Є—Е –Љ–Њ–Ј–≥–Њ–≤—Л—Е –∞—А—В–µ—А–Є–є, – —Г 33%.
–Р–љ–∞–ї–Є–Ј —А–∞–Ј–Љ–µ—А–Њ–≤ –Њ—З–∞–≥–Њ–≤ —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–є –Є—И–µ–Љ–Є–Є –њ–Њ –і–∞–љ–љ—Л–Љ –Ъ–Ґ –њ–Њ–Ј–≤–Њ–ї–Є–ї –≤—Л—П–≤–Є—В—М —А–∞–Ј–ї–Є—З–љ—Г—О –Є—Е —З–∞—Б—В–Њ—В—Г, –і–∞–љ–љ—Л–µ –Њ –Ї–Њ—В–Њ—А–Њ–є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1.
–Ы–µ—В–∞–ї—М–љ–Њ—Б—В—М –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б—В—А—Л–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ, –≤–Ї–ї—О—З–∞—П –ї–Є—Ж, –њ—А–Њ—Е–Њ–і–Є–≤—И–Є—Е –ї–µ—З–µ–љ–Є–µ –≤ –Њ—В–і–µ–ї–µ–љ–Є–Є –љ–µ–є—А–Њ—А–µ–∞–љ–Є–Љ–∞—Ж–Є–Є –Є –≤ –і–≤—Г—Е –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Њ—В–і–µ–ї–µ–љ–Є—П—Е, —Б–Њ—Б—В–∞–≤–Є–ї–∞ 16% (156 —З–µ–ї–Њ–≤–µ–Ї).
–Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є —В–µ—А–∞–њ–Є—О —Б–Њ–≥–ї–∞—Б–љ–Њ —Б—В–∞–љ–і–∞—А—В–∞–Љ –Њ–Ї–∞–Ј–∞–љ–Є—П –њ–Њ–Љ–Њ—Й–Є –±–Њ–ї—М–љ—Л–Љ —Б –Њ—Б—В—А—Л–Љ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ –≤ –≥. –Ь–Њ—Б–Ї–≤–µ. –Т —В.—З. —Б —Ж–µ–ї—М—О –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ –≤ –Њ—В–і–µ–ї–µ–љ–Є–Є –љ–µ–є—А–Њ—А–µ–∞–љ–Є–Љ–∞—Ж–Є–Є, —Б—А–µ–і–љ—П—П –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–µ–±—Л–≤–∞–љ–Є—П –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 3,2 –і–љ—П, –њ–Њ–і–Ї–Њ–ґ–љ–Њ –њ—А–Є–Љ–µ–љ—П–ї–Є —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ (–Ъ–ї–µ–Ї—Б–∞–љ) –≤ –і–Њ–Ј–µ 0,4–0,8 –Љ–ї/—Б—Г—В., –∞ –њ—А–Є –њ–µ—А–µ–≤–Њ–і–µ –≤ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Њ—В–і–µ–ї–µ–љ–Є—П (–Њ—В–і–µ–ї–µ–љ–Є—П —А–∞–љ–љ–µ–є —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Є) –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є –љ–µ—Д—А–∞–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л–є –≥–µ–њ–∞—А–Є–љ (Heparini) –њ–Њ–і–Ї–Њ–ґ–љ–Њ –≤ –і–Њ–Ј–µ 5 —В—Л—Б E–Ф –Њ—В 2 –і–Њ 4 —А–∞–Ј/—Б—Г—В. 40% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤–µ–љ–Њ–Ј–љ—Л–Љ–Є —В—А–Њ–Љ–±–Њ–Ј–∞–Љ–Є –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –≤ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Њ—В–і–µ–ї–µ–љ–Є—П—Е –њ–Њ–ї—Г—З–∞–ї–Є –≤–µ–љ–Њ—В–Њ–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л. –Т–∞—А—Д–∞—А–Є–љ –љ–∞–Ј–љ–∞—З–∞–ї—Б—П –≤ 13% —Б–ї—Г—З–∞–µ–≤.
–Ф–ї—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П –Є–ї–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –і–Є–∞–≥–љ–Њ–Ј–∞ –Ґ–≠–Ы–Р –±—Л–ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –Љ–µ—В–Њ–і—Л: –∞–љ–≥–Є–Њ–њ—Г–ї—М–Љ–Њ–љ–Њ–≥—А–∞—Д–Є—П, —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ –ї–µ–≥–Ї–Є—Е, —Б–њ–Є—А–∞–ї—М–љ–∞—П –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П –Є, –љ–∞–Ї–Њ–љ–µ—Ж, —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є –љ–∞ –љ–∞–ї–Є—З–Є–µ —Б–µ–≥–Љ–µ–љ—В–∞—А–љ–Њ–≥–Њ –∞—В–µ–ї–µ–Ї—В–∞–Ј–∞, –∞ —В–∞–Ї–ґ–µ —Б—В–∞–љ–і–∞—А—В–љ—Л–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ —В–µ—Б—В—Л – –Р–І–Ґ–Т, –Ї–Њ–∞–≥—Г–ї–Њ–≥—А–∞–Љ–Љ–∞, —Г—А–Њ–≤–µ–љ—М D-–і–Є–Љ–µ—А–∞ –Є —В—А–Њ–њ–Њ–љ–Є–љ–∞. –Т —Б–ї—Г—З–∞–µ –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ –њ–Њ—Б–ї–µ–і–љ—О—О —В–Њ—З–Ї—Г –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–Љ –њ–Њ–Є—Б–Ї–µ —Б—В–∞–≤–Є–ї –њ–∞—В–Њ–ї–Њ–≥–Њ–∞–љ–∞—В–Њ–Љ.
–£ 143 –Є–Ј 975 (14,6%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–∞ –Ґ–≠–Ы–Р, –њ—А–Є—З–µ–Љ —Г 9 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–љ–∞ –±—Л–ї–∞ —Д–∞—В–∞–ї—М–љ–Њ–є. –Т 45% —Б–ї—Г—З–∞–µ–≤ –Є–љ—Б—Г–ї—М—В –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ґ–≠–Ы–Р –±—Л–ї –њ–Њ–≤—В–Њ—А–љ—Л–Љ, —Г 67% –Њ—В–Љ–µ—З–µ–љ—Л –љ–∞—А—Г—И–µ–љ–Є—П —А–Є—В–Љ–∞ —Б –њ–Њ—Б—В–Њ—П–љ–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є, —Г 34% –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –±—Л–ї –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞, —Г 94% – –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–Њ–љ–Є—П —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (–†–°–°–Ю 4). –°—А–µ–і–љ–Є–µ —Б—А–Њ–Ї–Є —А–∞–Ј–≤–Є—В–Є—П –Ґ–≠–Ы–Р —Б–Њ—Б—В–∞–≤–Є–ї–Є 12 —Б—Г—В., –Ї–Њ–ї–µ–±–ї—П—Б—М –Њ—В 5 –і–Њ 17 –і–љ–µ–є. –£ 125 (88%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ґ–≠–Ы–Р –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ —В—А–Њ–Љ–±–Њ–Ј –≥–ї—Г–±–Њ–Ї–Є—Е –≤–µ–љ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –њ—А–Є—Е–Њ–і–Є—В—Б—П –Ї–Њ–љ—Б—В–∞—В–Є—А–Њ–≤–∞—В—М, —З—В–Њ —В–Њ–ї—М–Ї–Њ —Г 38% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –і–Њ –њ–Њ—П–≤–ї–µ–љ–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ґ–≠–Ы–Р, –∞ —Г 62% – —Г–ґ–µ –њ–Њ—Б–ї–µ. 78% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤–њ–Њ—Б–ї–µ–і—Б—В–≤–Є–Є –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ґ–≠–Ы–Р –њ—А–Є —Д–Њ–љ–Њ–≤–Њ–Љ –Ъ–Ґ-–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Є–Љ–µ–ї–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–µ –Њ—З–∞–≥–Є –±–Њ–ї—М—И–Є—Е —А–∞–Ј–Љ–µ—А–Њ–≤ (>10 cm3). –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –±–Њ–ї—М—И–Є–µ —А–∞–Ј–Љ–µ—А—Л –Њ—З–∞–≥–∞ –Є—И–µ–Љ–Є–Є, –Є–Љ–µ–≤—И–Є–µ –Љ–µ—Б—В–Њ —Г –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–≥–Њ —З–Є—Б–ї–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Љ–Њ–≥—Г—В –±—Л—В—М –Њ–±—К—П—Б–љ–µ–љ—Л –љ–µ —В–Њ–ї—М–Ї–Њ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є–є –±–Њ–ї—М—И–Њ–≥–Њ –Ї–∞–ї–Є–±—А–∞, –љ–Њ –Є –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В–Њ–є —Б–Є–љ–і—А–Њ–Љ–∞ –≥–Є–њ–µ—А–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є, –љ–∞–±–ї—О–і–∞–≤—И–µ–≥–Њ—Б—П —Г –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –≠—В–Њ—В —Б–Є–љ–і—А–Њ–Љ –љ–µ —В–Њ–ї—М–Ї–Њ —Г—В—П–ґ–µ–ї—П–µ—В —В–µ—З–µ–љ–Є–µ –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ–Ј–∞ –Є–ї–Є –Ї–∞—А–і–Є–Њ—Н–Љ–±–Њ–ї–Є–Є, –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ—А–Є–≤–Њ–і—П—Й–Є—Е –Ї –Є–љ—Б—Г–ї—М—В—Г, –љ–Њ –≤–њ–Њ—Б–ї–µ–і—Б—В–≤–Є–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –љ–∞ —Д–Њ–љ–µ –Њ–±–µ–Ј–і–≤–Є–ґ–µ–љ–љ–Њ—Б—В–Є –±–Њ–ї—М–љ—Л—Е, —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ–Љ –Љ–∞—Б—Б–Є–≤–љ—Л—Е –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –Є –Ґ–≠–Ы–Р. –Ш –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, —Г 87% –±–Њ–ї—М–љ—Л—Е —Б –Ґ–≠–Ы–Р –Є–љ—Б—Г–ї—М—В –њ—А–Њ—В–µ–Ї–∞–ї —В—П–ґ–µ–ї–Њ, –Њ–љ–Є –Є–Љ–µ–ї–Є –≥–ї—Г–±–Њ–Ї–Є–є –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –і–µ—Д–Є—Ж–Є—В –≤ –≤–Є–і–µ –≥–µ–Љ–Є–њ–∞—А–µ–Ј–Њ–≤ < 2 –±–∞–ї–ї–Њ–≤ –≤ 76% (108 –±–Њ–ї—М–љ—Л—Е) –Є –≥–µ–Љ–Є–њ–ї–µ–≥–Є–є – –≤ 34% (24) —Б–ї—Г—З–∞–µ–≤. –Ґ—П–ґ–µ—Б—В—М –Є–љ—Б—Г–ї—М—В–∞ –њ—А–Є –Њ—Ж–µ–љ–Ї–µ –њ–Њ —И–Ї–∞–ї–µ NIHSS —Г —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ >15 –±–∞–ї–ї–Њ–≤, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —В—П–ґ–µ–ї–Њ–Љ—Г –Є–љ—Б—Г–ї—М—В—Г, –њ—А–Є—З–µ–Љ –Ј–љ–∞—З–Є–Љ–Њ–є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Є –Ј–∞ –≤—А–µ–Љ—П –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –Є –Ї –Љ–Њ–Љ–µ–љ—В—Г –≤—Л–њ–Є—Б–Ї–Є —Г –≤—Л–ґ–Є–≤—И–Є—Е –±–Њ–ї—М–љ—Л—Е –љ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М. –°—А–µ–і–љ–Є–µ —Б—А–Њ–Ї–Є –љ–∞—З–∞–ї–∞ —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Њ–љ–љ—Л—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є, –Ј–∞–Ї–ї—О—З–∞–≤—И–Є—Е—Б—П –≤ –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Љ–∞—Б—Б–∞–ґ–∞ –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –Є –Ј–∞–љ—П—В–Є–є –Ы–§–Ъ (–∞–Ї—В–Є–≤–љ—Л–µ –Є –њ–∞—Б—Б–Є–≤–љ—Л–µ –і–≤–Є–ґ–µ–љ–Є—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –њ–Њ 15–20 –Љ–Є–љ. –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 5–6 –і–љ–µ–є, –њ—А–Є—Б–∞–ґ–Є–≤–∞–љ–Є—П –≤ –њ–Њ—Б—В–µ–ї–Є), —Г —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е –Њ–±—Л—З–љ–Њ –±—Л–ї–Є –љ–∞ 5–6-–µ —Б—Г—В–Ї–Є.
–£ 27 –Є–Ј –≤—Л–ґ–Є–≤—И–Є—Е –±–Њ–ї—М–љ—Л—Е (57%) —Г—А–Њ–≤–µ–љ—М –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –њ–Њ –Є–љ–і–µ–Ї—Б—Г –С–∞—А—В–µ–ї—М —Б–Њ—Б—В–∞–≤–ї—П–ї <38 –±–∞–ї–ї–Њ–≤, –∞ –њ–Њ —И–Ї–∞–ї–µ –†–µ–љ–Ї–Є–љ – 4–5 –±–∞–ї–ї–Њ–≤, —З—В–Њ –≥–Њ–≤–Њ—А–Є—В –Њ –њ–Њ–ї–љ–Њ–є –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Њ–Ї—А—Г–ґ–∞—О—Й–Є—Е. –Ґ—П–ґ–µ–ї—Л–є –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –і–µ—Д–Є—Ж–Є—В –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–ї —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ–Њ—Б—В–µ–ї—М–љ–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞ –Є –љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї —Б–∞–Љ–Њ–Њ–±—Б–ї—Г–ґ–Є–≤–∞–љ–Є—О, –≤–Ї–ї—О—З–∞—П «—Б—В–∞–Ї–∞–љ –≤–Њ–і—Л». –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –і–∞–љ–љ—Л—Е –Є—Б—В–Њ—А–Є–є –±–Њ–ї–µ–Ј–љ–Є, –Є –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –ї–Є—Б—В–Њ–≤ –љ–∞–Ј–љ–∞—З–µ–љ–Є–є, –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –±–Њ–ї—М–љ—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є –Є–љ—Д—Г–Ј–Є–Њ–љ–љ—Г—О —В–µ—А–∞–њ–Є—О, —Б—Г—В–Њ—З–љ—Л–є –Њ–±—К–µ–Љ –Ї–Њ—В–Њ—А–Њ–є –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–ї—П–ї 1,5–2 –ї, —З—В–Њ, –њ–Њ –≤—Б–µ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є, –љ–µ–ї—М–Ј—П –њ—А–Є–Ј–љ–∞—В—М –∞–і–µ–Ї–≤–∞—В–љ—Л–Љ –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–Є—Б–Ї–Њ–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П —Б–Є–љ–і—А–Њ–Љ–∞ –≥–Є–њ–µ—А–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є, —В–µ–Љ –±–Њ–ї–µ–µ, —З—В–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Є —Д–Њ–љ–Њ–≤–Њ–≥–Њ –≥–µ–Љ–∞—В–Њ–Ї—А–Є—В–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –Є –Њ–љ –Њ—Б—В–∞–≤–∞–ї—Б—П –≤—Л—Б–Њ–Ї–Є–Љ –њ–µ—А–≤—Л–µ 10–14 —Б—Г—В., —В.–µ. –Ї –Љ–Њ–Љ–µ–љ—В—Г —А–∞–Ј–≤–Є—В–Є—П –Ґ–≠–Ы–Р.
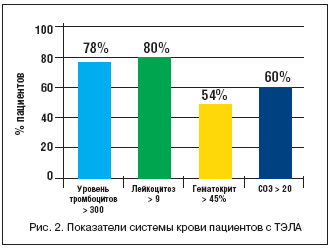
–У–Њ–≤–Њ—А—П –Њ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Љ–∞—А–Ї–µ—А–∞—Е —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ґ–≠–Ы–Р —Г –±–Њ–ї—М–љ—Л—Е —Б –Є–љ—Б—Г–ї—М—В–Њ–Љ, –љ–µ–ї—М–Ј—П –љ–µ –Њ—В–Љ–µ—В–Є—В—М –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Њ—Б–љ–Њ–≤–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є—Е —Б–≥—Г—Й–µ–љ–Є–µ –Ї—А–Њ–≤–Є (—А–Є—Б. 2), –Њ—В–Љ–µ—З–µ–љ–љ—Л—Е —Г –±–Њ–ї—М—И–Њ–≥–Њ —З–Є—Б–ї–∞ –±–Њ–ї—М–љ—Л—Е —Б –Ґ–≠–Ы–Р. –≠—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П –≤—Б–µ–Љ–Є 4 –њ—А–Є–≤–µ–і–µ–љ–љ—Л–Љ–Є –њ–∞—А–∞–Љ–µ—В—А–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –Њ–±—К—П—Б–љ—П—О—В –≤—Л—Б–Њ–Ї—Г—О –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞.
–£ 92 (65%) –±–Њ–ї—М–љ—Л—Е –Є–Ј 143 —Б –Ґ–≠–Ы–Р –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ –±—Л–ї–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–∞ –њ–љ–µ–≤–Љ–Њ–љ–Є—П, –њ—А–Є—З–µ–Љ –≤ 90% —Б–ї—Г—З–∞–µ–≤ –µ–µ –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є—П —Б–Њ–≤–њ–∞–ї–∞ —Б –њ—А–Њ–µ–Ї—Ж–Є–µ–є –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П –≤–µ—В–≤–µ–є —В—А–Њ–Љ–±–Є—А–Њ–≤–∞–љ–љ–Њ–є –ї–µ–≥–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є. –Т –Ї–∞—З–µ—Б—В–≤–µ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ —Б—А–µ–і—Б—В–≤–∞ –ї–µ—З–µ–љ–Є—П –њ–љ–µ–≤–Љ–Њ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є—О, –њ—А–Є—З–µ–Љ —Г 78% –±–Њ–ї—М–љ—Л—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є —Ж–µ—Д–Њ—В–∞–Ї—Б–Є–Љ –Є —Ж–Є–њ—А–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Њ—В –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ –±—Л–ї–Њ. –Ы–µ—В–∞–ї—М–љ–Њ—Б—В—М –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –Ґ–≠–Ы–Р –±—Л–ї–∞ –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї–Њ–є, —Б–Њ—Б—В–∞–≤–Є–≤ 67,1% (96 —З–µ–ї–Њ–≤–µ–Ї). –Я—А–Є—З–µ–Љ –≤ 30,4% —Б–ї—Г—З–∞–µ–≤ –њ–љ–µ–≤–Љ–Њ–љ–Є—П, –≤—Л—П–≤–ї–µ–љ–љ–∞—П –љ–∞ —Б–µ–Ї—Ж–Є–Є, –љ–Њ—Б–Є–ї–∞ –Є–љ—Д–∞—А–Ї—В–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А –Є –њ—А–Њ—В–µ–Ї–∞–ї–∞ –љ–∞ —Д–Њ–љ–µ —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–Є –Љ–µ–ї–Ї–Є—Е –≤–µ—В–≤–µ–є –Ы–Р.
–Р–љ–∞–ї–Є–Ј –Ї–∞—В–∞–Љ–љ–µ–Ј–∞ –±–Њ–ї—М–љ—Л—Е, –≤—Л–њ–Є—Б–∞–љ–љ—Л—Е –Є–Ј —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞, –њ–Њ–Ј–≤–Њ–ї–Є–ї –≤—Л—П–≤–Є—В—М, —З—В–Њ –Є–Ј 204 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 6 –Љ–µ—Б. –њ–Њ—Б–ї–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ —Б–Ї–Њ–љ—З–∞–ї–Є—Б—М 28 (13,8%) —З–µ–ї–Њ–≤–µ–Ї. –£ 10 –Є–Ј –љ–Є—Е —Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–Ї–∞ –њ–Њ—Б–Љ–µ—А—В–љ–Њ–≥–Њ –і–Є–∞–≥–љ–Њ–Ј–∞ –±—Л–ї–∞ —Б–ї–µ–і—Г—О—Й–µ–є: –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П –Њ—Б—В—А–Њ–≥–Њ –љ–∞—А—Г—И–µ–љ–Є—П –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П, –њ–љ–µ–≤–Љ–Њ–љ–Є—П. –Т—Б–Ї—А—Л—В–Є–µ –љ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Є—Е–Њ–і–Є—В—Б—П –Ї–Њ–љ—Б—В–∞—В–Є—А–Њ–≤–∞—В—М, —З—В–Њ –Њ–±—К–µ–Љ –Є –Ї–∞—З–µ—Б—В–≤–Њ –Њ–Ї–∞–Ј–∞–љ–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є —Е–Њ—В—П –Є —Г–і–Њ–≤–ї–µ—В–≤–Њ—А—П—О—В –Ј–∞–Ї–Њ–љ–Њ–і–∞—В–µ–ї—М–љ—Л–Љ –љ–Њ—А–Љ–∞–Љ –Є –њ—А–µ–і–њ–Є—Б–∞–љ–љ—Л–Љ —А–µ–≥–ї–∞–Љ–µ–љ—В–∞–Љ, –Њ–і–љ–∞–Ї–Њ –љ–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В –Є–Ј–±–µ–ґ–∞—В—М —А–∞–Ј–≤–Є—В–Є—П –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –±–Њ–ї—М—И–Њ–≥–Њ —З–Є—Б–ї–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–љ—Б—Г–ї—М—В–Њ–Љ.
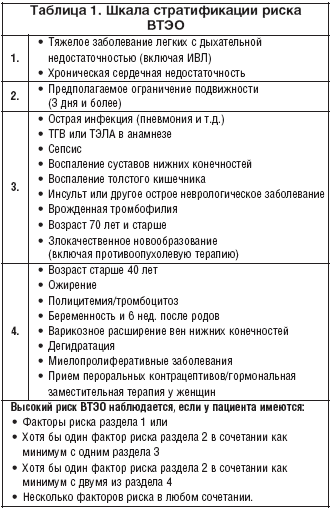
–Ю—Ж–µ–љ–Ї–∞ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (–Т–Ґ–≠–Ю) —Г –±–Њ–ї—М–љ—Л—Е —Б –Є–љ—Б—Г–ї—М—В–Њ–Љ –њ–Њ —И–Ї–∞–ї–µ —Б—В—А–∞—В–Є—Д–Є–Ї–∞—Ж–Є–Є —Г –љ–µ—Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е (—В–∞–±–ї. 1) —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В, —З—В–Њ –∞–±—Б–Њ–ї—О—В–љ–Њ–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є–Ј –љ–Є—Е –Є–Љ–µ–µ—В –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –Є–ї–Є –Ґ–≠–Ы–Р –Є —В—А–µ–±—Г–µ—В —А–∞–љ–љ–µ–≥–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є [8]. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –њ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є —Д–ї–µ–±–Њ–ї–Њ–≥–Њ–≤, —Б–∞–Љ –і–Є–∞–≥–љ–Њ–Ј –Њ—Б—В—А–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ —Г–ґ–µ –њ—А–µ–і–Њ–њ—А–µ–і–µ–ї—П–µ—В –љ–∞–ї–Є—З–Є–µ —Г –њ–∞—Ж–Є–µ–љ—В–∞ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ (> 3 –±–∞–ї–ї–Њ–≤).
–Я–Њ—Н—В–Њ–Љ—Г —Г –±–Њ–ї—М–љ—Л—Е —Б –Є–љ—Б—Г–ї—М—В–Њ–Љ –і–Њ–ї–ґ–љ—Л –±—Л—В—М –њ—А–Є–љ—П—В—Л –≤—Б–µ –Љ–µ—А—Л –Ї –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Т–Ґ–≠–Ю. –Ш –µ—Б–ї–Є –њ—А–Є –љ–Є–Ј–Ї–Њ–Љ —А–Є—Б–Ї–µ —А–∞–Ј–≤–Є—В–Є—П –Т–Ґ–≠–Ю –Љ–µ—А—Л –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Љ–Њ–≥—Г—В –±—Л—В—М –Њ–≥—А–∞–љ–Є—З–µ–љ—Л —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Њ–є –Ї–Њ–Љ–њ—А–µ—Б—Б–Є–µ–є –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є, —А–∞–љ–љ–µ–є –∞–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–µ–є –Є –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –Є–љ—Д—Г–Ј–Є–µ–є (–љ–µ –Љ–µ–љ–µ–µ 2000 –Љ–ї/—Б—Г—В.), —В–Њ –њ—А–Є –≤—Л—Б–Њ–Ї–Њ–Љ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –≥–µ–њ–∞—А–Є–љ–Њ–≤, –љ–∞–њ—А–Є–Љ–µ—А —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞, –≤ –≤—Л—Б–Њ–Ї–Є—Е –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –і–Њ–Ј–∞—Е (40 –Љ–≥ —Е 1 —А–∞–Ј/—Б—Г—В. –њ/–Ї). –Я–Њ –і–∞–љ–љ—Л–Љ –ї–Є—В–µ—А–∞—В—Г—А—Л, –і–Њ–Ј—Л —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞ –Љ–Њ–≥—Г—В –±—Л—В—М —Г–≤–µ–ї–Є—З–µ–љ—Л –і–Њ 40 –Љ–≥ 2 —А–∞–Ј–∞/—Б—Г—В. [7]. –Р–љ–∞–ї–Є–Ј –Є—Б—В–Њ—А–Є–є –±–Њ–ї–µ–Ј–љ–Є –њ–Њ–Ј–≤–Њ–ї–Є–ї —Б–і–µ–ї–∞—В—М –≤—Л–≤–Њ–і –Њ —В–Њ–Љ, —З—В–Њ –љ–µ–≤—А–Њ–ї–Њ–≥–Є, –Ї–∞–Ї –Є —А–µ–∞–љ–Є–Љ–∞—В–Њ–ї–Њ–≥–Є, —А–∞–±–Њ—В–∞—О—Й–Є–µ –≤ –Њ—В–і–µ–ї–µ–љ–Є–Є –љ–µ–є—А–Њ—А–µ–∞–љ–Є–Љ–∞—Ж–Є–Є, –љ–µ –≤—Б–µ–≥–і–∞ —Г–і–µ–ї—П—О—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –Њ—Ж–µ–љ–Ї–µ —А–Є—Б–Ї–∞ –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б—В—А—Л–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ. –Ґ–∞–Ї, –≤ –Є—Б—В–Њ—А–Є—П—Е –±–Њ–ї–µ–Ј–љ–Є –њ–Њ–і—А–Њ–±–љ–Њ–µ –Њ–њ–Є—Б–∞–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ —В–Њ–ї—М–Ї–Њ —Г 5% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В –Њ–љ–Њ –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ —Е–Є—А—Г—А–≥–∞–Љ. –Ґ–∞–Ї–Є–µ –Ї—А–Є—В–µ—А–Є–Є –Њ—Ж–µ–љ–Ї–Є —А–Є—Б–Ї–∞ –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤, –Ї–∞–Ї –±–Њ–ї–µ–Ј–љ–µ–љ–љ–Њ—Б—В—М –њ—А–Є –њ–∞–ї—М–њ–∞—Ж–Є–Є –њ–Њ —Е–Њ–і—Г –≥–ї—Г–±–Њ–Ї–Є—Е –≤–µ–љ, –Њ—В–µ–Ї –≤—Б–µ–є –љ–Њ–≥–Є, —А–∞–Ј–љ–Є—Ж–∞ –≤ –Њ—В–µ–Ї–µ –Є–Ї—А >3 —Б–Љ –љ–∞ —Г—А–Њ–≤–љ–µ 10 —Б–Љ –љ–Є–ґ–µ tibial tuberosity, –Њ—В–µ–Ї —Б —П–Љ–Ї–Њ–є –љ–∞ –±–Њ–ї—М–љ–Њ–є –љ–Њ–≥–µ, —А–∞—Б—И–Є—А–µ–љ–љ—Л–µ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–µ –≤–µ–љ—Л (–љ–µ –≤–∞—А–Є–Ї–Њ–Ј) –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є, –Ґ–У–Т –Є–ї–Є –Ґ–≠–Ы–Р –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, –Ї–∞–ґ–і—Л–є –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –њ—А–Є–±–∞–≤–ї—П–µ—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–є –±–∞–ї–ї –Ї —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–Љ—Г –Є–љ–і–µ–Ї—Б—Г –Њ—Ж–µ–љ–Ї–Є —А–Є—Б–Ї–∞ –Т–Ґ–≠–Ю [8], –Њ–њ–Є—Б—Л–≤–∞—О—В—Б—П, –Ї–∞–Ї —Г–ґ–µ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ, –≤—Б–µ–≥–Њ –≤ 5% –Є—Б—В–Њ—А–Є–є –±–Њ–ї–µ–Ј–љ–Є. –Э–µ—В –Њ–њ–Є—Б–∞–љ–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –Є –≤ –Є—Б—В–Њ—А–Є—П—Е –±–Њ–ї–µ–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е –≤–њ–Њ—Б–ї–µ–і—Б—В–≤–Є–Є –њ—А–Њ–Є–Ј–Њ—И–ї–∞ –Ґ–≠–Ы–Р. –Р —А–∞–Ј –≤–љ–Є–Љ–∞–љ–Є–µ –≤—А–∞—З–∞ –љ–µ –±—Л–ї–Њ –∞–Ї—Ж–µ–љ—В–Є—А–Њ–≤–∞–љ–Њ –љ–∞ —Н—В–Њ–є –њ—А–Њ–±–ї–µ–Љ–µ, —В–Њ –Є –∞–Ї—В–Є–≤–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –і–∞–ґ–µ –Є–Љ–µ—О—Й–Є—Е –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї –Т–Ґ–≠–Ю, –љ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –Є–ї–Є –Њ–љ–∞ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –љ–Є–Ј–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є –љ–µ—Д—А–∞–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≥–µ–њ–∞—А–Є–љ–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ–Є –і–Њ–Ј–∞–Љ–Є –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л.
–°–Њ–≥–ї–∞—Б–љ–Њ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј—Г —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є –Њ—Б—В—А–Њ–Љ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–Љ –Є–љ—Б—Г–ї—М—В–µ [9], –љ–µ—Б–Њ–Љ–љ–µ–љ–љ—Л–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ –Њ–±–ї–∞–і–∞—О—В –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –≥–µ–њ–∞—А–Є–љ—Л. –≠—В–Њ –ї–µ–≥–Ї–Њ–Њ–±—К—П—Б–љ–Є–Љ–Њ, –µ—Б–ї–Є –њ—А–Є–љ—П—В—М –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ, —З—В–Њ –љ–µ—Д—А–∞–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л–є –≥–µ–њ–∞—А–Є–љ —А–∞–±–Њ—В–∞–µ—В —В–Њ–ї—М–Ї–Њ –≤ –Ј–Њ–љ–µ —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –Ї—А–Њ–≤–µ–љ–Њ—Б–љ–Њ–≥–Њ —А—Г—Б–ї–∞ –Є –љ–µ –Ј–∞—В—А–∞–≥–Є–≤–∞–µ—В –Њ–±–ї–∞—Б—В—М –±–∞–Ј–∞–ї—М–љ–Њ–є —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л, –≥–і–µ —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ –Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —В—А–Њ–Љ–±–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ —Г –±–Њ–ї—М–љ—Л—Е —Б –ї—О–±—Л–Љ –≤–Є–і–Њ–Љ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –Ї–Њ–Љ–Њ—А–±–Є–і–љ–Њ—Б—В–Є, –Є –≤ —В.—З. —Б –Є–љ—Б—Г–ї—М—В–Њ–Љ. –Ф–ї—П –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –≥–µ–њ–∞—А–Є–љ–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –±–ї–∞–≥–Њ–і–∞—А—П —А–∞–Ј–Љ–µ—А—Г —Б–≤–Њ–Є—Е –Љ–Њ–ї–µ–Ї—Г–ї –Љ–Њ–≥—Г—В –њ—А–Њ–љ–Є–Ї–∞—В—М –Є –њ—А–Њ–љ–Є–Ї–∞—О—В –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –Ї –Ј–Њ–љ–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–љ–Њ–≥–Њ (—В—А–Њ–Љ–±–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ) —Н–љ–і–Њ—В–µ–ї–Є—П, –Є–Љ–µ–љ–љ–Њ –±–Њ–ї—М–љ—Л–µ —Б —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є, —А–µ–∞–ї–Є–Ј—Г—О—Й–µ–є—Б—П –Њ—Б—В—А—Л–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ, —П–≤–ї—П—О—В—Б—П —Б–∞–Љ—Л–Љ–Є –ї—Г—З—И–Є–Љ–Є «–Љ–Є—И–µ–љ—П–Љ–Є». –Ґ–µ—А–Љ–Є–љ –Љ–Њ–ґ–µ—В –њ–Њ–Ї–∞–Ј–∞—В—М—Б—П –љ–µ–Њ–±—Л—З–љ—Л–Љ, —В.–Ї. –њ–Њ–і «–Љ–Є—И–µ–љ—П–Љ–Є» –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ–Њ–љ–Є–Љ–∞—О—В —З–∞—Й–µ –≤—Б–µ–≥–Њ –Њ—А–≥–∞–љ—Л, –њ–Њ—А–∞–ґ–µ–љ–љ—Л–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–Љ. –Ь—Л –њ–Њ–Ї–∞ –µ—Й–µ –љ–µ –њ—А–Є–≤—Л–Ї–ї–Є –Ї —В–µ—А–Љ–Є–љ—Г «—Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Љ–Є—И–µ–љ—М», –њ–Њ—В–Њ–Љ—Г —З—В–Њ –љ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ –Ї–∞–Ї —Б—А–µ–і—Б—В–≤–∞ —А–µ—Ж–µ–њ—В–Њ—А–Њ—В—А–Њ–њ–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П [10]. –Т —Ж–µ–ї–Њ–Љ, –Є–і–µ–∞–ї—М–љ—Л–є —А–µ—Ж–µ–њ—В–Њ—А–Њ—В—А–Њ–њ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –і–ї—П —В—А–Њ–Љ–±–Њ–њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В—А—Л–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ –і–Њ–ї–ґ–µ–љ –Њ–±–ї–∞–і–∞—В—М —И–Є—А–Њ–Ї–Є–Љ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–Љ –Ї–Њ—А–Є–і–Њ—А–Њ–Љ (–±–Њ–ї—М—И–∞—П –і–µ–ї—М—В–∞ –Љ–µ–ґ–і—Г –і–Њ–Ј–Њ–є, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–µ–є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Њ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –Є –і–Њ–Ј–Њ–є, –≤—Л–Ј—Л–≤–∞—О—Й–µ–є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ), –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–є –Ї—А–∞—В–љ–Њ—Б—В—М—О –≤–≤–µ–і–µ–љ–Є—П, –ї–µ–≥–Ї–Њ—Б—В—М—О –≤–≤–µ–і–µ–љ–Є—П, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–Њ—З–µ–Ї, –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ –Ї–Њ–љ—В—А–Њ–ї–µ–Љ. –≠–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ –≤ —Н—В–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є —П–≤–ї—П–µ—В —Б–Њ–±–Њ–є –њ—А–Є–Љ–µ—А —В–Њ—З–љ–Њ–≥–Њ –њ–Њ–њ–∞–і–∞–љ–Є—П –≤ —Ж–µ–ї—М, —В.–Ї. –Њ—В–≤–µ—З–∞–µ—В –≤—Б–µ–Љ –≤—Л—И–µ–љ–∞–Ј–≤–∞–љ–љ—Л–Љ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ. –Ф–∞–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –њ–Њ–ї—Г—З–∞—О—В –њ—Г—В–µ–Љ –і–µ—Д—А–∞–≥–Љ–µ–љ—В–∞—Ж–Є–Є –љ–µ—Д—А–∞–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≥–µ–њ–∞—А–Є–љ–∞, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ–ї—Г—З–µ–љ–Є—О —Б–Љ–µ—Б–Є –Љ–Њ–ї–µ–Ї—Г–ї —Б —А–∞–Ј–ї–Є—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є. –Я—А–Є —Н—В–Њ–Љ –±–Њ–ї—М—И–∞—П —З–∞—Б—В—М —Н—В–Є—Е –Љ–Њ–ї–µ–Ї—Г–ї –Є–љ–≥–Є–±–Є—А—Г–µ—В —Д–∞–Ї—В–Њ—А –•–∞, –∞ –Љ–µ–љ—М—И–∞—П – —В—А–Њ–Љ–±–Є–љ, –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—П –љ–∞ –≤—Б–µ —Г—З–∞—Б—В–Ї–Є —Б–Є—Б—В–µ–Љ—Л —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є. –Т—Б–µ –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –≥–µ–њ–∞—А–Є–љ—Л –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–Є–Ї–∞–Ї –љ–µ –≤–ї–Є—П—О—В –љ–∞ –Р–І–Ґ–Т, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П, –љ–Є–Ј–Ї–∞—П –Ї—А–∞—В–љ–Њ—Б—В—М –≤–≤–µ–і–µ–љ–Є—П (1–2 –≤ —Б—Г—В.) —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞ –Є –і—А—Г–≥–Є—Е –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –≥–µ–њ–∞—А–Є–љ–Њ–≤ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ–±–ї–µ–≥—З–Є—В—М —А–∞–±–Њ—В—Г –њ–µ—А—Б–Њ–љ–∞–ї–∞, —З—В–Њ —В–∞–Ї–ґ–µ –љ–µ–Љ–∞–ї–Њ–≤–∞–ґ–љ–Њ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –±–Њ–ї—М—И–Њ–≥–Њ –њ–Њ—В–Њ–Ї–∞ –±–Њ–ї—М–љ—Л—Е –Є –Ї–∞–і—А–Њ–≤–Њ–≥–Њ «–≥–Њ–ї–Њ–і–∞».
–У–Њ–≤–Њ—А—П –Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е –Ї–∞—З–µ—Б—В–≤–∞—Е –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –≥–µ–њ–∞—А–Є–љ–Њ–≤, –љ–µ–ї—М–Ј—П –љ–µ –Њ—Б—В–∞–љ–Њ–≤–Є—В—М—Б—П –љ–∞ –љ–µ–і–Њ—Б—В–∞—В–Ї–∞—Е –љ–µ—Д—А–∞–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≥–µ–њ–∞—А–Є–љ–∞, –Ї –Ї–Њ—В–Њ—А—Л–Љ –Њ—В–љ–Њ—Б—П—В—Б—П: –≤—Л—Б–Њ–Ї–∞—П –Ї—А–∞—В–љ–Њ—Б—В—М –≤–≤–µ–і–µ–љ–Є—П (–і–Њ 6 –≤ —Б—Г—В.), –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М —В—Й–∞—В–µ–ї—М–љ–Њ–≥–Њ –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –і–ї—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —А–∞–Ј–≤–Є—В–Є–µ –≥–µ–Љ–∞—В–Њ–Љ –≤ –Љ–µ—Б—В–µ –Є–љ—К–µ–Ї—Ж–Є–Є, –≤—Л—Б–Њ–Ї–∞—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –≥–µ–њ–∞—А–Є–љ–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Ї–Њ–љ—В—А–Њ–ї—П —Г—А–Њ–≤–љ—П –∞–љ—В–Є—В—А–Њ–Љ–±–Є–љ–∞ 3 –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞.
–Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Ї–Њ—В–Њ—А–∞—П –Љ–Њ–ґ–µ—В –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М —А–∞–Ј–≤–Є—В–Є–µ —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –љ–µ —П–≤–ї—П–µ—В—Б—П –≤ –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ —Б—В—А–Њ–≥–Њ —А–µ–≥–ї–∞–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–љ–Њ–є. –І–∞—Й–µ –≤—Б–µ–≥–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –µ–µ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –љ–µ –Є—Б—В–Є–љ–љ—Л–Љ–Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В—П–Љ–Є –≤ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ —Б–≤–µ—А—В—Л–≤–∞—О—Й–µ–є –Є –њ—А–Њ—В–Є–≤–Њ—Б–≤–µ—А—В—Л–≤–∞—О—Й–µ–є —Б–Є—Б—В–µ–Љ –Ї—А–Њ–≤–Є, –∞ –ї–Є–Љ–Є—В–Є—А–Њ–≤–∞–љ–∞ –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Њ–љ–љ—Л–Љ–Є –Є–ї–Є —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ–±–ї–µ–Љ–∞–Љ–Є [11]. –Ґ–∞–Ї, —А–µ–Ј–Ї–Є–є –њ–µ—А–µ—Е–Њ–і —Б –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –≥–µ–њ–∞—А–Є–љ–Њ–≤ (–Ъ–ї–µ–Ї—Б–∞–љ), –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ–≤–Њ–і–Є—В—Б—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Т–Ґ–≠–Ю —Г –±–Њ–ї—М–љ—Л—Е —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ –≤ –†–Р–Ю, –љ–∞ –і–µ—И–µ–≤—Л–є –љ–µ—Д—А–∞–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л–є –≥–µ–њ–∞—А–Є–љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї —З–Є—Б–ї–Њ —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є–Љ–µ–љ–љ–Њ –≤ –њ–µ—А–Є–Њ–і 2–3 —Б—Г—В. –њ–Њ—Б–ї–µ –њ–µ—А–µ–≤–Њ–і–∞ –Є –≤ –±–Њ–ї–µ–µ –њ–Њ–Ј–і–љ–Є–µ —Б—А–Њ–Ї–Є. –Э–∞—И–Є –і–∞–љ–љ—Л–µ –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Њ–і–ї–µ–љ–Є—П –Ї—Г—А—Б–Њ–≤ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–Љ–Є –≥–µ–њ–∞—А–Є–љ–∞–Љ–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ –љ–∞ —Б—А–Њ–Ї–Є –љ–µ –Љ–µ–љ–µ–µ 10–14 –і–љ–µ–є –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В —А–µ–Ј—Г–ї—М—В–∞—В—Л, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ —Е–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П PREVAIL [12]. –Ю—Б–Њ–±—Г—О —Б–ї–Њ–ґ–љ–Њ—Б—В—М –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Т–Ґ–≠–Ю –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —В—П–ґ–µ–ї—Л–µ –Њ–±–µ–Ј–і–≤–Є–ґ–µ–љ–љ—Л–µ –±–Њ–ї—М–љ—Л–µ, —Г –Ї–Њ—В–Њ—А—Л—Е —В–∞–Ї—В–Є–Ї–∞ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–Љ–Є –≥–µ–њ–∞—А–Є–љ–∞–Љ–Є, —В.–µ. –µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є–µ, —В—А–µ–±—Г–µ—В –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –Є–Ј—Г—З–µ–љ–Є—П. –Э–∞–Ї–Њ–њ–ї–µ–љ–љ—Л–є –Њ–њ—Л—В –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ (–і–Њ 35 —Б—Г—В.) –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е –і—А—Г–≥–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і—Г–Љ–∞—В—М –Њ —В–Њ–Љ, —З—В–Њ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–µ —А–µ–≥–ї–∞–Љ–µ–љ—В—Л –ї–µ—З–µ–љ–Є—П –Љ–Њ–≥—Г—В –Є –і–Њ–ї–ґ–љ—Л –±—Л—В—М –њ–µ—А–µ—Б–Љ–Њ—В—А–µ–љ—Л.
–С–Њ–ї–µ–≤—Л–Љ–Є —В–Њ—З–Ї–∞–Љ–Є –њ—А–Њ–±–ї–µ–Љ—Л –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б—В—А—Л–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ, –Ї—А–Њ–Љ–µ –Є—Е –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В—Л, —П–≤–ї—П—О—В—Б—П: –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є –≤—А–∞—З–∞–Љ–Є-–љ–µ–≤—А–Њ–ї–Њ–≥–∞–Љ–Є, –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ–µ –Є–ї–Є –њ–Њ–Ј–і–љ–µ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, –љ–µ–њ–Њ–ї–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –Љ–µ—А –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–∞—П –Є—Е –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М. –° —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –∞–≤—В–Њ—А–Њ–≤, –≤ –∞–ї–≥–Њ—А–Є—В–Љ –≤–µ–і–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –і–Њ–±–∞–≤–Є—В—М:
1. –Ю–±—П–Ј–∞—В–µ–ї—М–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –Њ—Ж–µ–љ–Ї–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –Ї—А–Њ–≤–µ–љ–Њ—Б–љ–Њ–≥–Њ —А—Г—Б–ї–∞ –љ–µ —В–Њ–ї—М–Ї–Њ –±—А–∞—Е–Є–Њ—Ж–µ—Д–∞–ї—М–љ–Њ–≥–Њ –і–µ—А–µ–≤–∞, –љ–Њ –Є –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є.
2. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –љ–∞ –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–Љ —Н—В–∞–њ–µ —В–Њ–ї—М–Ї–Њ –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –≥–µ–њ–∞—А–Є–љ–Њ–≤ –Є —В–Њ–ї—М–Ї–Њ –≤ –∞–і–µ–Ї–≤–∞—В–љ—Л—Е –і–Њ–Ј–∞—Е, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е —Б—В–µ–њ–µ–љ—П–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Т–Ґ–≠–Ю.
3. –Я—А–Њ–≤–µ–і–µ–љ–Є–µ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ —А–∞–љ–љ–µ–є –њ–∞—Б—Б–Є–≤–љ–Њ–є –Є –∞–Ї—В–Є–≤–љ–Њ–є —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Є –±–Њ–ї—М–љ—Л—Е —Б —А–Є—Б–Ї–Њ–Љ –Т–Ґ–≠–Ю (–≤–µ—А—В–Є–Ї–∞–ї–Є–Ј–∞—Ж–Є—П, –∞–Ї—В–Є–≤–Є–Ј–∞—Ж–Є—П —Б —А–∞—Б—И–Є—А–µ–љ–Є–µ–Љ –і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞, –≤ —В.—З. –і–ї—П –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є —Г –ї–µ–ґ–∞—З–Є—Е –±–Њ–ї—М–љ—Л—Е –≤ –њ—А–µ–і–µ–ї–∞—Е –њ–Њ—Б—В–µ–ї–Є) —Б —Г—З–µ—В–Њ–Љ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ —В—А–Њ–Љ–±–Є—А–Њ–≤–∞–љ–Є—П –≤–µ–љ –Є –њ–∞—А–µ—В–Є—З–љ—Л—Е –Є –Ї–Њ–љ—В—А–ї–∞—В–µ—А–∞–ї—М–љ—Л—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є.
4. –Я—А–Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –Т–Ґ–≠–Ю –њ—А–Њ–і–Њ–ї–ґ–∞—В—М –і–ї–Є—В–µ–ї—М–љ—Г—О —В–µ—А–∞–њ–Є—О –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–Љ–Є –≥–µ–њ–∞—А–Є–љ–∞–Љ–Є –њ–Њ—Б–ї–µ –≤—Л–њ–Є—Б–Ї–Є –њ–∞—Ж–Є–µ–љ—В–∞, –≤ —В.—З. –≤ –і–љ–µ–≤–љ–Њ–Љ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ –Є–ї–Є –≤ –њ–Њ–ї–Є–Ї–ї–Є–љ–Є–Ї–µ. –Р–≤—В–Њ—А—Л, —П–≤–ї—П—П—Б—М –њ—А–Є–≤–µ—А–ґ–µ–љ—Ж–∞–Љ–Є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л, –љ–µ —А–∞—Б—Ж–µ–љ–Є–≤–∞—О—В –≤—Л—И–µ–Њ–њ–Є—Б–∞–љ–љ—Л–є –∞–ї–≥–Њ—А–Є—В–Љ –Ї–∞–Ї –Є—Б—В–Є–љ—Г –≤ –њ–Њ—Б–ї–µ–і–љ–µ–є –Є–љ—Б—В–∞–љ—Ж–Є–Є, –Њ–і–љ–∞–Ї–Њ –њ–Њ –Ј–∞–≤–µ—А—И–µ–љ–Є–Є –љ–∞—З–∞—В–Њ–≥–Њ –љ–∞–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –і–∞–љ–љ–Њ–Љ—Г –∞–ї–≥–Њ—А–Є—В–Љ—Г –µ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Г–і—Г—В –љ–µ–Љ–µ–і–ї–µ–љ–љ–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤–љ–Є–Љ–∞–љ–Є—О —З–Є—В–∞—В–µ–ї–µ–є –ґ—Г—А–љ–∞–ї–∞.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –°–Ї–≤–Њ—А—Ж–Њ–≤–∞ –Т.–Ш., –°—В–∞—Е–Њ–≤—Б–Ї–∞—П –Ы.–Т. –≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—П —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ –≤ –†–§. –Ь–∞—В–µ—А–Є–∞–ї—Л –≤—Б–µ—А–Њ—Б—Б–Є–є—Б–Ї–Њ–є –љ–∞—Г—З–љ–Њ-–њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –Ї–Њ–љ—Д–µ—А–µ–љ—Ж–Є–Є «–Э–∞—А—Г—И–µ–љ–Є—П –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П». – –Ш—А–Ї—Г—В—Б–Ї, 2011. –°. 7–15.
2. –°–Ї–≤–Њ—А—Ж–Њ–≤–∞ –Т.–Ш., –Ш–≤–∞–љ–Њ–≤–∞ –У.–Х., –°—В–∞—Е–Њ–≤—Б–Ї–∞—П –Ы.–Т. –Ш—В–Њ–≥–Є —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є –Я—А–Њ–≥—А–∞–Љ—Л –њ–Њ —Б–љ–Є–ґ–µ–љ–Є—О –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є, —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Є –Є–љ–≤–∞–ї–Є–і–Є–Ј–∞—Ж–Є–Є –Њ—В —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤ –†–§. –°–±–Њ—А–љ–Є–Ї —В—А—Г–і–Њ–≤ –Т—Б–µ—А–Њ—Б—Б–Є–є—Б–Ї–Њ–є –љ–∞—Г—З–љ–Њ-–њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –Ї–Њ–љ—Д–µ—А–µ–љ—Ж–Є–Є «–Ю—Б—В—А—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П». – –°–∞–Љ–∞—А–∞, 2012. –°. 5–17.
3. –†—Г–Љ—П–љ—Ж–µ–≤–∞ –°.–Р., –°—В—Г–њ–Є–љ –Т.–Р., –Р—Д–∞–љ–∞—Б—М–µ–≤ –Т.–Т., –°–Є–ї–Є–љ–∞ –Х.–Т. –Т—В–Њ—А–Њ–є —И–∞–љ—Б. ––Ь.: –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–∞—П –Є–Ј–і–∞—В–µ–ї—М—Б–Ї–∞—П –≥—А—Г–њ–њ–∞ «–Ь–µ–і–Є—Ж–Є–љ—Б–Ї–∞—П –Ї–љ–Є–≥–∞», 2011. 120 —Б.
4. McCarthy S.T. et al. Low-dose subcutaneous heparin in the prevention of deep-vein thrombosis and pulmonary emboli following acute stroke // Age agein. 1986. Vol. 15. P. 84–88.
5. Kelly J. et al. Venous thromboembolism after acute stroke // Stroke. 2001. Vol. 32. P. 262–267.
6. Cohen A.T., Agnelli G., Anderson F.A. et al. VTE Impact Assessment Group in Europe (VITAE). The number of VTE events and associated morbidity and mortality // Thromb. Haemost. 2007. Vol. 98(4). P. 756–764.
7. Ferri F. Ferri's Clinical Advisor Brown Medical School, Providence, RI. Annual reference covers more than 1,000 current topics to access important diagnostic and therapeutic information. 2004.
8. –†–Њ—Б—Б–Є–є—Б–Ї–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ, –ї–µ—З–µ–љ–Є—О –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є // –§–ї–µ–±–Њ–ї–Њ–≥–Є—П. 2010. вДЦ 1. –°. 4–39.
9. P. Sandercock et al. Anticoagulants for acute ischemic stroke. 2009. Vol. 40. 7: –µ 483 – –µ- 484.
10. –†—Г–Љ—П–љ—Ж–µ–≤–∞ –°.–Р., –°—В—Г–њ–Є–љ –Т.–Р., –Р—Д–∞–љ–∞—Б—М–µ–≤ –Т.–Т., –°–Є–ї–Є–љ–∞ –Х.–Т. –Ъ—А–Є—В–Є—З–µ—Б–Ї–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ. – –Ь.: –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–∞—П –Є–Ј–і–∞—В–µ–ї—М—Б–Ї–∞—П –≥—А—Г–њ–њ–∞ «–Ь–µ–і–Є—Ж–Є–љ—Б–Ї–∞—П –Ї–љ–Є–≥–∞», 2011. 751 —Б.
11. –†—Г–Љ—П–љ—Ж–µ–≤–∞ –°.–Р. –Ъ–Њ–Љ–Љ–µ–љ—В–∞—А–Є–є –Ї —Б—В–∞—В—М–µ Kase C. S. et al. –Э–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є—Б—Е–Њ–і—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ –Є–ї–Є –≥–µ–њ–∞—А–Є–љ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤–µ–љ–Њ–Ј–љ–Њ–є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–Є // Stroke. –Т—Л–њ. 1 (15). 2010. –°. 14.
12. Sherman D. et al. The effi cacy and safety of enoxaparin versus unfractionated heparin for the prevention of venous thromboembolism after acute ischaemic stroke (PREVAIL Study): an open-label randomised comparison // Lancet. 2007. Vol. 369. P. 1347–1355.












