Человек живет в постоянном контакте и сложнейшем взаимодействии с неисчислимым множеством микроорганизмов. Жить без микробов невозможно, но и с многими из них — тоже. Ежегодно, по самым скромным оценкам, не учитывающим недоступные для статистики ВОЗ данные многих развивающихся стран, погибает от пневмонии 3,9 млн человек, от диареи — 1,6 млн, от туберкулеза — 1,6 млн [1].
По данным Департамента здравоохранения г. Москвы за
С учетом нарастающей резистентности флоры к антибиотикам, вероятности аллергических и токсических реакций возникает проблема: что применять вместо антибиотиков или в комплексе с ними?
В авторитетном журнале Science [3] сказано следующее: «Терапия бактериофагами, впервые использованная в России в сталинскую эру, вновь привлекла внимание на Западе как вероятное оружие против
История наших знаний о фагах начинается с российского
Строение и микробиология фага
Бактериофаги — древнейшие вирусы, наиболее распространенный в биосфере биологический объект. Чистая природная вода содержит в 1 мл 2×108 фагов,
Длительное время фаги изучали на примере фагов
Принципы выбора терапии бактериофагами
В многочисленных отечественных и зарубежных публикациях продемонстрирована эффективность применения бактериофагов,
1. Бактериофаги высокоспецифичны и лизируют только «вредные микробы». Специфичность фагов варьирует от крайне избирательной к определенным бактериям (используется в типировании микробов) до относительно широкого спектра лизируемых бактерий. Но даже в этом случае широта воздействия не достигает широты действия антибиотиков. Поэтому, например, при лечении фагами не изменяется естественная флора кишечника, а для лечения инфекций требуется препарат, содержащий несколько фагов (по аналогии с поливалентным препаратом Секстафаг® (пиобактериофаг поливалентный)).
2. Бактериофаги — естественные природные средства. Бактериофаг не может длительно циркулировать в макроорганизме — длительность его жизни лимитирована наличием
3. Бактериофаги эффективны против
При применении бактериофагов следует учитывать, что специфичность фагов может ограничивать их применение в острых случаях.
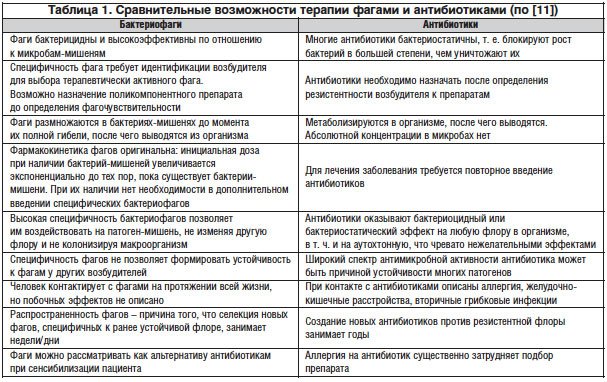
Соотношение бактериофаго- и антибиотикотерапии представлено в таблице 1.
Фаготерапия покровных и барьерных структур тканей
В эксперименте [14, 15] была показана эффективность фагов в лечении кожных инфекций и внутримышечных абсцессов (Pseudomonas (Ps.) aeruginosa, Staphylococcus (S.) aureus). В клинической практике эффективность лечения инфекций ран, инфицированных пострадиационных некрозов была продемонстрирована K. Markoishwili et al. [16] и другими представителями школы грузинского ученого Г. Элиавы.
В нашей стране для наружного применения используют комплексные фаговые препараты. Препарат пиобактериофаг поливалентный (Секстафаг®) для приема внутрь (20 мл 3 р./сут, 7–15 дней), местно или наружно способен лизировать стафило- и стрептококки, патогенные кишечные и синегнойные бактерии (Proteus mirabilis, Proteus vulgaris, Klebsiella pneumoniae). Это позволяет применять его при
Также существует гель с бактериофагами Отофаг производства НПЦ «МикроМир». Гель Отофаг содержит 32 вида бактериофагов, лизирующих Bacteroides spp., E. coli spp., Haemophilus influenzae spp., Klebsiella spp., Moraxella catarrhalis, Morganella morganii, Neisseria spp., Proteus vulgaris spp., Providencia rettgeri spp., Ps. aeruginosa spp., S. aureus spp., Streptococcus pyogenes spp. Таким образом, препарат эффективен по отношению к большой группе гноеродных бактерий и используется местно для профилактики бактериальных воспалительных заболеваний уха (наружный и средний отит) и их рецидивов, заболеваний носа (гайморит, ринит), горла (фарингит, абсцессы, ангина, хронический тонзиллит) и других респираторных заболеваний (бронхит, эпиглоттит, грипп, ОРВИ), а также для профилактики бактериальных осложнений при хирургических вмешательствах и других лечебных манипуляциях в области
Гель Отофаг применяют местно в дозировке 1–2 мл: для профилактики рецидивов заболеваний — 2–3 р./сут в течение 7–10 дней, при наличии бактериального воспалительного заболевания
Применение фагов как профилактического, лечебного и противорецидивного средства продемонстрировало свою эффективность в самой частой педиатрической группе: пациенты с инфекционной патологией верхних дыхательных путей (риносинуситы, тонзиллиты, ларингиты, фарингиты). Обычно эти инфекции трактуются как вирусные, хотя достаточно часто причиной бывают и бактерии, или бактериальная флора активируется в процессе манифестации вирусной инфекции.
Подавляющее большинство всех случаев острых заболеваний детей, особенно младшего возраста, вызваны острой респираторной инфекцией (ОРИ). Первичная заболеваемость детей и подростков по г. Москве за
Инфекционный ринит дебютирует первоначально, как правило, как вирусный с типичным водянистым или
Присоединение бактериальной инфекции с ее распространением на придаточные пазухи носа приводит к синуситу. Любые нарушения цилиарного клиренса, вентиляции, местного или системного иммунного ответа создают условия для хронизации синусита, вылечить который без воздействия на первоначальные причины невозможно. Признаки синусита:
- сохранение симптомов респираторной инфекции на протяжении 7–10 дней;
- дневной кашель и ринорея;
- заложенность носа;
- нередко низкий субфебрилитет;
- средний отит (у 60–70% больных);
- беспокойство;
- головные боли.
К признакам тяжелого течения синусита или его осложнений относятся гнойная ринорея, лихорадка выше 39ºС и периорбитальный отек. При остром и подостром синусите чаще обнаруживают Streptococcus pneumoniae, реже — Haemophilus (H.) influenzae, Moraxella catarrhalis, Streptococcus pyogenes (β-гемолитический). Хронический синусит чаще полимикробный, вызывается α-гемолитическим стрептококком, S. aureus, коагулазонегативными стафилококками, нетипичными H. influenzae, а также Moraxella catarrhalis и анаэробными бактериями (Peptostreptococcus spp., Prevotella, Bacteroides, Fusobacterium spр.), после многих курсов антибиотиков (или у иммунокомпрометированных пациентов) — Pseudomonads. Эти сведения еще раз заставляют оценить место и роль поливалентных бактериофагов в комплексном лечении синуситов.
При лечении риносинуситов препаратом пиобактериофаг путем его местного введения в пазухи отмечено значительное улучшение, нормализовались показатели завершенности фагоцитоза, что указывало на снижение интенсивности воспаления с восстановлением адекватного иммунного ответа слизистых оболочек носа. Таким образом, препарат пиобактериофаг поливалентный (Секстафаг®) обладает противовоспалительными и иммунорегуляторными свойствами, что проявляется нормализацией показателей местного иммунитета. В то же время применение антибиотиков при лечении больных хроническим гнойным риносинуситом сопровождается сохранением признаков воспаления в виде активации нейтрофильного звена иммунной системы, увеличением внеклеточной пероксидазной активности и угнетением процесса фагоцитоза с нарушением механизмов завершенности в клетках [18]. Пиобактериофаг при местном введении в пазухи улучшает показатели завершенности фагоцитоза, что свидетельствует о снижении интенсивности воспаления с восстановлением адекватного иммунного ответа слизистых оболочек носа [19].
Большой проблемой педиатрии являются тонзиллофарингиты, аденоидиты. За 1 год не менее 10% всей детской популяции переносят тонзиллофарингит, из них у 25–50% причиной является стрептококк группы А. 20% здоровых детей являются носителями стрептококка, А [20, 21]. Хроническая гипертрофия аденоидных вегетаций может приводить к нарушению естественного дренирования евстахиевых труб и восхождению инфекции в среднее ухо. Рецидивирующий аденоидит — самая частая причина кашля у детей: стекающая с воспаленной поверхности небной миндалины слизь («постназальная капель») раздражает верхние дыхательные пути и вызывает кашель. Чаще всего на аденоидных вегетациях обнаруживают H. influenzae, Streptococcus (S.) β-hemolytic гр. А, S. aureus, Moraxella (M.) catarrhalis, Streptococcus (S.) pneumoniae (по убывающей). При аденоидитах причинами среднего отита и риносинусита у детей чаще бывают антибиотикорезистентные H. influenzae, M. catarrhalis, S. pneumoniae [22]. Безусловно, это служит основанием для топического применения специфических фагов, хотя и отечественные авторы, с надеждой указывающие на это направление, ссылаются на недостаточную доказательность фаготерапии хронического аденоидита в детской практике [23]. Другие исследователи более оптимистичны. Показано, что введение в комплекс терапии при хроническом аденоидите местного бактериофага приводило к существенному улучшению результатов [24]. Но непосредственный эффект лечения и отдаленные последствия, видимо, во многом определяются генетически. В сравнительном исследовании по проверке гипотезы положительного влияния хирургического удаления аденоидов и миндалин на вероятность развития осложнений, связанных со стрептококковой инфекцией, показано, что значительной разницы в титре антистрептококковых антител, связанных со S. β-hemolytic гр. А детских аутоиммунных нейропсихиатрических нарушений,
При обследовании пациентов с компенсированной формой хронического тонзиллита S. aureus выделен у 92,5%. Чувствительность культур золотистого стафилококка к стафилококковому бактериофагу оказалась очень высокой (97,4%). По результатам монотерапии специфическим бактериофагом и комбинированного лечения зарегистрированы клиническое улучшение и уменьшение высеваемости S. aureus со слизистой оболочки миндалин [26].
Обострения хронического ларингита сопровождается обсеменением слизистой гортани патогенной микрофлорой. Использование в комплексном лечении таких пациентов специфического бактериофага в виде инстилляций в гортань, а в случае тяжелого обострения — в виде приема внутрь позволяет существенно сократить продолжительность лечения, значительно повышая его качество, достичь более длительной ремиссии болезни и снизить частоту обострений [27].
Эффективность бактериофаготерапии у иммунокомпрометированных пациентов доказана в зарубежных исследованиях [28].
Бактериофаги продемонстрировали эффективность при лечении инфекции, находящейся под биопленкой. Биопленка — плотная колония микроорганизмов на поверхности биологических или небиологических сред, окружающих себя секретируемым экстрацеллюлярным полимером, практически непроницаемым для антибиотиков. Способность бактерий образовывать биопленку — важнейшее условие их выживания на поверхности тканей или медицинских объектов (катетеры, имплантаты).
Применение бактериофагов известно также при собственно кишечных инфекциях [32] и при сепсисе, вызванном кишечной инфекцией Ps. aeruginosa [33]. При этом в эксперименте прием бактериофага per os привел к 67% выживаемости в экспериментальной группе животных и к 0% в контрольной.
Особое внимание привлекает возможность бактериофаготерапии при внутренних и системных инфекциях. Большинство таких исследований принадлежит отечественным ученым. Показано, что совместное применение бактериофагов и антибиотиков в лечении детей с осложненной инфекцией мочевыводящих путей значительно эффективней, чем изолированная антибиотикотерапия [34].
Есть много нерешенных проблем, которые сводятся к организации многоцентровых исследований по принципам доказательной медицины, соотношению антибиотиков и бактериофагов при лечении.
В любом случае можно утверждать, что это направление перспективно и достаточно обнадеживающе, особенно при инфицировании резистентными штаммами.
Разнообразие лекарственных форм бактериофагов (таблетки, гели, растворы) позволяет применять их как перорально, так и наносить на раневые поверхности, вводить в полости организма. Препараты бактериофагов широко применяются в педиатрии, акушерстве и гинекологии, офтальмологии
Заключение
История изучения бактериофагов и анализ их применения в медицине позволяют с уверенностью сказать, что бактериофаги могут оказаться чрезвычайно востребованными в лечении самых разнообразных инфекционных заболеваний человека, особенно при антибиотикорезистентных возбудителях. Каждый препарат, тем более обладающий качествами живого и вводимый в организм человека, имеет свои положительные и вероятностные отрицательные эффекты. В частности, литический эффект фагов, приводящий к разрушению клеточной стенки микроба, сопровождается выбросом в кровь большого количества эндотоксинов, что приводит к эффекту септицемии. Обсуждается необходимость приема активированного угля или иных адсорбентов. Более перспективным направлением кажется генетическая инженерия фага, которая сохраняла бы свой
В настоящее время в большинстве публикаций указывается на безопасность фаготерапии; хорошо организованные двойные слепые рандомизированные контролируемые исследования позволят определить безопасность и эффективность фагов как альтернативы антибиотикам при инфекциях с полирезистентной флорой [39]. Дальнейшее изучение возможностей бактериофаготерапии будет зависеть от объективной заинтересованности медицинского сообщества, проведения многоцентровых независимых исследований, развития вирусологии с ее возможностями получения новых чистых препаратов фагов.
1 Сборник среднемосковских основных показателей деятельности
2 Выбор инфекционного агента для опытов не был случайным: отец
3 Департамент здравоохранения г. Москвы. Доклад о состоянии здоровья населения г. Москвы в 2008 г.












