–Я–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –Т–Я–І –≤ 3 —А–∞–Ј–∞ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –≥–µ–љ–Є—В–∞–ї—М–љ—Л–є –≥–µ—А–њ–µ—Б –Є –љ–µ —Г—Б—В—Г–њ–∞–µ—В –≥–Њ–љ–Њ—А–µ–µ [4]. –Т –†–Њ—Б—Б–Є–Є —Г—А–Њ–≤–µ–љ—М –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –∞–љ–Њ–≥–µ–љ–Є—В–∞–ї—М–љ—Л–Љ–Є –±–Њ—А–Њ–і–∞–≤–Ї–∞–Љ–Є –≤ 2011 –≥. —Б–Њ—Б—В–∞–≤–Є–ї 29,4 –љ–∞ 100 —В—Л—Б. –љ–∞—Б–µ–ї–µ–љ–Є—П [5]. –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –Ї 50-—В–Є –≥–Њ–і–∞–Љ 80% –ґ–µ–љ—Й–Є–љ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ—Л –Т–Я–І [6]. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є–µ –ґ–µ–љ—Й–Є–љ –Т–Я–І —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ–µ–є—И–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –Ї–∞–љ—Ж–µ—А–Њ–≥–µ–љ–µ–Ј–∞ —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є - —А–∞–Ј–ї–Є—З–љ—Л–µ —В–Є–њ—Л –Т–Я–І –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –≤ 99,7% –±–Є–Њ–њ—В–∞—В–Њ–≤, –≤–Ј—П—В—Л—Е —Г –±–Њ–ї—М–љ—Л—Е —А–∞–Ї–Њ–Љ —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є –њ–Њ –≤—Б–µ–Љ—Г –Љ–Є—А—Г [7].
–°–Њ–≥–ї–∞—Б–љ–Њ —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–Љ –њ—А–Є–љ—Ж–Є–њ–∞–Љ –њ–Њ –≤–µ–і–µ–љ–Є—О –±–Њ–ї—М–љ—Л—Е —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є, —Б–≤—П–Ј–∞–љ–љ—Л–Љ–Є —Б –Т–Я–І, –ї–µ—З–µ–љ–Є–µ –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –ї–Є–±–Њ –љ–∞ —А–∞–Ј—А—Г—И–µ–љ–Є–µ —В–µ–Љ –Є–ї–Є –Є–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –њ–∞–њ–Є–ї–ї–Њ–Љ–∞—В–Њ–Ј–љ—Л—Е –Њ—З–∞–≥–Њ–≤, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є—Е –љ–∞ –Љ–µ—Б—В–µ –≤–љ–µ–і—А–µ–љ–Є—П –≤–Є—А—Г—Б–∞, –ї–Є–±–Њ –љ–∞ —Б—В–Є–Љ—Г–ї—П—Ж–Є—О –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞, –ї–Є–±–Њ –љ–∞ —Б–Њ—З–µ—В–∞–љ–Є–µ —Н—В–Є—Е –њ–Њ–і—Е–Њ–і–Њ–≤ [8].
–Т –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–Љ —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–µ –њ–Њ –ї–µ—З–µ–љ–Є—О –і–µ—А–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (–њ–Њ–і —А–µ–і. –Р. –Ъ–∞—Ж–∞–Љ–±–∞—Б–∞) –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ —Б–ї–µ–і—Г—О—Й–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П –∞–љ–Њ–≥–µ–љ–Є—В–∞–ї—М–љ—Л—Е –±–Њ—А–Њ–і–∞–≤–Њ–Ї [9]:
I. –Ь–µ—Б—В–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л.
1. –Ъ–µ—А–∞—В–Њ–ї–Є—В–Є–Ї–Є –Є –њ—А–Є–ґ–Є–≥–∞—О—Й–Є–µ —Б—А–µ–і—Б—В–≤–∞: —Б–∞–ї–Є—Ж–Є–ї–Њ–≤–∞—П –Є –Љ–Њ–ї–Њ—З–љ–∞—П –Ї–Є—Б–ї–Њ—В—Л, —Г–Ї—Б—Г—Б–љ–∞—П –Ї–Є—Б–ї–Њ—В–∞ –Є —В—А–Є—Е–ї–Њ—А—Г–Ї—Б—Г—Б–љ–∞—П –Ї–Є—Б–ї–Њ—В–∞.
2. –¶–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л: –њ–Њ–і–Њ—Д–Є–ї–ї–Є–љ,
3. –Ш–љ–≥–Є–±–Є—В–Њ—А—Л –Ф–Э–Ъ: —Д—В–Њ—А—Г—А–∞—Ж–Є–ї, –±–ї–µ–Њ–Љ–Є—Ж–Є–љ,
4. –Ь–µ—Б—В–љ—Л–µ —А–µ—В–Є–љ–Њ–Є–і—Л.
II. –Ф–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–µ –Љ–µ—В–Њ–і—Л.
1. –≠–ї–µ–Ї—В—А–Њ—Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л.
2. –Ъ—А–Є–Њ—В–µ—А–∞–њ–Є—П.
3. –Ы–∞–Ј–µ—А–Њ—В–µ—А–∞–њ–Є—П.
4. –•–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–µ—З–µ–љ–Є–µ.
5. –Ы–∞–Ј–µ—А–љ—Л–є —Д–Њ—В–Њ—В–µ—А–Љ–Њ–ї–Є–Ј.
III. –Я—А–µ–њ–∞—А–∞—В—Л — –Љ–Њ–і–Є—Д–Є–Ї–∞—В–Њ—А—Л –Ї–ї–µ—В–Њ–Ї.
1. –°–Є—Б—В–µ–Љ–љ—Л–µ —А–µ—В–Є–љ–Њ–Є–і—Л.
IV. –Я—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Є –Љ–Њ–і—Г–ї—П—В–Њ—А—Л –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞.
1. –Ш–љ—В–µ—А—Д–µ—А–Њ–љ—Л (–Ш–§).
2. –Ш–Љ–Є—Е–Є–Љ–Њ–і.
3. –Ш–љ–Њ–Ј–Є–љ –њ—А–∞–љ–Њ–±–µ–Ї—Б (–Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ).
–І–∞—Б—В–Њ—В–∞ —А–µ—Ж–Є–і–Є–≤–Њ–≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—Б–Њ–Ї–∞ –њ—А–Є –ї—О–±–Њ–Љ —Б–њ–Њ—Б–Њ–±–µ –ї–µ—З–µ–љ–Є—П [10]. –£—А–Њ–≤–µ–љ—М —А–µ—Ж–Є–і–Є–≤–Є—А–Њ–≤–∞–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–µ—В –≤ —Б—А–µ–і–љ–µ–Љ 25–30% –≤ —В–µ—З–µ–љ–Є–µ 3 –Љ–µ—Б. –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П [11, 12]. –†–µ—Ж–Є–і–Є–≤—Л –∞–љ–Њ–≥–µ–љ–Є—В–∞–ї—М–љ—Л—Е –±–Њ—А–Њ–і–∞–≤–Њ–Ї —З–∞—Й–µ –≤—Б–µ–≥–Њ —Б–≤—П–Ј–∞–љ—Л —Б —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–µ–є –Є–љ—Д–µ–Ї—Ж–Є–Є, –∞ –љ–µ —Б —А–µ–Є–љ—Д–µ–Ї—Ж–Є–µ–є –Њ—В –њ–Њ–ї–Њ–≤–Њ–≥–Њ –њ–∞—А—В–љ–µ—А–∞.
–Ы–µ—З–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е —Б —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ–Є –Њ—Б—В—А–Њ–Ї–Њ–љ–µ—З–љ—Л–Љ–Є –Ї–Њ–љ–і–Є–ї–Њ–Љ–∞–Љ–Є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –і–ї—П –≤—А–∞—З–∞ –љ–∞–Є–±–Њ–ї–µ–µ —Б–ї–Њ–ґ–љ—Г—О –Ј–∞–і–∞—З—Г,
–¶–µ–ї—М –љ–∞—Б—В–Њ—П—Й–µ–є —Б—В–∞—В—М–Є — –і–∞—В—М –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–µ –Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –Љ–µ—В–Њ–і–∞—Е —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Я–Т–Ш.
–Я–∞—В–Њ–≥–µ–љ–µ–Ј –≤–Є—А—Г—Б–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є — –Є–Љ–Љ—Г–љ–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–є; –Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є—П –Њ–±—Л—З–љ–Њ —Б–≤—П–Ј–∞–љ–∞ —Б –і–µ—Д–µ–Ї—В–∞–Љ–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Ј–≤–µ–љ—М–µ–≤ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞. –Т–∞–ґ–љ–µ–є—И–µ–є –њ—А–Є—З–Є–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є–Є –Я–Т–Ш –Є –µ–µ —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–≥–Њ —В–µ—З–µ–љ–Є—П —П–≤–ї—П—О—В—Б—П –љ–∞—А—Г—И–µ–љ–Є—П –≤ –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ–µ [13, 60]. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Т–Я–І –Є–Љ–µ–µ—В —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л, –њ–Њ–і–∞–≤–ї—П—О—Й–Є–µ –Ї–∞–Ї –Ї–ї–µ—В–Њ—З–љ—Л–є, —В–∞–Ї –Є –≥—Г–Љ–Њ—А–∞–ї—М–љ—Л–є –Є–Љ–Љ—Г–љ–Є—В–µ—В, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –Є–љ—В–µ—А—Д–µ—А–Њ–љ–Њ–≤–Њ–µ –Ј–≤–µ–љ–Њ –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л [14].
–Ю –≤–ї–Є—П–љ–Є–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–∞
–Ъ–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ —В–∞–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е –љ–∞–Љ–љ–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–µ–µ, —З–µ–Љ —В–Њ–ї—М–Ї–Њ –і–µ—Б—В—А—Г–Ї—Ж–Є—П –Њ—З–∞–≥–Њ–≤. –Я—А–Є –ї–µ—З–µ–љ–Є–Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–є –Я–Т–Ш —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є –љ–µ–≤—Л—Б–Њ–Ї–∞. –Ф–∞–ґ–µ –њ–Њ—Б–ї–µ –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ—Л—Е –Ї—Г—А—Б–Њ–≤ –ї–µ—З–µ–љ–Є—П —А–µ—Ж–Є–і–Є–≤–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–µ–Ї—А–∞—Й–∞–µ—В—Б—П –ї–Є—И—М —Г 40% –±–Њ–ї—М–љ—Л—Е [18]. –Ґ—Й–∞—В–µ–ї—М–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Б—В–Њ–ї—М –љ–µ–≤—Л—Б–Њ–Ї–Є–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Б–≤—П–Ј–∞–љ —Б —В–µ–Љ, —З—В–Њ –љ–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Г—Б—В—А–∞–љ–µ–љ–Є—П –≥–µ–љ–Њ–Љ–∞ –Т–Я–І –Є–Ј –њ–Њ—А–∞–ґ–µ–љ–Є–є, —Г—Б—В–Њ–є—З–Є–≤—Л—Е –Ї –ї–µ—З–µ–љ–Є—О (–њ–Њ –і–∞–љ–љ—Л–Љ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Љ–µ—В–Њ–і–Њ–Љ –њ–Њ–ї–Є–Љ–µ—А–∞–Ј–љ–Њ–є —Ж–µ–њ–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є (–Я–¶–†),
–Э–∞–Є–±–Њ–ї—М—И–Є–є –Є–љ—В–µ—А–µ—Б –≤—Л–Ј—Л–≤–∞–µ—В –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ —В–µ—А–∞–њ–Є–Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–є –Я–Т–Ш –њ—А–µ–њ–∞—А–∞—В–Њ–≤ III –Є IV –≥—А—Г–њ–њ –њ–Њ –≤—Л—И–µ—Г–Ї–∞–Ј–∞–љ–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Ъ–∞—Ж–∞–Љ–±–∞—Б–∞ — –Љ–Њ–і–Є—Д–Є–Ї–∞—В–Њ—А–Њ–≤ –Ї–ї–µ—В–Њ–Ї –Є –Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞ –Ъ –њ—А–µ–њ–∞—А–∞—В–∞–Љ, –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—Й–Є–Љ –љ–∞ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–µ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–µ –Ї–ї–µ—В–Ї–Є, –Љ–Њ–ґ–љ–Њ –Њ—В–љ–µ—Б—В–Є
–Я–Њ–≤—Л—Б–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –Є —Б–љ–Є–Ј–Є—В—М —З–∞—Б—В–Њ—В—Г —А–µ—Ж–Є–і–Є–≤–Њ–≤ –њ–Њ–Ј–≤–Њ–ї—П—О—В –Љ–Њ–і—Г–ї—П—В–Њ—А—Л –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞. –Ґ–∞–Ї –Ї–∞–Ї –Т–Я–І —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –≤ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е, –∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л—Е –Є —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –љ–µ –і–∞–µ—В –∞–±—Б–Њ–ї—О—В–љ–Њ–є –≥–∞—А–∞–љ—В–Є–Є –њ—А–Њ—В–Є–≤ —А–∞–Ј–≤–Є—В–Є—П —А–µ—Ж–Є–і–Є–≤–Њ–≤, –і–ї—П –Є—Е –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П –±–Њ–ї–µ–µ –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ш–§ –Є–ї–Є –µ–≥–Њ –Є–љ–і—Г–Ї—В–Њ—А–Њ–≤, –∞ —В–∞–Ї–ґ–µ –і—А—Г–≥–Є—Е –∞–Ї—В–Є–≤–∞—В–Њ—А–Њ–≤ –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–і—К—О–≤–∞–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є [14, 21]. –Ъ–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є—П –Љ–Њ–ґ–µ—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –њ—А–Є –ї–µ—З–µ–љ–Є–Є —Г–њ–Њ—А–љ—Л—Е, –њ–ї–Њ—Е–Њ –њ–Њ–і–і–∞—О—Й–Є—Е—Б—П –ї–µ—З–µ–љ–Є—О –±–Њ—А–Њ–і–∞–≤–Њ–Ї –Є –Ї–Њ–љ–і–Є–ї–Њ–Љ [22]. –Ґ–∞–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ –Љ–Њ–ґ–µ—В –њ–Њ–Ј–≤–Њ–ї–Є—В—М —Б –љ–∞–Є–±–Њ–ї—М—И–µ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –њ—А–µ–Њ–і–Њ–ї–µ—В—М –Њ—Б–љ–Њ–≤–љ—Г—О –њ—А–Њ–±–ї–µ–Љ—Г –Я–Т–Ш -—А–µ—Ж–Є–і–Є–≤—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є.
1. –Ш–љ—В–µ—А—Д–µ—А–Њ–љ—Л
–° —Г—З–µ—В–Њ–Љ –≤–Є—А—Г—Б–љ–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –Є–Љ–Љ—Г–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –і–ї—П —В–µ—А–∞–њ–Є–Є –Њ—Б—В—А–Њ–Ї–Њ–љ–µ—З–љ—Л—Е –Ї–Њ–љ–і–Є–ї–Њ–Љ, –≤—Б–µ–≥–і–∞ –±—Л–ї–Є –Ш–§. –Ш—Е –Љ–Њ–ґ–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М –Љ–µ—Б—В–љ–Њ, –≤–љ—Г—В—А–Є–Њ—З–∞–≥–Њ–≤–Њ –Є —Б–Є—Б—В–µ–Љ–љ–Њ (–њ–Њ–і–Ї–Њ–ґ–љ–Њ,
–Я–Њ –і–∞–љ–љ—Л–Љ —А–∞–Ј–ї–Є—З–љ—Л—Е –∞–≤—В–Њ—А–Њ–≤, –≤–љ—Г—В—А–Є–Њ—З–∞–≥–Њ–≤–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞- –Є
–Э–∞ —А–Њ—Б—Б–Є–є—Б–Ї–Њ–Љ —А—Л–љ–Ї–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ —И–Є—А–Њ–Ї–Є–є –≤—Л–±–Њ—А –Ш–§ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В–µ–ї–µ–є, –Ї–∞–Ї –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л—Е, —В–∞–Ї –Є –Ј–∞—А—Г–±–µ–ґ–љ—Л—Е. –Я—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–µ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —А–µ–Ї–Њ–Љ–±–Є–љ–∞–љ—В–љ—Л–µ, –∞ –љ–µ —З–µ–ї–Њ–≤–µ—З–µ—Б–Ї–Є–µ –Ш–§: —А–µ–Ї–Њ–Љ–±–Є–љ–∞–љ—В–љ—Л–є –Ш–§
–°–Њ—З–µ—В–∞–љ–Є–µ –Ш–§ —Б –ї–∞–Ј–µ—А–Њ—В–µ—А–∞–њ–Є–µ–є –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ, —З–µ–Љ —В–Њ–ї—М–Ї–Њ –ї–∞–Ј–µ—А–Њ—В–µ—А–∞–њ–Є—П: –њ–Њ–ї–љ–Њ–µ –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ –±–Њ—А–Њ–і–∞–≤–Њ–Ї –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г 52–81,5% –Є 19–61% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [30–34].
2. –Ш–Љ–Љ—Г–љ–Њ—В—А–Њ–њ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л
–Т–Њ–Ј–і–µ–є—Б—В–≤–Њ–≤–∞—В—М –љ–∞ –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ—Л–є –Є–Љ–Љ—Г–љ–Є—В–µ—В
–Љ–Њ–ґ–љ–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –Є–љ–і—Г–Ї—В–Њ—А–Њ–≤ —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ –Ш–§ –Є –і—А—Г–≥–Є—Е –∞–Ї—В–Є–≤–∞—В–Њ—А–Њ–≤ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –Љ–µ—Б—В–љ–Њ –Є–ї–Є —Б–Є—Б—В–µ–Љ–љ–Њ. –Э–∞ —А–Њ—Б—Б–Є–є—Б–Ї–Њ–Љ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–Љ —А—Л–љ–Ї–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –Љ–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–∞–Ї—В–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —Б–Њ–≥–ї–∞—Б–љ–Њ –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В–µ–ї—П –Є–ї–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –≤ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Я–Т–Ш –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є –Є–ї–Є –≤ –≤–Є–і–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є. –Ю–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ–Є —Г—Б–ї–Њ–≤–Є—П–Љ–Є –њ—А–Є —Б–Є—Б—В–µ–Љ–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ —П–≤–ї—П—О—В—Б—П –Ї–Њ–љ—В—А–Њ–ї—М –Є–Љ–Љ—Г–љ–Њ–≥—А–∞–Љ–Љ—Л –і–Њ, –≤–Њ –≤—А–µ–Љ—П –Є –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –Ї–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є—П –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–∞.
–° —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –њ—А–µ–Њ–і–Њ–ї–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —А–µ—Ж–Є–і–Є–≤–Њ–≤ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –Є–љ—В–µ—А–µ—Б –Љ–µ—Б—В–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–≥–Њ –њ—А–Њ–Є–Ј–≤–Њ–і–љ–Њ–≥–Њ
–Я–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–Ї—В–Є–≤–∞—В–Њ—А–∞ –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞ — –Ї–Є—Б–ї–Њ–≥–Њ
–Ь—Л –Є–Љ–µ–µ–Љ —Б–Њ–±—Б—В–≤–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ–± –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–Љ —В–µ—З–µ–љ–Є–Є –Я–Т–Ш –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –ї—О–±—Л–Љ –Є–Ј –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤. –С–Њ–ї—М–љ—Л–Љ —Г–і–∞–ї—П–ї–Є –Њ—Б—В—А–Њ–Ї–Њ–љ–µ—З–љ—Л–µ –Ї–Њ–љ–і–Є–ї–Њ–Љ—Л –Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –љ–∞–Ј–љ–∞—З–∞–ї–Є
–Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ (–Є–љ–Њ–Ј–Є–љ –њ—А–∞–љ–Њ–±–µ–Ї—Б)
–Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ (–Є–љ–Њ–Ј–Є–љ –њ—А–∞–љ–Њ–±–µ–Ї—Б) — –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А, —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–Є–є –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ—Г—О –Ј–∞—Й–Є—В—Г –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –Я—А–µ–њ–∞—А–∞—В –љ–Њ—А–Љ–∞–ї–Є–Ј—Г–µ—В –і–µ—Д–Є—Ж–Є—В –Є–ї–Є –і–Є—Б—Д—Г–љ–Ї—Ж–Є—О –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞, –Є–љ–і—Г—Ж–Є—А—Г—П —Б–Њ–Ј—А–µ–≤–∞–љ–Є–µ –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–Є–µ
–Ю–і–љ–Є–Љ –Є–Ј –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –њ—А–µ–њ–∞—А–∞—В–∞ —П–≤–ї—П—О—В—Б—П –Є–љ—Д–µ–Ї—Ж–Є–Є, –≤—Л–Ј–≤–∞–љ–љ—Л–µ –Т–Я–І: –Њ—Б—В—А–Њ–Ї–Њ–љ–µ—З–љ—Л–µ –Ї–Њ–љ–і–Є–ї–Њ–Љ—Л, –Я–Т–Ш –≤—Г–ї—М–≤—Л, –≤–∞–≥–Є–љ—Л –Є —И–µ–є–Ї–Є –Љ–∞—В–Ї–Є (–≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є).
–Т –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–Љ —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–µ –њ–Њ –ї–µ—З–µ–љ–Є—О –і–µ—А–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї–µ–Ј–љ–µ–є –Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ –≤—Е–Њ–і–Є—В –≤ —Б–њ–Є—Б–Њ–Ї —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П —В–µ—А–∞–њ–Є–Є –Њ—Б—В—А–Њ–Ї–Њ–љ–µ—З–љ—Л—Е –Ї–Њ–љ–і–Є–ї–Њ–Љ –Є –±–Њ—А–Њ–і–∞–≤–Њ–Ї. –Ю–љ —В–∞–Ї–ґ–µ –њ—А–Є—Б—Г—В—Б—В–≤—Г–µ—В –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–Љ –њ—А–Њ—В–Њ–Ї–Њ–ї–µ –≤–µ–і–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є, –њ–µ—А–µ–і–∞–≤–∞–µ–Љ—Л–Љ–Є –њ–Њ–ї–Њ–≤—Л–Љ –њ—Г—В–µ–Љ [51].
–Т –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О —Г–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–є –Я–Т–Ш –Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ –љ–∞–Ј–љ–∞—З–∞—О—В –њ–Њ 3 –≥/—Б—Г—В (2 —В–∞–±–ї–µ—В–Ї–Є 3 —А./—Б—Г—В) –Ї–∞–Ї –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї –Љ–µ—Б—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є–ї–Є –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–Љ –Љ–µ—В–Њ–і–∞–Љ –≤ —В–µ—З–µ–љ–Є–µ 14–28 –і–љ–µ–є, –і–∞–ї–µ–µ —Б
–Ш–Ј–≤–µ—Б—В–љ–Њ –Њ –Ј–∞—А—Г–±–µ–ґ–љ–Њ–Љ –Њ–њ—Л—В–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–љ–Њ–Ј–Є–љ –њ—А–∞–љ–Њ–±–µ–Ї—Б–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ —В–µ—А–∞–њ–Є–Є, –і–Њ–њ–Њ–ї–љ—П—О—Й–µ–є –і–µ—Б—В—А—Г–Ї—Ж–Є—О –∞–љ–Њ–≥–µ–љ–Є—В–∞–ї—М–љ—Л—Е –±–Њ—А–Њ–і–∞–≤–Њ–Ї [52]. –Я—А–µ–њ–∞—А–∞—В –њ—А–Є–Љ–µ–љ—П–ї–Є –њ–Њ 1 –≥ 3 —А./—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 28 –і–љ–µ–є. –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ —А–µ—Ж–Є–і–Є–≤–Њ–≤ —Б–љ–Є–ґ–∞–ї–Њ—Б—М —Б 41% –њ–Њ—Б–ї–µ –Ї—А–Є–Њ–і–µ—Б—В—А—Г–Ї—Ж–Є–Є –і–Њ 6% –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ–∞ –Є –њ–Њ–і–Њ—Д–Є–ї–ї–Њ—В–Њ–Ї—Б–Є–љ–∞.
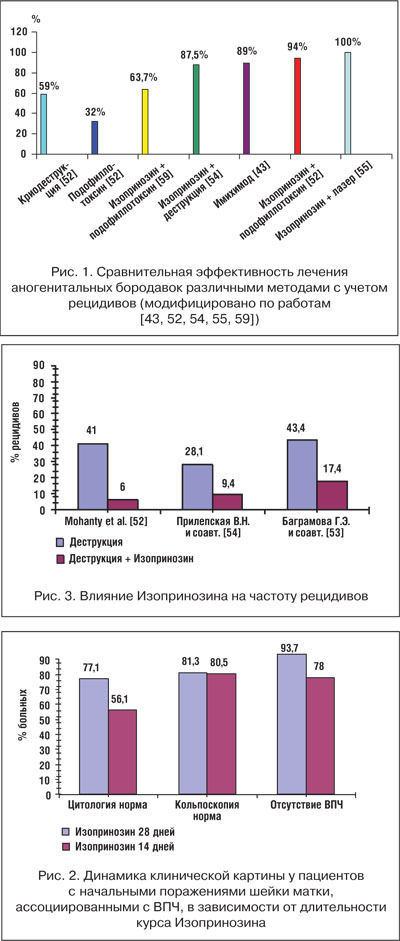
–С–ї–Є–Ј–Ї–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –≤–ї–Є—П–љ–Є—П –Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ–∞ –љ–∞ —З–∞—Б—В–Њ—В—Г —А–µ—Ж–Є–і–Є–≤–Њ–≤ –њ–Њ–ї—Г—З–µ–љ—Л –≤ —А–∞–±–Њ—В–µ
–Я–Њ—Е–Њ–ґ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ї–∞–Ј–∞–љ—Л –≤ —А–∞–±–Њ—В–∞—Е
–Э–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ–Њ–≤—Л—Б–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–∞–Ј–µ—А–Њ—В–µ—А–∞–њ–Є–Є —Ж–µ—А–≤–Є–Ї–∞–ї—М–љ—Л—Е –Є –≤—Г–ї—М–≤–Њ–≤–∞–≥–Є–љ–∞–ї—М–љ—Л—Е –Ї–Њ–љ–і–Є–ї–Њ–Љ –і–Њ 100% (—А–Є—Б. 1) [55].
–Ю—З–µ–љ—М –≤–∞–ґ–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–є –Я–Т–Ш —П–≤–ї—П–µ—В—Б—П –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ –≥–µ–љ–Њ–Љ–∞ –Т–Я–І –Є–Ј –Њ—З–∞–≥–Њ–≤ –њ–Њ—А–∞–ґ–µ–љ–Є—П. –Я—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ–∞ —Н—В–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Љ–Њ–ґ–љ–Њ –і–Њ—Б—В–Є—З—М –≤ 98% —Б–ї—Г—З–∞–µ–≤ [56]. –Ш–љ—В–µ—А–µ—Б–љ–Њ, —З—В–Њ —Б—В–µ–њ–µ–љ—М —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Є –≤–Є—А—Г—Б–∞ –Ј–∞–≤–Є—Б–Є—В –Њ—В –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є. –Т —Н—В–Њ–Љ –ґ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ–Ї–∞–Ј–∞–љ–Њ –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ –≤–Є—А—Г—Б–∞ –≤ 66% —Б–ї—Г—З–∞–µ–≤ –њ–Њ—Б–ї–µ –Њ–і–љ–Њ–≥–Њ
–С—Л–ї –њ—А–Њ–≤–µ–і–µ–љ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ–∞[58]. –Ф–∞–љ–љ—Л–µ –Є–Ј 15 –Є—Б—В–Њ—З–љ–Є–Ї–Њ–≤, –≤ –Ї–Њ—В–Њ—А—Л—Е –Њ–њ–Є—Б–∞–љ—Л 2369 —Б–ї—Г—З–∞–µ–≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ш–Ј–Њ–њ—А–Є–љ–Њ–Ј–Є–љ–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є, 3369 — –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –і—А—Г–≥–Є–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є, –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б 71 –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ю—Б–љ–Њ–≤–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї—О–±–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ —Г–і–∞–ї–µ–љ–Є—П –∞–љ–Њ–≥–µ–љ–Є—В–∞–ї—М–љ—Л—Е –±–Њ—А–Њ–і–∞–≤–Њ–Ї —П–≤–ї—П–µ—В—Б—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ —А–µ—Ж–Є–і–Є–≤–Њ–≤ (—А–Є—Б. 3). –Т –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В–µ –Љ—Л –њ–Њ—Б—В–∞—А–∞–ї–Є—Б—М —Б–і–µ–ї–∞—В—М –∞–Ї—Ж–µ–љ—В –љ–∞ –Љ–µ—В–Њ–і–Є–Ї–∞—Е, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є—Е –±—Л—Б—В—А–Њ –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –±–Њ—А–Њ—В—М—Б—П —Б —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –Я–Т–Ш. –Ф–ї—П —Н—В–Њ–≥–Њ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–Њ—В—А–Њ–њ–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Ґ–∞–Ї–Њ–є –њ–Њ–і—Е–Њ–і –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Я–Т–Ш, —З—В–Њ –і–Њ–ї–ґ–љ–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–ї—Г—З—И–Є—В—М –µ–µ –Ї–Њ–љ—В—А–Њ–ї—М –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є.












