При этом может окклюзироваться крупная коронарная артерия (рис. 2), и тогда развивается обширный трансмуральный некроз миокарда, что находит отражение на ЭКГ в виде подъема сегмента ST. При неполной окклюзии артерии могут быть ЭКГ-изменения в виде депрессии сегмента ST, формирования отрицательных зубцов Т, или ЭКГ-изменения могут отсутствовать.
ОКС с подъемом или без подъема сегмента ST — это диагноз, который ставит врач при первом контакте с пациентом. Далее на основании результатов, в т. ч. повторного исследования крови на содержание маркеров некроза миокарда, динамики ЭКГ, уточняется, имеет ли место развитие ИМпST или ИМб/пSТ, или у больного отсутствует некроз миокардиоцитов, и речь идет о НС.
Современный стандарт оказания помощи больным с ИМпST включает проведение экстренного чрескожного коронарного вмешательства (ЧКВ) со стентированием инфаркт-связанной артерии в течение первых 120 мин от начала ангинозного приступа. Это позволяет восстановить коронарный кровоток более чем у 90% больных [1, 2].
В то же время действующими рекомендациями предусматривается, что у больных, госпитализация которых в специализированный центр по каким-либо причинам откладывается, возможно применение фармакологического метода реваскуляризации миокарда — тромболитической терапии (ТЛТ) (рис. 3).
В результате системного тромболизиса (внутривенного введения тромболитического препарата) происходит лизис тромба и восстанавливается проходимость окклюзированной коронарной артерии. Восстановление коронарного кровотока приводит к сохранению жизнеспособности и электрической стабильности кардиомиоцитов, ограничению зоны некроза, нормализации функции миокарда, снижению смертности у больных с ИМпST [3]. Тромболизис считается эффективным, если через 90 мин отмечается значительное уменьшение интенсивности либо исчезновение болевого синдрома, снижение сегмента ST более 50%, появление реперфузионных аритмий [2].
Эффективность тромболизиса ограничена временными параметрами и резко снижается с увеличением времени от начала болевого приступа (т. е. от начала формирования коронарного тромба). Наиболее эффективен тромболизис в первые 2 ч от начала симптомов, а уже через 12 ч риск осложнений преобладает над возможной пользой (рис. 4) [2]. При тромболизисе повышается риск развития геморрагических осложнений. Факторами риска развития геморрагических осложнений у больных с ОКС являются: пожилой возраст, женский пол, кровотечения в анамнезе, почечная недостаточность, проводимые интракоронарные вмешательства, недавно проведенная фармакологическая реперфузия, а также терапия инотропами, диуретиками и блокаторами гликопротеиновых ΙΙ, В/ΙΙΙ α-рецепторов [4]. Одним из наиболее тяжелых геморрагических осложнений является внутримозговое кровоизлияние. У пациентов с факторами риска геморрагических осложнений и высоким риском кровотечения ТЛТ противопоказана.

Для проведения тромболизиса применяются фибринолитические средства (активаторы плазминогена), под действием которых циркулирующий в крови неактивный белок плазминоген переходит в активный фрагмент плазмин, вызывающий лизис фибрина и разрушение тромба [4]. Выделяют три поколения тромболитиков (табл. 1):
Ι — стрептокиназа — высокоочищенный белковый препарат активатора плазминогена, вырабатываемый β-гемолитическим стрептококком группы С. Стрептокиназа образует с плазминогеном комплекс, преобразуя плазминоген в плазмин. Не обладает фибриноспецифичностью.
ΙΙ — алтеплаза (препарат Актилизе®) — созданный методом генной инженерии рекомбинантный препарат человеческого тканевого активатора плазминогена. При внутривенном введении избирательно активирует плазминоген, адсорбированный на фибрине. Оказывает фибриноспецифическое действие без существенного снижения содержания фибриногена в плазме крови. По сравнению со стрептокиназой алтеплаза обладает более быстрым и выраженным фибринолитическим эффектом, устойчива к ингибитору активатора плазминогена. Благодаря фибриноспецифичности менее часто на фоне ее применения возникают геморрагические осложнения. Реакции гиперчувствительности редки [5, 6].

ΙΙΙ — тенектеплаза (препарат Метализе®). В результате модификации молекулы алтеплазы был создан новый фибринолитик, обладающий еще более выраженной фибриноспецифичностью и высокой устойчивостью к эндогенному ингибитору активатора плазминогена Ι (ИАП). Период полувыведения препарата был увеличен до 20 мин, что позволяет вводить его однократно болюсом [5].
Таким образом, прямые активаторы плазминогена обладают высокой фибриноспецифичностью, что существенно сокращает время эффективного тромболизиса, и высоким уровнем безопасности вследствие очень низкого системного действия, что снижает риск развития геморрагических осложнений, гипотензии. Т. к. эти препараты не аллергенны, то они могут, в отличие от стрептокиназы, применяться повторно.
Дополнительным преимуществом тенектеплазы является то, что она обладает наибольшей устойчивостью к ИАП 1, вследствие чего возможно проведение тромболизиса путем однократного болюсного введения. В отличие от алтеплазы тенектеплаза в очень малой степени потенцирует коллаген-сенсибилизированную агрегацию тромбоцитов, что снижает риск развития повторной окклюзии коронарной артерии после эффективного тромболизиса [8].
В многоцентровом клиническом исследовании ASSENT-II, в которое были включены почти 16 949 больных с ИМпST, оценивалась эффективность и безопасность ТЛТ в двух группах больных. В одной применяли алтеплазу в дозе ≤100 мг, вводимую в/в течение 90 мин, в другой — тенектеплазу 30–50 мг (в зависимости от массы тела больного) в/в однократно болюсом в течение 5–10 с. Было установлено, что показатели 30-дневной смертности у пациентов обеих групп не различались (6,15% — в группе алтеплазы и 6,18% — в группе тенектеплазы), при этом частота развития нежелательных побочных эффектов была достоверно ниже при использовании тенектеплазы [9].


Перенос ТЛТ на догоспитальный этап обеспечил не только снижение госпитальной летальности у больных с ОКС на 17% [10], но и увеличил продолжительность жизни в среднем на 2,5–3 года [11].
В исследовании ASSENT-III PLUS исследовалась эффективность и безопасность догоспитального тромболизиса тенектеплазой. Было показано, что время от первого появления симптомов до лечения было сокращено на 47 мин по сравнению с пациентами, получавшими лечение в стационаре. У 53% больных отмечалась положительная клиническая картина заболевания, которая выражалась в уменьшении длительности и характера ангинозного приступа и положительной динамике сегмента ST на ЭКГ, что в результате способствовало снижению 30-дневной летальности в группе больных, получивших ТЛТ. Этот показатель возрастал при уменьшении времени проведения тромболизиса с момента появления клинической картины заболевания [12].
Летальность в течение 12 мес у больных с прерванным инфарктом миокарда в результате проведенного тромболизиса на догоспитальном этапе в 5,3 раза ниже в сравнении с группой больных с установленным инфарктом миокарда [13].
Скорая медицинская помощь (СМП) является первой медицинской инстанцией, куда обращаются больные с ОКС. Ежегодно в России СМП выполняет около 50 млн выездов, в т. ч. ежедневно более 25 тыс. по поводу ОКС [14]. Бригада СМП, вне зависимости от профиля, должна в полном объеме провести весь комплекс лечебных мероприятий, а у пациентов с ИМпST при невозможности быстрой госпитализации в специализированный сосудистый центр провести реперфузионную терапию с помощью тромболитиков. ТЛТ в настоящее время является наиболее доступной реперфузионной стратегией для пациентов, проживающих на обширных территориях, при отдаленности специализированных центров, оказывающих высокотехнологичную помощь [15].
Догоспитальный тромболизис с использованием тенектеплазы медиком СМП может быть предпочтительнее вследствие простоты применения и более высокого уровня безопасности.
Целями проспективного когортного многоцентрового клинического исследования РОКС-ВОСТОК явились определение безопасности догоспитальной ТЛТ при ИМпST, а также зависимости летальности от временных промежутков, оценки ее влияния на 30-дневную летальность и частоту основных осложнений при применении рекомбинантных препаратов человеческого тканевого активатора плазминогена.
Материалы и методы. Исследование проводилось в крупных городах Дальневосточного Федерального округа (ДФО): Якутске, Благовещенске, Комсомольске-на-Амуре, Южно-Сахалинске, Петропавловске-Камчатском с 2009 по 2012 г. Нами изучены две группы больных с ИМпST, которые были сопоставимы по полу, возрасту, клинико-анамнестическим показателям. 1-ю группу составили 460 больных с ИМпST, получивших ТЛТ на догоспитальном этапе; 2-ю группу — 553 больных с ИМпST, которым ТЛТ не проводилась в связи с наличием противопоказаний. Для проведения тромболизиса использовались алтеплаза (15 мг в/в болюсом, затем в/в инфузия 0,75 мг/кг, но не более 50 мг в течение 30 мин, далее инфузия 0,5 мг/кг, максимально — 35 мг в течение 60 мин) и тенектеплаза (в/в болюсно за 5–10 с 30 мг при массе тела < 60 кг, 35 мг — при массе тела 60–69 кг, 40 мг — 70–79 кг, 45 мг — 80–89 кг и 50 мг — 90 и более кг). Пациенты включались в исследование при установлении диагноза ОКС с подъемом сегмента ST, при этом выбор препарата был обусловлен наличием последнего в укладке врача СМП. Проведение ТЛТ, согласно протоколу системного тромболизиса, включало применение ацетилсалициловой кислоты — 75 мг, клопидогрела — 300 мг, внутривенное введение гепарина 5 тыс. ед.
Всем больным с ОКС на догоспитальном этапе помимо стандартного клинического осмотра и регистрации ЭКГ в 12 стандартных отведениях проводилось определение биомаркеров некроза миокарда (тропонин Т I крови) в капиллярной крови на экспресс-панели ACON (КНР, Медилинк).
Для оценки эффективности реперфузии нами использованы неинвазивные ЭКГ-критерии. Повторная запись стандартной ЭКГ проводилась через 90 и 180 мин от начала введения тромболитика. Динамика сегмента ST оценивалась по степени его суммарного смещения в информативных отведениях ЭКГ. При этом снижение ST на 50% и более в сравнении с исходным уровнем расценивалось как признак успешной ТЛТ (наличие реперфузии); отсутствие динамики сегмента ST, его снижение менее 50% либо увеличение его элевации — как признак неэффективности ТЛТ.
Оценивались и фиксировались временные параметры, характеризующие работу СМП: время симптом-игла (СИ) — время от дебюта ангинозного приступа до момента начала оказания первой помощи, время транспортировки (ВТ) — время от начала транспортировки до передачи больного врачу приемного покоя, общее время обслуживания вызова (ОВ) — сумма временных интервалов от момента выезда бригады СМП до передачи больного врачу приемного покоя (табл. 2).
Статистическая обработка данных проводилась с помощью пакета прикладных программ IBM SPSS Statistics 19.
Полученные результаты. Снижение смертности от сердечно-сосудистых заболеваний в России в настоящее время зависит от трех главных факторов: информированности населения, обученности врачей первичного звена здравоохранения и правильной маршрутизации пациента [16].
В крупных городах ДФО время от появления симптомов ОКС до начала оказания медицинской помощи колеблется от 25 мин до 3 ч. В крупных городах ДФО пациенты с ИМпST на догоспитальном этапе обслуживаются как специализированными кардиологическими и реанимационными, так и общепрофильными линейными врачебными и фельдшерскими бригадами. Несмотря на это, одноэтапная схема оказания медицинской помощи больным с ИМпST, когда оказывается медицинская помощь одной бригадой СМП, составила 76%, при этом исключительно все больные при одноэтапной схеме обслужены специализированными бригадами СМП. Двухэтапная схема обслуживания больных с ИМпST, по нашим данным, составила 24% случаев. При анализе двухэтапной схемы было установлено, что первой бригадой, оказывающей медицинскую помощь, в 87% случаев была врачебная линейная бригада, в 13% — фельдшерская бригада. Передача вызова специализированной бригаде связана с необходимостью проведения ТЛТ или с необходимостью коррекции нестабильных клинических либо гемодинамических показателей пациента.
Специализированные и врачебные общепрофильные бригады СМП укладываются в рекомендуемые 90 мин для проведения эффективного тромболизиса, но в связи с несвоевременным или поздним вызовом больным СМП это время увеличивается на 86 мин.
СИ и ОВ являются основными временными показателями-предикторами исхода заболевания в группе больных ОКС с подъемом сегмента ST с ТЛТ (табл. 3).
Вероятность летального исхода увеличивается при увеличении времени от дебюта заболевания в группе больных ОКС с подъемом сегмента ST и ТЛТ свыше 88 мин.
Для ОВ точки отсечения распределились следующим образом (рис. 6):
Вероятность летального исхода достоверно увеличивается при времени ОВ в группе ИМпST + ТЛТ, превышающем 85 мин.
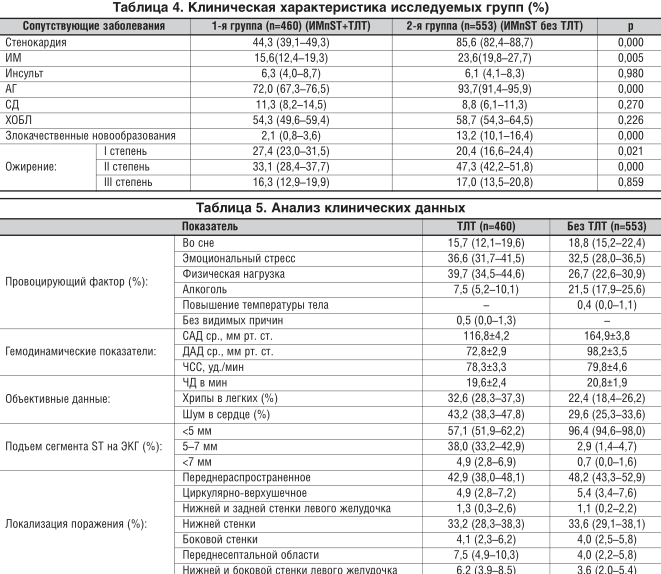
Больные с ОКС, включенные в исследование, страдали артериальной гипертензией (АГ), стенокардией, у 10% был сахарный диабет (СД) 2-го типа, 81% имели ожирение. Сопутствующие соматические заболевания отмечены более чем у половины больных, при этом наиболее часто встречались пациенты с хронической обструктивной болезнью легких (ХОБЛ) (табл. 4). Основными факторами развития клинической картины заболевания в группах являлся физический или/и эмоциональный стресс, а ангинозные боли появлялись и во сне. У 7,5% больных ОКС с подъемом сегмента ST с ТЛТ и у 21,5% пациентов с ОКС с подъемом сегмента ST без ТЛТ провоцирующим фактором был алкоголь (табл. 5).
Уровни систолического (САД) и диастолического (ДАД) артериального давления в группе больных ОКС с подъемом сегмента ST с ТЛТ были существенно ниже по сравнению с группой ОКС с подъемом сегмента ST без ТЛТ. У пациентов обеих групп преобладали ЭКГ-признаки распространенного поражения передней стенки левого желудочка, при этом в группе пациентов, кому была проведена ТЛТ, чаще встречались случаи с подъемом сегмента ST на 5 и более мм.
Положительный результат качественного теста на содержание тропонина Т и/или I получен у больных в группе с ТЛТ в 92,4%, без ТЛТ — в 93,0% случаев.
В группе ОКС с подъемом сегмента ST с ТЛТ изначально больные отмечали дискомфорт в 16,5%, средние по интенсивности боли — в 25,2% и сильные боли — в 58,3% случаев. На 90-й мин у 27,6% больных боли купированы, у 4,7% сохранились сильные боли, у 11% — боли средней интенсивности, у 56,7% пациентов осталось ощущение дискомфорта. У больных ОКС с подъемом сегмента ST без ТЛТ сильный характер указан в 45%, дискомфорт — в 22%, средние по интенсивности боли — в 33%, на 90-й мин от начала лечения боли купированы у 13,2% пациентов, сильные боли сохранились у 23%, у 17,6% отмечены боли средней интенсивности и у 46,2% — ощущение дискомфорта.
На догоспитальном этапе положительная динамика по ЭКГ-признакам наблюдалась у 63% пациентов группы ОКС с подъемом сегмента ST с ТЛТ и 38% больных — группы ОКС с подъемом сегмента ST без ТЛТ (р<0,01). На 30-й день с момента заболевания прерванный ИМ зафиксирован у больных с ТЛТ в 12,9%, без ТЛТ — в 5,2% случаев (р<0,01), развитие Q-образующего ИМ в группе с ТЛТ — в 75,6%, в группе без ТЛТ — в 94,5% (р<0,01), рецидив нефатального ИМ в группе с ТЛТ нами отмечен в 1,5%, а в группе без ТЛТ — в 15,4% случаев (р<0,01).

Неосложненное клиническое течение ИМ (без летальных случаев, рецидивов, прогрессирования недостаточности кровообращения, сложных нарушений ритма и проводимости): в группе с ТЛТ — у 51,2% , в группе без ТЛТ — у 19,8% больных (р<0,01). У 25,2% пациентов с ТЛТ зафиксированы реперфузионные аритмии, а у больных без ТЛТ они отмечены в 5,5% случаев (р<0,01).
В группе больных без ТЛТ уровень 30-дневной летальности составил 85,4%, против 50% у больных с ТЛТ(р<0,001). Общая летальность в группе больных с ТЛТ составила 13,5%, а в группе без ТЛТ — 27,4% (р=0,000). Это составляет 15 спасенных жизней на 100 пациентов, при этом шанс выжить при использовании ТЛТ повышается в 2,4 раза.
В заключение следует отметить, что наше исследование подтвердило зависимость выживаемости больных с ОКС от времени обращения за медицинской помощью. Проведение тромболизиса медиками СМП в течение первых 90–120 мин от появления симптомов рекомбинантными препаратами человеческого тканевого активатора плазминогена является безопасным и позволяет снизить смертность от ОКС с подъемом сегмента ST: 13,5% в группе с ТЛТ по сравнению с 27,4% — в группе без ТЛТ.

Литература
- Лечение острого инфаркта миокарда с подъемом сегмента ST. Методические рекомендации (№ 22). Составители Шпектор А.В., Васильева Е.Ю. М., 2013.
-
ESC Guidelines. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation // Eur. Heart J. 2012. Vol. 33. P. 2569–2619.
- Системный тромболизис: клинико-функциональная оценка электрической нестабильности сердца / И. П. Татарченко и др. // Кардиология. 2005. Т. 45, № 2.
-
Mehran R., Pocock S. J., Nikolsky E. et al. A Risk Score to Predict Bleeding in Patients With Acute Coronary // J. Am. Coll. Card. 2010. Vol. 55. P. 2567–2569.
-
Явелов И. С. Применение тенектеплазы при остром инфаркте миокарда // Кардиология. 2007. № 1 (47). С. 37–46.
- Пальшина А.М., Донская А.А., Морозов С.Н., Морозова Е. А. Острый коронарный синдром: диагностическая и лечебная тактика. Учебное пособие для врачей. Якутск: Изд-во Росбланкиздат, 2012. 137 с.
-
Вышлов Е.В., Севастьянова Д.С., Филюшкина В.Ю. и др. Сравнительная эффективность стрептокиназы и тенектеплазы на догоспитальном этапе у больных инфарктом миокарда // Сибирский мед. журнал. 2013. Т. 28, № 2. С. 39–43.
-
Barbash G. L. Treatment of reinfarction after thrombolytic therapy for acute myocardial infarction: an analysis of outcome and treatment choices in the global utilization of streptokinase and tissue activator for occluded coronary arteries (GUSTO I) and assessment of the safety of a new thrombolytic (ASSENT 2) studies // JAMA. 2007. Vol. 434. Р. 488–498.
-
ASSENT-2 Investigators. Single-bolus tenecteplase compared with front-loaded alteplase in acute myocardial infarction: the ASSENT-2 double-blind randomised trial // Lancet. 1999. Vol. 354. P. 716–722.
-
Morrison L.J., Verbeek P.R., McDonald A.C. et al. Mortality and prehospital thrombolysis for acute myocardial infarction: a meta-analysis // JAMA. 2000. Vol. 283. P. 2686–2692.
-
Van Domburg R.T., Kappetein A.P., Bogers Ad J. J. The clinical outcome after coronary bypass surgery: a 30-year follow-app study // Eur. Heart J. 2009. Vol. 30. № 4. P. 453–458.
-
Wallentin L., Goldstein P., Armstrong P. et al. Efficacy and Safety of Tenecteplase in Combination With the Low-Molecular-Weight Heparin Safety and Efficacy of a New Thrombolytic Regimen (ASSENT)-3 PLUS Randomized Trial in Enoxaparin or Unfractionated Heparin in the Prehospital Setting: The Assessment of the Acute Myocardial Infarction // Circulation. 2003. Vol. 108. P. 135–142.
-
Lamfers E., Hooghoudt T., Hertzberger D. et al. Abortion of acute ST segment elevation myocardial infarction after reperfusion: incidence, patients' characteristics, and prognosis // Heart. 2003. Vol. 89(5). P. 496–501.
-
Статистический сборник Росстата. М.: Изд-во «НИИЦ Статистика России», 2011. 86 с.
-
Явелов И. Г. Проблемы тромболизиса в начале XXI века // Сердце. 2007. № 4 (36). С. 184–188.
-
Ежегодный Государственный доклад о состоянии здоровья населения Российской Федерации в 2009 г.// Здравоохранение РФ. 2012. № 1. С. 3–8.



















