M.I. Karazhaeva, E.O. Saxonova, G.I. Klebanov,
O.B. Lubitskii, N.V. Gur’eva
Authors performed the study of antioxidant activity and concentration of POL products in tear and blood plasma in 222 patients with dystrophic retinal detachment and PVChRD. Decrease of antioxidant activity and absence of changing of POL concentration was found. Usage of flavonoid antioxidants (dicventine and ginkgo–biloba) decreases the level of POL and increases antioxidant activity in examined patients.
Установлено, что возникновение и развитие ряда патологических состояний организма человека сопровождается активацией процессов перекисного окисления липидов (ПОЛ), который рассматривают как универсальный механизм повреждения клетки [3]. Общеизвестно, что этот процесс является важным механизмом повреждения тканей при ишемии [14] и воспалении [4].
Исследования последних лет свидетельствуют об активации процессов ПОЛ при таких заболеваниях, как открытоугольная глаукома [1], катаракта [13], центральная инволюционная хориоретинальная дистрофия [11,12], увеиты [2,5], диабетическая ретинопатия [8].
Патогенез периферических витреохориоретинальных дистрофий (ПВХРД), дистрофической отслойки сетчатки до сих пор до конца не ясен. Однако в развитии этих патологий очевидной является роль ишемии и гипоксии, при которых, как известно, в тканях активируются реакции свободнорадикального окисления биомолекул, в том числе ПОЛ. В связи с этим актуальным является исследование активности процессов ПОЛ и системы антиоксидантной защиты при ПВХРД, дистрофической отслойке сетчатки, а также возможности их коррекции антиоксидантами.
В настоящее время среди антиоксидантов хорошо себя зарекомендовали препараты флавоноидного ряда, такие как:
– диквертин (дигидрокверцетин), получаемый из стружки древесины лиственницы даурской и лиственницы сибирской;
– гингко билоба (24% флавоновых гликозидов гингко и 6% терпеновых лактонов) – стандартизированный экстракт, получаемый из листьев одноименного растения. Эти препараты были выбраны ввиду присущей им высокой антиоксидантной активности (АОА), доказанной многочисленными клинико–лабораторными исследованиями. Оба препарата, помимо высокой АОА, обладают капилляропротекторным, противовоспалительным, гиполипидемическим, антиагрегантным, радиопротекторным действием, улучшают реологические свойства крови [6,7,9,11].
Цель настоящего исследования: изучение эффективности флавоноидных антиоксидантов при периферических витреохориоретинальных дистрофиях, дистрофической отслойке сетчатки на основе исследования активности процессов перекисного окисления липидов и системы антиоксидантной защиты.
Материалы и методы исследования. Всего было обследовано 222 человека в возрасте от 17 до 73 лет. Из них 33 человека (60 глаз) – больные с наиболее опасными в плане развития отслойки сетчатки ПВХРД, такими как решетчатая дистрофия, дырчатые и клапанные разрывы; 32 человека (34 глаза) – больные с неоперированной дистрофической отслойкой сетчатки, 135 человек (137 глаз) – больные с оперированной отслойкой сетчатки со стабильными зрительными функциями и послеоперационным периодом от 4 месяцев до 10 лет. Контрольную группу составили 22 клинически здоровых лица (44 глаза), без патологии на глазном дне.
Антиоксиданты назначались 2–х месячным курсом per os в дозе: диквертин – 2–4 mg/kg (120–160 mg в сутки); гингко билоба – 3,5 mg/kg (120–240 mg в сутки). Исследование действия препаратов проводили открытым методом, контролем служила группа больных, не получавших антиоксиданты.
Клинические методы исследования включали: биомикроскопию переднего отдела глаза, прямую и непрямую офтальмоскопию глазного дна в условиях медикаментозного мидриаза. Исследование остроты зрения проводили до и после приема антиоксидантов с помощью таблиц Головина–Сивцева без коррекции и с коррекцией. Исследование поля зрения проводили с помощью автоматической статической периметрии на приборе «Периком», разработанном «ВНИИМП–ОПТИМЕД». Оценивались: пороговая светочувствительность (dB), количество абсолютных скотом в %, суммарное количество относительных скотом I, II–ой степени в % до и после приема антиоксидантов.
Электрофизиологическое исследование включало регистрацию Ганц–Фельд электроретинограммы (ЭРГ) до и после приема антиоксидантов.
Биохимические исследования включали:
– определение уровня содержания продуктов ПОЛ в плазме крови, а именно малонового диальдегида (МДА–ТБК–активный продукт);
– исследование суммарной АОА плазмы крови и слезы проводили с помощью хемилюминесцентной модельной системы Нв–ЛМ–Н202.
Исследование показателей перекисного окисления липидов и суммарной антиоксидантной активности слезы и плазмы крови проводилось у трех групп больных:
– больные с ПВХРД, оперированной и неоперированной лазером;
– больные с неоперированной дистрофической отслойкой сетчатки;
– больные с оперированной дистрофической отслойкой сетчатки.
Контролем являлась группа клинически здоровых лиц без патологии на глазном дне.
Антиоксидантная терапия назначалась:
– больным с ПВХРД, оперированной лазером;
– больным с оперированной отслойкой сетчатки со стабильными зрительными функциями. В этих группах сравнивались показатели ПОЛ и АОА слезы, плазмы крови до и после приема антиоксидантов. Контролем являлась группа пациентов, не принимавших антиоксиданты.
Результаты исследования и их обсуждение.
В контрольной группе, в которую входили лица с миопией (12 человек), с эмметропией (5 человек), с гиперметропией (5 человек), средние значения суммарной АОА слезы составили 98,94±5,72 мкМ, АОА плазмы крови – 644±62,14 мкМ, ТБК – активных продуктов – 0,73±0,6 нмоль/мг липидов. Статистически достоверных различий этих показателей между рефракционными группами в контроле не выявлено.
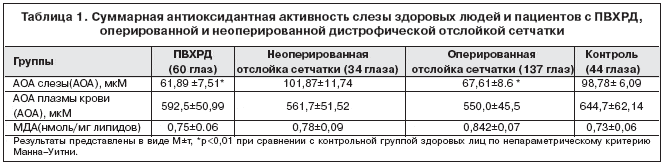
В группе больных с наиболее опасными в плане развития отслойки сетчатки ПВХРД (решетчатая дистрофия, клапанные и дырчатые разрывы) АОА слезы статистически достоверно (р<0,05) ниже нормы (98,94±5,72) на 37,45% (табл.1).
Степень снижения АОА слезы в данной группе связана с распространенностью ПВХРД: у больных с минимальными изменениями на глазном дне (единичные разрывы, размером менее 1 РД, единичные зоны решетчатой дистрофии, занимающие менее 1 квадранта) показатели АОА слезы не отличались от контрольных значений (95,78±9,23 мкМ), тогда как у больных с выраженными изменениями (гигантские разрывы, размером более 1 РД, множественные разрывы и зоны решетчатой дистрофии, занимающие более 1 квадранта) АОА слезы была снижена на 37,45% по сравнению с нормой и составила в среднем 61,49±9,11 мкМ (р<0,05).
В группе больных с оперированной отслойкой сетчатки суммарная АОА слезы составила 67,61±8,6 мкМ, что статистически достоверно (р<0,05) ниже нормы на 31,63% (табл. 1) . При этом наиболее низкие значения АОА выявляются у больных с миопией высокой степени (свыше 8 диоптрий) – 42,4±15,4 мкМ, что на 39% ниже (р<0,05) суммарного показателя АОА слезы больных с миопией слабой и средней степени, эмметропией, гиперметропией (70±7,6 мкМ).
Статистически достоверных различий АОА слезы больных с миопией слабой и средней степени, эмметропией и гиперметропией не выявлено (p>0,05).
Исследование показателей АОА слезы глаз у больных с дистрофической неоперированной отслойкой сетчатки (101,87±11,74мкМ) в целом по группе не выявило статистически достоверных различий с контрольной группой (98,94±5,72 мкМ) (р>0,05).
Оценка отдельных данных в группе больных с отслойкой сетчатки выявила большой разброс значений АОА слезы. Анализ причин такой вариабельности показателей выявил у 41% больных на глазу с неоперированной отслойкой сетчатки слабо и умеренно выраженные явления токсико–аллергического увеита. Биомикроскопически у этой группы больных определялись легкая стушеванность рисунка и отек радужки, незначительное изменение цвета радужки, задние синехии.
У больных с явлениями токсико–аллергического увеита на глазу с отслойкой сетчатки АОА слезы составляла 146,04±16,83 мкМ и была статистически достоверно (р<0,02) выше нормы на 47,9%.
Такое значительное увеличение АОА слезы, вероятно, является компенсаторной реакцией на воспаление, вызванное компонентами субретинальной жидкости и отслоенной сетчатки (иммунно–реактивный белок опсин, высвобождающийся из поврежденных фоторецепторных клеток и др.). В настоящее время известно, что воспаление сопровождается активацией свободнорадикальных реакций, в том числе процессов ПОЛ, так как активированные клетки макрофагального ряда начинают валово увеличивать продукцию активных форм кислорода и свободных радикалов. Рост АОА в тканях при этом является естественной и необходимой реакцией, направленной на локализацию процесса и нейтрализацию токсических продуктов свободнорадикального окисления.
АОА на глазах с отслойкой сетчатки без явлений токсико–аллергического увеита (59% больных) была статистически достоверно (р<0,05) ниже нормы на 41,7% и составила в среднем 57,69±6,64 мкМ.
При исследовании парных глаз в группах больных с ПВХРД, дистрофической оперированной и неоперированной отслойкой сетчатки было выявлено статистически достоверное (р<0,05) снижение АОА слезы как на глазах с дистрофическими изменениями, так и на т.н. парных «здоровых» глазах. В группе больных с ПВХРД АОА слезы парных т.н. «здоровых» глаз (68,89±7,12 мкМ) была в среднем на 30% ниже показателей контроля, в группе больных с оперированной отслойкой сетчатки аналогичный показатель (73,89±16,84 мкМ) был на 32,12 % ниже нормы. У больных с неоперированной отслойкой сетчатки средние показатели АОА слезы парных т.н. «здоровых» глаз составили 89,62±7,87 мкМ, что несколько ниже нормы, но эти различия статистически недостоверны (р>0,05). Можно предположить, что такое содружественное снижение АОА слезы в глазу без видимой патологии обусловлено рефлекторными окуло–окулярными реакциями. Однако нельзя исключить и того, что снижение АОА слезы предшествует развитию дистрофических изменений в сетчатке в последующем.
При сравнении АОА слезы обоих глаз у больных с ПВХРД, оперированной и неоперированной отслойкой сетчатки отмечалась выраженная асимметрия значений АОА слезы. Разница между показателями АОА слезы обоих глазах колебалась в широких пределах и составляла в среднем 25,5%, тогда как в норме этот показатель не превышал 1–3% (в среднем 1,5%) (р<0,05).
При исследовании средних показателей АОА и содержания продуктов ПОЛ (ТБК–активных продуктов) плазмы крови больных с ПВХРД, дистрофической неоперированной и оперированной отслойкой сетчатки статистически достоверных различий с контролем не выявлено (р>0,05).
Как и в контроле, во всех группах пациентов сохраняется корреляционная связь между показателями АОА плазмы и слезы: более высоким значениям АОА плазмы соответствуют, как правило, более высокие значения АОА слезы (коэффициент Спирмена=0,6; р<0,05).
Сопоставление показателей АОА в слезе и в плазме крови у больных во всех 3–х группах выявило снижение данного показателя только в слезе. Это свидетельствует о том, что нарушения метаболизма происходят прежде всего на местном, локальном уровне.
Анализ показателей ПОЛ и АОА слезы и плазмы крови в группах больных с ПВХРД и оперированной отслойкой сетчатки до и после 2–х месячного приема антиоксидантов (per os) выявил статистически достоверные различия. Так, АОА слезы больных с ПВХРД и оперированной отслойкой сетчатки после приема диквертина увеличилась в среднем на 32%–33%, после приема гингко билобы – на 35%–38% (р<0,05). Показатели АОА слезы после приема гингко билобы оказались несколько выше, чем после диквертина, однако статистически достоверных различий между этими группами нет (р >0,05).
АОА плазмы крови в группах больных с ПВХРД и оперированной отслойкой сетчатки после приема диквертина увеличилась соответственно на 12,2% и 14,2%; после приема гингко билобы – на 12,6% и 15,7% (р<0,05).
Содержание ТБК–активных продуктов в плазме крови у больных с ПВХРД после приема диквертина снизилось на 10,4%; после приема гингко билобы – на 14% (р<0,02). В группе больных с оперированной отслойкой сетчатки содержание ТБК–активных продуктов в плазме крови после приема диквертина снизилось на 20,3%; после приема гингко билобы – на 21,7% (р<0,02) (табл. 2).
Улучшение биохимических показателей после курса антиоксидантной терапии сопровождалось у больных с оперированной отслойкой сетчатки повышением зрительных функций.
У 77% больных, послеоперационный период которых на момент осмотра составил от 4 месяцев до 1 года, отмечалось статистически достоверное повышение остроты зрения. Так, в группе больных со средней остротой зрения от 0,02 до 0,1 (в среднем 0,05±0,03) этот показатель увеличился после приема диквертина на 0,03; после приема гингко билобы – на 0,07 (р<0,05). У больных с остротой зрения от 0,2 до 0,5 (в среднем 0,32±0,05) она увеличилась на 0,13 после приема диквертина и на 0,2 – после приема гингко билобы (р<0,05). В группе больных с остротой зрения от 0,6 до 0,9 (в среднем 0,72±0,05) этот показатель увеличился на 0,175 после приема гингко билобы; после приема диквертина – на 0,125 (р<0,05).
Дифференциальная светочувствительность у больных в послеоперационном периоде от 4 месяцев до 1 года после приема диквертина увеличилась на 25,3%; после приема гингко билобы – на 30,9% (p<0,05).
Количество абсолютных скотом у больных в вышеуказанной группе после приема диквертина уменьшилось на 44,4%; после приема гингко билобы на 48,9% (р<0,05). У большинства больных одновременно с уменьшением числа абсолютных скотом увеличивается количество относительных скотом I–ой и II–ой степени, что связано с переходом абсолютных скотом в относительные в связи с увеличением светочувствительности.
Полученные нами результаты свидетельствуют о более выраженном клиническом эффекте антиоксидантов у больных с послеоперационным периодом от 4 месяцев до 1 года, что указывает на целесообразность применения антиоксидантов уже в ранние сроки послеоперационного периода.
Регистрация ЭРГ у больных с оперированной отслойкой сетчатки до и после приема антиоксидантов выявила статистически достоверное увеличение амплитуды А– и в большей степени В–волны. После приема диквертина амплитуда А– и В–волны увеличилась соответственно на 27% и 24% (р<0,05). В группе больных, получавших гингко билобу, амплитуда А– и В–волны увеличилась на 50% и 50,4 % (р<0,05). Статистически достоверных изменений показателей латентности А– и В–волны после приема антиоксидантов не выявлено (р>0,07). Повышение амплитуды А– и В–волны свидетельствует о повышении биоэлектрической активности наружных (палочки, колбочки) и внутренних (биполяры, клетки Мюллера) слоев сетчатки. Эти данные объективно подтверждают влияние антиоксидантов на функциональную активность сетчатки.
Следует отметить, что у больных в более поздние сроки послеоперационного периода (от 1 года до 10 лет) статистически достоверного улучшения зрительных функций не выявлено (р>0,05).0днако биохимические и электрофизиологические показатели после применения флавоноидных антиоксидантов заметно улучшились, что указывает на необходимость использования антиоксидантов и у этой группы больных в целях нейропротекции и стабилизации зрительных функций.
Выводы
1. У больных с дистрофической отслойкой сетчатки и ПВХРД снижены показатели АОА слезы, тогда как в плазме АОА и содержание продуктов ПОЛ не изменяются. Это свидетельствует о локальном характере метаболических нарушений, а именно – нарушениях в системе антиоксидантной защиты глаза.
2. АОА слезы снижена не только на глазах с ПВХРД и отслойкой сетчатки, но и на парных, т.н. «здоровых» глазах.
3. Флавоноидные антиоксиданты – диквертин и гингко билоба снижают уровень содержания продуктов ПОЛ, увеличивают АОА слезы и плазмы крови у больных с ПВХРД и отслойкой сетчатки, повышают зрительные функции у больных с оперированной отслойкой сетчатки, что позволяет рекомендовать включение этих антиоксидантов в комплексное лечение периферических витреохориоретинальных дистрофий и дистрофической отслойки сетчатки с целью улучшения и стабилизации зрительных функций, нейропротекции.

Литература
1. Бунин А.Я. // Патофизиология и биохимия глаза. Сборник науч. работ МНИИ им. Гельмгольца.– 1986., стр.6–9.
2. Бабенкова И.В. Роль функциональной активности полиформноядерных лейкоцита крови и перекисного окисления липидов в патогенезе увеита. атореф. Дис.... канд. мед.наук. – М.,1991.
3. Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологоческих мембранах. М. Наука, 1972г.,252 стр.
4. Дубур Г.Я., Велена А.Х. //Биомембраны: Структура. Функции. Медицинские аспекты. – Рига: «Винатне», 1981.–стр.257–277.
5. Катаргина Л.А., Сидорова Т.В., Чеснокова И.Б., Кузнецова Т.П. // Вестник фтальмологии. Т–119 №2, 2003., стр.20–21.
6. Л.В. Недосугова, А.К. Волковой, И.А. Рудько, А.А. Кубатиев и др.//Клиническая фармакология и терапия –2000г., 9(4), стр.65–67.
7. Теселкин.Ю.О., И.В. Бабенкова, В.К.Колхир, Тюкавкина И.А., Колесник Ю.А. и др.// Вопросы биологической медицинской и фармацевтической химии.–1999., №3, стр.44–48.
8. Baenes J. // Diabetes/1997. 46., Р.3–10.
9. Baudoun С., Pisella P.JД Ettaiche M., Goldchild M. et all.//GraefesArch.Clin. Exp. Ophthalmol. 1999; Vol.237, № 1, P. 58–66.
10. Bird, A. C., Bressler, N. M. et all //Surv. Ophthalmol. – 1995, Vol 39, P.367–374.
11. l.De Feudis F.//Advanas in Ginkgo biloba Extract research., Elsevier. Paris, 1997. Vol.6, P.132–134.
12.Sarks, S. H., and Sarks, J. P.// «Retina» –1994. Vol.2, P. 1071–1102.
13. Spector A., Garner W. H. // Exp. Eye Res.,1981, v.2, P. 245.
14. Weiss J. LI I Acta Physiol. Scand. 1984.– Suppl.548., P.9–37.












