Методы: патологоанатомическое исследование проводилось у двух людей, при жизни страдавших глаукомой, смерть которых не была связана с заболеваниями ЦНС.
Результаты: при иммуногистохимическом исследовании обнаружены астроглиоз и наличие скоплений бета-амилоида в коре головного мозга и в зрительном нерве. Выявлены структурные и функциональные изменения митохондрий.
Заключение: при ПОУГ дегенеративным изменениям подвергаются как ганглионарные клетки сетчатки и волокна зрительного нерва, так и ткани проводящих путей зрительного анализатора вплоть до коры головного мозга. Дисфункция митохондрий может быть одним из механизмов развития и прогрессирования нейродегенерации при первичной открытоугольной глаукоме.
Ключевые слова: глаукома, нейродегенерация, головной мозг, митохондрии.
Abstract
Glaucoma as a neurodegenerative disease
Gazizova I.R.
GBOU VPO Bashkir State Medical University, Ufa
GBOU VPO North-Eastern State Medical University named after Mechnikov I.I. St.-Petersburg
Purpose: to study morphological changes of central area of visual analyzer in glaucoma and define the role of a mitochondrial dysfunction in a progression of the neurodegenerative changes.
Methods: pathologicoanatomic study was conducted in 2 subjects with the diagnosis of glaucoma, whose death wasn’t related to CNS diseases.
Results: immunohistochemical study revealed astrogliosis and accumulation of the beta-amyloid in cortex and optic nerve. There were structural and functional changes in mitochondria were found.
Conclusion: in POAG degenerative changes were found both in gangliar retinal cells, optic nerve fibers and conduction tract tissue of the visual analyzer up to the cortex. Mitochondrial dysfunction could be one of the mechanisms of development and progression of the neurodegeneration in POAG.
Key words: glaucoma, neurodegeneration, cerebrum, mitochondria.
Первичная открытоугольная глаукома (ПОУГ) – заболевание, которое развивается с возрастом и характеризуется прогрессирующим течением даже на фоне нормализованного уровня офтальмотонуса [1, 3]. Как известно, механизм гибели клеток сетчатки и аксонов зрительного нерва при глаукоме, как и при всех нейродегенеративных расстройствах, – это физиологически запрограммированный апоптоз [3, 4, 6, 12]. Нейродегенерация характеризуется повреждением клеток и межклеточного вещества, в результате чего происходит нарушение функции органа. В основе нейродегенерации лежит нарушение трофики, т. е. комплекса механизмов, обеспечивающих метаболизм и сохранность структуры клеток и тканей. Нейродегенеративные заболевания – это заболевания, которые возникают в результате прогрессирующей дегенерации и гибели нейронов, входящих в определенные структуры ЦНС, приводят к разрыву связей между отделами ЦНС и дисбалансу синтеза соответствующих нейромедиаторов и, как следствие, к нарушению памяти, координации движений и мыслительных способностей и т. д.
Помимо указанных признаков нейродегенеративные заболевания обладают рядом общих свойств. В частности, подавляющее большинство таких заболеваний развивается у лиц пожилого возраста. Так, например, у пациентов в возрасте 70–75 лет распространенность нейродегенеративных заболеваний составляет около 5%, а в возрасте старше 80 лет достигает 15%. Данные современных клинических и экспериментальных исследований показывают, что большинство нейродегенеративных заболеваний определяют генетические факторы (т. е. болезнь или передается по наследству, или возникает в результате патологической прижизненной мутации соответствующих генов). К числу общих признаков нейродегенеративных заболеваний нужно отнести длительный латентный период (от 6 до 8–10 лет).
Наиболее известными из этих заболеваний являются болезни Альцгеймера, Паркинсона, Гентингтона, Пика. Поскольку в развитых странах мира наблюдается неуклонное старение населения, общая частота нейродегенеративных заболеваний имеет четкую тенденцию к увеличению [5]. Выделяют заболевания, преимущественно проявляющиеся деменцией, например, болезнь Альцгеймера (атрофируется серое вещество головного мозга и холинэргические нейроны, страдают когнитивные функции (память, рассудок и т.д.)), болезнь Пика – злокачественное слабоумие, при котором происходит атрофия лобных и височных частей коры. Также выделяют заболевания с экстрапирамидными синдромами, например, болезнь Паркинсона, при которой происходит нейродегенерация черной субстанции (Substantia nigra) и дофаминовых нейронов, проявляющаяся двигательными нарушениями и тремором. Клинические проявления болезни Гентингтона, при которой атрофии подвергаются полосатое тело и кора, – гиперкинез и расстройства интеллекта. Отдельно выделяют мозжечковые дегенерации и поражение двигательных нейронов, например, боковой амиотрофический склероз, который возникает вследствие дегенерации моторной коры и проявляется в виде паралича и атрофии мышц.
Глаукома также является одним из нейродегенеративных заболеваний. Развитие нейродегенерации при глаукоме объединяет множество факторов и путей апоптоза ганглионарной клетки, но все они так или иначе связаны с митохондриями как основной единицей, ответственной за энергетические процессы в клетке и апоптоз. Выявление роли митохондриальной дисфункции в развитии ПОУГ даст возможность патогенетически обоснованной нейропротекции.
Приведем факты, которые могут объединять глаукому с нейродегенеративными заболеваниями.
1. Общий механизм гибели клетки: как известно, гибель ганглионарных клеток сетчатки, как и при всех нейродегенеративных заболеваниях, – это физиологически запрограммированный апоптоз. Запуск апоптоза происходит при активации специфических протеаз – каспаз, которые, проникая в ядро клетки, разрушают ДНК. В свою очередь активация каспаз напрямую связана с митохондриальной дисфункцией. При других нейродегенеративных заболеваниях, например, при болезни Альцгеймера, также происходит их активизация.
2. Гибель одного вида нейронов, нарушение межсинаптических связей, которые приводят к нарушению центральной функции: при болезни Альцгеймера страдают лобные доли головного мозга, что вызывает нарушение когнитивной функции, а при глаукоме погибают волокна зрительного нерва и страдают зрительные функции.
3. «Возрастной» характер заболевания: нейродегенеративные заболевания развиваются с возрастом и имеют длительный хронический характер течения. Распространенность глаукомы увеличивается с возрастом популяции, а прогрессирование заболевания происходит в течение нескольких лет.
Существует мнение [8–11], что глаукома – проявление общего нейродегенеративного состояния организма.
Цели исследования – изучение морфологических изменений центральных отделов зрительного анализатора при глаукоме и определение роли митохондриальной дисфункции в прогрессировании нейродегенеративных изменений.
Методы
Патологоанатомическое исследование проводилось у 2 лиц, смерть которых не была связана с заболеваниями ЦНС. Как было указано в амбулаторных картах, длительность заболевания ПОУГ составляла от 8 до 10 лет, причем диагноз далеко зашедшей глаукомы был документально подтвержден. Морфологическое и патологоанатомическое исследования, включавшие описание материала и морфометрию клеток анализируемых структур, были выполнены на кафедре патологической анатомии ГБОУ ВПО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России под руководством члена-корреспондента РАМН, заслуженного деятеля науки РФ, доктора медицинских наук, профессора Н.М. Аничкова. Иммуногистохимическое исследование проводилось в лаборатории функциональной морфологии центральной и периферической нервной системы ФГБУ «Научно-исследовательский институт экспериментальной медицины» Северо-Западного отделения РАМН под руководством заведующего отделом общей и частной морфологии, доктора медицинских наук Д.Э. Коржевского.
Результаты
При макроскопическом исследовании препаратов проводящих путей зрительного анализатора выявлены выраженная атрофия зрительного нерва с потерей значительного количества аксонов, а также потеря значительного количества нейронов в латеральном коленчатом теле. При микроскопическом исследовании выявлены уменьшение толщины клеточного слоя зрительной коры, сморщивание радиуса нейронов и их ядер, комковатая, зернистая цитоплазма, наличие липофусцина в больших количествах, что свидетельствовало об атрофическом процессе.
В обоих случаях у умерших пациентов, при жизни страдавших ПОУГ, выявлены процессы нейродегенерации. В дегенеративный процесс были вовлечены все уровни центрального отдела зрительного анализатора, но наиболее заметно – область зрительной коры в районе шпорной борозды. Особо следует выделить тот факт, что в зрительном нерве и в IV–V слоях коры головного мозга были обнаружены амилоидные бляшки и тельца (рис. 1, 2).
Как известно, бета-амилоид является маркером нейродегенеративных заболеваний, а его наличие свидетельствует о патогенетической связи ПОУГ с болезнью Альцгеймера. На нейродегенеративный процесс в коре головного мозга указывает также скрученность отдельных артерий корковой области, что является следствием уменьшения толщины коры при сохранении протяженности сосудистого русла. В этом случае радиальные артерии коры складываются и скручиваются в пределах сосудистого пространства. Выявленные при микроскопии признаки астроглиоза можно расценивать как следствие нейродегенерации, гибели нейронов и олигодендроцитов, замещение их незрелыми, функционально неполноценными астроцитами.
Можно считать установленным, что при ПОУГ происходит развитие нейродегенеративного процесса, в который вовлечены не только периферический отдел зрительного анализатора, но и проводящие пути и центральный отдел, т. е. зрительный путь в целом.
Два обстоятельства требуют отдельного рассмотрения. Это, во-первых, наличие в тканях головного мозга лиц, страдающих ПОУГ, бета-амилоида – общепризнанного маркера нейродегенерации, характерного морфологического признака болезни Альцгеймера. Во-вторых, процесс нейродегенерации сопровождается астроглиозом, т. е. гибелью и заменой клеток головного мозга на молодые, функционально незрелые астроциты, не способные осуществлять опорную, защитную, трофическую и другие вспомогательные функции.
Большая часть нейродегенеративных заболеваний является полиэтиологическими, и в настоящее время выделить пусковой механизм для каждого достаточно сложно. Тем не менее существуют убедительные доказательства того, что центральная роль в процессах апоптоза нервной клетки принадлежит митохондриям [6]. При различных состояниях (старение организма, «окислительный стресс», накопление мутантной митохондриальной ДНК) и воздействии различных веществ (нейротоксичных белков, в том числе и бета-амилоида) изменяется проницаемость митохондриальных пор [7]. Этот процесс приводит к выбросу из митохондрий ионов кальция и активаторов апоптоза, что и определяет необратимость процесса гибели нейроцита. В связи с этим мы исследовали функции митохондрий у пациентов с ПОУГ.
В настоящее время для определения характеристик митохондриальных функций используются клинические, биохимические (оценка уровней пирувата и лактата, антиоксидантной активности, продуктов перекисного окисления липидов крови) методы исследования. Суть данных исследований заключается в том, что при нарушении функций митохондрий (окислительном аэробном фосфорилировании) происходит сдвиг внутриклеточных процессов в сторону катаболизма. Большинство процессов в клетке идет по анаэробному пути с образованием молочной кислоты. Кроме того, дисфункция митохондрий сопровождается генерацией огромного количество АФК и развитием окислительного стресса, который усугубляет дисфункцию митохондрий [2, 12]. Активизируются процессы ПОЛ и окисления тиоловых групп мембранных белков.
В ходе нашего исследования у 30 больных ПОУГ проводилось изучение содержания сульфгидрильных (SH-) и дисульфидных (SS-) групп, а также их соотношения (в норме не снижающееся ниже 6,5). Были выявлены снижение в крови больных уровня сульфгидрильных SH-групп и повышение уровня дисульфидных SS-групп, а также изменение их соотношения, которое в среднем составило 5,4. Данные результаты отражают нарушение тканевого окислительно-восстановительного равновесия и смещение его в сторону катаболических процессов (рис. 3).
Также установлено участие сульфгидрильных групп в процессах перекисного окисления липидных компонентов мембран, приводящих к развитию дегенеративных изменений тканей. Активация свободно-радикального перекисного окисления липидов клеточных мембран считается одной из причин ускоренного старения. Изменение мембраны при старении приводит к тому, что клетка иначе реагирует на процессы возбуждения и торможения, межклеточные взаимоотношения и транспорт веществ в условиях гиперфункции, обусловленной изменившимся с возрастом метаболизмом. При биологическом старении происходит снижение тканевого потребления кислорода и интенсивности всех основных процессов обмена веществ.
О нарушении окислительно-восстановительных процессов и тканевого дыхания может свидетельствовать повышение уровня лактата в крови пациентов. Нами было проведено исследование содержания молочной кислоты в крови больных ПОУГ, а также пациентов контрольной группы. По полу и возрасту не было зарегистрировано статистически значимых различий между больными в основной и контрольной группах (рис. 4). Нормальные показатели уровня лактата в крови составляют 1,33–1,80 ммоль/л. У пациентов в контрольной группе уровень лактата в крови в среднем составил 2,78±0,15 ммоль/л, а у пациентов в основной группе (с ПОУГ) показатели лактата крови значительно превышали нормальные значения и в среднем достигали 4,33±0,3 ммоль/л.
Клетка с поврежденными митохондриями не способна производить достаточное количество энергии для поддержания своей жизнедеятельности, не может сохранять необходимый уровень кальция и вырабатывает повышенное количество повреждающих ее молекул-окислителей.
В нормальных условиях все митохондрии в клетке имеют одинаковую копию ДНК. Однако в митохондриальном геноме могут происходить мутации, вследствие чего появляются митохондрии с нарушенной функцией. При этом нормальная ДНК может компенсировать патологический эффект мутации. За счет неизмененных митохондрий клетка может некоторое время функционировать. Если же продукция энергии в ней падает ниже определенного порога, происходит компенсаторная пролиферация всех митохондрий, включая дефектные.
Минимальное количество измененной ДНК, необходимое для возникновения серьезных нарушений энергетического обмена и дисфункции конкретного органа или ткани, носит название «порогового эффекта». При превышении порога функционирование клетки изменяется, что сопровождается определенными клиническими расстройствами. На «пороговый эффект» влияют различные факторы, но наиболее значимыми являются энергетические потребности конкретных тканей и органов, а также их чувствительность к нарушениям окислительных процессов и возраст.
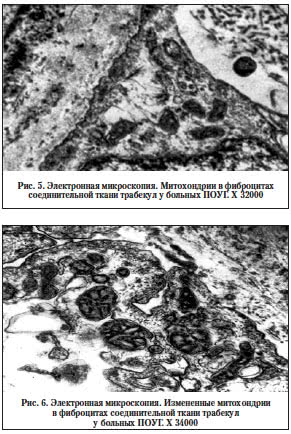
В связи с вышеизложенным особый интерес вызывает возможность визуально оценить состояние митохондрий в структурах глазного яблока при ПОУГ. Единственным доступным материалом для электронной микроскопии является препарат угла передней камеры, полученный во время проведения проникающей глубокой склерэктомии методом блокэксцизии.
На электроннограммах были зафиксированы клетки эндотелия шлеммова канала, а также фибробласты соединительной ткани, в которых обнаруживались несколько увеличенные в размерах митохондрии с электронно-плотным матриксом. Кристы митохондрий были укорочены и редуцированы. В единичных митохондриях отмечались явления дегенерации и деструкции. Все зарегистрированные структурные изменения митохондрий были различной степени выраженности.
В соединительнотканной части преобладают фиброциты, окруженные пучками коллагеновых волокон различного строения. Контуры митохондрий клеток фибробластического ряда волнистые, кристы деформированы (рис. 5). Наружная полость митохондрий светлая, выглядит оптически пустой. В матриксе определяется мелкозернистое вещество повышенной электронной плотности (рис. 6). В некоторых фибробластах с выраженными дистрофическими изменениями встречаются резко набухшие митохондрии. В них видны вакуоли и фрагменты крист, расположенные вблизи оболочки. Матрикс внутренней полости резко просветлен.
В эндотелии изменения митохондрий менее выражены, чем в клетках фибробластического ряда. Отмечается фрагментация крист митохондрий. Во внутренней полости митохондрий эндотелия также определяется мелкозернистое вещество повышенной электронной плотности.
При проведении морфологических, в частности, электронно-микроскопических исследований митохондрий в трабекулярной зоне глазного яблока нами выявлены выраженные изменения структуры изучаемых органелл. Нарушения структуры митохондрий могут привести к выраженному угнетению их функций. С возрастом происходит активация свободнорадикального перекисного окисления липидов клеточных мембран. Также возможно генетически детерминированное снижение функции митохондрий. Структурно-функциональные изменения митохондрий приводят к чрезмерной продукции активных форм кислорода. Митохондрии являются главным источником создания супероксидных анионов в клетках. В ходе транспорта электронов к молекулярному кислороду от 1 до 5% электронов в цепи дыхания теряются, участвуя в формировании супероксид-аниона. Происходит повреждение генома митохондриальной ДНК свободными радикалами – используя 90% клеточного кислорода, митохондрии являются лучшими кандидатами на окислительное повреждение ДНК. Снижение продукции АТФ и нарушение гомеостаза кальция при митохондриальной дисфункции являются пусковыми механизмами развития нейродегенерации, происходящей по механизму метаболической эксайтотоксичности. Набухание митохондрий приводит к высвобождению активаторов каспазы (таких, как цитохром С), что запускает процесс апоптоза – запрограммированной гибели клетки.
Все больше фактов свидетельствует в пользу того, что глаукому многое объединяет с другими нейродегенеративными заболеваниями. Глаукомный процесс распространяется далеко за пределы глазного яблока, патогенез данного заболевания выходит за рамки традиционной офтальмологии, находясь на стыке офтальмологии и неврологии. В свете этого необходимо взглянуть на глаукомный процесс с непривычной для нас, офтальмологов, стороны. Опыт, накопленный неврологами, которые занимаются проблемами развития нейродегенерации, поможет нам в дальнейшем изучении патогенеза, диагностики и лечения глаукомного процесса.
Выводы
1. При ПОУГ, как установлено в результате аутопсии, дегенеративным изменениям подвергаются как ганглионарные клетки сетчатки и волокна зрительного нерва, так и ткани проводящих путей зрительного анализатора вплоть до коры головного мозга. Это указывает на выраженный нейродегенеративный характер ПОУГ, что подтверждается и наличием таких общепризнанных критериев нейродегенеративного процесса, как астроглиоз и наличие скоплений бета-амилоида в коре головного мозга и зрительном нерве. Такая патология отмечается и при других нейродегенеративных заболеваниях, таких как болезни Альцгеймера или Паркинсона.
2. Нами выявлены структурные и функциональные изменения митохондрий у больных ПОУГ. Дисфункция митохондрий может быть одним из механизмов развития и прогрессирования нейродегенерации при ПОУГ.



Литература.
1. Алексеев В.Н., Газизова И.Р. Нейродегенеративные изменения у больных первичной открытоугольной глаукомой // Практическая медицина. 2012. № 4. С. 154–156.
2. Газизова И.Р. Митохондриальная патология и глаукома // Глаукома. 2011. № 4. С. 58–65.
3. Егоров Е.А., Алексеев В.Н., Мартынова Е.Б. и др. Патогенетические аспекты лечения первичной открытоугольной глаукомы. М., 2001. 118 с.
4. Еричев В.П., Туманов В.П., Панюшкина Л.А. Глаукома и нейродегенеративные заболевания // Глаукома. 2012. № 1. С. 62–68.
5. Иллариошкин С.Н. Конформационные болезни мозга. М.: Янус–К, 2003. 248 с.
6. Судаков Н.П., Никифоров С.Б., Константинов Ю.М., Лепехова С.А. Роль митохондрий в реализации механизмов программированной гибели клетки // Бюллетень ВСНЦ СО РАМН. 2007. № 1 (53). С. 103–107.
7. Шевцова Е.Ф., Киреева Е.Г., Бачурин С.О. Митохондрии как мишень действия нейропротекторных препаратов // Вестник РАМН. 2005. № 9. С. 13–17.
8. Bayer A.U., Keller O.N., Ferrari F., Maag K.P. Association of glaucoma with neurodegenerative diseases with apoptotic cell death: Alzheimer's disease and Parkinson's disease // Am. J. Ophthalmol. 2002. № 1. Р. 135–137.
9. Bizrah M., Guo L., Cordeiro M.F. Glaucoma and Alzheimer's disease in the elderly //Aging Health. 2011. № 5. Р.719–733.
10. Garaci F.G., Bolacchi F., Cerulli A. et al. Optic Nerve and Optic Radiation Neurodegeneration in Patients with Glaucoma: In Vivo Analysis with 3-T Diffusion-Tensor MR Imaging // Radiol. 2009. №2. Р. 496–501.
11. Gupta N., Ang L.C., Noel de Tilly L. et al. Human glaucoma and neural degeneration in intracranial optic nerve, lateral geniculate nucleus and visual cortex // Br. J. Ohthalmol. 2006. Vol. 90. P. 674–678.
12. Izzotti A., Sacca S.C., Longobardi M., Cartiglia C. Mitochondrial damage in the trabecular meshwork of patients with glaucoma // Arch. Opthalmol. 2010. Vol. 128. N. 6. P. 724–730.












