Slepova O.S., Zaharova G.Yu., Razik Said
Moscow NII of Eye Diseases of Gelmgoltsa
Purpose: To conduct clinical and immunologic evaluation of cryopexy role in surgery treatment of rhegmatogenous retinal detachment (RRD).
Materials and methods: Surgery treatment of RRD was performed in 46 patients with various stages of PVR. Accordingly to the type of operation, patients were divided into 2 groups: including 23 patients each; in first circular scleral impression and in the second – local scleral impression was made.
Each group was divided into subgroups: with surgery and with surgery combined with cryopexy. All patients received traditional drug treatment during 7-14 days after the operation. Examination was performed before and after the operation. Period of observation was 6-8 months.
Results and discussion: After the operation the reattachment was reached in all patients. Evident fibrin release was noted only in those groups in which cryopexy was made, particularly – in circular impression.
Significant increase of the eyesight after the operation was observed mostly in the groups without the cryopexy.
Forming of local and circular buckles without cryopexy provokes immunologic shifts which may be understood as appropriate reaction on the surgery trauma. One can’t completely avoid hyperactivation of separate units of systemic immunity (particularly, hemotactic, tissue-specific), especially if deviations existed before the operation. Cryopexy, in other standard conditions (main surgery method, initial immunologic background, postoperative therapy, PVR stage, age) led to prolongation of immunogenic, anti-inflammatory systemic reactions.
Conclusions: Usage of cryopxy increases the possibility of recidivation of RRD and PVR progression, leads to accelerated development and prolongation of systemic immunopathologic reactions.
Современные успехи в хирургическом лечении регматогенной отслойки сетчатки (РОС), связанные с последними достижениями в витреоретинальной хирургии, позволяют добиться высоких анатомических результатов. Однако до сих пор главной причиной неудач оперативного лечения остается развитие и прогрессирование пролиферативной витреоретинопатии (ПВР). При этом к факторам риска ее возникновения относят ряд хирургических вмешательств, в частности – криопексию [12,3,11,6,5], а также различные проявления иммунопатологии [1,2,8]. Так, имеются данные о том, что криопексия может вызывать повреждение пигментного эпителия с миграцией клеток в стекловидное тело с последующим образованием преретинальных мембран [13,4,7,9]. Однако ряд авторов не считают возможным отказ от криопексии и предлагают применять ее, соблюдая некоторые предосторожности: выполнять криопексию после выпускания субретинальной жидкости, так как при прилегании сетчатки уменьшается дисперсия клеток пигментного эпителия [9,14]; проводить криопексию до витрэктомии, так как это снижает частоту послеоперационной ПВР за счет удаления клеток пигментного эпителия из полости стекловидного тела [10]; по возможности избегать чрезмерного и повторного использования криопексии [13].
Таким образом, единого мнения о влиянии криопексии на результаты хирургического вмешательства и прогрессирование ПВР в настоящее время нет, что определяет актуальность углубленного изучения данной проблемы в целях оптимизации лечения больных с РОС.
Задачей настоящей работы явилось клинико–иммунологическое исследование роли криопексии при хирургическом лечении РОС.
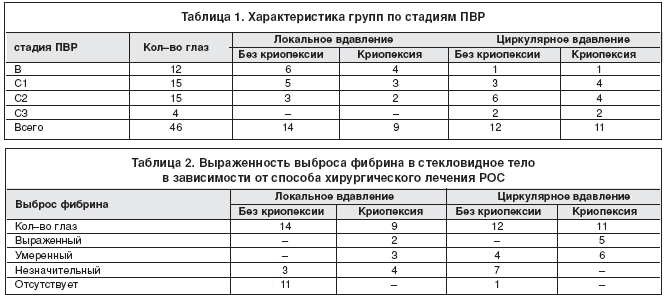
Материалы и методы. Хирургическое лечение РОС (склеропластические операции с использованием силиконовой губки и выпусканием субретинальной жидкости) было проведено 46 больным (19 мужчин, 27 женщин; возраст от 18 до 72 лет) с разными стадиями ПВР. В зависимости от вида операции больные были разделены на две группы по 23 человека каждая; 1–я – циркулярное вдавление склеры, 2–я – локальное вдавление склеры. Каждая группа подразделялась на подгруппы: операции с применением и без применения криопексии (табл. 1). Все больные получали медикаментозное лечение в течение 7–14 дней после операции по однотипной схеме: инстилляции гентамицина, дексаметазона, мидриацила; в/в, капельно – дексаметазон, гемодез, лазикс; в/м – дицинон; внутрь – диакарб, панангин, индометацин. Срок наблюдения составил 6–8 месяцев.
Офтальмологическое обследование проводилось до и после операции по традиционной методике, включающей визометрию, тонометрию, периметрию, биомикроскопию и офтальмоскопию.
Иммунологические исследования сыворотки крови проводились до и после операции (на 8, 14, 21–й дни и через 1, 2, 3 и 5–6 месяцев). Контроль: пробы сыворотки здоровых доноров. Исследовали (с помощью иммуноферментного анализа): цитокины (тест–системы «Протеиновый контур», «Цитокин»; С.–Петербург) и аутоантитела (IgG и IgМ) к S–антигену сетчатки (авторская тест–система; О.С. Слепова, Г.Р. Каламкаров с соавт., 1992–2000).
Статистический анализ осуществлялся с помощью программы «Биостатистика–1997», использовались критерии Фишера, c2 и Стьюдента.
Результаты и обсуждение. После проведения операции сетчатка прилегла у всех больных. В послеоперационном периоде особое внимание уделялось выбросу фибрина в стекловидное тело. При минимальном выбросе в стекловидном теле определялось небольшое количество фибрина, глазное дно свободно офтальмоскопировалось в деталях; при умеренном – детали глазного дна просматривались за флером, а при выраженном – не офтальмоскопировались. Как видно из таблицы 2, выраженный выброс фибрина отмечался только в тех группах, где применялась криопексия; особенно – при циркулярном вдавлении. Последнее, надо полагать, определялось значительно большим объемом криопексии.
В отдаленные сроки витреопролиферативные изменения встречались в 33% и в 41% глаз, соответственно в группах локального и циркулярного вдавления с криопексией. Если криопексия не проводилась, изменения в стекловидном теле наблюдались в 16,6% глаз при циркулярном вдавлении, а при локальном отсутствовали.
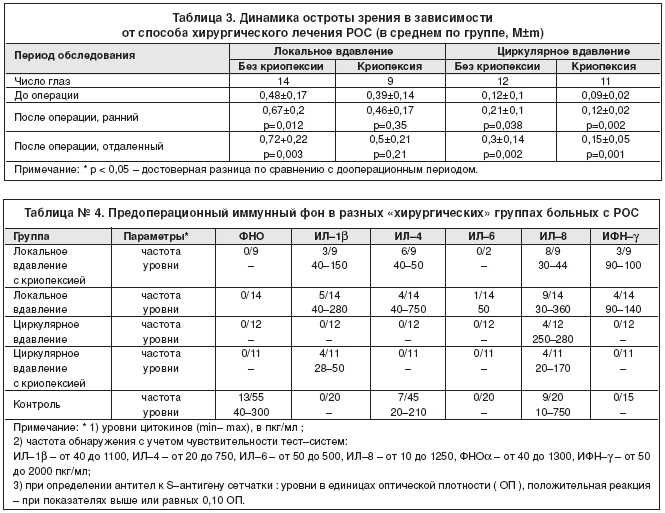
Значительное повышение остроты зрения после операции отмечалось преимущественно в тех группах, где криопексия не применялась (табл. 3).
Спустя 3–6 месяцев после операции у 3 из 20 больных, перенесших криопексию (15%), возникли рецидивы РОС; из них у двоих – при циркулярном пломбировании (18,1%), у одного – при локальном (11,1%). Рецидивы возникли в результате тракции образовавшихся преретинальных мембран и формирования вторичных разрывов в зонах криопексии. Во всех случаях они сопровождались прогрессированием ПВР: переходом из стадии В, С1 и С2 в стадии С1, С3 и D1 соответственно. В группе больных, которым криопексия не проводилась, рецидивов РОС не было.
Иммунологические исследования показали, что до операции частота выявления в сыворотке отдельных цитокинов в сравниваемых группах была различной и иногда превышала норму, но уровни редко выходили за контрольные параметры и в среднем были сопоставимы (табл. 4); антитела к S–антигену сетчатки (IgМ–класса) были обнаружены только в группе больных, которым криопексия не проводилась (у 18 из 26 чел.).
Хирургические вмешательства по поводу РОС в подавляющем большинстве случаев вызывали системные иммунологические сдвиги. Вместе с тем сравнительный анализ показал, что при сохранении общего характера сдвигов динамика их развития (частота и интенсивность, время и продолжительность проявления) в значительной степени зависела от объема и способа хирургического вмешательства, а по отдельным параметрам – и от исходного иммунного фона.
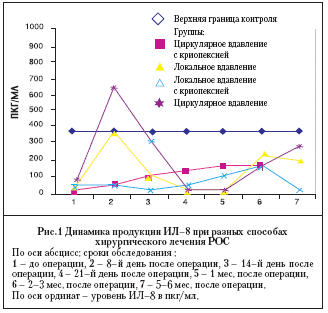
Локальное пломбирование без криопексии вызывало умеренную, но быструю и продолжительную активизацию нейтрофильно–макрофагального звена: периодическое повышение концентрации хемокинов – ИЛ–8 (в 75% случаев) и реже ИЛ–b (в 33%), в течение полугода с пиками на 1–й неделе и 3–м месяце (рис. 1); примерно в те же сроки – стимуляцию продукции ИФН–g (в 45%; 80–250 пкг/мл) – главного индуктора иммунного воспаления, способствующего усилению ответа на антигенные воздействия и развитию аутоиммунных реакций, что и наблюдалось у исходно серопозитивных по антителам к S–антигену больных (в 42,8%). Очень редко и лишь кратковременно (через 1–1,5 месяца) отмечалось повышение уровней других провоспалительных цитокинов – ФНО–a (13,3%) и ИЛ–6 (7%). В этой группе, в отличие от всех остальных (р=0,011), имело место постепенное повышение продукции противовоспалительного ИЛ–4, вплоть до 3 месяцев после операции (всего в 28,5%; у исходно серопозитивных больных – во всех случаях). При циркулярном вдавлении без криопексии динамика иммунологических реакций была в общем аналогичной, хотя продукция хемотаксического фактора (ИЛ–8) заметно усиливалась; вдвое чаще отмечалась стимуляция выработки ИФН–g (100%), ИЛ–1b (66,6%) и ФНО–a (33,3%), но без существенного повышения уровней, по сравнению с группой локального пломбирования.
При применении криопексии характер послеоперационного иммунного ответа менялся. При сравнении с аналогичными операциями без криопексии отмечалось : замедленное развитие и снижение уровней ИЛ–8– хемокина, участвующего в реализации раннего, нейтрофильно–макрофагального звена защиты (рис.1); полное подавление продукции противовоспалительного ИЛ–4, в том числе – у исходно серопозитивных пациентов (р=0,04). Вместе с тем раньше усиливалась ( с опережением в среднем на неделю) и позже угасала (на 2–3 неделе) выработка ИФН–g; чаще отмечалась стимуляция секреции провоспалительных цитокинов ИЛ–1b (75%), а также – ФНО–a (35%) и ИЛ–6 ( 35%), которые в группах сравнения выявлялись очень редко (соответственно 15,4% и 7,6%, р=0,05).
Характерно, что стимуляция иммуногенных, провоспалительных медиаторов, независимо от способа операции, наблюдалась как у исходно позитивных, так и у исходно негативных пациентов (примерно с одинаковой частотой, только у первых – обычно раньше и сильнее), тогда как уровень противовоспалительного ИЛ–4 повышался лишь в тех случаях, когда этот цитокин обнаруживался и до операции, причем, как подчеркивалось выше, только в группе пломбирования без криопексии. Подъем уровня антител к S–антигену, также отмечался только у исходно серопозитивных больных (независимо от способа хирургического вмешательства).
Следует подчеркнуть, что только в группе локального пломбирования без криопексии с помощью принятых схем консервативного лечения удавалось предупредить неблагоприятную гиперсекрецию тех цитокинов, умеренные сдвиги в продукции которых выявлялись и в предоперационном периоде. Так, уровень ИЛ–8 оставался неизменным или снижался в 25% случаев, ИЛ–6– в 50%, ИЛ–1b – в 66,6%, ИФН–g – в 100%. Подавить иммунный ответ на S–антиген у исходно серопозитивных пациентов удалось в этой группе в 62,5% случаев; в группе циркулярного пломбирования – в 50%.
Полная нормализация иммунного статуса спустя 1–1,5 месяца не отмечалась ни в одной из наблюдавшихся групп, через 3–6 месяцев – у половины из всех обследованных. При этом в группе больных, которым криопексия не проводилась, достоверно превышала контрольные параметры продукция ИЛ–1b (в 30%; р=0,008), реже – ИФН–g (19,2 %, р = 0,157); если криопексия применялась, значительно чаще чем в контроле, выявлялись ИЛ–1b (25%, р=0,05), ИФН–g (50%; р=0,019) и ИЛ–6 (30% ; р=0,029), причем последний обнаруживался только во второй группе (р=0,023).
Таким образом, полученные данные свидетельствуют о том, что локальное и циркулярное пломбирование без криопексии вызывают иммунологические сдвиги, которые могут быть расценены, как закономерная реакция на хирургическую травму; хотя полностью избежать гиперактивации отдельных звеньев системного иммунитета (в частности – хемотаксического, тканеспецифического) удается не всегда, особенно, если отклонения от нормы имели место и до операции. Криопексия, при прочих равных условиях (основной способ операции, исходный иммунный фон, послеоперационная терапия, стадия ПВР, возраст) приводила к пролонгации иммуногенных, провоспалительных реакций на уровне всего организма. Это согласуется с нашими клиническими наблюдениями и подтверждает мнение тех авторов, которые указывают на отягощающую роль криопексии при операциях по поводу РОС. Важно подчеркнуть, что, если при локальном пломбировании без криопексии послеоперационная терапия в большинстве случаев оказалась достаточной для предотвращения длительного иммунологического дисбаланса, то в условиях криопексии достичь такого эффекта удавалось значительно реже. В связи с этим в тех случаях, когда проведение криопексии диктуется клинической необходимостью, представляется целесообразным более активное и продолжительное использование иммуносупрессивных средств. Больным с исходными нарушениями в иммунном статусе иммунокорригирующая терапия, судя по результатам проведенного исследования, показана не только в послеоперационном, но и в предоперационном периоде.
Выводы
1. Применение криопексии повышает вероятность рецидивов РОС и прогрессирования ПВР.
2. Применение криопексии приводит к ускоренному развитию и пролонгации системных иммунопатологических реакций.
3. В целях коррекции иммунологического дисбаланса после операций по поводу РОС, особенно при использовании криопексии, целесообразно более активное и длительное применение иммуносупрессивных средств.
Литература
1. Слепова О.С., Захарова Г.Ю., Рзик С./ «Современные возможности в диагностике и лечении витреоретинальной патологии»– М., 2004. – С. 311–314.
2. Слепова О.С./ Докторская диссертация
3. Ahmadieh H, Entezari M, Soheilian M, Azarmina M, Mashayekhi A, Sajjadi H. Factors influencing anatomic and visual results in primary scleral buckling. Eur J Ophtalmol 2000, 10: 153–159.
4. Bonnet M, Guenoun S. Surgical risk factors for severe postoperative proliferative vitreoretinopathy (PVR) in retinal detachment with grade B PVR. Graefes Arch Clin. Exp Ophthalmol 1995, 233: 789–791.
5. Cowley M, Conway BP, Campochiaro PA, Kaiser D, Gaskin H. Clinical risk factors for proliferative vitreoretinopathy. Arch Ophtalmol 1989, 107: 1147–1151.
6. Dumas C, Bonnet M. Decollement choroidien associe au decollement rhegmatogene de la retine: facteur de risk de PVR postoperatoire. J Fr Ophtalmol 1996, 19: 97–100.
7. Dunker S, Faulborn J, Haller EM, Reich ME. The effect of retinal cryoapplication on the vitreous. Retina 1997, 17: 338–343.
8. Limb GA, Little BC, Meager A, Ogilvie JA, Wolstencroft RA, Franks WA, Chignel AH, Dumonde DC. Cytokines in proliferative vitreoretinopathy. Eye 1991, 5: 686–693.
9. Lincoff H, Kreissig I. Cryopexy is not as bad ad as all that. Retina 1998, 18: 486–488.
10. Michels RG, Rice TA, Blankenship G. Surgical techniques for selected giant retinal tears. Retina 1983, 3: 139–153.
11. Nagasaki H, Shinagawa K, Mochizuki M. Risk factors for proliferative vitreoretinopathy. Prog Retin Eye Res 1998, 17: 77–98.
12. Rodriguez de la Ruz Franch E, Aragon Roca JA, Pasco Herrero B, Gonzalez Rodriguez JC. Potential to predict the risk of developing proliferative vitreoretinopathy with the analysis of clinical factors of regmatogenous retinal detachments. Arch Soc Esp Oftalmol 2000, 75: 807–812.
13. Singh AK, Michels RG, Glasser BM. Skleral indentation following cryotherapy and repeat cryotherapy enhance release of viable retinal pigment epithelial cells. Retina 1986, 6: 77–80.
14. Tornambe PE, Hilton GF. The steamroller maneuver and proliferative vitreoretinopathy. Arch Ophtalmol 1992, 110: 15.












