–Ь–µ—В–Њ–і—Л: –њ—А–Њ–≤–µ–і–µ–љ–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є –£–С–Ь –≤—Л—Б–Њ—В—Л –Є–љ—В—А–∞—Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –њ–Њ—Б–ї–µ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–Љ –≤—Л–њ–Њ–ї–љ–µ–љ—Л 2 –Є –±–Њ–ї–µ–µ –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ—Л–µ –Њ–њ–µ—А–∞—Ж–Є–Є: —Б –Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ (1-—П –≥—А—Г–њ–њ–∞) –Є –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ (2-—П –≥—А—Г–њ–њ–∞) –Т–У–Ф –љ–∞ —Д–Њ–љ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Ї–ї–∞—Б—Б–∞–Љ–Є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤: β-–±–ї–Њ–Ї–∞—В–Њ—А—Л, –∞–љ–∞–ї–Њ–≥–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤, –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –∞–љ–∞–ї–Њ–≥–Њ–≤ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –Є β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤, –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –Є –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л; 3-—П –≥—А—Г–њ–њ–∞ (–Ї–Њ–љ—В—А–Њ–ї—М–љ–∞—П) – –±–µ–Ј –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л: –≤—Б–µ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Њ 102 –њ–∞—Ж–Є–µ–љ—В–∞ (104 –≥–ї–∞–Ј–∞) –≤ –≤–Њ–Ј—А–∞—Б—В–µ 68,4±0,8 –≥–Њ–і–∞. 1-—П –≥—А—Г–њ–њ–∞ –≤–Ї–ї—О—З–∞–ї–∞ 41 –њ–∞—Ж–Є–µ–љ—В–∞ (42 –≥–ї–∞–Ј–∞) —Б –Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Т–У–Ф (—Б—А–µ–і–љ–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Т–У–Ф – 21,6±0,34 –Љ–Љ —А—В. —Б—В.), 2-—П –≥—А—Г–њ–њ–∞ – 41 –њ–∞—Ж–Є–µ–љ—В–∞ (42 –≥–ї–∞–Ј–∞) —Б –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Т–У–Ф (31,7±0,69 –Љ–Љ —А—В. —Б—В.), –Ї–Њ–љ—В—А–Њ–ї—М–љ–∞—П –≥—А—Г–њ–њ–∞ – 20 –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Т—Л—Б–Њ—В–∞ –Є–љ—В—А–∞—Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤—Б–µ—Е –њ–Њ–і–≥—А—Г–њ–њ –±—Л–ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–µ–љ–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Б–Њ—З–µ—В–∞–љ–љ—Г—О —В–µ—А–∞–њ–Є—О β-–±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л –≤ 1-–є –≥—А—Г–њ–њ–µ, —Е–Њ—В—П –Є –Њ–љ –љ–µ –і–Њ—Б—В–Є–≥–∞–ї –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Т–У–Ф, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О, –≤—Л—Б–Њ—В–∞ –Є–љ—В—А–∞—Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–∞ –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е –ї–µ—З–µ–±–љ—Л—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ: –њ—А–Є —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–µ –і–ї—П –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –Т–У–Ф –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Г—О –Љ–µ—Б—В–љ—Г—О –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Г—О —В–µ—А–∞–њ–Є—О, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ —Б—В—А—Г–Ї—В—Г—А—Л –њ–µ—А–µ–і–љ–µ–є –Ї–∞–Љ–µ—А—Л –≥–ї–∞–Ј–∞ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –њ–Њ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В—Л, –љ–∞–Ј–љ–∞—З–µ–љ–љ—Л–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є.
–Ъ–ї—О—З–µ–≤—Л–µ —Б–ї–Њ–≤–∞: —А–µ—Д—А–∞–Ї—В–µ—А–љ–∞—П –≥–ї–∞—Г–Ї–Њ–Љ–∞, –Љ–µ—Б—В–љ–∞—П –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П, –Є–љ—В—А–∞—Б–Ї–ї–µ—А–∞–ї—М–љ–∞—П –њ–Њ–ї–Њ—Б—В—М.
Abstract
Medicamental therapy of refractory glaucoma:
the present and the future
Gusarevich O.G., Gusarevich A.A.,
Nurlanbayeva A.E., Aidagulova S.V.
Novosibirsk State Medical University
Road clinic hospital PLC «The Russian Railways» (Novosibirsk)
Purpose: by ultrasound biomicroscopy to evaluate the changes of a surgical area in refractory glaucoma patients which are using postoperative local hypotensive medicines of different kinds (UBM).
Methods: complex ophthalmological examination and UBM of an intrascleral cavity height was performed after surgical treatment in patients, who underwent two or more antiglaucoma surgery and long-term treatment with different hypotensive drugs: β-blockers, prostaglandin analogues, a combination of prostaglandin analogues and β-blockers, a combination of β-blockers and carbonic anhydrase inhibitors. Patients were divided into 2 groups depending on the intraocular pressure (IOP): with compensated IOP (1st group) and noncompensated one (2nd group); the 3rd group (control) - without medicamental therapy.
Results: overall, 102 patients (104 eyes) , average age 68,4±0,8 , were enrolled into the study.
First group consisted of 41 patients (42 eyes) with compensated IOP (21,6±0,34 mm Hg). Second group – 41 patients (42 eyes) with noncompensated IOP (31,7±0,69 mm Hg). Control group included 20 patients.
There was a statistically significant decrease of the intrascleral cavity height in patients of the main groups compared to the control one, excluding the patients treated with β-blockers and carbonic anhydrase inhibitors in the first group, although these indices were still less than the control ones. In patients with compensated IOP level height of the intrascleral cavity was regarded as an indication for additional treatment.
In the late postoperative period the best results were observed in patients in whom the complex drug therapy of β-blockers and carbonic anhydrase inhibitors has been used.
Conclusion: for the IOP compensation in refractory glaucoma it is necessary to use a combined local hypotensive therapy because of a complex effect on the eye anterior chamber structures which is characterized by more evident hypotensive effect than the monotherapy.
Key words: refractory glaucoma, local hypotensive therapy, intrascleral cavity.
–У–ї–∞—Г–Ї–Њ–Љ–∞ – —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–∞—П –Њ–њ—В–Є—З–µ—Б–Ї–∞—П –љ–µ–є—А–Њ–њ–∞—В–Є—П —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–є –≥–Є–±–µ–ї—М—О –≥–∞–љ–≥–ї–Є–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б–µ—В—З–∞—В–Ї–Є, —З—В–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –њ—А–Њ—П–≤–ї—П–µ—В—Б—П —Б—Г–ґ–µ–љ–Є–µ–Љ –љ–µ–є—А–Њ—А–µ—В–Є–љ–∞–ї—М–љ–Њ–≥–Њ –њ–Њ—П—Б–Ї–∞ –і–Є—Б–Ї–∞ –Ј—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –љ–µ—А–≤–∞, –і–µ—Д–µ–Ї—В–∞–Љ–Є –≤ —Б–ї–Њ–µ —А–µ—В–Є–љ–∞–ї—М–љ—Л—Е –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ –Є –і–µ—Д–µ–Ї—В–∞–Љ–Є –њ–Њ–ї–µ–є –Ј—А–µ–љ–Є—П. –Э–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–є —Д–Њ—А–Љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л —П–≤–ї—П–µ—В—Б—П –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–∞—П –≥–ї–∞—Г–Ї–Њ–Љ–∞ (–Ю–£–У), –Ї–Њ—В–Њ—А–∞—П —Г —А—П–і–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є–Њ–±—А–µ—В–∞–µ—В —А–µ—Д—А–∞–Ї—В–µ—А–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А [1, 2, 5]. –Ъ —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–µ –Њ—В–љ–Њ—Б—П—В —В–∞–Ї–Є–µ —Б–ї—Г—З–∞–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –љ–Є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є, –љ–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–Љ–Є —Б–њ–Њ—Б–Њ–±–∞–Љ–Є –љ–µ —Г–і–∞–µ—В—Б—П –і–Њ—Б—В–Є—З—М —Б—В–∞–±–Є–ї—М–љ–Њ–є –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П (–Т–У–Ф): –њ–µ—А–≤–Є—З–љ–∞—П –Њ–њ–µ—А–Є—А–Њ–≤–∞–љ–љ–∞—П –≥–ї–∞—Г–Ї–Њ–Љ–∞, —В—А–µ–±—Г—О—Й–∞—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ–Њ–≤—В–Њ—А–љ—Л—Е —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤, –∞ —В–∞–Ї–ґ–µ —А–∞–Ј–ї–Є—З–љ—Л–µ —Д–Њ—А–Љ—Л –≤—В–Њ—А–Є—З–љ—Л—Е –≥–ї–∞—Г–Ї–Њ–Љ [12, 16].
–¶–µ–ї—М—О –ї–µ—З–µ–љ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л —П–≤–ї—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ –Т–У–Ф –і–Њ —Г—А–Њ–≤–љ—П, –Ї–Њ—В–Њ—А—Л–є –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В –Є–ї–Є –Љ–Є–љ–Є–Љ–Є–Ј–Є—А—Г–µ—В –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й—Г—О –њ–Њ—В–µ—А—О –Ј—А–µ–љ–Є—П. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —П–≤–љ—Л–µ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –≤ –ї–∞–Ј–µ—А–љ–Њ–є –Є –і—А–µ–љ–∞–ґ–љ–Њ–є —Е–Є—А—Г—А–≥–Є–Є [14], –Љ–µ—Б—В–љ–∞—П –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–∞—П —В–µ—А–∞–њ–Є—П –њ–Њ-–њ—А–µ–ґ–љ–µ–Љ—Г –Њ—Б—В–∞–µ—В—Б—П –≤–µ–і—Г—Й–Є–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ, —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ—В–Њ—А–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г—О—В –Т–У–Ф. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б—В–∞–љ–і–∞—А—В–Њ–Љ –ї–µ—З–µ–љ–Є—П –≤–њ–µ—А–≤—Л–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ю–£–У —В–∞–Ї–ґ–µ —П–≤–ї—П–µ—В—Б—П –Љ–µ—Б—В–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ. –Ь–Њ–љ–Њ—В–µ—А–∞–њ–Є—П, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —П–≤–ї—П–µ—В—Б—П –њ–µ—А–≤—Л–Љ —Н—В–∞–њ–Њ–Љ –ї–µ—З–µ–љ–Є—П, –Њ–і–љ–∞–Ї–Њ –Љ–љ–Њ–≥–Є–µ –њ–∞—Ж–Є–µ–љ—В—Л, –Њ—Б–Њ–±–µ–љ–љ–Њ —Б —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є, –љ—Г–ґ–і–∞—О—В—Б—П –≤ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–µ –і–ї—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –Т–У–Ф –Є –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л [18].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–ї—П —Б–љ–Є–ґ–µ–љ–Є—П –Т–У–Ф –њ—А–Є–Љ–µ–љ—П—О—В 5 –≥—А—Г–њ–њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Є–Ј –љ–Є—Е –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л β-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (β-–±–ї–Њ–Ї–∞—В–Њ—А—Л), –∞–љ–∞–ї–Њ–≥–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –Є –Є–љ–≥–Є–±–Є—В–Њ—А—Л –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л; –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –Є–Љ–µ—О—В –і–Њ–Ї–∞–Ј–∞–љ–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М α-–∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Є–µ –∞–≥–Њ–љ–Є—Б—В—Л –Є –Ь-—Е–Њ–ї–Є–љ–Њ–Љ–Є–Љ–µ—В–Є–Ї–Є (–Љ–Є–Њ—В–Є–Ї–Є). –Я—А–µ–њ–∞—А–∞—В—Л –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–Њ—З–µ—В–∞–љ–Є—П—Е –±–ї–∞–≥–Њ–і–∞—А—П –Є—Е –≤–Ј–∞–Є–Љ–љ–Њ –і–Њ–њ–Њ–ї–љ—П—О—Й–µ–Љ—Г –і–µ–є—Б—В–≤–Є—О –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б–љ–Є–ґ–µ–љ–Є—П –Т–У–Ф [3, 12].
–° —Г—З–µ—В–Њ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є, –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Є –і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є —П–≤–ї—П—О—В—Б—П β-–±–ї–Њ–Ї–∞—В–Њ—А—Л –Є –∞–љ–∞–ї–Њ–≥–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤.
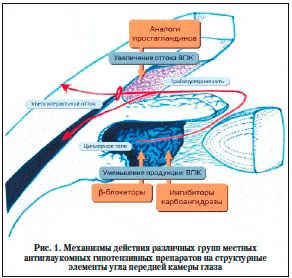
β-–±–ї–Њ–Ї–∞—В–Њ—А—Л —Б–љ–Є–ґ–∞—О—В –Т–У–Ф –њ—Г—В–µ–Љ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –њ—А–Њ–і—Г–Ї—Ж–Є–Є –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є (–Т–У–Ц) (—А–Є—Б. 1) –Є –≤ —В–µ—З–µ–љ–Є–µ –Љ–љ–Њ–≥–Є—Е –ї–µ—В —П–≤–ї—П—О—В—Б—П –≤–µ—Б—М–Љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ–Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л. –Ю–і–Є–љ –Є–Ј –љ–Є—Е – —В–Є–Љ–Њ–ї–Њ–ї –Љ–∞–ї–µ–∞—В —Б—З–Є—В–∞–µ—В—Б—П «–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ» –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є [17]. –Ю–љ —П–≤–ї—П–µ—В—Б—П –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–Љ –∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є –љ–µ –њ—А–Њ—П–≤–ї—П–µ—В —П–≤–љ–Њ–є —Б–Є–Љ–њ–∞—В–Њ–Љ–Є–Љ–µ—В–Є—З–µ—Б–Ї–Њ–є –Є–ї–Є –Љ–µ–Љ–±—А–∞–љ–Њ—Б—В–∞–±–Є–ї–Є–Ј–Є—А—Г—О—Й–µ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є. –С–ї–Њ–Ї–Є—А–Њ–≤–∞–љ–Є–µ β––∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –њ–Њ—Б—А–µ–і–љ–Є–Ї–∞ —Ж–Р–Ь–§, –Ї–Њ—В–Њ—А—Л–є —Г—З–∞—Б—В–≤—Г–µ—В –≤ –њ—А–Њ—Ж–µ—Б—Б–∞—Е, –њ—А–Є–≤–Њ–і—П—Й–Є—Е –Ї —В–Њ—А–Љ–Њ–ґ–µ–љ–Є—О –њ—А–Њ–і—Г–Ї—Ж–Є–Є –Т–У–Ц [10].
β-–±–ї–Њ–Ї–∞—В–Њ—А—Л —Г–і–Њ–±–љ—Л –≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є (1 –Є–ї–Є 2 —А./–і–µ–љ—М) –Є —З–∞—Б—В–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є. β-–±–ї–Њ–Ї–∞—В–Њ—А—Л –љ–µ –≤–ї–Є—П—О—В –љ–∞ —А–∞–Ј–Љ–µ—А –Ј—А–∞—З–Ї–∞ –Є –∞–Ї–Ї–Њ–Љ–Њ–і–∞—Ж–Є—О –≥–ї–∞–Ј–∞, –Є–Љ–µ—О—В —Е–Њ—А–Њ—И—Г—О –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М, –љ–Њ –Љ–Њ–≥—Г—В –≤—Л–Ј–≤–∞—В—М —Б–Є—Б—В–µ–Љ–љ—Л–µ (–≤ —В. —З. —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–µ –Є —Б–µ—А–і–µ—З–љ—Л–µ) –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л. –°—А–µ–і–Є –Љ–µ—Б—В–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ – –≥–Є–њ–µ—А–µ–Љ–Є—П –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л, —З—Г–≤—Б—В–≤–Њ –ґ–ґ–µ–љ–Є—П, –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–є —В–Њ—З–µ—З–љ—Л–є –Ї–µ—А–∞—В–Є—В –Є —Б–љ–Є–ґ–µ–љ–Є–µ –њ—А–Њ–і—Г–Ї—Ж–Є–Є —Б–ї–µ–Ј–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–Є–љ–і—А–Њ–Љ–∞ «—Б—Г—Е–Њ–≥–Њ –≥–ї–∞–Ј–∞» [15].
–Р–љ–∞–ї–Њ–≥–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —В–∞–Ї–ґ–µ –Њ—В–љ–Њ—Б—П—В—Б—П –Ї –њ—А–µ–њ–∞—А–∞—В–∞–Љ –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Ю–£–У [8]; —Б–љ–Є–ґ–µ–љ–Є–µ –Т–У–Ф –Њ—Б–љ–Њ–≤–∞–љ–Њ –љ–∞ —Г–≤–µ–ї–Є—З–µ–љ–Є–Є —В—А–∞–±–µ–Ї—Г–ї—П—А–љ–Њ–≥–Њ –Є —Г–≤–µ–Њ—Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–≥–Њ –Њ—В—В–Њ–Ї–∞ (—А–Є—Б. 1). –Р–љ–∞–ї–Њ–≥–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ c–љ–Є–ґ–∞—О—В —Г—А–Њ–≤–µ–љ—М –Т–У–Ф, —З–µ–Љ —В–Є–Љ–Њ–ї–Њ–ї [17]; –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–љ–Є –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—О—В —А–µ–Ј–Ї–Є–µ –њ–Њ–і—К–µ–Љ—Л –Т–У–Ф –Є –µ–≥–Њ –Ї–Њ–ї–µ–±–∞–љ–Є—П –≤ —В–µ—З–µ–љ–Є–µ 24 —З [27, 29]. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –њ—А–µ–њ–∞—А–∞—В—Л —Н—В–Њ–є –≥—А—Г–њ–њ—Л —А–µ–і–Ї–Њ –≤—Л–Ј—Л–≤–∞—О—В —Б–Є—Б—В–µ–Љ–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л, –Њ–љ–Є –Њ—З–µ–љ—М —З–∞—Б—В–Њ –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л –Ј–∞ –Љ–µ—Б—В–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л, –љ–∞–њ—А–Є–Љ–µ—А, –≥–Є–њ–µ—А–µ–Љ–Є—О –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л, —З—Г–≤—Б—В–≤–Њ –ґ–ґ–µ–љ–Є—П, —В–Њ—З–µ—З–љ—Л–є –Ї–µ—А–∞—В–Є—В, –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Є–≥–Љ–µ–љ—В–∞—Ж–Є–Є —А–∞–і—Г–ґ–Ї–Є, –≥–Є–њ–µ—А—В—А–Є—Е–Њ–Ј —А–µ—Б–љ–Є—Ж, –∞ —В–∞–Ї–ґ–µ –Ї–Є—Б—В–Њ–Ј–љ—Л–є –Љ–∞–Ї—Г–ї—П—А–љ—Л–є –Њ—В–µ–Ї —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ—Л–Љ —Е—А—Г—Б—В–∞–ї–Є–Ї–Њ–Љ [22, 24, 26].
–Я—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤—В–Њ—А–Њ–є –ї–Є–љ–Є–Є —П–≤–ї—П—О—В—Б—П –Љ–µ—Б—В–љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л –Є α-–∞–≥–Њ–љ–Є—Б—В—Л; –Њ–љ–Є –Љ–Њ–≥—Г—В –Ј–∞–Љ–µ–љ—П—В—М –Є–ї–Є –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б β-–±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –Є–ї–Є –∞–љ–∞–ї–Њ–≥–∞–Љ–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ [23].
–Ш–љ–≥–Є–±–Є—В–Њ—А—Л –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л —Б–љ–Є–ґ–∞—О—В –Т–У–Ф –њ—Г—В–µ–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є—П –њ—А–Њ–і—Г–Ї—Ж–Є–Є –Т–У–Ц —Б –њ–Њ–Љ–Њ—Й—М—О —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–≥–Њ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ–Є –њ–Њ–±–Њ—З–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є —П–≤–ї—П—О—В—Б—П —З—Г–≤—Б—В–≤–Њ –ґ–ґ–µ–љ–Є—П, –Ј—А–Є—В–µ–ї—М–љ—Л–є –і–Є—Б–Ї–Њ–Љ—Д–Њ—А—В, –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–є —В–Њ—З–µ—З–љ—Л–є –Ї–µ—А–∞—В–Є—В –Є –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є–є –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–Є—В. –Ш–љ–≥–Є–±–Є—В–Њ—А—Л –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л —В–∞–Ї–ґ–µ –Љ–Њ–≥—Г—В —Г—Е—Г–і—И–Є—В—М —Д—Г–љ–Ї—Ж–Є—О —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞ —А–Њ–≥–Њ–≤–Є—Ж—Л, —В–µ–Љ —Б–∞–Љ—Л–Љ –≤—Л–Ј—Л–≤–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—О —А–Њ–≥–Њ–≤–Є—Ж—Л [16].
α-–∞–≥–Њ–љ–Є—Б—В—Л —Г–Љ–µ–љ—М—И–∞—О—В –њ—А–Њ–і—Г–Ї—Ж–Є—О –Т–У–Ц –Є —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В —Г–≤–µ–Њ—Б–Ї–ї–µ—А–∞–ї—М–љ—Л–є –Њ—В—В–Њ–Ї –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ. –Я—А–Є —Н—В–Њ–Љ α2––∞–≥–Њ–љ–Є—Б—В—Л –љ–Њ–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П, –љ–∞–њ—А–Є–Љ–µ—А, –±—А–Є–Љ–Њ–љ–Є–і–Є–љ –Є –∞–њ—А–∞–Ї–ї–Њ–љ–Є–і–Є–љ, —П–≤–ї—П—П—Б—М –±–Њ–ї–µ–µ —Б–њ–µ—Ж–Є—Д–Є—З–љ—Л–Љ–Є, –≤—Л–Ј—Л–≤–∞—О—В –Љ–µ–љ—М—И–µ —Б–Є—Б—В–µ–Љ–љ—Л—Е –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, —З–µ–Љ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–µ —А–∞–љ–µ–µ –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ α-–∞–≥–Њ–љ–Є—Б—В—Л. –С—А–Є–Љ–Њ–љ–Є–і–Є–љ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –і–ї—П –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –∞–њ—А–∞–Ї–ї–Њ–љ–Є–і–Є–љ —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –њ—А–Є –Ї—А–∞—В–Ї–Њ—Б—А–Њ—З–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є [29]. –Ю—Б–љ–Њ–≤–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ–Ї α-–∞–≥–Њ–љ–Є—Б—В–Њ–≤ – –Љ–µ—Б—В–љ—Л–µ –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є.
–Т—Л–±–Њ—А–Њ–Љ —В—А–µ—В—М–µ–є –ї–Є–љ–Є–Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Ю–£–У —П–≤–ї—П—О—В—Б—П —Е–Њ–ї–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Є–µ –∞–≥–Њ–љ–Є—Б—В—Л – –Ь-—Е–Њ–ї–Є–љ–Њ–Љ–Є–Љ–µ—В–Є–Ї–Є (–Љ–Є–Њ—В–Є–Ї–Є), —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Б–љ–Є–ґ–∞—О—Й–Є–µ –Т–У–Ф –Ј–∞ —Б—З–µ—В —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Њ–±—Л—З–љ–Њ–≥–Њ —В—А–∞–±–µ–Ї—Г–ї—П—А–љ–Њ–≥–Њ –Њ—В—В–Њ–Ї–∞ –≤ —А–µ–ґ–Є–Љ–µ –Њ—В 3 –і–Њ 4 –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є –≤ –і–µ–љ—М. –Я—А–µ–њ–∞—А–∞—В—Л –Є–Ј –≥—А—Г–њ–њ—Л –Љ–Є–Њ—В–Є–Ї–Њ–≤ –њ—А–Њ–≤–Њ—Ж–Є—А—Г—О—В —В–Ї–∞–љ–µ–≤—Г—О –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Г—О —А–µ–∞–Ї—Ж–Є—О, –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–∞—П –±–ї–Є–Ј–Њ—А—Г–Ї–Њ—Б—В—М, –≥–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М, —А–∞–Ј–≤–Є—В–Є–µ –Ї–∞—В–∞—А–∞–Ї—В—Л –Є –Љ–Є–Њ–Ј–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –і–ї–Є—В–µ–ї—М–љ–∞—П —Б—В–Є–Љ—Г–ї—П—Ж–Є—П —Б—В—А—Г–Ї—В—Г—А —Ж–Є–ї–Є–∞—А–љ–Њ–≥–Њ —В–µ–ї–∞ –Є –Ј—А–∞—З–Ї–Њ–≤–Њ–≥–Њ —Б—Д–Є–љ–Ї—В–µ—А–∞ –Ь-—Е–Њ–ї–Є–љ–Њ–Љ–Є–Љ–µ—В–Є–Ї–∞–Љ–Є –Љ–Њ–ґ–µ—В —Б–љ–Є–Ј–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є –≤ —Б–≤—П–Ј–Є —Б –Њ—В—Б–ї–Њ–є–Ї–Њ–є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –≥–ї–∞–Ј–∞ –Є–ї–Є —А–∞–Ј–≤–Є—В–Є–µ–Љ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л [12].
–Ъ–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–µ—Б—В–љ—Л—Е –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –≤–Њ –Љ–љ–Њ–≥–Є—Е —Б–ї—Г—З–∞—П—Е –љ–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –Т–У–Ф [3]. –Ґ–∞–Ї, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є —В—А–µ–±—Г–µ—В—Б—П –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Т–У–Ф, –љ–µ—А–µ–і–Ї–Њ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ –і–Њ–±–∞–≤–ї–µ–љ–Є–Є –≤—В–Њ—А–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞.
–Т–Ј–∞–Є–Љ–Њ–і–Њ–њ–Њ–ї–љ—П—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ 2-—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —З–∞—Б—В–Њ —Б–ї—Г–ґ–Є—В –Њ—Б–љ–Њ–≤–Њ–є –і–ї—П —А–∞–Ј—А–∞–±–Њ—В–Ї–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Ш—Е –≤–∞–ґ–љ—Л–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ —П–≤–ї—П–µ—В—Б—П 2 –і–µ–є—Б—В–≤—Г—О—Й–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –≤ 1 –Ї–∞–њ–ї–µ, —З—В–Њ —Г—Б—В—А–∞–љ—П–µ—В –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П –≤—Л–Љ—Л–≤–∞–љ–Є—П –њ–µ—А–≤–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ –і—А—Г–≥–Є–Љ –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Г–≤–µ–ї–Є—З–µ–љ–Є—О –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—О – –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –µ–≥–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –≤ —Б–≤—П–Ј–Є —Б —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –і–Њ–Ј—Л —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е—Б—П –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –≥–ї–∞–Ј–љ—Л—Е –Ї–∞–њ–µ–ї—М –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–Њ–≤ (–≤ —В. —З. –±–µ–љ–Ј–∞–ї–Ї–Њ–љ–Є—П —Е–ї–Њ—А–Є–і–∞), –Ї–Њ—В–Њ—А—Л–µ –Њ–±–ї–∞–і–∞—О—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ–є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Н–њ–Є—В–µ–ї–Є—П —А–Њ–≥–Њ–≤–Є—Ж—Л [19].
–Ґ–∞–Ї, β-–±–ї–Њ–Ї–∞—В–Њ—А—Л (–≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —В–Є–Љ–Њ–ї–Њ–ї) —Е–Њ—А–Њ—И–Њ –Ї–Њ–Љ–±–Є–љ–Є—А—Г—О—В—Б—П —Б –Љ–µ—Б—В–љ—Л–Љ–Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л –Є –∞–љ–∞–ї–Њ–≥–∞–Љ–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤. –Э–∞–њ—А–Є–Љ–µ—А, —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ—Л–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –і–Њ—А–Ј–Њ–ї–∞–Љ–Є–і/—В–Є–Љ–Њ–ї–Њ–ї (–Ъ–Њ—Б–Њ–њ—В) –Є –±—А–Є–љ–Ј–Њ–ї–∞–Љ–Є–і/—В–Є–Љ–Њ–ї–Њ–ї (–Р–Ј–∞—А–≥–∞) —П–≤–ї—П—О—В—Б—П —Б—В–Њ–ї—М –ґ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ–Є –і–ї—П —Б–љ–Є–ґ–µ–љ–Є—П –Т–У–Ф, –Ї–∞–Ї –њ—А–Є –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є –Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ 2 —А./–і–µ–љ—М –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –ї—Г—З—И–Є–є –Ї–Њ–љ—В—А–Њ–ї—М –Т–У–Ф, —З–µ–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–љ–∞–ї–Њ–≥–Њ–≤ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ 1 —А./–і–µ–љ—М. –Я—А–Є —Н—В–Њ–Љ –і–Њ—А–Ј–Њ–ї–∞–Љ–Є–і —Г—Б–Є–ї–Є–≤–∞–µ—В –Ї—А–Њ–≤–Њ—В–Њ–Ї –≤ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ –≥–ї–∞–Ј–∞ –Є —А–µ—В—А–Њ–±—Г–ї—М–±–∞—А–љ—Л—Е —Б–Њ—Б—Г–і–∞—Е.
–§–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–∞—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –±—А–Є–Љ–Њ–љ–Є–і–Є–љ/—В–Є–Љ–Њ–ї–Њ–ї (–Ъ–Њ–Љ–±–Є–≥–∞–љ) –≤–Ї–ї—О—З–∞–µ—В —Б–Њ—З–µ—В–∞–љ–Є–µ β-–±–ї–Њ–Ї–∞—В–Њ—А–∞ —В–Є–Љ–Њ–ї–Њ–ї–∞, –Ї–Њ—В–Њ—А—Л–є —Г–Љ–µ–љ—М—И–∞–µ—В –Т–У–Ф –њ—Г—В–µ–Љ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–∞ –Т–У–Ц, –Є –±—А–Є–Љ–Њ–љ–Є–і–Є–љ–∞ – –∞–≥–Њ–љ–Є—Б—В–∞ α-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, –Є–Љ–µ—О—Й–µ–≥–Њ –і–≤–Њ–є–љ–Њ–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П: –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г–≤–µ–Њ—Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–≥–Њ –Њ—В—В–Њ–Ї–∞ —Б –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ–Љ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–∞ –Т–У–Ц [16].
–Ф—А—Г–≥–Њ–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –њ–Њ–ї–µ–Ј–љ–Њ–є —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–µ–є —П–≤–ї—П–µ—В—Б—П β-–±–ї–Њ–Ї–∞—В–Њ—А –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –∞–љ–∞–ї–Њ–≥–∞–Љ–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ – —Н—В–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В/—В–Є–Љ–Њ–ї–Њ–ї (–Ъ—Б–∞–ї–∞–Ї–Њ–Љ) –Є —В—А–∞–≤–Њ–њ—А–Њ—Б—В/—В–Є–Љ–Њ–ї–Њ–ї (–Ф—Г–Њ—В—А–∞–≤) [28]. –Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –∞–љ–∞–ї–Њ–≥–Њ–≤ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞ —П–≤–ї—П–µ—В—Б—П –і–Њ–њ–Њ–ї–љ—П—О—Й–Є–Љ –Ї –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ —Б–љ–Є–ґ–µ–љ–Є—П –Т–У–Ф β––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤.
–†–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞ –Є —В–Є–Љ–Њ–ї–Њ–ї–∞ –±—Л–ї –∞–±—Б–Њ–ї—О—В–љ–Њ –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Т–У–Ф –≤ –Ї–∞–ґ–і—Л–є –Љ–Њ–Љ–µ–љ—В –≤—А–µ–Љ–µ–љ–Є –≤ —В–µ—З–µ–љ–Є–µ 24 —З. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Љ–∞–Ї—Б–Є–Љ—Г–Љ, –Љ–Є–љ–Є–Љ—Г–Љ –Є –Ї–Њ–ї–µ–±–∞–љ–Є—П –Т–У–Ф –±—Л–ї–Є –љ–Є–ґ–µ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–∞/ —В–Є–Љ–Њ–ї–Њ–ї–∞, —З–µ–Љ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ї–∞–ґ–і–Њ–≥–Њ –Є–Ј –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –Њ—В–і–µ–ї—М–љ–Њ—Б—В–Є. –Ф–Њ–≤–Њ–ї—М–љ–Њ —З–∞—Б—В–Њ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л: –≥–Є–њ–µ—А–µ–Љ–Є—П –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л, —А–µ–Ј–Є –Є –Ј—Г–і –≤ –≥–ї–∞–Ј—Г [13, 28].
–Х—Й–µ –Њ–і–љ–Њ–є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –љ–Њ–≤–Њ–є —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–µ–є —П–≤–ї—П–µ—В—Б—П 0,03% –±–Є–Љ–∞—В–Њ–њ—А–Њ—Б—В –Є 0,5% —В–Є–Љ–Њ–ї–Њ–ї (–У–∞–љ—Д–Њ—А—В). –С–Є–Љ–∞—В–Њ–њ—А–Њ—Б—В – —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Б—В–∞–Љ–Є–і, –Ї–Њ—В–Њ—А—Л–є —Б–љ–Є–ґ–∞–µ—В –Т–У–Ф –Ј–∞ —Б—З–µ—В —Г–≤–µ–ї–Є—З–µ–љ–Є—П –≤–Њ–і–љ–Њ–≥–Њ –Њ—В—В–Њ–Ї–∞ —З–µ—А–µ–Ј —В—А–∞–±–µ–Ї—Г–ї—П—А–љ—Г—О —Б–µ—В—М –Є –њ–Њ–≤—Л—И–µ–љ–Є—П —Г–≤–µ–Њ—Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–≥–Њ –Њ—В—В–Њ–Ї–∞. –§–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–∞—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –±–Є–Љ–∞—В–Њ–њ—А–Њ—Б—В/—В–Є–Љ–Њ–ї–Њ–ї –±—Л—Б—В—А–Њ –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П –Є –Ї–Њ–љ—Ж–µ–љ—В—А–Є—А—Г–µ—В—Б—П –≤ —А–∞–і—Г–ґ–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ –Є —Ж–Є–ї–Є–∞—А–љ–Њ–Љ —В–µ–ї–µ, –Ї–Њ—В–Њ—А—Л–µ —П–≤–ї—П—О—В—Б—П —В–Њ—З–Ї–∞–Љ–Є –њ—А–Є–ї–Њ–ґ–µ–љ–Є—П –µ–µ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П [16].
–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї—М—И–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –±–Є–Љ–∞—В–Њ–њ—А–Њ—Б—В–∞ –Є —В–Є–Љ–Њ–ї–Њ–ї–∞, —З–µ–Љ –ї—О–±–Њ–≥–Њ –Є–Ј –µ–≥–Њ –∞–Ї—В–Є–≤–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –≤ –Њ—В–і–µ–ї—М–љ–Њ—Б—В–Є. –Т –Њ—В–љ–Њ—И–µ–љ–Є–Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ –љ–Є–Ї–∞–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є, –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Б–ї—Г—З–∞–µ–≤ –≥–Є–њ–µ—А–µ–Љ–Є–Є –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –±—Л–ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Љ–µ–љ—М—И–µ, —З–µ–Љ –њ—А–Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є [16].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (–љ–∞–њ—А–Є–Љ–µ—А, —Б–Њ—З–µ—В–∞–љ–Є–µ β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ —Б –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л, –∞–љ–∞–ї–Њ–≥–∞–Љ–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –Є–ї–Є α-–∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є) –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –і–ї—П —Г–і–Њ–±—Б—В–≤–∞ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П, –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–∞ –≤—Л–Љ—Л–≤–∞–љ–Є—П –Њ–і–љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ –і—А—Г–≥–Є–Љ, —Г–Љ–µ–љ—М—И–µ–љ–Є—П –љ–µ–≥–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–Њ–≤ –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є [11].
–Я–µ—А—Б–њ–µ–Ї—В–Є–≤—Л –Љ–µ—Б—В–љ–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –≤ —Б–Њ–Ј–і–∞–љ–Є–Є —И–Є—А–Њ–Ї–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ –Љ–µ—Б—В–љ–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л, –Њ—В–Ї–∞–Ј –Њ—В –ї–µ—З–µ–љ–Є—П —П–≤–ї—П–µ—В—Б—П —Б–µ—А—М–µ–Ј–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–Њ–є –≤ —Б–≤—П–Ј–Є —Б –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ –љ–Є–Ј–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є. –Ф—А—Г–≥–Є–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є –Њ—В–Ї–∞–Ј–∞ –Њ—В –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є —П–≤–ї—П—О—В—Б—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б—Г—В–Њ—З–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –Т–У–Ф, –Њ—В—Б—А–Њ—З–µ–љ–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є —Б–Є—Б—В–µ–Љ–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л [25].
–Э–µ—Б–Њ–±–ї—О–і–µ–љ–Є–µ —А–µ–ґ–Є–Љ–∞ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є –Є–Љ–Є—В–Є—А—Г–µ—В –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –Є, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Љ–љ–Њ–≥–Є–µ –њ–∞—Ж–Є–µ–љ—В—Л, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ–Њ–ґ–Є–ї–Њ–≥–Њ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –љ–µ –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є –њ—А–∞–≤–Є–ї—М–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≥–ї–∞–Ј–љ—Л–µ –Ї–∞–њ–ї–Є [23]. –≠—В–Њ –і–µ–ї–∞–µ—В –Њ–±—Г—З–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —А–µ—И–∞—О—Й–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —Г—Б–њ–µ—Е–∞ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л—Е –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Є—Б—В–µ–Љ –і–Њ—Б—В–∞–≤–Ї–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї «–њ—А–µ–њ–∞—А–∞—В-—А–Є–ї–Є–Ј–Є–љ–≥» –≤ –Ї–Њ–љ—В–∞–Ї—В–љ—Л—Е –ї–Є–љ–Ј–∞—Е –Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є –Є–Љ–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–љ–љ—Л–µ —Г—Б—В—А–Њ–є—Б—В–≤–∞ —Б –±–Є–Њ—А–∞–Ј–ї–∞–≥–∞–µ–Љ—Л–Љ–Є –Љ–Є–Ї—А–Њ- –Є –љ–∞–љ–Њ—З–∞—Б—В–Є—Ж–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –љ–∞—Е–Њ–і—П—В—Б—П –≤ —Д–∞–Ј–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є [20].
–Т —Б—В–∞–і–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —В–µ—Б—В–Є—А—Г—О—В —А—П–і –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ –љ–Њ–≤—Л—Е –∞–Ї—В–Є–≤–љ—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї, –њ–Њ–љ–Є–ґ–∞—О—Й–Є—Е –Т–У–Ф. –Я–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ –Ї–ї–∞—Б—Б–Њ–Љ –љ–Њ–≤—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —П–≤–ї—П—О—В—Б—П –Є–љ–≥–Є–±–Є—В–Њ—А—Л Rho-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–є –њ—А–Њ—В–µ–Є–љ–Ї–Є–љ–∞–Ј—Л: –Њ–љ–Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—О—В —Б —Ж–Є—В–Њ—Б–Ї–µ–ї–µ—В–Њ–Љ —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ—В–Ї–∞–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, —Б–Њ–Ї—А–∞—Й–∞—П —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ –Њ—В—В–Њ–Ї—Г –Т–У–Ц. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ–Є –Љ–µ—Б—В–љ—Л–Љ–Є –њ–Њ–±–Њ—З–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є, —В–∞–Ї–Є–Љ–Є –Ї–∞–Ї –≥–Є–њ–µ—А–µ–Љ–Є—П –Є —Б—Г–±–Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ—Л–µ –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є—П. –Ф–ї—П –њ—А–µ–Њ–і–Њ–ї–µ–љ–Є—П —Н—В–Є—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –њ–ї–∞–љ–Є—А—Г–µ—В—Б—П —А–∞–Ј—А–∞–±–Њ—В–Ї–∞ –њ—А–Њ–ї–µ–Ї–∞—А—Б—В–≤, —Б–њ–Њ—Б–Њ–±–љ—Л—Е –њ—А–Њ–љ–Є–Ї–∞—В—М —З–µ—А–µ–Ј —А–Њ–≥–Њ–≤–Є—Ж—Г –≤ –њ–µ—А–µ–і–љ—О—О –Ї–∞–Љ–µ—А—Г –≥–ї–∞–Ј–∞, –≥–і–µ –Њ–љ–Є –±—Г–і—Г—В –њ—А–µ–Њ–±—А–∞–Ј–Њ–≤–∞–љ—Л –≤ –∞–Ї—В–Є–≤–љ—Л–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П [12].
–Р–≥–Њ–љ–Є—Б—В—Л —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –∞–і–µ–љ–Њ–Ј–Є–љ–∞ (4 –Є—Е —А–∞–Ј–љ–Њ–≤–Є–і–љ–Њ—Б—В–Є) —В–∞–Ї–ґ–µ –Љ–Њ–≥—Г—В —Г–≤–µ–ї–Є—З–Є—В—М —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Њ—В—В–Њ–Ї–∞ –Т–У–Ц –Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ–±–љ–∞–і–µ–ґ–Є–≤–∞—О—Й–µ–є –њ–µ—А—Б–њ–µ–Ї—В–Є–≤—Л —Б–Њ–Ј–і–∞–љ–Є—П –љ–Њ–≤—Л—Е –∞–≥–µ–љ—В–Њ–≤, —Б–љ–Є–ґ–∞—О—Й–Є—Е –Т–У–Ф. –Р–≥–Њ–љ–Є—Б—В—Л —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –∞–і–µ–љ–Њ–Ј–Є–љ–∞ –Љ–Њ–≥—Г—В –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞—В—М –∞—В—А–Њ—Д–Є—О –Ї–ї–µ—В–Њ–Ї —В—А–∞–±–µ–Ї—Г–ї—П—А–љ–Њ–є —Б–µ—В–Є –Є —Б–µ–Ї—А–µ—Ж–Є—О –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–∞–Ј, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —З–µ–≥–Њ —А–µ–Љ–Њ–і–µ–ї–Є—А—Г–µ—В—Б—П –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л–є –Љ–∞—В—А–Є–Ї—Б, —Б–љ–Є–ґ–∞–µ—В—Б—П —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ –Њ—В—В–Њ–Ї—Г –Т–У–Ц [12].
–Ы–∞—В—А—Г–љ–Ї—Г–ї–Є–љ—Л —П–≤–ї—П—О—В—Б—П –і–Њ–±—Л–≤–∞–µ–Љ—Л–Љ–Є –Є–Ј –Љ–Њ—А—Б–Ї–Є—Е –≥—Г–±–Њ–Ї –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –Є–љ–≥–Є–±–Є—А—Г—О—В –њ–Њ–ї–Є–Љ–µ—А–Є–Ј–∞—Ж–Є—О –∞–Ї—В–Є–љ–∞. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л–µ –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –љ–∞ –Љ–∞–Ї–∞–Ї–∞—Е, –∞ —В–∞–Ї–ґ–µ –љ–∞ —В—А—Г–њ–љ—Л—Е –≥–ї–∞–Ј–∞—Е —З–µ–ї–Њ–≤–µ–Ї–∞, –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –ї–∞—В—А—Г–љ–Ї—Г–ї–Є–љ –Т —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —В—А–∞–±–µ–Ї—Г–ї—П—А–љ—Л–є –Њ—В—В–Њ–Ї –њ—Г—В–µ–Љ –і–µ—Б—В—А—Г–Ї—Ж–Є–Є –∞–Ї—В–Є–љ–Њ–≤–Њ–≥–Њ —Ж–Є—В–Њ—Б–Ї–µ–ї–µ—В–∞, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –Њ—В–≤–µ—А—Б—В–Є–є –Љ–µ–ґ–і—Г –Ї–ї–µ—В–Ї–∞–Љ–Є –≤–љ—Г—В—А–µ–љ–љ–µ–є —Б—В–µ–љ–Ї–Є —И–ї–µ–Љ–Љ–Њ–≤–∞ –Ї–∞–љ–∞–ї–∞, –∞ —В–∞–Ї–ґ–µ –Љ–µ–ґ–і—Г —И–ї–µ–Љ–Љ–Њ–≤—Л–Љ –Ї–∞–љ–∞–ї–Њ–Љ –Є –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤—Л–Љ–Є –њ—Г—З–Ї–∞–Љ–Є —В—А–∞–±–µ–Ї—Г–ї—Л. –£—З–∞—Б—В–Є–µ –ї–∞—В—А—Г–љ–Ї—Г–ї–Є–љ–Њ–≤ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є—П—Е –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В—Б—П –Є—Е –њ–ї–Њ—Е–Њ–є —А–∞—Б—В–≤–Њ—А–Є–Љ–Њ—Б—В—М—О –Є —В—А–∞–љ–Ј–Є—В–Њ—А–љ—Л–Љ–Є –њ–Њ–±–Њ—З–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є, —В–∞–Ї–Є–Љ–Є –Ї–∞–Ї —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —В–Њ–ї—Й–Є–љ—Л —А–Њ–≥–Њ–≤–Є—Ж—Л –Є –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є –µ–µ —Н–љ–і–Њ—В–µ–ї–Є—П [13, 30].
–Т–ї–Є—П–љ–Є–µ –Љ–µ—Б—В–љ—Л—Е –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ—Б—В–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л
–•–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ –Я–Ю–£–У –њ–Њ–Ї–∞–Ј–∞–љ–Њ —В–Њ–ї—М–Ї–Њ –њ–Њ—Б–ї–µ —В–Њ–≥–Њ, –Ї–∞–Ї –Є—Б—З–µ—А–њ–∞–љ—Л –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Я—А–Є —Н—В–Њ–Љ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Љ–µ—Б—В–љ–Њ–є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є –і–Њ –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є –Љ–Њ–ґ–µ—В –њ–Њ–≤—Л—Б–Є—В—М —А–Є—Б–Ї —Г—Б–Ї–Њ—А–µ–љ–љ–Њ–≥–Њ —А—Г–±—Ж–µ–≤–∞–љ–Є—П —Д–Є–ї—М—В—А–∞—Ж–Є–Њ–љ–љ–Њ–є –њ–Њ–і—Г—И–Ї–Є. –†–µ–Ј–µ–Ї—Ж–Є–Њ–љ–љ–∞—П —В—А–∞–≤–Љ–∞ –Є–љ–і—Г—Ж–Є—А—Г–µ—В —А–µ–≥–µ–љ–µ—А–∞—В–Њ—А–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є –≤ –Ј–Њ–љ–µ –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є, –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –Ї–Њ—В–Њ—А—Л—Е –Њ–њ—А–µ–і–µ–ї—П–µ—В —Д–µ–љ–Њ–Љ–µ–љ —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–µ–є—Б—П –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —Д–Є–±—А–Њ–њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є –Є –Њ–±–ї–Є—В–µ—А–∞—Ж–Є–µ–є —Б–Њ–Ј–і–∞–љ–љ—Л—Е –≤ —Е–Њ–і–µ —Б—В–∞–љ–і–∞—А—В–љ—Л—Е —Д–Є–ї—М—В—А—Г—О—Й–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є –њ—Г—В–µ–є –Њ—В—В–Њ–Ї–∞ –Т–У–Ц.
–Э–∞—А—П–і—Г —Б –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є –Ј–љ–∞—З–Є–Љ—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –Є–Ј–±—Л—В–Њ—З–љ–Њ–≥–Њ —А—Г–±—Ж–µ–≤–∞–љ–Є—П –њ–Њ—Б–ї–µ –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є –Њ—В–≤–Њ–і—П—В –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є –і—А–µ–љ–∞–ґ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –≥–ї–∞–Ј–∞ –Є —Б–Ї–ї–µ—А—Л [4, 7], –њ—А–Њ–≤–Њ—Ж–Є—А—Г–µ–Љ—Л–Љ –≤ —В–Њ–Љ —З–Є—Б–ї–µ —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–Љ –≤–ї–Є—П–љ–Є–µ–Љ —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е—Б—П –≤ –≥–ї–∞–Ј–љ—Л—Е –Ї–∞–њ–ї—П—Е –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–Њ–≤ –Є –і—А—Г–≥–Є—Е –≤—Б–њ–Њ–Љ–Њ–≥–∞—В–µ–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–µ–ї—М–Ј—П –Є—Б–Ї–ї—О—З–Є—В—М, —З—В–Њ –Љ–µ—Б—В–љ—Л–µ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, –і–ї–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–ґ–∞—О—Й–Є–µ –њ—А–Њ–і—Г–Ї—Ж–Є—О –Т–У–Ц, –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –њ—А–Њ–ї–Њ–љ–≥–Є—А—Г—О—В –њ–µ—А–Є–Њ–і –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Є –≥–ї–∞–Ј–∞, –≤–Љ–µ—И–Є–≤–∞—П—Б—М –≤ –Ї–ї–Є—А–µ–љ—Б –Т–У–Ц, –Є –Љ–Њ–≥—Г—В –њ—А–Њ–≤–Њ—Ж–Є—А–Њ–≤–∞—В—М –Ј–∞–Љ–µ–і–ї–µ–љ–Є–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –≥–ї—Г–±–Є–љ—Л –њ–µ—А–µ–і–љ–µ–є –Ї–∞–Љ–µ—А—Л –Є —А–∞–Ј–≤–Є—В–Є–µ –Њ—В—Б–ї–Њ–є–Ї–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –≥–ї–∞–Ј–∞.
–Ь–љ–Њ–≥–Є–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —Г—Б–Ї–Њ—А–µ–љ–љ–Њ–Љ—Г —А–∞–Ј–≤–Є—В–Є—О —Д–Є–±—А–Њ–Ј–∞ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—А–≥–∞–љ–∞—Е [6]. –Ю—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –≥–ї–∞—Г–Ї–Њ–Љ—Л –Љ–Њ–ґ–µ—В –≤—Л–Ј—Л–≤–∞—В—М –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –љ–µ —В–Њ–ї—М–Ї–Њ –≤ —Б–≤—П–Ј–Є —Б –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ–∞–Ї—Ж–Є—П–Љ–Є –Є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–Њ–≤, –љ–Њ –Є —Б —Д–Є–±—А–Њ–Ј–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є, –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л–Љ–Є –њ–∞—А–∞—Б–Є–Љ–њ–∞—В–Њ–Љ–Є–Љ–µ—В–Є–Ї–∞–Љ–Є, —Б–Є–Љ–њ–∞—В–Њ–Љ–Є–Љ–µ—В–Є–Ї–∞–Љ–Є –Є β-–±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є, —Е–Њ—В—П –љ–µ—В –µ–і–Є–љ–Њ–≥–Њ –Љ–љ–µ–љ–Є—П –Њ —Б—В–µ–њ–µ–љ–Є –Є —Е–∞—А–∞–Ї—В–µ—А–µ –љ–µ–≥–∞—В–Є–≤–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М —Н—Д—Д–µ–Ї—В–∞ –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є –Є –і–∞–ї—М–љ–µ–є—И–µ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ [14, 21].
–¶–µ–ї—М: –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–є –±–Є–Њ–Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є–Є (–£–С–Ь) –Њ—Ж–µ–љ–Є—В—М –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –Ј–Њ–љ–µ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є, –Є—Б–њ–Њ–ї—М–Ј—Г—О—Й–Є—Е –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л —А–∞–Ј–ї–Є—З–љ—Л—Е –≥—А—Г–њ–њ.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –љ–∞–±–ї—О–і–µ–љ–Є—П –Є –Љ–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Я—А–Њ–≤–µ–і–µ–љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–є –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Њ—В–і–∞–ї–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П 102 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (104 –≥–ї–∞–Ј–∞) – 73 –Љ—Г–ґ—З–Є–љ –Є 29 –ґ–µ–љ—Й–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 53 –і–Њ 82 –ї–µ—В (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В – 68,4±0,8 –≥–Њ–і–∞). –Ъ—А–Є—В–µ—А–Є–Є –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ: –њ–∞—Ж–Є–µ–љ—В—Л —Б —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–є –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є, –Ї–Њ—В–Њ—А—Л–Љ –≤—Л–њ–Њ–ї–љ–µ–љ—Л 2 –Є –±–Њ–ї–µ–µ –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ—Л–µ –Њ–њ–µ—А–∞—Ж–Є–Є –њ—А–Њ–љ–Є–Ї–∞—О—Й–µ–≥–Њ —В–Є–њ–∞; —Б—А–Њ–Ї –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї –Њ—В 2 –Љ–µ—Б. –і–Њ 3 –ї–µ—В. –°—А–µ–і–Є –Ї—А–Є—В–µ—А–Є–µ–≤ –Є—Б–Ї–ї—О—З–µ–љ–Є—П –±—Л–ї–Є: –і–Є—Б—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–∞—П —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є—П —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В–Є –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Њ–њ—Г—Е–Њ–ї–µ–≤—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
–Я–∞—Ж–Є–µ–љ—В—Л —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 3 –≥—А—Г–њ–њ—Л —А–µ–њ—А–µ–Ј–µ–љ—В–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Г—А–Њ–≤–љ—П –Т–У–Ф –≤ –Њ—В–і–∞–ї–µ–љ–љ—Л–µ —Б—А–Њ–Ї–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л: 1-—П –Є 2-—П –≥—А—Г–њ–њ—Л – –љ–∞ —Д–Њ–љ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –≤ –њ–Њ–Ј–і–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –≥—А—Г–њ–њ–∞–Љ–Є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, 3-—П –≥—А—Г–њ–њ–∞ – –±–µ–Ј –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Т 1-—О –≥—А—Г–њ–њ—Г –±—Л–ї –≤–Ї–ї—О—З–µ–љ 41 –њ–∞—Ж–Є–µ–љ—В (42 –≥–ї–∞–Ј–∞) —Б –Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Т–У–Ф (—Б—А–µ–і–љ–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Т–У–Ф – 21,6±0,34 –Љ–Љ —А—В. —Б—В.), –≤–Њ 2-—О – 41 –њ–∞—Ж–Є–µ–љ—В (42 –≥–ї–∞–Ј–∞) —Б –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Т–У–Ф (31,7±0,69 –Љ–Љ —А—В. —Б—В.). –Ъ–∞–ґ–і–∞—П –Є–Ј –і–≤—Г—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –≥—А—Г–њ–њ –±—Л–ї–∞ —А–∞–Ј–і–µ–ї–µ–љ–∞ –љ–∞ 4 –њ–Њ–і–≥—А—Г–њ–њ—Л –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤: –Р – β-–±–ї–Њ–Ї–∞—В–Њ—А—Л, –С – –∞–љ–∞–ї–Њ–≥–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ (–Р–Я), –Т – –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –Р–Я –Є β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤, –У – –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –Є –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л. –Т 3-—О (–Ї–Њ–љ—В—А–Њ–ї—М–љ—Г—О) –≥—А—Г–њ–њ—Г –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л 20 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (20 –≥–ї–∞–Ј) —Б–Њ —Б—В–Њ–є–Ї–Њ–є –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–µ–є –Т–У–Ф (17,2±0,53 –Љ–Љ —А—В. —Б—В.), —Б –Њ–і–љ–Њ–є –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–є –Њ–њ–µ—А–∞—Ж–Є–µ–є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, –љ–µ –љ—Г–ґ–і–∞—О—Й–Є–µ—Б—П –≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
–Т—Л–њ–Њ–ї–љ–µ–љ–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ: –≤–Є–Ј–Њ–Љ–µ—В—А–Є—П, —А–µ—Д—А–∞–Ї—В–Њ–Љ–µ—В—А–Є—П, –њ–µ—А–Є–Љ–µ—В—А–Є—П –њ–Њ –§–µ—А—Б—В–µ—А—Г, –±–Є–Њ–Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—П, –Љ–Є–Ї—А–Њ–≥–Њ–љ–Є–Њ—Б–Ї–Њ–њ–Є—П –ї–Є–љ–Ј–Њ–є –У–Њ–ї—М–і–Љ–∞–љ–∞, –њ—А—П–Љ–∞—П –Њ—Д—В–∞–ї—М–Љ–Њ—Б–Ї–Њ–њ–Є—П, –∞–њ–њ–ї–∞–љ–∞—Ж–Є–Њ–љ–љ–∞—П —В–Њ–љ–Њ–Љ–µ—В—А–Є—П —В–Њ–љ–Њ–Љ–µ—В—А–Њ–Љ –Ь–∞–Ї–ї–∞–Ї–Њ–≤–∞ (10 –≥) –Є –£–С–Ь —Б –Њ—Ж–µ–љ–Ї–Њ–є –≤—Л—Б–Њ—В—Л –Є–љ—В—А–∞—Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є [9], –≤—Л–њ–Њ–ї–љ–µ–љ–љ–∞—П –љ–∞ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–Љ –Є–Ј–Љ–µ—А–Є—В–µ–ї—М–љ–Њ–Љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ Accutome B–scan plus (–°–®–Р) —Б —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤—Л–Љ –±–Є–Њ–Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Њ–Љ (—З–∞—Б—В–Њ—В–∞ –і–∞—В—З–Є–Ї–∞ – 40 –Ь–У—Ж). –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї—Г—О –Њ–±—А–∞–±–Њ—В–Ї—Г –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ–≥—А–∞–Љ–Љ—Л SPSS 11,5 for Windows. –Я—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–Є –Є–Ј—Г—З–∞–µ–Љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –≤ —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л—Е –≥—А—Г–њ–њ–∞—Е –і–ї—П –Њ—Ж–µ–љ–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є —А–∞–Ј–ї–Є—З–Є–є –њ—А–Є–Љ–µ–љ—П–ї–Є –Ї—А–Є—В–µ—А–Є–є –°—В—М—О–і–µ–љ—В–∞.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
–Я–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–∞—П –£–С–Ь –і—А–µ–љ–∞–ґ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –≥–ї–∞–Ј–∞ –≤ –Ј–Њ–љ–µ –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–∞ —А–∞–Ј–ї–Є—З–љ—Г—О —Б—В–µ–њ–µ–љ—М –Є–Ј–Љ–µ–љ–µ–љ–Є–є –њ–∞—А–∞–Љ–µ—В—А–Њ–≤, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є—Е –њ—Г—В–Є –Њ—В—В–Њ–Ї–∞ –Т–У–Ц, –Ї–Њ—В–Њ—А–∞—П –∞–љ–∞–ї–Є–Ј–Є—А—Г–µ—В—Б—П –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤ –њ—А–µ–і–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –Є—Е —Б–Њ—З–µ—В–∞–љ–Є—П.
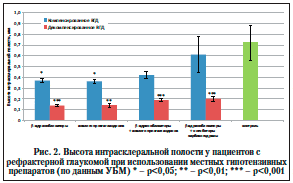
–Т—Л—Б–Њ—В–∞ –Є–љ—В—А–∞—Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤—Б–µ—Е –њ–Њ–і–≥—А—Г–њ–њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–µ–љ–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л (—А–Є—Б. 2), –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ 1-–є –≥—А—Г–њ–њ—Л, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Б–Њ—З–µ—В–∞–љ–љ—Г—О —В–µ—А–∞–њ–Є—О β-–±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л, —Е–Њ—В—П –Є –Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –љ–µ –і–Њ—Б—В–Є–≥–∞–ї –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Т–У–Ф, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О, –≤—Л—Б–Њ—В–∞ –Є–љ—В—А–∞—Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–∞ –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е –ї–µ—З–µ–±–љ—Л—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–µ–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ (2-—П –≥—А—Г–њ–њ–∞) –≤ —В–µ—Е –ґ–µ –њ–Њ–і–≥—А—Г–њ–њ–∞—Е —Б–Њ—Б—В–Њ—П–љ–Є–µ –Є–љ—В—А–∞—Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є —А–∞—Б—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П.
–Т—Л—Б–Њ—В–∞ –Є–љ—В—А–∞—Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –≤ –њ–Њ–і–≥—А—Г–њ–њ–∞—Е 1–Р –Є 1–С –±—Л–ї–∞ –љ–Є–ґ–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л –≤ 2 —А–∞–Ј–∞. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–∞–Є–±–Њ–ї–µ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–∞—П –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є—П –Т–У–Ф –±—Л–ї–∞ –Њ—В–Љ–µ—З–µ–љ–∞ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є – –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ —Б –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л, —В. –µ. –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –Ї–Њ—А—А–Є–≥–Є—А—Г—О—Й–µ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –њ–Њ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В—Л, –љ–∞–Ј–љ–∞—З–µ–љ–љ—Л–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є.
–Ш–Ј–Љ–µ–љ–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є, —А–∞–Ј–≤–Є–≤–∞—О—Й–Є–µ—Б—П –≤ –Ј–Њ–љ–µ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –≤–∞–ґ–љ–Њ—Б—В–Є –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –£–С–Ь. –Т —Ж–µ–ї–Њ–Љ –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ —А—Г–±—Ж–µ–≤–∞–љ–Є–µ–Љ –њ—Г—В–µ–є –Њ—В—В–Њ–Ї–∞ –Т–У–Ц –≤ –Њ—В–і–∞–ї–µ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –њ–Њ—Б–ї–µ –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–§–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ—Л–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–љ–∞–њ—А–Є–Љ–µ—А, —Б–Њ—З–µ—В–∞–љ–Є–µ β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ —Б –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л –ї–Є–±–Њ –∞–љ–∞–ї–Њ–≥–∞–Љ–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤) —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –±–Њ–ї—М—И–µ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –≤ —Б–≤—П–Ј–Є —Б —Г–і–Њ–±—Б—В–≤–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П, –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ —Н—Д—Д–µ–Ї—В–∞ –≤—Л–Љ—Л–≤–∞–љ–Є—П –Њ–і–љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ –і—А—Г–≥–Є–Љ, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –љ–µ–≥–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–Њ–≤ –Є –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ—Л–Љ —Г–ї—Г—З—И–µ–љ–Є–µ–Љ –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є, —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –±–Њ–ї–µ–µ –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –Т–У–Ф –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Г–ї—Г—З—И–µ–љ–Є—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є.
–Т –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –љ–∞–Љ–Є –£–С–Ь-–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤—Л—Б–Њ—В—Л –Є–љ—В—А–∞—Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –љ–∞–Є–±–Њ–ї–µ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –Њ—В–Љ–µ—З–µ–љ—Л –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є – –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ —Б –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Р–ї–µ–Ї—Б–µ–µ–≤ –Т.–Э. –Я—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–∞—П –≥–ї–∞—Г–Ї–Њ–Љ–∞ – –љ–µ–Є–Ј–±–µ–ґ–љ–Њ—Б—В—М –Є–ї–Є –љ–µ–і–Њ—А–∞–±–Њ—В–Ї–∞? // –У–ї–∞—Г–Ї–Њ–Љ–∞. 2012. вДЦ 3. –°. 26–32.
2. –Х–≥–Њ—А–Њ–≤ –Х.–Р. (—А–µ–і.) –У–ї–∞—Г–Ї–Њ–Љ–∞. –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–µ —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ. –Ь.: –У–≠–Ю–Ґ–Р–†-–Ь–µ–і–Є–∞, 2013. 824 —Б.
3. –Х—А–Є—З–µ–≤ –Т.–Я., –Ф—Г–≥–Є–љ–∞ –Р.–Х., –Ь–∞–Ј—Г—А–Њ–≤–∞ –Ѓ.–Т. –§–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ—Л–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Д–Њ—А–Љ—Л: —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є –њ–Њ–і—Е–Њ–і –Ї —В–µ—А–∞–њ–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л // –У–ї–∞—Г–Ї–Њ–Љ–∞. 2010. вДЦ 1. –°. 62–66.
4. –Ъ—Г–ї–µ—И–Њ–≤–∞ –Ю.–Э., –Э–µ–њ–Њ–Љ–љ—П—Й–Є—Е –У.–Ш., –Р–є–і–∞–≥—Г–ї–Њ–≤–∞ –°.–Т. –Р–љ–∞–ї–Є–Ј –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —О–Ї—Б—В–∞–Ї–∞–љ–∞–ї–Є–Ї—Г–ї—П—А–љ–Њ–є —В–Ї–∞–љ–Є –Є —Б–Ї–ї–µ—А—Л –њ–Њ –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ—Г –Љ–∞—В–µ—А–Є–∞–ї—Г –њ—А–Є –њ–µ—А–≤–Є—З–љ–Њ–є —О–≤–µ–љ–Є–ї—М–љ–Њ–є –Є –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–µ // –Ю—Д—В–∞–ї—М–Љ–Њ—Е–Є—А—Г—А–≥–Є—П. 2008. вДЦ 3. –°. 12–15.
5. –Ы–Є–±–Љ–∞–љ –Х.–°. –≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –≥–ї–∞—Г–Ї–Њ–Љ—Л // –У–ї–∞—Г–Ї–Њ–Љ–∞ (–њ—А–Є–ї–Њ–ґ–µ–љ–Є–µ). 2009. вДЦ 1. –°. 2–3.
6. –Э–µ–њ–Њ–Љ–љ—П—Й–Є—Е –У.–Ш., –Ф—О–±–∞–љ–Њ–≤–∞ –У.–Р., –Э–µ–њ–Њ–Љ–љ—П—Й–Є—Е –Ф.–Ы. –Є –і—А. –£–љ–Є–≤–µ—А—Б–∞–ї—М–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –Љ–∞—А–Ї–µ—А—Л –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ // –С—О–ї–ї–µ—В–µ–љ—М –°–Є–±–Є—А—Б–Ї–Њ–≥–Њ –Њ—В–і–µ–ї–µ–љ–Є—П –†–Р–Ь–Э. 2008. вДЦ 6. –°. 86–92.
7. –§–µ–љ—М–Ї–Њ–≤–∞ –Ю.–У., –§—Г—А—Б–Њ–≤–∞ –Р.–Ц., –У—Г—Б–∞—А–µ–≤–Є—З –Ю.–У. –Ъ–ї–Є–љ–Є–Ї–Њ-–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –Ї—А–Є—В–µ—А–Є–Є –Њ—Ж–µ–љ–Ї–Є —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л // –†–Ь–Ц. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—П. 2011. –Ґ. 12. вДЦ 2. –°. 56–58.
8. –•–Њ–і–ґ–∞–µ–≤ –Э.–°., –І–µ—А–љ—Л—Е –Т.–Т., –Ґ—А—Г–љ–Њ–≤ –Р.–Э. –Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –Є–Љ–Љ—Г–љ–Њ-–±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Г –±–Њ–ї—М–љ—Л—Е —Б –Я–Ю–£–У –љ–∞ —Д–Њ–љ–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –∞–љ–∞–ї–Њ–≥–Њ–Љ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞ F2a –У–ї–∞—Г–њ—А–Њ—Б—В–Њ–Љ // –†–Ь–Ц. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—П. 2013. –Ґ. 13. вДЦ 2. –Я—А–Є–ї–Њ–ґ–µ–љ–Є–µ. –°. 1–4.
9. –©—Г–Ї–Њ –Р.–У., –Ц—Г–Ї–Њ–≤–∞ –°.–Ш., –Ѓ—А—М–µ–≤–∞ –Ґ.–Э. –£–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –≤ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є. –Ь.: –Ю—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—П, 2013. 128 —Б.
10. Andrés-Guerrero V., Vicario-de-la-Torre M., Molina-Martínez I.T. et al. Comparison of the in vitro tolerance and in vivo efficacy of traditional timolol maleate eye drops versus new formulations with bioadhesive polymers // Invest. Ophthalmol. Vis. Sci. 2011. Vol. 52. Iss. 6. P. 3548–3556.
11. Bagnis A., Papadia M., Scotto R., Traverso C.E. Current and emerging medical therapies in the treatment of glaucoma // Expert. Opin. Emerg. Drugs. 2011. Vol. 16. Iss. 2. P. 293–307.
12. Bettin P., Di Matteo F. Glaucoma: present challenges and future trends // Ophthalmic Res. 2013. Vol. 50. Iss. 4. P. 197–208.
13. Chen J., Runyan S.A., Robinson M.R. Novel ocular antihypertensive compounds in clinical trials // Clin. Ophthalmol. 2011. Vol. 5. P. 667–677.
14. Dada T., Kusumesh R., Bali S.J. et al. Trabeculectomy with combined use of subconjunctival collagen implant and low-dose mitomycin C // J. Glaucoma. 2013. Vol. 22. Iss. 8. P. 659–662.
15. Dreer L.E., Girkin C., Mansberger S.L. Determinants of medication adherence to topical glaucoma therapy // J. Glaucoma. 2012. Vol. 21. Iss. 4. P. 234–240.
16. Gheith M.E., Mayer J.R., Siam G.A. et al. Managing refractory glaucoma with a fixed combination of bimatoprost (0.03%) and timolol (0.5%) // Clin. Ophthalmol. 2008. Vol. 2, Iss. 1. P. 15–20.
17. Hedman K., Alm A., Gross R.L. Pooled-data analysis of three randomized, double-masked, six-month studies comparing intraocular pressure-reducing effects of latanoprost and timolol in patients with ocular hypertension // J. Glaucoma. 2003. Vol. 12. P. 463–465.
18. Kerr N.M., Patel H.Y., Chew S.S. et al. Patient satisfaction with topical ocular hypotensives // Clin. Experiment. Ophthalmol. 2013. Vol. 41. Iss. 1. P. 27–35.
19. Kobayashi H. Efficacy of single glaucoma drug in combined timolol XE, latanoprost and brinzolamide therapy: a discontinuation study // J. Ocul. Pharmacol. Ther. 2012. Vol. 28. Iss. 3. P. 245–250.
20. Lavik E., Kuehn M.H., Kwon Y.H. Novel drug delivery systems for glaucoma // Eye (Lond). 2011. Vol. 25. P. 578–586.
21. Pharm A.J. Does medical treatment influence the success of trabeculectomy? // Trans. Am. Ophthalmol. Soc. 2004. Vol. 102. P. 219–224.
22. Pozarowska D. Safety and tolerability of tafluprost in treatment of elevated intraocular pressure in open-angle glaucoma and ocular hypertension // Clin. Ophthalmol. 2010. Vol. 4. P. 1229–1236.
23. Reardon G., Kotak S., Schwartz G.F. Objective assessment of compliance and persistence among patients treated for glaucoma and ocular hypertension: a systematic review // Patient. Prefer. Adherence. 2011. Vol. 5. P. 441–463.
24. Reardon G., Schwartz G.F., Kotak S. Persistence on prostaglandin ocular hypotensive therapy: an assessment using medication possession and days covered on therapy // BMC Ophthalmol. 2010. Vol. 10. P. 5.
25. Schwartz G.F., Hollander D.A., Williams J.M. Evaluation of eye drop administration technique in patients with glaucoma or ocular hypertension // Curr. Med. Res. Opin. 2013. Vol. 29. Iss. 11. P. 1515–522.
26. Schwartz G.F., Tan J., Kotak S. Hyperemia-associated costs of medication changes in glaucoma patients treated initially with prostaglandin analogs // J. Ocul. Pharmacol. Ther. 2009. Vol. 25. Iss. 6. P. 555–561.
27. Schwenn O., Heckmann B., Guzy C., Miller P.J. Long-term effect of latanoprost /timolol fixed combination in patients with glaucoma or ocular hypertension: a prospective, observational, noninterventional study // BMC Ophthalmol. 2010. Vol. 10. P. 21–23.
28. Shoji T., Sato H., Mizukawa A. et al. Hypotensive effect of latanoprost/timolol versus travoprost/timolol fixed combinations in NTG patients: a randomized, multicenter, crossover clinical trial // Invest. Ophthalmol. Vis. Sci. 2013. Vol. 54. Iss. 9. P. 6242–6247.
29. Tsai J.C., Kanner E.M. Current and emerging medical therapies for glaucoma // Expert. Opin. Emerg. Drugs. 2005. Vol. 10. P. 109–118.
30. Zhang K., Zhang L., Weinreb R.N. Ophthalmic drug discovery: novel targets and mechanisms for retinal diseases and glaucoma // Nat. Rev. Drug. Discov. 2012. Vol. 11. P. 541–559.












