–Ю–і–љ–Њ–є –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –њ—А–Є—З–Є–љ —Б–љ–Є–ґ–µ–љ–Є—П –Ј—А–µ–љ–Є—П —П–≤–ї—П–µ—В—Б—П –Ї–∞—В–∞—А–∞–Ї—В–∞ —З–∞—Б—В–Є—З–љ–Њ–µ –Є–ї–Є –њ–Њ–ї–љ–Њ–µ –њ–Њ–Љ—Г—В–љ–µ–љ–Є–µ –≤–µ—Й–µ—Б—В–≤–∞ –Є–ї–Є –Ї–∞–њ—Б—Г–ї—Л —Е—А—Г—Б—В–∞–ї–Є–Ї–∞.
–•—А—Г—Б—В–∞–ї–Є–Ї вАФ —Г–љ–Є–Ї–∞–ї—М–љ–∞—П —Б—В—А—Г–Ї—В—Г—А–∞, –≤—Е–Њ–і—П—Й–∞—П –≤ —Б–Њ—Б—В–∞–≤ –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є —Б–Є—Б—В–µ–Љ—Л –≥–ї–∞–Ј–∞, –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є —Д—Г–љ–Ї—Ж–Є—П–Љ–Є –Ї–Њ—В–Њ—А–Њ–є —П–≤–ї—П—О—В—Б—П —Б–≤–µ—В–Њ–њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Є —Д–Њ–Ї—Г—Б–Є—А–Њ–≤–Ї–∞ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –љ–∞ —Б–µ—В—З–∞—В–Ї–µ. –Ф–ї—П –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є—П —Н—В–Є—Е —Д—Г–љ–Ї—Ж–Є–є —Е—А—Г—Б—В–∞–ї–Є–Ї –і–Њ–ї–ґ–µ–љ –і–Њ–ї–≥–Њ–µ –≤—А–µ–Љ—П —Б–Њ—Е—А–∞–љ—П—В—М —Б–≤–Њ–µ –≥–ї–∞–≤–љ–Њ–µ —Б–≤–Њ–є—Б—В–≤–Њ вАФ –њ—А–Њ–Ј—А–∞—З–љ–Њ—Б—В—М. –Ю–љ–∞ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –±–ї–∞–≥–Њ–і–∞—А—П —В–Њ–Љ—Г, —З—В–Њ –≤ —Е—А—Г—Б—В–∞–ї–Є–Ї–µ –Њ—В—Б—Г—В—Б—В–≤—Г—О—В –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л–µ –Є –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–µ —Б–Њ—Б—Г–і—Л, –љ–µ—А–≤–љ—Л–µ —Б—В–≤–Њ–ї—Л, –∞ –њ–Є—В–∞–љ–Є–µ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –њ—Г—В–µ–Љ –і–Є—Д—Д—Г–Ј–Є–Є –Є –∞–Ї—В–Є–≤–љ–Њ–≥–Њ —В—А–∞–љ—Б–њ–Њ—А—В–∞ —З–µ—А–µ–Ј –Ї–∞–њ—Б—Г–ї—Г —А–∞—Б—В–≤–Њ—А–µ–љ–љ—Л—Е –≤–Њ –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –Є –Ї–Є—Б–ї–Њ—А–Њ–і–∞.
–Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, —Б–Њ –≤—Б–µ—Е —Б—В–Њ—А–Њ–љ —Е—А—Г—Б—В–∞–ї–Є–Ї –њ–Њ–Ї—А—Л—В —В–Њ–љ–Ї–Њ–є —Н–ї–∞—Б—В–Є—З–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є вАУ –Ї–∞–њ—Б—Г–ї–Њ–є. –І–∞—Б—В—М –Ї–∞–њ—Б—Г–ї—Л, –њ–Њ–Ї—А—Л–≤–∞—О—Й–µ–є –µ–≥–Њ –њ–µ—А–µ–і–љ—О—О –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М, –љ–∞–Ј—Л–≤–∞–µ—В—Б—П –њ–µ—А–µ–і–љ–µ–є –Ї–∞–њ—Б—Г–ї–Њ–є —Е—А—Г—Б—В–∞–ї–Є–Ї–∞, –∞ —Г—З–∞—Б—В–Њ–Ї, –њ–Њ–Ї—А—Л–≤–∞—О—Й–µ–є –Ј–∞–і–љ—О—О –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М, вАУ –Ј–∞–і–љ–µ–є –Ї–∞–њ—Б—Г–ї–Њ–є. –Ґ–Њ–ї—Й–Є–љ–∞ –њ–µ—А–µ–і–љ–µ–є –Ї–∞–њ—Б—Г–ї—Л —Б–Њ—Б—В–∞–≤–ї—П–µ—В 11вАУ18 –Љ–Ї–Љ, –Ј–∞–і–љ—П—П –њ–Њ—З—В–Є –≤ 2,5 —А–∞–Ј–∞ —В–Њ–љ—М—И–µ вАУ 4вАУ5 –Љ–Ї–Љ [2]. –Ъ–∞–њ—Б—Г–ї–∞ —Б–Њ—Б—В–Њ–Є—В –Є–Ј –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤, –ї–∞–Љ–Є–љ–Є–љ–∞ –Є –Љ—Г–Ї–Њ–њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і–∞ –≥–µ–њ–∞—А–∞–љ-—Б—Г–ї—М—Д–∞—В–∞, –Ї–Њ—В–Њ—А—Л–є –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є —Б—В—А—Г–Ї—В—Г—А—Л –Љ–∞—В—А–Є–Ї—Б–∞ –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є –њ—А–Њ–Ј—А–∞—З–љ–Њ—Б—В–Є –Ї–∞–њ—Б—Г–ї—Л. –Я—А–Є —Б–≤–µ—В–Њ–≤–Њ–є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є–Є –Њ–љ–∞ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –≥–Њ–Љ–Њ–≥–µ–љ–љ—Г—О –±–µ—Б—Б—В—А—Г–Ї—В—Г—А–љ—Г—О –Љ–µ–Љ–±—А–∞–љ—Г, –љ–∞ –≤–љ—Г—В—А–µ–љ–љ–µ–є –Ј–∞–і–љ–µ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ї–Њ—В–Њ—А–Њ–є —А–∞—Б–њ–Њ–ї–∞–≥–∞—О—В—Б—П —Г–≥–ї—Г–±–ї–µ–љ–Є—П, –Ї—Г–і–∞ –≤—Е–Њ–і—П—В –≤–Њ–ї–Њ–Ї–љ–∞ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ [3].
–Я–Њ–і –њ–µ—А–µ–і–љ–µ–є –Ї–∞–њ—Б—Г–ї–Њ–є —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ –Њ–і–љ–Њ—Б–ї–Њ–є–љ—Л–є —Н–њ–Є—В–µ–ї–Є–є, –Ї–Њ—В–Њ—А—Л–є –њ—А–Њ—Б—В–Є—А–∞–µ—В—Б—П –і–Њ –Њ–±–ї–∞—Б—В–Є —Н–Ї–≤–∞—В–Њ—А–∞. –Т —Н–њ–Є—В–µ–ї–Є–Є —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –≤—Л–і–µ–ї—П—О—В 3 –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Ї–ї–µ—В–Њ–Ї:
вАУ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–є —Б–ї–Њ–є –Ї–ї–µ—В–Њ–Ї, —Б–Њ–і–µ—А–ґ–∞—Й–Є–є –Њ—А–≥–∞–љ–µ–ї–ї—Л –Є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–Є–є –∞–Ї—В–Є–≤–љ—Л–є —В—А–∞–љ—Б–њ–Њ—А—В –Є–Њ–љ–Њ–≤, –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В, –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ —Б–Є–љ—В–µ–Ј–∞ –ї–Є–њ–Є–і–Њ–≤ –≤ —Е—А—Г—Б—В–∞–ї–Є–Ї, –∞ —В–∞–Ї–ґ–µ –Њ–±–ї–µ–≥—З–µ–љ–љ—Г—О –і–Є—Д—Д—Г–Ј–Є—О –≥–ї—О–Ї–Њ–Ј—Л;
вАУ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—Й–Є–µ—Б—П —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–µ –Ї–ї–µ—В–Ї–Є, –Ї–Њ—В–Њ—А—Л–µ, —Г–і–ї–Є–љ—П—П—Б—М, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В —А–Њ—Б—В —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –Є –њ—А–µ–≤—А–∞—Й–∞—О—В—Б—П –≤ —Е—А—Г—Б—В–∞–ї–Є–Ї–Њ–≤—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ –≤ –Ј–Њ–љ–µ —Н–Ї–≤–∞—В–Њ—А–∞;
вАУ –Ј—А–µ–ї—Л–µ —Е—А—Г—Б—В–∞–ї–Є–Ї–Њ–≤—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞, –≤ –Ї–Њ—В–Њ—А—Л—Е –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Ї–ї–µ—В–Њ—З–љ—Л—Е –Њ—А–≥–∞–љ–µ–ї–ї.
–Т–Њ–ї–Њ–Ї–љ–∞ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –Ї–Њ–љ—В–∞–Ї—В–Є—А—Г—О—В –і—А—Г–≥ —Б –і—А—Г–≥–Њ–Љ –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ —И–∞—А–Њ–≤–Є–і–љ–Њ-–≥–љ–µ–Ј–і–Њ–≤—Л—Е, —П–Ј—Л–Ї–Њ–≤–Є–і–љ—Л—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є –Є –і–µ—Б–Љ–Њ—Б–Њ–Љ [4].
–Ь–Њ–ї–Њ–і—Л–µ –ї–µ–љ—В–Њ–≤–Є–і–љ—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ –Њ—В—В–µ—Б–љ—П—О—В –±–Њ–ї–µ–µ —Б—В–∞—А—Л–µ –Ї —Ж–µ–љ—В—А—Г –Є –Њ–±—А–∞–Ј—Г—О—В –≤–Њ–Ї—А—Г–≥ –њ–ї–Њ—В–љ–Њ–≥–Њ —П–і—А–∞ —Н–ї–∞—Б—В–Є—З–љ—Г—О –Ї–Њ—А—Г —Е—А—Г—Б—В–∞–ї–Є–Ї–∞, –Ї–Њ—В–Њ—А–∞—П —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ–Њ–є –Ј–Њ–љ–Њ–є. –•—А—Г—Б—В–∞–ї–Є–Ї–Њ–≤—Л–Љ –≤–Њ–ї–Њ–Ї–љ–∞–Љ –≤ —Ж–µ–љ—В—А–µ —П–і—А–∞ —Б—В–Њ–ї—М–Ї–Њ –ґ–µ –ї–µ—В, —Б–Ї–Њ–ї—М–Ї–Њ –Є –≤—Б–µ–Љ—Г –Њ—А–≥–∞–љ–Є–Ј–Љ—Г.
–Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤ —Е–Њ–і–µ –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ–є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –≤ —Е—А—Г—Б—В–∞–ї–Є–Ї–Њ–≤—Л—Е –≤–Њ–ї–Њ–Ї–љ–∞—Е –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ–Њ—Б—В–µ–њ–µ–љ–љ—Л–є —А–∞—Б–њ–∞–і —П–і—А–∞, –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–є –Є –і—А—Г–≥–Є—Е –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л—Е –Њ—А–≥–∞–љ–µ–ї–ї, –≤ –Ј—А–µ–ї–Њ–Љ —Е—А—Г—Б—В–∞–ї–Є–Ї–µ —Б–Њ–і–µ—А–ґ–Є—В—Б—П –±–Њ–ї—М—И–Њ–є –Њ–±—К–µ–Љ —В–Ї–∞–љ–Є, –љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ–є –Ї —Б–Є–љ—В–µ–Ј—Г –±–µ–ї–Ї–∞ –Є –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є—О –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤. –Ю–і–љ–∞–Ї–Њ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –љ–µ–Ї–Њ—В–Њ—А–∞—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї —Б–Є–љ—В–µ–Ј—Г –Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ–≥–Њ –љ–∞–±–Њ—А–∞ –њ—А–Њ—В–µ–Є–љ–Њ–≤, –Є –Є–Љ–µ—О—В—Б—П –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –њ—А–Њ—В–Є–≤–Њ–і–µ–є—Б—В–≤–Є—П –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–Љ—Г —Б—В—А–µ—Б—Б—Г, —Б–њ–Њ—Б–Њ–±–љ–Њ–Љ—Г –љ–∞—А—Г—И–Є—В—М —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є—Е –±–µ–ї–Ї–Њ–≤. –Ш—Б—В–Њ—З–љ–Є–Ї–Њ–Љ —Н–љ–µ—А–≥–Є–Є –і–ї—П —Н—В–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —Б–ї—Г–ґ–Є—В –∞–љ–∞—Н—А–Њ–±–љ—Л–є –≥–ї–Є–Ї–Њ–ї–Є–Ј. –І—В–Њ–±—Л –і–Њ—Б—В–∞–≤–Є—В—М –≥–ї—О–Ї–Њ–Ј—Г –Њ—В –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –Ї –≤–љ—Г—В—А–µ–љ–љ–Є–Љ —Б–ї–Њ—П–Љ –њ—Г—В–µ–Љ –і–Є—Д—Д—Г–Ј–Є–Є (–µ–µ –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –і–Є—Д—Д—Г–Ј–Є–Є вАУ 10-6 —Б–Љ2/—Б), –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М –±—Л –Њ–Ї–Њ–ї–Њ 1вАУ2 —З –і–ї—П —Е—А—Г—Б—В–∞–ї–Є–Ї–Њ–≤ –ї—П–≥—Г—И–Ї–Є –Є –Љ—Л—И–Є –Є 4вАУ8 –і–љ–µ–є вАУ —Г —З–µ–ї–Њ–≤–µ–Ї–∞ [5]!
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б—В–∞–љ–Њ–≤–Є—В—Б—П –њ–Њ–љ—П—В–љ–Њ, —З—В–Њ —Е—А—Г—Б—В–∞–ї–Є–Ї–Њ–≤—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ –Є–Љ–µ—О—В –≤–µ—Б—М–Љ–∞ –Њ–≥—А–∞–љ–Є—З–µ–љ–љ—Л–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј–∞ –Є –њ—А–Њ—В–Є–≤–Њ–і–µ–є—Б—В–≤–Є—П –≤–љ–µ—И–љ–Є–Љ –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–Є–Љ —Д–∞–Ї—В–Њ—А–∞–Љ –Є –њ–Њ–ї–љ–Њ—Б—В—М—О –Ј–∞–≤–Є—Б—П—В –Њ—В —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П —Н–њ–Є—В–µ–ї–Є—П –њ–µ—А–µ–і–љ–µ–є –Ї–∞–њ—Б—Г–ї—Л –Є —Б–Њ—Б—В–∞–≤–∞ –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є.
–Т —Б–Њ—Б—В–∞–≤ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –≤—Е–Њ–і–Є—В –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –±–µ–ї–Ї–Њ–≤ (35вАУ40%) –Є –≤–Њ–і—Л, –њ—А–Є—З–µ–Љ –љ–∞ –і–Њ–ї—О –њ–Њ—Б–ї–µ–і–љ–µ–є –њ—А–Є—Е–Њ–і–Є—В—Б—П –ї–Є—И—М 60вАУ65% –Љ–∞—Б—Б—Л —Е—А—Г—Б—В–∞–ї–Є–Ї–∞. –Т—Л–і–µ–ї—П—О—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —В–Є–њ–Њ–≤ –±–µ–ї–Ї–Њ–≤: –≤–Њ–і–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л–µ ќ±-, ќ≤- –Є ќ≥-–Ї—А–Є—Б—В–∞–ї–ї–Є–љ—Л (80вАУ90% —Б—Г—Е–Њ–є –Љ–∞—Б—Б—Л) –Є –≤–Њ–і–Њ–љ–µ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л–µ –±–µ–ї–Ї–Є (10вАУ20%). –Ш–Љ–µ–љ–љ–Њ —А–∞—Б—В–≤–Њ—А–Є–Љ—Л–µ —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ –±–µ–ї–Ї–Є –Ї—А–Є—Б—В–∞–ї–ї–Є–љ—Л –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—О—В –≤—Л—Б–Њ–Ї–Є–є –Є–љ–і–µ–Ї—Б —А–µ—Д—А–∞–Ї—Ж–Є–Є, –Њ–±—А–∞–Ј—Г—П —Г–њ–Њ—А—П–і–Њ—З–µ–љ–љ—Л–є –≥–µ–ї—М —Б –љ–Є–Ј–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –≤–Њ–і—Л, –њ—А–Є —Н—В–Њ–Љ –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –њ—А–µ–ї–Њ–Љ–ї–µ–љ–Є—П —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ—Л –Ї–ї–µ—В–Њ–Ї —А–∞–≤–µ–љ –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В—Г –њ—А–µ–ї–Њ–Љ–ї–µ–љ–Є—П –Љ–µ–Љ–±—А–∞–љ [6].
–Ш—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –і–Њ 50% –Ї —Ж–µ–љ—В—А—Г —Е—А—Г—Б—В–∞–ї–Є–Ї–∞, –±–ї–∞–≥–Њ–і–∞—А—П —З–µ–Љ—Г –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є—П —Б—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –∞–±–µ—А—А–∞—Ж–Є–є [7]. –Р–ї—М—Д–∞-–Ї—А–Є—Б—В–∞–ї–ї–Є–љ—Л —Б–Њ—Б—В–Њ—П—В –Є–Ј –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В–Є 80вАУ100 –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В. J. Horwitz –≤–њ–µ—А–≤—Л–µ –Њ–њ–Є—Б–∞–ї ќ±-–Ї—А–Є—Б—В–∞–ї–ї–Є–љ—Л –Ї–∞–Ї —И–∞–њ–µ—А–Њ–љ—Л вАУ –Ї–ї–∞—Б—Б –±–µ–ї–Ї–Њ–≤, –≥–ї–∞–≤–љ–∞—П —Д—Г–љ–Ї—Ж–Є—П –Ї–Њ—В–Њ—А—Л—Е —Б–Њ—Б—В–Њ–Є—В –≤ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–Є –њ—А–∞–≤–Є–ї—М–љ–Њ–є –љ–∞—В–Є–≤–љ–Њ–є —В—А–µ—В–Є—З–љ–Њ–є –Є–ї–Є —З–µ—В–≤–µ—А—В–Є—З–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л –±–µ–ї–Ї–Њ–≤, –∞ —В–∞–Ї–ґ–µ –≤ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є –Є –і–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –±–µ–ї–Ї–Њ–≤—Л—Е –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤ [8]. –Ґ–∞–Ї, ќ±-–Ї—А–Є—Б—В–∞–ї–ї–Є–љ—Л –Љ–Њ–≥—Г—В –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—В—М –∞–≥—А–µ–≥–∞—Ж–Є—О —З–∞—Б—В–Є—З–љ–Њ –і–µ–љ–∞—В—Г—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –±–µ–ї–Ї–Њ–≤ –Є –≤–Њ–Ј–≤—А–∞—Й–∞—В—М –Є—Е –љ–∞—В–Є–≤–љ—Г—О —Б—В—А—Г–Ї—В—Г—А—Г. –Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞—Е –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ–Њ—П–≤–ї–µ–љ–Є–µ –Љ—Г—В–∞—Ж–Є–є –≤ –≥–µ–љ–∞—Е, –Ї–Њ–і–Є—А—Г—О—Й–Є—Е ќ±-–Ї—А–Є—Б—В–∞–ї–ї–Є–љ—Л, –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–≤–Є—В–Є—О –Ї–∞—В–∞—А–∞–Ї—В—Л [9].
–†–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –±–µ–ї–Ї–Њ–≤ –≤ —Е—А—Г—Б—В–∞–ї–Є–Ї–µ –љ–µ—А–∞–≤–љ–Њ–Љ–µ—А–љ–Њ. –Ю—В–Љ–µ—З–∞–µ—В—Б—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–µ –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ ќ±- –Є ќ≤-–Ї—А–Є—Б—В–∞–ї–ї–Є–љ–Њ–≤ –≤ –Ї–Њ—А–µ, –∞ –≤–Њ–і–Њ–љ–µ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л—Е –±–µ–ї–Ї–Њ–≤ вАУ –≤ —П–і—А–µ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞. –У–∞–Љ–Љ–∞-–Ї—А–Є—Б—В–∞–ї–ї–Є–љ —В–∞–Ї–ґ–µ –њ—А–µ–Њ–±–ї–∞–і–∞–µ—В –≤ —П–і—А–µ, –∞ –Є–Љ–µ–љ–љ–Њ –≤ —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –≤–Њ–ї–Њ–Ї–љ–∞—Е, –Ї–Њ—В–Њ—А—Л–µ —А–∞—Б–њ–Њ–ї–∞–≥–∞—О—В—Б—П –≤–і–Њ–ї—М –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –Њ—Б–Є —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ [10].
–° –≤–Њ–Ј—А–∞—Б—В–Њ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≤ —Е—А—Г—Б—В–∞–ї–Є–Ї–µ –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є —Д—А–∞–Ї—Ж–Є–Є ќ±-–Ї—А–Є—Б—В–∞–ї–ї–Є–љ–∞ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П. –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ ќ≥-–Ї—А–Є—Б—В–∞–ї–ї–Є–љ–∞ —В–∞–Ї–ґ–µ –Є–Љ–µ–µ—В —В–µ–љ–і–µ–љ—Ж–Є—О –Ї —Б–љ–Є–ґ–µ–љ–Є—О. –Ъ –≤–Њ–Ј—А–∞—Б—В–љ—Л–Љ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ –Њ—В–љ–Њ—Б–Є—В—Б—П –Є —В–∞–Ї–∞—П –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—П –±–µ–ї–Ї–Њ–≤, –Ї–∞–Ї –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –і–Є—Б—Г–ї—М—Д–Є–і–љ—Л—Е —Б–≤—П–Ј–µ–є –Љ–µ–ґ–і—Г –Љ–Њ–ї–µ–Ї—Г–ї–∞–Љ–Є –±–µ–ї–Ї–∞ –Є –≥–ї—Г—В–∞—В–Є–Њ–љ–Њ–Љ –Є–ї–Є —Ж–Є—Б—В–µ–Є–љ–Њ–Љ [11].
–Ф–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –њ—А–Њ–Ј—А–∞—З–љ–Њ—Б—В–Є –Є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В—А–Њ–µ–љ–Є—П —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –ї–Є—И—М –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –њ–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—О –њ–Є—В–∞—В–µ–ї—М–љ—Л–Љ–Є –≤–µ—Й–µ—Б—В–≤–∞–Љ–Є –≤–љ—Г—В—А–µ–љ–љ–Є—Е —Б–ї–Њ–µ–≤, –≤–∞–ґ–љ–Њ —В–∞–Ї–ґ–µ —А–µ–≥—Г–ї–Є—А–Њ–≤–∞—В—М –Њ–±—К–µ–Љ —Н—В–Є—Е –Ї–ї–µ—В–Њ–Ї. –Т–Њ–ї–Њ–Ї–љ–∞ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞–љ—Л —Б—В—А–Њ–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –Є –њ—А–Є–ї–µ–≥–∞—О—В –Њ—З–µ–љ—М –њ–ї–Њ—В–љ–Њ –і—А—Г–≥ –Ї –і—А—Г–≥—Г, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –і–ї—П —Г–Љ–µ–љ—М—И–µ–љ–Є—П —А–∞—Б—Б–µ–Є–≤–∞–љ–Є—П —Б–≤–µ—В–∞ –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ–Њ–µ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–Њ –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –Љ–µ–љ—М—И–µ –і–ї–Є–љ—Л —Б–≤–µ—В–Њ–≤–Њ–є –≤–Њ–ї–љ—Л. –Э–∞ –њ–Њ–њ–µ—А–µ—З–љ–Њ–Љ —Б—А–µ–Ј–µ —Е—А—Г—Б—В–∞–ї–Є–Ї–Њ–≤—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ –Є–Љ–µ—О—В –≤–Є–і –≤—Л—В—П–љ—Г—В–Њ–≥–Њ —И–µ—Б—В–Є—Г–≥–Њ–ї—М–љ–Є–Ї–∞ —А–∞–Ј–Љ–µ—А–Њ–Љ 3—Е9 ќЉ–Љ, –∞ –≤–µ–ї–Є—З–Є–љ–∞ –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 0,01 ќЉ–Љ [12]. –Я—А–Є —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Њ–±—К–µ–Љ–∞ –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ–Њ–µ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–Њ —А–∞—Б—И–Є—А—П–µ—В—Б—П, —З—В–Њ –≤–µ–і–µ—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –Њ–њ—В–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞.
–Ф–ї—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –њ—А–Њ–Ј—А–∞—З–љ–Њ—Б—В–Є –Њ—З–µ–љ—М –≤–∞–ґ–µ–љ –±–∞–ї–∞–љ—Б –ґ–Є–і–Ї–Њ—Б—В–Є. –С–ї–∞–≥–Њ–і–∞—А—П –љ–∞–ї–Є—З–Є—О –≤ –Ї–ї–µ—В–Ї–∞—Е —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –∞–Ї–≤–∞–њ–Њ—А–Є–љ–Њ–≤ (AQPs) –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –±—Л—Б—В—А—Л–є –њ–µ—А–µ–љ–Њ—Б –±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ґ–Є–і–Ї–Њ—Б—В–Є. –≠—В–Њ —Б–≤–Њ–є—Б—В–≤–Њ –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є–Є –∞–Ї–Ї–Њ–Љ–Њ–і–∞—Ж–Є–Є. –Р–Ї–≤–∞–њ–Њ—А–Є–љ—Л (AQP) вАУ —Б–µ–Љ–µ–є—Б—В–≤–Њ –≤—Б—В—А–Њ–µ–љ–љ—Л—Е –≤ –Љ–µ–Љ–±—А–∞–љ—Г —В—А–∞–љ—Б–њ–Њ—А—В–љ—Л—Е –±–µ–ї–Ї–Њ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤, —И–Є—А–Њ–Ї–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–µ –≤–Њ –Љ–љ–Њ–≥–Є—Е —В–Ї–∞–љ—П—Е –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞. –Ч–∞ –Њ—В–Ї—А—Л—В–Є–µ –њ–µ—А–≤–Њ–≥–Њ —З–ї–µ–љ–∞ —Н—В–Њ–≥–Њ —Б–µ–Љ–µ–є—Б—В–≤–∞, AQP1, –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М Peter Agre –≤ 2003 –≥. –њ–Њ–ї—Г—З–Є–ї –Э–Њ–±–µ–ї–µ–≤—Б–Ї—Г—О –њ—А–µ–Љ–Є—О –њ–Њ —Е–Є–Љ–Є–Є. –С–ї–∞–≥–Њ–і–∞—А—П —Н—В–Њ–Љ—Г –Њ—В–Ї—А—Л—В–Є—О —Б—В–∞–ї–Њ –њ–Њ–љ—П—В–љ–Њ, –Ї–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –Ї–ї–µ—В–Њ—З–љ–∞—П –Љ–µ–Љ–±—А–∞–љ–∞, –ї–Є—И—М –Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–∞—П –і–ї—П –Љ–Њ–ї–µ–Ї—Г–ї –≤–Њ–і—Л, –њ—А–Њ–њ—Г—Б–Ї–∞–µ—В –µ–µ –≤ —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ—Г —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, –њ–Њ—З–µ—З–љ—Л—Е –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –Ї–∞–љ–∞–ї—М—Ж–µ–≤ –Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –і—А—Г–≥–Є—Е —В–Ї–∞–љ–µ–є —Б —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є —Б–Ї–Њ—А–Њ—Б—В—М—О. –Р—А—Е–Є—В–µ–Ї—В—Г—А–∞ –Ї–∞–љ–∞–ї–∞ —В–∞–Ї–Њ–≤–∞ (—Г–Ј–Ї–∞—П —Й–µ–ї—М –≤ —Ж–µ–љ—В—А–µ –Є —А–∞—Б—И–Є—А–µ–љ–Є—П –љ–∞ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ—Л—Е –Ї–Њ–љ—Ж–∞—Е), —З—В–Њ –≤–Њ–і–∞ –Љ–Њ–ґ–µ—В –њ—А–Њ–љ–Є–Ї–∞—В—М —В–Њ–ї—М–Ї–Њ –≤ –≤–Є–і–µ —В–Њ–љ–Ї–Њ–є —Ж–µ–њ–Њ—З–Ї–Є –Љ–Њ–ї–µ–Ї—Г–ї, —Б–Њ–µ–і–Є–љ–µ–љ–љ—Л—Е –≤–Њ–і–Њ—А–Њ–і–љ—Л–Љ–Є —Б–≤—П–Ј—П–Љ–Є. –Я–Њ–і–Њ–±–љ—Л–µ –±–µ–ї–Ї–Є, —Б–њ–Њ—Б–Њ–±–љ—Л–µ –њ—А–Њ–≤–Њ–і–Є—В—М 3—Е109 –Љ–Њ–ї–µ–Ї—Г–ї –≤–Њ–і—Л –≤ —Б–µ–Ї—Г–љ–і—Г –≤ —А–∞—Б—З–µ—В–µ –љ–∞ –Ї–∞–ґ–і—Л–є –Љ–Њ–љ–Њ–Љ–µ—А, –µ—Б—В—М –≤–Њ –≤—Б–µ—Е –ґ–Є–≤—Л—Е –Ї–ї–µ—В–Ї–∞—Е. –£ —З–µ–ї–Њ–≤–µ–Ї–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ 13 –≤–Є–і–Њ–≤ –∞–Ї–≤–∞–њ–Њ—А–Є–љ–Њ–≤.
–≠–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–µ –Ї–ї–µ—В–Ї–Є —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –≤ –±–Њ–ї—М—И–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ —Б–Њ–і–µ—А–ґ–∞—В AQP1, –∞ –≤ –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –њ–Њ—П–≤–Є–ї–Є—Б—М —Б–Њ–Њ–±—Й–µ–љ–Є—П –Њ —В–Њ–Љ, —З—В–Њ –≤ –љ–Є—Е –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —В–∞–Ї–ґ–µ AQP5 –Є AQP7. –Т –њ—А–Њ—Ж–µ—Б—Б–µ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –Є –њ—А–µ–≤—А–∞—Й–µ–љ–Є—П –≤ —Е—А—Г—Б—В–∞–ї–Є–Ї–Њ–≤—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ —Н–Ї—Б–њ—А–µ—Б—Б–Є—П AQP1 —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П, –∞ –≤–Љ–µ—Б—В–Њ –љ–µ–≥–Њ –њ–Њ—П–≤–ї—П—О—В—Б—П AQP0, —В–∞–Ї–ґ–µ –Є–Ј–≤–µ—Б—В–љ—Л–є, –Ї–∞–Ї –Њ—Б–љ–Њ–≤–љ–Њ–є –≤–љ—Г—В—А–µ–љ–љ–Є–є –±–µ–ї–Њ–Ї (major intrinsic protein (MIP)), –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –±–Њ–ї–µ–µ 50% –≤—Б–µ—Е –Љ–µ–Љ–±—А–∞–љ–љ—Л—Е –±–µ–ї–Ї–Њ–≤ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞, –Є AQP5 (5% –Њ—В AQP0) [13, 14]. –Я—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В—М –і–ї—П –≤–Њ–і—Л MIP —Б–Њ—Б—В–∞–≤–ї—П–µ—В 45 ќЉ–Љ/—Б, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≤ –Ї–ї–µ—В–Ї–∞—Е —Н–њ–Є—В–µ–ї–Є—П –±–ї–∞–≥–Њ–і–∞—А—П AQP1 —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –і–Њ—Б—В–Є–≥–∞–µ—В 135 ќЉ–Љ/—Б, –љ–Њ —Б —Г—З–µ—В–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Н—В–Є—Е –±–µ–ї–Ї–Њ–≤ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Є—Е —Б—Г–Љ–Љ–∞—А–љ–∞—П –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В—М –Њ–і–Є–љ–∞–Ї–Њ–≤–∞ [15]. –Ф–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –љ–∞ –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В—М AQP0 (–љ–Њ –љ–µ AQP1) –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М –≤–ї–Є—П–љ–Є–µ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–∞, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —А–Э –Є —Г—А–Њ–≤–љ—П –°–∞2+ [16]. –Ґ–∞–Ї–ґ–µ AQP0 –≤—Л–њ–Њ–ї–љ—П–µ—В —Д—Г–љ–Ї—Ж–Є—О —Б—В—А—Г–Ї—В—Г—А–љ–Њ–≥–Њ –±–µ–ї–Ї–∞, –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—П —Б–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ–Є –±–µ–ї–Ї–∞–Љ–Є —Ж–Є—В–Њ—Б–Ї–µ–ї–µ—В–∞ –Ї–ї–µ—В–Њ–Ї —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ вАФ —Д–∞–Ї–Є–љ–Є–љ–Њ–Љ –Є —Д–Є–ї–µ–љ—Б–Є–љ–Њ–Љ [17]. –Я—А–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–Є –Љ—Г—В–∞—Ж–Є–є –≤ –≥–µ–љ–µ AQP0 –Њ–њ–Є—Б–∞–љ—Л —Б–ї—Г—З–∞–Є –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –Ї–∞—В–∞—А–∞–Ї—В—Л [18].
–°–Њ—Е—А–∞–љ–љ–Њ—Б—В—М –њ—А–Њ–Ј—А–∞—З–љ–Њ—Б—В–Є —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В—Б—П —Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ —Д–Є–Ј–Є–Ї–Њ-—Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ –µ–≥–Њ –±–µ–ї–Ї–Њ–≤ –Є –ї–Є–њ–Є–і–Њ–≤ –Љ–µ–Љ–±—А–∞–љ, —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –≤–Њ–і—Л –Є –Є–Њ–љ–Њ–≤, –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ–Љ –Є –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ –њ—А–Њ–і—Г–Ї—В–Њ–≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞.
–Т —Е—А—Г—Б—В–∞–ї–Є–Ї–µ —Б–Њ–і–µ—А–ґ–∞—В—Б—П —Г–≥–ї–µ–≤–Њ–і—Л –Є –Є—Е –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л–µ, –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї–Є –≥–ї—Г—В–∞—В–Є–Њ–љ–∞, —Ж–Є—Б—В–µ–Є–љ–∞, –∞—Б–Ї–Њ—А–±–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є –і—А. –°–Њ–і–µ—А–ґ–∞–љ–Є–µ –±–µ–ї–Ї–∞, –≤–Њ–і—Л –Є —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В —В–µ—Е –њ—А–Њ–њ–Њ—А—Ж–Є–є, –Ї–Њ—В–Њ—А—Л–µ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П –≤ –≤–Њ–і—П–љ–Є—Б—В–Њ–є –≤–ї–∞–≥–µ (–Т–Т), —Б—В–µ–Ї–ї–Њ–≤–Є–і–љ–Њ–Љ —В–µ–ї–µ –Є –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є. –Ґ–∞–Ї, –≤ –љ–µ–Љ –Є–Љ–µ—О—В—Б—П –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Є–Њ–љ–Њ–≤ –Ъ+ (–≤ 25 —А–∞–Ј –±–Њ–ї—М—И–µ, —З–µ–Љ –≤ –Т–Т) –Є –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Є–Њ–љ–Њ–≤ Na+.
–Ф–ї—П –Њ–±—К—П—Б–љ–µ–љ–Є—П –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Њ–±–Љ–µ–љ–∞ –≤ —Е—А—Г—Б—В–∞–ї–Є–Ї–µ –±—Л–ї–∞ –њ—А–µ–і–ї–Њ–ґ–µ–љ–∞ –Љ–Њ–і–µ–ї—М, –Њ—В—А–∞–ґ–∞—О—Й–∞—П –і–≤–Є–ґ–µ–љ–Є–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–≥–Њ –Є–Њ–љ–љ–Њ–≥–Њ –њ–Њ—В–Њ–Ї–∞ –≤–љ—Г—В—А–Є —Е—А—Г—Б—В–∞–ї–Є–Ї–∞. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Є–Њ–љ–љ—Л–є –њ–Њ—В–Њ–Ї –љ–∞—З–Є–љ–∞–µ—В –њ—А–Њ–љ–Є–Ї–∞—В—М –≤ –Њ–±–ї–∞—Б—В–Є –њ–µ—А–µ–і–љ–µ–≥–Њ –Є –Ј–∞–і–љ–µ–≥–Њ –њ–Њ–ї—О—Б–∞ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ —З–µ—А–µ–Ј —Й–µ–ї–Є –Љ–µ–ґ–і—Г –≤–Њ–ї–Њ–Ї–љ–∞–Љ–Є, –њ—А–Є–љ–Њ—Б—П –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Є–Њ–љ—Л Na+, –Ј–∞—В–µ–Љ –њ—А–Њ–љ–Є–Ї–∞–µ—В –≤–љ—Г—В—А—М –Ї–ї–µ—В–Њ–Ї –Є –њ–Њ —Й–µ–ї–µ–≤–Є–і–љ—Л–Љ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П–Љ –і–≤–Є–ґ–µ—В—Б—П –Є–Ј –Ї–ї–µ—В–Ї–Є –≤ –Ї–ї–µ—В–Ї—Г –≤ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є —Н–Ї–≤–∞—В–Њ—А–∞ (—А–Є—Б. 1). –Ґ–∞–Љ –≤ –Ї–ї–µ—В–Ї–∞—Е –≥–µ—А–Љ–Є–љ–∞—В–Є–≤–љ–Њ–є –Ј–Њ–љ—Л –Њ—В–Љ–µ—З–∞–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П Na+/K+-–Р–Ґ–§–∞–Ј—Л, –Є –Є–Њ–љ—Л Na+ –∞–Ї—В–Є–≤–љ–Њ –≤—Л–≤–Њ–і—П—В—Б—П –Є–Ј —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ [19].
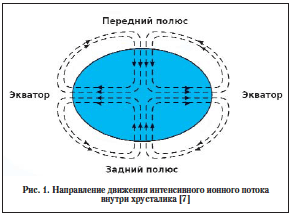
Gao et al. –њ–Њ–і—Б—З–Є—В–∞–ї–Є, —З—В–Њ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М Na+/K+-–њ–Њ–Љ–њ—Л –љ–∞ –µ–і–Є–љ–Є—Ж—Г –њ–ї–Њ—Й–∞–і–Є –≤ –Њ–±–ї–∞—Б—В–Є —Н–Ї–≤–∞—В–Њ—А–∞ –≤ 20 —А–∞–Ј –≤—Л—И–µ, —З–µ–Љ –≤ –Њ–±–ї–∞—Б—В–Є –њ–µ—А–µ–і–љ–µ–≥–Њ –њ–Њ–ї—О—Б–∞ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ [20]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В—Б—П –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Є–Њ–љ–Њ–≤ –Ъ+ –Є –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Є–Њ–љ–Њ–≤ Na+. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ—В–Љ–µ—З–∞–µ—В—Б—П –Є —А–∞–Ј–ї–Є—З–Є–µ –≤ —Б—В—А–Њ–µ–љ–Є–Є Na+/K+-–њ–Њ–Љ–њ—Л –≤ —Н—В–Є—Е –Ј–Њ–љ–∞—Е: ќ±1-–Є–Ј–Њ—Д–Њ—А–Љ–∞ –ї–Њ–Ї–∞–ї–Є–Ј—Г–µ—В—Б—П –≤ —Н–Ї–≤–∞—В–Њ—А–µ, –∞ ќ±2-–Є–Ј–Њ—Д–Њ—А–Љ–∞ вАУ –љ–∞ –њ–µ—А–µ–і–љ–µ–Љ –њ–Њ–ї—О—Б–µ [20]. –Я—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ–Њ, —З—В–Њ —Н—В–Є –Є–Ј–Њ—Д–Њ—А–Љ—Л –Є–Љ–µ—О—В —А–∞–Ј–љ—Г—О —А–µ–≥—Г–ї—П—Ж–Є—О: ќ±1 вАУ ќ≤-–∞–і—А–µ–љ—Н—А–≥–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –њ—А–Њ—В–µ–Є–љ–Ї–Є–љ–∞–Ј—Л A, ќ±2-–Є–Ј–Њ—Д–Њ—А–Љ–∞ вАУ ќ≤-–∞–і—А–µ–љ—Н—А–≥–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –њ—А–Њ—В–µ–Є–љ–Ї–Є–љ–∞–Ј—Л –° [21]. –Т–ї–Є—П–љ–Є–µ –љ–∞ –≤–љ—Г—В—А–Є—Е—А—Г—Б—В–∞–ї–Є–Ї–Њ–≤—Л–є –Є–Њ–љ–љ—Л–є –њ–Њ—В–Њ–Ї –Љ–Њ–ґ–µ—В –њ–Њ—Б–ї—Г–ґ–Є—В—М —В–Њ—З–Ї–Њ–є –њ—А–Є–ї–Њ–ґ–µ–љ–Є—П –≤ —Б–Њ–Ј–і–∞–љ–Є–Є –љ–Њ–≤—Л—Е —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤ –±–Њ—А—М–±—Л —Б –Ї–∞—В–∞—А–∞–Ї—В–Њ–є.
–Я—А–Є –Ї–∞—В–∞—А–∞–Ї—В–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Н—В–Є—Е –Є–Њ–љ–Њ–≤ –љ–∞—А—П–і—Г —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є Na+/K+-–Р–Ґ–§–∞–Ј—Л. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Њ–і–љ–Њ–є –Є–Ј –њ—А–Є—З–Є–љ —Н—В–Њ–≥–Њ –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Э2–Ю2. –Т –љ–Њ—А–Љ–µ —Г—А–Њ–≤–µ–љ—М –Э2–Ю2 –≤ —В–Ї–∞–љ—П—Е —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –Є –Т–Т —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 20вАУ30 ¬µ–Ь, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Г 1/3 –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–Љ–µ—О—Й–µ–є—Б—П –Ї–∞—В–∞—А–∞–Ї—В–Њ–є вАУ –њ–Њ–≤—Л—И–µ–љ –≤ 2вАУ7 —А–∞–Ј –≤ —Е—А—Г—Б—В–∞–ї–Є–Ї–µ –Є 30-–Ї—А–∞—В–љ–Њ вАФ –≤ –Т–Т [22]. –Я—А–Њ–≤–µ–і–µ–љ–љ—Л–µ in vitro –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є —Г—Б—В–∞–љ–Њ–≤–Є—В—М, —З—В–Њ –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –∞–љ—В–Є–њ–µ—А–Њ–Ї—Б–Є–і–∞–Ј–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –љ–∞—А—Г—И–∞–µ—В—Б—П –і–µ—П—В–µ–ї—М–љ–Њ—Б—В—М Na+/K+-–Р–Ґ–§–∞–Ј—Л, –Є–љ–≥–Є–±–Є—А—Г–µ—В—Б—П –≥–Є–і—А–Њ–ї–Є–Ј –Р–Ґ–§ –Є –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≥–Є–±–µ–ї—М –Ї–ї–µ—В–Њ–Ї —Н–њ–Є—В–µ–ї–Є—П [23].
–Т–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –њ–Њ–Љ—Г—В–љ–µ–љ–Є–є –≤ —Е—А—Г—Б—В–∞–ї–Є–Ї–µ –Є–Љ–µ—О—В –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤–Њ–і–љ–Њ-—Б–Њ–ї–µ–≤–Њ–≥–Њ –Є —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞. –Я—А–Є –Ї–∞—В–∞—А–∞–Ї—В–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–љ–Њ–≥–Њ, –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞, –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Б–Ї–Њ–њ–ї–µ–љ–Є–µ –≤ –µ–≥–Њ —В–Ї–∞–љ—П—Е –љ–∞—В—А–Є—П, –Ї–∞–ї—М—Ж–Є—П, —Ж–Є–љ–Ї–∞ –Є –≤–Њ–і—Л, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Ї–∞–ї–Є—П, –∞–ї—О–Љ–Є–љ–Є—П, —А–∞—Б—В–≤–Њ—А–Є–Љ—Л—Е –±–µ–ї–Ї–Њ–≤, —Б–µ—А–Њ—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В, –∞—Б–Ї–Њ—А–±–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, —А–Є–±–Њ—Д–ї–∞–≤–Є–љ–∞, —Ж–Є—В–Њ—Е—А–Њ–Љ–∞. –°–љ–Є–ґ–∞–µ—В—Б—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Р–Ґ–§-–∞–Ј—Л, –њ–Є—А—Г–≤–∞—В—Д–Њ—Б—Д–Њ–Ї–Є–љ–∞–Ј—Л, –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л –Є —В. –і.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ–і–љ–Њ–є –Є–Ј –і–Њ–Љ–Є–љ–Є—А—Г—О—Й–Є—Е —В–µ–Њ—А–Є–є –Ї–∞—В–∞—А–∞–Ї—В–Њ–≥–µ–љ–µ–Ј–∞ —П–≤–ї—П–µ—В—Б—П —В–µ–Њ—А–Є—П –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞. –Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Е—А—Г—Б—В–∞–ї–Є–Ї–Њ–≤ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ї–∞—В–∞—А–∞–Ї—В–Њ–є, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є, –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П –Њ–Ї–Є—Б–ї–µ–љ–Є–µ –±–µ–ї–Ї–Њ–≤ –љ–µ —В–Њ–ї—М–Ї–Њ –Љ–µ–Љ–±—А–∞–љ, –љ–Њ –Є —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ—Л, –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –Є—Е –Ї–Њ–љ—Д–Є–≥—Г—А–∞—Ж–Є–Є —Б –Њ–±–љ–∞–ґ–µ–љ–Є–µ–Љ —В–Є–Њ–ї—М–љ—Л—Е –≥—А—Г–њ–њ, –Ї–Њ—В–Њ—А—Л–µ –≤ –љ–Њ—А–Љ–µ –љ–∞—Е–Њ–і—П—В—Б—П –≤–љ—Г—В—А–Є –±–µ–ї–Ї–Њ–≤–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л, –Њ–Ї–Є—Б–ї–µ–љ–Є–µ –Љ–µ—В–Є–Њ–љ–Є–љ–∞, —Ж–Є—Б—В–µ–Є–љ–∞, –∞ —В–∞–Ї–ґ–µ –Њ–Ї–Є—Б–ї–µ–љ–Є–µ –ї–Є–њ–Є–і–Њ–≤ –Љ–µ–Љ–±—А–∞–љ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –і–ї—П –Ї–∞—В–∞—А–∞–Ї—В—Л —Е–∞—А–∞–Ї—В–µ—А–љ–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –≤—Л—Б–Њ–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –±–µ–ї–Ї–Њ–≤—Л—Е –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤, –Ї–Њ–≤–∞–ї–µ–љ—В–љ–Њ —Б–≤—П–Ј–∞–љ–љ—Л—Е –і–Є—Б—Г–ї—М—Д–Є–і–љ—Л–Љ–Є —Б–≤—П–Ј—П–Љ–Є [24]. –Ґ–∞–Ї–Є–µ –±–µ–ї–Ї–Њ–≤—Л–µ –∞–≥—А–µ–≥–∞—Ж–Є–Є –њ—А–Є–≤–Њ–і—П—В –Ї —В–Њ–Љ—Г, —З—В–Њ —Б–≤–µ—В –≤ —Н—В–Є—Е —Г—З–∞—Б—В–Ї–∞—Е —А–∞—Б—Б–µ–Є–≤–∞–µ—В—Б—П, –Є –њ—А–Њ–Ј—А–∞—З–љ–Њ—Б—В—М —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ —Б–љ–Є–ґ–∞–µ—В—Б—П.
–Ч–љ–∞—З–Є—В–µ–ї—М–љ—Л–є –Є–љ—В–µ—А–µ—Б –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Е–Є–љ–Њ–Є–і–љ–∞—П —В–µ–Њ—А–Є—П, –Ї–Њ—В–Њ—А–∞—П –њ—А–Є–і–∞–µ—В –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Ї–∞—В–∞—А–∞–Ї—В—Л –≤–µ—Й–µ—Б—В–≤–∞–Љ —Е–Є–љ–Њ–Є–і–љ–Њ–є –≥—А—Г–њ–њ—Л, –Њ–±—А–∞–Ј—Г—О—Й–Є–Љ—Б—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –љ–∞—А—Г—И–µ–љ–Є—П –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –∞—А–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В (—В—А–Є–њ—В–Њ—Д–∞–љ–∞, —В–Є—А–Њ–Ј–Є–љ–∞ –Є –і—А.). –°–Њ–≥–ї–∞—Б–љ–Њ —Н—В–Њ–є —В–µ–Њ—А–Є–Є, –њ–Њ–Љ—Г—В–љ–µ–љ–Є–µ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В, –Ї–Њ–≥–і–∞ –µ–≥–Њ –≤–Њ–і–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л–µ –±–µ–ї–Ї–Є –љ–∞—З–Є–љ–∞—О—В –і–µ–љ–∞—В—Г—А–Є—А–Њ–≤–∞—В—М—Б—П –Є –њ—А–µ–≤—А–∞—Й–∞—В—М—Б—П –≤ –љ–µ–њ—А–Њ–Ј—А–∞—З–љ—Л–µ —Б—Г–±—Б—В–∞–љ—Ж–Є–Є –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ —Е–Є–љ–Њ–Є–і–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –≤–µ—Й–µ—Б—В–≤–Њ –њ–Є—А–µ–љ–Њ–Ї—Б–Є–љ –Ї–Њ–љ–Ї—Г—А–µ–љ—В–љ–Њ –Є–љ–≥–Є–±–Є—А—Г–µ—В –і–µ–є—Б—В–≤–Є–µ —Е–Є–љ–Њ–Є–і–љ—Л—Е –≤–µ—Й–µ—Б—В–≤, –∞ —В–∞–Ї–ґ–µ –љ–Њ—А–Љ–∞–ї–Є–Ј—Г–µ—В –Њ–±–Љ–µ–љ –≥–ї—О–Ї–Њ–Ј—Л –≤ —Е—А—Г—Б—В–∞–ї–Є–Ї–µ –Є –њ—А–µ–њ—П—В—Б—В–≤—Г–µ—В –Њ—В–ї–Њ–ґ–µ–љ–Є—О —Б–Њ—А–±–Є—В–∞, —Б—В–∞–±–Є–ї–Є–Ј–Є—А—Г–µ—В –Ї–ї–µ—В–Њ—З–љ—Л–µ –Љ–µ–Љ–±—А–∞–љ—Л, –Є–љ–≥–Є–±–Є—А—Г–µ—В –њ–µ—А–µ–Ї–Є—Б–љ–Њ–µ –Њ–Ї–Є—Б–ї–µ–љ–Є–µ –ї–Є–њ–Є–і–Њ–≤ [25].
–У–ї–∞–Ј–љ—Л–µ –Ї–∞–њ–ї–Є –Ъ–∞—В–∞–ї–Є–љ, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –њ–Є—А–µ–љ–Њ–Ї—Б–Є–љ, –±—Л–ї–Є –≤–њ–µ—А–≤—Л–µ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ—Л –≤ –ѓ–њ–Њ–љ–Є–Є –≤ 1958 –≥. —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Є–Љ –Ї–Њ–љ—Ж–µ—А–љ–Њ–Љ Senju Pharmaceutical –Є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –±–Њ–ї–µ–µ —З–µ–Љ –≤ 20 —Б—В—А–∞–љ–∞—Е –Љ–Є—А–∞.
–≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –Ъ–∞—В–∞–ї–Є–љ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –Ї–∞–Ї –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Є—Б–њ—Л—В–∞–љ–Є—П—Е, —В–∞–Ї –Є –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е.
J. Kociecki et al. –њ—А–Њ–≤–µ–ї–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –њ—А–Є–љ—П–ї–Є —Г—З–∞—Б—В–Є–µ 72 –њ–∞—Ж–Є–µ–љ—В–∞ —Б—В–∞—А—И–µ 40 –ї–µ—В —Б –љ–∞—З–∞–ї—М–љ–Њ–є —Б—В–∞–і–Є–µ–є –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –Ї–∞—В–∞—А–∞–Ї—В—Л –Є –Њ—Б—В—А–Њ—В–Њ–є –Ј—А–µ–љ–Є—П –љ–µ –Љ–µ–љ—М—И–µ 0,5. 35 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–ї—Г—З–∞–ї–Є –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є –Ъ–∞—В–∞–ї–Є–љ–∞, 37 вАУ –њ–ї–∞—Ж–µ–±–Њ. –Ю—Ж–µ–љ–Ї–∞ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —З–µ—А–µ–Ј 3, 6, 12, 18 –Є 24 –Љ–µ—Б. –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–∞ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –і–µ–љ—Б–Є—В–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ—А–µ–љ–Є–є –њ—А–Њ–Ј—А–∞—З–љ–Њ—Б—В–Є —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –љ–∞ –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–µ –њ–µ—А–µ–і–љ–µ–≥–Њ –Њ—В—А–µ–Ј–Ї–∞ –≥–ї–∞–Ј–∞ EAS-1000 (NIDEK, –ѓ–њ–Њ–љ–Є—П). –Р–≤—В–Њ—А—Л –њ—А–Є—И–ї–Є –Ї –Ј–∞–Ї–ї—О—З–µ–љ–Є—О, —З—В–Њ –Ъ–∞—В–∞–ї–Є–љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В —А–∞–Ј–≤–Є—В–Є–µ –њ–Њ–Љ—Г—В–љ–µ–љ–Є–є –≤ —Е—А—Г—Б—В–∞–ї–Є–Ї–µ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –≥—А—Г–њ–њ–Њ–є –њ–ї–∞—Ж–µ–±–Њ, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ–Њ–ї–Њ–ґ–µ 60 –ї–µ—В, –Є –і–µ–є—Б—В–≤–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ —Г—Б–Є–ї–Є–≤–∞–µ—В—Б—П –њ—А–Є –љ–µ–њ—А–µ—А—Л–≤–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –≤ —В–µ—З–µ–љ–Є–µ 18 –Љ–µ—Б. [26].
–У.–°. –Я–Њ–ї—Г–љ–Є–љ –Є —Б–Њ–∞–≤—В. –≤ —Б–≤–Њ–µ–є —А–∞–±–Њ—В–µ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ъ–∞—В–∞–ї–Є–љ–∞ —Г 50 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –Ї–∞—В–∞—А–∞–Ї—В–Њ–є –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –Њ–±—Й–µ–њ—А–Є–љ—П—В—Л—Е –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є –і–µ–љ—Б–Є—В–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Њ–Ј—А–∞—З–љ–Њ—Б—В–Є —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –Њ—В–Љ–µ—З–∞–ї–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л. –Ю–њ—А–µ–і–µ–ї—П–ї–Њ—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –і–µ–љ—Б–Є—В–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –≤ –њ–µ—А–µ–і–љ–Є—Е –Є –Ј–∞–і–љ–Є—Е –Ї–Њ—А—В–Є–Ї–∞–ї—М–љ—Л—Е —Б–ї–Њ—П—Е, –≤ –Ј–∞–і–љ–µ–є –Ї–∞–њ—Б—Г–ї–µ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–≤—И–µ–є –Ґ–∞—Г—А–Є–љ, –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Є–Ј–Љ–µ–љ—П–ї–Є—Б—М, —З—В–Њ —В–∞–Ї–ґ–µ –±—Л–ї–Њ —А–∞—Б—Ж–µ–љ–µ–љ–Њ –Ї–∞–Ї –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В [27].
–Ш–Љ–µ—О—В—Б—П —Б–Њ–Њ–±—Й–µ–љ–Є—П –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –љ–∞–±–ї—О–і–µ–љ–Є–Є –Ј–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–Љ–µ–љ—П–ї–Є –Ъ–∞—В–∞–ї–Є–љ –Є –љ–µ–Ї–Њ—В–Њ—А—Л–µ –і—А—Г–≥–Є–µ –∞–љ—В–Є–Ї–∞—В–∞—А–∞–Ї—В–∞–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, —Г–Љ–µ–љ—М—И–∞–ї–Є—Б—М –љ–µ —В–Њ–ї—М–Ї–Њ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –њ–Њ–Љ—Г—В–љ–µ–љ–Є–є, –љ–Њ –Є –Є—Е –њ–ї–Њ—Й–∞–і—М [26].
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –Ъ–∞—В–∞–ї–Є–љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –∞–љ—В–Є–Ї–∞—В–∞—А–∞–Ї—В–∞–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ –≤—Б–µ —Б–ї–Њ–Є —Е—А—Г—Б—В–∞–ї–Є–Ї–∞, –љ–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ вАУ –љ–∞ –µ–≥–Њ –Ї–Њ—А—В–Є–Ї–∞–ї—М–љ—Л–µ —Б–ї–Њ–Є –Є –Ј–∞–і–љ—О—О –Ї–∞–њ—Б—Г–ї—Г. –Т–∞–ґ–љ–Њ, —З—В–Њ —В–∞–Ї–ґ–µ –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ —Е–Њ—А–Њ—И–∞—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М —Н—В–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є –≤—Б–µ—Е –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –≥—А—Г–њ–њ, –њ–Њ–±–Њ—З–љ—Л–µ —П–≤–ї–µ–љ–Є—П –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Њ. –Т—Л—Б–Њ–Ї–∞—П —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ–Њ–Ј–≤–Њ–ї—П—О—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –≥–ї–∞–Ј–љ—Л–µ –Ї–∞–њ–ї–Є –Ъ–∞—В–∞–ї–Є–љ –і–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –Ї–∞—В–∞—А–∞–Ї—В—Л, –Њ—Б–Њ–±–µ–љ–љ–Њ –љ–∞ –љ–∞—З–∞–ї—М–љ—Л—Е —Б—В–∞–і–Є—П—Е.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–µ –Њ—Б—В–∞–µ—В—Б—П —Б–Њ–Љ–љ–µ–љ–Є–є –≤ —В–Њ–Љ, —З—В–Њ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ —П–≤–ї—П–µ—В—Б—П –Ї–ї—О—З–µ–≤—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —Б–Њ—Е—А–∞–љ–µ–љ–Є—П –µ–≥–Њ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ —Б–≤–Њ–є—Б—В–≤–∞ вАУ –њ—А–Њ–Ј—А–∞—З–љ–Њ—Б—В–Є. –Я–Њ—Н—В–Њ–Љ—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Ї–∞—В–∞—А–∞–Ї—В—Л –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–Њ–≤–Њ–і—П—В—Б—П –љ–∞ —Б—В—Л–Ї–µ –Љ–µ–і–Є—Ж–Є–љ—Л, –±–Є–Њ—Е–Є–Љ–Є–Є, –±–Є–Њ—Д–Є–Ј–Є–Ї–Є –Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –±–Є–Њ–ї–Њ–≥–Є–Є. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –љ–∞—З–∞–ї–∞ —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –µ—Й–µ –і–∞–ї–µ–Ї–Њ –љ–µ –њ–Њ–ї–љ–Њ—Б—В—М—О —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л, –Є –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ –≤–µ–і—Г—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Є—З–Є–љ –Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П –Ї–∞—В–∞—А–∞–Ї—В—Л. –Т–µ–і—М –Ј–љ–∞–љ–Є–µ —Н—В–∞–њ–Њ–≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –Ї–∞—В–∞—А–∞–Ї—В—Л –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –і–ї—П —А–∞–Ј—А–∞–±–Њ—В–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є.












