
Введение
Первичная открытоугольная глаукома (ПОУГ) — наиболее распространенная причина развития слепоты во всем мире [1, 2]. Полиэтиологичность ПОУГ обеспечивает высокую вероятность развития «рефрактерной» формы заболевания с тяжелым течением и устойчивостью к традиционным методам и подходам к лечению [3, 4].
В литературе проблема формирования рефрактерности ПОУГ освещена недостаточно подробно, в основном рассматриваются офтальмологические причины [5]. В зарубежных публикациях обсуждается лишь сама проблематика и, частично, локальные факторы риска, а в большинстве случаев дискуссия касается вторичных форм заболевания [6–9]. Вместе с тем число таких пациентов неуклонно увеличивается. На наш взгляд, это обусловлено несвоевременной диагностикой, неэффективно выстроенной системой динамического наблюдения и не всегда достаточно компетентным решением о назначении адекватного лечения, зачастую отр ицающим значение персонализированного и системного подхода [10]. Факторы, приводящие к формированию рефрактерности, многообразны и включают в себя генетическую предрасположенность и полиморфизм, сопутствующую патологию (преимущественно сосудистого генеза) и социально-экономические аспекты [11, 12]. Медикаментозные (терапевтические) и лазерный подходы к лечению ПОУГ имеют доказанные ограниченные возможности, а использование хирургических методов лечения связано с развитием известных осложнений и имеет четкие показания к применению [13–15]. В целом особая устойчивость рефрактерной ПОУГ к традиционно применяемым методам лечения свидетельствует об отсутствии общепринятой тактики ведения пациентов с данной клинической разновидностью заболевания [16–18]. В связи с этим более детальное изучение связи между местЦ dыми, общими, социальными факторами и формированием рефрактерности ПОУГ может способствовать адекватному выбору тактики ведения пациентов и правильной оценке дальнейшего прогноза заболевания [19, 20].
Цель исследования: определить отдельные категории факторов риска и характеристики их взаимоотношений, определяющих прогноз течения ПОУГ у пациентов с разными стадиями заболевания.
Материал и методы
Проведено ретроспективное когортное научно-клиническое комбинированное многоцентровое исследование. В ходе исследования изучались такие показатели, как возраст, продолжительность заболевания и его стадии, уровни офтальмотонуса, гипотензивный режим, а также наличие сопутствующих заболеваний и иных факторов, которые могут являться потенциальными причинами рефрактерности ПОУГ. Ретроспективный анализ проведен за период наблюдения с момента диагностирования ПОУГ до момента обследования и подразумевал анализ ряда данных анамнеза болезни. Финальное обследование проводилось с декабря 2020 г. по июнь 2021 г., в период госпитализации пациентов в стационарные лечебные учреждения. В это время проводилось документальное подтверждение стадии заболевания по результатам выполнения стандартной статической периметрии (ССП), измерения внутриглазного давления (ВГД), толщины роговицы в оптической зоне, изучение режимов назначений и медицинской документации на предмет наличия сопутствующей соматической патологии, а также проводился дополнительный опрос, касающийся социального статуса пациентов.
Критерии включения: продолжительность заболевания более 6 мес. с момента верификации диагноза; возраст на момент диагностирования ПОУГ от 40 до 85 лет; клиническая рефракция не более ±6,0 Д и астигматизм не более ±3,0 Д.
Критерии исключения: глаукома низкого давления; выраженное помутнение оптических сред, затрудняющее использование морфометрических или периметрических методов исследования или приводящее к неправильной трактовке их результатов; любые другие заболевания сетчатки (например, возрастная макулодистрофия, «сухая» форма — начиная со II стадии по классификации AREDS (Age-related eye disease study, 2001) [22], состояния после окклюзий и осложнений диабетической ретинопатии, «влажная» форма макулодистрофии, в том числе на фоне интравитреальных инъекций препаратами — ингибиторами ангиогенеза и др.); травмы и заболевания органа зрения в анамнезе, затрудняющие проведение тонометрии; наличие в анамнезе интракапсулярной экстракции катаракты, «классической» экстракапсулярной экстракции катаракты или факоэмульсификации, прошедших с осложнениями; любая форма отслойки сетчатки (оперированная или не-оперированная); общие (системные) заболевания, требующие гормональной терапии.
В итоговый протокол исследования были включены данные 293 человек (средний возраст 65 (59–70) лет; 293 глаза, из них 158 правых, 135 левых), что составило 73,62% (пациентов/глаз) от общего числа проанализированных наблюдений. Исключенные из исследования протоколы содержали неполные данные или данные, соответствовавшие критериям невключения. На момент диагностирования заболевания у 142 пациентов была установлена начальная стадия ПОУГ, у 78 — развитая, у 52 —далеко зашедшая и у 21 — терминальная. Терминальная стадия ПОУГ соответствовала изменениям показателя MD (mean deviation, среднее отклонение) по данным ССП >20,01 дБ, что позволило детализировать клиническую картину [21]. Большинство составили мужчины — 159 (54,3%) человек. Возраст на момент диагностирования заболевания находился в пределах от 58 лет до 71 года; на момент включения в исследование — в интервале от 61 года до 76 лет.
Дизайн исследования. В связи с тем, что на сегодняшний день не существует классификации рефрактерной формы ПОУГ, которая включала бы в себя неофтальмологические факторы риска, для проведения данной работы нами было представлено оригинальное мнение, согласно которому все пациенты были разделены на 2 группы («нерефрактерная глаукома» и «рефрактерная глаукома») в соответствии с достижением/недостижением «целевого» уровня ВГД (по Маклакову, груз 10 г): 22–24 мм рт. ст. — для I стадии ПОУГ, 19–21 мм рт. ст. — для II стадии ПОУГ, 18 мм рт. ст. и менее — для III стадии ПОУГ на фоне лечения с учетом системных и иных факторов риска [17]. Далее все пациенты были разделены на 6 подгрупп: 2 — в группе «нерефрактерная глаукома» и 4 — в группе «рефрактерная глаукома».
В группе «нерефрактерная глаукома» выделены 2 подгруппы: в подгруппу 1 вошли 83 (28,3%) пациента в возрасте 65 (58; 70) лет, у которых «целевой» уровень ВГД был достигнут, режим лечения на момент финального обследования мог быть любым, а в анамнезе не было антиглаукомной операции(й); в подгруппу 2 — 59 (20,1%) пациентов в возрасте 64 (59; 69) лет, у которых «целевой» уровень ВГД был также достигнут при использовании любого гипотензивного режима, но эти пациенты уже были оперированы однажды.
Группа «рефрактерная глаукома» была разделена на 4 подгруппы: в подгруппу 3 были включены 52 (17,8%) пациента в возрасте 65,5 (58,5; 73,5) года, у которых «целевой» уровень ВГД не был достигнут на гипотензивном режиме, включающем 3 и более препаратов, и не было антиглаукомных операций в анамнезе; в подгруппу 4 — 36 (12,3%) пациентов в возрасте 66 (61; 70) лет, у которых «целевой» уровень ВГД не был достигнут на режиме с применением 3 и более препаратов и в анамнезе имелась антиглаукомная операция (выполненная более 6 нед. назад); в подгруппу 5 — 27 (9,2%) пациентов в возрасте 66 (58; 70) лет, у которых не был достигнут «целевой» уровень ВГД при использовании 1 и более препаратов при выполненной ранее антиглаукомной операции (менее 6 нед. назад); в подгруппу 6 — 36 (12,3%) пациентов в возрасте 64 (60; 69) лет, у которых «целевой» уровень ВГД также не был достигнут при использовании любого гипотензивного режима и было более 1 антиглаукомной операции в анамнезе.
Наибольшая продолжительность заболевания была установлена у пациентов из подгруппы 6 — 6 (3; 8,5) лет, а наименьшая — в подгруппах 3 и 5 — 2 (1; 4,5) и 2 (1; 5) года соответственно.
Статистический анализ полученных данных осуществляли с использованием программы Statistica 10.0 (StatSoft Inc., США). Параметры, имеющие распределение, отличное от нормального, представлены в формате Мe (Q1; Q3), где Мe — медиана, Q1 и Q3 — квартили. Для проверки равенства медиан нескольких выборок применяли H-критерий Краскела — Уоллеса; при отличном от нормального распределении параметров для сравнения нескольких независимых выборок — для попарного сравнения двух независимых выборок — Z-аппроксимация U-критерия Манна — Уитни, для повторных внутригрупповых сравнений — Z-аппроксимация T-критерия Вилкоксона. Статистическую значимость различий двух или нескольких относительных показателей (частот, долей) оценивали с использованием критерия согласия Пирсона (χ2). Критический уровень значимости при проверке статистических гипотез принят равным <0,05.
Результаты и обсуждение
Клиническая характеристика пациентов на момент диагностирования заболевания и во время финального обследования представлена в таблице 1.

На момент верификации диагноза превалировали пациенты с начальной стадией ПОУГ, при этом пациенты с развитой стадией заболевания были старше, чем лица с начальной стадией, — 67 (62; 71) и 63 (58; 69) года соответственно (p1,2=0,004, U1,2=-2,870). На момент проведения итоговых исследований статистически значимых различий по возрасту не выявлено. Среднее значение показателя ВГД по стадиям на момент диагностирования составило 28, 29, 31,5 и 34 мм рт. ст. для начальной, развитой, далеко зашедшей и терминальной стадий заболевания соответственно. Уровень ВГД на момент диагностирования ПОУГ был тем выше, чем более «продвинутой» была стадия заболевания (p1,2=0,002, p1,3<0,001, p1,4<0,001, p2,3=0,007, p2,4=0,006, p3,4=0,456). На момент проведения финальных обследований показатели ВГД также достоверно не отличались между стадиями болезни и составили в среднем для всех пациентов 21 мм рт. ст. Нами было установлено, что чем выше была стадия на момент диагностирования заболевания или финального обследования, тем выше уровень ВГД был на момент верификации глаукомы (рис. 1).
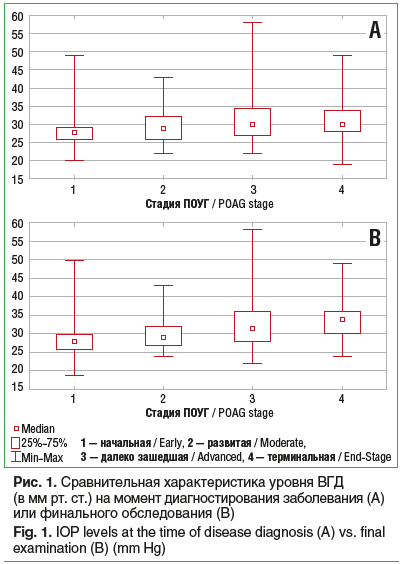
Таким образом, более высокие значения офтальмотонуса на момент выявления заболевания являются определяющим параметром рефрактерности глаукомы в плане прогноза лечения [24, 25].
Как видно из таблицы 2, наибольшей продолжительность заболевания была у пациентов из подгруппы 6 — 6 (3; 8,5) лет. В остальных случаях различия этого показателя не были статистически значимыми. Среди пациентов обеих групп самые высокие показатели ВГД имели пациенты подгрупп 4–6. На момент финального обследования уровень ВГД в подгруппах группы «рефрактерная глаукома» был выше, чем у пациентов в подгруппах группы «нерефрактерная глаукома». В связи с тем, что наиболее высокие показатели уровня ВГД на момент выявления заболевания и на момент финального обследования были в подгруппах 4–6, можно предположить, что уровень ВГД на момент верификации диагноза определяет рефрактерность заболевания в будущем. На момент проведения финального обследования показатели офтальмотонуса достоверно отличались в подгруппах группы «рефрактерная глаукома». Так, в подгруппах 3–6 уровень ВГД был выше, чем в подгруппах 1 и 2, с максимальными одинаковыми значениями в подгруппах 3 (максимальный режим, требуется оперативное лечение) и 5 (операция выполнена более 6 нед. назад, режим — более 1 препарата).
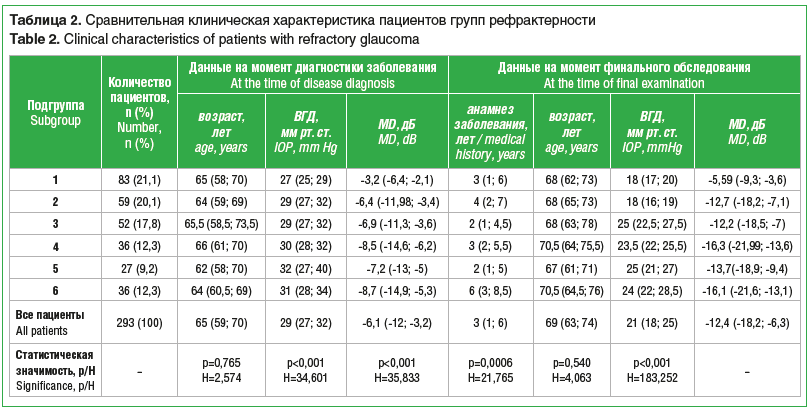
Анализ показал, что в качестве топической гипотензивной терапии пациенты получали препараты (и их сочетания), относящиеся к группам β-адреноблокаторов (БАБ), аналогов простагландинов (АПГ), адреномиметиков, местных ингибиторов карбоангидразы (ИКА) (рис. 2).

Использование БАБ и местных ИКА было наиболее распространено (в первую очередь за счет применения комбинированных схем лечения) у пациентов в подгруппах 1 и 3; АПГ активно применялись в подгруппах 1–4, преимущественно в подгруппах 1 и 3; адреномиметики чаще всего использовали в подгруппах 3 и 4. Обращает на себя внимание объем назначаемой местной гипотензивной терапии у пациентов подгруппы 5 (см. рис. 2). Несмотря на то, что «целевые» показатели уровня ВГД не были достигнуты, доктора не спешили возобновлять или изменять топическую терапию на ранних сроках после выполнения антиглау-комной операции, вероятно, связывая повышенный уровень офтальмотонуса с локальными местными факторами (например, «реактивный синдром», плоская фильтрационная подушка, требующая выполнения нидлинга) и попытками купировать данное состояние и добиться должного функционального эффекта от ранее выполненного хирургического лечения.
Подводя итог этой части работы, отметим, что чем выше был уровень ВГД на момент обнаружения заболевания, тем сложнее было с ним справиться, тем больший спектр режимов медикаментозных назначений применялся.
Фармакоэкономическая оценка местной гипотензивной терапии открытоугольной глаукомы также является важным аспектом оптимизации лекарственной помощи пациентам с глау комой. В целом совершенствование системы доступности офтальмологических лекарственных средств направлено на стабилизацию прогрессирования глаукомной оптической нейропатии (ГОН), сохранение зрения и повышение качества жизни пациентов. Необходимость оптимизации лекарственной помощи пациентам с глаукомой обусловлена, прежде всего, ограниченными возможностями бюджета системы здравоохранения, а имеющийся арсенал противоглаукомных препаратов предоставляет врачам широкий выбор [26, 27]. В этой связи определяющее значение имеет последовательность назначений в лечебно-диагностической стратегии, что доказано фактом приверженности, напрямую связанной с доступностью препаратов для пациента [28]. Анализ данных литературы свидетельствует о том, что более низкая цена препарата является преимуществом дженериков перед оригинальными лекарственными средствами. Данные различных авторов подтверждают, что такие препараты на этапе выбора стартовой терапии ПОУГ аналогами простагландинов могут не уступать оригинальному лекарственному с редству или даже полностью ему соответствовать, в результате чего достигаются классические «целевые» показатели уровня офтальмотонуса [29, 30]. Стоит также отметить, что в некоторых случаях дженерик может быть лучше оригинального препарата по числу нежелательных побочных явлений за счет иного состава вспомогательных веществ [31]. Таким образом, в ряде случаев при выборе терапии ПОУГ лечащий врач и пациент могут ориентироваться именно на пр епараты-дженерики, среди которых, например, Латанопрост-Оптик и Травопрост-Оптик, с целью оптимизации лечения и обеспечения большей доступности лекарственных средств.
Анализ иных факторов (местных и системных), потенциально способных влиять на рефрактерность заболевания, с которыми чаще всего сталкивается врач на приеме, представлен в таблице 3.


Нами были отмечены тенденции к увеличению степени рефрактерности при наличии таких местных факторов, как псевдоэксфолиативный синдром (ПЭС), синдром пигментной дисперсии (СПД), синдром «сухого глаза» (ССГ). Среди системных факторов обращают на себя внимание ишемическая болезнь сердца (ИБС) и наличие в анамнезе инфаркта миокарда (ИМ). Так, например, ПЭС наиболее часто (р<0,05) регистрировался в подгруппах 4 и 6, СПД — в подгруппах 5 и 6, ССГ — в подгруппах 4 и 6; миопия высокой степени — в подгруппе 4. Среди общих системных факторов достоверно чаще (р<0,05) выявлялись ИБС, ИМ (у пациентов подгрупп 5 и 4 соответственно).
Среди других факторов риска обращают на себя внимание курение и установленная инвалидность. Так, в подгруппе 5 в 27,8% наблюдений определялся фактор курения, а в подгруппе 6 22,2% пациентов имели группу инвалидности по общесоматической патологии. При сравнении частоты встречаемости всех факторов в подгруппах не было выявлено достоверных различий, за исключением показателя «приверженность лечению» (p1,3=0,001, p2,3=0,002), что свидетельствует в пользу того, что все они могут оказывать влияние на течение заболевания.
Одним из наиболее важных факторов риска развития и прогрессирования ГОН является высокий уровень ВГД [7]. К настоящему времени в литературе опубликовано несколько обзоров, свидетельствующих о спорной роли колебаний офтальмотонуса в развитии и прогрессировании глаукомы [18, 19, 22]. Результаты крупного исследования Advanced Glaucoma Intervention Study (AGIS) подтверждают, что для каждого увеличения колебаний уровня ВГД у пациентов, в том числе и с «рефрактерной» ПОУГ, риск ее прогрессирования увеличивается на 30% [32]. В ходе настоящего исследования также было отмечено, что более высокий средний уровень ВГД на момент диагностики ПОУГ соответствовал большей стадии заболевания, способствовал прогрессированию и увеличивал степень рефрактерности в ходе лечения. Следует отметить, что не было установлено влияние на течение ПОУГ следующих факторов: трудоустройство, одиночество, индекс массы тела, артериальная гипотензия. Кроме того, нами были рассмотрены такие факторы, как гиперметропия высокой степени, мигрень, болезнь Паркинсона, сахарный диабет 1 типа, злокачественные новообразования в анамнезе, группа инвалидности по зрению, сатурация <95%, но они не были включены в общую таблицу в связи с малым количеством зарегистрированных случаев.
В таблице 4 приведены данные о прогрессировании ПОУГ в соответствии с продолжительностью заболевания, которая в группах начальной, развитой, далеко зашедшей и терминальной стадий ПОУГ составила 3 (1; 6), 4 (2; 7), 2 (1; 4,5) и 3 (2; 5,5) года соответственно.
Установленные различия распределения пациентов внутри групп рефрактерности на момент диагностирования заболевания и на момент финального обследования были статистически значимы между подгруппами 1 и 2 (р=0,01 и р=0,00007), 3 и 4 (р=0,05 и р=0,02), 3 и 6 (р=0,02 и р=0,01). Это свидетельствует в пользу оптимально подобранного дизайна исследования, а также позволяет говорить о последовательном влиянии отдельных факторов на рефрактерность заболевания. В частности, из таблицы 4 видно, что за отчетный период исследования во всех подгруппах произошло прогрессирование глаукомного процесса, а подгруппу 1 группы «нерефрактерная глаукома» на момент финального обследования составили пациенты с начальной и развитой стадиями заболевания. Подгруппа 2 была представлена около 20% пациентов с каждой из стадий ПОУГ, а в подгруппе 3 группы «рефрактерная глаукома» был наибольший процент пациентов с начальной стадией на момент финального обследования (14,5%), далее он значительно снизился (вплоть до 1,5%), но результаты были ограничены количеством случаев наблюдения. У пациентов подгрупп 4 и 5 была отмечена связь скорости прогрессирования со стадией заболевания на момент диагностики, в основном за счет пациентов с развитой стадией ПОУГ. В подгруппе 6 была установлена наиболее выраженная скорость прогрессирования заболевания за весь период наблюдения за счет появления большого количества случаев терминальной стадии ПОУГ (22,2%). Стоит также напомнить, что количество пациентов в одной и той же подгруппе варьируется в зависимости от стадии ПОУГ на момент выявления заболевания и н а момент финального обследования. Именно поэтому в подгруппе 1 (начальная стадия ПОУГ) на момент диагностики было 62 пациента, что составило 43,7% от общего числа случаев, а на момент финального обследования — 44 человека, но уже 63,8%. Таким образом, вследствие естественного прогрессирования заболевания произошло перераспределение пациентов по стадиям болезни при неизменном общем количестве пациентов. Подводя итог этой части исследования, следует подчеркнуть, что отвечающие на лечение пациенты, которым требуется простой режим, имеют начальную или развитую стадии ПОУГ на момент верификации диагноза. Среди пациентов с начальной стадией 63,8% не требуют сложного режима топических назначений или проведения операции для достижения «целевого» уровня ВГД, среди пациентов с развитой стадией — только каждый третий (31,1%), а число случаев среди лиц с III стадией, состояние которых в течение 3 (1; 6) лет может быть стабилизировано, варьирует в диапазоне от 12,4% до 20%, в зависимости от указанной выше подгруппы рефрактерности.
Кроме этого, были проведены сравнения внутри каждой из подгрупп, позволяющие предположить изменения, произошедшие за весь период наблюдения. Установлено, что такие девиации были ничтожны (p>0,05). Иными словами, изменение количества пациентов в подгруппах в период от момента верификации ПОУГ и до момента финального обследования происходило в основном только внутри групп «нерефрактерная глаукома» и «рефрактерная глаукома», что, на наш взгляд, также свидетельствует о правильном отборе когорт в данном исследовании.
Ограничение исследования. Исключение четверти всех случаев (26,4%), скорее всего, отразилось на распределении как по стадиям заболевания, так и по подгруппам рефрактерности, а следовательно, и на результатах исследования. Изучение значимости дополнительных факторов риска с учетом дизайна работы было проведено лишь на финальном этапе исследования, что исключило возможность анализа в период обнаружения заболевания. Требуется продолжение работы с целью включения результатов количественной статистики (например, цифровые значения уровней АД или показателей теста Ширмера — ССГ и т. д.) для возможности применения дополнительного корреляционного анализа.
Заключение
Вне зависимости от стадии ПОУГ на момент финального обследования возраст пациентов был приблизительно одинаковым — около 69 лет, анамнез в среднем составлял 3 года (50% пациентов имели установленную продолжительность заболевания от 1 года до 6 лет). Вместе с тем подгруппы пациентов, согласно принятому условному делению на разные подгруппы рефрактерности, были гомогенны по возрасту. В литературе встречается достаточное количество работ, изучающих влияние преимущественно местных факторов (офтальмогипертензии, ПЭС, СПД и т. д.) на развитие ПОУГ и ее устойчивость к лечению [33–36]. По результатам проведенного исследования ключевым фактором, влияющим на степень рефрактерности заболевания в будущем, является уровень ВГД, установленный на момент диагностирования болезни. В свою очередь, также очевидна и связь между стадией ПОУГ и уровнем офтальмотонуса на старте заболевания. Согласно нашим данным более 75% пациентов на момент верификации заболевания имели уровень ВГД выше 26 мм рт. ст., а наибольшая продолжительность заболевания была у пациентов из подгруппы 6, имеющих более 1 операции в анамнезе. Лечебные мероприятия позволили снизить офтальмотонус в среднем до 21 (18; 25) мм рт. ст., и, таким образом, у значительного числа пациентов с «продвинутыми» стадиями ПОУГ заболевание на момент финального обследования стало «неуправляемым», что, в свою очередь, подтверждает необходимость применения дифференцированного подхода к лечению на момент верификации диагноза [37–39]. Также настоящее исследование показало, что тяжесть течения глаукомного процесса и прогрессирование рефрактерной ПОУГ могут определять не только местные, но и общие и социальные факторы (ИБС, артериальная гипотензия, ИМ в анамнезе; группа инвалидности по соматическому состоянию, курение, высокая приверженность лечению, наличие высшего образования), что необходимо учитывать при разработке классификации рефрактерной ПОУГ.
Сведения об авторах:
Фомин Николай Евгеньевич — врач-офтальмолог консультативного отдела ФКУ «ЦВКГ им. П.В. Мандрыка»; 107014, Россия, г. Москва, ул. Большая Оленья, вл. 8А; ассистент кафедры офтальмологии РНИМУ им. Н.И. Пирогова Минздрава России; 117437, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7738-1839.
Завадский Павел Чеславович — к.м.н., врач-офтальмолог, главный врач ООО «Офтальмологический центр Карелии»; 185031, Россия, г. Петрозаводск, наб. Варкауса, д. 1б; ORCID iD 0000-0002-6159-6120.
Куроедов Александр Владимирович — д.м.н., профессор кафедры офтальмологии РНИМУ им. Н.И. Пирогова Минздрава России; 117437, Россия, г. Москва, ул. Островитянова, д. 1; начальник офтальмологического отделения ФКУ «ЦВКГ им. П.В. Мандрыка»; 107014, Россия, г. Москва, ул. Большая Оленья, вл. 8А; ORCID iD 0000-0001-9606-0566.
Селезнев Алексей Владимирович — к.м.н., врач-офтальмолог, доцент кафедры оториноларингологии и офтальмологии ФГБОУ ВО ИвГМА Минздрава России; 153012, Россия, г. Иваново, Шереметевский пр-т, д. 8; ORCID iD 0000-0002-4583-6050.
Нагорнова Зоя Михайловна — к.м.н., врач-офтальмолог, ассистент кафедры оториноларингологии и офтальмологии ФГБОУ ВО ИвГМА Минздрава России; 153012, Россия, г. Иваново, Шереметевский пр-т, д. 8; ORCID iD 0000-0002-3821-689X.
Барышникова Дарья Андреевна — врач-офтальмолог ОКДЦ ПАО «Газпром»; 117420, Россия, г. Москва, ул. Наметкина, д. 16; ORCID iD 0000-0001-7983-7556.
Авдеев Роман Васильевич — к.м.н., доцент кафедры офтальмологии ФГБОУ ВО ВГМУ им. Н.Н. Бурденко Минздрава России; 394036, Россия, г. Воронеж, ул. Студенческая, д. 10; ORCID iD 0000-0003-4392-8311.
Гетманова Анастасия Михайловна — врач-офтальмолог ГАУЗ «Брянская областная больница № 1»; 241033, Россия, г. Брянск, пр-т Станке Димитрова, д. 86; ORCID iD 0000-0002-4900-6193.
Глушнев Игорь Александрович — врач-офтальмолог ГУ «РНПЦ РМиЭЧ»; 246040, Республика Беларусь, г. Гомель, ул. Ильича, д. 290; ORCID iD 0000-0002-3021-9498.
Гусаревич Анна Аркадьевна — к.м.н., врач-офтальмолог, руководитель Междорожного центра микрохирургии глаза стационара ЧУЗ «Клиническая больница «РЖД-Медицина» г. Новосибирск»; 630003, Россия, г. Новосибирск, Владимировский спуск, д. 2а; ORCID iD 0000-0002-8206-7510.
Дорофеев Дмитрий Александрович — врач-офтальмолог ГАУЗ ГКБ № 2; 454090, Россия, г. Челябинск, ул. Российская, д. 200; ORCID iD 0000-0003-3352-8170.
Космынина Светлана Васильевна — врач-офтальмолог ГОБУЗ «МОКБ им. П.А. Баяндина»; 183032, Россия, г. Мурманск, ул. Академика Павлова, д. 6; ORCID iD 0000-0002-8994-4555.
Мяконькая Олеся Сергеевна — врач-офтальмолог, заведующая офтальмологическим диагностическим отделением Волгоградского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 400138, Россия, г. Волгоград, ул. им. Землячки, д. 80; ORCID iD 0000-0002-0345-9912.
Ребенок Наталия Александровна — врач-офтальмолог отделения микрохирургии глаза ГУ «РНПЦ РМиЭЧ»; 246040, Республика Беларусь, г. Гомель, ул. Ильича, д. 290; ORCID iD 0000-0001-7264-4663.
Ражко Юлия Ивановна — к.м.н., врач-офтальмолог отделения микрохирургии глаза ГУ «РНПЦ РМиЭЧ»; 246040, Республика Беларусь, г. Гомель, ул. Ильича, д. 290; ORCID iD 0000-0003-4290-9952.
Семенова Ирина Ивановна — врач-офтальмолог УЗ «МГБ СМРП»; 212030, Республика Беларусь, г. Могилев, ул. Боткина, д. 2; ORCID iD 0000-0002-9801-5926.
Чернякова Татьяна Васильевна — к.м.н., врач-офтальмолог Многопрофильного медицинского центра Банка России; 117593, Россия, г. Москва, Севастопольский пр-т, д. 66; ORCID iD 0000-0003-1361-6704.
Контактная информация: Фомин Николай Евгеньевич, e-mail: nikolay.fomin2608@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.03.2022.
Поступила после рецензирования 29.03.2022.
Принята в печать 21.04.2022.
About the authors:
Nikolay E. Fomin — ophthalmologist of the Consultative Division, P.V. Mandryka Military Clinical Hospital; 8A, Bolshaya Olenya str., Moscow, 107014, Russian Federation; assistant of the Department of Ophthalmology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-7738-1839.
Pavel Ch. Zavadskiy — C. Sc. (Med.), Head Doctor, Karelia Ophthalmological Center; 1B, Varkaus emb., Petrozavodsk, 185031, Russian Federation; ORCID iD 0000-0002-6159-6120.
Aleksandr V. Kuroyedov — Dr. Sc. (Med.), Professor of the Department of Ophthalmology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; Head of the Division of Ophthalmology, P.V. Mandryka Military Clinical Hospital; 8A, Bolshaya Olenya str., Moscow, 107014, Russian Federation; ORCID iD 0000-0001-9606-0566.
Aleksei V. Seleznev — C. Sc. (Med.), associate professor of the Department of Otorhinolaryngology and Ophthalmology, Ivanovo State Medical Academy; 8, Sheremet’evskiy pass., Ivanovo, 153012, Russian Federation; ORCID iD 0000-0002-4583-6050.
Zoya M. Nagornova — C. Sc. (Med.), associate professor of the Department of Otorhinolaryngology and Ophthalmology, Ivanovo State Medical Academy; 8, Sheremet’evskiy pass., Ivanovo, 153012, Russian Federation; ORCID iD 0000-0002-3821-689X.
Darya A. Baryshnikova — ophthalmologist, Sectoral Clinical and Diagnostic Center of the PJSC "Gazprom"; 16, Nametkin str., Moscow, 117420, Russian Federation; ORCID iD 0000-0001-7983-7556.
Roman V. Avdeev — C. Sc. (Med.), associate professor of the Department of Ophthalmology, N.N. Burdenko Voronezh State Medical University; 10, Studencheskaya str., Voronezh, 394036, Russian Federation; ORCID iD 0000-0003-4392-8311.
Anastasiya M. Getmanova — ophthalmologist, Bryansk Regional Hospital No. 1; 86, Stanke Dimitrov av., Bryansk, 241033, Russian Federation; ORCID iD 0000-0002-4900-6193.
Igor A. Glushnev — ophthalmologist, Republican Scientific Practical Center of Radiation Medicine and Human Ecology; 290, Il’ich str., Gomel, 246040, Republic of Belarus; ORCID iD 0000-0002-3021-9498.
Anna A. Gusarevich — C. Sc. (Med.), Head of Cross-road Center of Eye Microsurgery, Clinical Hospital "RZD-Medicine" of the city of Novosibirsk; 2A, Vladimirovskiy desc., Novosibirsk, 630003, Russian Federation; ORCID iD 0000-0002-8206-7510.
Dmitriy A. Dorofeev — ophthalmologist, City Clinical Hospital No. 2; 200, Rossiyskaya str., Chelyabinsk, 454090, Russian Federation; ORCID iD 0000-0003-3352-8170.
Svetlana S. Kosmynina — ophthalmologist, P.A. Bayandin Murmansk Regional Clinical Hospital; 6, Academician Pavlov str., Murmansk, 183032, Russian Federation; ORCID iD 0000-0002-8994-4555.
Olesya S. Myakonkaya — ophthalmologist, Head of the Ophthalmological Diagnostic Department, Volgograd Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 80, Zemlyachki str., Volgograd, 400138, Russian Federation; ORCID iD 0000-0002-0345-9912.
Natalya A. Rebenok — ophthalmologist of the Department of Eye Microsurgery, Republican Scientific Practical Center of Radiation Medicine and Human Ecology; 290, Il’ich str., Gomel, 246040, Republic of Belarus; ORCID iD 0000-0001-7264-4663.
Yuliya I. Razhko — C. Sc. (Med.), ophthalmologist of the Department of Eye Microsurgery, Republican Scientific Practical Center of Radiation Medicine and Human Ecology; 290, Il’ich str., Gomel, 246040, Republic of Belarus; ORCID iD 0000-0003-4290-9952.
Irina I. Semenova — ophthalmologist, Mogilev City Hospital of the Emergency Medical Care; 2, Botkin str., Mogilev, 212030, Republic of Belarus; ORCID iD 0000-0002-9801-5926.
Tatyana V. Chernyakova — C. Sc. (Med.), ophthalmologist, Multidisciplinary Medical Center of the Bank of Russia; 66, Sevastopolskiy av., Moscow, 117593, Russian Federation; ORCID iD 0000-0003-1361-6704.
Contact information: Nikolay E. Fomin, e-mail: nikolay.fomin2608@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 02.03.2022.
Revised 29.03.2022.
Accepted 21.04.2022.












