Введение
Искусственный интеллект (ИИ) — направление в информатике, занимающееся разработкой программ, способных имитировать человеческое мышление. Понятие ИИ включает алгоритмы или технические устройства, ориентированные на имитацию отдельных функций человеческого интеллекта: восприятие визуальной информации (компьютерное зрение), обучаемость (искусственные нейронные сети), планирование и принятие решений и т. д. Один из разделов ИИ — машинное обучение (machine learning), его целью является создание обучаемых алгоритмов. Обучение может осуществляться при помощи набора заранее подготовленных примеров (обучение с учителем, supervised learning) либо на больших массивах данных без контроля со стороны человека (обучение без учителя, unsupervised learning).
Искусственные нейронные сети — наиболее широко применяемый метод машинного обучения. Искусственные нейронные сети являются очень простым математическим приближением биологических нейронных сетей и тоже состоят из нейронов. Искусственный нейрон, как и биологический его прототип, включает в себя синапсы, соединяющие его с другими нейронами, сумматор сигналов с синапсов (аналог тела нейрона) и один выход, аналогом которого является аксон биологического нейрона. Синапсы в искусственных нейронах представляют собой коэффициенты, на которые умножаются входы нейрона, а обучение искусственного нейрона производится путем подбора этих коэффициентов с помощью такого алгоритма математической оптимизации, как градиентный спуск, т. е. подбирается сила синаптической связи с другими нейронами в сети. Сверточные нейронные сети решают три вида задач: классификация изображений (требуется отнести входное изображение к одному из классов), семантическая сегментация (требуется обозначить все пиксели входного изображения, относящиеся к искомому классу объектов), детекция объектов на изображениях (требуется получить прямоугольник, описывающий искомый объект на изображении). Таким образом, научная дисциплина «Исследование ИИ» является разделом науки о работе с большими данными (Data Science), машинное обучение — разделом ИИ, а искусственные нейронные сети — методом машинного обучения.
Искусственный интеллект в медицине
Технологии ИИ используются в различных областях медицины: пульмонологии [1], онкологии [2], дерматологии [3], кардиологии [4].
Получение и анализ изображений — важнейший этап диагностики и лечения офтальмологической патологии, в особенности патологии сетчатки. Современные алгоритмы ИИ обучены анализировать изображения, полученные при помощи цифровых ретинальных фундус-камер, оптических когерентных томографов (ОКТ), ОКТ-ангиографии (ОКТ-А). Для идентификации патологических структур на цифровых изображениях программа ИИ должна быть обучена на примере большого массива данных, на которых эти структуры присутствуют. По завершении процесса обучения программа способна самостоятельно проанализировать фотографию, ОКТ, ОКТ-А глазного дна пациента и с высокой долей вероятности ответить на вопрос, присутствуют ли на данном снимке патологические изменения, которые ее научили распознавать.
Для оценки точности работы алгоритмов ИИ вычисляют несколько параметров:
количество правильных положительных срабатываний (True positives, TP);
количество неправильных положительных срабатываний (False positives, FP);
количество неправильных отрицательных срабатываний (False negatives, FN);
количество правильных отрицательных срабатываний (True negatives TN).
На основе этих параметров вычисляются следующие показатели:
Precision (точность срабатывания) — процент правильных положительных случаев из предсказанных положительных случаев; Precision = TP / (TP + FP);
Recall/Sensitivity (чувствительность) — процент правильно предсказанных положительных случаев из всех положительных случаев; Recall = TP / (TP + FN);
Specificity (специфичность) — процент правильно предсказанных отрицательных случаев из всех отрицательных случаев; Specificity = TN / (TN + FP).
Исходя из полученных показателей строится ROC-кривая (Receiver Operator Characteristic — операционная характеристика приемника), которая показывает зависимость количества верно классифицированных положительных примеров от количества неверно классифицированных отрицательных примеров. Количественную интерпретацию ROC дает показатель AUC (area under curve) — площадь под кривой, по которой можно оценивать качество предсказаний алгоритма ИИ. Если AUC равна 0,5, то алгоритм считается непригодным для решения данной задачи; если AUC менее 0,5, то алгоритм предсказывает результаты обратным образом от требуемого, т. е. негативные предсказывает как позитивные, а позитивные предсказывает как негативные; если AUC более 0,5, то можно считать, что алгоритм не просто угадывает, а действительно может отличать позитивные и негативные случаи. У идеального алгоритма AUC будет равна 1, соответственно, чем AUC ближе к 1, тем качественнее предсказания алгоритма ИИ.
Технологии ИИ в диагностике заболеваний сетчатки и перспективы их использования на различных этапах лечебно-диагностического процесса
Диабетическая ретинопатия
Важнейшими маркерами и критериями тяжести диабетической ретинопатии (ДР) являются микроаневризмы, интраретинальные геморрагии, интраретинальные микрососудистые аномалии, твердые экссудаты, ватообразные очаги, венозные аномалии, неоваскуляризация сетчатки и диска зрительного нерва, преретинальные геморрагии [5, 6]. Современные программы ИИ способны осуществлять анализ цифровых фотографий глазного дна, выявлять указанные патологические структуры, определять наличие и стадию ДР и выдавать заключение по результатам анализа [7–10]. На рисунке 1 приведен пример анализа алгоритмом ИИ фотографии глазного дна пациента с ДР. Программа автоматически выявляет твердые экссудаты и интраретинальные геморрагии, детектирует радиус макулы и наличие твердых экссудатов внутри радиуса макулы (что является критерием наличия диабетического макулярного отека (ДМО)), зонирует фотографию на квадранты и подсчитывает количество интраретинальных геморрагий внутри каждого квадранта (критерий тяжелой непролиферативной ДР [6]).
![Рис. 1. Пример анализа программой ИИ фотографии глазного дна пациента с ДР [10]Fig. 1. An example of artificial intelligence-based analysis of fundus photo in diabetic retinopathy [10] Рис. 1. Пример анализа программой ИИ фотографии глазного дна пациента с ДР [10]Fig. 1. An example of artificial intelligence-based analysis of fundus photo in diabetic retinopathy [10]](/upload/medialibrary/463/36-1.png)
С практической точки зрения наиболее перспективным представляется использование программ ИИ для диагностики ДР на этапе офтальмологического скрининга пациентов с сахарным диабетом (СД). По данным Всемирной организации здравоохранения (ВОЗ), 422 млн человек в мире страдают СД [11]. Прогнозируемое число больных к 2040 г. составит 645 млн, причем подавляющее большинство из них будет проживать в развивающихся странах [12]. Каждый пациент с СД, в зависимости от наличия и тяжести ДР и ДМО, нуждается в офтальмологическом обследовании от 1 раза в 2 года до 12 раз в год [6]. Это создает большую нагрузку на систему здравоохранения. Разработка программ скрининга остается серьезной проблемой даже для стран со значительными ресурсами. Согласно исследованиям около половины пациентов с СД остаются недостаточно обследованными [13]. Только в странах Европейского союза (ЕС) порядка 950 тыс. человек имеют слепоту или слабовидение вследствие ДР и ДМО [14]. ВОЗ рассматривает программы скрининга как наиболее эффективный инструмент борьбы со слепотой и слабовидением вследствие ДР. В руководстве ВОЗ от 2020 г. приводится пример организации скрининговых программ, когда все пациенты с СД регулярно приглашаются на фотографирование глазного дна, при этом за съемку отвечает средний медицинский персонал, затем все фотографии отправляются в референс-центр, где проводится анализ стадии и рисков заболевания и определяется дальнейшая маршрутизация пациентов [14]. В ситуации, когда необходимо за ограниченный период времени обследовать большое количество пациентов, оценить стадию заболевания, динамику и выявить пациентов, нуждающихся в неотложной офтальмологической помощи, программы ИИ могут оказать большую поддержку. Их использование на этапе первичного скрининга позволит снизить нагрузку на систему здравоохранения, увеличить охват населения скрининговым обследованием. Положительными результатами при этом потенциально могут стать уменьшение случаев слепоты и слабовидения вследствие несвоевременной диагностики ДР и ДМО, сокращение количества пациентов с далеко зашедшими формами ДР, нуждающихся в дорогостоящем хирургическом лечении, а также унификация диагностики.
На сегодняшний день в мировую офтальмологическую практику внедряются первые программы ИИ для скрининга ДР, одобренные для клинического использования Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов Министерства здравоохранения США (Food and Drug Administration, FDA). Первая из них — iDx-DR компании Digital Diagnostics — была одобрена в 2018 г. В 2019 г. Американская ассоциация диабетологов включила программу в стандарты скрининга ДР. В 2020 г. iDx-DR вошла в национальную программу медицинского страхования США Medicare [15]. Программа EyeArt компании Eyenuk была одобрена FDA в 2020 г., она подходит для анализа изображений с различных типов фундус-камер и используется в системах здравоохранения 13 стран мира [16].
Диабетический макулярный отек
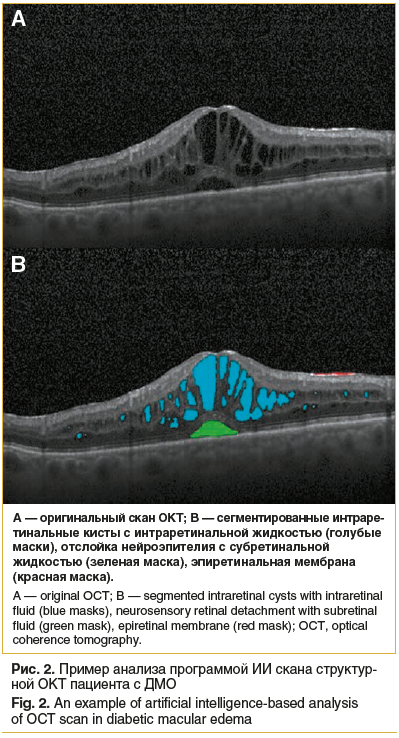
Основным методом диагностики ДМО является ОКТ. Она позволяет определить наличие интраретинальной и субретинальной жидкости, состояние витреомакулярного интерфейса, сохранность важнейших слоев сетчатки как критерий зрительного прогноза, оценить динамику процесса в ходе лечения. Современные алгоритмы ИИ обучены проводить анализ сканов структурной ОКТ и сегментировать морфологические признаки ДМО: интраретинальные кисты, отслойку нейроэпителия, твердые экссудаты, аномалии витреомакулярного интерфейса [17–19]. На рисунке 2 приведен пример сегментации субретинальной, интраретинальной жидкости и эпиретинальной мембраны программой ИИ.
Возрастная макулярная дегенерация
Возможности структурной ОКТ в диагностике возрастной макулярной дегенерации (ВМД) включают визуализацию и оценку размера и типа макулярных друз, выявление зон атрофии, гиперплазии и миграции клеток ретинального пигментного эпителия (РПЭ), отслойки РПЭ и нейроэпителия, интра- и субретинальной жидкости, субретинального гиперрефлективного материала, оценку типа хориоидальной неоваскуляризации и признаков ее активности [20]. В последние годы были опубликованы результаты исследований, посвященных разработке программ ИИ для автоматического распознавания макулярных друз [21], географической атрофии [22], морфологических признаков хориоидальной неоваскуляризации (ХНВ) [23].
С практической точки зрения наибольший интерес представляет разработка программ автоматического мониторинга активности патологического процесса в ходе терапии ингибиторами ангиогенеза ДМО и ХНВ. Данная терапия включает регулярные повторные интравитреальные инъекции ингибиторов ангиогенеза в течение длительного времени (до 1 года и более). Целью лечения является подавление активности патологического процесса, ликвидация отека и поддержание достигнутой остроты зрения так долго, насколько это возможно. В ходе исследований были предложены различные протоколы введения препаратов. Фиксированные режимы включают ежемесячные, 1 раз в 2 мес. и ежеквартальные инъекции. Недостатками фиксированных режимов являются риск избыточного лечения, высокая стоимость препаратов и большая нагрузка на пациентов и систему здравоохранения. В связи с этим большую актуальность приобрела разработка протоколов лечения, ориентированных на пациента.
Важнейшими показателями, отражающими эффективность антиангиогенной терапии и определяющими дальнейшую тактику и прогноз, являются морфологические изменения сетчатки, определяемые при помощи структурной ОКТ. К ним относятся центральная толщина сетчатки, наличие и количество интраретинальной жидкости, субретинальной жидкости и витреомакулярный интерфейс. P. Prahs et al. [24] опубликовали результаты исследования, проведенного в Университетской клинике Регенсбурга, в ходе которого на базе 1 млн сканов ОКТ была разработана программа ИИ для автоматического выявления показаний для повторной инъекции ингибиторов ангиогенеза. На основе анализа одного ОКТ-скана классификатор подразделял пациентов на 2 группы: нуждающиеся в повторной инъекции анти-VEGF в ближайшие 21 день и не нуждающиеся в ней. Точность классификатора составила 90%, т. е. в 19 случаях из 20 программа верно определяла потребность в повторной инъекции без участия человека. H. Bogunovic et al. [25] представили алгоритм персонализированного расчета интервалов введения ингибиторов ангиогенеза на основе ИИ. Алгоритм базировался на прогнозировании объема интраретинальной жидкости в макуле в течение 2 мес. после начала анти-VEGF терапии. В руководстве по ведению ДМО от Европейского общества специалистов-ретинологов алгоритмы сегментации и объемного вычисления интраретинальной жидкости рассматриваются как инструмент, способный повлиять на индивидуальные схемы антиангиогенной терапии [26].
Дифференциальная диагностика макулярной патологии
В 2018 г. компания Google Deep Mind провела на базе британской офтальмологической клиники Moorfields Eye Hospital исследование программы ИИ для дифференциальной диагностики следующих макулярных патологий по данным ОКТ: ХНВ, макулярного отека без ХНВ, макулярных друз, географической атрофии, эпиретинального тракционного синдрома, сквозных и ламеллярных макулярных разрывов, центральной серозной хориоретинопатии (ЦСХ). Программа распределяла патологии на 4 категории: неотложные, срочные, требующие лечения в плановом порядке, требующие наблюдения. Точность программы составила 96,6%, AUC — 0,999. Результаты исследования были опубликованы J. De Fauw et al. [27].
S. Kuwayama et al. [28] на базе 59 400 изображений ОКТ разработали алгоритм ИИ для дифференциальной диагностики ретинальных друз, «влажной» формы ВМД, ЦСХ, кистозного макулярного отека различной этиологии, эпиретинального тракционного синдрома, сквозных и ламеллярных макулярных разрывов, географической атрофии, полипоидной хориоидальной васкулопатии (ПХВ), макулярных телеангиэктазий 1 типа, синдрома Фогта — Коянаги — Харада. Программа анализировала сканы ОКТ и рассчитывала вероятность развития перечисленных патологий. На рисунке 3 представлены примеры заключений программы при различных патологиях.
![Рис. 3. Дифференциальная диагностика программой ИИ ЦСХ, ПХВ, «влажной» формы ВМД и синдрома Фогта —Коянаги — Харада [28]Fig. 3. AI-based differential diagnosis of CSC, PCV, wet AMD, and VKH [28] Рис. 3. Дифференциальная диагностика программой ИИ ЦСХ, ПХВ, «влажной» формы ВМД и синдрома Фогта —Коянаги — Харада [28]Fig. 3. AI-based differential diagnosis of CSC, PCV, wet AMD, and VKH [28]](/upload/medialibrary/317/36-3.png)
Перспективы использования алгоритмов ИИ при лазерных вмешательствах на сетчатке
Согласно стандартам Международного совета по офтальмологии панретинальная лазеркоагуляция (ПЛК) является предпочтительным методом лечения пролиферативной ДР [6]. H. Takahashi et al. [29] разработали алгоритм прогнозирования потребности в ПЛК у пациентов с ДР. В задачи программы ИИ входила градация ДР, оценка динамики и прогнозирование потребности и сроков ПЛК. Точность алгоритма составила 96%.
Согласно исследованиям субпороговое лазерное воздействие на сетчатку может иметь терапевтический эффект, не вызывая ее видимого повреждения [30]. Субпороговая микроимпульсная лазеркоагуляция (СМИЛК) используется для лечения хронической ЦСХ [31], ХНВ, резистентной к анти-VEGF терапии [32], ДМО [33]. Однако применение данного метода ограничено сложностью контроля степени термического повреждения сетчатки в процессе лазерного воздействия. Перегрев фоторецепторов и ретинального пигментного эпителия ведет к повреждению и гибели клеток, недостаточный нагрев нивелирует терапевтический эффект. Различными исследователями предлагались методы температурного контроля в процессе лазерного воздействия, основанные на принципах МРТ-сканирования [34], люминесцентной спектроскопии [35], оптоакустического мониторинга [36]. M. Pitkänen et al. [37] опубликовали результаты эксперимента по измерению температуры фоторецепторов и ретинального пигментного эпителия на основе регистрации параметров электроретинограммы, зависимых от температуры клеток. Эксперимент проводился ex vivo на изолированных сетчатках лабораторных мышей. При помощи алгоритма ИИ была разработана модель оценки температуры сетчатки и расчета минимальной энергии и таргетной температуры, необходимой для фотоактивации нейроэпителия, потенциально пригодная для использования in vivo.
Вопросы организации медицинских исследований с использованием алгоритмов ИИ
В 2020 г. группа европейских ученых во главе с L. Faes [38] опубликовала руководство, посвященное вопросу, как правильно и критически оценивать медицинские исследования, в которых использовались алгоритмы ИИ. В руководстве были озвучены следующие ключевые моменты планирования, проведения и интерпретации результатов исследований в области ИИ.
В ходе разработки алгоритмов ИИ используются большие массивы данных. Все данные подразделяются на обучающую и тестовую базы. Обучающая база служит непосредственно для разработки алгоритма, тестовая — для проверки точности его работы. При этом очень важно, чтобы данные из обучающей базы не попали в тестовую. В идеале разработанный алгоритм должен проходить проверку дважды — на внутренней тестовой базе данных, а затем валидироваться на внешних данных независимыми экспертами. Очень важно, чтобы обучающая база была сбалансирована по характеру данных и была максимально приближена к реальным клиническим условиям.
Важнейшим этапом разработки алгоритмов ИИ является разметка данных. Она может проводиться вручную или автоматически путем извлечения информации из электронных ресурсов системы здравоохранения. Разметка данных должна проводиться офтальмологами на основании существующих классификаций, рекомендованных и удобных для использования в клинической практике. В некоторых ситуациях желательно делать разметку ретроспективно, с использованием дополнительных данных, подтверждающих диагноз.
Развитие технологий ИИ и их быстрая интеграция в сферу здравоохранения диктуют необходимость разработки единых стандартов проведения медицинских исследований с использованием ИИ. В настоящее время ведется разработка международных протоколов TRIPOD-ML, SPIRIT-AI и CONSORT-AI, призванных улучшить дизайн и отчетность исследований [39].
Правовой статус использования алгоритмов ИИ в здравоохранении
Важнейшим вопросом при применении алгоритмов ИИ являются доверие результатам, полученным от применения данных алгоритмов, а также ответственность за эти результаты. В мировой практике на данные вопросы пока еще нет однозначного ответа. С одной стороны, современные технологии ИИ де-факто уже начинают использоваться в клинической практике. Так, по экспертным оценкам консалтинговой компании Tata Consulting Services, в 2018 г. порядка 86% организаций, оказывающих различные услуги в области здравоохранения, в той или иной форме использовали алгоритмы ИИ [40].
При этом во многом алгоритмы ИИ работают по принципу «черного ящика» — механизм их работы до конца неизвестен, исследователь подает данные на входе и получает определенный результат на выходе, называя это «обучением модели». При добавлении дополнительных данных программа может изменить свой процесс принятия решений, выдавая более точный ответ, без какого-либо понимания для исследователя, как это получается. С ростом объемов данных, получаемых программой в процессе обучения, модели становятся все более точными и, улучшаясь, в конце концов будут способны добиться более высокой диагностической точности, чем человек.
Первые алгоритмы ИИ получают одобрение регулирующих органов в США и ЕС и, таким образом, легальный статус для повседневного применения. Между тем юридический статус применения ИИ в медицине в значительной степени все еще не определен. Например, неясно, применима ли, в случае ошибочных решений (например, ошибки диагноза) вследствие использования алгоритма ИИ, продуктовая ответственность (product liability), т. е. ответственность производителя или продавца продукции в случае причинения потребителю продукции имущественного ущерба или вреда здоровью из-за дефекта или фактического отказа изделия; или же ошибки ИИ следует относить к врачебным ошибкам и руководствоваться соответствующими стандартами и рекомендациями поведения. В США применение ИИ в здравоохранении, как уже упоминалось, попадает под регулирование FDA, а именно в сферу регулирования медицинских изделий (medical device) для диагностики, лечения, предотвращения заболевания. Однако законодательство в данной области не является устоявшимся, ему еще предстоит сформироваться [41]. Специалисты отмечают, что регулирование отдельных областей применения ИИ требует новых, ранее не существовавших подходов — например как в случае с машинным обучением алгоритмов ИИ, которые по определению быстро изменяются со временем вследствие появления новых математических алгоритмов, новых нейронных сетей (архитектуры), новых данных, на основе которых обучаются алгоритмы и результат их работы становится более точным, и т. п. [42].
Алгоритмы ИИ — это еще один инструмент, появляющийся в арсенале врача, позволяющий получить «второе мнение» и снизить вероятность врачебной ошибки. Однако итоговое решение и ответственность за это решение несет врач. Именно такой подход, как считается, в наибольшей степени соответствует интересам и пациента, и врача, и компаний, разрабатывающих данный инструментарий.
Принимая во внимание сложную природу технологий ИИ и риски, которые несет их бесконтрольное применение, общепринятый международный подход на сегодня состоит в том, что решения на основе ИИ не являются самодостаточными и требуют обязательной верификации со стороны врача. Врач не должен и не может полагаться в своем решении исключительно на результат, рекомендованный алгоритмом ИИ.
В этой связи особую важность в организации здравоохранения приобретает разработка стандартов, регламентирующих применение технологий ИИ, а также стандартов, позволяющих достоверно оценивать безопасность, точность и надежность функционирования систем на основе ИИ. В Российской Федерации в составе Технического комитета 164 «Искусственный интеллект», созданного на базе Российской венчурной компании (утвержден приказом Росстандарта от 25.07.2019 №1732), функционирует Центр диагностики и телемедицины, поддержанный Министерством здравоохранения, в задачи которого входит координация экспертной деятельности по разработке стандартов ИИ в клинической медицине. Данный комитет является отражением международного подкомитета SC 42 Artificial Intelligence, что позволяет эффективно гармонизировать подходы к стандартизации и нормативные документы.
Можно предположить, что по мере появления стандартов разработки и использования алгоритмов ИИ в здравоохранении область их применения будет стремительно расширяться. ИИ — перспективный инструмент, способный стать помощником в лечебно-диагностическом процессе, однако нельзя забывать об ограничениях данного инструмента и о том, что последнее слово остается за врачом.
Сведения об авторах:
1Каталевская Евгения Алексеевна — к.м.н., врач-офтальмолог, научный руководитель проекта RETINA AI; ORCID iD 0000-0002-5710-9205.
1,2Каталевский Дмитрий Юрьевич — к.э.н., генеральный директор; доцент Института бизнеса и делового администрирования РАНХиГС; ORCID iD 0000-0002-3920-5041.
1,3Тюриков Максим Игоревич — главный инженер-программист; ассистент кафедры автоматизации машиностроения; ORCID iD 0000-0003-1839-4506.
4Велиева Инджи Арифовна — к.м.н., врач-офтальмолог, научный сотрудник; ORCID iD 0000-0002-9230-3150.
4Большунов Андрей Валентинович — д.м.н., профессор; ORCID iD 0000-0002-2316-9920.
1ООО «Диджитал Вижн Солюшнс». 119027, Россия, г. Москва, п. Внуково, ул. Центральная, д. 86.
2РАНХиГС. 119571, Россия, г. Москва, пр-т Вернадского, д. 82.
3ФГБОУ ВО «Нижегородский государственный технический университет им. Р.Е. Алексеева». 603950, Россия, г. Нижний Новгород, ул. Минина, д. 24.
4ФГБНУ «НИИГБ». 119021, Россия, г. Москва, ул. Россолимо, д. 11А.
Контактная информация: Каталевская Евгения Алексеевна, e-mail: ekatalevskaya@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 21.12.2020.
About the authors:
1Evgeniya A. Katalevskaya — C. Sc. (Med.), opthahlmologist, Principal Investigator of the RETINA AI; ORCID iD 0000-0002-5710-9205.
1,2Dmitriy Yu. Katalevskiy — C. Sc. (Econ.), CEO; associate professor of the Institute of Business and Business Administration of the RANEPA; ORCID iD 0000-0002-3920-5041.
1,3Maksim I. Tyurikov — chief engineer programmer; assistant of the Department of Machinery Automation; ORCID iD 0000-0003-1839-4506.
4Indzhi A. Velieva — C. Sc. (Med.), ophthalmologist, researcher; ORCID iD 0000-0002-9230-3150.
4Andrey V. Bolshunov — Dr. Sc. (Med.), Professor; ORCID iD 0000-0002-2316-9920.
1LLC "Digital Vision Solutions", 86, Tsentralnaya str., Vnukovo, Moscow, 119027, Russian Federation.
2Russian Presidential Academy of National Economy and Public Administration (RANEPA), 82, Vernadskiy av., Moscow, 119571, Russian Federation.
3Nizhny Novgorod State Technical University named after R.E. Alekseev, 24, Minin str., Nizhny Novgorod, 603950, Russian Federation.
4Scientific Research Institute of Eye Diseases, 11A, Rossolimo str., Moscow, 119021, Russian Federation.
Contact information: Evgeniya A. Katalevskaya, e-mail: ekatalevskaya@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 21.12.2020.












