–¶–µ–ї—М. –Ю—Ж–µ–љ–Є—В—М —Б—В–µ–њ–µ–љ—М –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –∞–њ–Њ–њ—В–Њ–Ј–∞ –Ї–ї–µ—В–Њ–Ї –і—А–µ–љ–∞–ґ–љ–Њ–є –Ј–Њ–љ—Л —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Љ–µ—В–Њ–і–∞ –Є–Љ–Љ—Г–љ–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Б—В–∞–і–Є—П–Љ–Є –њ–µ—А–≤–Є—З–љ–Њ–є –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л. (–Я–Ю–£–У).
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–µ–љ–Њ 20 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (20 –≥–ї–∞–Ј) —Б —А–∞–Ј–≤–Є—В–Њ–є –Є –і–∞–ї–µ–Ї–Њ –Ј–∞—И–µ–і—И–µ–є —Б—В–∞–і–Є—П–Љ–Є –њ–µ—А–≤–Є—З–љ–Њ–є –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л. –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ—Б—В–∞–≤–Є–ї 69,25±8,04 –≥–Њ–і–∞, –∞ –і–Њ–Ї—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–є –∞–љ–∞–Љ–љ–µ–Ј –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П 5,66±5,86 –≥–Њ–і–∞. –Т —Е–Њ–і–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–є –≤—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є –±—Л–ї –≤—Л–і–µ–ї–µ–љ —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–—В—А–∞–±–µ–Ї—Г–ї—П—А–љ—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б, –Ї–Њ—В–Њ—А—Л–є –Ј–∞—В–µ–Љ –њ–Њ–і–≤–µ—А–≥–∞–ї—Б—П –Є–Љ–Љ—Г–љ–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–Љ—Г –∞–љ–∞–ї–Є–Ј—Г. –ѓ–і—А–∞ –Ї–ї–µ—В–Њ–Ї –±—Л–ї–Є –Њ–Ї—А–∞—И–µ–љ—Л —П–і–µ—А–љ—Л–Љ –Ї—А–∞—Б–Є—В–µ–ї–µ–Љ Hoechst 33342. –Ф–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –∞–њ–Њ–њ—В–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –њ—А–Є–Љ–µ–љ—П–ї–Є –Љ–µ—В–Њ–і TUNEL.
–†–µ–Ј—Г–ї—М—В–∞—В—Л. –Ю–±–љ–∞—А—Г–ґ–µ–љ–∞ —Г–Љ–µ—А–µ–љ–љ–∞—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –≤–Њ–Ј—А–∞—Б—В–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –∞–њ–Њ–њ—В–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –љ–∞ —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (r=0,57). –Ф–ї—П –і–∞–ї–µ–Ї–Њ –Ј–∞—И–µ–і—И–µ–є —Б—В–∞–і–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л —Е–∞—А–∞–Ї—В–µ—А–љ–∞ —Г–Љ–µ—А–µ–љ–љ–∞—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є—П —Б—В–µ–њ–µ–љ–Є –∞–њ–Њ–њ—В–Њ–Ј–∞ –Ї–ї–µ—В–Њ–Ї –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –∞–љ–∞–Љ–љ–µ–Ј–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (r=0,55). –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є —А–∞–Ј–љ–Є—Ж—Л –≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –∞–њ–Њ—В–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –і—А–µ–љ–∞–ґ–љ–Њ–є –Ј–Њ–љ—Л –њ—А–Є —А–∞–Ј–≤–Є—В–Њ–є –Є –і–∞–ї–µ–Ї–Њ –Ј–∞—И–µ–і—И–µ–є —Б—В–∞–і–Є—П—Е –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –љ–µ –±—Л–ї–Њ.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ. –Ш–Љ–Љ—Г–љ–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–є –Љ–µ—В–Њ–і –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –∞–њ–Њ–њ—В–Њ–Ј–∞ –Ї–ї–µ—В–Њ–Ї –і—А–µ–љ–∞–ґ–љ–Њ–є –Ј–Њ–љ—Л —П–≤–ї—П–µ—В—Б—П –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ –Є –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–µ–і–ї–Њ–ґ–µ–љ –і–ї—П –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –Є–Ј—Г—З–µ–љ–Є—П –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞.
–Ъ–ї—О—З–µ–≤—Л–µ —Б–ї–Њ–≤–∞: –≥–ї–∞—Г–Ї–Њ–Љ–∞, –∞–њ–Њ–њ—В–Њ–Ј, –і—А–µ–љ–∞–ґ–љ–∞—П –Ј–Њ–љ–∞, TUNEL––Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ.
Abstract
Immunochemical analysis of drainage areas cells
in advanced glaucoma patients
V.Yu. Ogorodnikova1, E.A. Egorov1,
A.V. Kuroyedov2, Yu.V. Markitantova3, A.N. Petrov4
1 Pirogov Russian National Research Medical University,
2 Mandryka Medical Training and Research Clinical Center, Moscow,
3 Koltzov Institute of Developmental Biology, Moscow,
4 Hertzen Moscow Research Oncological Institute, Moscow, Russia
Purpose. To estimate the degree of apoptosis in the drainage area in different glaucoma stages.
Material and methods. 20 patients (20 eyes) with primary open angle glaucoma were included. The mean age was 69,25±8,04 years, glaucoma in past history – for 5,66±5,86 years. All patients underwent a penetrating filtering surgery. Scleral–trabecular complex was separated and investigated by a TUNEL assay.
Results. Moderate positive correlation was found between a patient age and an apoptosis in a II stage of a glaucoma (r=0,57). In advanced glaucoma moderate positive correlation was found between the duration of the glaucoma history and the cell apoptosis (r=0,55). Statistical significant difference in the number of apoptotic cells of different glaucoma stages was not found.
Conclusion. Immunochemical method may be proposed for the further study of the mechanism of glaucoma process.
Key words: glaucoma, apoptosis, drainage area, TUNEL assay.
–Т–≤–µ–і–µ–љ–Є–µ
–Ю–і–љ–Є–Љ –Є–Ј –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –њ—Г—В–µ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ –ї–µ—З–µ–љ–Є—П —В–∞–Ї–Є—Е –љ–µ–є—А–Њ–і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Ї–∞–Ї –≥–ї–∞—Г–Ї–Њ–Љ–∞, —П–≤–ї—П–µ—В—Б—П –≤—Л—П–≤–ї–µ–љ–Є–µ –Ї–ї–µ—В–Њ—З–љ—Л—Е –Є—Б—В–Њ—З–љ–Є–Ї–Њ–≤ —А–µ–≥–µ–љ–µ—А–∞—Ж–Є–Є –Є —Б–њ–Њ—Б–Њ–±–Њ–≤ –Є—Е —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞–љ–Є—П. –Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –њ–Њ—П–≤–Є–ї–Њ—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —А–∞–±–Њ—В, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –Є–Ј—Г—З–µ–љ–Є—О –љ–µ–є—А–Њ–і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –≥–ї–∞—Г–Ї–Њ–Љ—Л.
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–є –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є –Є–≥—А–∞–µ—В –Љ–µ—Е–∞–љ–Є–Ј–Љ –∞–њ–Њ–њ—В–Њ–Ј–∞ –≤ –≥–∞–љ–≥–ї–Є–Њ–љ–∞—А–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е —Б–µ—В—З–∞—В–Ї–Є [1,9,15]. –Ю–і–љ–∞–Ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —В–∞–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —П–≤–ї—П–µ—В—Б—П –љ–µ–њ—А–Њ—Б—В–Њ–є –Ј–∞–і–∞—З–µ–є. –Ф–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –Є –Є–Ј—Г—З–µ–љ–Є—П –Ї–ї–µ—В–Њ–Ї, –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є –∞–њ–Њ–њ—В–Њ–Ј–∞, –±—Л–ї–Њ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–Њ –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –Є –Є—Е –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–є. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —А–∞–±–Њ—В –≤ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є –±—Л–ї–Њ –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞–љ–Њ –љ–∞ –Є–Ј–Љ–µ—А–µ–љ–Є–µ —А–∞–Ј–Љ–µ—А–Њ–≤ –Є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ–Ї, –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є – –љ–∞ –Є–Ј—Г—З–µ–љ–Є–µ —Б–Њ—Б—В–∞–≤–∞ –љ–∞—А—Г–ґ–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л, –Є, –љ–∞–Ї–Њ–љ–µ—Ж, –љ–Є–Ї–Њ–≥–і–∞ –љ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–ї–Є—Б—М —Д—А–∞–≥–Љ–µ–љ—В–∞—Ж–Є—П —П–і–µ—А–љ–Њ–є –і–µ–Ј–Њ–Ї—Б–Є—А–Є–±–Њ–љ—Г–Ї–ї–µ–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–Ф–Э–Ъ) –Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤ –≤ –Ї–ї–µ—В–Ї–∞—Е. –Ґ–∞–Ї–Є–µ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П —Б–≤—П–Ј–∞–љ—Л —Б —В–µ–Љ, —З—В–Њ –Є–Ј—Г—З–µ–љ–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ —В–Ї–∞–љ—П—Е –≥–ї–∞–Ј–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —А–µ–∞–ї–Є–Ј–Њ–≤–∞—В—М —В–Њ–ї—М–Ї–Њ –≤ —Н–љ—Г–Ї–ї–µ–Є—А–Њ–≤–∞–љ–љ—Л—Е –≥–ї–∞–Ј–∞—Е –Є–ї–Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П «–ґ–Є–≤—Л—Е» –≥–ї–∞–Ј –≤–Њ–Ј–Љ–Њ–ґ–љ—Л –љ–∞ –њ—А–Є–Љ–µ—А–µ –Њ–±—А–∞–Ј—Ж–Њ–≤ –і—А–µ–љ–∞–ґ–љ–Њ–є –Ј–Њ–љ—Л, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –≤ —Е–Њ–і–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤. –†.–Р. –°–Є–Љ–∞–Ї–Њ–≤–Њ–є (1974) –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –≥–ї–∞—Г–Ї–Њ–Љ–љ—Л–є –∞–љ–∞–Љ–љ–µ–Ј –≤ —Ж–µ–ї–Њ–Љ –Є –њ–µ—А–µ—Е–Њ–і –Њ—В —Б—В–∞–і–Є–Є –Ї —Б—В–∞–і–Є–Є —Г—Б—Г–≥—Г–±–ї—П—О—В –і–Є—Б—В—А–Њ—Д–Є—О –і—А–µ–љ–∞–ґ–љ–Њ–є –Ј–Њ–љ—Л [10].
–Э–∞–Љ–Є —А–∞–љ–µ–µ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ —Н–ї–µ–Ї—В—А–Њ–љ–љ–Њ––Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —В—А–∞–±–µ–Ї—Г–ї—П—А–љ–Њ–є —Б–µ—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ—А–Њ–і–≤–Є–љ—Г—В—Л–Љ–Є —Б—В–∞–і–Є—П–Љ–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л –Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —З–Є—Б–ї–Њ –і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ–Њ––Є–Ј–Љ–µ–љ–µ–љ–љ—Л—Е –Ї–ї–µ—В–Њ—З–љ—Л—Е –Њ—А–≥–∞–љ–µ–ї–ї –≤ –Ї–ї–µ—В–Ї–∞—Е —Б —А–∞–Ј–љ–Њ–є —Б—В–µ–њ–µ–љ—М—О –∞–њ–Њ–њ—В–Њ–Ј–∞ [8]. –Ю–і–љ–∞–Ї–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ —Б–≤–µ—В–Њ–≤–Њ–є –Є —Н–ї–µ–Ї—В—А–Њ–љ–љ–Њ–є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є–Є —П–≤–ї—П–µ—В—Б—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Њ–±—К–µ–Ї—В–Є–≤–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е. –Я–Њ–Љ–Є–Љ–Њ —Н—В–Њ–≥–Њ —Б–ї–µ–і—Г–µ—В —Г—З–Є—В—Л–≤–∞—В—М, —З—В–Њ –∞–њ–Њ–њ—В–Њ–Ј —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П –і–≤—Г–Љ—П –њ—Г—В—П–Љ–Є: –њ—А–Є —Г—З–∞—Б—В–Є–Є —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Ї–ї–µ—В–Њ—З–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –ї–Є–±–Њ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А (—З–∞—Й–µ –≤—Б–µ–≥–Њ –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–є). –Т —Б–≤–Њ–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л–µ —Г—З–µ–љ—Л–µ —Г–Ї–∞–Ј—Л–≤–∞—О—В –ї–Є—И—М –љ–∞ –њ–Њ—Б–ї–µ–і–љ–Є–є (–Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ—Л–є) –њ—Г—В—М –≥–Є–±–µ–ї–Є –Ї–ї–µ—В–Њ–Ї [2–4,6,7]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤ –Ј–∞—А—Г–±–µ–ґ–љ–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ –Љ—Л –≤—Б—В—А–µ—В–Є–ї–Є —А–∞–±–Њ—В—Л –њ–Њ –Њ—Ж–µ–љ–Ї–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –∞–њ–Њ–њ—В–Њ–Ј–∞ –≤ –љ–Њ—А–Љ–µ, –њ—А–Є –њ–µ—А–≤–Є—З–љ–Њ–є –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–µ (–Я–Ю–£–У) –Є –Ј–∞–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Є–Ї [12,15]. –Я—А–Є —Н—В–Њ–Љ –∞–≤—В–Њ—А—Л –љ–µ –њ—А–Є–≤–Њ–і—П—В –і–∞–љ–љ—Л–µ, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї –∞–њ–Њ–њ—В–Њ–Ј–∞ –њ—А–Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –≤—Л—И–µ—Г–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є. –Т –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ –љ–∞–Љ–Є –љ–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ —А–∞–±–Њ—В, –∞–≤—В–Њ—А—Л –Ї–Њ—В–Њ—А—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–Є –±—Л –Є–Љ–Љ—Г–љ–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–—В—А–∞–±–µ–Ї—Г–ї—П—А–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –Њ–њ—А–µ–і–µ–ї–Є—В—М —Ж–µ–ї—М –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –Њ—Ж–µ–љ–Є—В—М —Б—В–µ–њ–µ–љ—М –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –∞–њ–Њ–њ—В–Њ–Ј–∞ –Ї–ї–µ—В–Њ–Ї –і—А–µ–љ–∞–ґ–љ–Њ–є –Ј–Њ–љ—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Б—В–∞–і–Є—П–Љ–Є –Я–Ю–£–У.
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –љ–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –±–∞–Ј–µ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–і–µ–ї–µ–љ–Є—П –§–Ъ–£ «–Ь–µ–і–Є—Ж–Є–љ—Б–Ї–Є–є —Г—З–µ–±–љ–Њ––љ–∞—Г—З–љ—Л–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Ж–µ–љ—В—А –Є–Љ. –Я.–Т. –Ь–∞–љ–і—А—Л–Ї–∞» –Ь–Ю –†–§ –≤ –њ–µ—А–Є–Њ–і —Б —П–љ–≤–∞—А—П –њ–Њ –Љ–∞–є 2012 –≥. –Т –Є—В–Њ–≥–Њ–≤—Л–є –њ—А–Њ—В–Њ–Ї–Њ–ї –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л –і–∞–љ–љ—Л–µ 20 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (20 –≥–ї–∞–Ј) —Б –Я–Ю–£–У, –і–ї–Є—В–µ–ї—М–љ–Њ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ—Г—О –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Г—О —В–µ—А–∞–њ–Є—О (–±–µ—В–∞––±–ї–Њ–Ї–∞—В–Њ—А—Л, –∞–љ–∞–ї–Њ–≥–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –Є –Љ–µ—Б—В–љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –Ї–∞—А–±–Њ–∞–љ–≥–Є–і—А–∞–Ј—Л) –њ—А–Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ–Љ —А–µ–ґ–Є–Љ–µ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є –Є –њ–Њ—Б—В—Г–њ–Є–≤—И–Є—Е –љ–∞ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –≤ —Б–≤—П–Ј–Є —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –Є —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є –Ј—А–Є—В–µ–ї—М–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є. –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ—Б—В–∞–≤–Є–ї 69,25±8,04 –≥–Њ–і–∞, –∞ –і–Њ–Ї—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–є –∞–љ–∞–Љ–љ–µ–Ј –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П – 5,66±5,86 –≥–Њ–і–∞. –Ш—Б—Б–ї–µ–і—Г–µ–Љ—Л–µ –±—Л–ї–Є —Б–≥—А—Г–њ–њ–Є—А–Њ–≤–∞–љ—Л —Б–Њ–≥–ї–∞—Б–љ–Њ —Б—В–∞–і–Є—П–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (—В–∞–±–ї. 1). –Т–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е –і–Є–∞–≥–љ–Њ–Ј –≥–ї–∞—Г–Ї–Њ–Љ—Л –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ –і–∞–љ–љ—Л–Љ–Є –Њ–±—К–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–µ–ї–Є –і–∞–ї–µ–Ї–Њ –Ј–∞—И–µ–і—И—Г—О —Б—В–∞–і–Є—О –≥–ї–∞—Г–Ї–Њ–Љ—Л (55%), –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ—Г–ґ—Б–Ї–Њ–≥–Њ –њ–Њ–ї–∞ –±—Л–ї–Њ –±–Њ–ї—М—И–µ (60%).
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –Њ—З–µ–≤–Є–і–љ—Г—О —А–∞–Ј–љ–Є—Ж—Г –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–Љ –∞–љ–∞–Љ–љ–µ–Ј–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤—Б–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ—Л (p>0,05).
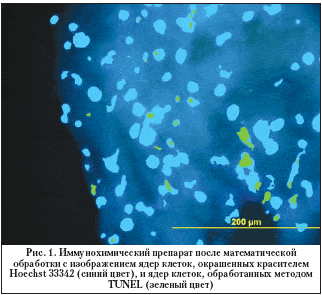
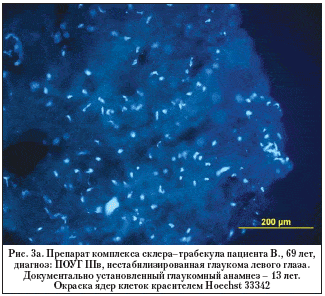
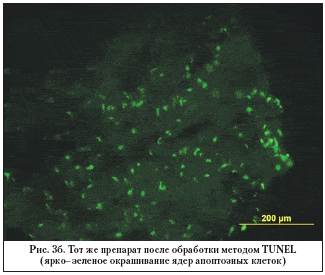
–Т—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –±—Л–ї–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ–∞—П –Њ–њ–µ—А–∞—Ж–Є–Є –њ—А–Њ–љ–Є–Ї–∞—О—Й–µ–≥–Њ —В–Є–њ–∞. –Т —Е–Њ–і–µ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ —Г–і–∞–ї—П–ї–Є —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–—В—А–∞–±–µ–Ї—Г–ї—П—А–љ—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б, –Ї–Њ—В–Њ—А—Л–є –Ј–∞—В–µ–Љ –њ–Њ–і–≤–µ—А–≥–∞–ї–Є –Є–Љ–Љ—Г–љ–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–Љ—Г –∞–љ–∞–ї–Є–Ј—Г. –Ф–ї—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ–±—А–∞–Ј—Ж—Л —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–Є –≤ 4% –љ–µ–є—В—А–∞–ї—М–љ–Њ–Љ —Д–Њ—А–Љ–∞–ї–Є–љ–µ, –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ–Њ–Љ –љ–∞ 0,1 –Ь PBS (pH 7,4) —Б 5% —Б–∞—Е–∞—А–Њ–Ј–Њ–є. –Я–Њ–і–≥–Њ—В–Њ–≤–Ї–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –њ–Њ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –Љ–µ—В–Њ–і–Є–Ї–µ. –° –њ–Њ–Љ–Њ—Й—М—О –Ї—А–Є–Њ—Б—В–∞—В–∞ Leica M1900 (Leica, –У–µ—А–Љ–∞–љ–Є—П) –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –њ–Њ–њ–µ—А–µ—З–љ—Л–µ —Б—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 10 –Љ–Ї–Љ. –ѓ–і—А–∞ –Ї–ї–µ—В–Њ–Ї –±—Л–ї–Є –Њ–Ї—А–∞—И–µ–љ—Л —П–і–µ—А–љ—Л–Љ –Ї—А–∞—Б–Є—В–µ–ї–µ–Љ Hoechst 33342. –Ш–Љ–Љ—Г–љ–Њ—Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—Ж–Є—О –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—В–љ–Њ–≥–Њ –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–∞ Leica DM RXA2 (–У–µ—А–Љ–∞–љ–Є—П), –Њ—Б–љ–∞—Й–µ–љ–љ–Њ–≥–Њ –љ–∞–±–Њ—А–Њ–Љ —Б–≤–µ—В–Њ—Д–Є–ї—М—В—А–Њ–≤, –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є –њ—А–Є—Б—В–∞–≤–Ї–Њ–є –Є –њ—А–Њ–≥—А–∞–Љ–Љ–Њ–є Leica for Windows (–У–µ—А–Љ–∞–љ–Є—П). –Ф–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –∞–њ–Њ–њ—В–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –њ–Њ —А–∞–Ј—А—Л–≤–∞–Љ –Є—Е –Ф–Э–Ъ –њ—А–Є–Љ–µ–љ—П–ї–Є –Љ–µ—В–Њ–і TUNEL (Terminal deoxynucleotidyl Transferase Biotin–dUTP Nick End Labeling), –Ї–Њ—В–Њ—А—Л–є –Љ–∞—А–Ї–Є—А—Г–µ—В –Ї–ї–µ—В–Ї–Є —Б –Ф–Э–Ъ, –і–µ–≥—А–∞–і–Є—А—Г—О—Й–µ–є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –∞–Ї—В–Є–≤–∞—Ж–Є–Є Ca/Mg––Ј–∞–≤–Є—Б–Є–Љ–Њ–є —Н–љ–і–Њ–љ—Г–Ї–ї–µ–∞–Ј—Л. –Т –∞–љ–∞–ї–Є–Ј–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –љ–∞–±–Њ—А —А–µ–∞–≥–µ–љ—В–Њ–≤ —Д–Є—А–Љ—Л Promega (DeadEnd Fluorometric TUNEL System, Promega, –°–®–Р). –Ю—Ж–µ–љ–Ї–∞ –Є –∞–љ–∞–ї–Є–Ј –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–є –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ –∞–і–∞–њ—В–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–Њ–≥—А–∞–Љ–Љ Adobe Photoshop CS3 Extendet –Є Corel Draw X3 –љ–∞ –њ–µ—А—Б–Њ–љ–∞–ї—М–љ–Њ–Љ –Ї–Њ–Љ–њ—М—О—В–µ—А–µ –њ–Њ–і —Г–њ—А–∞–≤–ї–µ–љ–Є–µ–Љ –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л Windows XP —Б –ї–Є—Ж–µ–љ–Ј–Є–Њ–љ–љ—Л–Љ –њ—А–Њ–≥—А–∞–Љ–Љ–љ—Л–Љ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–µ–Љ MS Office XP Professional (—А–Є—Б. 1).
–Т—Б–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–і–≤–µ—А–≥–∞–ї–Є—Б—М –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–µ (–њ—А–Њ–≥—А–∞–Љ–Љ–∞ Statistica, –≤–µ—А—Б–Є—П 6.0, StatSoft, Inc., –Р–≤—Б—В—А–∞–ї–Є—П – –°–®–Р) —В–∞–Ї–ґ–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –ї–Є—Ж–µ–љ–Ј–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Њ–≥—А–∞–Љ–Љ–љ–Њ–≥–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П.
–†–µ–Ј—Г–ї—М—В–∞—В—Л
–Я–Њ—Б–ї–µ –Њ–±—А–∞–±–Њ—В–Ї–Є –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–є –Є –њ–Њ–і—Б—З–µ—В–∞ –Ї–ї–µ—В–Њ–Ї –±—Л–ї–Њ –≤—Л—З–Є—Б–ї–µ–љ–Њ –њ—А–Њ—Ж–µ–љ—В–љ–Њ–µ –Њ—В–љ–Њ—И–µ–љ–Є–µ –∞–њ–Њ–њ—В–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Ї –Є—Е –Њ–±—Й–µ–Љ—Г —З–Є—Б–ї—Г. –Т —В–∞–±–ї–Є—Ж–µ 2 –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л —Б—А–µ–і–љ–Є–µ –і–∞–љ–љ—Л–µ –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–≤–Є—В–Њ–є –Є –і–∞–ї–µ–Ї–Њ –Ј–∞—И–µ–і—И–µ–є —Б—В–∞–і–Є—П–Љ–Є –Я–Ю–£–У.
–Ш–Ј —В–∞–±–ї–Є—Ж—Л 1 –≤–Є–і–љ–Њ, —З—В–Њ —А–∞–Ј–ї–Є—З–Є—П –≤ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –∞–њ–Њ–њ—В–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї (%) —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–≤–Є—В–Њ–є –Є –і–∞–ї–µ–Ї–Њ –Ј–∞—И–µ–і—И–µ–є —Б—В–∞–і–Є—П–Љ–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ—Л (23,95±12,30 –Є 25,34±7,70; p>0,05). –Ґ–∞–Ї–Є–µ –і–∞–љ–љ—Л–µ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–∞—В –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–Љ —А–∞–љ–µ–µ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е —Б –њ–Њ–Љ–Њ—Й—М—О —Б–≤–µ—В–Њ–≤–Њ–є –Є —Н–ї–µ–Ї—В—А–Њ–љ–љ–Њ–є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є–Є [10,13]. –Ю–і–љ–∞–Ї–Њ –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ —Н—В–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —П–≤–ї—П–µ—В—Б—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Њ–±—К–µ–Ї—В–Є–≤–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –і–∞–љ–љ—Л—Е, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —Б –њ–Њ–Љ–Њ—Й—М—О —Н–ї–µ–Ї—В—А–Њ–љ–љ–Њ–≥–Њ –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–∞, –Љ–Њ–ґ–љ–Њ –Њ—В—В–∞–ї–Ї–Є–≤–∞—В—М—Б—П —В–Њ–ї—М–Ї–Њ –Њ—В —Б—Г–±—К–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–љ–µ–љ–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П, –Ї–Њ—В–Њ—А—Л–є –њ—А–Њ—Б–Љ–∞—В—А–Є–≤–∞–µ—В –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П. –Ш–Љ–Љ—Г–љ–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–∞—П –Љ–µ—В–Њ–і–Є–Ї–∞ –≤–Ї—Г–њ–µ —Б –Ї–Њ–Љ–њ—М—О—В–µ—А–љ—Л–Љ –∞–љ–∞–ї–Є–Ј–Њ–Љ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–є –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ–Њ–ї—Г—З–Є—В—М —З–Є—Б–ї–Њ–≤—Л–µ –Ј–љ–∞—З–µ–љ–Є—П –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –і–ї—П –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–∞–Љ –љ–µ —Г–і–∞–ї–Њ—Б—М –Њ–±–љ–∞—А—Г–ґ–Є—В—М —Б—А–µ–і–Є –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е —А–∞–љ–µ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –і–∞–љ–љ—Л—Е —Б—А–∞–≤–љ–µ–љ–Є—П —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –∞–њ–Њ–њ—В–Њ–Ј–∞ –Ї–ї–µ—В–Њ–Ї –і—А–µ–љ–∞–ґ–љ–Њ–є –Ј–Њ–љ—Л —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –і—А—Г–≥–Є—Е –Њ–±—К–µ–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Є–Ї.
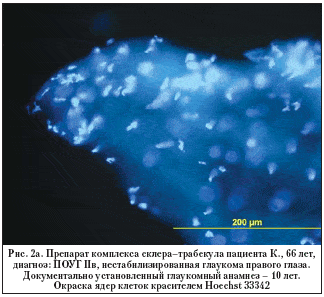
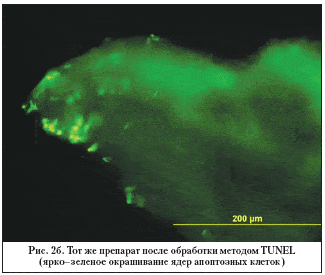
–Э–∞ —А–Є—Б—Г–љ–Ї–∞—Е 2–∞ –Є 2–± –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –њ—А–Є–Љ–µ—А –Є–Љ–Љ—Г–љ–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–—В—А–∞–±–µ–Ї—Г–ї—П—А–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –њ–∞—Ж–Є–µ–љ—В–∞ —Б —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–µ–є –Я–Ю–£–У.
–Э–∞ —А–Є—Б—Г–љ–Ї–µ 3 (–∞, –±) –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –њ—А–Є–Љ–µ—А –Є–Љ–Љ—Г–љ–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ – –Њ–±—А–∞–Ј—Ж–∞ —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–—В—А–∞–±–µ–Ї—Г–ї—П—А–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞, –≤–Ј—П—В–Њ–≥–Њ —Г –њ–∞—Ж–Є–µ–љ—В–∞ —Б –і–∞–ї–µ–Ї–Њ –Ј–∞—И–µ–і—И–µ–є —Б—В–∞–і–Є–µ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л.
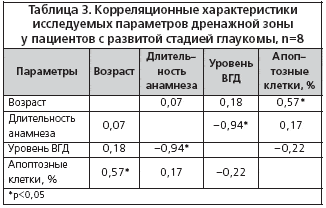
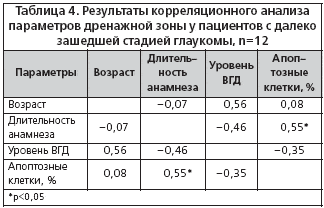
–Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г –Є–Љ–Љ—Г–љ–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ–∞—А–∞–Љ–µ—В—А–∞–Љ–Є –і—А–µ–љ–∞–ґ–љ–Њ–є –Ј–Њ–љ—Л –Є –∞–љ–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Є–Љ–Є –і–∞–љ–љ—Л–Љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї –њ—А–Є–Љ–µ–љ–µ–љ –њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј. –Ф–ї—П –і–µ—В–∞–ї–Є–Ј–∞—Ж–Є–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л —Б–Њ–≥–ї–∞—Б–љ–Њ —Б—В–∞–і–Є—П–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –†–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Є–≤–µ–і–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–∞—Е 3 –Є 4.
–Т—Л—П–≤–ї–µ–љ–∞ —Г–Љ–µ—А–µ–љ–љ–∞—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –≤–Њ–Ј—А–∞—Б—В–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –∞–њ–Њ–њ—В–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї (r=0,57), —В.–µ. —З–µ–Љ —Б—В–∞—А—И–µ –њ–∞—Ж–Є–µ–љ—В, —В–µ–Љ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –∞–њ–Њ–њ—В–Њ–Ј–∞ –≤ –і—А–µ–љ–∞–ґ–љ–Њ–є –Ј–Њ–љ–µ –±–Њ–ї—М—И–µ. –Р–њ–Њ–њ—В–Њ–Ј —П–≤–ї—П–µ—В—Б—П –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –њ—А–Њ—Ж–µ—Б—Б–∞ —А–∞–Ј–≤–Є—В–Є—П, –Є–љ–≤–Њ–ї—О—Ж–Є–Є, –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј–∞, –∞—В—А–Њ—Д–Є–Є –Є –і—А—Г–≥–Є—Е —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є [5]. Alvarado J. –µt al. (1981) –Њ—Ж–µ–љ–Є–ї–Є –≤–Њ–Ј—А–∞—Б—В–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ї–ї–µ—В–Њ–Ї —В—А–∞–±–µ–Ї—Г–ї—П—А–љ–Њ–є —Б–µ—В–Є –≤ –љ–Њ—А–Љ–µ –Є –љ–∞—И–ї–Є, —З—В–Њ –њ–Њ—В–µ—А—П –Ї–ї–µ—В–Њ–Ї —В—А–∞–±–µ–Ї—Г–ї—П—А–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ –Є–Љ–µ–µ—В –ї–Є–љ–µ–є–љ—Г—О –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Њ—В –≤–Њ–Ј—А–∞—Б—В–∞ –Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 0,58% –≤ –≥–Њ–і [11]. –°—З–Є—В–∞–µ—В—Б—П —В–∞–Ї–ґ–µ, —З—В–Њ –≥–ї–∞—Г–Ї–Њ–Љ–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б —Б–≤—П–Ј–∞–љ —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –њ—А–Њ–≥—А–∞–Љ–Љ—Л –∞–њ–Њ–њ—В–Њ–Ј–∞, –Ї–Њ—В–Њ—А–Њ–µ –Љ–Њ–ґ–µ—В –Є–љ–Є—Ж–Є–Є—А–Њ–≤–∞—В—М—Б—П —А—П–і–Њ–Љ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ [15]. –Ф–∞–ї–µ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Ј–∞–њ—Г—Б–Ї–∞–µ—В –њ–Њ—А–Њ—З–љ—Л–є –Ї—А—Г–≥ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є —Г—Б—Г–≥—Г–±–ї–µ–љ–Є–µ –і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ —Б—В—А—Г–Ї—В—Г—А–∞—Е –≥–ї–∞–Ј–∞. –Ґ–µ–љ–і–µ–љ—Ж–Є—О —Г—Б–Є–ї–µ–љ–Є—П –і–Є—Б—В—А–Њ—Д–Є–Є –і—А–µ–љ–∞–ґ–љ–Њ–є –Ј–Њ–љ—Л –њ—А–Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –Њ—В–Љ–µ—В–Є–ї–∞ –†.–Р. –°–Є–Љ–∞–Ї–Њ–≤–∞ (1974) [10]. –°–Њ–≥–ї–∞—Б–љ–Њ –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ –љ–∞–Љ–Є –і–∞–љ–љ—Л–Љ, –і–ї—П —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Е–∞—А–∞–Ї—В–µ—А–љ–∞ —В–∞ –ґ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –і–Є—Б—В—А–Њ—Д–Є–Є, —З—В–Њ –Є –≤ –љ–Њ—А–Љ–µ. –Я—А–Є –і–∞–ї–µ–Ї–Њ –Ј–∞—И–µ–і—И–µ–є —Б—В–∞–і–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л –Љ—Л –љ–µ —Г—Б—В–∞–љ–Њ–≤–Є–ї–Є –њ–Њ–і–Њ–±–љ–Њ–є –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є.
–Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –±—Л–ї–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ —Г–Љ–µ—А–µ–љ–љ–∞—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –∞–њ–Њ–њ—В–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞ (r=0,55), —В.–µ. —З–µ–Љ –і–Њ–ї—М—И–µ –њ–∞—Ж–Є–µ–љ—В –±–Њ–ї–µ–µ—В –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є, —В–µ–Љ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ –њ—А–Њ—Ж–µ—Б—Б –∞–њ–Њ–њ—В–Њ–Ј–∞ –≤ –µ–≥–Њ –і—А–µ–љ–∞–ґ–љ–Њ–є –Ј–Њ–љ–µ. –Ґ–∞–Ї–∞—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–Љ —В–Њ–≥–Њ, —З—В–Њ –Ј–∞–њ—Г—Б–Ї –Є —А–∞–Ј–≤–Є—В–Є–µ –∞–њ–Њ–њ—В–Њ–Ј–∞ –Є–Љ–µ—О—В –Љ—Г–ї—М—В–Є—Д–∞–Ї—В–Њ—А–љ—Г—О –њ—А–Є—А–Њ–і—Г. –Ю–Ї—Б–Є–і–∞—В–Є–≤–љ—Л–є —Б—В—А–µ—Б—Б, –љ–∞—А—Г—И–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є–µ–≤–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, –і–ї–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–µ—Б—В–љ—Л—Е –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Љ–Њ–≥—Г—В –≤–ї–Є—П—В—М –љ–∞ –њ—А–Њ—Ж–µ—Б—Б –∞–њ–Њ–њ—В–Њ–Ј–∞, —Г—Б–Є–ї–Є–≤–∞—П –і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П. –Я—А–Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л –≤–Њ–Ј–љ–Є–Ї–∞—О—В —Г—Б–ї–Њ–≤–Є—П –і–ї—П —Г—Б–Є–ї–µ–љ–Є—П –∞–њ–Њ–њ—В–Њ–Ј–∞, –Є –Њ–±—А–∞–Ј—Г–µ—В—Б—П –њ–Њ—А–Њ—З–љ—Л–є –Ї—А—Г–≥ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є.
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –і–ї—П –Њ–±–µ–Є—Е —Б—В–∞–і–Є–є –±–Њ–ї–µ–Ј–љ–Є –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М —А–∞–Ј–≤–Є—В–Є—П –∞–њ–Њ–њ—В–Њ–Ј–∞ —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –∞–љ–∞–Љ–љ–µ–Ј–∞ (r=0,36 –Є r=0,28, p<0,05). –Ю–±–љ–∞—А—Г–ґ–µ–љ–∞ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –∞–њ–Њ–њ—В–Њ–Ј–∞ –Є —Г—А–Њ–≤–љ—П –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞. –Я—А–Є–љ—П—В–Њ —Б—З–Є—В–∞—В—М, —З—В–Њ —Б—В–Њ–є–Ї–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –њ—А–Є–≤–Њ–і–Є—В –Ї —Г—Б–Є–ї–µ–љ–Є—О —А–∞–Ј–≤–Є—В–Є—П –∞–њ–Њ–њ—В–Њ–Ј–∞ [14]. –Ю–і–љ–∞–Ї–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —Г–Ї–∞–Ј—Л–≤–∞—О—Й–Є–µ –љ–∞ —Н—В–Њ, –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –ї–Є—И—М —Б –Є–Ј—Г—З–µ–љ–Є–µ–Љ –≥–∞–љ–≥–ї–Є–Њ–љ–∞—А–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б–µ—В—З–∞—В–Ї–Є –Є –љ–µ –Ї–∞—Б–∞–ї–Є—Б—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –∞–њ–Њ–њ—В–Њ–Ј–∞ –≤ –і—А–µ–љ–∞–ґ–љ–Њ–є –Ј–Њ–љ–µ.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ш–Ј—Г—З–µ–љ–Є–µ –њ—А–Њ—Ж–µ—Б—Б–∞ –∞–њ–Њ–њ—В–Њ–Ј–∞ —П–≤–ї—П–µ—В—Б—П –∞–Ї—В—Г–∞–ї—М–љ–Њ–є –Є —Б–ї–Њ–ґ–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–∞—В–Њ–ї–Њ–≥–Є–Є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –∞–њ–Њ–њ—В–Њ–Ј–∞ –Љ–Њ–ґ–µ—В –і–∞—В—М –љ–Њ–≤–Њ–µ, –±–Њ–ї–µ–µ —Ж–µ–ї–Њ—Б—В–љ–Њ–µ, –Ї–Њ–љ—Ж–µ–њ—В—Г–∞–ї—М–љ–Њ–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–µ –Њ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Я–Ю–£–У, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є—В —А–∞–Ј—А–∞–±–Њ—В–∞—В—М –Є –≤–љ–µ–і—А–Є—В—М –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–µ –Љ–µ—В–Њ–і—Л –µ–µ –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П, –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞ –Є –ї–µ—З–µ–љ–Є—П. –Я—А–Њ–±–ї–µ–Љ—Л –љ–∞ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ —Н—В–∞–њ–µ –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Б–≤—П–Ј–∞–љ—Л —Б –њ–Њ–ї—Г—З–µ–љ–Є–µ–Љ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Љ–∞—В–µ—А–Є–∞–ї–∞ –і–ї—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Њ–±—К–µ–Ї—В–Є–≤–љ–Њ–є –Њ—Ж–µ–љ–Ї–Њ–є –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є —Б—В–Њ–Є–Љ–Њ—Б—В—М—О –Љ–µ—В–Њ–і–Є–Ї–Є. –Ь–µ—В–Њ–і–Є–Ї–∞ –Є–Љ–Љ—Г–љ–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Њ–≤–µ—Б—В–Є –њ–Њ–і—Б—З–µ—В –Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї—Г—О –Њ–±—А–∞–±–Њ—В–Ї—Г –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –Њ–±—К–µ–Ї—В–∞. –Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ –њ—А–Є–Љ–µ–љ—П–µ–Љ–Њ–є –Љ–µ—В–Њ–і–Є–Ї–Є —П–≤–ї—П–µ—В—Б—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ –Ї–∞–Ї –ґ–Є–≤—Л—Е –Ї–ї–µ—В–Њ–Ї, —В–∞–Ї –Є –Ї–ї–µ—В–Њ–Ї, –њ–Њ–≥–Є–±—И–Є—Е –≤—Б–ї–µ–і—Б—В–≤–Є–µ –∞–њ–Њ–њ—В–Њ–Ј–∞.
–Т –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–µ –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є —А–∞–Ј–љ–Є—Ж—Л –≤ —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –∞–њ–Њ–њ—В–Њ–Ј–∞ –≤ –Ї–ї–µ—В–Ї–∞—Е –і—А–µ–љ–∞–ґ–љ–Њ–є –Ј–Њ–љ—Л —А–∞–Ј–≤–Є—В–Њ–є –Є –і–∞–ї–µ–Ї–Њ –Ј–∞—И–µ–і—И–µ–є —Б—В–∞–і–Є–є –Я–Ю–£–У. –Ф–ї—П —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –∞–њ–Њ–њ—В–Њ–Ј–∞ —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т –і–∞–ї–µ–Ї–Њ –Ј–∞—И–µ–і—И–µ–є —Б—В–∞–і–Є–Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –∞–њ–Њ–њ—В–Њ–Ј–∞ –Ј–∞–≤–Є—Б–Є—В –Њ—В –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –∞–љ–∞–Љ–љ–µ–Ј–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –С—Л–ї–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–∞ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М —Г—А–Њ–≤–љ—П –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –Є –∞–њ–Њ–њ—В–Њ–Ј–∞. –£—З–Є—В—Л–≤–∞—П –љ–µ–±–Њ–ї—М—И–Њ–µ —З–Є—Б–ї–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Є –∞–Ї—В—Г–∞–ї—М–љ–Њ—Б—В—М –≤–Њ–њ—А–Њ—Б–∞, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –і–∞–ї—М–љ–µ–є—И–µ–µ –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ —А–∞–±–Њ—В—Л –≤ –≤—Л–±—А–∞–љ–љ–Њ–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є. –Я—А–Є–љ—П—В–Њ —Б—З–Є—В–∞—В—М, —З—В–Њ —Б—В–Њ–є–Ї–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –њ—А–Є–≤–Њ–і–Є—В –Ї —Г—Б–Є–ї–µ–љ–Є—О —А–∞–Ј–≤–Є—В–Є—П –∞–њ–Њ–њ—В–Њ–Ј–∞ [14]. –Ю–і–љ–∞–Ї–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —Г–Ї–∞–Ј—Л–≤–∞—О—Й–Є–µ –љ–∞ —Н—В–Њ, –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –ї–Є—И—М —Б –Є–Ј—Г—З–µ–љ–Є–µ–Љ –≥–∞–љ–≥–ї–Є–Њ–љ–∞—А–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б–µ—В—З–∞—В–Ї–Є –Є –љ–µ –Ї–∞—Б–∞–ї–Є—Б—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –∞–њ–Њ–њ—В–Њ–Ј–∞ –≤ –і—А–µ–љ–∞–ґ–љ–Њ–є –Ј–Њ–љ–µ.


–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Р–ї–µ–Ї—Б–µ–µ–≤ –Т.–Э., –Ь–∞—А—В—Л–љ–Њ–≤–∞ –Х.–С., –°–∞–і–Ї–Њ–≤ –Т.–Ш., –°–∞–Љ—Г—Б–µ–љ–Ї–Њ –Ш.–Р. –†–Њ–ї—М –∞–њ–Њ–њ—В–Њ–Ј–∞ –Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Љ—О–ї–ї–µ—А–Њ–≤—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї –њ—А–Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–µ // –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—П. 2005. вДЦ 2. –°. 52–54.
2. –Р–ї–µ–Ї—Б–µ–µ–≤ –Т.–Э., –Э–Є–Ї–Є—В–Є–љ –Ф.–Э., –°–∞–і–Ї–Њ–≤ –Т.–Ш. –Є –і—А. –Э–∞—А—Г—И–µ–љ–Є—П —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е –њ–µ—А–≤–Є—З–љ–Њ–є –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є: –Ъ–Њ–љ—Д. «–У–ї–∞—Г–Ї–Њ–Љ–∞: —В–µ–Њ—А–Є—П –Є –њ—А–∞–Ї—В–Є–Ї–∞». –°–±. –љ–∞—Г—З–љ. —В—А. –°–Я–±., 2012. –°. 20–23.
3. –Р–ї–µ–Ї—Б–µ–µ–≤ –Т.–Э., –У–∞–Ј–Є–Ј–Њ–≤–∞ –Ш.–†., –Э–Є–Ї–Є—В–Є–љ –Ф.–Э. –Ь–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ї–ї–µ—В–Њ–Ї —И–ї–µ–Љ–Љ–Њ–≤–∞ –Ї–∞–љ–∞–ї–∞ —Г –±–Њ–ї—М–љ—Л—Е –њ–µ—А–≤–Є—З–љ–Њ–є –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є: –Э–∞—Г—З–љ.––њ—А–∞–Ї—В. –Ї–Њ–љ—Д. «–Т–Њ—Б—В–Њ–Ї––Ч–∞–њ–∞–і». –°–±. –љ–∞—Г—З–љ. —В—А. –£—Д–∞, 2012. –°. 165–167.
4. –Р–ї–µ–Ї—Б–µ–µ–≤ –Т.–Э., –У–∞–Ј–Є–Ј–Њ–≤–∞ –Ш.–†. –Я—А–Є–Ј–љ–∞–Ї–Є –і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Ј—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ —Г –±–Њ–ї—М–љ—Л—Е –њ–µ—А–≤–Є—З–љ–Њ–є –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є: «–Х—А–Њ—И–µ–≤—Б–Ї–Є–µ —З—В–µ–љ–Є—П»: –Ґ—А. –Т—Б–µ—А–Њ—Б. –Ї–Њ–љ—Д. –°–∞–Љ–∞—А–∞, 2012. –°. 133–135.
5. –С–∞—А—Л—И–љ–Є–Ї–Њ–≤ –Р.–Ѓ., –®–Є—И–Ї–Є–љ –Ѓ.–Т. –Я—А–Њ–≥—А–∞–Љ–Љ–Є—А–Њ–≤–∞–љ–љ–∞—П –Ї–ї–µ—В–Њ—З–љ–∞—П —Б–Љ–µ—А—В—М (–∞–њ–Њ–њ—В–Њ–Ј) // –†–Њ—Б—Б–Є–є—Б–Ї–Є–є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –ґ—Г—А–љ–∞–ї. 1996. вДЦ 1. –°. 58–61.
6. –У–∞–Ј–Є–Ј–Њ–≤–∞ –Ш.–†. –Ь–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П –Є –≥–ї–∞—Г–Ї–Њ–Љ–∞ // –У–ї–∞—Г–Ї–Њ–Љ–∞. 2012. вДЦ 4. –°. 58–64.
7. –У–∞–Ј–Є–Ј–Њ–≤–∞ –Ш.–†. –Ъ–Њ—А—А–µ–Ї—Ж–Є—П –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Ї–∞–Ї –Њ—Б–љ–Њ–≤–∞ –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—Ж–Є–Є –њ—А–Є –≥–ї–∞—Г–Ї–Њ–Љ–µ // –Ю—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –≤–µ–і–Њ–Љ–Њ—Б—В–Є. 2011. вДЦ 4. –°. 63–69.
8. –Ъ—Г—А–Њ–µ–і–Њ–≤ –Р.–Т., –Ю–≥–Њ—А–Њ–і–љ–Є–Ї–Њ–≤–∞ –Т.–Ѓ., –°–Љ–Є—А–љ–Њ–≤–∞ –Х.–Р. –Ш–Ј–Љ–µ–љ–µ–љ–Є–µ –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–є –≤ –Ї–ї–µ—В–Ї–∞—Е —В—А–∞–±–µ–Ї—Г–ї—П—А–љ–Њ–є —Б–µ—В–Є –≥–ї–∞–Ј–∞ –±–Њ–ї—М–љ—Л—Е –њ–µ—А–≤–Є—З–љ–Њ–є –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є // –Ю—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—П. 2011. вДЦ 2. –°. 8–11.
9. –Э–µ—А–Њ–µ–≤ –Т.–Т., –Ч—Г–µ–≤–∞ –Ь.–Т., –Ъ–∞–ї–∞–Љ–Ї–∞—А–Њ–≤ –У.–†. –Ь–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —А–µ—В–Є–љ–∞–ї—М–љ–Њ–є –Є—И–µ–Љ–Є–Є // –Т–µ—Б—В–љ–Є–Ї –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є. 2010. вДЦ 3. –°. 59–64.
10. –°–Є–Љ–∞–Ї–Њ–≤–∞ –†.–Р., –Т–Њ–є—В–Њ–≤–∞ –†.–Э. –°—В—А—Г–Ї—В—Г—А–љ–Њ––Њ–±–Љ–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –і—А–µ–љ–∞–ґ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –≥–ї–∞–Ј–∞ —Г –±–Њ–ї—М–љ—Л—Е –њ–µ—А–≤–Є—З–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є // –Т–µ—Б—В–љ–Є–Ї –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є. 1974. вДЦ 3. –°. 15–19.
11. Alvarado J., Murphy C., Polansky J., Juster R. Age–related changes in trabecular meshwork cellularity // Invest. Ophtalmol. Vis. Sci. 1981. Vol. 21. вДЦ 5. P. 714–727.
12. Baleriola J., Garcia–Feijoo J., Martinez–de–la–Casa J.M., –µt al. Apoptosis in the trabecular meshwork of glaucomatous patients // Mol. Vis. 2008. Vol. 18. вДЦ 4. –†. 1513–1516.
13. Izzotti A., Sacca S.C., Longobardi M., Cartiglia C. Mitochondrial damage in the trabecular meshwork of patients with glaucoma // Arch. ophthalmol. 2010. Vol. 128. вДЦ 6. P. 724–730.
14. Ju W.K., Kim K.Y., Lindsey J.D. et al. Intraocular pressure elevation induces mitochondrial fission and triggers OPA1 release in glaucomatous optic nerve // Invest. Ophthalmol. Vis. Sci. 2008. Vol. 49. вДЦ 11. P. 4903–4911.
15. Kong G.Y.X., Van Bergen N.J., Trounce I.A., Crowston J.G., Mitochondrial dysfunction and glaucoma // J. Glaucoma. 2009. Vol. 18. вДЦ 2. P. 93–100.












