–Ь–µ—В–Њ–і—Л: –њ—А–Њ–≤–µ–і–µ–љ–∞ –Њ—Ж–µ–љ–Ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є, –њ—А–Њ—Ж–µ–љ—В–∞ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —Б—В–µ–њ–µ–љ–Є –Љ–µ—Б—В–љ–Њ–є —В–Ї–∞–љ–µ–≤–Њ–є —А–µ–∞–Ї—Ж–Є–Є, –∞ —В–∞–Ї–ґ–µ —Б—А–Њ–Ї–Њ–≤ —А–µ–Ј–Њ—А–±—Ж–Є–Є –±–Є–Њ—А–µ–Ј–Њ—А–±–Є—А—Г–µ–Љ–Њ–≥–Њ –Є–Љ–њ–ї–∞–љ—В–∞—В–∞ –љ–∞ –Њ—Б–љ–Њ–≤–µ –њ–Њ–ї–Є–Љ–Њ–ї–Њ—З–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –С—Л–ї–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ –≥–ї–∞—Г–Ї–Њ–Љ—Л —А–∞–Ј–ї–Є—З–љ—Л—Е —В–Є–њ–Њ–≤ —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–≥–Њ –ї–Њ—Б–Ї—Г—В–∞. –°—А–Њ–Ї–Є –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–Є –Њ—В 6 –і–Њ 12 –љ–µ–і. —Б –Љ–Њ–Љ–µ–љ—В–∞ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Њ–њ–µ—А–∞—Ж–Є–Є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л: –Њ—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М —А–µ–Ј—Г–ї—М—В–∞—В—Л 239 –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –њ–Њ –њ–Њ–≤–Њ–і—Г –≥–ї–∞—Г–Ї–Њ–Љ—Л —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Є–Љ–њ–ї–∞–љ—В–∞—В–∞ –У–ї–∞—Г—В–µ–Ї—Б. –Ю—В–Љ–µ—З–µ–љ–∞ –њ–Њ–ї–љ–∞—П —А–µ–Ј–Њ—А–±—Ж–Є—П –і—А–µ–љ–∞–ґ–∞ –≤ —Б—А–Њ–Ї 4–5 –Љ–µ—Б. –Э–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –љ–Є–Ї–∞–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –і–Є—Б–ї–Њ–Ї–∞—Ж–Є–µ–є, –Њ—В—В–Њ—А–ґ–µ–љ–Є–µ–Љ –Є–ї–Є –Є–љ–Ї–∞–њ—Б—Г–ї—П—Ж–Є–µ–є –і—А–µ–љ–∞–ґ–∞, –љ–µ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М –µ–≥–Њ —Г–і–∞–ї–µ–љ–Є–µ. –Ю—В–Љ–µ—З–∞–ї–∞—Б—М –Љ–µ—Б—В–љ–∞—П —В–Ї–∞–љ–µ–≤–∞—П —А–µ–∞–Ї—Ж–Є—П –≤–µ—А—Е–љ–µ–≥–Њ —Б–≤–Њ–і–∞ –±—Г–ї—М–±–∞—А–љ–Њ–є –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –≤ 23 —Б–ї—Г—З–∞—Пx (9,6%) –±–µ–Ј –њ—А–Є—Б–Њ–µ–і–Є–љ–µ–љ–Є—П –≤—В–Њ—А–Є—З–љ–Њ–є —Д–ї–Њ—А—Л, –њ–Њ —В–Є–њ—Г –∞—Б–µ–њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П. –Ф–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є—П –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –≤ 12 —Б–ї—Г—З–∞—П—Е (5,0%) –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ, –≤ 15 —Б–ї—Г—З–∞—П—Е (6,3%) – –≤ –њ–Њ–Ј–і–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ. –Я—А–Њ–≤–µ–і–µ–љ–Є–µ –і–µ—Б—Ж–µ–Љ–µ—В–Њ–≥–Њ–љ–Є–Њ–њ—Г–љ–Ї—В—Г—А—Л –≤ 51 —Б–ї—Г—З–∞–µ (26,8% –Њ—В –Њ–±—Й–µ–≥–Њ —З–Є—Б–ї–∞ –Њ–њ–µ—А–∞—Ж–Є–є –љ–µ–њ—А–Њ–љ–Є–Ї–∞—О—Й–µ–≥–Њ —В–Є–њ–∞ –њ–Њ –њ–Њ–≤–Њ–і—Г –≥–ї–∞—Г–Ї–Њ–Љ—Л) –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б–Њ—Е—А–∞–љ–Є—В—М –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б –≤ –њ—А–µ–і–µ–ї–∞—Е –љ–Њ—А–Љ—Л –љ–∞ –≤–µ—Б—М –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П. –Т 2-—Е —Б–ї—Г—З–∞—П—Е –≤—Л—П–≤–ї–µ–љ–Њ –≤—Б—В–∞–≤–ї–µ–љ–Є–µ –Ї–Њ—А–љ—П —А–∞–і—Г–ґ–Ї–Є –≤–Њ –≤–љ—Г—В—А–µ–љ–љ—О—О —Д–Є—Б—В—Г–ї—Г, —З—В–Њ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ: –Є–Љ–њ–ї–∞–љ—В–∞—В –У–ї–∞—Г—В–µ–Ї—Б –њ—А–Њ—Б—В –≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є, –њ–Њ–і—Е–Њ–і–Є—В –і–ї—П –ї—О–±–Њ–≥–Њ —В–Є–њ–∞ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –њ–Њ –њ–Њ–≤–Њ–і—Г –≥–ї–∞—Г–Ї–Њ–Љ—Л —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–≥–Њ –ї–Њ—Б–Ї—Г—В–∞. –Ь–∞—В–µ—А–Є–∞–ї –Є–Љ–њ–ї–∞–љ—В–∞—В–∞ –Њ–±–ї–∞–і–∞–µ—В —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –±–Є–Њ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ—Б—В–Є. –Ю—В–Љ–µ—З–∞–µ—В—Б—П –њ–Њ–ї–љ–∞—П —А–µ–Ј–Њ—А–±—Ж–Є—П –і—А–µ–љ–∞–ґ–∞ –≤ –Ј–∞—П–≤–ї–µ–љ–љ—Л–µ —Б—А–Њ–Ї–Є.
–Ъ–ї—О—З–µ–≤—Л–µ —Б–ї–Њ–≤–∞: —Е–Є—А—Г—А–≥–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л, –У–ї–∞—Г—В–µ–Ї—Б, –±–Є–Њ—А–µ–Ј–Њ—А–±–Є—А—Г–µ–Љ—Л–є –і—А–µ–љ–∞–ґ.
Abstract
The russian experience of glaucoma surgery using Glautex implant
Alekseev I.B., Abrosimova E.V., Adleiba O,A,, Arkhipov A.N., Apyakin A.P., Afonina E.V., Babushkin A.Ae., Bikbov M.M., Boris N. A.,
Volik E.I., Volik S.A., Golushkov G.A.,
Gamzaev M.G., Zhukov S.S., Zelentsov K.S., Karlova E.V., Kozlova M.I., Molotkov I.A.,
Maximov V.Yu., Novokreshchenov A.V.,
Orenburkina O.I., Radaykina M.V., Rahvanov V.V., Slonimskii A.Yu., Tishchenko O.N., Schawa A.I.
Purpose: to evaluate the effect of bioresorbable polylactic acid implant Glautex.
Methods: we have evaluated the effect, percentage of complications, degree of local tissue reaction, time of total resorption of the implant. Surgical treatment was carried out in patients with various types of glaucoma with a formation of a scleral flap. Follow-up lasted from 6 to 12 weeks after surgery.
Results: 239 cases of glaucoma surgery using Glautex were evaluated . The study involved 11 clinics in the Russian Federation. Complete resorption of the drainage during 4-5 months was registered. There were no complications related to a dislocation, rejection or encapsulation. The removal of the drainage was not required. There was a local tissue reaction of the anterior fornix of bulbar conjunctiva in 23 cases (9.6%) without joining of secondary flora (aseptic inflammation). Decompensation was observed in 12 cases (5.0%) in the early postoperative period. Decompensation in the late postoperative period was observed in 15 cases (6.3%). In 2 cases iris root insertion into the internal fistula was detected, which required re-intervention.
Conclusion: Glautex is easy in its usage, suitable for any type of glaucoma surgery with the formation of the scleral flap. Glautex material has the properties of biocompatibility and is resorbed in short term period.
Key words: glaucoma surgery, Glautex, bioresorbable drainage.
–Ю—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–∞—П –≥–ї–∞—Г–Ї–Њ–Љ–∞ – —Н—В–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–∞—П –љ–µ–є—А–Њ–њ–∞—В–Є—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ–Њ—В–µ—А–Є –≥–∞–љ–≥–ї–Є–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б–µ—В—З–∞—В–Ї–Є, –Ї–Њ—В–Њ—А–∞—П –њ—А–Є–≤–Њ–і–Є—В –Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–Љ—Г –Є–Ј–Љ–µ–љ–µ–љ–Є—О –њ–Њ–ї–µ–є –Ј—А–µ–љ–Є—П. –У–ї–∞—Г–Ї–Њ–Љ–∞ –Ј–∞–љ–Є–Љ–∞–µ—В –ї–Є–і–Є—А—Г—О—Й–Є–µ –њ–Њ–Ј–Є—Ж–Є–Є –≤ —Б—В—А—Г–Ї—В—Г—А–µ –њ—А–Є—З–Є–љ —Б–ї–µ–њ–Њ—В—Л –≤ —А–∞–Ј–≤–Є—В—Л—Е —Б—В—А–∞–љ–∞—Е [13, 15, 17]. –†—П–і –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –і–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П (–Т–У–Ф) —Г–Љ–µ–љ—М—И–∞–µ—В —А–Є—Б–Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ–∞—В–Њ–Ј–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ [16]. –Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Т–У–Ф –≤ —Б–ї—Г—З–∞–µ –≥–ї–∞—Г–Ї–Њ–Љ—Л –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П —В–∞–Ї–ґ–µ —Г–Љ–µ–љ—М—И–∞–µ—В —А–Є—Б–Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ–∞—В–Њ–Ј–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ [8].
–Ы–µ—З–µ–љ–Є–µ –≥–ї–∞—Г–Ї–Њ–Љ—Л –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –љ–∞ c–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –Ї–∞–Ї –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л–Љ, —В–∞–Ї –Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–Љ –њ—Г—В–µ–Љ [5, 14]. –Ъ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О –≥–ї–∞—Г–Ї–Њ–Љ—Л –њ—А–Є–±–µ–≥–∞—О—В –≤ —Б–ї—Г—З–∞–µ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є –ї–∞–Ј–µ—А–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П [6].
–°—А–∞—Й–µ–љ–Є–µ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–Њ–≥–Њ –ї–Њ—Б–Ї—Г—В–∞ —Б–Ї–ї–µ—А—Л –Є —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–≥–Њ –ї–Њ–ґ–∞ —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –≤–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е –љ–µ–њ—А–Њ–љ–Є–Ї–∞—О—Й–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є, –∞ –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Б–Є–љ—Г—Б–Њ—В—А–∞–±–µ–Ї—Г–ї–Њ—Н–Ї—В–Њ–Љ–Є–Є –Њ—В–Љ–µ—З–∞–µ—В—Б—П –≤ 48% —Б–ї—Г—З–∞–µ–≤. –†—Г–±—Ж–µ–≤–∞–љ–Є–µ —Д–Є–ї—М—В—А–∞—Ж–Є–Њ–љ–љ–Њ–є –њ–Њ–і—Г—И–Ї–Є –њ–Њ—Б–ї–µ —Б–Є–љ—Г—Б–Њ—В—А–∞–±–µ–Ї—Г–ї–Њ—Н–Ї—В–Њ–Љ–Є–Є –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –≤ 18,7% —Б–ї—Г—З–∞–µ–≤, –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Ј–∞—А–∞—Й–µ–љ–Є–µ –≤–љ—Г—В—А–µ–љ–љ–µ–є —Д–Є—Б—В—Г–ї—Л – –≤ 16,6%, –∞ —А—Г–±—Ж–µ–≤–∞–љ–Є–µ —Д–Є–ї—М—В—А–∞—Ж–Є–Њ–љ–љ–Њ–є –њ–Њ–і—Г—И–Ї–Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Ј–∞—А–∞—Й–µ–љ–Є–µ–Љ —Д–Є—Б—В—Г–ї—Л – –≤ 16,6% [1].
–Ш–Ј —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є—Е –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М —Б–њ–Њ—Б–Њ–±–Њ–≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є–Ј–±—Л—В–Њ—З–љ–Њ–≥–Њ —А—Г–±—Ж–µ–≤–∞–љ–Є—П –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ –Њ—В–і–∞–µ—В—Б—П –Є–Љ–њ–ї–∞–љ—В–∞—В–∞–Љ –Є–Ј —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤. –Ф–ї–Є—В–µ–ї—М–љ—Л–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є–є –і–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Њ—Ж–µ–љ–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–∞–ґ–і–Њ–≥–Њ –Є–Ј –љ–Є—Е.
–Ґ–∞–Ї, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞—Г—В–Њ–і—А–µ–љ–∞–ґ–µ–є —Б–≤—П–Ј–∞–љ–Њ —Б —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Љ–∞–Ї—А–Њ—Д–∞–≥–∞–ї—М–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є –≤ –Њ–±–ї–∞—Б—В–Є —Д–Є–ї—М—В—А–∞—Ж–Є–Є —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –Ј–∞–Љ–µ—Й–µ–љ–Є–µ–Љ –∞—Г—В–Њ—В–Ї–∞–љ–Є –љ–∞ —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ—В–Ї–∞–љ–љ—Л–є —А—Г–±–µ—Ж [19]. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–ї–ї–Њ- –Є –Ї—Б–µ–љ–Њ–і—А–µ–љ–∞–ґ–µ–є —Б–Њ–њ—А—П–ґ–µ–љ–Њ —Б–Њ —Б–ї–Њ–ґ–љ–Њ—Б—В—П–Љ–Є –Ј–∞–±–Њ—А–∞ –Є —Е—А–∞–љ–µ–љ–Є—П –і–Њ–љ–Њ—А—Б–Ї–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Є, —Б–∞–Љ–Њ–µ –≥–ї–∞–≤–љ–Њ–µ, —Б –Є–Љ–Љ—Г–љ–Њ–∞–ї–ї–µ—А–≥–Є–Ј–Є—А—Г—О—Й–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–Њ–≤ –љ–∞ —В–Ї–∞–љ–Є –≥–ї–∞–Ј–∞ [3].
–Ю—В—Б—Г—В—Б—В–≤–Є–µ –Є–Љ–Љ—Г–љ–Њ–≥–µ–љ–љ–Њ—Б—В–Є —П–≤–ї—П–µ—В—Б—П –љ–µ–Љ–∞–ї–Њ–≤–∞–ґ–љ—Л–Љ –і–Њ—Б—В–Њ–Є–љ—Б—В–≤–Њ–Љ –і—А–µ–љ–∞–ґ–µ–є –Є–Ј —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є—Е –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤. –Ю–і–љ–∞–Ї–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Њ–і–љ–Є—Е –Є–Ј –љ–Є—Е (—В—А—Г–±—З–∞—В—Л–µ —Б–Є–ї–Є–Ї–Њ–љ–Њ–≤—Л–µ, Molteno, Baerveldt) –≤ —Б–≤—П–Ј–Є —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П —В–Њ–Ї—Г –ґ–Є–і–Ї–Њ—Б—В–Є –њ–Њ –і—А–µ–љ–∞–ґ—Г –≤–µ–і–µ—В –Ї —А–∞–Ј–≤–Є—В–Є—О —Б—В–Њ–є–Ї–Њ–є –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –≥–Є–њ–Њ—В–Њ–љ–Є–Є [12,13], –і—А—Г–≥–Є–µ –і—А–µ–љ–∞–ґ–Є (Krupin-Denver, Ahmed), –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –љ–∞–ї–Є—З–Є–µ –Ї–ї–∞–њ–∞–љ–љ–Њ–≥–Њ —Г—Б—В—А–Њ–є—Б—В–≤–∞, –љ–µ —А–µ—И–∞—О—В –њ—А–Њ–±–ї–µ–Љ—Л –Є–Ј–±—Л—В–Њ—З–љ–Њ–є —Д–Є–ї—М—В—А–∞—Ж–Є–Є, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–µ—А–µ–і–Ї–Њ –Є–љ–Є—Ж–Є–Є—А—Г—О—В —Д–Є–±—А–Њ–Ј–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –њ—А–Њ—Б–≤–µ—В–µ –і—А–µ–љ–∞–ґ–∞ [10, 12]. –Я–Њ –њ—А–Є—З–Є–љ–µ –љ–µ—Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є—П —Н–ї–∞—Б—В–Є—З–љ–Њ—Б—В–Є –Є–Љ–њ–ї–∞–љ—В–∞—В–∞ —В–Ї–∞–љ—П–Љ –≥–ї–∞–Ј–∞ –і—А–µ–љ–∞–ґ–Є –Љ–Њ–≥—Г—В –і–Є—Б–ї–Њ—Ж–Є—А–Њ–≤–∞—В—М—Б—П, –∞ —В–∞–Ї–ґ–µ —Б–њ–Њ—Б–Њ–±–љ—Л –њ—А–Є–≤–µ—Б—В–Є –Ї –љ–∞—А—Г—И–µ–љ–Є—О —Д—Г–љ–Ї—Ж–Є–є —Н–Ї—Б—В—А–∞–Њ–Ї—Г–ї—П—А–љ—Л—Е –Љ—Л—И—Ж [16, 17].
–Ь–Є–љ–Є-—И—Г–љ—В Ex-press –Њ–±–µ—Й–∞–µ—В —Б—В–Њ–є–Ї–Є–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В, –Њ–і–љ–∞–Ї–Њ –њ–Њ—Б–ї–µ–і–љ–Є–µ –і–∞–љ–љ—Л–µ –≥–Њ–≤–Њ—А—П—В –Њ —В–Њ–Љ, —З—В–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П —В–Њ–ї—М–Ї–Њ —Г 57–63% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –њ–µ—А–≤—Л–µ 5 –ї–µ—В –љ–∞–±–ї—О–і–µ–љ–Є—П. –Р —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ –Є –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–є –љ–µ–µ–≤—А–Њ–њ–µ–Њ–Є–і–љ–Њ–є —А–∞—Б—Л —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–љ–Є–ґ–∞–µ—В—Б—П –і–Њ 42% –≤ –њ–µ—А–≤—Л–µ 5 –ї–µ—В –љ–∞–±–ї—О–і–µ–љ–Є—П [7].
–С–Є–Њ–і–µ—Б—В—А—Г–Ї—В–Є—А—Г–µ–Љ—Л–µ –і—А–µ–љ–∞–ґ–Є –Є –≥–Є–∞–ї—Г—А–Њ–љ–∞—В –љ–∞—В—А–Є—П, –њ–Њ–і–≤–µ—А–≥–∞—П—Б—М —А–µ–Ј–Њ—А–±—Ж–Є–Є —Б–њ—Г—Б—В—П 1–3 –Љ–µ—Б. –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є, –љ–µ –њ—А–Њ—В–Є–≤–Њ–і–µ–є—Б—В–≤—Г—О—В —Д–Є–±—А–Њ–Ј—Г –≤ –Њ—В–і–∞–ї–µ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ [2]. –Р–Ї—В—Г–∞–ї—М–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –њ–Њ–Є—Б–Ї –љ–Њ–≤—Л—Е –њ–Њ–ї–Є–Љ–µ—А–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ –і–ї—П —Н–Ї—Б–њ–ї–∞–љ—В–Њ–і—А–µ–љ–Є—А–Њ–≤–∞–љ–Є—П –≤ —Е–Є—А—Г—А–≥–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л, —Б–Њ—З–µ—В–∞—О—Й–Є—Е –≤ —Б–µ–±–µ —В–∞–Ї–Є–µ –і–Њ—Б—В–Њ–Є–љ—Б—В–≤–∞, –Ї–∞–Ї –≤—Л—Б–Њ–Ї–∞—П –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ—Б—В—М, —Н–ї–∞—Б—В–Є—З–љ–Њ—Б—В—М, —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М –Ї —А–µ–Ј–Њ—А–±—Ж–Є–Є –≤ —А–∞–љ–љ–Є–µ —Б—А–Њ–Ї–Є –Є –≤–ї–∞–≥–Њ–њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В—М. –Ґ–∞–Ї–Є–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ, –њ–Њ –љ–∞—И–µ–Љ—Г –Љ–љ–µ–љ–Є—О, —П–≤–ї—П–µ—В—Б—П –њ–Њ–ї–Є–Љ–µ—А –љ–∞ –Њ—Б–љ–Њ–≤–µ –Љ–Њ–ї–Њ—З–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Я–Њ–ї–Є–Љ–µ—А—Л –љ–∞ –Њ—Б–љ–Њ–≤–µ –Љ–Њ–ї–Њ—З–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –≤ —В–Ї–∞–љ–µ–≤–Њ–є –Є–љ–ґ–µ–љ–µ—А–Є–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–∞—В—А–Є—Ж—Л –љ–Њ—Б–Є—В–µ–ї—П –њ—А–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Ї–ї–µ—В–Њ–Ї. –Ю–љ–Є –Њ–±–ї–∞–і–∞—О—В –≤—Б–µ–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –±–Є–Њ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ—Б—В–Є, –Њ–і–Њ–±—А–µ–љ—Л –Р–≥–µ–љ—В—Б—В–≤–Њ–Љ –њ–Њ –Ї–Њ–љ—В—А–Њ–ї—О –Ј–∞ –ї–µ–Ї–∞—А—Б—В–≤–∞–Љ–Є –Є –њ—А–Њ–і—Г–Ї—В–∞–Љ–Є –њ–Є—В–∞–љ–Є—П (FDA) –°–®–Р.
–Т 2011 –≥. –љ–∞ —А—Л–љ–Ї–µ –±—Л–ї –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –љ–Њ–≤—Л–є –±–Є–Њ—А–µ–Ј–Њ—А–±–Є—А—Г–µ–Љ—Л–є –Є–Љ–њ–ї–∞–љ—В–∞—В –љ–∞ –Њ—Б–љ–Њ–≤–µ –њ–Њ–ї–Є–Љ–Њ–ї–Њ—З–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –У–ї–∞—Г—В–µ–Ї—Б. –Х–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –њ—А–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–Љ –ї–µ—З–µ–љ–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л –ї—О–±–Њ–≥–Њ —В–Є–њ–∞ —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–Њ–≥–Њ —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–≥–Њ –ї–Њ—Б–Ї—Г—В–∞. –Т 11 –Ї–ї–Є–љ–Є–Ї–∞—Е –†–Њ—Б—Б–Є–Є –≤ —В–µ—З–µ–љ–Є–µ –≥–Њ–і–∞ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ 239 –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–∞—В–Њ–Ј–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Є–Љ–њ–ї–∞–љ—В–∞—В–∞ –У–ї–∞—Г—В–µ–Ї—Б.
–¶–µ–ї—М –љ–∞—И–µ–є —А–∞–±–Њ—В—Л – –Њ—Ж–µ–љ–Ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –±–Є–Њ—А–µ–Ј–Њ—А–±–Є—А—Г–µ–Љ–Њ–≥–Њ –Є–Љ–њ–ї–∞–љ—В–∞—В–∞ –У–ї–∞—Г—В–µ–Ї—Б –љ–∞ –Њ—Б–љ–Њ–≤–µ –њ–Њ–ї–Є–Љ–Њ–ї–Њ—З–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –њ–Њ –і–∞–љ–љ—Л–Љ –Љ—Г–ї—М—В–Є—Ж–µ–љ—В—А–Њ–≤–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–ї–Є–љ–Є–Ї–∞—Е –†–Њ—Б—Б–Є–Є.
–Ь–µ—В–Њ–і—Л
–У–ї–∞—Г—В–µ–Ї—Б –Є–Ј–≥–Њ—В–Њ–≤–ї–µ–љ –Є–Ј –Ї–Њ–Љ–њ–Њ–Ј–Є—Ж–Є–Є –љ–∞ –Њ—Б–љ–Њ–≤–µ –њ–Њ–ї–Є–Љ–Њ–ї–Њ—З–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–њ–Њ–ї–Є–ї–∞–Ї—В–Є–і–∞). –Я—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –њ–Њ—А–Є—Б—В—Г—О, –±–Є–Њ—А–µ–Ј–Њ—А–±–Є—А—Г–µ–Љ—Г—О –њ–ї–µ–љ–Ї—Г –±–µ–ї–Њ–≥–Њ —Ж–≤–µ—В–∞ —Б —Е–Њ—А–Њ—И–Є–Љ —Д–Є–ї—М—В—А—Г—О—Й–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ; –Є–Љ–µ–µ—В —Д–Њ—А–Љ—Г –њ—А—П–Љ–Њ—Г–≥–Њ–ї—М–љ–Њ–є –Љ—Г—Д—В—Л (–Ј–∞–Љ–Ї–љ—Г—В–Њ–µ –Ї–Њ–ї—М—Ж–Њ) –≤ —Б–ї–Њ–ґ–µ–љ–љ–Њ–Љ –≤–Є–і–µ —В–Њ–ї—Й–Є–љ–Њ–є 80 –Љ–Ї–Љ, –і–Є–∞–Љ–µ—В—А –њ–Њ—А – 30–50 –Љ–Ї–Љ. –У–ї–∞—Г—В–µ–Ї—Б –Є–Љ–µ–µ—В –Љ–∞–ї—Г—О —В–Њ–ї—Й–Є–љ—Г –Є –љ–µ —А–∞–Ј–±—Г—Е–∞–µ—В, –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Є–Ј–±—Л—В–Њ—З–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –љ–∞ –Њ–Ї—А—Г–ґ–∞—О—Й–Є–µ —В–Ї–∞–љ–Є.
–Ш–Љ–µ—О—В—Б—П —А–∞–Ј–ї–Є—З–љ—Л–µ —Д–Њ—А–Љ—Л –Є–Љ–њ–ї–∞–љ—В–∞—В–Њ–≤ (—А–Є—Б. 1). –Ф–ї—П —Б–Є–љ—Г—Б—В—А–∞–±–µ–Ї—Г–ї–Њ—Н–Ї—В–Њ–Љ–Є–Є –Љ–Њ–ґ–µ—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ –У–ї–∞—Г—В–µ–Ї—Б —Б –Ј—Г–±—Ж–Њ–Љ. –Т —Е–Њ–і–µ –Њ–њ–µ—А–∞—Ж–Є–Є –њ—А–Є –Є–Љ–њ–ї–∞–љ—В–∞—Ж–Є–Є –Ј—Г–±–µ—Ж –≤—Е–Њ–і–Є—В –≤–Њ –≤–љ—Г—В—А–µ–љ–љ—О—О —Д–Є—Б—В—Г–ї—Г, –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—П –µ–µ –Њ–±—В—Г—А–∞—Ж–Є—О –Ї—А–Њ–≤—М—О, —Н–Ї—Б—Б—Г–і–∞—В–Њ–Љ, —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ—М—О.
–Ю—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М 239 –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–∞—В–Њ–Ј–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Є–Љ–њ–ї–∞–љ—В–∞—В–∞ –У–ї–∞—Г—В–µ–Ї—Б, –Є–Ј –љ–Є—Е 48 –Њ–њ–µ—А–∞—Ж–Є–є –њ—А–Њ–љ–Є–Ї–∞—О—Й–µ–≥–Њ —В–Є–њ–∞ –Є 190 – –љ–µ–њ—А–Њ–љ–Є–Ї–∞—О—Й–µ–≥–Њ, 1 – —Б –µ–і–Є–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є —Г—Б—В–∞–љ–Њ–≤–Ї–Њ–є –і—А–µ–љ–∞–ґ–∞ –У–ї–∞—Г—В–µ–Ї—Б –Є —И—Г–љ—В–∞ Ex-press.
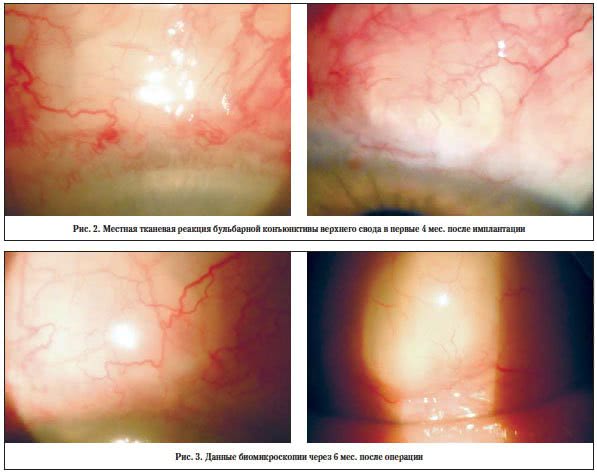
–Э–∞–±–ї—О–і–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Њ—Б—М –≤ –њ–µ—А–Є–Њ–і –Њ—В 6 –і–Њ 12 –Љ–µ—Б. –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є. –Ю—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М —Б—В–µ–њ–µ–љ—М –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є —В–Ї–∞–љ–µ–≤–Њ–є —А–µ–∞–Ї—Ж–Є–Є –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞ –≤ —А–∞–љ–љ–µ–Љ –Є –Њ—В–і–∞–ї–µ–љ–љ–Њ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ, –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –Њ–њ–µ—А–∞—Ж–Є–Є –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ —Б—А–Њ–Ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П, –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П —А–∞–љ–љ–µ–≥–Њ –Є –Њ—В–і–∞–ї–µ–љ–љ–Њ–≥–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г—З–∞—Б—В–≤–Њ–≤–∞–ї–Њ 239 —З–µ–ї–Њ–≤–µ–Ї, –Є–Ј –љ–Є—Е –ґ–µ–љ—Й–Є–љ – 117, –Љ—Г–ґ—З–Є–љ – 122.
–†–µ–Ј—Г–ї—М—В–∞—В—Л
–Т 23 —Б–ї—Г—З–∞—П—Е (9,6%) –Њ—В–Љ–µ—З–∞–ї–∞—Б—М –Љ–µ—Б—В–љ–∞—П —В–Ї–∞–љ–µ–≤–∞—П —А–µ–∞–Ї—Ж–Є—П –≤–µ—А—Е–љ–µ–≥–Њ —Б–≤–Њ–і–∞ –±—Г–ї—М–±–∞—А–љ–Њ–є –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –±–µ–Ј –њ—А–Є—Б–Њ–µ–і–Є–љ–µ–љ–Є—П –≤—В–Њ—А–Є—З–љ–Њ–є —Д–ї–Њ—А—Л, –њ–Њ —В–Є–њ—Г –∞—Б–µ–њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П (—А–Є—Б. 2). –Э–Є –≤ –Њ–і–љ–Њ–Љ –Є–Ј —Б–ї—Г—З–∞–µ–≤ –љ–µ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М —Г–і–∞–ї–µ–љ–Є–µ –Є–Љ–њ–ї–∞–љ—В–∞—В–∞. –Ю—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є –Ї–∞–Ї–Є–µ-–ї–Є–±–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –і–Є—Б–ї–Њ–Ї–∞—Ж–Є–µ–є, –Њ—В—В–Њ—А–ґ–µ–љ–Є–µ–Љ –Є–ї–Є –Є–љ–Ї–∞–њ—Б—Г–ї—П—Ж–Є–µ–є –і—А–µ–љ–∞–ґ–∞. –Т 10 —Б–ї—Г—З–∞—П—Е –±—Л–ї–Є –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ—Л —А–∞—Б—Е–Њ–ґ–і–µ–љ–Є–µ —И–≤–Њ–≤ –Є –Њ–±–љ–∞–ґ–µ–љ–Є–µ –і—А–µ–љ–∞–ґ–∞. –Ю–і–љ–∞–Ї–Њ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —И–≤–∞ 10-0 –љ–µ—Б–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–≥–Њ —И–≤–∞ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ –љ–µ –±—Л–ї–Њ.
–Я—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –Њ–њ–µ—А–∞—Ж–Є–Є –њ—А–Њ–љ–Є–Ї–∞—О—Й–µ–≥–Њ —В–Є–њ–∞ –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –≤—Л—П–≤–ї–µ–љ—Л 4 —Б–ї—Г—З–∞—П (8,1%) –њ–ї–Њ—Б–Ї–Њ–є –Њ—В—Б–ї–Њ–є–Ї–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є, –Ї–Њ—В–Њ—А—Л–µ –љ–µ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞. –Т –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –Њ–њ–µ—А–∞—Ж–Є–Є –љ–µ–њ—А–Њ–љ–Є–Ї–∞—О—Й–µ–≥–Њ —В–Є–њ–∞, –±—Л–ї –≤—Л—П–≤–ї–µ–љ 1 (0,5%) —Б–ї—Г—З–∞–є –њ–ї–Њ—Б–Ї–Њ–є –Њ—В—Б–ї–Њ–є–Ї–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є.
–Э–∞–±–ї—О–і–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –≤ —Б–ї—Г—З–∞–µ –Њ–њ–µ—А–∞—Ж–Є–Є –њ—А–Њ–љ–Є–Ї–∞—О—Й–µ–≥–Њ —В–Є–њ–∞ –≤—Л—П–≤–Є–ї–Њ 4 —Б–ї—Г—З–∞—П (9,5%) –њ–Њ–≤—Л—И–µ–љ–Є—П –Т–У–Ф, —З—В–Њ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Љ–µ—Б—В–љ–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є. 51 –њ–∞—Ж–Є–µ–љ—В—Г (26%) –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є –љ–µ–њ—А–Њ–љ–Є–Ї–∞—О—Й–µ–≥–Њ —В–Є–њ–∞ –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 6 –Љ–µ—Б. –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –ї–∞–Ј–µ—А–љ–Њ–є –і–µ—Б—Ж–µ–Љ–µ—В–Њ–≥–Њ–љ–Є–Њ–њ—Г–љ–Ї—В—Г—А—Л (–Ф–У–Я), —З—В–Њ –њ—А–Є–≤–µ–ї–Њ –Ї —Б—В–Њ–є–Ї–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –љ–∞ –≤–µ—Б—М –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П. –Т 2-—Е —Б–ї—Г—З–∞—П—Е –њ–Њ—Б–ї–µ –Ф–У–Я –њ—А–Њ–Є–Ј–Њ—И–ї–Њ –≤—Б—В–∞–≤–ї–µ–љ–Є–µ –Ї–Њ—А–љ—П —А–∞–і—Г–ґ–Ї–Є –≤–Њ –≤–љ—Г—В—А–µ–љ–љ—О—О —Д–Є—Б—В—Г–ї—Г, —З—В–Њ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ (—А–Є—Б. 5).
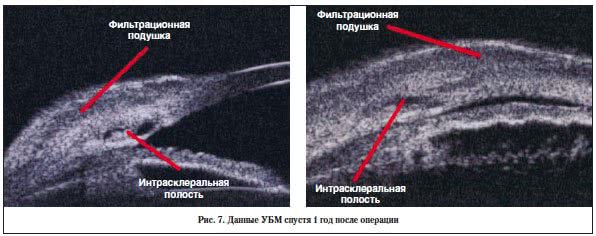
–Я–Њ–ї–љ–∞—П —А–µ–Ј–Њ—А–±—Ж–Є—П –Є–Љ–њ–ї–∞–љ—В–∞—В–∞ –У–ї–∞—Г—В–µ–Ї—Б –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –≤ —Б—А–Њ–Ї 4–5 –Љ–µ—Б. –њ–Њ—Б–ї–µ –µ–≥–Њ —Г—Б—В–∞–љ–Њ–≤–Ї–Є, —З—В–Њ —В–∞–Ї–ґ–µ –≤–Є–і–љ–Њ –њ–Њ –і–∞–љ–љ—Л–Љ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–є –±–Є–Њ–Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є–Є (–£–С–Ь) (—А–Є—Б. 6, 7).
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ш–Љ–њ–ї–∞–љ—В–∞—В –У–ї–∞—Г—В–µ–Ї—Б —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –≤ —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е –Ї–ї–Є–љ–Є–Ї–∞—Е –±–Њ–ї–µ–µ 2-—Е –ї–µ—В, –њ—А–Њ—Б—В –≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Є –љ–µ —Г—Б–ї–Њ–ґ–љ—П–µ—В —Е–Њ–і —Б–∞–Љ–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є. –Я—А–Є–Љ–µ–љ—П–µ—В—Б—П –≤ —Е–Њ–і–µ –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–∞—В–Њ–Ј–љ–Њ–є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є –ї—О–±–Њ–≥–Њ —В–Є–њ–∞ —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–≥–Њ –ї–Њ—Б–Ї—Г—В–∞. –°–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О —Д–Є–ї—М—В—А–∞—Ж–Є–Њ–љ–љ–Њ–є –њ–Њ–і—Г—И–Ї–Є, —В. –Ї. —Б—А–Њ–Ї–Є –њ–Њ–ї–љ–Њ–є —А–µ–Ј–Њ—А–±—Ж–Є–Є –Є–Љ–њ–ї–∞–љ—В–∞—В–∞ —Б–Њ–≤–њ–∞–і–∞—О—В —Б –Њ–Ї–Њ–љ—З–∞–љ–Є–µ–Љ –Њ—Б–љ–Њ–≤–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —А—Г–±—Ж–µ–≤–∞–љ–Є—П –≤ –Ј–Њ–љ–µ –Њ–њ–µ—А–∞—Ж–Є–Є. –Ь–∞—В–µ—А–Є–∞–ї, –Є–Ј –Ї–Њ—В–Њ—А–Њ–≥–Њ –Є–Ј–≥–Њ—В–Њ–≤–ї–µ–љ –Є–Љ–њ–ї–∞–љ—В–∞—В, –Њ–±–ї–∞–і–∞–µ—В –≤—Б–µ–Љ–Є –Ї–∞—З–µ—Б—В–≤–∞–Љ–Є –±–Є–Њ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ—Б—В–Є. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є–Љ–њ–ї–∞–љ—В–∞—В–∞ –У–ї–∞—Г—В–µ–Ї—Б –≤ —Е–Њ–і–µ –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–∞—В–Њ–Ј–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –љ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –њ—А–Њ—Ж–µ–љ—В –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є; –љ–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Є–љ–Ї–∞–њ—Б—Г–ї—П—Ж–Є–Є –Є–Љ–њ–ї–∞–љ—В–∞—В–∞ –Є–ї–Є –µ–≥–Њ –і–Є—Б–ї–Њ–Ї–∞—Ж–Є–Є –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —И–Њ–≤–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ 10-0 –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Ј–±–µ–ґ–∞—В—М —А–∞—Б—Е–Њ–ґ–і–µ–љ–Є—П –Ї—А–∞–µ–≤ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –Є –Њ–±–љ–∞–ґ–µ–љ–Є—П –і—А–µ–љ–∞–ґ–∞ –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ.
–Я—А–Њ—Б—В–Њ—В–∞ –Є–Љ–њ–ї–∞–љ—В–∞—Ж–Є–Є, –љ–∞–і–µ–ґ–љ–Њ—Б—В—М –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —И–Є—А–Њ–Ї–Њ–Љ—Г –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Є–Љ–њ–ї–∞–љ—В–∞—В–∞ –У–ї–∞—Г—В–µ–Ї—Б –≤ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ї–ї–Є–љ–Є–Ї–∞—Е –†–Њ—Б—Б–Є–Є.




–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Ш–Љ—И–µ–љ–µ—Ж–Ї–∞—П –Ґ.–Р., –°–Є—В–љ–Є–Ї –У.–Т., –Т–∞—И–Ї–µ–≤–Є—З –У.–Т. –°–Є–љ—Г—Б–Њ—В—А–∞–±–µ–Ї—Г–ї–Њ—Н–Ї—В–Њ–Љ–Є—П —Б –Є–љ—В—А–∞—Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–є –Є —Н–њ–Є—Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–є –∞–Љ–љ–Є–Њ–њ–ї–∞—Б—В–Є–Ї–Њ–є. –Ь–µ—В–Њ–і–Є—З–µ—Б–Ї–Њ–µ –њ–Њ—Б–Њ–±–Є–µ. –Ь–Є–љ—Б–Ї, 2010.
2. –І–µ–≥–ї–∞–Ї–Њ–≤ –Ѓ.–Р., –Ъ–∞–і—Л–Љ–Њ–≤–∞ –§.–≠., –Ъ–Њ–њ–∞–µ–≤–∞ –°.–Т. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≥–ї—Г–±–Њ–Ї–Њ–є —Б–Ї–ї–µ—А—Н–Ї—В–Њ–Љ–Є–Є —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –і—А–µ–љ–∞–ґ–∞ –Є–Ј –≥–Є–і—А–Њ–≥–µ–ї—П –≤ –Њ—В–і–∞–ї–µ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –љ–∞–±–ї—О–і–µ–љ–Є—П // –Ю—Д—В–∞–ї—М–Љ–Њ—Е–Є—А—Г—А–≥–Є—П. 1990. вДЦ 2. –°. 29–31.
3. –І–µ–≥–ї–∞–Ї–Њ–≤ –Ѓ.–Р., –Ь–Њ—А–Њ–Ј –Ч.–Ш., –Ъ–∞–і—Л–Љ–Њ–≤–∞ –§.–≠. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≥–ї—Г–±–Њ–Ї–Њ–є —Б–Ї–ї–µ—А—Н–Ї—В–Њ–Љ–Є–Є —Б —Н–Ї—Б–њ–ї–∞–љ—В–Њ–і—А–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Є —Г–≤–µ–∞–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–µ / –°–±. —Б—В–∞—В–µ–є: –Р–Ї—В—Г–∞–ї—М–љ—Л–µ –њ—А–Њ–±–ї–µ–Љ—Л —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л. –Ь., 1989. –°. 153–159.
4. Boswell C.A., Noecker R.J., Mac M. et al. Evaluation of aqueous drainage glaucoma device constructed of e-PTFE // J. Biomed. Mater. Res. 1999. Vol. 48. вДЦ 5. P. 591–595.
5. Caprioli J., Coleman A.L. Intraocular pressure fluctuation a risk factor for visual field progression at low intraocular pressures in the Advanced Glaucoma Intervention Study // Ophthalmology. 2008. Vol. 115. вДЦ 7. P. 1123–1129.
6. Classen L., Kiveld –Ґ., Tarkkanen A. Histopathological and immunohisto-chemical analysis of the filtration bleb after unsuccessful glaucoma seton implantation // Am. J. Ophthalmol. 1996 Aug. Vol. 122. вДЦ 2. P. 205–212.
7. Mariotti C., Dahan E., Nicolai M., Levitz L., Bouee S. Long-term outcomes and risk factors for failure with the EX-press glaucoma drainage device // Eye. 2014. Vol. 28. P.1–8.
8. Collaborative Normal-Tension Glaucoma Study Group. Comparison of glaucomatous progression between untreated patients with normaltension glaucoma and patients with therapeutically reduced intraocular pressures // Am. J. Ophtalmol. 1998. Vol. 126. вДЦ 4. P. 487–497.
9. European Glaucoma Society // Terminology and Guidelines for Glaucoma. 3rd ed.
10. Feldmann R.M., El Harazi S.M., Villanueva G. Valve membrane adhesion as a cause of Ahmed glaucoma valve failure // J. Glaucoma. 1997 Feb. Vol. 6. вДЦ 1. P. 10–12.
11. Greenfield D.S., Tello C., Budenz D.L. et al. Aqueous misdirection after glaucoma drainage device implantation // Ophthalmology. 1999 May. Vol. 106. вДЦ 5. P. 1035–1040.
12. Gil Carrasco F., Salinas Vanorman E., Ricillas Gispert C. et al. Ahmed valve implant for uncontrolled uveitic glaucoma // Ocul. Immunol. Inflamm. 1988 Mar. Vol. 6. вДЦ 1. P. 27–37.
13. Henson D.B., Thampy R. Preventing blindness from glaucoma // B. M. J. 2005. Vol. 331. вДЦ 7509. P. 120–121.
14. Keltner J.L., Miller J.P., Parrish R.K. 2nd, Wilson M.R., Kass M.A. The Ocular Hypertension Treatment Study: Baseline factors that predict the onset of primary open-angle glaucoma // Arch.Ophthalmol. 2002. Vol. 120. вДЦ 6. P. 714–720.
15. Kingman S. Glaucoma is second leading cause of blindness globally // Bull.World Health. 2004. Vol. 82. вДЦ 11. P. 887–888.
16. Leske M.C., Heijl A., Hussein M. et al. Factors for glaucoma progression and the effect of treatment: the early manifest glaucoma trial // Arch.Ophthalmol. 2003. Vol. 121. вДЦ 1. P. 48–56.
17. Quigley H.A., Broman A.T. The number of people with glaucoma worldwide in 2010 and 2020 // B. M. G. 2006. Vol. 90. вДЦ 3. P. 262–267.
18. Zalloum J.N., Ahuja R.M., Shin D., Weiss J.S. Assessment of corneal decompensation in eyes having undergone Molteno shunt procedures compared to eyes having undergone trabeculectomy // CLAOJ. 1999 Jan. Vol. 25. вДЦ 1. P. 57–60.
19. Woltman W. Nebenwirkungen und Risiken der medikamentosen Glaucom-therapie // Z. Prakt. Augenheilk. 1980. Vol. 6. вДЦ 6. P. 347–349.












