–Р–Ї—В—Г–∞–ї—М–љ–Њ—Б—В—М
–Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М —Д–µ—А–Љ–µ–љ—В–Њ—В–µ—А–∞–њ–Є—П –њ—А–Њ—З–љ–Њ –≤–Њ—И–ї–∞ –≤ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г. –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –У–µ–Љ–∞–Ј–∞ –љ–∞ –Њ—Б–љ–Њ–≤–µ —А–µ–Ї–Њ–Љ–±–Є–љ–∞–љ—В–љ–Њ–є –њ—А–Њ—Г—А–Њ–Ї–Є–љ–∞–Ј—Л (–†–Я–£) —Г—Б–њ–µ—И–љ–Њ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –≤ –Ї–ї–Є–љ–Є–Ї–µ –і–ї—П –ї–µ—З–µ–љ–Є—П —Д–Є–±—А–Є–љ–Њ–Є–і–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, –≥–Є—Д–µ–Љ—Л, –∞ —В–∞–Ї–ґ–µ –≥–µ–Љ–Њ—Д—В–∞–ї—М–Љ–∞ [1вАУ3]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–∞–Ї–Њ–њ–ї–µ–љ –±–Њ–ї—М—И–Њ–є –Њ–њ—Л—В –Є–љ—В—А–∞–≤–Є—В—А–µ–∞–ї—М–љ–Њ–≥–Њ [4вАУ7] –Є —Б—Г–±–Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –У–µ–Љ–∞–Ј–∞ [8, 9]. –Ю–і–љ–∞–Ї–Њ –і–∞–љ–љ—Л–µ –Љ–µ—В–Њ–і—Л –≤–≤–µ–і–µ–љ–Є—П –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–∞ –±–∞–Ј–µ —Б—В–∞—Ж–Є–Њ–љ–∞—А–Њ–≤. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –љ—Г–ґ–і–∞–µ–Љ–Њ—Б—В—М –≤ —Д–Є–±—А–Є–љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Є–Љ–µ–µ—В—Б—П –Є –≤ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ-–њ–Њ–ї–Є–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –Ј–≤–µ–љ–µ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Ї–µ—А–∞—В–Є—В–Њ–≤, –Є—А–Є–і–Њ—Ж–Є–Ї–ї–Є—В–Њ–≤, —Г–≤–µ–Є—В–Њ–≤, –њ–Њ—Б–ї–µ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Є—Е –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є—П—Е –і–ї—П —Г–ї—Г—З—И–µ–љ–Є—П –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –і–µ—В–∞–ї–µ–є –≥–ї–∞–Ј–љ–Њ–≥–Њ –і–љ–∞ –њ–µ—А–µ–і –њ–∞–љ—А–µ—В–Є–љ–∞–ї—М–љ–Њ–є –ї–∞–Ј–µ—А–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–µ–є. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –Є–љ–≤–∞–Ј–Є–≤–љ—Л–µ –Љ–µ—В–Њ–і—Л –≤–≤–µ–і–µ–љ–Є—П —З–∞—Б—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—В—Б—П –±–Њ–ї—М—О –Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є –≤ –≤–Є–і–µ —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є–є (1,5вАУ1,7% —Б–ї—Г—З–∞–µ–≤), —А—Г–±—Ж–µ–≤–∞–љ–Є—П (0,6вАУ0,75%) –Є–ї–Є –љ–µ–Ї—А–Њ–Ј–∞ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –≤ –Љ–µ—Б—В–µ –Є–љ—К–µ–Ї—Ж–Є–є (0,06вАУ0,075%), –∞ —В–∞–Ї–ґ–µ –њ—А–Њ–±–Њ–і–µ–љ–Є–µ–Љ –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞ (0,003вАУ0,006%) [10]. –Э–∞—А—П–і—Г —Б —Н—В–Є–Љ –Є–Љ–µ—О—В—Б—П —Г–±–µ–і–Є—В–µ–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ —Е–Њ—А–Њ—И–µ–є –њ—А–Њ–љ–Є–Ї–∞—О—Й–µ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —А–∞—Б—В–≤–Њ—А–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –У–µ–Љ–∞–Ј–∞ –≤–Њ –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А—Л –њ—А–Є –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–∞—Е –≤–≤–µ–і–µ–љ–Є—П, —В–∞–Ї–Є—Е –Ї–∞–Ї –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є [11], —Б –њ–Њ–Љ–Њ—Й—М—О —Б—Г–±—В–µ–љ–Њ–љ–Њ–≤–Њ–є –Є–Љ–њ–ї–∞–љ—В–∞—Ж–Є–Є –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤–Њ–є –Є–љ—Д—Г–Ј–Є–Њ–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (–°–Ш–Ъ–Ш–°) [12], –∞ —В–∞–Ї–ґ–µ –Љ–µ—В–Њ–і–Њ–Љ —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–∞ [13]. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ—Л–Љ–Є —Б–њ–Њ—Б–Њ–±–∞–Љ–Є –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —В—А–Њ–Љ–±–Њ- –Є —Д–Є–±—А–Є–љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В, —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–є —Б —Н—Д—Д–µ–Ї—В–Њ–Љ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е –Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –≤–≤–µ–і–µ–љ–Є—П. –Я–Њ—Б—В–µ–њ–µ–љ–љ–Њ –љ–∞–Ї–∞–њ–ї–Є–≤–∞–µ—В—Б—П –Є –∞–љ–∞–ї–Є–Ј–Є—А—Г–µ—В—Б—П –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ –Љ–љ–Њ–≥–Є–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ, –∞ —В–∞–Ї–ґ–µ –њ—Г—В–µ–Љ —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –≤–≤–µ–і–µ–љ–Є—П. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ –љ–∞—Б—В–Њ—П—Й–Є–є –Љ–Њ–Љ–µ–љ—В –У–µ–Љ–∞–Ј–∞ –Є–Љ–µ–µ—В —И–Є—А–Њ–Ї–Є–є —Б–њ–µ–Ї—В—А –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П, –Є –Њ–љ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В —А–∞—Б—И–Є—А—П—В—М—Б—П. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л —Г—Б–Є–ї–Є—П –њ–Њ –њ–Њ–Є—Б–Ї—Г –љ–Њ–≤—Л—Е, –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –≤–≤–µ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –і–ї—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ.–¶–µ–ї—М —А–∞–±–Њ—В—Л вАУ —Б—А–∞–≤–љ–Є—В—М –і–Є–љ–∞–Љ–Є–Ї—Г –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –У–µ–Љ–∞–Ј–∞ –≤–Њ –≤–ї–∞–≥–µ –њ–µ—А–µ–і–љ–µ–є –Ї–∞–Љ–µ—А—Л (–Т–Я–Ъ) –≥–ї–∞–Ј–∞ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –≤–≤–µ–і–µ–љ–Є—П (–Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є, —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј, –љ–∞—Б—Л—Й–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –ї–µ—З–µ–±–љ—Л–µ –Љ—П–≥–Ї–Є–µ –Ї–Њ–љ—В–∞–Ї—В–љ—Л–µ –ї–Є–љ–Ј—Л (–Ы–Ь–Ъ–Ы)) —Б –њ–Њ–Љ–Њ—Й—М—О —Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—В–љ–Њ–є —Б–њ–µ–Ї—В—А–Њ—Д–Њ—В–Њ–Љ–µ—В—А–Є–Є.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Є–љ–Є–Љ–∞–ї–Є —Г—З–∞—Б—В–Є–µ –±–Њ–ї—М–љ—Л–µ, –Њ–њ–µ—А–Є—А–Њ–≤–∞–љ–љ—Л–µ –њ–Њ –њ–Њ–≤–Њ–і—Г –Ї–∞—В–∞—А–∞–Ї—В—Л –≤ –Ї–ї–Є–љ–Є–Ї–µ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є –Т–Њ–µ–љ–љ–Њ-–Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –∞–Ї–∞–і–µ–Љ–Є–Є –Є–Љ. –°.–Ь. –Ъ–Є—А–Њ–≤–∞ (–°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥). –Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –њ—А–Њ—В–Њ–Ї–Њ–ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ—В –Ї–∞–ґ–і–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ –±—Л–ї–Њ –њ–Њ–ї—Г—З–µ–љ–Њ –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ, –Њ—Д–Њ—А–Љ–ї–µ–љ–љ–Њ–µ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –ї–Њ–Ї–∞–ї—М–љ–Њ–≥–Њ —Н—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–Љ–Є—В–µ—В–∞ –Т–Ь–µ–і–Р. –Ф–ї—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ—В–±–Є—А–∞–ї–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–Є–≥–Є–і–љ—Л–Љ –Ј—А–∞—З–Ї–Њ–Љ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ—Б–µ–≤–і–Њ—Н–Ї—Б—Д–Њ–ї–Є–∞—В–Є–≤–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –ї–Є–±–Њ –њ–Њ—Б–ї–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–≥–Њ —А–∞–љ–µ–µ –Њ—Б—В—А–Њ–≥–Њ –Є—А–Є–і–Њ—Ж–Є–Ї–ї–Є—В–∞, —Г –Ї–Њ—В–Њ—А—Л—Е –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є –Љ–Њ–ґ–љ–Њ –±—Л–ї–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М –≤—Л–њ–Њ—В —Д–Є–±—А–Є–љ–∞ –≤ –≤–Є–і–µ —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –њ–µ—А–µ–і–љ–µ–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞ (Toxic anterior segment syndrome) [14вАУ16]. –Я–Њ –і–∞–љ–љ—Л–Љ –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–є –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї–∞–і–µ–Љ–Є–Є, –±–Њ–ї–µ–µ 52% –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Њ–≤ –≤ —Б–≤–Њ–µ–є –њ—А–∞–Ї—В–Є–Ї–µ —Б—В–∞–ї–Ї–Є–≤–∞–ї–Є—Б—М —Б —Н—В–Є–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –љ–µ–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Д–Є–±—А–Є–љ–Њ–Ј–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П [17].87 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (87 –≥–ї–∞–Ј) –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 3 –≥—А—Г–њ–њ—Л: –≤ 1-–є –≤–≤–µ–і–µ–љ–Є–µ –У–µ–Љ–∞–Ј—Л –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Є –њ—Г—В–µ–Љ —Д–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є (31 –≥–ї–∞–Ј), –≤–Њ 2-–є вАУ –њ—Г—В–µ–Љ —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–∞ (36 –≥–ї–∞–Ј), –≤ 3-–є вАУ —Б –њ–Њ–Љ–Њ—Й—М—О –Ы–Ь–Ъ–Ы, –љ–∞—Б—Л—Й–µ–љ–љ–Њ–є —А–∞—Б—В–≤–Њ—А–Њ–Љ –У–µ–Љ–∞–Ј—Л (20 –≥–ї–∞–Ј).
–Я—А–Њ–±—Л –Т–Я–Ъ –≥–ї–∞–Ј–∞ –њ–Њ–ї—Г—З–∞–ї–Є –≤ –љ–∞—З–∞–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є –њ—Г—В–µ–Љ –∞—Б–њ–Є—А–∞—Ж–Є–Є 0,1 –Љ–ї –≤–ї–∞–≥–Є –≤ —Б—В–µ—А–Є–ї—М–љ—Л–є –Є–љ—Б—Г–ї–Є–љ–Њ–≤—Л–є —И–њ—А–Є—Ж. –Ф–ї—П –Ї–∞–ґ–і–Њ–є –њ—А–Њ–±—Л —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–Є –≤—А–µ–Љ—П –≤ –Љ–Є–љ—Г—В–∞—Е –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –≤–≤–µ–і–µ–љ–Є—П –У–µ–Љ–∞–Ј—Л –њ–∞—Ж–Є–µ–љ—В—Г –і–Њ –Љ–Њ–Љ–µ–љ—В–∞ –Ј–∞–±–Њ—А–∞ –≤–ї–∞–≥–Є, —Б–Њ–і–µ—А–ґ–∞—Й–µ–є –≤–≤–µ–і–µ–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В.
–§–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ—Л–µ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є —А–∞—Б—В–≤–Њ—А–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є 330 –Ь–Х –≤ 1 –Љ–ї 0,9% —А–∞—Б—В–≤–Њ—А–∞ —Е–ї–Њ—А–Є–і–∞ –љ–∞—В—А–Є—П –љ–µ–њ—А–µ—А—Л–≤–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 10 –Љ–Є–љ —Б–Њ —Б–Ї–Њ—А–Њ—Б—В—М—О 30 –Ї–∞–њ–µ–ї—М –≤ –Љ–Є–љ—Г—В—Г. –Ю–±—Й–Є–є –Њ–±—К–µ–Љ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є –њ—А–µ–њ–∞—А–∞—В–∞ —Б–Њ—Б—В–∞–≤–Є–ї 15 –Љ–ї (5000 –Ь–Х –У–µ–Љ–∞–Ј—Л).
–≠–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј –њ—А–Њ–≤–Њ–і–Є–ї–Є —А–∞—Б—В–≤–Њ—А–Њ–Љ –У–µ–Љ–∞–Ј—Л –≤ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є 5000 –Ь–Х –≤ 10 –Љ–ї 0,9% —А–∞—Б—В–≤–Њ—А–∞ —Е–ї–Њ—А–Є–і–∞ –љ–∞—В—А–Є—П —З–µ—А–µ–Ј —Б–њ–µ—Ж–Є–∞–ї—М–љ—Г—О –≥–ї–∞–Ј–љ—Г—О –≤–∞–љ–љ–Њ—З–Ї—Г —Б –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –Ј–∞—А—П–ґ–µ–љ–љ–Њ–≥–Њ —Н–ї–µ–Ї—В—А–Њ–і–∞ –≤ —В–µ—З–µ–љ–Є–µ 10 –Љ–Є–љ —Б —Б–Є–ї–Њ–є —В–Њ–Ї–∞ 1 –Љ–Р (–∞–њ–њ–∞—А–∞—В –і–ї—П –≥–∞–ї—М–≤–∞–љ–Є–Ј–∞—Ж–Є–Є –Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–∞ ¬Ђ–≠–Ы–§–Ю–†-–Я–†–Ю–§¬ї, —А–µ–≥–Є—Б—В—А–∞—Ж–Є–Њ–љ–љ–Њ–µ —Г–і–Њ—Б—В–Њ–≤–µ—А–µ–љ–Є–µ вДЦ 29/06060701/2742-01 –Њ—В 30.10.2001 –≥.). –Т—Л–±–Њ—А —Н–ї–µ–Ї—В—А–Њ–і–∞ –±—Л–ї –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ –Є–Ј–Њ—Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–є —В–Њ—З–Ї–Є (pI) –†–Я–£, —Б–Њ—Б—В–∞–≤–ї—П—О—Й–µ–є 9,2вАУ9,4. –С–µ–ї–Њ–Ї —Б —В–∞–Ї–Є–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ pI –њ—А–Є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–љ–∞—З–µ–љ–Є—П—Е —А–Э 6,0вАУ7,5 –Њ–±–ї–∞–і–∞–µ—В –Њ–±—Й–Є–Љ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ –Ј–∞—А—П–і–Њ–Љ –Є –≤ –њ–Њ—Б—В–Њ—П–љ–љ–Њ–Љ —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–Љ –њ–Њ–ї–µ –і–≤–Є–ґ–µ—В—Б—П –Њ—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤ —Б—В–Њ—А–Њ–љ—Г –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ –њ–Њ–ї—О—Б–∞.
–Ф–ї—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П –Ы–Ь–Ъ–Ы –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Љ—П–≥–Ї–Є–µ –Ї–Њ–љ—В–∞–Ї—В–љ—Л–µ –ї–Є–љ–Ј—Л 1-Day Acuvue Define (–њ—А–Њ–Є–Ј–≤–Њ–і–Є—В–µ–ї—М вАУ Johnson and Johnson Vision Care, –Љ–∞—В–µ—А–Є–∞–ї вАУ —Н—В–∞—Д–Є–ї–Ї–Њ–љ A, –≤–ї–∞–≥–Њ—Б–Њ–і–µ—А–ґ–∞–љ–Є–µ вАУ 58%). –Ь–µ—В–Њ–і–Є–Ї–∞ –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П –Ы–Ь–Ъ–Ы –Ј–∞–Ї–ї—О—З–∞–ї–∞—Б—М –≤ –љ–∞—Б—Л—Й–µ–љ–Є–Є –ї–Є–љ–Ј –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ, –∞ –Є–Љ–µ–љ–љ–Њ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –У–µ–Љ–∞–Ј–∞, –њ—Г—В–µ–Љ –Є—Е –њ–Њ–Љ–µ—Й–µ–љ–Є—П –≤ —А–∞—Б—В–≤–Њ—А —Б –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є –њ—А–µ–њ–∞—А–∞—В–∞. –Э–∞—Б—Л—Й–µ–љ–Є–µ –ї–Є–љ–Ј—Л –њ—А–Њ–≤–Њ–і–Є–ї–Є –≤ —Б–ї–µ–і—Г—О—Й–µ–є –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В–Є: –ї–Є–љ–Ј—Г –Є–Ј–≤–ї–µ–Ї–∞–ї–Є –Є–Ј –Ј–∞–≤–Њ–і—Б–Ї–Њ–є —Г–њ–∞–Ї–Њ–≤–Ї–Є –Є –њ–Њ–Љ–µ—Й–∞–ї–Є –≤ 200 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –љ–∞ 2вАУ4 —З –і–ї—П –Њ—В–Љ—Л–≤–∞–љ–Є—П –Њ—В –Ї–Њ–љ—Б–µ—А–≤–Є—А—Г—О—Й–Є—Е –Є –±—Г—Д–µ—А–љ—Л—Е –і–Њ–±–∞–≤–Њ–Ї. –Ю—В–Љ—Л—В—Л–µ –ї–Є–љ–Ј—Л –њ–Њ–Љ–µ—Й–∞–ї–Є –≤ —А–∞—Б—В–≤–Њ—А –У–µ–Љ–∞–Ј—Л —В—А–µ–±—Г–µ–Љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Є–Ј —А–∞—Б—З–µ—В–∞ 2,0 –Љ–ї (5000 –Ь–Х) —А–∞—Б—В–≤–Њ—А–∞ –љ–∞ 1 –ї–Є–љ–Ј—Г –Є –Њ—Б—В–∞–≤–ї—П–ї–Є –љ–∞ 12вАУ18 —З –њ—А–Є –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ –≤ —В–µ–Љ–љ–Њ–Љ –Љ–µ—Б—В–µ. –Т –њ—А–Њ—Ж–µ—Б—Б–µ –љ–∞—Б—Л—Й–µ–љ–Є—П –ї–Є–љ–Ј–∞ –њ–Њ–≥–ї–Њ—Й–∞–ї–∞ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ—А–µ–њ–∞—А–∞—В–∞, —В. –µ. –і–Њ—Б—В–Є–≥–∞–ї–∞—Б—М —А–∞–≤–љ–Њ–≤–µ—Б–љ–∞—П –≤–µ–ї–Є—З–Є–љ–∞ —Б–Њ—А–±—Ж–Є–Є. –Ы–Є–љ–Ј–∞ 1-Day Acuvue Define –≤—Б–µ–≥–Њ –Љ–Њ–ґ–µ—В —Б–Њ—А–±–Є—А–Њ–≤–∞—В—М 1082 –Ь–Х (21,6% –У–µ–Љ–∞–Ј—Л –Њ—В –Њ–±—Й–µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞, –≤–Ј—П—В–Њ–≥–Њ –і–ї—П –љ–∞—Б—Л—Й–µ–љ–Є—П –Ы–Ь–Ъ–Ы, вАУ 5000 –Ь–Х) [18]. –Ы–Ь–Ъ–Ы, –љ–∞—Б—Л—Й–µ–љ–љ—Г—О —Г–Ї–∞–Ј–∞–љ–љ—Л–Љ —Б–њ–Њ—Б–Њ–±–Њ–Љ, –њ–Њ–Љ–µ—Й–∞–ї–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ –љ–∞ —А–∞–Ј–ї–Є—З–љ–Њ–µ –≤—А–µ–Љ—П –љ–∞ –Њ–њ–µ—А–Є—А—Г–µ–Љ—Л–є –≥–ї–∞–Ј. –Э–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–µ—А–µ–і –Ј–∞–±–Њ—А–Њ–Љ –њ—А–Њ–±—Л –Т–Я–Ъ –Ы–Ь–Ъ–Ы —Г–і–∞–ї—П–ї–Є. –Я—А–Њ–±—Л –њ–Њ–ї—Г—З–∞–ї–Є –≤ –љ–∞—З–∞–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є –њ—Г—В–µ–Љ –∞—Б–њ–Є—А–∞—Ж–Є–Є 0,1 –Љ–ї –≤–ї–∞–≥–Є –≤ —Б—В–µ—А–Є–ї—М–љ—Л–є –Є–љ—Б—Г–ї–Є–љ–Њ–≤—Л–є —И–њ—А–Є—Ж. –Ф–ї—П –Ї–∞–ґ–і–Њ–є –њ—А–Њ–±—Л —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–Є —Б—А–Њ–Ї–Є –љ–Њ—И–µ–љ–Є—П –Ы–Ь–Ъ–Ы –≤ –Љ–Є–љ—Г—В–∞—Е.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –њ—А–µ–њ–∞—А–∞—В –У–µ–Љ–∞–Ј–∞, –і–µ–є—Б—В–≤—Г—О—Й–Є–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ –Ї–Њ—В–Њ—А–Њ–≥–Њ —П–≤–ї—П–µ—В—Б—П —А–µ–Ї–Њ–Љ–±–Є–љ–∞–љ—В–љ–∞—П –њ—А–Њ—Г—А–Њ–Ї–Є–љ–∞–Ј–∞ (–†–Я–£) [19]. –У–µ–Љ–∞–Ј–∞ –≤—Л–њ—Г—Б–Ї–∞–µ—В—Б—П –≤ –≤–Є–і–µ –ї–Є–Њ—Д–Є–ї–Є–Ј–∞—В–∞ —Б –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О 5000 –Ь–Х –≤ –∞–Љ–њ—Г–ї–µ.
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –У–µ–Љ–∞–Ј—Л –Ї–∞–Ї –≤ –≤–Є–і–µ —А–∞—Б—В–≤–Њ—А–∞ –і–ї—П –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є, —В–∞–Ї –Є –њ—А–Є –њ–Њ–Љ–Њ—Й–Є —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–∞ –Є –Ы–Ь–Ъ–Ы –њ–Њ–Ї–∞ –µ—Й–µ –љ–µ –≤–љ–µ—Б–µ–љ–Њ –≤ –Є–љ—Б—В—А—Г–Ї—Ж–Є—О –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –њ—А–µ–њ–∞—А–∞—В–∞ –Є –≤—Л–њ–Њ–ї–љ—П–ї–Њ—Б—М –≤ —А–∞–Љ–Ї–∞—Е –љ–∞—Г—З–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б —А–∞–Ј—А–µ—И–µ–љ–Є—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ —Н—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–Љ–Є—В–µ—В–∞ –њ—А–Є –Т–Ь–µ–і–Р (–њ—А–Њ—В–Њ–Ї–Њ–ї –Ј–∞—Б–µ–і–∞–љ–Є—П –Ї–Њ–Љ–Є—Б—Б–Є–Є вДЦ 168 –Њ—В 17 –љ–Њ—П–±—А—П 2015 –≥.). –Я—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –і–∞–љ–љ–Њ–≥–Њ –љ–∞—Г—З–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ—В–Љ–µ—З–∞–ї–Є –љ–∞–ї–Є—З–Є–µ –Є–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л—Е –Њ—Й—Г—Й–µ–љ–Є–є –њ–∞—Ж–Є–µ–љ—В–∞ –≤ –≤–Є–і–µ –і–Є—Б–Ї–Њ–Љ—Д–Њ—А—В–∞, –ґ–ґ–µ–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Њ–є —А–µ–∞–Ї—Ж–Є–Є –≤ –≤–Є–і–µ –≥–Є–њ–µ—А–µ–Љ–Є–Є –Є –Њ—В–µ–Ї–∞ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л.
–Ф–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –њ—А–Њ–±–∞—Е –Т–Я–Ъ –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Ї–∞–ї–Є–±—А–Њ–≤–Њ—З–љ—Г—О –Ї—А–Є–≤—Г—О, –њ–Њ—Б—В—А–Њ–µ–љ–љ—Г—О –њ–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ —Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—Ж–Є–Є —А–∞—Б—В–≤–Њ—А–Њ–≤ –У–µ–Љ–∞–Ј—Л –≤ —Б—В–∞–љ–і–∞—А—В–љ—Л—Е —А–∞–Ј–≤–µ–і–µ–љ–Є—П—Е –≤ 0,9% —А–∞—Б—В–≤–Њ—А–µ —Е–ї–Њ—А–Є–і–∞ –љ–∞—В—А–Є—П.
–Ъ–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –У–µ–Љ–∞–Ј—Л –Њ–њ—А–µ–і–µ–ї—П–ї–Є –Љ–µ—В–Њ–і–Њ–Љ —Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—В–љ–Њ–є —Б–њ–µ–Ї—В—А–Њ—Д–Њ—В–Њ–Љ–µ—В—А–Є–Є –љ–∞ –∞–њ–њ–∞—А–∞—В–µ Hitachi 650-60 (–ѓ–њ–Њ–љ–Є—П) —Б —А–Э 6,0вАУ7,5. –Я—А–Є —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–Є —А–∞—Б—В–≤–Њ—А–∞ –У–µ–Љ–∞–Ј—Л —Б –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є 5000 –Ь–Х/–Љ–ї —Г—Б—В–∞–љ–Њ–≤–Є–ї–Є, —З—В–Њ –і–ї–Є–љ–∞ –≤–Њ–ї–љ—Л –≤–Њ–Ј–±—Г–ґ–і–µ–љ–Є—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В 294 –љ–Љ, –∞ –і–ї–Є–љ–∞ –≤–Њ–ї–љ—Л —Н–Љ–Є—Б—Б–Є–Є вАУ 329 –љ–Љ. –Ф–∞–ї–µ–µ –њ—А–µ–њ–∞—А–∞—В –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ —А–∞–Ј–≤–Њ–і–Є–ї–Є 0,9% —А–∞—Б—В–≤–Њ—А–Њ–Љ —Е–ї–Њ—А–Є–і–∞ –љ–∞—В—А–Є—П, —Б–љ–Є–Љ–∞—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—Ж–Є–Є –њ—А–Є –Ї–∞–ґ–і–Њ–Љ —А–∞–Ј–≤–µ–і–µ–љ–Є–Є (—В–∞–±–ї. 1).

–° –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—Ж–Є–Є —А–∞—Б—В–≤–Њ—А–Њ–≤ –У–µ–Љ–∞–Ј—Л —Б –Є–Ј–≤–µ—Б—В–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є –±—Л–ї–∞ –њ–Њ—Б—В—А–Њ–µ–љ–∞ –Ї–∞–ї–Є–±—А–Њ–≤–Њ—З–љ–∞—П –Ї—А–Є–≤–∞—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –≤–µ–ї–Є—З–Є–љ—Л —Д–ї—О–Њ—А–µ—Б—Ж–µ–љ—Ж–Є–Є –Њ—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ (—А–Є—Б. 1).
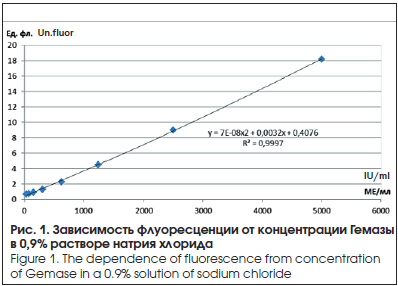
–Ф–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –±–∞–Ј–Њ–≤–Њ–є —Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—Ж–Є–Є —З–Є—Б—В–Њ–є –Т–Я–Ъ (–±–µ–Ј –≤–≤–µ–і–µ–љ–Є—П –У–µ–Љ–∞–Ј—Л) —Г 30 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–µ—А–µ–і –Њ–њ–µ—А–∞—Ж–Є–µ–є –њ–Њ –њ–Њ–≤–Њ–і—Г –Ї–∞—В–∞—А–∞–Ї—В—Л –±—Л–ї —Б–і–µ–ї–∞–љ –Ј–∞–±–Њ—А –Т–Я–Ъ –Є –Њ–њ—А–µ–і–µ–ї–µ–љ–∞ –±–∞–Ј–Њ–≤–∞—П —Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—Ж–Є—П, –Ї–Њ—В–Њ—А–∞—П –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 4¬±0,07 –µ–і. —Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—Ж–Є–Є. –≠—В—Г –≤–µ–ї–Є—З–Є–љ—Г –≤—Л—З–Є—В–∞–ї–Є –Є–Ј –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ї–∞–ґ–і–Њ–є –њ—А–Њ–±—Л, –Њ—Б—В–∞–≤—И–µ–µ—Б—П –Ј–љ–∞—З–µ–љ–Є–µ —Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—Ж–Є–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –У–µ–Љ–∞–Ј—Л —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–∞–ї–Є–±—А–Њ–≤–Њ—З–љ–Њ–є –Ї—А–Є–≤–Њ–є (—А–Є—Б. 1).
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О —Б—В–∞–љ–і–∞—А—В–љ—Л—Е –њ—А–Њ—Ж–µ–і—Г—А –≤ —Б—А–µ–і–µ Excel. –Ф–ї—П –Њ–њ–Є—Б–∞–љ–Є—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –У–µ–Љ–∞–Ј—Л –Њ—В –≤—А–µ–Љ–µ–љ–Є, –њ—А–Њ—И–µ–і—И–µ–≥–Њ –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –≤–≤–µ–і–µ–љ–Є—П, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–∞ —Н–Ї—Б–њ–Њ–љ–µ–љ—Ж–Є–∞–ї—М–љ–∞—П —А–µ–≥—А–µ—Б—Б–Є—П, –њ–∞—А–∞–Љ–µ—В—А—Л –Ї–Њ—В–Њ—А–Њ–є –≤—Л—З–Є—Б–ї—П–ї–Є—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О —Б—В–∞–љ–і–∞—А—В–љ—Л—Е —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ–і—Г—А.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Э–∞ –Њ—Б–љ–Њ–≤–µ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –У–µ–Љ–∞–Ј—Л –≤–Њ –Т–Я–Ъ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤—А–µ–Љ–µ–љ–Є, –њ—А–Њ—И–µ–і—И–µ–≥–Њ –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –µ–µ –≤–≤–µ–і–µ–љ–Є—П, –±—Л–ї–Є –њ–Њ—Б—В—А–Њ–µ–љ—Л —Н–Ї—Б–њ–Њ–љ–µ–љ—Ж–Є–∞–ї—М–љ—Л–µ –Ї—А–Є–≤—Л–µ –і–ї—П –Ї–∞–ґ–і–Њ–є –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—А–Є—Б. 2). –Т–∞–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є —А–∞—Б—В–≤–Њ—А–∞ –У–µ–Љ–∞–Ј—Л, –њ—А–Є —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–µ –Є –љ–Њ—И–µ–љ–Є–Є –Ы–Ь–Ъ–Ы –љ–µ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –ґ–∞–ї–Њ–± –љ–∞ –љ–∞–ї–Є—З–Є–µ –і–Є—Б–Ї–Њ–Љ—Д–Њ—А—В–∞ –Є–ї–Є –ґ–ґ–µ–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Њ–є —А–µ–∞–Ї—Ж–Є–Є –≤ –≤–Є–і–µ –≥–Є–њ–µ—А–µ–Љ–Є–Є –Є –Њ—В–µ–Ї–∞ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л. –Я—А–Є –Њ—Ж–µ–љ–Ї–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–µ—А–µ–і–љ–µ–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞ –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞ –≤–Њ –≤—Б–µ—Е —В—А–µ—Е –≥—А—Г–њ–њ–∞—Е –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ —А–∞–Ј–љ–Є—Ж—Л, —З—В–Њ –Ї–Њ—Б–≤–µ–љ–љ–Њ –Љ–Њ–ґ–µ—В —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞—В—М –Њ —Б–љ–Є–ґ–µ–љ–Є–Є —Д–Є–±—А–Є–љ–Њ–Є–і–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ—Б–ї–µ —Д–∞–Ї–Њ—Н–Љ—Г–ї—М—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Ї–∞—В–∞—А–∞–Ї—В—Л.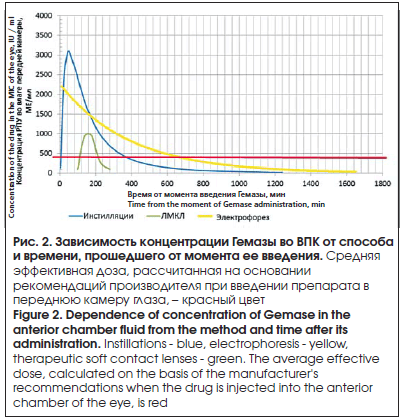
–Ч–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –У–µ–Љ–∞–Ј—Л –Њ—В –≤—А–µ–Љ–µ–љ–Є, –њ—А–Њ—И–µ–і—И–µ–≥–Њ –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –≤–≤–µ–і–µ–љ–Є—П, –Њ–њ–Є—Б—Л–≤–∞–µ—В—Б—П —Н–Ї—Б–њ–Њ–љ–µ–љ—Ж–Є–∞–ї—М–љ—Л–Љ–Є –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—П–Љ–Є —Б –≤—Л—Б–Њ–Ї–Є–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В–∞ –і–µ—В–µ—А–Љ–Є–љ–∞—Ж–Є–Є:
(1) y = 3346 e-0,006x, R2 = 0,9047 –і–ї—П –≥—А—Г–њ–њ—Л —Б —Д–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –Є–љ—Б—В–Є–ї–ї—П—Ж–Є—П–Љ–Є,
–≥–і–µ y вАУ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤–Њ –Т–Я–Ъ, x вАУ –≤—А–µ–Љ—П, –њ—А–Њ—И–µ–і—И–µ–µ –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –≤–≤–µ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞.
–Ф–ї—П –∞–њ–њ—А–Њ–Ї—Б–Є–Љ–∞—Ж–Є–Є –і–∞–љ–љ—Л—Е, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –≤ –≥—А—Г–њ–њ–µ —Б –Є–љ—Б—В–Є–ї–ї—П—Ж–Є—П–Љ–Є, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Њ –ї–Њ–≥–љ–Њ—А–Љ–∞–ї—М–љ–Њ–µ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Є –і–Њ–±–∞–≤–ї–µ–љ –њ–∞—А–∞–Љ–µ—В—А –Љ–∞—Б—И—В–∞–±–∞ b: b=633667, ќЉ=4,78, ѕГ=0,86
f(t)= b exp (-(ln(t)-ќЉ)2)
(вИЪ2ѕА ѕГt) 2ѕГ2 )
(2) y = 2270,6 e-0,003x, R2 = 0,8287 –і–ї—П –≥—А—Г–њ–њ—Л —Б —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–Њ–Љ,
–≥–і–µ y вАУ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤–Њ –Т–Я–Ъ, x вАУ –≤—А–µ–Љ—П, –њ—А–Њ—И–µ–і—И–µ–µ –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –≤–≤–µ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞.
(3) y = вАУ 0,3567x2 + 120,87x вАУ 9441,6; R2 = 0,7544 –і–ї—П –≥—А—Г–њ–њ—Л —Б –Ы–Ь–Ъ–Ы,
–≥–і–µ y вАУ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤–Њ –Т–Я–Ъ, x вАУ –≤—А–µ–Љ—П —Н–Ї—Б–њ–Њ–Ј–Є—Ж–Є–Є –ї–Є–љ–Ј—Л 1-Day Acuvue Define –љ–∞ –≥–ї–∞–Ј—Г –њ–∞—Ж–Є–µ–љ—В–∞.
–Ю–±—К–µ–Љ –Т–Я–Ъ –≥–ї–∞–Ј–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 1,23вАУ1,32 –Љ–ї –Є–ї–Є —Б–Љ3, —Б–Њ–≥–ї–∞—Б–љ–Њ –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є –њ–Њ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–Љ—Г –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –њ–µ—А–µ–і–љ—О—О –Ї–∞–Љ–µ—А—Г –≥–ї–∞–Ј–∞ –≤–≤–Њ–і—П—В 500 –Ь–Х –У–µ–Љ–∞–Ј—Л, —В–µ–Љ —Б–∞–Љ—Л–Љ —Б–Њ–Ј–і–∞–µ—В—Б—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Њ—В 406 –Ь–Х/–Љ–ї (–њ—А–Є 1,23 –Љ–ї) –і–Њ 378 –Ь–Х/–Љ–ї (–њ—А–Є 1,32 –Љ–ї), –≤ —Б—А–µ–і–љ–µ–Љ вАУ 390 –Ь–Х/–Љ–ї.
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –њ–Њ–ї—Г—З–µ–љ–љ–Њ–≥–Њ –≥—А–∞—Д–Є–Ї–∞ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –У–µ–Љ–∞–Ј—Л –≤–Њ –Т–Я–Ъ –Њ—В —Б–њ–Њ—Б–Њ–±–∞ –Є –≤—А–µ–Љ–µ–љ–Є, –њ—А–Њ—И–µ–і—И–µ–≥–Њ –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –µ–µ –≤–≤–µ–і–µ–љ–Є—П, –Љ–Њ–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М —Б–ї–µ–і—Г—О—Й–µ–µ:
вАУ –њ—А–Є —Д–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є–љ—Б—В–Є–ї–ї—П—Ж–Є—П—Е –њ—А–µ–њ–∞—А–∞—В –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤–Њ –Т–Я–Ъ –≥–ї–∞–Ј–∞ —Б 5-–є –Љ–Є–љ –њ–Њ—Б–ї–µ –≤–≤–µ–і–µ–љ–Є—П —Б –±—Л—Б—В—А—Л–Љ –љ–∞—А–∞—Б—В–∞–љ–Є–µ–Љ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ —В–µ—З–µ–љ–Є–µ 30вАУ60 –Љ–Є–љ –і–Њ 3100 –Ь–Х/–Љ–ї, –Њ–і–љ–∞–Ї–Њ –Ј–∞—В–µ–Љ –µ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П —Б –њ–µ—А–Є–Њ–і–Њ–Љ –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П, —А–∞–≤–љ—Л–Љ 160вАУ180 –Љ–Є–љ;
вАУ –њ—А–Є —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–µ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П —Б—А–∞–Ј—Г –њ–Њ—Б–ї–µ –≤–≤–µ–і–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–µ—В 2200 –Ь–Х/–Љ–ї, —Б –њ–µ—А–Є–Њ–і–Њ–Љ –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П –і–Њ 280 –Љ–Є–љ;
вАУ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Ы–Ь–Ъ–Ы –њ—А–µ–њ–∞—А–∞—В –љ–∞—З–Є–љ–∞–µ—В –Њ–њ—А–µ–і–µ–ї—П—В—М—Б—П –≤–Њ –Т–Я–Ъ —З–µ—А–µ–Ј 90вАУ100 –Љ–Є–љ –љ–Њ—И–µ–љ–Є—П –Є –і–Њ—Б—В–Є–≥–∞–µ—В –Љ–∞–Ї—Б–Є–Љ—Г–Љ–∞ 1000 –Ь–Х/–Љ–ї –Ї 160-–є –Љ–Є–љ, —Б –±—Л—Б—В—А—Л–Љ –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –Ї 250-–є –Љ–Є–љ.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–І–∞—Й–µ –≤—Б–µ–≥–Њ –њ—А–Є –ї–µ—З–µ–љ–Є–Є —Д–Є–±—А–Є–љ–Њ–Є–і–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є —Д–Є–±—А–Є–љ–Њ–ї–Є—В–Є–Ї–Є –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –ї–Њ–Ї–∞–ї—М–љ–Њ –≤ –≤–Є–і–µ –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ—Л—Е —Б—Г–±–Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ—Л—Е –Є–љ—К–µ–Ї—Ж–Є–є [11, 20], –Њ–і–љ–∞–Ї–Њ —Н—В–Њ—В –Є–љ–≤–∞–Ј–Є–≤–љ—Л–є –Љ–µ—В–Њ–і –≤–≤–µ–і–µ–љ–Є—П –≤—Л–Ј—Л–≤–∞–µ—В –±–Њ–ї–µ–≤—Л–µ –Њ—Й—Г—Й–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –њ—А–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є –∞–љ–µ—Б—В–µ–Ј–Є–Є, —Б–Њ–Ј–і–∞–µ—В –њ—А–µ–і–њ–Њ—Б—Л–ї–Ї–Є –Ї —А–∞–Ј–≤–Є—В–Є—О –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є–є –Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—О —Н–њ–Є—В–µ–ї–Є—П –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –≤ –Љ–µ—Б—В–∞—Е –≤–≤–µ–і–µ–љ–Є—П [10]. –Ь–Њ–ґ–µ—В –њ—А–Њ–Є–Ј–Њ–є—В–Є –≤—Л—Е–Њ–і –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —З–∞—Б—В–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –Є–Ј –Љ–µ—Б—В–∞ –њ—А–Њ–Ї–Њ–ї–∞ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л, —З—В–Њ –њ—А–Є–≤–µ–і–µ—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П.–†–µ–Ј—Г–ї—М—В–∞—В—Л, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ –љ–∞—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ –У–µ–Љ–∞–Ј–∞ –њ—А–Њ–љ–Є–Ї–∞–µ—В –≤–Њ –Т–Я–Ъ –њ—А–Є –≤—Б–µ—Е —В—А–µ—Е –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е —Б–њ–Њ—Б–Њ–±–∞—Е –≤–≤–µ–і–µ–љ–Є—П. –Ю–і–љ–∞–Ї–Њ –Є–Љ–µ—О—В—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є, –Ї–Њ—В–Њ—А—Л–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —В–Њ–≥–Њ –Є–ї–Є –Є–љ–Њ–≥–Њ —Б–њ–Њ—Б–Њ–±–∞.
–Я—А–Є —Д–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є–љ—Б—В–Є–ї–ї—П—Ж–Є—П—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –У–µ–Љ–∞–Ј—Л –љ–µ —Б—А–∞–Ј—Г —Б–Њ–Ј–і–∞–µ—В—Б—П –≤–Њ –Т–Я–Ъ, –Њ–і–љ–∞–Ї–Њ —З–µ—А–µ–Ј 30вАУ60 –Љ–Є–љ –Њ–љ–∞ –≤ 1,5 —А–∞–Ј–∞ –≤—Л—И–µ, —З–µ–Љ –њ—А–Є —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–µ, –љ–Њ –њ—А–Є —Н—В–Њ–Љ –њ—А–µ–њ–∞—А–∞—В –≤—Л–≤–Њ–і–Є—В—Б—П –±—Л—Б—В—А–µ–µ, —З–µ–Љ –њ—А–Є —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–µ. –≠—В–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ —Б–≤—П–Ј–∞–љ–Њ —Б —В–µ–Љ, —З—В–Њ –њ—А–Є –Є–љ—Б—В–Є–ї–ї—П—Ж–Є—П—Е –У–µ–Љ–∞–Ј–∞ —З–∞—Б—В–Є—З–љ–Њ —А–∞—Б—В–≤–Њ—А—П–µ—В—Б—П —Б–ї–µ–Ј–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В—М—О –Є —Н–ї–Є–Љ–Є–љ–Є—А—Г–µ—В—Б—П –њ–Њ —Е–Њ–і—Г —Б–ї–µ–Ј—Л.
–Я—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Ы–Ь–Ъ–Ы, –љ–∞—Б—Л—Й–µ–љ–љ–Њ–є —А–∞—Б—В–≤–Њ—А–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–∞, –≤–Њ –Т–Я–Ъ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤ 3 —А–∞–Ј–∞ –Љ–µ–љ—М—И–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є–љ—Б—В–Є–ї–ї—П—Ж–Є—П–Љ–Є –Є –≤ 2 —А–∞–Ј–∞ вАУ —Б —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–Њ–Љ. –≠—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є —Б–Њ—А–±—Ж–Є–Є –Є –і–µ—Б–Њ—А–±—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Є–Ј –Ы–Ь–Ъ–Ы, –Ї–Њ—В–Њ—А–∞—П —Б–њ–Њ—Б–Њ–±–љ–∞ —Б–Њ—А–±–Є—А–Њ–≤–∞—В—М –і–Њ 1082 –Ь–Х (21,6% —А–∞—Б—В–≤–Њ—А–µ–љ–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –њ—А–µ–њ–∞—А–∞—В–∞ 5000 –Ь–Х), –њ–Њ—Н—В–Њ–Љ—Г –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В —Н—В–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ. –Я—А–µ–њ–∞—А–∞—В –Љ–µ–і–ї–µ–љ–љ–µ–µ –њ–Њ—Б—В—Г–њ–∞–µ—В –≤ –њ–µ—А–µ–і–љ—О—О –Ї–∞–Љ–µ—А—Г, —З–µ–Љ –њ—А–Є —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–µ –Є –Є–љ—Б—В–Є–ї–ї—П—Ж–Є—П—Е. –Ф–µ—Б–Њ—А–±—Ж–Є—П –У–µ–Љ–∞–Ј—Л –Є–Ј –Ы–Ь–Ъ–Ы –Њ–њ–Є—Б—Л–≤–∞–µ—В—Б—П –ї–Є–љ–µ–є–љ–Њ–є –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М—О –Є —Г—А–∞–≤–љ–µ–љ–Є–µ–Љ:
lg (W/W0) = 0,4699 lg t вАУ 1,0709,
–≥–і–µ W0 –Є W вАУ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –У–µ–Љ–∞–Ј—Л, —Б–Њ–і–µ—А–ґ–∞—Й–µ–µ—Б—П –≤ –Ы–Ь–Ъ–Ы –і–Њ –љ–∞—З–∞–ї–∞ –Є –њ–Њ—Б–ї–µ –і–µ—Б–Њ—А–±—Ж–Є–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ;
t вАУ –≤—А–µ–Љ—П —Н–Ї—Б–њ–Њ–Ј–Є—Ж–Є–Є –Ы–Ь–Ъ–Ы –љ–∞ –≥–ї–∞–Ј—Г;
–≤–µ–ї–Є—З–Є–љ–∞ 0,4699 вАУ –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –і–Є—Д—Д—Г–Ј–Є–Є n, –Ї–Њ—В–Њ—А—Л–є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В 0,5, —З—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –і–Є—Д—Д—Г–Ј–Є–Њ–љ–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –њ–µ—А–µ–љ–Њ—Б–∞ –≤–µ—Й–µ—Б—В–≤–∞ –Є–Ј –Ы–Ь–Ъ–Ы [18].
–Я–Њ—Н—В–Њ–Љ—Г –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤—А–µ–Љ–µ–љ–Є –і–ї—П –≤—Л—Е–Њ–і–∞ –≤–µ—Й–µ—Б—В–≤–∞ –Є–Ј –Ы–Ь–Ъ–Ы –≤ —Б–ї–µ–Ј–љ—Г—О –ґ–Є–і–Ї–Њ—Б—В—М, –∞ –Ј–∞—В–µ–Љ –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –µ–µ –≤ –њ–µ—А–µ–і–љ—О—О –Ї–∞–Љ–µ—А—Г. –Я—А–Є —Н—В–Њ–Љ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –У–µ–Љ–∞–Ј—Л –≤–Њ –Т–Я–Ъ –Ј–∞–≤–Є—Б–Є—В –Њ—В —Б–Њ—А–±—Ж–Є–Њ–љ–љ—Л—Е —Б–≤–Њ–є—Б—В–≤ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Ї–Њ–љ—В–∞–Ї—В–љ–Њ–є –ї–Є–љ–Ј—Л, –Є–Ј –Ї–Њ—В–Њ—А–Њ–є –Љ–Њ–ґ–µ—В –≤—Л–і–µ–ї–Є—В—М—Б—П —А–Њ–≤–љ–Њ —Б—В–Њ–ї—М–Ї–Њ –У–µ–Љ–∞–Ј—Л, —Б–Ї–Њ–ї—М–Ї–Њ –≤ –љ–µ–µ –њ–Њ—Б—В—Г–њ–Є–ї–Њ.
–Я—А–Є –≤–≤–µ–і–µ–љ–Є–Є –Љ–µ—В–Њ–і–Њ–Љ —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–∞ —Б –њ–µ—А–≤—Л—Е –Љ–Є–љ—Г—В –њ—А–µ–њ–∞—А–∞—В –њ—А–Њ–љ–Є–Ї–∞–µ—В –≤–Њ –Т–Я–Ъ —Б –њ–Њ—Б—В–µ–њ–µ–љ–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є, –±—Л—Б—В—А–Њ–µ –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ —З–µ—А–µ–Ј —А–Њ–≥–Њ–≤–Є—Ж—Г –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В—Б—П —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Є–Љ –њ–Њ–ї–µ–Љ [21, 22]. –Ш—Б—Е–Њ–і—П –Є–Ј –≤—Л—И–µ–Є–Ј–ї–Њ–ґ–µ–љ–љ–Њ–≥–Њ, –Љ–Њ–ґ–љ–Њ —Г—В–≤–µ—А–ґ–і–∞—В—М, —З—В–Њ –љ–∞—И–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П—О—В —А–∞—Б—И–Є—А–Є—В—М –і–Є–∞–њ–∞–Ј–Њ–љ –ї–µ—З–µ–±–љ—Л—Е –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–µ–є –Ї–∞–Ї –і–ї—П –≤—А–∞—З–∞, —В–∞–Ї –Є –і–ї—П –њ–∞—Ж–Є–µ–љ—В–∞. –° —Г—З–µ—В–Њ–Љ –Љ–∞–ї–Њ–є —В—А–∞–≤–Љ–∞—В–Є–Ј–∞—Ж–Є–Є –Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —В–µ—З–µ–љ–Є–µ 6вАУ7 —З –њ–Њ—Б–ї–µ —Д–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є –У–µ–Љ–∞–Ј—Л –і–∞–љ–љ—Л–є –Љ–µ—В–Њ–і –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–µ–љ –і–ї—П –і–≤—Г–Ї—А–∞—В–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ –і–µ–љ—М –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –і–Њ–±–Є—В—М—Б—П —Е–Њ—А–Њ—И–µ–≥–Њ —Д–Є–±—А–Є–љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –њ—А–Є —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤–Њ –Т–Я–Ъ –≥–ї–∞–Ј–∞ –і–µ—А–ґ–Є—В—Б—П –і–Њ–ї—М—И–µ вАУ –њ—А–Є–Љ–µ—А–љ–Њ 10вАУ12 —З, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М 1 –њ—А–Њ—Ж–µ–і—Г—А—Г –≤ –і–µ–љ—М.
–Ъ—А–Њ–Љ–µ —Н—В–Њ–≥–Њ, –≤–≤–µ–і–µ–љ–Є–µ –У–µ–Љ–∞–Ј—Л –Љ–µ—В–Њ–і–Њ–Љ —Д–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є –њ–∞—Ж–Є–µ–љ—В –Љ–Њ–ґ–µ—В –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ –≤ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е, –±–µ–Ј –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –∞–Ї—В–Є–≤–љ–Њ–≥–Њ —Г—З–∞—Б—В–Є—П –≤—А–∞—З–µ–±–љ–Њ–≥–Њ –њ–µ—А—Б–Њ–љ–∞–ї–∞, —З—В–Њ –Є—Б–Ї–ї—О—З–µ–љ–Њ –њ—А–Є –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ–Њ–Љ –Љ–µ—В–Њ–і–µ –≤–≤–µ–і–µ–љ–Є—П. –Ь–µ—В–Њ–і–Є–Ї–∞ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є, –њ—А–Є–Љ–µ–љ–µ–љ–љ–∞—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞–µ—В –љ–µ–њ—А–µ—А—Л–≤–љ–Њ–µ –Ј–∞–Ї–∞–њ—Л–≤–∞–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –Њ–±—Й–µ–є –і–Њ–Ј–Њ–є –≤ 5000 –Ь–Х –≤ —В–µ—З–µ–љ–Є–µ 10 –Љ–Є–љ. –£—З–Є—В—Л–≤–∞—П, —З—В–Њ –≤—Л—Б–Њ–Ї–∞—П —Д–Є–±—А–Є–љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —З–∞—Б–Њ–≤ [23], –≤ –і–Њ–Љ–∞—И–љ–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е –Њ–±—Й—Г—О –і–Њ–Ј—Г —А–∞—Б—В–≤–Њ—А–∞ 5000 –Ь–Х –Љ–Њ–ґ–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М –≤ —В–µ—З–µ–љ–Є–µ 1вАУ2 —З –Є–ї–Є –і–∞–ґ–µ —Ж–µ–ї–Њ–≥–Њ –і–љ—П (–њ—А–Є —Г—Б–ї–Њ–≤–Є–Є, —З—В–Њ —А–∞—Б—В–≤–Њ—А –њ—А–µ–њ–∞—А–∞—В–∞ –±—Г–і–µ—В —Е—А–∞–љ–Є—В—М—Б—П —Н—В–Њ –≤—А–µ–Љ—П –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ + 4¬∞ –°). –≠—В–Њ —Е–Њ—В—П –Є –Є–Ј–Љ–µ–љ–Є—В —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї—Г –њ—А–µ–њ–∞—А–∞—В–∞, –≤ —В–Њ –ґ–µ –≤—А–µ–Љ—П –њ–Њ–Ј–≤–Њ–ї–Є—В –і–Њ—Б—В–Є—З—М —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Є –≤ –Є—В–Њ–≥–µ –Љ–Њ–ґ–µ—В –Њ–±–µ—Б–њ–µ—З–Є—В—М –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Є —Г–і–Њ–±—Б—В–≤–Њ –і–ї—П –њ–∞—Ж–Є–µ–љ—В–∞.
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ы–Ь–Ъ–Ы –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –≤ —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –Є–Љ–µ–µ—В—Б—П –њ–∞—В–Њ–ї–Њ–≥–Є—П —А–Њ–≥–Њ–≤–Є—Ж—Л, –љ–∞–њ—А–Є–Љ–µ—А, –≤ –≤–Є–і–µ —Г—З–∞—Б—В–Ї–Њ–≤ –і–µ—Н–њ–Є—В–µ–ї–Є–Ј–∞—Ж–Є–Є —А–Њ–≥–Њ–≤–Є—Ж—Л –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —Д–Є–±—А–Є–љ–Њ–Ј–љ—Л–Љ –≤—Л–њ–Њ—В–Њ–Љ –≤ –њ–µ—А–µ–і–љ–µ–є –Ї–∞–Љ–µ—А–µ. –Ы–Ь–Ъ–Ы –±—Г–і–µ—В –Ј–∞—Й–Є—Й–∞—В—М –Є —Б–Њ–Ј–і–∞–≤–∞—В—М —Г—Б–ї–Њ–≤–Є—П –і–ї—П —Н–њ–Є—В–µ–ї–Є–Ј–∞—Ж–Є–Є, –∞ –≤—Л–і–µ–ї—П—О—Й–∞—П—Б—П –У–µ–Љ–∞–Ј–∞ вАУ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —А–∞—Б—Б–∞—Б—Л–≤–∞–љ–Є—О —Д–Є–±—А–Є–љ–∞.
–Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Д–Є–±—А–Є–љ–Њ–Є–і–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —В–Њ–≥–Њ –Є–ї–Є –і—А—Г–≥–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –≤–≤–µ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞. –Т —В–Њ–Љ —Б–ї—Г—З–∞–µ, –µ—Б–ї–Є –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ (–≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е —Б—Г—В–Њ–Ї) –Њ—В–Љ–µ—З–∞—О—В—Б—П –Њ—В–ї–Њ–ґ–µ–љ–Є—П –µ–і–Є–љ–Є—З–љ—Л—Е –љ–Є—В–µ–є —Д–Є–±—А–Є–љ–∞ –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ш–Ю–Ы –Є–ї–Є –≤ –њ—А–Њ—Б–≤–µ—В–µ –Ј—А–∞—З–Ї–∞, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –і–∞–ґ–µ –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Д–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є —А–∞—Б—В–≤–Њ—А–∞ –У–µ–Љ–∞–Ј—Л. –Т –і—А—Г–≥–Є—Е —Б–ї—Г—З–∞—П—Е, –µ—Б–ї–Є –Њ—В–Љ–µ—З–∞–µ—В—Б—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —Д–Є–±—А–Є–љ–Њ–≤–Њ–≥–Њ —Б–≥—Г—Б—В–Ї–∞ –≤ –њ—А–Њ—Б–≤–µ—В–µ –Ј—А–∞—З–Ї–∞ –Є–ї–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –њ–ї–Њ—В–љ—Л—Е –Ј–∞–і–љ–Є—Е —Б–Є–љ–µ—Е–Є–є, —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –≤–≤–µ–і–µ–љ–Є–µ —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–Њ–Љ. –С–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –Љ–Њ–ґ–µ—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –Љ–µ—В–Њ–і–Њ–≤ вАУ –Ї–∞–Ї –Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е, —В–∞–Ї –Є –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е.
–Т—Л–≤–Њ–і—Л
1. –Т–≤–µ–і–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –У–µ–Љ–∞–Ј–∞ –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ—Л–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є вАУ —Д–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –Є–љ—Б—В–Є–ї–ї—П—Ж–Є—П–Љ–Є, —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–Њ–Љ, —Б –њ–Њ–Љ–Њ—Й—М—О –Ы–Ь–Ъ–Ы вАУ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ—Б—В–Є—З—М –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Д–µ—А–Љ–µ–љ—В–∞ –≤–Њ –Т–Я–Ъ –≥–ї–∞–Ј–∞ –Є –Љ–Њ–ґ–µ—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Њ –і–ї—П –ї–µ—З–µ–љ–Є—П —Д–Є–±—А–Є–љ–Њ–Є–і–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞.2. –•–∞—А–∞–Ї—В–µ—А —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –У–µ–Љ–∞–Ј–∞ –≤–Њ –Т–Я–Ъ –≥–ї–∞–Ј–∞ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –Љ–µ—В–Њ–і–Њ–Љ —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–∞ –Є –і–Њ–њ—Г—Б–Ї–∞–µ—В –і–≤—Г–Ї—А–∞—В–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є –≤ —В–µ—З–µ–љ–Є–µ —Б—Г—В–Њ–Ї.
–°–≤–µ–і–µ–љ–Є—П –Њ–± –∞–≤—В–Њ—А–∞—Е: 1 2,3–С–Њ–є–Ї–Њ –≠—А–љ–µ—Б—В –Т–Є—В–∞–ї—М–µ–≤–Є—З вАУ –і.–Љ.–љ., –њ—А–Њ—Д–µ—Б—Б–Њ—А; 2–Ф–∞–љ–Є–ї–Є—З–µ–≤ –Т–ї–∞–і–Є–Љ–Є—А –§–µ–і–Њ—А–Њ–≤–Є—З вАУ –і.–Љ.–љ., –њ—А–Њ—Д–µ—Б—Б–Њ—А; 2–°–∞–ґ–Є–љ –Ґ–Є–Љ—Г—А –У–µ–љ–љ–∞–і—М–µ–≤–Є—З вАУ –Ї.–Љ.–љ.; 4–С–µ–ї–Њ–≥—Г—А–Њ–≤ –Р–љ–∞—В–Њ–ї–Є–є –Р–ї–µ–Ї—Б–∞–љ–і—А–Њ–≤–Є—З вАУ –Ї.–±.–љ.; 4–Ф–µ–ї—М–≤–µ—А –Х–≤–≥–µ–љ–Є–є –Я–µ—В—А–Њ–≤–Є—З - –Ї.–±.–љ.; 4–Р–≥–∞—Д–Њ–љ–Њ–≤–∞ –Ю–ї—М–≥–∞ –Т—П—З–µ—Б–ї–∞–≤–Њ–≤–љ–∞ - –Ї.–±.–љ.; 2–Р.–°. –°—Г–≤–Њ—А–Њ–≤ - –≤—А–∞—З. 1–°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥—Б–Ї–Є–є —Д–Є–ї–Є–∞–ї –§–У–Р–£ ¬Ђ–Ь–Э–Ґ–Ъ ¬Ђ–Ь–Є–Ї—А–Њ—Е–Є—А—Г—А–≥–Є—П –≥–ї–∞–Ј–∞¬ї –Є–Љ. –∞–Ї–∞–і–µ–Љ–Є–Ї–∞ –°.–Э. –§–µ–і–Њ—А–Њ–≤–∞¬ї –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є. 192283, –†–Њ—Б—Б–Є–є—Б–Ї–∞—П –§–µ–і–µ—А–∞—Ж–Є—П, –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, —Г–ї. –ѓ—А–Њ—Б–ї–∞–≤–∞ –У–∞—И–µ–Ї–∞, 21. 2–§–У–С–Т–Ю–£ –Т–Ю ¬Ђ–Т–Ь–µ–і–Р –Є–Љ. –°.–Ь. –Ъ–Є—А–Њ–≤–∞¬ї –Ь–Є–љ–Њ–±–Њ—А–Њ–љ—Л –†–Њ—Б—Б–Є–Є. 194044, –†–Њ—Б—Б–Є–є—Б–Ї–∞—П –§–µ–і–µ—А–∞—Ж–Є—П, –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, —Г–ї. –Р–Ї–∞–і–µ–Љ–Є–Ї–∞ –Ы–µ–±–µ–і–µ–≤–∞, 6. 3–§–У–С–Ю–£ –Т–Ю ¬Ђ–°–Ч–У–Ь–£ –Є–Љ. –Ш.–Ш. –Ь–µ—З–љ–Є–Ї–Њ–≤–∞¬ї –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є. 191015, –†–Њ—Б—Б–Є–є—Б–Ї–∞—П –§–µ–і–µ—А–∞—Ж–Є—П, –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, —Г–ї. –Ъ–Є—А–Њ—З–љ–∞—П, 41. 4–§–У–С–£ ¬Ђ–Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Є–є —Ж–µ–љ—В—А –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є–Є¬ї –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є. 121552, –†–Њ—Б—Б–Є–є—Б–Ї–∞—П –§–µ–і–µ—А–∞—Ж–Є—П, –Ь–Њ—Б–Ї–≤–∞, —Г–ї. 3-—П –І–µ—А–µ–њ–Ї–Њ–≤—Б–Ї–∞—П, 15–∞. –Ъ–Њ–љ—В–∞–Ї—В–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П: –С–Њ–є–Ї–Њ –≠—А–љ–µ—Б—В –Т–Є—В–∞–ї—М–µ–≤–Є—З, e-mail: Ernest.Boiko@szgmu.ru. –Я—А–Њ–Ј—А–∞—З–љ–Њ—Б—В—М —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є: –љ–Є–Ї—В–Њ –Є–Ј –∞–≤—В–Њ—А–Њ–≤ –љ–µ –Є–Љ–µ–µ—В —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–∞—Е –Є–ї–Є –Љ–µ—В–Њ–і–∞—Е. –Ъ–Њ–љ—Д–ї–Є–Ї—В –Є–љ—В–µ—А–µ—Б–Њ–≤ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В. –°—В–∞—В—М—П –њ–Њ—Б—В—Г–њ–Є–ї–∞ 15.11.2017.
About the authors: 1,2,3Ernest V. Boyko вАУ professor; 2Vladimir F. Danilichev вАУ professor; 2 Timur G. Sazhin вАУ PhD; 4Anatoly A. Belugurov вАУ PhD; 4Yevgeny P. Delver вАУ PhD; 4Olga V. Agafonova вАУ PhD; 2Alexander S. Suvorov вАУ MD. 1S. Fyodorov Eye Microsurgery Federal State Institution, St. Petersburg branch. 21, Jaroslav Hasek str., St. Petersburg, 192283, Russian Federation. 2Military Medical Academy named after S. M. Kirov. 6, Acad. Lebedev str., St. Petersburg, 194044, Russian Federation. 3North-West State Medical University named after I.I. Mechnikov. 41, Kirochnaya str., Saint-Petersburg, 191015, Russian Federation. 4National Medical Research Center of Cardiology. 15–∞, 3rd Cherepkovskaya str., Moscow, Russian Federation. Contact information: Ernest V. Boyko, e-mail: Ernest.Boiko@szgmu.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 15.11.2017.












