–Р–љ–µ–Љ–Є—П – —Н—В–Њ –Ї–ї–Є–љ–Є–Ї–Њ––≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–є—Б—П —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –Є –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –≤ –Ї—А–Њ–≤–Є. –°–љ–Є–ґ–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –і–Њ —Г—А–Њ–≤–љ—П –Љ–µ–љ–µ–µ 120 –≥/–ї —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї –∞–љ–µ–Љ–Є—П [Aapro, 2008]. –°–∞–Љ—Л–µ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л–µ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –Љ–Њ–≥—Г—В —Б–ї—Г–ґ–Є—В—М –Њ—Б–љ–Њ–≤–Њ–є —А–∞–Ј–≤–Є—В–Є—П –∞–љ–µ–Љ–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –∞–љ–µ–Љ–Є–Є –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Ї–∞–Ї —Б–Є–Љ–њ—В–Њ–Љ, –∞ –љ–µ –Ї–∞–Ї –Њ—Б–љ–Њ–≤–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ. –Р–љ–µ–Љ–Є–Є –љ–∞–±–ї—О–і–∞—О—В—Б—П –њ—А–Є –Љ–љ–Њ–≥–Є—Е —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е, —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е, –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є –і—А—Г–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е. –†–∞–Ј–ї–Є—З–∞—О—В –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ—Л–µ, —Б–Є–і–µ—А–Њ–∞—Е—А–µ—Б—В–Є—З–µ—Б–Ї–Є–µ (—Б –Є–Ј–±—Л—В–Ї–Њ–Љ –ґ–µ–ї–µ–Ј–∞), –Т12– –Є —Д–Њ–ї–Є–µ–≤–Њ–і–µ—Д–Є—Ж–Є—В–љ—Л–µ, –≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–µ, –∞–љ–µ–Љ–Є–Є –њ—А–Є –Ї–Њ—Б—В–љ–Њ–Љ–Њ–Ј–≥–Њ–≤–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, –њ–Њ—Б—В–≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–µ, –∞–љ–µ–Љ–Є–Є, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –њ–µ—А–µ—А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ –ґ–µ–ї–µ–Ј–∞, –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –∞–љ–µ–Љ–Є–Є. –Ю–і–љ–∞–Ї–Њ 80% –≤—Б–µ—Е –∞–љ–µ–Љ–Є–є —Б–≤—П–Ј–∞–љ–Њ —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ –ґ–µ–ї–µ–Ј–∞. –Ц–µ–ї–µ–Ј–Њ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —З–µ–ї–Њ–≤–µ–Ї–∞ —Г—З–∞—Б—В–≤—Г–µ—В –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –Њ–±–Љ–µ–љ–∞ –≤–µ—Й–µ—Б—В–≤, –≤ –њ—А–Њ—Ж–µ—Б—Б–∞—Е –њ–µ—А–µ–љ–Њ—Б–∞ –Ї–Є—Б–ї–Њ—А–Њ–і–∞, –≤ —В–Ї–∞–љ–µ–≤–Њ–Љ –і—Л—Е–∞–љ–Є–Є –Є –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Њ–≥—А–Њ–Љ–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є.
–Я–Њ—З—В–Є –≤—Б–µ –ґ–µ–ї–µ–Ј–Њ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —З–µ–ї–Њ–≤–µ–Ї–∞ –≤—Е–Њ–і–Є—В –≤ —Б–Њ—Б—В–∞–≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –±–µ–ї–Ї–Њ–≤ –Є —Д–µ—А–Љ–µ–љ—В–Њ–≤. –Ь–Њ–ґ–љ–Њ –≤—Л–і–µ–ї–Є—В—М –і–≤–µ –µ–≥–Њ –Њ—Б–љ–Њ–≤–љ—Л–µ —Д–Њ—А–Љ—Л: –≥–µ–Љ–Њ–≤–Њ–µ (–≤—Е–Њ–і—П—Й–µ–µ –≤ —Б–Њ—Б—В–∞–≤ –≥–µ–Љ–∞ – —Б–Њ—Б—В–∞–≤–љ–Њ–є —З–∞—Б—В–Є –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –Є –Љ–Є–Њ–≥–ї–Њ–±–Є–љ–∞) –Є –љ–µ–≥–µ–Љ–Њ–≤–Њ–µ. –Ц–µ–ї–µ–Ј–Њ –≥–µ–Љ–∞ –Љ—П—Б–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П –±–µ–Ј —Г—З–∞—Б—В–Є—П —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Ю–і–љ–∞–Ї–Њ –∞—Е–Є–ї–Є—П –Љ–Њ–ґ–µ—В –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –Љ–µ—А–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є—О –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–Њ–є –∞–љ–µ–Љ–Є–Є (–Ц–Ф–Р) –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л—Е –њ–Њ—В–µ—А—М –ґ–µ–ї–µ–Ј–∞ –Є –≤—Л—Б–Њ–Ї–Њ–є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –љ–µ–Љ.
–Т—Б–∞—Б—Л–≤–∞–љ–Є–µ –ґ–µ–ї–µ–Ј–∞ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–µ –Є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–∞—Е —В–Њ—Й–µ–є –Ї–Є—И–Ї–Є. –°—В–µ–њ–µ–љ—М –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –Ј–∞–≤–Є—Б–Є—В –Њ—В –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –≤ –љ–µ–Љ. –Я—А–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–Љ –і–µ—Д–Є—Ж–Є—В–µ –ґ–µ–ї–µ–Ј–∞ –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –µ–≥–Њ –Љ–Њ–ґ–µ—В –њ—А–Њ–Є—Б—Е–Њ–і–Є—В—М –Є –≤ –Њ—Б—В–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–∞—Е —В–Њ–љ–Ї–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞. –Я—А–Є —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –≤ –ґ–µ–ї–µ–Ј–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Ї–Њ—А–Њ—Б—В–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –µ–≥–Њ –≤ –њ–ї–∞–Ј–Љ—Г –Ї—А–Њ–≤–Є –Є —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –Њ—В–ї–Њ–ґ–µ–љ–Є–µ –≤ —Н–љ—В–µ—А–Њ—Ж–Є—В–∞—Е –≤ –≤–Є–і–µ —Д–µ—А—А–Є—В–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є —Н–ї–Є–Љ–Є–љ–Є—А—Г–µ—В—Б—П –њ—А–Є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ —Б–ї—Г—Й–Є–≤–∞–љ–Є–Є —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Ї–Є—И–µ—З–љ–Є–Ї–∞. –Т –Ї—А–Њ–≤–Є –ґ–µ–ї–µ–Ј–Њ —Ж–Є—А–Ї—Г–ї–Є—А—Г–µ—В –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ —Б –њ–ї–∞–Ј–Љ–µ–љ–љ—Л–Љ —В—А–∞–љ—Б—Д–µ—А—А–Є–љ–Њ–Љ. –≠—В–Њ—В –±–µ–ї–Њ–Ї —Б–Є–љ—В–µ–Ј–Є—А—Г–µ—В—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ –њ–µ—З–µ–љ–Є. –Ґ—А–∞–љ—Б—Д–µ—А—А–Є–љ –Ј–∞—Е–≤–∞—В—Л–≤–∞–µ—В –ґ–µ–ї–µ–Ј–Њ –Є–Ј —Н–љ—В–µ—А–Њ—Ж–Є—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ –Є–Ј –і–µ–њ–Њ –≤ –њ–µ—З–µ–љ–Є –Є —Б–µ–ї–µ–Ј–µ–љ–Ї–µ –Є –њ–µ—А–µ–љ–Њ—Б–Є—В –µ–≥–Њ –Ї —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ –љ–∞ —Н—А–Є—В—А–Њ–Ї–∞—А–Є–Њ—Ж–Є—В–∞—Е –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞. –Т –љ–Њ—А–Љ–µ —В—А–∞–љ—Б—Д–µ—А—А–Є–љ –љ–∞—Б—Л—Й–µ–љ –ґ–µ–ї–µ–Ј–Њ–Љ –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ –љ–∞ 30%. –Ъ–Њ–Љ–њ–ї–µ–Ї—Б —В—А–∞–љ—Б—Д–µ—А—А–Є–љ––ґ–µ–ї–µ–Ј–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г–µ—В —Б–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –љ–∞ –Љ–µ–Љ–±—А–∞–љ–µ —Н—А–Є—В—А–Њ–Ї–∞—А–Є–Њ—Ж–Є—В–Њ–≤ –Є —А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В–Њ–≤ –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –њ–Њ—Б–ї–µ —З–µ–≥–Њ –њ—Г—В–µ–Љ —Н–љ–і–Њ—Ж–Є—В–Њ–Ј–∞ –њ—А–Њ–љ–Є–Ї–∞–µ—В –≤ –Ї–ї–µ—В–Ї–Є, –Є –ґ–µ–ї–µ–Ј–Њ –њ–µ—А–µ–љ–Њ—Б–Є—В—Б—П –≤ –Є—Е –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–Є, –≥–і–µ –≤–Ї–ї—О—З–∞–µ—В—Б—П –≤ –њ—А–Њ—В–Њ–њ–Њ—А—Д–Є—А–Є–љ –Є —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ —Г—З–∞—Б—В–≤—Г–µ—В –≤ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є –≥–µ–Љ–∞. –Ю—Б–≤–Њ–±–Њ–і–Є–≤—И–Є–є—Б—П –Њ—В –ґ–µ–ї–µ–Ј–∞ —В—А–∞–љ—Б—Д–µ—А—А–Є–љ –љ–µ–Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ —Г—З–∞—Б—В–≤—Г–µ—В –≤ –њ–µ—А–µ–љ–Њ—Б–µ –ґ–µ–ї–µ–Ј–∞. –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –ґ–µ–ї–µ–Ј–∞, –Ї–Њ—В–Њ—А–Њ–µ —А–∞—Б—Е–Њ–і—Г–µ—В—Б—П –љ–∞ —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј, —Б–Њ—Б—В–∞–≤–ї—П–µ—В 25 –Љ–≥/—Б—Г—В., —З—В–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ—А–µ–≤—Л—И–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –і–ї—П –≥–µ–Љ–Њ–њ–Њ—Н–Ј–∞ –њ–Њ—Б—В–Њ—П–љ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –ґ–µ–ї–µ–Ј–Њ, –Њ—Б–≤–Њ–±–Њ–ґ–і–∞—О—Й–µ–µ—Б—П –њ—А–Є —А–∞—Б–њ–∞–і–µ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –≤ —Б–µ–ї–µ–Ј–µ–љ–Ї–µ. –•—А–∞–љ–µ–љ–Є–µ (–і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ) –ґ–µ–ї–µ–Ј–∞ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –≤ –і–µ–њ–Њ –≤ —Б–Њ—Б—В–∞–≤–µ –±–µ–ї–Ї–Њ–≤ —Д–µ—А—А–Є—В–Є–љ–∞ –Є –≥–µ–Љ–Њ—Б–Є–і–µ—А–Є–љ–∞.
–Э–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–∞—П —Д–Њ—А–Љ–∞ –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ – —Д–µ—А—А–Є—В–Є–љ. –§–µ—А—А–Є—В–Є–љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –≤–Њ–і–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л–є –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б, –≤ —Ж–µ–љ—В—А–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–Њ –ґ–µ–ї–µ–Ј–Њ, –њ–Њ–Ї—А—Л—В–Њ–µ –±–µ–ї–Ї–Њ–≤–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є –Є–Ј –∞–њ–Њ—Д–µ—А—А–Є—В–Є–љ–∞. –Ъ–∞–ґ–і–∞—П –Љ–Њ–ї–µ–Ї—Г–ї–∞ —Д–µ—А—А–Є—В–Є–љ–∞ —Б–Њ–і–µ—А–ґ–Є—В –Њ—В 1000 –і–Њ 3000 –∞—В–Њ–Љ–Њ–≤ –ґ–µ–ї–µ–Ј–∞. –§–µ—А—А–Є—В–Є–љ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –њ–Њ—З—В–Є –≤–Њ –≤—Б–µ—Е –Њ—А–≥–∞–љ–∞—Е –Є —В–Ї–∞–љ—П—Е, –љ–Њ –љ–∞–Є–±–Њ–ї—М—И–µ–µ –µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –≤ –Љ–∞–Ї—А–Њ—Д–∞–≥–∞—Е –њ–µ—З–µ–љ–Є, —Б–µ–ї–µ–Ј–µ–љ–Ї–Є, –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, —Н—А–Є—В—А–Њ—Ж–Є—В–∞—Е, —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є. –Я—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ –±–∞–ї–∞–љ—Б–µ –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П —Б–≤–Њ–µ–Њ–±—А–∞–Ј–љ–Њ–µ —А–∞–≤–љ–Њ–≤–µ—Б–Є–µ –Љ–µ–ґ–і—Г —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ —Д–µ—А—А–Є—В–Є–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Є –і–µ–њ–Њ (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –≤ –њ–µ—З–µ–љ–Є –Є —Б–µ–ї–µ–Ј–µ–љ–Ї–µ). –£—А–Њ–≤–µ–љ—М —Д–µ—А—А–Є—В–Є–љ–∞ –≤ –Ї—А–Њ–≤–Є –Њ—В—А–∞–ґ–∞–µ—В –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞. –§–µ—А—А–Є—В–Є–љ —Б–Њ–Ј–і–∞–µ—В –Ј–∞–њ–∞—Б—Л –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –±—Л—Б—В—А–Њ –Љ–Њ–±–Є–ї–Є–Ј–Њ–≤–∞—В—М—Б—П –њ—А–Є –њ–Њ–≤—Л—И–µ–љ–Є–Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є —В–Ї–∞–љ–µ–є –≤ –ґ–µ–ї–µ–Ј–µ.
–Ф—А—Г–≥–∞—П —Д–Њ—А–Љ–∞ –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞ – –≥–µ–Љ–Њ—Б–Є–і–µ—А–Є–љ. –≠—В–Њ –Љ–∞–ї–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ–Њ–µ –њ—А–Њ–Є–Ј–≤–Њ–і–љ–Њ–µ —Д–µ—А—А–Є—В–Є–љ–∞ —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є –ґ–µ–ї–µ–Ј–∞, —Б–Њ—Б—В–Њ—П—Й–µ–µ –Є–Ј –∞–≥—А–µ–≥–∞—В–Њ–≤ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –ґ–µ–ї–µ–Ј–∞, –љ–µ –Є–Љ–µ—О—Й–Є—Е –∞–њ–Њ—Д–µ—А—А–Є—В–Є–љ–Њ–≤–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є. –У–µ–Љ–Њ—Б–Є–і–µ—А–Є–љ –љ–∞–Ї–∞–њ–ї–Є–≤–∞–µ—В—Б—П –≤ –Љ–∞–Ї—А–Њ—Д–∞–≥–∞—Е –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, —Б–µ–ї–µ–Ј–µ–љ–Ї–Є, –Ї—Г–њ—Д–µ—А–Њ–≤—Б–Ї–Є—Е –Ї–ї–µ—В–Ї–∞—Е –њ–µ—З–µ–љ–Є.
–Ю–±—Й–µ–њ—А–Є–љ—П—В–Њ –≤—Л–і–µ–ї—П—В—М –і–≤–µ —Д–Њ—А–Љ—Л –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є: –ї–∞—В–µ–љ—В–љ—Л–є –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ –Є –Ц–Ф–Р. –Ы–∞—В–µ–љ—В–љ—Л–є –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ґ–µ–ї–µ–Ј–∞ –≤ –µ–≥–Њ –і–µ–њ–Њ –Є —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П —В—А–∞–љ—Б–њ–Њ—А—В–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –Ї—А–Њ–≤–Є –њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П—Е –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤. –Ц–Ф–Р – –≥–Є–њ–Њ—Е—А–Њ–Љ–љ–∞—П –Љ–Є–Ї—А–Њ—Ж–Є—В–∞—А–љ–∞—П –∞–љ–µ–Љ–Є—П, —А–∞–Ј–≤–Є–≤–∞—О—Й–∞—П—Б—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, –Ї–Њ—Б—В–љ–Њ–Љ –Љ–Њ–Ј–≥–µ –Є –і–µ–њ–Њ – –њ–µ—З–µ–љ–Є –Є —Б–µ–ї–µ–Ј–µ–љ–Ї–µ. –Ц–Ф–Р –≤–Њ–Ј–љ–Є–Ї–∞–µ—В, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –њ–Њ—В–µ—А–µ –Ї—А–Њ–≤–Є –Є (–Є–ї–Є) –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–Љ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ.
–Я–Њ –і–∞–љ–љ—Л–Љ –Т—Б–µ–Љ–Є—А–љ–Њ–є –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П (–Т–Ю–Ч), –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —З–µ–ї–Њ–≤–µ–Ї–∞ —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –і–µ—Д–Є—Ж–Є—В–Њ–≤ –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —З–µ–ї–Њ–≤–µ–Ї–∞ –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ [Benoist B. et al., 2008; WHO, 2001]. –Р–љ–µ–Љ–Є—П –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї —З–Є—Б–ї—Г –≥–ї–Њ–±–∞–ї—М–љ—Л—Е –њ—А–Њ–±–ї–µ–Љ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П. –Т –Љ–Є—А–µ –∞–љ–µ–Љ–Є–µ–є —Б—В—А–∞–і–∞—О—В –Њ–Ї–Њ–ї–Њ 1,6 –Љ–ї—А–і —З–µ–ї–Њ–≤–µ–Ї, –Є–ї–Є 24,8% –Њ—В –Њ–±—Й–µ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П. –І–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –∞–љ–µ–Љ–Є–Є –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –≤—Л—Б–Њ–Ї–Њ–є –≤–Њ –≤—Б–µ—Е –≥—А—Г–њ–њ–∞—Е –Є —Б–Њ—Б—В–∞–≤–Є–ї–∞ 25,4–47,4% —Г –і–µ—В–µ–є –і–Њ—И–Ї–Њ–ї—М–љ–Њ–≥–Њ –Є —И–Ї–Њ–ї—М–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, 41,8% – —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –ґ–µ–љ—Й–Є–љ, 30,2% – —Г –љ–µ–±–µ—А–µ–Љ–µ–љ–љ—Л—Е –ґ–µ–љ—Й–Є–љ —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, 23,9% – —Г –њ–Њ–ґ–Є–ї—Л—Е –ї—О–і–µ–є –Є 12,7% – —Г –Љ—Г–ґ—З–Є–љ.
–•–Њ—В—П —Б—А–µ–і–Є –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П –∞–љ–µ–Љ–Є—П —З–∞—Й–µ –≤—Б–µ–≥–Њ —А–∞–Ј–≤–Є–≤–∞–ї–∞—Б—М —Г –ґ–µ–љ—Й–Є–љ –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, —В–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Њ—Б–љ–Њ–≤–љ—Г—О –і–Њ–ї—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞–љ–µ–Љ–Є–µ–є —Б–Њ—Б—В–∞–≤–ї—П–ї–Є –љ–µ–±–µ—А–µ–Љ–µ–љ–љ—Л–µ –ґ–µ–љ—Й–Є–љ—Л —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (468 –Љ–ї–љ —З–µ–ї–Њ–≤–µ–Ї). –Я–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ –≤ –њ–Њ–ї–Њ–≤–Є–љ–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Є—З–Є–љ–Њ–є –∞–љ–µ–Љ–Є–Є —Б–ї—Г–ґ–Є—В –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ [WHO, 2001], –Ї–Њ—В–Њ—А—Л–є –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–ї–µ–і—Б—В–≤–Є–µ–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–Є (–Љ–µ–љ—Б—В—А—Г–∞—Ж–Є–Є, –Њ–Ї–Ї—Г–ї—М—В–љ—Л–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –њ—А–Є –Њ–њ—Г—Е–Њ–ї—П—Е –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ (–Ц–Ъ–Ґ), –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ –Є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —В–Њ–љ–Ї–Њ–є –Є —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є, –і—А—Г–≥–Є–µ –њ—А–Є—З–Є–љ—Л), –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –ґ–µ–ї–µ–Ј–∞ —Б –њ–Є—Й–µ–є –Є–ї–Є –љ–∞—А—Г—И–µ–љ–Є—П –µ–≥–Њ —Г—Б–≤–Њ—П–µ–Љ–Њ—Б—В–Є (–љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ –∞–ї–Ї–Њ–≥–Њ–ї–Є–Ј–Љ–µ), –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є (–і–µ—В—Б–Ї–Є–є –Є –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤—Л–є –≤–Њ–Ј—А–∞—Б—В, –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М, –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤—Л–є –њ–µ—А–Є–Њ–і), –љ–∞—А—Г—И–µ–љ–Є—П –≤—Б–∞—Б—Л–≤–∞–љ–Є—П.
–Ф–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ –±—Л–≤–∞–µ—В –љ–µ —В–Њ–ї—М–Ї–Њ –∞–±—Б–Њ–ї—О—В–љ—Л–Љ, –љ–Њ –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ. –Я–Њ—Б–ї–µ–і–љ–Є–є –≤–Њ–Ј–љ–Є–Ї–∞–µ—В, –Ї–Њ–≥–і–∞ –∞–і–µ–Ї–≤–∞—В–љ–Њ–µ –Є–ї–Є –і–∞–ґ–µ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–µ –Њ–±—Й–µ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ —Г –±–Њ–ї—М–љ—Л—Е –њ—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –ґ–µ–ї–µ–Ј–µ –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –љ–∞ —Д–Њ–љ–µ —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞. –Т–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –Њ–±–Љ–µ–љ–∞ –ґ–µ–ї–µ–Ј–∞ –Є–≥—А–∞–µ—В –≥–µ–њ—Б–Є–і–Є–љ – –≥–Њ—А–Љ–Њ–љ, –Ї–Њ—В–Њ—А—Л–є –Њ–±—А–∞–Ј—Г–µ—В—Б—П –≤ –њ–µ—З–µ–љ–Є, –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г–µ—В —Б —Д–µ—А—А–Њ–њ–Њ—А—В–Є–љ–Њ–Љ (–±–µ–ї–Ї–Њ–Љ, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—О—Й–Є–Љ —В—А–∞–љ—Б–њ–Њ—А—В –ґ–µ–ї–µ–Ј–∞) –Є –њ–Њ–і–∞–≤–ї—П–µ—В –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –ґ–µ–ї–µ–Ј–∞ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ, –∞ —В–∞–Ї–ґ–µ –µ–≥–Њ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –Є–Ј –і–µ–њ–Њ –Є –Љ–∞–Ї—А–Њ—Д–∞–≥–Њ–≤. –Я–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–µ–њ—Б–Є–і–Є–љ–∞, –Њ—В–Љ–µ—З–∞—О—Й–µ–µ—Б—П –њ—А–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–Є, —Б—З–Є—В–∞—О—В –Њ—Б–љ–Њ–≤–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є –∞–љ–µ–Љ–Є–Є –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Г—А–Њ–≤–µ–љ—М –≥–µ–њ—Б–Є–і–Є–љ–∞ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є –њ–Њ—З–µ–Ї, —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–Ј–≤–Є—В–Є—О –љ–µ—Д—А–Њ–≥–µ–љ–љ–Њ–є –∞–љ–µ–Љ–Є–Є –Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї —Б—В–Є–Љ—Г–ї—П—В–Њ—А–∞–Љ —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞. –Я—А–Є —Г—Б–Є–ї–µ–љ–Є–Є —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞ –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ —Н—А–Є—В—А–Њ–њ–Њ—Н—В–Є–љ–∞ —Б–Ї–Њ—А–Њ—Б—В—М –Љ–Њ–±–Є–ї–Є–Ј–∞—Ж–Є–Є –ґ–µ–ї–µ–Ј–∞ –Є–Ј –і–µ–њ–Њ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є –і–ї—П –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –≤–Њ–Ј—А–Њ—Б—И–Є—Е –њ–Њ—В—А–µ–±–љ–Њ—Б—В–µ–є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞. –Я—А–Њ–ї–Є—Д–µ—А–Є—А—Г—О—Й–Є–Љ —Н—А–Є—В—А–Њ–±–ї–∞—Б—В–∞–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –≤—Б–µ –±–Њ–ї—М—И–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –ґ–µ–ї–µ–Ј–∞, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Є—Б—В–Њ—Й–µ–љ–Є—О –ї–∞–±–Є–ї—М–љ–Њ–≥–Њ –њ—Г–ї–∞ –ґ–µ–ї–µ–Ј–∞ –Є —Б–љ–Є–ґ–µ–љ–Є—О —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Д–µ—А—А–Є—В–Є–љ–∞. –Ф–ї—П –Љ–Њ–±–Є–ї–Є–Ј–∞—Ж–Є–Є –Є —А–∞—Б—В–≤–Њ—А–µ–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –Є–Ј –≥–µ–Љ–Њ—Б–Є–і–µ—А–Є–љ–∞ —В—А–µ–±—Г–µ—В—Б—П –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–µ –≤—А–µ–Љ—П. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–Њ—Б—В—Г–њ–∞—О—Й–µ–≥–Њ –≤ –Ї–Њ—Б—В–љ—Л–є –Љ–Њ–Ј–≥ –ґ–µ–ї–µ–Ј–∞ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П, —З—В–Њ –≤—Л–Ј—Л–≤–∞–µ—В —А–∞–Ј–≤–Є—В–Є–µ –µ–≥–Њ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Є –∞–±—Б–Њ–ї—О—В–љ–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞.
–Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–µ–є –±–Њ–ї–µ–Ј–љ–µ–є 10––≥–Њ –њ–µ—А–µ—Б–Љ–Њ—В—А–∞ (–Ь–Ъ–С–10) —Г—З–Є—В—Л–≤–∞—О—В —Б–ї–µ–і—Г—О—Й–Є–µ —Д–Њ—А–Љ—Л –∞–љ–µ–Љ–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –∞–±—Б–Њ–ї—О—В–љ—Л–Љ –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–Љ –і–µ—Д–Є—Ж–Є—В–Њ–Љ –ґ–µ–ї–µ–Ј–∞:
• D50. –Ц–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–∞—П –∞–љ–µ–Љ–Є—П (–∞—Б–Є–і–µ—А–Њ—В–Є—З–µ—Б–Ї–∞—П, —Б–Є–і–µ—А–Њ–њ–µ–љ–Є—З–µ—Б–Ї–∞—П, –≥–Є–њ–Њ—Е—А–Њ–Љ–љ–∞—П).
• D50.0. –Ц–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–∞—П –∞–љ–µ–Љ–Є—П, —Б–≤—П–Ј–∞–љ–љ–∞—П —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–µ–є (—Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –њ–Њ—Б—В–≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–∞—П –∞–љ–µ–Љ–Є—П).
• D50.1. –°–Є–і–µ—А–Њ–њ–µ–љ–Є—З–µ—Б–Ї–∞—П –і–Є—Б—Д–∞–≥–Є—П (—Б–Є–љ–і—А–Њ–Љ—Л –Ъ–µ–ї–ї–Є––Я–∞—В—В–µ—А—Б–Њ–љ–∞ (Kelly–Paterson) –Є–ї–Є –Я–ї–∞–Љ–Љ–µ—А–∞––Т–Є–љ—Б–Њ–љ–∞ (Plummer–Vinson)).
• D50.8. –Ф—А—Г–≥–Є–µ –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ—Л–µ –∞–љ–µ–Љ–Є–Є.
• D50.9. –Ц–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–∞—П –∞–љ–µ–Љ–Є—П –љ–µ—Г—В–Њ—З–љ–µ–љ–љ–∞—П.
–Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П, –Ї–ї–Є–љ–Є–Ї–∞
–Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Ц–Ф–Р
–Ю–±—Й–µ–њ—А–Є–Ј–љ–∞–љ–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Ц–Ф–Р –љ–µ —Б—Г—Й–µ—Б—В–≤—Г–µ—В. –Ш–Љ–µ—О—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Ц–Ф–Р –Є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –њ–Њ —Б—В–∞–і–Є—П–Љ –Є —В—П–ґ–µ—Б—В–Є –њ—А–Њ—В–µ–Ї–∞–љ–Є—П –∞–љ–µ–Љ–Є–Є.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Ц–Ф–Р:
1. –Ц–Ф–Р –њ–Њ—Б—В–≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–µ. –≠—В—Г –≥—А—Г–њ–њ—Г —Б–Њ—Б—В–∞–≤–ї—П—О—В –∞–љ–µ–Љ–Є–Є, —А–∞–Ј–≤–Є–≤–∞—О—Й–Є–µ—Б—П –љ–∞ –њ–Њ—З–≤–µ –њ–Њ–≤—В–Њ—А–љ—Л—Е –љ–µ–±–Њ–ї—М—И–Є—Е –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А—М, – –Љ–µ—В—А–Њ—А—А–∞–≥–Є–Є, —Н–њ–Є—Б—В–∞–Ї—Б–Є—Б, –≥–µ–Љ–∞—В—Г—А–Є—П –Є —В.–і.
2. –Ц–Ф–Р –±–µ—А–µ–Љ–µ–љ–љ—Л—Е. –Я—А–Є—З–Є–љ—Л –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –∞–љ–µ–Љ–Є–є –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л —А–∞–Ј–ї–Є—З–љ—Л: –і–Є—Б–±–∞–ї–∞–љ—Б –њ–Є—В–∞–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –Є —Б–≤—П–Ј–∞–љ–љ–Њ–µ —Б —Н—В–Є–Љ —Г—Е—Г–і—И–µ–љ–Є–µ —Г—В–Є–ї–Є–Ј–∞—Ж–Є–Є –ґ–µ–ї–µ–Ј–∞, –њ–µ—А–µ–і–∞—З–∞ –Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–Љ –Љ–∞—В–µ—А–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–≥–Њ –µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —А–∞–Ј–≤–Є–≤–∞—О—Й–µ–Љ—Г—Б—П –њ–ї–Њ–і—Г, –њ–Њ—В–µ—А–Є –ґ–µ–ї–µ–Ј–∞ –≤ –њ–µ—А–Є–Њ–і –ї–∞–Ї—В–∞—Ж–Є–Є –Є –і—А.
3. –Ц–Ф–Р, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є –Ц–Ъ–Ґ. –Ъ –љ–Є–Љ –Њ—В–љ–Њ—Б—П—В—Б—П –∞–љ–µ–Љ–Є–Є, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є–µ –њ–Њ—Б–ї–µ –≥–∞—Б—В—А—Н–Ї—В–Њ–Љ–Є–Є, –Њ–±—И–Є—А–љ—Л—Е —А–µ–Ј–µ–Ї—Ж–Є–є —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є, –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —Н–љ—В–µ—А–Њ–њ–∞—В–Є—П—Е. –Я–Њ —Б–≤–Њ–µ–є —Б—Г—В–Є —Н—В–Њ –Ц–Ф–Р, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–µ –≥—А—Г–±—Л–Љ, —В—П–ґ–µ–ї—Л–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–Є –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –≤ –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–Љ –Њ—В–і–µ–ї–µ –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є.
4. –Ц–Ф–Р –≤—В–Њ—А–Є—З–љ—Л–µ, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є–µ –њ—А–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е, –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Є–ї–Є –Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е –±–Њ–ї–µ–Ј–љ—П—Е. –Р–љ–µ–Љ–Є–Є –≤ —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ –±–Њ–ї—М—И–Є—Е –њ–Њ—В–µ—А—М –ґ–µ–ї–µ–Ј–∞ –њ—А–Є –≥–Є–±–µ–ї–Є –Ї–ї–µ—В–Њ–Ї –Њ–њ—Г—Е–Њ–ї–µ–є, —А–∞—Б–њ–∞–і–µ —В–Ї–∞–љ–µ–є, –Љ–Є–Ї—А–Њ– –Є –і–∞–ґ–µ –Љ–∞–Ї—А–Њ–≥–µ–Љ–Њ—А—А–∞–≥–Є—П—Е, –њ–Њ–≤—Л—И–µ–љ–Є–Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –ґ–µ–ї–µ–Ј–µ –≤ –Њ—З–∞–≥–∞—Е –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П.
5. –≠—Б—Б–µ–љ—Ж–Є–∞–ї—М–љ–∞—П (–Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–∞—П) –Ц–Ф–Р, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є —Б–∞–Љ—Л–є —В—Й–∞—В–µ–ї—М–љ—Л–є –∞–љ–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Є–є –Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–є –њ–Њ–Є—Б–Ї –љ–µ –≤—Л—П–≤–ї—П–µ—В –Њ–±—Й–µ–Є–Ј–≤–µ—Б—В–љ—Л–µ –њ—А–Є—З–Є–љ—Л –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞. –£ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –±–Њ–ї—М–љ—Л—Е –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –Њ—Б–Њ–±–∞—П —Д–Њ—А–Љ–∞ –љ–∞—А—Г—И–µ–љ–Є—П –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞.
6. –Ѓ–≤–µ–љ–Є–ї—М–љ–∞—П –Ц–Ф–Р – –∞–љ–µ–Љ–Є—П, —А–∞–Ј–≤–Є–≤–∞—О—Й–∞—П—Б—П —Г –Љ–Њ–ї–Њ–і—Л—Е –і–µ–≤—Г—И–µ–Ї (–Є —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ —А–µ–і–Ї–Њ – —Г —О–љ–Њ—И–µ–є). –Ф–∞–љ–љ–∞—П —Д–Њ—А–Љ–∞ –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–Њ–≥–Њ –Љ–∞–ї–Њ–Ї—А–Њ–≤–Є—П —Б–≤—П–Ј–∞–љ–∞ —Б –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –Є–ї–Є —Д–µ–љ–Њ—В–Є–њ–Є—З–µ—Б–Ї–Є–Љ–Є –і–Є—Б–≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л–Љ–Є —П–≤–ї–µ–љ–Є—П–Љ–Є.
7. –Ц–Ф–Р —Б–ї–Њ–ґ–љ–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞. –Т —Н—В—Г –≥—А—Г–њ–њ—Г –≤—Е–Њ–і—П—В –∞–љ–µ–Љ–Є–Є –∞–ї–Є–Љ–µ–љ—В–∞—А–љ—Л–µ.
–Ц–Ф–Р —В–∞–Ї–ґ–µ –Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А—Г—О—В –њ–Њ —Б—В–∞–і–Є—П–Љ –Є —В—П–ґ–µ—Б—В–Є –њ—А–Њ—В–µ–Ї–∞–љ–Є—П.
–Я–Њ —Б—В–∞–і–Є—П–Љ:
I —Б—В–∞–і–Є—П – –њ–Њ—В–µ—А—П –ґ–µ–ї–µ–Ј–∞ –њ—А–µ–≤—Л—И–∞–µ—В –µ–≥–Њ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ, –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–µ –Є—Б—В–Њ—Й–µ–љ–Є–µ –Ј–∞–њ–∞—Б–Њ–≤, –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П;
II —Б—В–∞–і–Є—П – –Є—Б—В–Њ—Й–µ–љ–Є–µ –Ј–∞–њ–∞—Б–Њ–≤ –ґ–µ–ї–µ–Ј–∞ (—Г—А–Њ–≤–µ–љ—М —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ – –љ–Є–ґ–µ 50 –Љ–Ї–≥/–ї, –љ–∞—Б—Л—Й–µ–љ–Є–µ —В—А–∞–љ—Б—Д–µ—А—А–Є–љ–∞ – –љ–Є–ґ–µ 16%) –њ—А–µ–њ—П—В—Б—В–≤—Г–µ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ—Г —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј—Г, —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј –љ–∞—З–Є–љ–∞–µ—В –њ–∞–і–∞—В—М;
III —Б—В–∞–і–Є—П – —А–∞–Ј–≤–Є—В–Є–µ –∞–љ–µ–Љ–Є–Є –ї–µ–≥–Ї–Њ–є —Б—В–µ–њ–µ–љ–Є (100–120 –≥/–ї –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞, –Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ–є), —Б –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Ж–≤–µ—В–Њ–≤–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Є –і—А—Г–≥–Є—Е –Є–љ–і–µ–Ї—Б–Њ–≤ –љ–∞—Б—Л—Й–µ–љ–Є—П —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–Њ–Љ;
IV —Б—В–∞–і–Є—П – –≤—Л—А–∞–ґ–µ–љ–љ–∞—П (–Љ–µ–љ–µ–µ 100 –≥/–ї –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞, —Б—Г–±–Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ–∞—П) –∞–љ–µ–Љ–Є—П —Б —П–≤–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –љ–∞—Б—Л—Й–µ–љ–Є—П —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–Њ–Љ;
V —Б—В–∞–і–Є—П – —В—П–ґ–µ–ї–∞—П –∞–љ–µ–Љ–Є—П (60–80 –≥/–ї –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞) —Б —Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є –Є —В–Ї–∞–љ–µ–≤–Њ–є –≥–Є–њ–Њ–Ї—Б–Є–µ–є.
–Я–Њ —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є:
• –ї–µ–≥–Ї–∞—П (—Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Эb – 90–120 –≥/–ї);
• —Б—А–µ–і–љ—П—П (70–90 –≥/–ї);
• —В—П–ґ–µ–ї–∞—П (–Љ–µ–љ–µ–µ 70 –≥/–ї).
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ –Ц–Ф–Р
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –Ц–Ф–Р —П–≤–ї—П—О—В—Б—П –і–≤–∞ –≤–∞–ґ–љ–µ–є—И–Є—Е —Б–Є–љ–і—А–Њ–Љ–∞ – –∞–љ–µ–Љ–Є—З–µ—Б–Ї–Є–є –Є —Б–Є–і–µ—А–Њ–њ–µ–љ–Є—З–µ—Б–Ї–Є–є.
–Р–љ–µ–Љ–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –Є —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–µ–Љ —В–Ї–∞–љ–µ–є –Ї–Є—Б–ї–Њ—А–Њ–і–Њ–Љ –Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ–Є —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є. –С–Њ–ї—М–љ—Л–µ –ґ–∞–ї—Г—О—В—Б—П –љ–∞ –Њ–±—Й—Г—О —Б–ї–∞–±–Њ—Б—В—М, –њ–Њ–≤—Л—И–µ–љ–љ—Г—О —Г—В–Њ–Љ–ї—П–µ–Љ–Њ—Б—В—М, —Б–љ–Є–ґ–µ–љ–Є–µ —А–∞–±–Њ—В–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є, –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ, —И—Г–Љ –≤ —Г—И–∞—Е, –Љ–µ–ї—М–Ї–∞–љ–Є–µ –Љ—Г—И–µ–Ї –њ–µ—А–µ–і –≥–ї–∞–Ј–∞–Љ–Є, —Б–µ—А–і—Ж–µ–±–Є–µ–љ–Є—П, –Њ–і—Л—И–Ї—Г –њ—А–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –љ–∞–≥—А—Г–Ј–Ї–µ, –њ–Њ—П–≤–ї–µ–љ–Є–µ –Њ–±–Љ–Њ—А–Њ—З–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є. –Ь–Њ–≥—Г—В –њ–Њ—П–≤–ї—П—В—М—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ —Г–Љ—Б—В–≤–µ–љ–љ–Њ–є —А–∞–±–Њ—В–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є, —Г—Е—Г–і—И–µ–љ–Є–µ –њ–∞–Љ—П—В–Є, —Б–Њ–љ–ї–Є–≤–Њ—Б—В—М. –°—Г–±—К–µ–Ї—В–Є–≤–љ—Л–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –∞–љ–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –≤–љ–∞—З–∞–ї–µ –±–µ—Б–њ–Њ–Ї–Њ—П—В –±–Њ–ї—М–љ—Л—Е –њ—А–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –љ–∞–≥—А—Г–Ј–Ї–µ, –∞ –Ј–∞—В–µ–Љ –Є –≤ –њ–Њ–Ї–Њ–µ (–њ–Њ –Љ–µ—А–µ —А–∞–Ј–≤–Є—В–Є—П –∞–љ–µ–Љ–Є–Є).
–Я—А–Є –Њ–±—К–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –±–ї–µ–і–љ–Њ—Б—В—М –Ї–Њ–ґ–Є –Є –≤–Є–і–Є–Љ—Л—Е —Б–ї–Є–Ј–Є—Б—В—Л—Е –Њ–±–Њ–ї–Њ—З–µ–Ї, –љ–µ—А–µ–і–Ї–Њ – –љ–µ–Ї–Њ—В–Њ—А–∞—П –њ–∞—Б—В–Њ–Ј–љ–Њ—Б—В—М –≤ –Њ–±–ї–∞—Б—В–Є –≥–Њ–ї–µ–љ–µ–є, —Б—В–Њ–њ, –ї–Є—Ж–∞. –•–∞—А–∞–Ї—В–µ—А–љ—Л —Г—В—А–µ–љ–љ–Є–µ –Њ—В–µ–Ї–Є – «–Љ–µ—И–Ї–Є» –≤–Њ–Ї—А—Г–≥ –≥–ї–∞–Ј. –Р–љ–µ–Љ–Є—П –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В —А–∞–Ј–≤–Є—В–Є–µ —Б–Є–љ–і—А–Њ–Љ–∞ –Љ–Є–Њ–Ї–∞—А–і–Є–Њ–і–Є—Б—В—А–Њ—Д–Є–Є, –Ї–Њ—В–Њ—А—Л–є –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –Њ–і—Л—И–Ї–Њ–є, —В–∞—Е–Є–Ї–∞—А–і–Є–µ–є, —З–∞—Б—В–Њ –∞—А–Є—В–Љ–Є–µ–є, —Г–Љ–µ—А–µ–љ–љ—Л–Љ —А–∞—Б—И–Є—А–µ–љ–Є–µ–Љ –≥—А–∞–љ–Є—Ж —Б–µ—А–і—Ж–∞ –≤–ї–µ–≤–Њ, –≥–ї—Г—Е–Њ—Б—В—М—О —В–Њ–љ–Њ–≤ —Б–µ—А–і—Ж–∞, –љ–µ–≥—А–Њ–Љ–Ї–Є–Љ —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Є–Љ —И—Г–Љ–Њ–Љ –≤–Њ –≤—Б–µ—Е –∞—Г—Б–Ї—Г–ї—М—В–∞—В–Є–≤–љ—Л—Е —В–Њ—З–Ї–∞—Е. –Я—А–Є —В—П–ґ–µ–ї–Њ–є –Є –і–ї–Є—В–µ–ї—М–љ–Њ–є –∞–љ–µ–Љ–Є–Є –Љ–Є–Њ–Ї–∞—А–і–Є–Њ–і–Є—Б—В—А–Њ—Д–Є—П –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П. –Ц–Ф–Р —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ, –њ–Њ—Н—В–Њ–Љ—Г –Њ—А–≥–∞–љ–Є–Ј–Љ –±–Њ–ї—М–љ–Њ–≥–Њ –∞–і–∞–њ—В–Є—А—Г–µ—В—Б—П –Ї –љ–Є–Ј–Ї–Њ–Љ—Г —Г—А–Њ–≤–љ—О –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞, –Є —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –∞–љ–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –љ–µ –≤—Б–µ–≥–і–∞ –±—Л–≤–∞—О—В —П—А–Ї–Њ –≤—Л—А–∞–ґ–µ–љ—Л.
–°–Є–і–µ—А–Њ–њ–µ–љ–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ (—Б–Є–љ–і—А–Њ–Љ –≥–Є–њ–Њ—Б–Є–і–µ—А–Њ–Ј–∞) –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ —В–Ї–∞–љ–µ–≤—Л–Љ –і–µ—Д–Є—Ж–Є—В–Њ–Љ –ґ–µ–ї–µ–Ј–∞, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–љ–Њ–≥–Є—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ (—Ж–Є—В–Њ—Е—А–Њ–Љ–Њ–Ї—Б–Є–і–∞–Ј–∞, –њ–µ—А–Њ–Ї—Б–Є–і–∞–Ј–∞, —Б—Г–Ї—Ж–Є–љ–∞—В––і–µ–≥–Є–і—А–Њ–≥–µ–љ–∞–Ј–∞ –Є –і—А.). –°–Є–і–µ—А–Њ–њ–µ–љ–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–Љ–Є —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є, —В–∞–Ї–Є–Љ–Є –Ї–∞–Ї:
• –Є–Ј–≤—А–∞—Й–µ–љ–Є–µ –≤–Ї—Г—Б–∞ (pica chlorotica) – –љ–µ–њ—А–µ–Њ–і–Њ–ї–Є–Љ–Њ–µ –ґ–µ–ї–∞–љ–Є–µ —Г–њ–Њ—В—А–µ–±–ї—П—В—М –≤ –њ–Є—Й—Г —З—В–Њ––ї–Є–±–Њ –љ–µ–Њ–±—Л—З–љ–Њ–µ –Є –Љ–∞–ї–Њ—Б—К–µ–і–Њ–±–љ–Њ–µ (–Љ–µ–ї, –Ј—Г–±–љ–Њ–є –њ–Њ—А–Њ—И–Њ–Ї, —Г–≥–Њ–ї—М, –≥–ї–Є–љ—Г, –њ–µ—Б–Њ–Ї, –ї–µ–і), –∞ —В–∞–Ї–ґ–µ —Б—Л—А–Њ–µ —В–µ—Б—В–Њ, —Д–∞—А—И, –Ї—А—Г–њ—Г; —Н—В–Њ—В —Б–Є–Љ–њ—В–Њ–Љ —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Г –і–µ—В–µ–є –Є –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤, –љ–Њ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —З–∞—Б—В–Њ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Є —Г –≤–Ј—А–Њ—Б–ї—Л—Е –ґ–µ–љ—Й–Є–љ;
• –њ—А–Є—Б—В—А–∞—Б—В–Є–µ –Ї –Њ—Б—В—А–Њ–є, —Б–Њ–ї–µ–љ–Њ–є, –Ї–Є—Б–ї–Њ–є, –њ—А—П–љ–Њ–є –њ–Є—Й–µ;
• –Є–Ј–≤—А–∞—Й–µ–љ–Є–µ –Њ–±–Њ–љ—П–љ–Є—П – –њ—А–Є—Б—В—А–∞—Б—В–Є–µ –Ї –Ј–∞–њ–∞—Е–∞–Љ, –Ї–Њ—В–Њ—А—Л–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ–Љ –Њ–Ї—А—Г–ґ–∞—О—Й–Є—Е –≤–Њ—Б–њ—А–Є–љ–Є–Љ–∞—О—В—Б—П –Ї–∞–Ї –љ–µ–њ—А–Є—П—В–љ—Л–µ (–Ј–∞–њ–∞—Е–Є –±–µ–љ–Ј–Є–љ–∞, –∞—Ж–µ—В–Њ–љ–∞, –ї–∞–Ї–Њ–≤, –Ї—А–∞—Б–Њ–Ї, –≥—Г—В–∞–ї–Є–љ–∞ –Є –і—А.);
• –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –Љ—Л—И–µ—З–љ–∞—П —Б–ї–∞–±–Њ—Б—В—М –Є —Г—В–Њ–Љ–ї—П–µ–Љ–Њ—Б—В—М, –∞—В—А–Њ—Д–Є—П –Љ—Л—И—Ж –Є —Б–љ–Є–ґ–µ–љ–Є–µ –Љ—Л—И–µ—З–љ–Њ–є —Б–Є–ї—Л –≤ —Б–≤—П–Ј–Є —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ –Љ–Є–Њ–≥–ї–Њ–±–Є–љ–∞ –Є —Д–µ—А–Љ–µ–љ—В–Њ–≤ —В–Ї–∞–љ–µ–≤–Њ–≥–Њ –і—Л—Е–∞–љ–Є—П;
• –і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ї–Њ–ґ–Є –Є –µ–µ –њ—А–Є–і–∞—В–Ї–Њ–≤ (—Б—Г—Е–Њ—Б—В—М, —И–µ–ї—Г—И–µ–љ–Є–µ, —Б–Ї–ї–Њ–љ–љ–Њ—Б—В—М –Ї –±—Л—Б—В—А–Њ–Љ—Г –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—О –љ–∞ –Ї–Њ–ґ–µ —В—А–µ—Й–Є–љ; —В—Г—Б–Ї–ї–Њ—Б—В—М, –ї–Њ–Љ–Ї–Њ—Б—В—М, –≤—Л–њ–∞–і–µ–љ–Є–µ, —А–∞–љ–љ–µ–µ –њ–Њ—Б–µ–і–µ–љ–Є–µ –≤–Њ–ї–Њ—Б; –Є—Б—В–Њ–љ—З–µ–љ–Є–µ, –ї–Њ–Љ–Ї–Њ—Б—В—М, –њ–Њ–њ–µ—А–µ—З–љ–∞—П –Є—Б—З–µ—А—З–µ–љ–љ–Њ—Б—В—М, —В—Г—Б–Ї–ї–Њ—Б—В—М –љ–Њ–≥—В–µ–є; —Б–Є–Љ–њ—В–Њ–Љ –Ї–Њ–є–ї–Њ–љ–Є—Е–Є–Є – –ї–Њ–ґ–Ї–Њ–Њ–±—А–∞–Ј–љ–∞—П –≤–Њ–≥–љ—Г—В–Њ—Б—В—М –љ–Њ–≥—В–µ–є);
• –∞–љ–≥—Г–ї—П—А–љ—Л–є —Б—В–Њ–Љ–∞—В–Є—В – —В—А–µ—Й–Є–љ—Л, «–Ј–∞–µ–і—Л» –≤ —Г–≥–ї–∞—Е —А—В–∞ (–≤—Б—В—А–µ—З–∞—О—В—Б—П —Г 10–15% –±–Њ–ї—М–љ—Л—Е);
• –≥–ї–Њ—Б—Б–Є—В (—Г 10% –±–Њ–ї—М–љ—Л—Е) – —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –Њ—Й—Г—Й–µ–љ–Є–µ–Љ –±–Њ–ї–Є –Є —А–∞—Б–њ–Є—А–∞–љ–Є—П –≤ –Њ–±–ї–∞—Б—В–Є —П–Ј—Л–Ї–∞, –њ–Њ–Ї—А–∞—Б–љ–µ–љ–Є–µ–Љ –µ–≥–Њ –Ї–Њ–љ—З–Є–Ї–∞, –∞ –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ – –∞—В—А–Њ—Д–Є–µ–є —Б–Њ—Б–Њ—З–Ї–Њ–≤ («–ї–∞–Ї–Є—А–Њ–≤–∞–љ–љ—Л–є» —П–Ј—Л–Ї); —З–∞—Б—В–Њ –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Б–Ї–ї–Њ–љ–љ–Њ—Б—В—М –Ї –њ–∞—А–Њ–і–Њ–љ—В–Њ–Ј—Г –Є –Ї–∞—А–Є–µ—Б—Г;
• –∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Ц–Ъ–Ґ – —Н—В–Њ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П —Б—Г—Е–Њ—Б—В—М—О —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –њ–Є—Й–µ–≤–Њ–і–∞ –Є –Ј–∞—В—А—Г–і–љ–µ–љ–Є—П–Љ–Є, –∞ –Є–љ–Њ–≥–і–∞ –±–Њ–ї—П–Љ–Є –њ—А–Є –≥–ї–Њ—В–∞–љ–Є–Є –њ–Є—Й–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ —Б—Г—Е–Њ–є (—Б–Є–і–µ—А–Њ–њ–µ–љ–Є—З–µ—Б–Ї–∞—П –і–Є—Б—Д–∞–≥–Є—П); —А–∞–Ј–≤–Є—В–Є–µ–Љ –∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–∞—Б—В—А–Є—В–∞ –Є —Н–љ—В–µ—А–Є—В–∞;
• —Б–Є–Љ–њ—В–Њ–Љ «—Б–Є–љ–Є—Е —Б–Ї–ї–µ—А» – —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Б–Є–љ–µ–≤–∞—В–Њ–є –Њ–Ї—А–∞—Б–Ї–Њ–є –Є–ї–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –≥–Њ–ї—Г–±–Є–Ј–љ–Њ–є —Б–Ї–ї–µ—А. –≠—В–Њ –Њ–±—К—П—Б–љ—П–µ—В—Б—П —В–µ–Љ, —З—В–Њ –њ—А–Є –і–µ—Д–Є—Ж–Є—В–µ –ґ–µ–ї–µ–Ј–∞ –љ–∞—А—Г—И–∞–µ—В—Б—П —Б–Є–љ—В–µ–Ј –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ –≤ —Б–Ї–ї–µ—А–µ, –Њ–љ–∞ –Є—Б—В–Њ–љ—З–∞–µ—В—Б—П –Є —З–µ—А–µ–Ј –љ–µ–µ –њ—А–Њ—Б–≤–µ—З–Є–≤–∞–µ—В —Б–Њ—Б—Г–і–Є—Б—В–∞—П –Њ–±–Њ–ї–Њ—З–Ї–∞ –≥–ї–∞–Ј–∞;
• –Є–Љ–њ–µ—А–∞—В–Є–≤–љ—Л–µ –њ–Њ–Ј—Л–≤—Л –љ–∞ –Љ–Њ—З–µ–Є—Б–њ—Г—Б–Ї–∞–љ–Є–µ, –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Г–і–µ—А–ґ–∞—В—М –Љ–Њ—З—Г –њ—А–Є —Б–Љ–µ—Е–µ, –Ї–∞—И–ї–µ, —З–Є—Е–∞–љ–Є–Є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –і–∞–ґ–µ –љ–Њ—З–љ–Њ–µ –љ–µ–і–µ—А–ґ–∞–љ–Є–µ –Љ–Њ—З–Є, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —Б–ї–∞–±–Њ—Б—В—М—О —Б—Д–Є–љ–Ї—В–µ—А–Њ–≤ –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П;
• «—Б–Є–і–µ—А–Њ–њ–µ–љ–Є—З–µ—Б–Ї–Є–є —Б—Г–±—Д–µ–±—А–Є–ї–Є—В–µ—В» – —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –і–ї–Є—В–µ–ї—М–љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –і–Њ —Б—Г–±—Д–µ–±—А–Є–ї—М–љ—Л—Е –≤–µ–ї–Є—З–Є–љ;
• –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М –Ї –Њ—Б—В—А—Л–Љ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ––≤–Є—А—Г—Б–љ—Л–Љ –Є –і—А—Г–≥–Є–Љ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ––≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –њ—А–Њ—Ж–µ—Б—Б–∞–Љ, —Е—А–Њ–љ–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–є, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ –Є –Њ—Б–ї–∞–±–ї–µ–љ–Є–µ–Љ —Б–Є—Б—В–µ–Љ—Л –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞;
• —Б–љ–Є–ґ–µ–љ–Є–µ —А–µ–њ–∞—А–∞—В–Є–≤–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ –Ї–Њ–ґ–µ, —Б–ї–Є–Ј–Є—Б—В—Л—Е –Њ–±–Њ–ї–Њ—З–Ї–∞—Е.
–Ы–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –і–∞–љ–љ—Л–µ
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –ї–∞—В–µ–љ—В–љ–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞
–Ы–∞—В–µ–љ—В–љ—Л–є –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ—В—Б—П –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Б–ї–µ–і—Г—О—Й–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤:
• –∞–љ–µ–Љ–Є—П –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В, —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–µ;
• –Є–Љ–µ—О—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є —Б–Є–і–µ—А–Њ–њ–µ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –≤ —Б–≤—П–Ј–Є —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ –ґ–µ–ї–µ–Ј–∞ –≤ —В–Ї–∞–љ–µ–≤—Л—Е –і–µ–њ–Њ;
• —Г—А–Њ–≤–µ–љ—М —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ —Б–љ–Є–ґ–µ–љ, —З—В–Њ –Њ—В—А–∞–ґ–∞–µ—В —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —В—А–∞–љ—Б–њ–Њ—А—В–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –Ї—А–Њ–≤–Є;
• –Њ–±—Й–∞—П –ґ–µ–ї–µ–Ј–Њ—Б–≤—П–Ј—Л–≤–∞—О—Й–∞—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Б—Л–≤–Њ—А–Њ—В–Ї–Є (–Ю–Ц–°–°) –Ї—А–Њ–≤–Є –њ–Њ–≤—Л—И–µ–љ–∞. –≠—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Њ—В—А–∞–ґ–∞–µ—В —Б—В–µ–њ–µ–љ—М «–≥–Њ–ї–Њ–і–∞–љ–Є—П» —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є –Є –љ–∞—Б—Л—Й–µ–љ–Є—П –ґ–µ–ї–µ–Ј–Њ–Љ —В—А–∞–љ—Б—Д–µ—А—А–Є–љ–∞;
• –њ—А–Є –і–µ—Д–Є—Ж–Є—В–µ –ґ–µ–ї–µ–Ј–∞ –њ—А–Њ—Ж–µ–љ—В –љ–∞—Б—Л—Й–µ–љ–Є—П —В—А–∞–љ—Б—Д–µ—А—А–Є–љ–∞ –ґ–µ–ї–µ–Ј–Њ–Љ —Б–љ–Є–ґ–µ–љ.
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Ц–Ф–Р
–Я—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–Њ–≤–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –њ–Њ—П–≤–ї—П—О—В—Б—П —Е–∞—А–∞–Ї—В–µ—А–љ—Л–µ –і–ї—П –Ц–Ф–Р –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ–±—Й–µ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Ї—А–Њ–≤–Є:
• —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –≤ –Ї—А–Њ–≤–Є;
• —Б–љ–Є–ґ–µ–љ–Є–µ —Б—А–µ–і–љ–µ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –≤ —Н—А–Є—В—А–Њ—Ж–Є—В–∞—Е;
• —Б–љ–Є–ґ–µ–љ–Є–µ —Ж–≤–µ—В–Њ–≤–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П (–Ц–Ф–Р —П–≤–ї—П–µ—В—Б—П –≥–Є–њ–Њ—Е—А–Њ–Љ–љ–Њ–є);
• –≥–Є–њ–Њ—Е—А–Њ–Љ–Є—П —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–∞—П—Б—П –Є—Е –±–ї–µ–і–љ—Л–Љ –њ—А–Њ–Ї—А–∞—И–Є–≤–∞–љ–Є–µ–Љ, –Є –њ–Њ—П–≤–ї–µ–љ–Є–µ –њ—А–Њ—Б–≤–µ—В–ї–µ–љ–Є—П –≤ —Ж–µ–љ—В—А–µ;
• –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ –≤ –Љ–∞–Ј–Ї–µ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є —Б—А–µ–і–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –Љ–Є–Ї—А–Њ—Ж–Є—В–Њ–≤ – —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —Г–Љ–µ–љ—М—И–µ–љ–љ–Њ–≥–Њ –і–Є–∞–Љ–µ—В—А–∞;
• –∞–љ–Є–Ј–Њ—Ж–Є—В–Њ–Ј – –љ–µ–Њ–і–Є–љ–∞–Ї–Њ–≤–∞—П –≤–µ–ї–Є—З–Є–љ–∞ –Є –њ–Њ–є–Ї–Є–ї–Њ—Ж–Є—В–Њ–Ј – —А–∞–Ј–ї–Є—З–љ–∞—П —Д–Њ—А–Љ–∞ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤;
• –љ–Њ—А–Љ–∞–ї—М–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ —А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В–Њ–≤ –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є, –Њ–і–љ–∞–Ї–Њ –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –ґ–µ–ї–µ–Ј–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В–Њ–≤;
• —В–µ–љ–і–µ–љ—Ж–Є—П –Ї –ї–µ–є–Ї–Њ–њ–µ–љ–Є–Є; –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –Њ–±—Л—З–љ–Њ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–µ;
• –њ—А–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –∞–љ–µ–Љ–Є–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —Г–Љ–µ—А–µ–љ–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –°–Ю–≠ (–і–Њ 20–25 –Љ–Љ/—З).
–Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–Љ–Є –≤ –њ—А–∞–Ї—В–Є–Ї–µ –Ї—А–Є—В–µ—А–Є—П–Љ–Є –Ц–Ф–Р —П–≤–ї—П—О—В—Б—П:
– –љ–Є–Ј–Ї–Є–є —Ж–≤–µ—В–Њ–≤–Њ–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М;
– –≥–Є–њ–Њ—Е—А–Њ–Љ–Є—П —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, –Љ–Є–Ї—А–Њ—Ж–Є—В–Њ–Ј;
– —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞;
– –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ю–Ц–°–°;
– —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П —Д–µ—А—А–Є—В–Є–љ–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ.
–Я—А–Є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Ї—А–Њ–≤–Є, –Ї—А–Њ–Љ–µ —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –Є —Д–µ—А—А–Є—В–Є–љ–∞, –≤—Л—П–≤–ї—П—О—В—Б—П —В–∞–Ї–ґ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–µ –Њ—Б–љ–Њ–≤–љ—Л–Љ –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Є–ї–Є –і—А—Г–≥–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ.
–Ы–µ—З–µ–љ–Є–µ
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Б—Г—Й–µ—Б—В–≤—Г—О—В —Б–ї–µ–і—Г—О—Й–Є–µ —Н—В–∞–њ—Л –ї–µ—З–µ–љ–Є—П –Ц–Ф–Р:
• 1––є —Н—В–∞–њ – –Ї—Г–њ–Є—А—Г—О—Й–∞—П —В–µ—А–∞–њ–Є—П, –љ–∞—Ж–µ–ї–µ–љ–љ–∞—П –љ–∞ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –Є –≤–Њ—Б–њ–Њ–ї–љ–µ–љ–Є–µ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –Ј–∞–њ–∞—Б–Њ–≤ –ґ–µ–ї–µ–Ј–∞;
• 2––є —Н—В–∞–њ – —В–µ—А–∞–њ–Є—П, –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—Й–∞—П —В–Ї–∞–љ–µ–≤—Л–µ –Ј–∞–њ–∞—Б—Л –ґ–µ–ї–µ–Ј–∞;
• 3––є —Н—В–∞–њ – –њ—А–Њ—В–Є–≤–Њ—А–µ—Ж–Є–і–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ.
–Э–µ —В–∞–Ї –і–∞–≤–љ–Њ –≥–µ–Љ–Њ—В—А–∞–љ—Б—Д—Г–Ј–Є—П —П–≤–ї—П–ї–∞—Б—М –Њ–і–љ–Є–Љ –Є–Ј —Б–∞–Љ—Л—Е —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е —Б–њ–Њ—Б–Њ–±–Њ–≤ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –∞–љ–µ–Љ–Є–Є –і–∞–ґ–µ –ї–µ–≥–Ї–Њ–є —Б—В–µ–њ–µ–љ–Є —Г –±–Њ–ї—М–љ—Л—Е –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–Є –Є –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–Є –њ—А–Є –і—А—Г–≥–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є—В—Г–∞—Ж–Є—П—Е (—А–Њ–і—Л, –Љ–∞—В–Њ—З–љ—Л–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, –≥–µ–Љ–Њ—А—А–Њ–є, –Њ–њ—Г—Е–Њ–ї–Є –Ц–Ъ–Ґ –Є –і—А.). –°—З–Є—В–∞–ї–Њ—Б—М, —З—В–Њ –љ–∞–і–Њ –Њ—Б—В–∞–љ–Њ–≤–Є—В—М –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ –Є –њ–µ—А–µ–ї–Є—В—М –і–Њ–љ–Њ—А—Б–Ї—Г—О –Ї—А–Њ–≤—М –Є–ї–Є —Н—А–Є—В—А–Њ—Ж–Є—В–љ—Г—О –Љ–∞—Б—Б—Г. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–µ –і–ї—П –њ–µ—А–µ–ї–Є–≤–∞–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –Њ–њ—А–µ–і–µ–ї—П–ї–Є –Є—Б—Е–Њ–і—П –Є–Ј –Њ–±—К–µ–Љ–∞ –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–Є –Є —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞. –Ю–і–љ–∞–Ї–Њ –Њ—А–Є–µ–љ—В–∞—Ж–Є—П –љ–∞ –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –Є–љ–Њ–≥–і–∞ –њ—А–Є–≤–Њ–і–Є–ї–∞ –Ї –њ–µ—А–µ–ї–Є–≤–∞–љ–Є—О –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤ (–і–Њ 5–6 –ї) –і–Њ–љ–Њ—А—Б–Ї–Њ–є –Ї—А–Њ–≤–Є, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–Є–љ–і—А–Њ–Љ–∞ –Љ–∞—Б—Б–Є–≤–љ–Њ–є —В—А–∞–љ—Б—Д—Г–Ј–Є–Є, —А–µ—Ж–Є–і–Є–≤–Њ–Љ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ–Њ–ї–Є–Њ—А–≥–∞–љ–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є —Б –≤—Л—Б–Њ–Ї–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О.
–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –њ–Њ–ї—Г—З–Є–ї–∞ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –љ–Њ–≤–∞—П —В—А–∞–љ—Б—Д—Г–Ј–Є–Њ–љ–љ–∞—П —В–∞–Ї—В–Є–Ї–∞ – –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–љ–∞—П –≥–µ–Љ–Њ—В–µ—А–∞–њ–Є—П, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –њ–µ—А–µ–ї–Є–≤–∞–љ–Є–µ —Н—А–Є—В—А–Њ—Ж–Є—В–љ–Њ–є –Љ–∞—Б—Б—Л –Ј–∞–љ—П–ї–Њ –і–Њ–Љ–Є–љ–Є—А—Г—О—Й–µ–µ –Љ–µ—Б—В–Њ –≤ –ї–µ—З–µ–љ–Є–Є –љ–µ —В–Њ–ї—М–Ї–Њ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є, –љ–Њ –Є –Њ—Б—В—А–Њ–є –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–Є. –Ю–і–љ–∞–Ї–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і–µ—В–∞–ї—М–љ–Њ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Л—Е –Є —Б—Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –≥–µ–Љ–Њ—В–µ—А–∞–њ–Є–Є —Б —Г—З–µ—В–Њ–Љ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ—А–µ–і–Ї–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –љ–µ–Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л–Љ, –љ–µ–Њ–њ—А–∞–≤–і–∞–љ–љ—Л–Љ —В—А–∞–љ—Б—Д—Г–Ј–Є—П–Љ, –Ї–Њ—В–Њ—А—Л—Е, –Ї —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –µ—Й–µ –Љ–љ–Њ–≥–Њ. –Т —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е –Њ–њ—А–∞–≤–і–∞–љ–∞ —В–µ–љ–і–µ–љ—Ж–Є—П –Ї –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—О –њ–µ—А–µ–ї–Є–≤–∞–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ї—А–Њ–≤–Є –≤ —Б–≤—П–Ј–Є —Б —А–Њ—Б—В–Њ–Љ —З–Є—Б–ї–∞ —В–∞–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –Ї–∞–Ї –њ–µ—А–µ–љ–Њ—Б –Є–љ—Д–µ–Ї—Ж–Є–є, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –ї–Њ–ґ–љ—Л—Е –≥—А—Г–њ–њ–Њ–≤—Л—Е –∞–љ—В–Є—В–µ–ї, –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞.
–Ы–µ—З–µ–±–љ–∞—П –њ—А–Њ–≥—А–∞–Љ–Љ–∞ –њ—А–Є –Ц–Ф–Р –≤–Ї–ї—О—З–∞–µ—В:
• —Г—Б—В—А–∞–љ–µ–љ–Є–µ —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ (–ї–µ—З–µ–љ–Є–µ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П);
• –ї–µ—З–µ–±–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ;
• –ї–µ—З–µ–љ–Є–µ –ґ–µ–ї–µ–Ј–Њ—Б–Њ–і–µ—А–ґ–∞—Й–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є;
• —Г—Б—В—А–∞–љ–µ–љ–Є–µ –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ –Є –∞–љ–µ–Љ–Є–Є;
• –≤–Њ—Б–њ–Њ–ї–љ–µ–љ–Є–µ –Ј–∞–њ–∞—Б–Њ–≤ –ґ–µ–ї–µ–Ј–∞ (—В–µ—А–∞–њ–Є—П –љ–∞—Б—Л—Й–µ–љ–Є—П).
• –њ—А–Њ—В–Є–≤–Њ—А–µ—Ж–Є–і–Є–≤–љ—Г—О —В–µ—А–∞–њ–Є—О.
–Я—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є –њ—А–Є—З–Є–љ—Л —А–∞–Ј–≤–Є—В–Є—П –Ц–Ф–Р –Њ—Б–љ–Њ–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –љ–∞ –µ–µ —Г—Б—В—А–∞–љ–µ–љ–Є–µ (–Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –Њ–њ—Г—Е–Њ–ї–Є –ґ–µ–ї—Г–і–Ї–∞, –Ї–Є—И–µ—З–љ–Є–Ї–∞, –ї–µ—З–µ–љ–Є–µ —Н–љ—В–µ—А–Є—В–∞, –Ї–Њ—А—А–µ–Ї—Ж–Є—П –∞–ї–Є–Љ–µ–љ—В–∞—А–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Є –і—А.). –Т —Ж–µ–ї–Њ–Љ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ —А–∞–і–Є–Ї–∞–ї—М–љ–Њ–µ —Г—Б—В—А–∞–љ–µ–љ–Є–µ –њ—А–Є—З–Є–љ—Л –Ц–Ф–Р –љ–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ, –љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Є –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–Є—Е—Б—П –Љ–µ–љ–Њ—А—А–∞–≥–Є—П—Е, –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л—Е –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –і–Є–∞—В–µ–Ј–∞—Е, –њ—А–Њ—П–≤–ї—П—О—Й–Є—Е—Б—П –љ–Њ—Б–Њ–≤—Л–Љ–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П–Љ–Є, —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –Є –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –і—А—Г–≥–Є—Е —Б–Є—В—Г–∞—Ж–Є—П—Е. –Т —В–∞–Ї–Є—Е —Б–ї—Г—З–∞—П—Е –Њ—Б–љ–Њ–≤–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є–Њ–±—А–µ—В–∞–µ—В –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П –ґ–µ–ї–µ–Ј–Њ—Б–Њ–і–µ—А–ґ–∞—Й–Є–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є.
–Я—Г—В—М –≤–≤–µ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –±–Њ–ї—М–љ–Њ–Љ—Г –Ц–Ф–Р –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є—В—Г–∞—Ж–Є–µ–є. –Я—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ї—Г–њ–Є—А—Г—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–µ –Є –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ґ–µ–ї–µ–Ј–∞ (–Я–Ц) –±–Њ–ї—М–љ–Њ–Љ—Г.
–Я–µ—А–≤—Л–є –њ—Г—В—М – –њ–µ—А–Њ—А–∞–ї—М–љ—Л–є – —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ, —Е–Њ—В—П –Є –і–∞—О—Й–Є–Љ –±–Њ–ї–µ–µ –Њ—В—Б—А–Њ—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л.
–Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –њ—А–Є–љ—Ж–Є–њ–∞–Љ–Є –ї–µ—З–µ–љ–Є—П –Я–Ц –і–ї—П –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М —П–≤–ї—П—О—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–µ:
– –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Я–Ц —Б –і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ —В—А–µ—Е–≤–∞–ї–µ–љ—В–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞;
– –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –≥—А—Г–њ–њ—Л –Т (–≤ —В–Њ–Љ —З–Є—Б–ї–µ –Т12), —Д–Њ–ї–Є–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –±–µ–Ј —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞–љ–Є–є;
– –Є–Ј–±–µ–≥–∞–љ–Є–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Я–Ц –≤–љ—Г—В—А—М –њ—А–Є –љ–∞–ї–Є—З–Є–Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –љ–∞—А—Г—И–µ–љ–Є—П –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ;
– –і–Њ—Б—В–∞—В–Њ—З–љ–∞—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –љ–∞—Б—Л—Й–∞—О—Й–µ–≥–Њ –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є (–љ–µ –Љ–µ–љ–µ–µ 3–5 –Љ–µ—Б.);
– –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –Я–Ц –њ–Њ—Б–ї–µ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е —Б–Є—В—Г–∞—Ж–Є—П—Е.
–Ф–ї—П –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –њ—А–Є—А–Њ—Б—В–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –љ–∞–Ј–љ–∞—З–∞—В—М –Њ—В 100 –і–Њ 300 –Љ–≥ —В—А–µ—Е–≤–∞–ї–µ–љ—В–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –≤ —Б—Г—В–Ї–Є. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –љ–µ –Є–Љ–µ–µ—В —Б–Љ—Л—Б–ї–∞, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –ґ–µ–ї–µ–Ј–∞ –њ—А–Є —Н—В–Њ–Љ –љ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П. –Ш–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–µ –Ї–Њ–ї–µ–±–∞–љ–Є—П –≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л —Б—В–µ–њ–µ–љ—М—О –µ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, –Є—Б—В–Њ—Й–µ–љ–Є—П –Ј–∞–њ–∞—Б–Њ–≤, —Б–Ї–Њ—А–Њ—Б—В—М—О —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞, –≤—Б–∞—Б—Л–≤–∞–µ–Љ–Њ—Б—В—М—О, –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –Є –љ–µ–Ї–Њ—В–Њ—А—Л–Љ–Є –і—А—Г–≥–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є. –° —Г—З–µ—В–Њ–Љ —Н—В–Њ–≥–Њ –њ—А–Є –≤—Л–±–Њ—А–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Я–Ц —Б–ї–µ–і—Г–µ—В –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞—В—М—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –љ–∞ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≤ –љ–µ–Љ –Њ–±—Й–µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞, –љ–Њ –Є, –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–∞ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —В—А–µ—Е–≤–∞–ї–µ–љ—В–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞, –Ї–Њ—В–Њ—А–Њ–µ —В–Њ–ї—М–Ї–Њ –Є –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ.
–Я—А–Є—З–Є–љ—Л –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –Я–Ц –і–ї—П –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М:
– –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ (–љ–µ–њ—А–∞–≤–Є–ї—М–љ–∞—П —В—А–∞–Ї—В–Њ–≤–Ї–∞ –њ—А–Є—А–Њ–і—Л –≥–Є–њ–Њ—Е—А–Њ–Љ–љ–Њ–є –∞–љ–µ–Љ–Є–Є –Є –Њ—И–Є–±–Њ—З–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Я–Ц);
– –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–∞—П –і–Њ–Ј–Є—А–Њ–≤–Ї–∞ –Я–Ц (–љ–µ–і–Њ—Г—З–µ—В –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —В—А–µ—Е–≤–∞–ї–µ–љ—В–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –≤ –њ—А–µ–њ–∞—А–∞—В–µ);
– –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–∞—П –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –Я–Ц;
– –љ–∞—А—Г—И–µ–љ–Є–µ –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –Я–Ц, –љ–∞–Ј–љ–∞—З–∞–µ–Љ—Л—Е –≤–љ—Г—В—А—М –±–Њ–ї—М–љ—Л–Љ —Б —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є;
– –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є –њ—А–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –љ–∞—А—Г—И–∞—О—Й–Є—Е –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –ґ–µ–ї–µ–Ј–∞;
– –љ–∞–ї–Є—З–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е (–Њ–Ї–Ї—Г–ї—М—В–љ—Л—Е) –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А—М, —З–∞—Й–µ –≤—Б–µ–≥–Њ –Є–Ј –Њ—А–≥–∞–љ–Њ–≤ –Ц–Ъ–Ґ;
– —Б–Њ—З–µ—В–∞–љ–Є–µ –Ц–Ф–Р —Б –і—А—Г–≥–Є–Љ–Є –∞–љ–µ–Љ–Є—З–µ—Б–Ї–Є–Љ–Є —Б–Є–љ–і—А–Њ–Љ–∞–Љ–Є (–Т12––і–µ—Д–Є—Ж–Є—В–љ–Њ–є, —Д–Њ–ї–Є–µ–≤–Њ–і–µ—Д–Є—Ж–Є—В–љ–Њ–є).
–Т—В–Њ—А–Њ–є –њ—Г—В—М –≤–≤–µ–і–µ–љ–Є—П –Я–Ц – –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ—Л–Љ –Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–Љ. –Я–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –і–ї—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Я–Ц –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ –Љ–Њ–≥—Г—В –±—Л—В—М —Б–ї–µ–і—Г—О—Й–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Б–Є—В—Г–∞—Ж–Є–Є:
– –љ–∞—А—Г—И–µ–љ–Є–µ –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –њ—А–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞ (—Н–љ—В–µ—А–Є—В—Л, —Б–Є–љ–і—А–Њ–Љ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –≤—Б–∞—Б—Л–≤–∞–љ–Є—П, —А–µ–Ј–µ–Ї—Ж–Є—П —В–Њ–љ–Ї–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞, —А–µ–Ј–µ–Ї—Ж–Є—П –ґ–µ–ї—Г–і–Ї–∞ –њ–Њ –Љ–µ—В–Њ–і—Г –С–Є–ї—М—А–Њ—В II —Б –≤—Л–Ї–ї—О—З–µ–љ–Є–µ–Љ –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є);
– –Њ–±–Њ—Б—В—А–µ–љ–Є–µ —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –ґ–µ–ї—Г–і–Ї–∞ –Є–ї–Є –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є;
– –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Я–Ц –і–ї—П –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М, –љ–µ –њ–Њ–Ј–≤–Њ–ї—П—О—Й–∞—П –і–∞–ї—М–љ–µ–є—И–µ–µ –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ –ї–µ—З–µ–љ–Є—П;
– –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –±–Њ–ї–µ–µ –±—Л—Б—В—А–Њ–≥–Њ –љ–∞—Б—Л—Й–µ–љ–Є—П –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –ґ–µ–ї–µ–Ј–Њ–Љ, –љ–∞–њ—А–Є–Љ–µ—А, —Г –±–Њ–ї—М–љ—Л—Е –Ц–Ф–Р, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–µ–і—Б—В–Њ—П—В –Њ–њ–µ—А–∞—В–Є–≤–љ—Л–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ (–Љ–Є–Њ–Љ–∞ –Љ–∞—В–Ї–Є, –≥–µ–Љ–Њ—А—А–Њ–є –Є –і—А.).
–Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Я–Ц –і–ї—П –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М –≤ –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–∞—Е –ґ–µ–ї–µ–Ј–Њ –≤—Б–µ–≥–і–∞ –љ–∞—Е–Њ–і–Є—В—Б—П –≤ —В—А–µ—Е–≤–∞–ї–µ–љ—В–љ–Њ–є —Д–Њ—А–Љ–µ. –Ы–µ—З–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е —Б –Ц–Ф–Р –Є–Љ–µ–µ—В —Б–≤–Њ–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є —Б —Г—З–µ—В–Њ–Љ –Љ–љ–Њ–≥–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Е–∞—А–∞–Ї—В–µ—А–∞ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –≤–Њ–Ј—А–∞—Б—В–∞ –±–Њ–ї—М–љ—Л—Е (–і–µ—В–Є, –њ–Њ–ґ–Є–ї—Л–µ –ї—О–і–Є), –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –∞–љ–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞, –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Я–Ц –Є –і—А. –Ю–±—Й–∞—П –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–Њ—З–љ–∞—П –і–Њ–Ј–∞ –Я–Ц –і–ї—П –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞—П –і–ї—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ –Є –∞–љ–µ–Љ–Є–Є, –Љ–Њ–ґ–µ—В –±—Л—В—М —А–∞—Б—Б—З–Є—В–∞–љ–∞ –њ–Њ —Д–Њ—А–Љ—Г–ї–µ:
–Р = –Ъ—ЕF (100 – 6 –• –Эb) F = 0,0066,
–≥–і–µ –Р – —З–Є—Б–ї–Њ –∞–Љ–њ—Г–ї, –Ъ – –Љ–∞—Б—Б–∞ –±–Њ–ї—М–љ–Њ–≥–Њ –≤ –Ї–≥, –Эb – —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –≤ –≥ %.
–Я—А–Є –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –Я–Ц –≤–Њ–Ј–Љ–Њ–ґ–љ—Л —А–∞–Ј–≤–Є—В–Є–µ —Д–ї–µ–±–Є—В–Њ–≤, –Є–љ—Д–Є–ї—М—В—А–∞—В–Њ–≤, –њ–Њ—В–µ–Љ–љ–µ–љ–Є–µ –Ї–Њ–ґ–Є –≤ –Љ–µ—Б—В–∞—Е –Є–љ—К–µ–Ї—Ж–Є–є, –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —В—П–ґ–µ–ї—Л—Е (–∞–љ–∞—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є–є —И–Њ–Ї). –Т–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ—Л–µ –Є–љ—К–µ–Ї—Ж–Є–Є –±–Њ–ї–µ–Ј–љ–µ–љ–љ—Л, –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е –Њ–љ–Є –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–Є—Б—М —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–∞—А–Ї–Њ–Љ—Л —П–≥–Њ–і–Є—З–љ–Њ–є –Љ—Л—И—Ж—Л [Grasso P., 1973; Greenberg G., 1976]. –Я–Њ –Љ–љ–µ–љ–Є—О –љ–µ–Ї–Њ—В–Њ—А—Л—Е –∞–≤—В–Њ—А–Њ–≤ [Auerbach M. et al., 2007], –Њ—В –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –Я–Ц —Б–ї–µ–і—Г–µ—В –Њ—В–Ї–∞–Ј–∞—В—М—Б—П.
–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –Њ—Б–Њ–±–µ–љ–љ–Њ –±–Њ–ї—М—И–Њ–є –Є–љ—В–µ—А–µ—Б –≤—Л–Ј—Л–≤–∞—О—В –Я–Ц –і–ї—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П —Б —Ж–µ–ї—М—О —В–µ—А–∞–њ–Є–Є –њ–Њ—Б—В–≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –∞–љ–µ–Љ–Є–є. –Т –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —А–∞–±–Њ—В–∞—Е –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –Я–Ц –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –њ—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ—А–Є–µ–Љ–Њ–Љ –ґ–µ–ї–µ–Ј–∞ –≤–љ—Г—В—А—М –њ—А–Є —В–µ—Е –ґ–µ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П—Е. –Я–Њ–Љ–Є–Љ–Њ —Н—В–Њ–≥–Њ, –≤–љ—Г—В—А–Є–≤–µ–љ–љ–∞—П —В–µ—А–∞–њ–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Ј–±–µ–ґ–∞—В—М –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Ї–∞–Ї –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ, –љ–∞–±–ї—О–і–∞—О—Й–Є—Е—Б—П –њ—А–Є –њ—А–Є–µ–Љ–µ –Я–Ц –≤–љ—Г—В—А—М, —В–∞–Ї –Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –≤—Л–Ј—Л–≤–∞–µ–Љ—Л—Е –њ—А–Є –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –Я–Ц, –Њ–і–љ–∞–Ї–Њ —В—А–µ–±—Г–µ—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П —А–µ–∞–љ–Є–Љ–∞—Ж–Є–Њ–љ–љ–Њ–є —Б–ї—Г–ґ–±—Л —Г—З—А–µ–ґ–і–µ–љ–Є—П, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –≤–≤–Њ–і—П—В—Б—П –њ—А–µ–њ–∞—А–∞—В—Л.
–Я–Ц –і–ї—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П
–Ф–ї—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –≤ –†–Њ—Б—Б–Є–Є –њ—А–Є–Љ–µ–љ—П—О—В –Ї–∞—А–±–Њ–Ї—Б–Є–Љ–∞–ї—М—В–Њ–Ј–∞—В –ґ–µ–ї–µ–Ј–∞ (–§–µ—А–Є–љ–ґ–µ–Ї—В®), —Б–∞—Е–∞—А–∞—В –ґ–µ–ї–µ–Ј–∞ (–Т–µ–љ–Њ—Д–µ—А), –≥–ї—О–Ї–Њ–љ–∞—В –ґ–µ–ї–µ–Ј–∞ –Є –і–µ–Ї—Б—В—А–∞–љ –ґ–µ–ї–µ–Ј–∞, –Ї–Њ—В–Њ—А—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є —Б—Д–µ—А–Є—З–µ—Б–Ї–Є–µ –ґ–µ–ї–µ–Ј–Њ—Г–≥–ї–µ–≤–Њ–і–љ—Л–µ –Ї–Њ–ї–ї–Њ–Є–і—Л. –£–≥–ї–µ–≤–Њ–і–љ–∞—П –Њ–±–Њ–ї–Њ—З–Ї–∞ –њ—А–Є–і–∞–µ—В –Ї–Њ–Љ–њ–ї–µ–Ї—Б—Г —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В—М, –Ј–∞–Љ–µ–і–ї—П–µ—В –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –ґ–µ–ї–µ–Ј–∞ –Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞–µ—В –Њ–±—А–∞–Ј—Г—О—Й–Є–µ—Б—П —Д–Њ—А–Љ—Л –≤ –Ї–Њ–ї–ї–Њ–Є–і–љ–Њ–є —Б—Г—Б–њ–µ–љ–Ј–Є–Є.
–Т–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –і–µ–Ї—Б—В—А–∞–љ–∞ –ґ–µ–ї–µ–Ј–∞ –≤—Л–Ј—Л–≤–∞–µ—В –±–Њ–ї—М—И–Њ–µ —З–Є—Б–ї–Њ –∞–љ–∞—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є—Е—Б—П –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М—О –≤ 13,5% —Б–ї—Г—З–∞–µ–≤ [Faich G. –µt Strobos J., 1999], –Є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–∞—В—А–Є–µ–≤–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –≥–ї—О–Ї–Њ–љ–∞—В–∞ –ґ–µ–ї–µ–Ј–∞ –≤ —Б—Г–Ї—А–Њ–Ј–µ –≤—Л–Ј—Л–≤–∞–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–Љ–µ—А—В–µ–ї—М–љ—Л–Љ–Є –Є—Б—Е–Њ–і–∞–Љ–Є. –Ю–і–љ–∞–Ї–Њ —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ–Љ —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—О—В –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –µ–ґ–µ–і–љ–µ–≤–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ —В–µ—А–∞–њ–Є–Є –Ц–Ф–Р.
–°–∞—Е–∞—А–∞—В –ґ–µ–ї–µ–Ј–∞ (III) (–Т–µ–љ–Њ—Д–µ—А®) —П–≤–ї—П–µ—В—Б—П –њ–Њ–њ—Г–ї—П—А–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –і–ї—П –ї–µ—З–µ–љ–Є—П —Б–Є–љ–і—А–Њ–Љ–∞ –Ц–Ф–Р. –≠—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М—О –Є –≤—Л—Б–Њ–Ї–Њ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ —В—А–µ—Е–≤–∞–ї–µ–љ—В–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ —Б —Б–∞—Е–∞—А–∞—В–Њ–Љ –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –і–µ–Ї—Б—В—А–∞–љ–∞ –ґ–µ–ї–µ–Ј–∞ –Є –≥–ї—О–Ї–Њ–љ–∞—В–∞ –ґ–µ–ї–µ–Ј–∞. –Ф–∞–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –Њ–і–Њ–±—А–µ–љ –і–ї—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—П, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –≤ –њ–µ—А–Є–Њ–і –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –Т–µ–љ–Њ—Д–µ—А —Б–ї–µ–і—Г–µ—В –≤–≤–Њ–і–Є—В—М —В–Њ–ї—М–Ї–Њ –≤ —Г—З—А–µ–ґ–і–µ–љ–Є—П—Е, —А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–Є—Е –Њ–±–Њ—А—Г–і–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П —Б–µ—А–і–µ—З–љ–Њ––ї–µ–≥–Њ—З–љ–Њ–є —А–µ–∞–љ–Є–Љ–∞—Ж–Є–Є, —В–∞–Ї –Ї–∞–Ї —З–∞—Б—В–Њ –Љ–Њ–≥—Г—В –Њ—В–Љ–µ—З–∞—В—М—Б—П —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –≤ –≤–Є–і–µ –≥–Є–њ–Њ—В–Њ–љ–Є–Є. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —А–∞–Ј–Њ–≤–∞—П –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–∞—П –і–Њ–Ј–∞ —Б–∞—Е–∞—А–∞—В–∞ –ґ–µ–ї–µ–Ј–∞ (III) —Б–Њ—Б—В–∞–≤–ї—П–µ—В 500 –Љ–≥, –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–Њ —А–∞–Ј–≤–µ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В –≤ 100 –Љ–ї 0,9% —А–∞—Б—В–≤–Њ—А–∞ NaCl –і–ї—П –≤–≤–µ–і–µ–љ–Є—П –≤ —Д–Њ—А–Љ–µ –Є–љ—Д—Г–Ј–Є–Є. –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є–љ—Д—Г–Ј–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ 4,5 —З —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –і–Њ—Б—В—Г–њ–∞ (—Б–ї–µ–і—Г–µ—В –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ –≤—Л—Б–Њ–Ї–∞—П —Б–Ї–Њ—А–Њ—Б—В—М –Є–љ—Д—Г–Ј–Є–Є —Б–≤—П–Ј–∞–љ–∞ —Б —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є). –Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Є—Б—Е–Њ–і–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –њ–Њ–≤—В–Њ—А—П—О—В 1–3 —А–∞–Ј–∞/–љ–µ–і. –і–Њ –њ–Њ–≤—Л—И–µ–љ–Є—П —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ >105 –≥/–ї. –Ч–∞—В–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞ –Љ–Њ–ґ–љ–Њ –њ–µ—А–µ–≤–µ—Б—В–Є –љ–∞ –њ—А–Є–µ–Љ –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е –Я–Ц –і–ї—П –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є. –Ю—Б–љ–Њ–≤–∞–љ–Є–є –Њ–ґ–Є–і–∞—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–є –њ–µ—А–µ–і–Њ–Ј–Є—А–Њ–≤–Ї–Є –ґ–µ–ї–µ–Ј–Њ–Љ –љ–µ –Є–Љ–µ–µ—В—Б—П.
–Ъ–Њ–Љ–њ–ї–µ–Ї—Б –ґ–µ–ї–µ–Ј–∞ —Б –Ї–∞—А–±–Њ–Ї—Б–Є–Љ–∞–ї—М—В–Њ–Ј–Њ–є (–§–µ—А–Є–љ–ґ–µ–Ї—В®) – –љ–Њ–≤—Л–є –љ–µ–і–µ–Ї—Б—В—А–∞–љ–Њ–≤—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б –ґ–µ–ї–µ–Ј–∞, –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ –Ї–Њ—В–Њ—А–Њ–≥–Њ —П–≤–ї—П–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≤–≤–µ–і–µ–љ–Є—П –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј (–і–Њ 1000 –Љ–≥ –Ј–∞ 1 –≤–≤–µ–і–µ–љ–Є–µ) –≤ –Ї–Њ—А–Њ—В–Ї–Є–є –њ—А–Њ–Љ–µ–ґ—Г—В–Њ–Ї –≤—А–µ–Љ–µ–љ–Є (–љ–∞ 1 –Є–љ—Д—Г–Ј–Є—О —В—А–µ–±—Г–µ—В—Б—П 15 –Љ–Є–љ.). –С–ї–∞–≥–Њ–і–∞—А—П —Н—В–Њ–Љ—Г –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ –і–Њ—А–Њ–≥–Њ—Б—В–Њ—П—Й–Є—Е –њ–Њ–≤—В–Њ—А–љ—Л—Е –Є–љ—Д—Г–Ј–Є—П—Е –љ–µ–±–Њ–ї—М—И–Є—Е –і–Њ–Ј –ґ–µ–ї–µ–Ј–∞, –њ—А–Є —Н—В–Њ–Љ –§–µ—А–Є–љ–ґ–µ–Ї—В® —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О. –§–µ—А–Є–љ–ґ–µ–Ї—В® —В–∞–Ї–ґ–µ –Њ–і–Њ–±—А–µ–љ –і–ї—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—П, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –≤ –њ–µ—А–Є–Њ–і –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М (–Ї–∞–Ї –Є –≤ —Б–ї—Г—З–∞–µ —Б–∞—Е–∞—А–∞—В–∞ –ґ–µ–ї–µ–Ј–∞) –љ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –Љ–∞—Б—И—В–∞–±–љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –і–ї—П –Њ—Ж–µ–љ–Ї–Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –і–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –і–ї—П –њ–ї–Њ–і–∞. –Я–Њ —Н—В–Њ–є –њ—А–Є—З–Є–љ–µ –њ–µ—А–µ–і –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –ї—О–±—Л—Е –Я–Ц –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —В—Й–∞—В–µ–ї—М–љ–Њ –Њ—Ж–µ–љ–Є—В—М —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –њ–Њ–ї—М–Ј—Л –Є —А–Є—Б–Ї–Њ–≤.
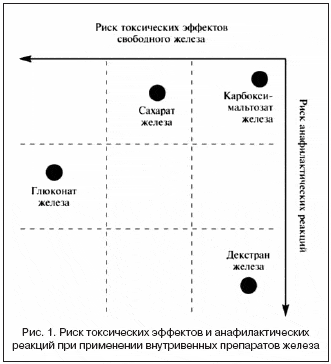
–≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –Я–Ц –Ј–∞–≤–Є—Б—П—В –Њ—В –Є—Е –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б—Л, —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В–Є –Є —Б–Њ—Б—В–∞–≤–∞. –Ъ–Њ–Љ–њ–ї–µ–Ї—Б—Л —Б –љ–Є–Ј–Ї–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б–Њ–є, —В–∞–Ї–Є–µ –Ї–∞–Ї –≥–ї—О–Ї–Њ–љ–∞—В –ґ–µ–ї–µ–Ј–∞, –Љ–µ–љ–µ–µ —Б—В–∞–±–Є–ї—М–љ—Л –Є –±—Л—Б—В—А–µ–µ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞—О—В –≤ –њ–ї–∞–Ј–Љ—Г –ґ–µ–ї–µ–Ј–Њ, –Ї–Њ—В–Њ—А–Њ–µ –≤ —Б–≤–Њ–±–Њ–і–љ–Њ–Љ –≤–Є–і–µ –Љ–Њ–ґ–µ—В –Ї–∞—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞—В—М –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ —А–µ–∞–Ї—В–Є–≤–љ—Л—Е —Д–Њ—А–Љ –Ї–Є—Б–ї–Њ—А–Њ–і–∞, –≤—Л–Ј—Л–≤–∞—О—Й–Є—Е –њ–µ—А–µ–Ї–Є—Б–љ–Њ–µ –Њ–Ї–Є—Б–ї–µ–љ–Є–µ –ї–Є–њ–Є–і–Њ–≤ –Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ —В–Ї–∞–љ–µ–є. –Ч–љ–∞—З–Є—В–µ–ї—М–љ–∞—П —З–∞—Б—В—М –і–Њ–Ј—Л –њ–Њ–і–Њ–±–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤—Л–≤–Њ–і–Є—В—Б—П —З–µ—А–µ–Ј –њ–Њ—З–Ї–Є –≤ –њ–µ—А–≤—Л–µ 4 —З –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Є –љ–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –і–ї—П —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞. –•–Њ—В—П –і–µ–Ї—Б—В—А–∞–љ –ґ–µ–ї–µ–Ј–∞ –Њ–±–ї–∞–і–∞–µ—В –≤—Л—Б–Њ–Ї–Є–Љ–Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б–Њ–є –Є —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В—М—О, –µ–≥–Њ –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ —П–≤–ї—П–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є. –Ъ–∞—А–±–Њ–Ї—Б–Є–Љ–∞–ї—М—В–Њ–Ј–∞—В –ґ–µ–ї–µ–Ј–∞ —Б–Њ—З–µ—В–∞–µ—В –≤ —Б–µ–±–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –≤—Л—Б–Њ–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤ –ґ–µ–ї–µ–Ј–∞, –љ–Њ –љ–µ –≤—Л–Ј—Л–≤–∞–µ—В —А–µ–∞–Ї—Ж–Є–Є –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є, –љ–∞–±–ї—О–і–∞—О—Й–Є–µ—Б—П –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –і–µ–Ї—Б—В—А–∞–љ, –Є, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В —Б–∞—Е–∞—А–∞—В–∞ –Є –≥–ї—О–Ї–Њ–љ–∞—В–∞ –ґ–µ–ї–µ–Ј–∞, –Љ–Њ–ґ–µ—В –≤–≤–Њ–і–Є—В—М—Б—П –≤ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є –і–Њ–Ј–µ [Geisser P., 2009]. –°—Е–µ–Љ–∞ –Њ—Ж–µ–љ–Ї–Є —А–Є—Б–Ї–∞ —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є –∞–љ–∞—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –і–ї—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1 [–°.–Т. –Ь–Њ–Є—Б–µ–µ–≤, 2012].
–Ш–Ј —А–Є—Б—Г–љ–Ї–∞ 1 –≤–Є–і–љ–Њ, —З—В–Њ –≥–ї—О–Ї–Њ–љ–∞—В –ґ–µ–ї–µ–Ј–∞ –Љ–Њ–ґ–µ—В –≤—Л–Ј—Л–≤–∞—В—М –∞–љ–∞—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є –Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Њ–±–ї–∞–і–∞–µ—В –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ. –Ф–µ–Ї—Б—В—А–∞–љ –ґ–µ–ї–µ–Ј–∞, –љ–µ —П–≤–ї—П—П—Б—М –њ—А–µ–њ–∞—А–∞—В–Њ–Љ —Б –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є, —Б–њ–Њ—Б–Њ–±–µ–љ –≤—Л–Ј—Л–≤–∞—В—М –∞–љ–∞—Д–Є–ї–∞–Ї—Б–Є—О. –°–∞—Е–∞—А–∞—В –ґ–µ–ї–µ–Ј–∞ –љ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–≤–Є—В–Є—О –∞–љ–∞—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є —Г –±–Њ–ї—М–љ—Л—Е —Б –Ц–Ф–Р, –љ–Њ –Њ–±–ї–∞–і–∞–µ—В —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є. –Ъ–∞—А–±–Њ–Ї—Б–Є–Љ–∞–ї—М—В–Њ–Ј–∞—В –ґ–µ–ї–µ–Ј–∞ – –§–µ—А–Є–љ–ґ–µ–Ї—В® —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Ї–∞–Ї —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞, —В–∞–Ї –Є –∞–љ–∞—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є.
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–∞—А–±–Њ–Ї—Б–Є–Љ–∞–ї—М—В–Њ–Ј–∞—В–∞ –ґ–µ–ї–µ–Ј–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤–≤–Њ–і–Є—В—М –Ј–∞ 1 –Є–љ—Д—Г–Ј–Є—О –і–Њ 1000 –Љ–≥ –ґ–µ–ї–µ–Ј–∞ (–≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –Ї–∞–њ–µ–ї—М–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 15 –Љ–Є–љ.), –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –і–Њ–Ј–∞ –ґ–µ–ї–µ–Ј–∞ –≤ –≤–Є–і–µ —Б–∞—Е–∞—А–∞—В–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 500 –Љ–≥ –Є –≤–≤–Њ–і–Є—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ 4,5 —З, –∞ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є–љ—Д—Г–Ј–Є–Є –і–µ–Ї—Б—В—А–∞–љ–∞ –ґ–µ–ї–µ–Ј–∞ –і–Њ—Б—В–Є–≥–∞–µ—В 6 —З. –Я—А–Є—З–µ–Љ –≤ –і–≤—Г—Е –њ–Њ—Б–ї–µ–і–љ–Є—Е —Б–ї—Г—З–∞—П—Е –њ–µ—А–µ–і –љ–∞—З–∞–ї–Њ–Љ –Є–љ—Д—Г–Ј–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –≤–≤–µ—Б—В–Є —В–µ—Б—В–Њ–≤—Г—О –і–Њ–Ј—Г –њ—А–µ–њ–∞—А–∞—В–∞. –Т–≤–µ–і–µ–љ–Є–µ –±–Њ–ї—М—И–Њ–є –і–Њ–Ј—Л –ґ–µ–ї–µ–Ј–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–Њ–Ї—А–∞—В–Є—В—М –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–µ —З–Є—Б–ї–Њ –Є–љ—Д—Г–Ј–Є–є –Є –Ј–∞—В—А–∞—В—Л –љ–∞ –ї–µ—З–µ–љ–Є–µ. –Ъ–∞—А–±–Њ–Ї—Б–Є–Љ–∞–ї—М—В–Њ–Ј–∞—В –ґ–µ–ї–µ–Ј–∞ –Њ—В–ї–Є—З–∞–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ —Г–і–Њ–±—Б—В–≤–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П, –љ–Њ –Є –љ–Є–Ј–Ї–Њ–є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О, –∞ —В–∞–Ї–ґ–µ –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞, –Ї–Њ—В–Њ—А—Л–µ –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П –Љ–µ–і–ї–µ–љ–љ—Л–Љ –Є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–љ—Л–Љ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ–Љ –ґ–µ–ї–µ–Ј–∞ –Є–Ј —Б—В–∞–±–Є–ї—М–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ —Б —Г–≥–ї–µ–≤–Њ–і–Њ–Љ, –њ–Њ —Б—В—А—Г–Ї—В—Г—А–µ —Б—Е–Њ–і–љ–Њ–≥–Њ —Б —Д–µ—А—А–Є—В–Є–љ–Њ–Љ.
–Ґ–∞–Ї–ґ–µ –§–µ—А–Є–љ–ґ–µ–Ї—В® –≤–≤–Њ–і—П—В –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –≤ –≤–Є–і–µ –±–Њ–ї—О—Б–∞ (–Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –і–Њ–Ј–∞ – 4 –Љ–ї, –Є–ї–Є 200 –Љ–≥ –ґ–µ–ї–µ–Ј–∞, –љ–µ –±–Њ–ї–µ–µ 3 —А–∞–Ј/–љ–µ–і.) –Є–ї–Є –Ї–∞–њ–µ–ї—М–љ–Њ (–Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –і–Њ–Ј–∞ – 20 –Љ–ї, –Є–ї–Є 1000 –Љ–≥ –ґ–µ–ї–µ–Ј–∞, –љ–µ —З–∞—Й–µ 1 —А–∞–Ј–∞/–љ–µ–і.). –Я–µ—А–µ–і –љ–∞—З–∞–ї–Њ–Љ –ї–µ—З–µ–љ–Є—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —А–∞—Б—Б—З–Є—В–∞—В—М –Њ–њ—В–Є–Љ–∞–ї—М–љ—Г—О –Ї—Г–Љ—Г–ї—П—В–Є–≤–љ—Г—О –і–Њ–Ј—Г –њ—А–µ–њ–∞—А–∞—В–∞, –Ї–Њ—В–Њ—А—Г—О –љ–µ —Б–ї–µ–і—Г–µ—В –њ—А–µ–≤—Л—И–∞—В—М. –Ъ—Г–Љ—Г–ї—П—В–Є–≤–љ—Г—О –і–Њ–Ј—Г, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Г—О –і–ї—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –≤ –Ї—А–Њ–≤–Є –Є –≤–Њ—Б–њ–Њ–ї–љ–µ–љ–Є—П –Ј–∞–њ–∞—Б–Њ–≤ –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, –≤—Л—З–Є—Б–ї—П—О—В –њ–Њ —Д–Њ—А–Љ—Г–ї–µ –У–∞–љ–Ј–Њ–љ–Є:
–Ъ—Г–Љ—Г–ї—П—В–Є–≤–љ—Л–є –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ (–Љ–≥) = –Љ–∞—Б—Б–∞ —В–µ–ї–∞ (–Ї–≥) —Е (—Ж–µ–ї–µ–≤–Њ–є –Эb – —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є–є –Эb) (–≥/–і–ї) —Е 2,4 + —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ (–Љ–≥),
–≥–і–µ —Ж–µ–ї–µ–≤–Њ–є —Г—А–Њ–≤–µ–љ—М –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ (–Эb) —Г —З–µ–ї–Њ–≤–µ–Ї–∞ —Б –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ <35 – 13 –≥/–і–ї (8,1 –Љ–Љ–Њ–ї—М/–ї) –Є —Г —З–µ–ї–Њ–≤–µ–Ї–∞ —Б –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ > –Є–ї–Є = 35 –Ї–≥ 15 –≥/–і–ї (9,3 –Љ–Љ–Њ–ї—М/–ї), —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –і–µ–њ–Њ –ґ–µ–ї–µ–Ј–∞ —Г —З–µ–ї–Њ–≤–µ–Ї–∞ —Б –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ >35 –Ї–≥ –Є = 35 –Ї–≥ = 500 –Љ–≥ –Є <35 –Ї–≥ = 15 –Љ–≥/–Ї–≥ –Љ–∞—Б—Б—Л —В–µ–ї–∞. –Ф–ї—П –њ–µ—А–µ–≤–Њ–і–∞ —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –Є–Ј –Љ–Љ–Њ–ї—М/–ї –≤ –≥/–і–ї –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Б–ї–µ–і—Г–µ—В —Г–Љ–љ–Њ–ґ–Є—В—М –љ–∞ 1,61145.
–§–µ—А—А–Њ–Ї–Є–љ–µ—В–Є–Ї—Г –Ї–∞—А–±–Њ–Ї—Б–Є–Љ–∞–ї—М—В–Њ–Ј–∞—В–∞ –ґ–µ–ї–µ–Ј–∞ –Є–Ј—Г—З–∞–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –њ–Њ–Ј–Є—В—А–Њ–љ–љ–Њ–є —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є —Б —Ж–µ–ї—М—О –Њ—Ж–µ–љ–Ї–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –њ–Њ—Б–ї–µ –≤–≤–µ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –і–Њ–Ј–µ 100 –Љ–≥ [Beshara S. –µt al., 2003]. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–µ–њ–∞—А–∞—В –±—Л—Б—В—А–Њ —А–∞—Б–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤ –њ–µ—З–µ–љ–Є –Є —Б–µ–ї–µ–Ј–µ–љ–Ї–µ, –∞ –Ј–∞—В–µ–Љ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –њ–Њ—Б—В—Г–њ–∞–µ—В –≤ –Ї–Њ—Б—В–љ—Л–є –Љ–Њ–Ј–≥. –£ –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Г—А–Њ–≤–µ–љ—М —Г—В–Є–ї–Є–Ј–∞—Ж–Є–Є –ґ–µ–ї–µ–Ј–∞ —Н—А–Є—В—А–Њ—Ж–Є—В–∞–Љ–Є –±—Л—Б—В—А–Њ –њ–Њ–≤—Л—Б–Є–ї—Б—П –≤ —В–µ—З–µ–љ–Є–µ 6–9 –і–љ–µ–є, –∞ –Ј–∞—В–µ–Љ –њ—А–Њ–і–Њ–ї–ґ–∞–ї –љ–∞—А–∞—Б—В–∞—В—М –±–Њ–ї–µ–µ –Љ–µ–і–ї–µ–љ–љ–Њ. –І–µ—А–µ–Ј 2–3 –љ–µ–і. —Б—В–µ–њ–µ–љ—М —Г—В–Є–ї–Є–Ј–∞—Ж–Є–Є –ґ–µ–ї–µ–Ј–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 91–99% —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ц–Ф–Р –Є 61–84% – —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ –і–µ—Д–Є—Ж–Є—В–Њ–Љ –ґ–µ–ї–µ–Ј–∞.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Worldwide prevalence of anaemia 1993–2005. WHO global database of anaemia. Edited by de Benoist –Т. et al. World Health Organisation. 2008.
2. Iron deficiency anaemia: assessment, prevention, and control. A guide for programme managers. Geneva, WHO, 2001 (WHO/NHD/01.3).
3. Grasso P. Sarcoma after intramuscular iron injection // Br. Med. J., 1973. Vol. 2. –†. 667.
4. Greenberg G. Sarcoma after intramuscular iron injection // Br. Med. J. 1976. Vol. 1. –†. 1508–1509.
5. Auerbach M., Ballard H., Glaspy J. et al. Clinical update: intravenous iron for anaemia // Lancet. 2007. Vol. 369. –†. 1502–1504.
6. Geisser P. The pharmacology and safety profile of ferric carboxymaltose (Ferinject®): structure/reactivity relationships of iron preparations // Port. J. Nephrol. Hypert. 2009. Vol. 23 (1). –†. 11–16.
7. –Ь–Њ–Є—Б–µ–µ–≤ –°.–Т. –Ц–µ–ї–µ–Ј–∞ –Ї–∞—А–±–Њ–Ї—Б–Є–Љ–∞–ї—М—В–Њ–Ј–∞—В (–§–µ—А–Є–љ–ґ–µ–Ї—В) – –љ–Њ–≤—Л–є –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –і–ї—П –ї–µ—З–µ–љ–Є—П –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–Њ–є –∞–љ–µ–Љ–Є–Є // –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—П –Є —В–µ—А–∞–њ–Є—П. 2012. вДЦ 21 (2). –°. 2–7.
8. Faich G., Strobos J. // Am. J. Kidney Dis. 1999. Vol. 33. No. 3. P. 464–470.
9. Beshara S., Sorensen J., Lubberink M. et al. Pharmacokinetics and red cell utilization of 52Fe/59Fe–labelled iron polymaltose in anaemic patients using positron emission tomography // Br. J. Haematol. 2003. Vol. 120. –†. 853–859.












