В настоящее время основным методом лечения первичного рака печени остается хирургическое лечение. Однако остро стоит вопрос о возможности проведения обширных резекций печени, резекций печени при наличии в ней сопутствующих патологических процессов, а также выполнения повторных оперативных вмешательств при диагностировании метахронных опухолей печени, рецидивов и метастазов в оставшейся части печени. При невозможности оперативного вмешательства в связи с выраженными сопутствующими заболеваниями или распространенностью опухолевого процесса используются радиочастотная термоабляция, криодеструкция, артериальная химиоэмболизация и полихимиотерапия.
Материалы и методы
В хирургическом отделении опухолей печени и поджелудочной железы РОНЦ им. Н.Н. Блохина РАМН выполнены 1004 резекции печени, из них 174 (17,3%) по поводу первичного рака печени, среди последних в 85,1% случаев диагностирован ГЦР (148 пациентов) и у 26 пациентов (14,9%) – холангиоцеллюлярный рак. Среди оперированных пациентов мужчин было 106 (60,9%), женщин – 68 (39,1%). Возраст больных варьировал от 13 до 74 лет (средний возраст 49,7 лет). Сопутствующие вирусные гепатиты диагностированы в 43,5% случаев, а гистологически подтвержденный цирроз печени – у 39,2% пациентов. Данные о распространенности опухолевого процесса в печени представлены в таблице 1. Несмотря на преобладание солитарных и монолобарных опухолей в печени, хирургическому лечению подвергались также пациенты с множественными и билобарными очагами при условии соблюдения радикальности операции в объеме R0. Исключение составили 27 пациентов (15,5%), операции которым проводились по жизненным показаниям с санационной целью или при угрозе разрыва опухоли. Обширные резекции печени выполнены у 120 пациентов (69%), из них правосторонняя гемигепатэктомия в 48,8% случаев, левосторонняя – в 27,3%, расширенные гемигепатэктомии – у 23,9% больных. Экономные резекции произведены у 49 (28%) пациентов. В группе с сопутствующим циррозом печени обширные резекции печени выполнены в 58,1% случаев, экономные в 37,5%.
Для проведения обширных резекций печени мы руководствовались следующими показаниями:
• Отсутствие цирроза или цирроз печени Child A.
• Первая или вторая стадии угнетения поглотительно–выделительной функции печени (определяется методом радиоизотопной диагностики 99Tc Brom MESIDA).
• Достаточные размеры остающейся паренхимы печени (не менее 30%, а при сопутствующем циррозе печени – не менее 50%).
• Невозможность выполнения экономной резекции печени.
У 5 больных (3%) использовались локальные методы деструкции (термоабляция или криодеструкция). Данные методы нами используются у больных с солитарными, единичными опухолями печени размером до 5 см и выраженным сопутствующим циррозом печени (Child B).
Для соблюдения радикальности операции при инфильтрации опухолью смежных анатомических структур в 5 случаях мы выполнили резекцию магистральных сосудов, в 2–х – резекцию правого надпочечника и по одному случаю – дистальную резекцию поджелудочной железы и нефрэктомию.
У 19 больных (10,9%) при прогрессировании опухолевого процесса выполнены повторные операции, из них по поводу ГЦР 16 случаев (84%), холангиоцеллюлярного – 3 (16%). Повторные операции на печени проведены у 13 больных (68,4%), из них обширные резекции у 4 пациентов (30,8%), экономные у 9 (69,2%). В остальных случаях (6 человек) в связи с метастатическим поражением лимфатических узлов выполнена лимфодиссекция, у 3 больных опухолевое поражение распространялось на поджелудочную железу, из них в 2 случаях потребовалась операция в объеме гастропанкреатодуоденальной резекции, а в 1 – дистальная резекция поджелудочной железы.
Статистический анализ
Статистическая обработка результатов исследования проведена с использованием программы SPSS (SPSS Inc, Chicago, Illinois). Сравнение качественных и количественных переменных выполнено с помощью chi–square test и Wilcoxon test соответственно. Общая выживаемость оценивалась по методике Kaplan–Meier. Достоверность различия между кривыми выживаемости оценивалась при помощи log–rank test. Прогностические факторы определялись с помощью Cox model, с использованием пошагового выбора, чтобы идентифицировать независимые показатели смерти. Различие между кривыми выживаемости считалось достоверным при р<0,05.
Результаты
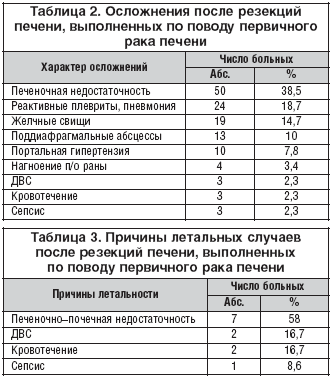
Среди всех больных послеоперационные осложнения диагностированы в 43,6% случаев, их характер представлен в таблице 2. Наиболее часто в структуре осложнений встречались печеночная недостаточность, реактивные плевриты, пневмония и желчные свищи. Послеоперационная летальность в анализированной группе составила 6,9%, основными причинами послужили: медикаментозно некорректируемая печеночная недостаточность, приводящая к полиорганной недостаточности, массивная кровопотеря с последующим развитием ДВС–синдрома, инфекционно–воспалительные осложнения с исходом в сепсис (табл. 3).
Отмечено увеличение количества осложнений и летальности после обширных резекций печени (46,9 и 7,1% соответственно) чем после экономных операций (37 и 4,3%). Послеоперационный период ухудшает также наличие сопутствующих заболеваний печени. Послеоперационные осложнения и летальность при сопутствующей вирусном гепатите составили 55,6 и 11,1% соответственно, а в остальной группе – 38,7 и 4,8%. При сопутствующем циррозе печени данные показатели составили соответственно 56,3 и 11,6%, а в остальной группе 33,3 и 4,8%.
В группе с сопутствующим циррозом печени мы проанализировали частоту послеоперационных осложнений и летальность в зависимости от объема операции. Так, осложнения после обширных и экономных резекций печени диагностированы в 48 и 56,6% случаев соответственно (р=0,31), а летальность в 16 и 5,5% (р=0,08).
После повторных операций летальность отсутствовала, а послеоперационные осложнения диагностированы у 5 пациентов (26,3%).
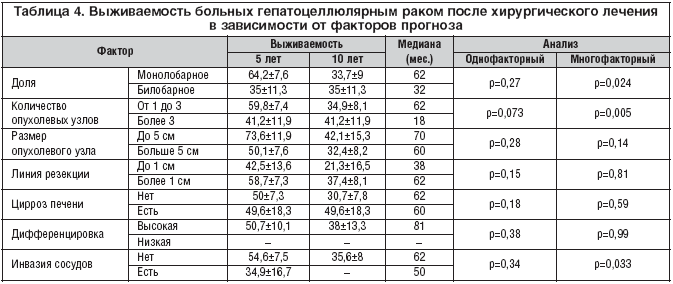
Радикальные операции выполнены у 147 больных (85%). Именно эта группа пациентов рассматривалась в анализе отдаленных результатов лечения больных первичным раком печени. Кумулятивная 5– и 10–летняя выживаемость после радикальных резекций, выполненных по поводу ГЦР, составила 58,8±6,5 и 36,4±7,5% соответственно, а медиана – 62 месяца. В таблице 4 представлены отдаленные результаты лечения ГЦР в зависимости от ряда основных факторов прогноза. При многофакторном анализе выявлено достоверное отрицательное влияние на отдаленные результаты лечения таких факторов, как множественные и билобарные очаги в печени, инвазия магистральных сосудов.
Холангиоцеллюлярный рак имеет более агрессивное течение. Так, нами выявлена только 2–летняя выживаемость – 62,9±16,7%, а медиана составила 27 месяцев.
Обсуждение
В настоящее время резекция остается единственным методом в лечении первичного рака печени [11,14,16], но резектабельность при карциноме печени варьирует от 6 до 67% [5,11,13].
По литературным данным, абсолютными противопоказаниями к резекциям печени являются: гене¬рализация опухолевого процесса на обе половины печени, множественные метастазы в лимфатических узлах и органах (легкие, кости), выраженный цирроз печени, поражение опухолевыми узлами кавальных и портальных ворот печени, нижней полой вены, тяжелое общее со¬стояние больного [3,9,16]. Однако некоторые из вышеперечисленных противопоказаний, такие как множественные, билобарные метастазы в печени, вовлечение магистральных сосудов и соседних органов, мы считаем относительными. В доказательство мы провели хирургическое лечение данной группы пациентов и пришли к выводу, что при условии соблюдения радикальности операции в объеме R0 целесообразно выполнение таких вмешательств на печени, так как это позволяет добиться длительной ремиссии опухолевого процесса, хотя вышеперечисленные факторы являются неблагоприятными в прогнозе опухолевого заболевания (табл. 4).
Мы согласны с мнением, что при резекциях печени по поводу ее поражения злокачественной опухолью, могут выполняться большие и предельно большие резекции печени, где меньший объем резекции невыполним без ущерба радикальности операции, а функциональное состояние оставшейся части печени способно обеспечивать метаболические потребности организма больного в послеоперационном периоде [3,15]. Основной объем оперативных вмешательств на нашем материале пришелся на обширные резекции печени (69%). Даже при сопутствующем циррозе печени (Child A) для обеспечения объема резекции R0 в большинстве случаев (58,1%) мы выполняли обширные операции на печени.
Послеоперационные осложнения после резекции печени при первичном раке, по данным литературы, варьируют от 35 до 52% [7,12,14,19]. В нашем исследовании послеоперационные осложнения возникли у 43,6% пациентов (табл. 2). Специфическими осложнениями принято считать кровотечение из культи печени, желчные перитониты, желчные свищи, поддиафрагмальные абсцессы, секвестрацию участков печени и печеночную недостаточность. В непосредственной связи с частотой и тяжестью послеоперационных осложнений стоит летальность после резекции печени. Процент летальности колеблется от 3,5 до 21,8% [2,14,16,20]. По нашим данным, послеоперационная летальность составила 6,7%. Основной причиной послужила печеночная недостаточность на фоне исходного цирроза печени (табл. 3). Имеются публикации о том, что при больших и предельно больших резекциях печени послеопераци¬онная летальность достигает 30–50% [2,16,20], мы отметили повышение данного показателя только до 7,1%. Большое влияние на непосредственные результаты лечения первичного рака печени оказывают вирусные гепатиты и цирроз печени [7,21]. Это происходит вследствие того, что у пациентов с сопутствующими патологическими процессами в печени хуже ее резервная функция и имеются многоцентровые поражения [15]. По нашим данным, также отмечено увеличение количества послеоперационных осложнений и летальности при сопутствующих вирусных гепатитах – до 55,6 и 11,1% соответственно, при циррозе печени – до 56,3 и 11,6%. Сравнительная оценка непосредственных результатов лечения пациентов с первичным раком печени на фоне цирроза (Child A), перенесших операции различного объема, показала возможность выполнения гемигепатэктомии, но в данной группе следует особо тщательно проводить отбор пациентов на обширную резекцию печени.
Что касается повторных операций при первичном раке печени, то, по данным литературы, летальность составляет от 2,3 до 8% [14,20]. У других авторов [1] отсутствовала послеоперационная летальность при повторных резекциях, а число осложнений при них не превышало аналогичный показатель при первичных вмешательствах. В нашем исследовании послеоперационные осложнения встречались у 26% пациентов, что не превышало их количество после первичных операций, летальности также не отмечено.
Основным критерием эффективности хирургического лечения больных раком печени является выживаемость. Пятилетняя выживаемость после резекции печени при ГЦР, по данным литературы, варьирует от 25 до 55% [5,6]. У нас при тщательном мониторинге пациентов 5–летняя выживаемость составила 58,8%. Многие факторы, такие как общее состояние пациента (сопутствующий гепатит, цирроз печени), макро– и микроскопическая характеристика опухоли (размер, количество опухолевых узлов, внепеченочная распространенность, инвазия сосудов, расстояние от линии резекции до опухоли), являются важными прогностическими факторами [6,20–22]. По нашим данным, при многофакторном анализе выявлено отрицательное влияние на выживаемость пациентов таких факторов, как множественные и билобарные опухоли в печени, инвазия в магистральные сосуды (табл. 4). Однако, по нашим данным, больные с вышеперечисленными факторами живут более 10 лет (табл. 4), поэтому это не должно быть абсолютным противопоказанием к хирургическому лечению.
Результаты лечения холангиоцеллюлярного рака печени остаются неутешительными. По литературным данным, 5–летняя выживаемость пациентов колеблется от 26% до 35% [11]. Но анализ наших данных показал только 2–летнюю выживаемость 62,9%. По нашему мнению, такие неудовлетворительные результаты связаны в большинстве случаев с агрессивным характером опухоли: нам приходилось оперировать больных уже с четвертой стадией заболевания (табл. 1), и операции носили паллиативный характер.
В настоящее время хирургическое лечение включает как резекцию печени, так и ортотопическую трансплантацию печени. Основными показаниями для ортотопической трансплантации являются солитарные опухоли, не превышающие 5 см в диаметре, или не более 3 очагов в печени размером до 3 см, отсутствие внепеченочного распространения опухоли. Выживаемость пациентов между этими группами сопоставима, использование трансплантации печени ограничено из–за сложности в подборе доноров и высокой стоимости [12].

Литература
1. Arii S., Monden K., Niwano M. et al. Results of surgical treatment for recurrent hepatocellular carcinoma: comparison of outcome among patients with multicentric carcinogenesis, intrahepatic metastasis, and extrahepatic.
2. Bartolozzi C., Lencioni R., Caramella D. et al. Treatment of large HCC: transcatherer arterial chemioembolization combined with percutaneous ethanol injection versus repeated transcatherer arterial chemioembolization // Radiology ,1995;197:812–818.
3. Beasley R.P., Hwang L–Y. Overview on the epidemiology of hepatocellular carcinoma.–In: Hollinger F.B., Lemon S.M., Margolis H. S. Viral Hepatitis and liver disease. – Baltimore: Wiliams & Wilkins, – 1991. – p.532–535.
4. Bosch F.X., Ribes J., Borras J. Epidemiology of primary liver cancer.//Semin Liver Dis 1999;19:271–285.
5. Caballero T. et al. Fibrolamellar hepatocellular carcinoma. An immunohistochemical and ultrastructural study//Histopathology, 1985; 9: 445–456.
6. Cance W.G., Stewart A.K., Menck H.R. The National Cancer Data Base Report on treatment patterns for hepatocellular carcinomas: improved survival of surgically resected patients, 1985–1996. //Cancer 2000;88:912–920.
7. Chen J.H., Chau G.Y., Lui W.Y., Tsay S.H., King K.L., Loong C.C., Hsia C.Y., Wu C.W. Surgical results in patients with hepatitis B–related hepatocellular carcinoma and positive hepatitis B early antigen. //World J Surg 2000;24:383–387.
8. Fan S.T., Lai E.G., Lo C.M. et al. Hepatectomy with an ultrasonic dissector for hepatocellular carcinoma // Br. J. Surg., 1996;83:117–120.
9. Fujiyama S. Early detection of hepatocellular carcinoma associated with cirrhosis by combined assay of Des–y–Carboxy Prothrombin and a–fetoprotein: a prospective study // Hepato–Gastroenterology, 1995; 42: 387–393.
10. Huo T.I., Lee S.D., Wu J.C. Staging for hepatocellular carcinoma: look for a perfect classification system. J Hepatol. 2004 Jun;40(6):1041–2.
11. Kawarad A., Mizumoto R. Cholangiocellular carcinoma of the liver //Amer. J. Surg., 1994;3: 354–359.
12. Little S.A., Fong Y. Hepatocellular carcinoma: current surgical management. //Semin Oncol 2001;28:474–486.
13. Lygidakis J. et al. Resution versus Resection combined with Adjuvant Pre– and Post– Operative Chemotherapy–Immunotherapy for Liver cancer. A New Look at an Old Problem // Hepato–Gastroenterol., 1995; 42: 155–161.
14. Nagasue N., Kohno H., Chang Y.C., et al. Liver resection for hepatocellular carcinoma. Results of 229 consecutive patients during 11 years // Ann. Surg., 1993;217:375–384.
15. Noguchi K., Nakashima O., Nakashima Y., Shiota K., Nawata H., Kojiro M. Clinicopathologic study on hepatocellular carcinoma negative for hepatitis B surface antigen and antibody to hepatitis C virus. //Int J Mol Med 2000;6:661–665.
16. Oka H., Kurioka N., Kim N. et al. Prospective study of early detection of hepatocellular carcinoma in patients with cirrhosis//Hepatology,1990;12:680–687.
17. Shimada M., Rikimaru T., Hamatsu T., Yamashita Y., Terashi T., Taguchi K., Tanaka S., Shirabe K., Sugimachi K. The role of macroscopic classification in nodular–type hepatocellular carcinoma. Am J Surg. 2001 Aug;182(2):177–82.
18. Soper R., Himmelreich U., Painter D., Somorjai R.L., Lean C.L., Dolenko B., Mountford C.E., Russell P. Pathology of hepatocellular carcinoma and its precursors using proton magnetic resonance spectroscopy and a statistical classification strategy. Pathology. 2002 Oct;34(5):417–22.
19. Starzl Т.Е., Iwatsiki S. et al. Treatment of fibrolammelar hepatoma with partial or total hepatectomy and transplantation of the liver // Surg.gynecol.Obstet., 1986; 162:145–148.
20. Tang Z.Y. Hepatocellular carcinoma. //J Gastroenterol Hepatol 2000,15 Suppl:G1.
21. Wu C.C., Ho W.L., Chen J.T., Tang J.S., Yeh D.C., P’eng F.K. Hepatitis viral status in patients undergoing liver resection for hepatocellular carcinoma. //Br J Surg 1999;86:1391–1396.
22. Zhang Z., Liu Q., He J., Yang J., Yang G., Wu M. The effect of preoperative transcatheter hepatic arterial chemoembolization on disease–free survival after hepatectomy for hepatocellular carcinoma. //Cancer 2000;89:2606–2612.












