–§–∞–Ї—В–Њ—А—Л –≤—Л–±–Њ—А–∞ —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –њ—А–Є –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–Љ —А–∞–Ї–µ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (–Х.–Т. –Р—А—В–∞–Љ–Њ–љ–Њ–≤–∞)
–Ю—Б–љ–Њ–≤–љ–Њ–є —Ж–µ–ї—М—О —В–µ—А–∞–њ–Є–Є –њ—А–Є –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–Љ —А–∞–Ї–µ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (–Љ–†–Ь–Ц) —П–≤–ї—П–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ґ–Є–Ј–љ–Є, –љ–Њ –Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ –Є–ї–Є —Г–ї—Г—З—И–µ–љ–Є–µ –µ–µ –Ї–∞—З–µ—Б—В–≤–∞. –Т –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є –њ–µ—А–≤–Є—З–љ—Л–є –Љ–†–Ь–Ц —Б–Њ—Б—В–∞–≤–ї—П–µ—В 8% –Њ—В –≤—Б–µ—Е –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б–ї—Г—З–∞–µ–≤ –†–Ь–Ц, –∞ –Њ—В–і–∞–ї–µ–љ–љ—Л–µ –Љ–µ—В–∞—Б—В–∞–Ј—Л –≤ —А–∞–Ј–ї–Є—З–љ—Л–µ —Б—А–Њ–Ї–Є –њ–Њ—Б–ї–µ –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –≤—Л—П–≤–ї—П—О—В—Б—П –љ–µ –Љ–µ–љ–µ–µ —З–µ–Љ —Г 40% –њ–∞—Ж–Є–µ–љ—В–Њ–Ї. –° —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –њ—А–Њ–≥–љ–Њ–Ј–∞ —В—А–Њ–є–љ–Њ–є –љ–µ–≥–∞—В–Є–≤–љ—Л–є –†–Ь–Ц –Є–Љ–µ–µ—В –љ–∞–Є–±–Њ–ї–µ–µ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –≤–∞—А–Є–∞–љ—В —В–µ—З–µ–љ–Є—П. –Т –Њ–і–љ–Њ–Љ –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [1], –≥–і–µ –Њ—Ж–µ–љ–Є–≤–∞–ї—Б—П –њ—А–Њ–≥–љ–Њ–Ј —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –њ–µ—А–≤–Є—З–љ—Л–Љ –Љ–†–Ь–Ц –Є–ї–Є —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –†–Ь–Ц. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —В—А–Њ–є–љ–Њ–є –љ–µ–≥–∞—В–Є–≤–љ—Л–є –†–Ь–Ц –Є–Љ–µ–ї —Б–∞–Љ—Л–µ –љ–Є–Ј–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Њ–±—Й–µ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є. –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –µ–і–Є–љ–Њ–≥–Њ —Б—В–∞–љ–і–∞—А—В–∞ –ї–µ—З–µ–љ–Є—П –Љ–†–Ь–Ц –љ–µ —Б—Г—Й–µ—Б—В–≤—Г–µ—В, –љ–∞ –≤—Л–±–Њ—А –ї–µ—З–µ–±–љ–Њ–є —В–∞–Ї—В–Є–Ї–Є –≤–ї–Є—П—О—В —А–∞–Ј–ї–Є—З–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л вАФ –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ, –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–є –њ–Њ–і—В–Є–њ –†–Ь–Ц –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —В–µ—З–µ–љ–Є–µ –±–Њ–ї–µ–Ј–љ–Є. –Ю—Б–љ–Њ–≤–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –ї–µ—З–µ–љ–Є—П –Љ–†–Ь–Ц —П–≤–ї—П–µ—В—Б—П —Е–Є–Љ–Є–Њ- –Є/–Є–ї–Є –≥–Њ—А–Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П, –Ї–Њ—В–Њ—А–∞—П –Љ–Њ–ґ–µ—В –і–Њ–њ–Њ–ї–љ—П—В—М—Б—П –њ–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ —В–∞—А–≥–µ—В–љ–Њ–є –Є–ї–Є –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є–µ–є.
–Я—А–Є –≤—Л–±–Њ—А–µ —В–µ—А–∞–њ–Є–Є –Љ–†–Ь–Ц –Њ—Б–љ–Њ–≤–Њ–њ–Њ–ї–∞–≥–∞—О—Й–µ–є —П–≤–ї—П–µ—В—Б—П –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –±–Њ–ї–µ–Ј–љ–Є. –Ю—Б–љ–Њ–≤–љ—Л–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–µ –Є–Љ–Љ—Г–љ–Њ–≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є:
–†–≠ (—А–µ—Ж–µ–њ—В–Њ—А—Л —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤);
–†–Я (—А–µ—Ж–µ–њ—В–Њ—А—Л –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–∞);
HER2 (—А–µ—Ж–µ–њ—В–Њ—А—Л —З–µ–ї–Њ–≤–µ—З–µ—Б–Ї–Њ–≥–Њ —Н–њ–Є–і–µ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ —А–Њ—Б—В–∞ 2-–≥–Њ —В–Є–њ–∞);
ki-67 (–Є–љ–і–µ–Ї—Б –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є).
–Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є:
–Љ—Г—В–∞—Ж–Є–Є BRCA 1 –Є 2;
—Н–Ї—Б–њ—А–µ—Б—Б–Є—П PD-L1 –њ—А–Є —В—А–Њ–є–љ–Њ–Љ –љ–µ–≥–∞—В–Є–≤–љ–Њ–Љ –Љ–†–Ь–Ц;
–Љ—Г—В–∞—Ж–Є–Є PIK3CA –њ—А–Є –ї—О–Љ–Є–љ–∞–ї—М–љ–Њ–Љ HER2- –Љ–†–Ь–Ц.
–•–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—П (–•–Ґ) —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ–Њ–є –Њ–њ—Ж–Є–µ–є –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М—И–Њ–≥–Њ —З–Є—Б–ї–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Љ–†–Ь–Ц. –Т –Њ–і–љ–Њ–є –Є–Ј –њ—Г–±–ї–Є–Ї–∞—Ж–Є–є [2] –≤–µ–і—Г—Й–Є—Е –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є—Е —Н–Ї—Б–њ–µ—А—В–Њ–≤ –±—Л–ї–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л —Г—Б–ї–Њ–≤–Є—П, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П –•–Ґ –њ—А–Є –Љ–†–Ь–Ц:
–љ–µ–≥–∞—В–Є–≤–љ—Л–є —Б—В–∞—В—Г—Б –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (–У–†-—Б—В–∞—В—Г—Б);
–љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М (–Є—Б—З–µ—А–њ–∞–љ–љ–Њ—Б—В—М) –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ–є —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є;
—Б–Њ–≤–Љ–µ—Б—В–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б —В–∞—А–≥–µ—В–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є;
–±—Л—Б—В—А–∞—П –њ—А–Њ–≥—А–µ—Б—Б–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П;
–≤—Л—А–∞–ґ–µ–љ–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л;
—Г–≥—А–Њ–ґ–∞—О—Й–Є–µ –ґ–Є–Ј–љ–Є –Љ–µ—В–∞—Б—В–∞–Ј—Л (–≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л–є –Ї—А–Є–Ј).
–Ъ–Њ–љ—Ж–µ–њ—Ж–Є—П ¬Ђ–Њ–ґ–Є–і–∞–µ–Љ–Њ–≥–Њ –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Є–Ј–∞¬ї —А–∞—Б—И–Є—А—П–µ—В –Ї–Њ–љ—В–Є–љ–≥–µ–љ—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –љ—Г–ґ–і–∞—О—В—Б—П –≤ –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є –Њ–±—К–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞ –Є –≤ –ї–µ—З–µ–љ–Є–Є –Ї–Њ—В–Њ—А—Л—Е –•–Ґ –Є–≥—А–∞–µ—В –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М.
–Я–Њ –Љ–µ—А–µ —А–∞–Ј–≤–Є—В–Є—П –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б –Љ–†–Ь–Ц –Љ–Њ–≥—Г—В –њ–Њ–ї—Г—З–Є—В—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –ї–Є–љ–Є–є –•–Ґ. –Я—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–є –≤—Л–±–Њ—А –•–Ґ –њ—А–Є –Љ–†–Ь–Ц вАФ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Љ–Њ–љ–Њ—А–µ–ґ–Є–Љ–Њ–≤. –Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Љ–Њ–≥—Г—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –њ—А–Є –±—Л—Б—В—А–Њ–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–Є –†–Ь–Ц, –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–Љ –Ї—А–Є–Ј–µ, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –±—Л—Б—В—А–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Я—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –•–Ґ –љ–∞–Ј–љ–∞—З–∞—О—В—Б—П –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ—Л –Є —В–∞–Ї—Б–∞–љ—Л –≤ –Љ–Њ–љ–Њ—А–µ–ґ–Є–Љ–µ, –µ—Б–ї–Є –њ–∞—Ж–Є–µ–љ—В–Ї–Є –љ–µ –њ–Њ–ї—Г—З–∞–ї–Є –Є—Е –≤ –љ–µ–Њ–∞–і—К—О–≤–∞–љ—В–љ–Њ–Љ –Є–ї–Є –∞–і—К—О–≤–∞–љ—В–љ–Њ–Љ —А–µ–ґ–Є–Љ–µ. –Ґ–∞–Ї–ґ–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –•–Ґ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ї–∞–њ–µ—Ж–Є—В–∞–±–Є–љ–∞ –Є–ї–Є –≤–Є–љ–Њ—А–µ–ї–±–Є–љ–∞. –Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –≥–Њ–≤–Њ—А–Є—В—Б—П –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є, —В–∞–Ї –Ї–∞–Ї –Њ–љ–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Њ–±—Й–µ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є. –°—Г—Й–µ—Б—В–≤—Г—О—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П –≤ –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є. –¶–µ–ї—Л–є —А—П–і –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ –Љ–Њ–ґ–µ—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є: –љ–∞–њ—А–Є–Љ–µ—А, –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ—Л –Є–Љ–µ—О—В –њ—А–µ–і–µ–ї—М–љ–Њ –і–Њ–њ—Г—Б—В–Є–Љ—Г—О –і–Њ–Ј—Г, –њ—А–Є –њ—А–µ–≤—Л—И–µ–љ–Є–Є –Ї–Њ—В–Њ—А–Њ–є —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Ї–∞—А–і–Є–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М (–і–Њ–Ї—Б–Њ—А—Г–±–Є—Ж–Є–љ 550 –Љ–≥/–Љ2, —Н–њ–Є—А—Г–±–Є—Ж–Є–љ 900 –Љ–≥/–Љ2); —В–∞–Ї—Б–∞–љ—Л —В–∞–Ї–ґ–µ —З–∞—Б—В–Њ –≤—Л–Ј—Л–≤–∞—О—В —А–∞–Ј–≤–Є—В–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (–і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї вАФ —А–Є—Б–Ї –Ї—Г–Љ—Г–ї—П—В–Є–≤–љ–Њ–є –Ј–∞–і–µ—А–ґ–Ї–Є –ґ–Є–і–Ї–Њ—Б—В–Є; –њ–∞–Ї–ї–Є—В–∞–Ї—Б–µ–ї вАФ —А–Є—Б–Ї –Ї—Г–Љ—Г–ї—П—В–Є–≤–љ–Њ–є –љ–µ–є—А–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є). –Э–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –Ї–∞–њ–µ—Ж–Є—В–∞–±–Є–љ–Њ–Љ –Є–Љ–µ–µ—В—Б—П –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —В—П–ґ–µ–ї–Њ–≥–Њ –ї–∞–і–Њ–љ–љ–Њ-–њ–Њ–і–Њ—И–≤–µ–љ–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, —В—П–ґ–µ–ї–Њ–є –і–Є–∞—А–µ–Є [3]. –Я–Њ—Н—В–Њ–Љ—Г –Ј–∞—З–∞—Б—В—Г—О –љ–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–Љ —Н—В–∞–њ–µ –ї–µ—З–µ–љ–Є—П –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ—А–µ–Ї—А–∞—В–Є—В—М –•–Ґ –Є–ї–Є –њ–µ—А–µ–є—В–Є –љ–∞ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й—Г—О —В–µ—А–∞–њ–Є—О.
–Т —Б–≤—П–Ј–Є —Б –≤—Л—И–µ–Є–Ј–ї–Њ–ґ–µ–љ–љ—Л–Љ –Њ—Б–Њ–±–Њ–≥–Њ –≤–љ–Є–Љ–∞–љ–Є—П –Ј–∞—Б–ї—Г–ґ–Є–≤–∞–µ—В –≤–Є–љ–Њ—А–µ–ї–±–Є–љ вАФ –∞–љ—В–Є–Љ–Є–Ї—А–Њ—В—А—Г–±–Њ—З–Ї–Њ–≤—Л–є –∞–≥–µ–љ—В, –љ–∞—А—Г—И–∞—О—Й–Є–є –њ–Њ–ї–Є–Љ–µ—А–Є–Ј–∞—Ж–Є—О —В—Г–±—Г–ї–Є–љ–∞ –Є –њ—А–µ–њ—П—В—Б—В–≤—Г—О—Й–Є–є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –Љ–Є—В–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–µ—А–µ—В–µ–љ–∞. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –±–ї–Њ–Ї–Є—А–Њ–≤–Ї–∞ –Љ–Є—В–Њ–Ј–∞ –Ї–ї–µ—В–Њ–Ї –љ–∞ —Б—В–∞–і–Є–Є –Љ–µ—В–∞—Д–∞–Ј—Л G2вАУM, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –∞–њ–Њ–њ—В–Њ—В–Є—З–µ—Б–Ї–Њ–є –≥–Є–±–µ–ї–Є –Ї–ї–µ—В–Ї–Є.
–Т–Є–љ–Њ—А–µ–ї–±–Є–љ –і–µ–є—Б—В–≤—Г–µ—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–∞ –Љ–Є—В–Њ—В–Є—З–µ—Б–Ї–Є–µ –Љ–Є–Ї—А–Њ—В—А—Г–±–Њ—З–Ї–Є. –Т–ї–Є—П–љ–Є–µ –љ–∞ –∞–Ї—Б–Њ–љ–∞–ї—М–љ—Л–µ –Љ–Є–Ї—А–Њ—В—А—Г–±–Њ—З–Ї–Є, —Б –Ї–Њ—В–Њ—А—Л–Љ —Б–≤—П–Ј–∞–љ–∞ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–∞—П –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є—П, —Г –≤–Є–љ–Њ—А–µ–ї–±–Є–љ–∞ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –µ–≥–Њ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј. –Я–Њ—Н—В–Њ–Љ—Г –≤–Є–љ–Њ—А–µ–ї–±–Є–љ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –љ–Є–Ј–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –љ–µ–є—А–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є –Є —П–≤–ї—П–µ—В—Б—П –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤—Л–±–Њ—А–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Ї–Њ–Љ—Д–Њ—А—В–љ–Њ–є –і–ї—П –њ–∞—Ж–Є–µ–љ—В–∞ —В–µ—А–∞–њ–Є–Є.
–Я—А–Є –≤—Л–±–Њ—А–µ –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –≤–∞—А–Є–∞–љ—В–∞ –•–Ґ —В–∞–Ї–ґ–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М —Д–Њ—А–Љ—Г –≤—Л–њ—Г—Б–Ї–∞ –њ—А–µ–њ–∞—А–∞—В–∞. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–і–∞—О—В –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П. –Я–µ—А–Њ—А–∞–ї—М–љ—Л–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ –Є–Љ–µ—О—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –Ј–∞ —Б—З–µ—В —Г–і–Њ–±—Б—В–≤–∞ –њ—А–Єe–Љ–∞, –Є—Б–Ї–ї—О—З–µ–љ–Є—П –≤–µ–љ–Њ–њ—Г–љ–Ї—Ж–Є–Є –Є —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –љ–µ–є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Я—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е —Д–Њ—А–Љ –≤ —Б–ї—Г—З–∞–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ—А–Њ—Б—В–Њ –Љ–µ–љ—П—В—М –Є—Е –і–Њ–Ј–Є—А–Њ–≤–Ї—Г. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ–∞—Ж–Є–µ–љ—В –Є–Љ–µ–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ—А–Њ—Е–Њ–і–Є—В—М –ї–µ—З–µ–љ–Є–µ –≤ –±–Њ–ї–µ–µ –Ї–Њ–Љ—Д–Њ—А—В–љ—Л—Е –і–Њ–Љ–∞—И–љ–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е, —Г–Љ–µ–љ—М—И–Є—В—М —З–Є—Б–ї–Њ –≤–Є–Ј–Є—В–Њ–≤ –≤ –Ї–ї–Є–љ–Є–Ї—Г –Є —Б–Њ–≤–Љ–µ—Й–∞—В—М —В–µ—А–∞–њ–Є—О —Б —А–∞–±–Њ—В–Њ–є [4, 5]. –Т–Є–љ–Њ—А–µ–ї–±–Є–љ –Ї–∞–њ—Б—Г–ї—Л –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤ –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –•–Ґ –Љ–†–Ь–Ц —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ —Б —В–∞–Ї—Б–∞–љ–∞–Љ–Є [6], –њ—А–Є —Н—В–Њ–Љ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –≤—Б–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Т–Є–љ–Њ—А–µ–ї–±–Є–љ –≤–Ї–ї—О—З–µ–љ –≤ —А–Њ—Б—Б–Є–є—Б–Ї–Є–µ [7] –Є –Ј–∞—А—Г–±–µ–ґ–љ—Л–µ [8] –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є.
–•–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—П –њ—А–Є –ї—О–Љ–Є–љ–∞–ї—М–љ—Л—Е –њ–Њ–і—В–Є–њ–∞—Е HER2- –Љ–†–Ь–Ц (–Ц. –§—А–µ–є–µ—А)
–Т —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б HR+/HER2- –†–Ь–Ц –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Б–Њ—З–µ—В–∞–љ–Є–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є CDK 4/6 –Є–Љ–µ–µ—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –њ–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –С–†–Т –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ –ї–µ—З–µ–љ–Є–µ–Љ. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ CDK 4/6 –њ–Њ–≤—Л—И–∞–µ—В –Њ–±—Й—Г—О –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б 45 –Љ–µ—Б. –і–Њ –±–Њ–ї–µ–µ —З–µ–Љ 50 –Љ–µ—Б.
–Т —Б–ї—Г—З–∞–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ–µ—А–µ—Е–Њ–і–∞ —Б –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ CDK 4/6 –љ–∞ –і—А—Г–≥–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–ї–µ–і—Г—О—Й–Є—Е —В–∞—А–≥–µ—В–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤:
–Є–љ–≥–Є–±–Є—В–Њ—А PI3KCA вАФ –∞–ї–њ–µ–ї–Є—Б–Є–± (–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ SOLAR 1);
–Є–љ–≥–Є–±–Є—В–Њ—А AKT вАФ –Ї–∞–њ–Є–≤–∞—Б–µ—А—В–Є–± (–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ FAKTION);
–Є–љ–≥–Є–±–Є—В–Њ—А mTOR вАФ —Н–≤–µ—А–Њ–ї–Є–Љ—Г—Б.
–Ф–∞–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л —Е—Г–ґ–µ –њ–µ—А–µ–љ–Њ—Б—П—В—Б—П –Є –Є–Љ–µ—О—В —А—П–і –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–ґ–∞—О—Й–Є—Е –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є–Љ–µ—О—В—Б—П –љ–Њ–≤—Л–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –∞–≥–µ–љ—В—Л вАФ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ —Б—Г–њ—А–µ—Б—Б–Њ—А—Л —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (SERD):
—Н–ї–∞—Б–µ—Б—В—А–∞–љ—В (–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ EMERALD), –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–≤—И–Є–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –њ–Њ–Ј–і–љ–Є—Е –ї–Є–љ–Є—П—Е –ї–µ—З–µ–љ–Є—П –≥–Њ—А–Љ–Њ–љ–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ HER2-–љ–µ–≥–∞—В–Є–≤–љ–Њ–≥–Њ –†–Ь–Ц;
–Є–љ–≥–Є–±–Є—В–Њ—А—Л PARP –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Љ—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ BRCA;
–Њ–ї–∞–њ–∞—А–Є–± (–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ OLYMPIAD);
—В–∞–ї–∞–Ј–Њ–њ–∞—А–Є–± (–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ EMBRACA).
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –њ–Њ—П–≤–ї–µ–љ–Є–µ –љ–Њ–≤—Л—Е –Ї–ї–∞—Б—Б–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –•–Ґ –Њ—Б—В–∞–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–Љ –Ј–≤–µ–љ–Њ–Љ –њ–Њ–Љ–Њ—Й–Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –±–Њ–ї—М–љ—Л–Љ, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є —А–∞–Ј–≤–Є—В–Є–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Т–Њ–њ—А–Њ—Б—Л —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –•–Ґ –Є–Ј—Г—З–∞–ї–Є—Б—М –≤ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є III —Д–∞–Ј—Л PEARL [9]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Б –Љ–†–Ь–Ц HR+/HER2- (—Б —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ –Є –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ–Њ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–Љ –†–Ь–Ц), —Г –Ї–Њ—В–Њ—А—Л—Е –Є–Љ–µ–ї–Є—Б—М: —А–µ—Ж–Є–і–Є–≤ –љ–∞ —Д–Њ–љ–µ –∞–і—К—О–≤–∞–љ—В–љ–Њ–є –≥–Њ—А–Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –∞—А–Њ–Љ–∞—В–∞–Ј—Л –Є–ї–Є —З–µ—А–µ–Ј –≥–Њ–і –њ–Њ—Б–ї–µ –µ–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П; –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –љ–∞ —Д–Њ–љ–µ –≥–Њ—А–Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –∞—А–Њ–Љ–∞—В–∞–Ј—Л –њ–Њ –њ–Њ–≤–Њ–і—Г –Љ–µ—В–∞—Б—В–∞–Ј–Є—А—Г—О—Й–µ–є –Њ–њ—Г—Е–Њ–ї–Є –Є–ї–Є —З–µ—А–µ–Ј –Љ–µ—Б—П—Ж –њ–Њ—Б–ї–µ –µ–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П; –Љ–µ—В–∞—Б—В–∞–Ј–Є—А—Г—О—Й–Є–µ –Њ–њ—Г—Е–Њ–ї–Є. –°—В—А–∞—В–Є—Д–Є–Ї–∞—Ж–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (n=300) –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–∞—Б—М –њ–Њ —Б–ї–µ–і—Г—О—Й–Є–Љ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ: –Љ–µ—В–∞—Б—В–∞–Ј—Л (–≤–љ—Г—В—А–µ–љ–љ–Є–µ –Њ—А–≥–∞–љ—Л / –і—А—Г–≥–∞—П –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є—П); —А–∞–љ–µ–µ –≤—Л—П–≤–ї–µ–љ–љ–∞—П –≥–Њ—А–Љ–Њ–љ–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М; –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–∞—П –•–Ґ –њ–Њ –њ–Њ–≤–Њ–і—Г –Љ–µ—В–∞—Б—В–∞–Ј–Є—А—Г—О—Й–µ–є –Њ–њ—Г—Е–Њ–ї–Є.
–Я–∞—Ж–Є–µ–љ—В–Ї–Є –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –љ–∞ 2 —А–∞–≤–љ—Л–µ –≥—А—Г–њ–њ—Л: 1-—П –≥—А—Г–њ–њ–∞ –њ–Њ–ї—Г—З–∞–ї–∞ —Д—Г–ї–≤–µ—Б—В—А–∞–љ—В 500 –Љ–≥ –љ–∞ 1-–є –Є 15-–є –і–љ–Є 1-–≥–Њ —Ж–Є–Ї–ї–∞, –Ј–∞—В–µ–Љ 1-–є –і–µ–љ—М –Ї–∞–ґ–і–Њ–≥–Њ 28-–і–љ–µ–≤–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞ + –њ–∞–ї–±–Њ—Ж–Є–Ї–ї–Є–± 125 –Љ–≥ —Б 1-–≥–Њ –њ–Њ 21-–є –і–µ–љ—М –Ї–∞–ґ–і–Њ–≥–Њ 28-–і–љ–µ–≤–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞; 2-—П –≥—А—Г–њ–њ–∞ –њ–Њ–ї—Г—З–∞–ї–∞ –Ї–∞–њ–µ—Ж–Є—В–∞–±–Є–љ 1250 –Љ–≥/–Љ2 (1000 –Љ–≥/–Љ2 –њ–Њ–ї—Г—З–∞–ї–Є –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Б—В–∞—А—И–µ 70 –ї–µ—В) 2 —А/—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 2 –љ–µ–і. –Ї–∞–ґ–і–Њ–≥–Њ 3-–љ–µ–і–µ–ї—М–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞. –Т –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В–µ –љ–µ –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –С–†–Т –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Г—О —В–µ—А–∞–њ–Є—О –Є–ї–Є –•–Ґ (—А–Є—Б. 1).
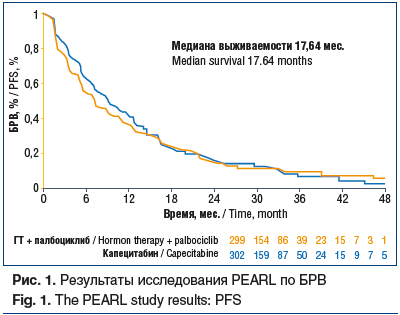
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Љ–љ–Њ–≥–Њ—Д–∞–Ї—В–Њ—А–љ—Л—Е –∞–љ–∞–ї–Є–Ј–Њ–≤ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ—А–Є –ї—О–Љ–Є–љ–∞–ї—М–љ—Л—Е –њ–Њ–і—В–Є–њ–∞—Е –Љ–†–Ь–Ц –µ—Б—В—М –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –±–∞–Ј—Л –і–∞–љ–љ—Л—Е SEER (n=18 322) —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –љ–∞–ї–Є—З–Є–µ –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤ –≤ –њ–µ—З–µ–љ—М, –ї–µ–≥–Ї–Є–µ –Є –≥–Њ–ї–Њ–≤–љ–Њ–є –Љ–Њ–Ј–≥, –∞ —В–∞–Ї–ґ–µ –љ–∞–ї–Є—З–Є–µ –Ї–Њ—Б—В–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤ —П–≤–ї—П–µ—В—Б—П –Ї—А–∞–є–љ–µ –њ–ї–Њ—Е–Є–Љ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–Љ. –Ь–љ–Њ–≥–Њ—Д–∞–Ї—В–Њ—А–љ—Л–є –∞–љ–∞–ї–Є–Ј –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї, —З—В–Њ –≤–Њ–Ј—А–∞—Б—В, —А–∞—Б–∞, —Б–µ–Љ–µ–є–љ–Њ–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ, —Б—В–µ–њ–µ–љ—М –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ—Б—В–Є –Њ–њ—Г—Е–Њ–ї–Є, –њ–Њ–і—В–Є–њ –Є —А–∞–Ј–Љ–µ—А –Њ–њ—Г—Е–Њ–ї–Є, –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –њ–µ—А–≤–Є—З–љ–Њ–є –Њ–њ—Г—Е–Њ–ї–Є –Є –ї—Г—З–µ–≤–∞—П —В–µ—А–∞–њ–Є—П –Є–ї–Є –•–Ґ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ —П–≤–ї—П—О—В—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ–Є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є [10, 11]. –Ґ–∞–Ї–ґ–µ –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ –њ–Њ–ї–Є—Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—П –≥–Њ—А–∞–Ј–і–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–µ–µ –Љ–Њ–љ–Њ—Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є, –љ–Њ –њ—А–Є —Н—В–Њ–Љ –±–Њ–ї–µ–µ —В–Њ–Ї—Б–Є—З–љ–∞. –Я–Њ–ї–Є—Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—П —Г–ї—Г—З—И–∞–µ—В –С–†–Т, –љ–µ –≤–ї–Є—П—П –њ—А–Є —Н—В–Њ–Љ –љ–∞ –Њ–±—Й—Г—О –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М. –С–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ–∞—П –•–Ґ –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –Т–С–Я –Є –Ю–Т —Г –±–Њ–ї—М–љ—Л—Е –Љ–†–Ь–Ц. –Т–∞–ґ–љ—Л–Љ –Љ–Њ–Љ–µ–љ—В–Њ–Љ —П–≤–ї—П–µ—В—Б—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Њ—Ж–µ–љ–Ї–Є —А–Є—Б–Ї–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Є–Ј–∞ –і–Њ –µ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П –Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–Њ–љ–Њ—Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є.
–Э–∞–њ–Њ–Љ–љ–Є–Љ, —З—В–Њ –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л–є –Ї—А–Є–Ј вАФ —Н—В–Њ —В—П–ґ–µ–ї–∞—П –њ–Њ–ї–Є–Њ—А–≥–∞–љ–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ–Љ–∞—П –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –њ—А–Є–Ј–љ–∞–Ї–∞–Љ –Є —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ, –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ –і–∞–љ–љ—Л–Љ –Є –±—Л—Б—В—А–Њ–Љ—Г –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Т–Є—Б—Ж–µ—А–∞–ї—М–љ—Л–є –Ї—А–Є–Ј –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤, –љ–Њ –Є —В—П–ґ–µ–ї—Л–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Є—Е —Д—Г–љ–Ї—Ж–Є–є, —З—В–Њ —П–≤–ї—П–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–µ–є –±–Њ–ї–µ–µ –±—Л—Б—В—А–Њ–µ —А–∞–Ј–≤–Є—В–Є–µ —Н—Д—Д–µ–Ї—В–∞ (–Њ–і–љ–∞–Ї–Њ —Н—В–Њ –љ–µ –Є–Љ–µ–µ—В –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ—Л—Е –і–∞–љ–љ—Л—Е), —В–∞–Ї –Ї–∞–Ї –і—А—Г–≥–Є—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ –ї–µ—З–µ–љ–Є—П –љ–∞ —Д–Њ–љ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Љ–Њ–ґ–µ—В –љ–µ –±—Л—В—М (—Г—А–Њ–≤–µ–љ—М –і–Њ–Ї–∞–Ј–∞–љ–љ–Њ—Б—В–Є: —Н–Ї—Б–њ–µ—А—В–љ–Њ–µ –Љ–љ–µ–љ–Є–µ).
–Я–µ—А–Њ—А–∞–ї—М–љ—Л–µ —Е–Є–Љ–Є–Њ–њ—А–µ–њ–∞—А–∞—В—Л –≤ —В–µ—А–∞–њ–Є–Є –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М, –Њ—Б–љ–Њ–≤—Л–≤–∞—П—Б—М: –љ–∞ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–µ –Њ–њ—Г—Е–Њ–ї–Є: HR+, –≥–Њ—А–Љ–Њ–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Є–Ј–∞ –Є–ї–Є –Ї–Њ—Б—В–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤; –љ–∞ –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–∞: –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ, —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –∞–ї–Њ–њ–µ—Ж–Є–Є; –љ–∞ —Г—А–Њ–≤–љ–µ —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є: —Е–Њ—А–Њ—И–∞—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М; –љ–∞ –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–Є –≤—А–∞—З–∞: –Њ–і–Њ–±—А–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–∞—Г—З–љ–Њ–µ —Б–Њ–Њ–±—Й–µ—Б—В–≤–Њ –Њ–±–ї–∞–і–∞–µ—В –±–Њ–ї—М—И–Є–Љ –Њ–±—К–µ–Љ–Њ–Љ –і–∞–љ–љ—Л—Е –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤–Є–љ–Њ—А–µ–ї–±–Є–љ, –Ї–∞–њ–µ—Ж–Є—В–∞–±–Є–љ –Є –Є—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є.
–Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤–Є–љ–Њ—А–µ–ї–±–Є–љ–∞ –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –≤ —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Т —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є NorBREAST-231 II —Д–∞–Ј—Л —Г—З–∞—Б—В–≤–Њ–≤–∞–ї–Є 2 –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤: –≥—А—Г–њ–њ–∞ A (n=66) –њ–Њ–ї—Г—З–∞–ї–∞ –≤–Є–љ–Њ—А–µ–ї–±–Є–љ –Ї–∞–њ—Б—Г–ї—Л –µ–ґ–µ–љ–µ–і–µ–ї—М–љ–Њ 60 –Љ–≥/–Љ2 –≤ 1, 8 –Є 15-–є –і–љ–Є 1-–≥–Њ —Ж–Є–Ї–ї–∞, –Ј–∞—В–µ–Љ —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –і–Њ–Ј—Л –і–Њ 80 –Љ–≥/–Љ2 –≤ 1, 8 –Є 15-–є –і–љ–Є —Б–ї–µ–і—Г—О—Й–Є—Е —Ж–Є–Ї–ї–Њ–≤ (–њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є 3вАУ4-–є —Б—В–µ–њ–µ–љ–Є); –≥—А—Г–њ–њ–∞ B (n=65) –њ–Њ–ї—Г—З–∞–ї–∞ –њ–∞–Ї–ї–Є—В–∞–Ї—Б–µ–ї –µ–ґ–µ–љ–µ–і–µ–ї—М–љ–Њ 80 –Љ–≥/–Љ2 –≤ 1, 8 –Є 15-–є –і–љ–Є [6]. –Я–µ—А–≤–Є—З–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –±—Л–ї —Г—А–Њ–≤–µ–љ—М –Ї–Њ–љ—В—А–Њ–ї—П –љ–∞–і –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ.
–°—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–є —А–∞–Ј–љ–Є—Ж—Л (—В–∞–±–ї. 1, 2) —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Ї–Њ–љ—В—А–Њ–ї—П –љ–∞–і –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ, –Њ–і–љ–∞–Ї–Њ –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –≤–Є–љ–Њ—А–µ–ї–±–Є–љ–Њ–Љ –Њ—В–Љ–µ—З–∞–ї—Б—П –ї—Г—З—И–Є–є –Њ—В–≤–µ—В. –° —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –С–†–Т –Є –Љ–µ–і–Є–∞–љ—Л –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –≤ –≥—А—Г–њ–њ–∞—Е –±—Л–ї–Є —Б—Е–Њ–ґ–Є–Љ–Є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤–Є–љ–Њ—А–µ–ї–±–Є–љ —П–≤–ї—П–µ—В—Б—П —Е–Њ—А–Њ—И–Є–Љ –Ї–∞–љ–і–Є–і–∞—В–Њ–Љ –і–ї—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –•–Ґ –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є.

–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞ –ґ–µ–љ—Б–Ї–Њ–≥–Њ –њ–Њ–ї–∞ (–°.–Э. –І–µ—А–љ—П–і—М–µ–≤–∞)
–Я–∞—Ж–Є–µ–љ—В–Ї–∞ –Ь., 58 –ї–µ—В. –†–Њ—Б—В 159 —Б–Љ, –Љ–∞—Б—Б–∞ —В–µ–ї–∞ 65 –Ї–≥.
–Ф–Є–∞–≥–љ–Њ–Ј: —А–∞–Ї –њ—А–∞–≤–Њ–є –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л T1N2M0 IIA —Б—В–∞–і–Є—П. –Ф–∞—В–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –і–Є–∞–≥–љ–Њ–Ј–∞ вАФ –Њ–Ї—В—П–±—А—М 2017 –≥. –Я–Њ –і–∞–љ–љ—Л–Љ –£–Ч–Ш –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, –≤—Л–њ–Њ–ї–љ–µ–љ–љ–Њ–≥–Њ –њ–Њ –Љ–µ—Б—В—Г –ґ–Є—В–µ–ї—М—Б—В–≤–∞ –≤ —Б–µ–љ—В—П–±—А–µ 2017 –≥., –≤—Л—П–≤–ї–µ–љ —Г–Ј–µ–ї —А–∞–Ј–Љ–µ—А–Њ–Љ 1 —Б–Љ –≤ –њ—А–∞–≤–Њ–є –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј–µ. –Я—А–Є –Љ–∞–Љ–Љ–Њ–≥—А–∞—Д–Є–Є –≤ –Њ–Ї—В—П–±—А–µ 2017 –≥.–≤ –≤–µ—А—Е–љ–µ–Љ –Ї–≤–∞–і—А–∞–љ—В–µ –њ—А–∞–≤–Њ–є –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Њ–њ—А–µ–і–µ–ї—П–ї–Њ—Б—М 1 —Г–Ј–ї–Њ–≤–Њ–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –љ–µ–њ—А–∞–≤–Є–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л —А–∞–Ј–Љ–µ—А–Њ–Љ 10√Ч15 –Љ–Љ —Б —В—П–ґ–Є—Б—В—Л–Љ –Ї–Њ–љ—В—Г—А–Њ–Љ; BAIRADS —Б–њ—А–∞–≤–∞ 4, —Б–ї–µ–≤–∞ 0.
–Ю–±—Й–µ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ: –±–µ–Ј –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є.
–У–Є—Б—В–Њ–ї–Њ–≥–Є—П: –Є–љ–≤–∞–Ј–Є–≤–љ—Л–є —А–∞–Ї –њ—А–∞–≤–Њ–є –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л III–Р —Б—В–∞–і–Є–Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ—Б—В–Є —Б –Љ–µ—В–∞—Б—В–∞–Ј–∞–Љ–Є –≤ 7 –њ–Њ–і–Љ—Л—И–µ—З–љ—Л—Е –ї–Є–Љ—Д–Њ—Г–Ј–ї–Њ–≤.
–Ш–Љ–Љ—Г–љ–Њ–≥–Є—Б—В–Њ—Е–Є–Љ–Є—П: –†–≠ вАФ 8, –†–Я вАФ 6; –љ–µ–≥–∞—В–Є–≤–љ—Л–є —Б—В–∞—В—Г—Б –њ–Њ –Њ–љ–Ї–Њ–≥–µ–љ—Г вАФ HER2neu, ki-67 вАФ 44%.
–°–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П: –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–∞—П –±–Њ–ї–µ–Ј–љ—М II —Б—В–∞–і–Є–Є, 2-–є —Б—В–µ–њ–µ–љ–Є, —А–Є—Б–Ї 3, —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М 1-–є —Б—В–µ–њ–µ–љ–Є, –≥–Є–њ–µ—А—В—А–Њ—Д–Є—П –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞.
–Я–Њ –і–∞–љ–љ—Л–Љ —В—А–µ–њ–∞–љ–Њ–±–Є–Њ–њ—Б–Є–Є: –Є–љ–≤–∞–Ј–Є–≤–љ—Л–є —А–∞–Ї –њ—А–∞–≤–Њ–є –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л 3-–є —Б—В–µ–њ–µ–љ–Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ—Б—В–Є.
–Ъ–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ. –Т –Њ–Ї—В—П–±—А–µ 2017 –≥. –њ–∞—Ж–Є–µ–љ—В–Ї–µ –±—Л–ї–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ —А–∞–і–Є–Ї–∞–ї—М–љ–∞—П –Љ–∞—Б—В—Н–Ї—В–Њ–Љ–Є—П –њ–Њ –Ь–∞–і–і–µ–љ—Г —Б–њ—А–∞–≤–∞. –Т –Њ–Ї—В—П–±—А–µ 2017 –≥. вАФ —П–љ–≤–∞—А–µ 2018 –≥. –њ—А–Њ–≤–µ–і–µ–љ–∞ —Б—В–∞–љ–і–∞—А—В–љ–∞—П –∞–і—К—О–≤–∞–љ—В–љ–∞—П –•–Ґ: 4 –Ї—Г—А—Б–∞ AC + 4 –Ї—Г—А—Б–∞ –і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї–∞. –Ф–∞–љ–љ—Л–µ –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є (–Ъ–Ґ) –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є, –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –≤ —П–љ–≤–∞—А–µ 2018 –≥.: –±–µ–Ј –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є.
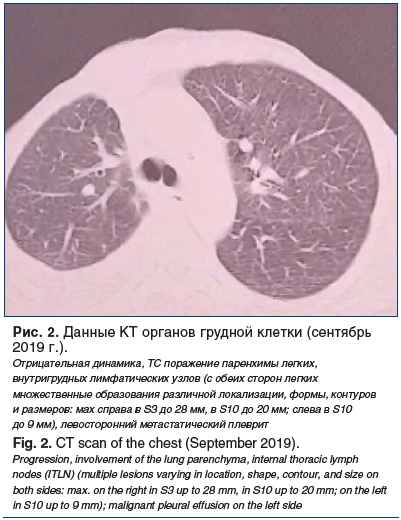
–Ф–∞–ї–µ–µ –≤ –Њ–Ї—В—П–±—А–µ 2017 –≥. вАФ —Б–µ–љ—В—П–±—А–µ 2019 –≥. –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –ї—Г—З–µ–≤–∞—П —В–µ—А–∞–њ–Є—П –Є –љ–∞–Ј–љ–∞—З–µ–љ–∞ –∞–і—К—О–≤–∞–љ—В–љ–∞—П –≥–Њ—А–Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є: —В–∞–Љ–Њ–Ї—Б–Є—Д–µ–љ 20 –Љ–≥ –≤ —В–µ—З–µ–љ–Є–µ 3 –ї–µ—В. –Т —Б–µ–љ—В—П–±—А–µ 2019 –≥. —Г –њ–∞—Ж–Є–µ–љ—В–Ї–Є –њ–Њ—П–≤–Є–ї–Є—Б—М –њ—А–Є–Ј–љ–∞–Ї–Є –і—Л—Е–∞—В–µ–ї—М–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, –Њ–і—Л—И–Ї–∞ –њ—А–Є –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –љ–∞–≥—А—Г–Ј–Ї–µ, –Ї–∞—И–µ–ї—М. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Ъ–Ґ –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є (—Б–µ–љ—В—П–±—А—М 2019 –≥.) –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 2.
–Т –љ–Њ—П–±—А–µ 2019 –≥. вАФ –∞–њ—А–µ–ї–µ 2020 –≥. –њ—А–Њ–≤–µ–і–µ–љ–∞ –≥–Њ—А–Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є: —Д—Г–ї–≤–µ—Б—В—А–∞–љ—В 500 –Љ–≥ 5 –Ї—Г—А—Б–Њ–≤. –Т –∞–њ—А–µ–ї–µ 2020 –≥. —Г –њ–∞—Ж–Є–µ–љ—В–Ї–Є –Њ—В–Љ–µ—З–µ–љ—Л: –і—Л—Е–∞—В–µ–ї—М–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, —Г—Б–Є–ї–µ–љ–Є–µ –Њ–і—Л—И–Ї–Є, –Ї–∞—И–µ–ї—М, –љ–∞—А–∞—Б—В–∞–љ–Є–µ –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–ї–µ–≤—А–Є—В–∞, –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–∞–Ј–Љ–µ—А–Њ–≤ –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤ –≤ –ї–µ–≥–Ї–Є—Е. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Ъ–Ґ –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є (–∞–њ—А–µ–ї—М 2020 –≥.) –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 3.

–£ –њ–∞—Ж–Є–µ–љ—В–Ї–Є –њ–Њ—П–≤–Є–ї–Є—Б—М –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є –≤ –≤–Є–і–µ –∞—В–∞–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Є –љ–∞—А–∞—Б—В–∞–љ–Є–µ –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є. –Ъ–Ґ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ (–∞–њ—А–µ–ї—М 2020 –≥.): –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –≤ –ї–µ–≤–Њ–є –ї–Њ–±–љ–Њ–є –і–Њ–ї–µ (18 –Љ–Љ) –Є –њ—А–∞–≤–Њ–є –≥–µ–Љ–Є—Б—Д–µ—А–µ –Љ–Њ–Ј–ґ–µ—З–Ї–∞ (7 –Љ–Љ) –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞.
–Т –∞–њ—А–µ–ї–µ 2020 –≥. –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –њ–∞–ї–ї–Є–∞—В–Є–≤–љ–∞—П –ї—Г—З–µ–≤–∞—П —В–µ—А–∞–њ–Є—П –љ–∞ –≤–µ—Б—М –Њ–±—К–µ–Љ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞. –°–Њ—Б—В–Њ—П–љ–Є–µ –±—Л–ї–Њ —А–∞—Б—Ж–µ–љ–µ–љ–Њ –Ї–∞–Ї –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л–є –Ї—А–Є–Ј.
–Я—А–Њ–≤–Њ–і–Є–Љ–∞—П —В–µ—А–∞–њ–Є—П. –° –∞–њ—А–µ–ї—П 2020 –≥. –њ–Њ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –њ–Њ–ї—Г—З–∞–µ—В –•–Ґ –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є: –њ–µ—А–Њ—А–∞–ї—М–љ–Њ –≤–Є–љ–Њ—А–µ–ї–±–Є–љ 60 –Љ–≥/–Љ2 –њ–µ—А–≤—Л–µ 3 –љ–µ–і. (100 –Љ–≥), –і–∞–ї–µ–µ 80 –Љ–≥/–Љ2 (130 –Љ–≥) –µ–ґ–µ–љ–µ–і–µ–ї—М–љ–Њ.
–Т –љ–∞—З–∞–ї–µ —В–µ—А–∞–њ–Є–Є –Њ—В–Љ–µ—З–∞–ї–∞—Б—М –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ (–њ–Њ –і–∞–љ–љ—Л–Љ –Ъ–Ґ –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є —Б –Є—О–ї—П 2020 –≥. –њ–Њ —П–љ–≤–∞—А—М 2021 –≥.), –≤ –љ–∞—Б—В–Њ—П—Й–Є–є –Љ–Њ–Љ–µ–љ—В –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є—П –њ—А–Њ—Ж–µ—Б—Б–∞ (–њ–Њ –і–∞–љ–љ—Л–Љ –Ъ–Ґ –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є —Б –∞–њ—А–µ–ї—П 2021 –≥. –њ–Њ –∞–њ—А–µ–ї—М 2022 –≥.).
–Т –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –љ–∞–±–ї—О–і–µ–љ–Є–Є –≤—Л–±–Њ—А –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ–Ј–≤–Њ–ї–Є–ї –њ–∞—Ж–Є–µ–љ—В–Ї–µ –љ–µ —В–Њ–ї—М–Ї–Њ —Б–Њ—Е—А–∞–љ–Є—В—М –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є, –љ–Њ –Є —Г–≤–µ–ї–Є—З–Є—В—М –µ–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М (–Ї –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –Љ–Њ–Љ–µ–љ—В—Г –љ–∞ 26 –Љ–µ—Б.).
–Я—А–Є–Љ–µ–љ—П–µ–Љ—Л–є –њ—А–µ–њ–∞—А–∞—В –≤–Є–љ–Њ—А–µ–ї–±–Є–љ –≤ –Ї–∞–њ—Б—Г–ї–∞—Е –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –•–Ґ —Г –њ–∞—Ж–Є–µ–љ—В–Ї–Є c –Љ–†–Ь–Ц (HR+, HER2neu-) –Њ–±–µ—Б–њ–µ—З–Є–ї –і–ї–Є—В–µ–ї—М–љ—Л–є –Ї–Њ–љ—В—А–Њ–ї—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Т–Є–љ–Њ—А–µ–ї–±–Є–љ —Е–Њ—А–Њ—И–Њ –њ–µ—А–µ–љ–Њ—Б–Є—В—Б—П, –њ–Њ–±–Њ—З–љ—Л—Е –Є –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є, —В—А–µ–±—Г—О—Й–Є—Е –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞ –Є–ї–Є –њ–Њ–љ–Є–ґ–µ–љ–Є—П –і–Њ–Ј–Є—А–Њ–≤–Ї–Є, –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ. –Я–µ—А–Њ—А–∞–ї—М–љ—Л–є –њ—А–Є–µ–Љ —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ–Ј–≤–Њ–ї–Є–ї –Є–Ј–±–µ–ґ–∞—В—М –њ–Њ—Б—В–Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є —Б–Њ—Е—А–∞–љ–Є—В—М –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є —Г–і–∞–ї–Њ—Б—М –і–Њ–±–Є—В—М—Б—П —Г–ї—Г—З—И–µ–љ–Є—П –Њ–±—Й–µ–≥–Њ —Б–∞–Љ–Њ—З—Г–≤—Б—В–≤–Є—П –Є –њ—Б–Є—Е–Њ—Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –њ–∞—Ж–Є–µ–љ—В–Ї–Є.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞ –Љ—Г–ґ—Б–Ї–Њ–≥–Њ –њ–Њ–ї–∞ (–Х.–Т. –Р—А—В–∞–Љ–Њ–љ–Њ–≤–∞)
–Я–∞—Ж–Є–µ–љ—В N., 55 –ї–µ—В, —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є –љ–µ –Њ—В—П–≥–Њ—Й–µ–љ, –≤–њ–µ—А–≤—Л–µ –Њ–±—А–∞—В–Є–ї –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ —Г–њ–ї–Њ—В–љ–µ–љ–Є–µ –≤ –ї–µ–≤–Њ–є –≥—А—Г–і–љ–Њ–є –ґ–µ–ї–µ–Ј–µ –≤ 2015 –≥., –љ–Њ –Ј–∞ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й—М—О –љ–µ –Њ–±—А–∞—Й–∞–ї—Б—П. –Т 2020 –≥. —Б—В–∞–ї –Њ—В–Љ–µ—З–∞—В—М –њ–Њ—Б—В–µ–њ–µ–љ–љ—Л–є —А–Њ—Б—В –і–∞–љ–љ–Њ–≥–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П, –і–µ—Д–Њ—А–Љ–∞—Ж–Є—О –ґ–µ–ї–µ–Ј—Л, –њ–Њ—П–≤–ї–µ–љ–Є–µ –њ–ї–Њ—В–љ—Л—Е —Г–Ј–ї–Њ–≤—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –≤ –ї–µ–≤–Њ–є –њ–Њ–і–Љ—Л—И–µ—З–љ–Њ–є –Њ–±–ї–∞—Б—В–Є.
–°–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ –Њ–±—А–∞—В–Є–ї—Б—П –≤ –§–У–С–£ ¬Ђ–Э–Ь–Ш–¶ –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є –Є–Љ. –Э.–Э. –С–ї–Њ—Е–Є–љ–∞¬ї –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є –≤ –Љ–∞—А—В–µ 2020 –≥., –≥–і–µ –њ—А–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ –і–Є–∞–≥–љ–Њ–Ј —А–∞–Ї–∞ –ї–µ–≤–Њ–є –≥—А—Г–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л T4N3M0. –Ь–∞–Љ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б –£–Ч–Ш –њ–Њ–Ї–∞–Ј–∞–ї–Њ —Г—В–Њ–ї—Й–µ–љ–Є–µ –Ї–Њ–ґ–Є –≤—Б–µ–є –ґ–µ–ї–µ–Ј—Л, –љ–∞–ї–Є—З–Є–µ –Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–≥–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –љ–µ–њ—А–∞–≤–Є–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л –і–Њ 5,5 —Б–Љ, –Є–љ—Д–Є–ї—М—В—А–Є—А—Г—О—Й–µ–≥–Њ –≥—А—Г–і–љ—Г—О –Љ—Л—И—Ж—Г. –Т –ї–µ–≤–Њ–є –∞–Ї—Б–Є–ї–ї—П—А–љ–Њ–є –Њ–±–ї–∞—Б—В–Є –Њ–њ—А–µ–і–µ–ї—П–ї–Є—Б—М –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–љ—Л–µ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–µ —Г–Ј–ї—Л –і–Њ 2,4 —Б–Љ –Є –Ї–Њ–љ–≥–ї–Њ–Љ–µ—А–∞—В —А–∞–Ј–Љ–µ—А–Њ–Љ 4,0√Ч3,0 —Б–Љ. –Т –ї–µ–≤–Њ–є –њ–Њ–і–Ї–ї—О—З–Є—З–љ–Њ–є –Њ–±–ї–∞—Б—В–Є вАФ —Ж–µ–њ–Њ—З–Ї–∞ –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є –њ–Њ—А–∞–ґ–µ–љ–љ—Л—Е –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤ –і–Њ 1,2 —Б–Љ –≤ –і–Є–∞–Љ–µ—В—А–µ. –Я—А–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ—В–і–∞–ї–µ–љ–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤ –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ. –Ь—Г—В–∞—Ж–Є–є –≤ –≥–µ–љ–∞—Е BRCA1/2 —В–∞–Ї–ґ–µ –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ.
–Ш–Љ–Љ—Г–љ–Њ–≥–Є—Б—В–Њ—Е–Є–Љ–Є—П: –†–≠ вАФ 8; –†–Я вАФ 7; ki-67 вАФ 40%; –љ–µ–≥–∞—В–Є–≤–љ—Л–є —Б—В–∞—В—Г—Б –њ–Њ –Њ–љ–Ї–Њ–≥–µ–љ—Г вАФ Her2/neu 2+ (–љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞ FISH-—А–µ–∞–Ї—Ж–Є—П).
–£—З–Є—В—Л–≤–∞—П –ї—О–Љ–Є–љ–∞–ї—М–љ—Л–є –њ–Њ–і—В–Є–њ –Њ–њ—Г—Е–Њ–ї–Є —Б –љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–Љ —Б—В–∞—В—Г—Б–Њ–Љ HER2, –љ–∞ –≤—А–µ–Љ—П –Њ–ґ–Є–і–∞–љ–Є—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ FISH-–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В—Г –±—Л–ї –љ–∞–Ј–љ–∞—З–µ–љ —В–∞–Љ–Њ–Ї—Б–Є—Д–µ–љ –≤ –і–Њ–Ј–µ 20 –Љ–≥ 1 —А/—Б—Г—В –µ–ґ–µ–і–љ–µ–≤–љ–Њ, –Є–Љ–µ—О—Й–Є–є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –њ–µ—А–µ–і –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –∞—А–Њ–Љ–∞—В–∞–Ј—Л. –Ы–µ—З–µ–љ–Є–µ –Њ—Б–ї–Њ–ґ–љ–Є–ї–Њ—Б—М –≥–љ–Њ–є–љ—Л–Љ –Љ–∞—Б—В–Є—В–Њ–Љ —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ —Б–≤–Є—Й–∞, –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ. –Э–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є —В–∞–Љ–Њ–Ї—Б–Є—Д–µ–љ–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ 1,5 –Љ–µ—Б. –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –њ–µ—А–≤–Є—З–љ–Њ–є –Њ–њ—Г—Е–Њ–ї–Є –Є –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤ –≤ –ї–Є–Љ—Д–Њ—Г–Ј–ї–∞—Е –≤ —А–∞–Љ–Ї–∞—Е –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–є —А–µ–≥—А–µ—Б—Б–Є–Є (-25%).
–Ф–Є–∞–≥–љ–Њ–Ј: –†–Ь–Ц (–ї–µ–≤–Њ–є) T4N3M0 –ї—О–Љ–Є–љ–∞–ї—М–љ—Л–є, –њ–Њ–і—В–Є–њ Her2+.
–£—З–Є—В—Л–≤–∞—П –≤—Л—А–∞–ґ–µ–љ–љ—Г—О –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Г—О –і–Є–љ–∞–Љ–Є–Ї—Г, –ї—О–Љ–Є–љ–∞–ї—М–љ—Л–є –њ–Њ–і—В–Є–њ –Њ–њ—Г—Е–Њ–ї–Є —Б –≤—Л—Б–Њ–Ї–Њ–є —Н–Ї—Б–њ—А–µ—Б—Б–Є–µ–є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є –ґ–µ–ї–∞–љ–Є–µ –њ–Њ–ї—Г—З–∞—В—М –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ —Й–∞–і—П—Й–µ–µ –ї–µ—З–µ–љ–Є–µ, –љ–∞ –Ї–Њ–љ—Б–Є–ї–Є—Г–Љ–µ –±—Л–ї–Њ –њ—А–Є–љ—П—В–Њ —А–µ—И–µ–љ–Є–µ: –њ—А–Њ–і–Њ–ї–ґ–Є—В—М –≥–Њ—А–Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О —В–∞–Љ–Њ–Ї—Б–Є—Д–µ–љ–Њ–Љ —Б –і–Њ–±–∞–≤–ї–µ–љ–Є–µ–Љ –і–≤–Њ–є–љ–Њ–є –∞–љ—В–Є-Her2-–±–ї–Њ–Ї–∞–і—Л –≤ —Б—В–∞–љ–і–∞—А—В–љ–Њ–Љ —А–µ–ґ–Є–Љ–µ: –њ–µ—А—В—А—Г–Ј–Є–Љ–∞–± + —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–± –Ї–∞–ґ–і—Л–µ 3 –љ–µ–і.
–° –∞–њ—А–µ–ї—П 2020 –≥. –њ–∞—Ж–Є–µ–љ—В—Г –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ 8 –Ї—Г—А—Б–Њ–≤ —В–∞—А–≥–µ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–±–Њ–Љ 6 –Љ–≥/–Ї–≥ (–љ–∞–≥—А—Г–Ј–Њ—З–љ–∞—П –і–Њ–Ј–∞ 8 –Љ–≥/–Ї–≥) –Є –њ–µ—А—В—Г–Ј—Г–Љ–∞–±–Њ–Љ 420 –Љ–≥ (–љ–∞–≥—А—Г–Ј–Њ—З–љ–∞—П –і–Њ–Ј–∞ 840 –Љ–≥) –Ї–∞–ґ–і—Л–µ 3 –љ–µ–і., –њ—А–Њ–і–Њ–ї–ґ–µ–љ –њ—А–Є–µ–Љ —В–∞–Љ–Њ–Ї—Б–Є—Д–µ–љ–∞. –Ы–µ—З–µ–љ–Є–µ –њ–µ—А–µ–љ–Њ—Б–Є–ї —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–Њ, —Б –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Є–Љ–Є –і–Є–∞—А–µ—П–Љ–Є –≤ –њ—А–µ–і–µ–ї–∞—Е 2-–є —Б—В–µ–њ–µ–љ–Є. –Я–Њ—Б–ї–µ 4 —Ж–Є–Ї–ї–Њ–≤ —В–µ—А–∞–њ–Є–Є –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–∞ —З–∞—Б—В–Є—З–љ–∞—П —А–µ–≥—А–µ—Б—Б–Є—П –Њ–њ—Г—Е–Њ–ї–Є: –Њ—В–µ–Ї –Ї–Њ–ґ–Є —Г–Љ–µ–љ—М—И–Є–ї—Б—П, —А–∞–Ј–Љ–µ—А—Л –Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–≥–Њ —Г–Ј–ї–∞ —Б–Њ–Ї—А–∞—В–Є–ї–Є—Б—М –і–Њ 3,0√Ч1,8 —Б–Љ, –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–µ —Г–Ј–ї—Л –≤ –њ–Њ–і–Ї–ї—О—З–Є—З–љ–Њ–є –Њ–±–ї–∞—Б—В–Є –њ–µ—А–µ—Б—В–∞–ї–Є –Њ–њ—А–µ–і–µ–ї—П—В—М—Б—П, –≤ –∞–Ї—Б–Є–ї–ї—П—А–љ–Њ–є –Њ–±–ї–∞—Б—В–Є —Б–Њ–Ї—А–∞—В–Є–ї–Є—Б—М –і–Њ 1,4 —Б–Љ, –Ї–Њ–љ–≥–ї–Њ–Љ–µ—А–∞—В –њ–µ—А–µ—Б—В–∞–ї –Њ–њ—А–µ–і–µ–ї—П—В—М—Б—П (-76%). –Ф–Њ—Б—В–Є–≥–љ—Г—В—Л–є —Н—Д—Д–µ–Ї—В —Б–Њ—Е—А–∞–љ—П–ї—Б—П –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –ї–µ—З–µ–љ–Є—П.
–Т –Њ–Ї—В—П–±—А–µ 2020 –≥. –≤—Л–њ–Њ–ї–љ–µ–љ–∞ —А–∞–і–Є–Ї–∞–ї—М–љ–∞—П –Љ–∞—Б—В—Н–Ї—В–Њ–Љ–Є—П —Б–ї–µ–≤–∞ —Б –њ–ї–∞—Б—В–Є–Ї–Њ–є –њ–Њ–і–Љ—Л—И–µ—З–љ–Њ-–њ–Њ–і–Ї–ї—О—З–Є—З–љ–Њ-–њ–Њ–і–ї–Њ–њ–∞—В–Њ—З–љ–Њ–є –Њ–±–ї–∞—Б—В–Є –Ї–Њ–Љ–њ–Њ–Ј–Є—В–љ—Л–Љ –Љ—Л—И–µ—З–љ—Л–Љ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–Њ–Љ.
–Я—А–Є –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є: –Њ—Б—В–∞—В–Њ—З–љ–∞—П –Њ–њ—Г—Е–Њ–ї—М 3,5√Ч3√Ч2,5 —Б–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –Є–љ—Д–Є–ї—М—В—А–∞—В–Є–≤–љ—Л–Љ —А–∞–Ї–Њ–Љ –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ —В–Є–њ–∞ —Б –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –ї–µ—З–µ–±–љ–Њ–≥–Њ –њ–∞—В–Њ–Љ–Њ—А—Д–Њ–Ј–∞ RCB-III. –Ъ–ї–µ—В–Њ—З–љ–Њ—Б—В—М –Њ–њ—Г—Е–Њ–ї–Є вАФ 96%, –Њ—В–Љ–µ—З–µ–љ–Њ –≤—А–∞—Б—В–∞–љ–Є–µ –Њ–њ—Г—Е–Њ–ї–Є –≤ –Ї–Њ–ґ—Г —Б–Њ—Б–Ї–∞, –њ—А–Є–Ј–љ–∞–Ї–Є –∞–љ–≥–Є–Њ–ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Њ–є –Є –њ–µ—А–Є–љ–µ–≤—А–∞–ї—М–љ–Њ–є –Є–љ–≤–∞–Ј–Є–Є. –°—В—А–Њ–Љ–∞–ї—М–љ—Л–µ TIL вАФ 4%. –Ы–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤ —Б –Љ–µ—В–∞—Б—В–∞–Ј–∞–Љ–Є вАФ 6 –Є–Ј 9.
–Ш–Љ–Љ—Г–љ–Њ–≥–Є—Б—В–Њ—Е–Є–Љ–Є—П: –†–≠ вАФ 7, –†–Я вАФ 5, HER2/neu 2+, ki-67 вАФ 23%.
–£—З–Є—В—Л–≤–∞—П –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ, –±—Л–ї–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –∞–і—К—О–≤–∞–љ—В–љ–Њ–є —Е–Є–Љ–Є–Њ—В–∞—А–≥–µ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ —Б—Е–µ–Љ–µ 4 –Ї—Г—А—Б–∞ –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ–Њ–≤ –Ї–∞–ґ–і—Л–µ 3 –љ–µ–і., –і–∞–ї–µ–µ 4 –Ї—Г—А—Б–∞ –њ–Њ —Б—Е–µ–Љ–µ –і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї 75 –Љ–≥/–Љ2 + —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–± 6 –Љ–≥/–Ї–≥ + –њ–µ—А—В—Г–Ј—Г–Љ–∞–± 420 –Љ–≥ –Ї–∞–ґ–і—Л–µ 3 –љ–µ–і. —Б –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ–Љ —В–µ—А–∞–њ–Є–Є –і–Њ –≥–Њ–і–∞ (–Њ—В –µ–µ –љ–∞—З–∞–ї–∞).
–Я–µ—А–≤—Л–є –±–ї–Њ–Ї —В–µ—А–∞–њ–Є–Є –±—Л–ї –њ—А–Њ–≤–µ–і–µ–љ –≤ –Ј–∞–њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–љ–Њ–Љ —А–µ–ґ–Є–Љ–µ –Є –Њ—Б–ї–Њ–ґ–љ–Є–ї—Б—П –∞—Б—В–µ–љ–Є–µ–є 2-–є —Б—В–µ–њ–µ–љ–Є, –љ–µ–є—В—А–Њ–њ–µ–љ–Є–µ–є 2-–є —Б—В–µ–њ–µ–љ–Є, —В–Њ—И–љ–Њ—В–Њ–є 1-–є —Б—В–µ–њ–µ–љ–Є –Є –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ–Њ–є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О 1-–є —Б—В–µ–њ–µ–љ–Є.
–Я–µ—А–≤—Л–є —Ж–Є–Ї–ї –≤—В–Њ—А–Њ–≥–Њ –±–ї–Њ–Ї–∞, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –њ—А–Њ–≤–Њ–і–Є–Љ—Г—О –У-–Ъ–°–§ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г, –Њ—Б–ї–Њ–ґ–љ–Є–ї—Б—П —Д–µ–±—А–Є–ї—М–љ–Њ–є –љ–µ–є—В—А–Њ–њ–µ–љ–Є–µ–є, –∞–≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–Њ–Ј–Њ–Љ, –Љ—Г–Ї–Њ–Ј–Є—В–Њ–Љ 3-–є —Б—В–µ–њ–µ–љ–Є, –і–Є–∞—А–µ–µ–є 2-–є —Б—В–µ–њ–µ–љ–Є, –∞—Б—В–µ–љ–Є–µ–є 2-–є —Б—В–µ–њ–µ–љ–Є, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –њ–∞—Ж–Є–µ–љ—В –±—Л–ї —Н–Ї—Б—В—А–µ–љ–љ–Њ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ, –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П, –њ—А–Њ—В–Є–≤–Њ–≥—А–Є–±–Ї–Њ–≤–∞—П —В–µ—А–∞–њ–Є—П, —В–µ—А–∞–њ–Є—П –Њ–Ї—В—А–µ–Њ—В–Є–і–Њ–Љ. –Т —В–µ—З–µ–љ–Є–µ 5 –і–љ–µ–є –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —П–≤–ї–µ–љ–Є—П –±—Л–ї–Є –Ї—Г–њ–Є—А–Њ–≤–∞–љ—Л.
–Т–≤–Є–і—Г –Њ—Б–ї–Њ–ґ–љ–Є–≤—И–µ–≥–Њ—Б—П 1-–≥–Њ –Ї—Г—А—Б–∞ 2-–≥–Њ –±–ї–Њ–Ї–∞ —В–µ—А–∞–њ–Є–Є 2-–є –Ї—Г—А—Б –њ—А–Њ–≤–µ–і–µ–љ —Б —А–µ–і—Г–Ї—Ж–Є–µ–є –і–Њ–Ј—Л –і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї–∞ –љ–∞ 30%. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —Н—В–Њ, –ї–µ—З–µ–љ–Є–µ –Њ—Б–ї–Њ–ґ–љ–Є–ї–Њ—Б—М –љ–µ–є—В—А–Њ–њ–µ–љ–Є–µ–є 2-–є —Б—В–µ–њ–µ–љ–Є, –∞—Б—В–µ–љ–Є–µ–є 2-–є —Б—В–µ–њ–µ–љ–Є, —Б—В–Њ–Љ–∞—В–Є—В–Њ–Љ 2-–є —Б—В–µ–њ–µ–љ–Є, –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ –Љ–Њ—З–µ–Ї–∞–Љ–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є, –њ–Њ –њ–Њ–≤–Њ–і—Г —З–µ–≥–Њ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–∞—Б—М —Н–Ї—Б—В—А–µ–љ–љ–∞—П –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є—П –≤ —Г—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є —Б—В–∞—Ж–Є–Њ–љ–∞—А. –Я–µ—А–µ—А—Л–≤ –≤ –ї–µ—З–µ–љ–Є–Є —Б–Њ—Б—В–∞–≤–Є–ї –±–Њ–ї–µ–µ 6 –љ–µ–і.
–Ю—В –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –•–Ґ –њ–∞—Ж–Є–µ–љ—В –Ї–∞—В–µ–≥–Њ—А–Є—З–µ—Б–Ї–Є –Њ—В–Ї–∞–Ј–∞–ї—Б—П. –Я–µ—А—В—Г–Ј—Г–Љ–∞–± –Њ—В–Љ–µ–љ–µ–љ –Є–Ј-–Ј–∞ –і–Є–∞—А–µ–Є. –Я—А–Њ–≤–µ–і–µ–љ –Ї—Г—А—Б –∞–і—К—О–≤–∞–љ—В–љ–Њ–є –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞ –ї–µ–≤—Г—О –њ–Њ–ї–Њ–≤–Є–љ—Г –≥—А—Г–і–љ–Њ–є —Б—В–µ–љ–Ї–Є –Є –Ј–Њ–љ—Л –ї–Є–Љ—Д–Њ–Њ—В—В–Њ–Ї–∞. –Р–і—К—О–≤–∞–љ—В–љ–∞—П —В–µ—А–∞–њ–Є—П —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–±–Њ–Љ –±—Л–ї–∞ –Ј–∞–≤–µ—А—И–µ–љ–∞ –≤ –Є—О–љ–µ 2021 –≥.
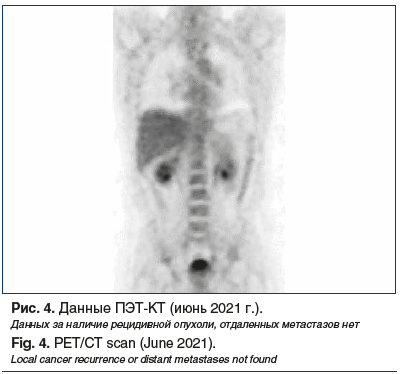
–Я–Њ –і–∞–љ–љ—Л–Љ –Я–≠–Ґ-–Ъ–Ґ (–Є—О–љ—М 2021 –≥.), –њ—А–Є–Ј–љ–∞–Ї–Є –±–Њ–ї–µ–Ј–љ–Є –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є, –њ—А–Њ–і–Њ–ї–ґ–µ–љ–∞ —В–µ—А–∞–њ–Є—П —В–∞–Љ–Њ–Ї—Б–Є—Д–µ–љ–Њ–Љ (—А–Є—Б. 4). –І–µ—А–µ–Ј 6 –Љ–µ—Б. –≤ –љ–Њ—П–±—А–µ 2021 –≥. –њ—А–Є –Я–≠–Ґ-–Ъ–Ґ –≤—Л—П–≤–ї–µ–љ–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ: –Љ–µ—В–∞—Б—В–∞–Ј –≤ –ї–Є–Љ—Д–Њ—Г–Ј–ї–µ –Ї–Њ—А–љ—П –ї–µ–≤–Њ–≥–Њ –ї–µ–≥–Ї–Њ–≥–Њ, 22√Ч20 –Љ–Љ, —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–Њ–Љ —А–∞–і–Є–Њ—Д–∞—А–Љ–њ—А–µ–њ–∞—А–∞—В–∞ SUVmax=5,75 (—А–Є—Б. 5).

–Я–Њ—Б–ї–µ –Њ–±—Б—Г–ґ–і–µ–љ–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –њ–∞—Ж–Є–µ–љ—В –Њ—В–Ї–∞–Ј–∞–ї—Б—П –Њ—В –њ—А–Њ–≤–µ–і–µ–љ–Є—П:
—В–µ—А–∞–њ–Є–Є —В-–Ф–Ь1;
—Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є Her2-–њ–Њ–Ј–Є—В–Є–≤–љ–Њ–≥–Њ –Љ–†–Ь–Ц –≤ —А–µ–ґ–Є–Љ–µ –і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї + —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–± + –њ–µ—А—В—Г–Ј—Г–Љ–∞–± (–њ–ї–∞–љ –∞–і—К—О–≤–∞–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–µ –±—Л–ї –≤—Л–њ–Њ–ї–љ–µ–љ);
–њ—А–Њ–≤–µ–і–µ–љ–Є—П –і–≤–Њ–є–љ–Њ–є –∞–љ—В–Є-HER2-—В–µ—А–∞–њ–Є–Є —Б –≥–Њ—А–Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є, –∞–љ–∞–ї–Њ–≥ –Ы–У–†–У + –Є–љ–≥–Є–±–Є—В–Њ—А—Л –∞—А–Њ–Љ–∞—В–∞–Ј—Л.
–Т –Ї–∞—З–µ—Б—В–≤–µ –Ї–Њ–Љ–њ—А–Њ–Љ–Є—Б—Б–љ–Њ–≥–Њ —А–µ—И–µ–љ–Є—П, —Б –њ—А–Є–Њ—А–Є—В–µ—В–љ—Л–Љ —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ–Љ –≤—Л—Б–Њ–Ї–Њ–≥–Њ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є, –≤—Л–±—А–∞–љ–∞ —В–µ—А–∞–њ–Є—П –≤ —А–µ–ґ–Є–Љ–µ: –≤–Є–љ–Њ—А–µ–ї–±–Є–љ –≤ –Ї–∞–њ—Б—Г–ї–∞—Е (60 –Љ–≥/–Љ2 –≤–љ—Г—В—А—М 1 —А–∞–Ј –≤ 7 –і–љ–µ–є –њ–µ—А–≤—Л–µ 3 –љ–µ–і., –њ–Њ—Б–ї–µ –Њ—Ж–µ–љ–Ї–Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є —Н—Б–Ї–∞–ї–∞—Ж–Є—П –і–Њ–Ј—Л –і–Њ 80 –Љ–≥/–Љ2 –µ–ґ–µ–љ–µ–і–µ–ї—М–љ–Њ) + —В–∞—А–≥–µ—В–љ–∞—П —В–µ—А–∞–њ–Є—П —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–±–Њ–Љ. –Я–µ—А—В—Г–Ј—Г–Љ–∞–± –љ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ –≤ —Б–≤—П–Ј–Є —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ –і–Є–∞—А–µ–Є. –Ы–µ—З–µ–љ–Є–µ –≤ –і–∞–љ–љ–Њ–Љ —А–µ–ґ–Є–Љ–µ –±—Л–ї–Њ –љ–∞—З–∞—В–Њ –≤ –і–µ–Ї–∞–±—А–µ 2021 –≥. –Ч–љ–∞—З–Є–Љ—Л—Е –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –љ–µ –±—Л–ї–Њ, –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Є –Њ—В–Љ–µ—З–∞–ї–∞—Б—М –љ–µ–±–Њ–ї—М—И–∞—П —Б–ї–∞–±–Њ—Б—В—М (1-–є —Б—В–µ–њ–µ–љ–Є), –і–Њ–Ј–∞ –≤–Є–љ–Њ—А–µ–ї–±–Є–љ–∞, —Б–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ, –±—Л–ї–∞ —Н—Б–Ї–∞–ї–Є—А–Њ–≤–∞–љ–∞ –і–Њ 80 –Љ–≥/–Љ2, –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ.
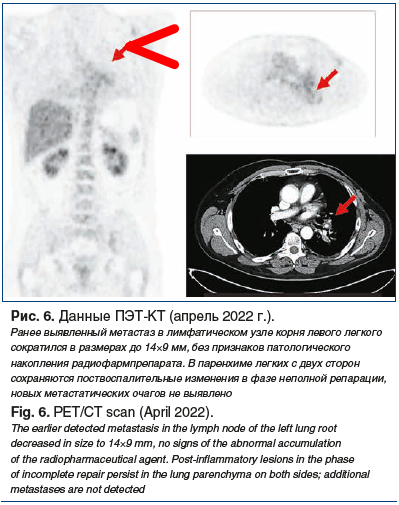
–Т —П–љ–≤–∞—А–µ вАФ —Д–µ–≤—А–∞–ї–µ 2022 –≥. –ї–µ—З–µ–љ–Є–µ –±—Л–ї–Њ –њ—А–µ—А–≤–∞–љ–Њ –љ–∞ 4 –љ–µ–і. –≤ —Б–≤—П–Ј–Є —Б COVID-19 —Б—А–µ–і–љ–µ—В—П–ґ–µ–ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П, —Б –і–≤—Г—Б—В–Њ—А–Њ–љ–љ–Є–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –њ–∞—А–µ–љ—Е–Є–Љ—Л –ї–µ–≥–Ї–Є—Е –і–Њ 40%. –Я–Њ—Б–ї–µ —Б—В–Є—Е–∞–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤–∞—П —Б–Є—Б—В–µ–Љ–љ–∞—П —В–µ—А–∞–њ–Є—П –≤–Њ–Ј–Њ–±–љ–Њ–≤–ї–µ–љ–∞ –≤ –њ—А–µ–ґ–љ–µ–Љ —А–µ–ґ–Є–Љ–µ. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –њ–µ—А–µ—А—Л–≤, –њ—А–Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤ –∞–њ—А–µ–ї–µ 2022 –≥. (–Я–≠–Ґ-–Ъ–Ґ) —А–∞–љ–µ–µ –≤—Л—П–≤–ї–µ–љ–љ—Л–є –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–є —Г–Ј–µ–ї –Ї–Њ—А–љ—П –ї–µ–≤–Њ–≥–Њ –ї–µ–≥–Ї–Њ–≥–Њ —Б–Њ–Ї—А–∞—В–Є–ї—Б—П –≤ —А–∞–Ј–Љ–µ—А–∞—Е –і–Њ 14√Ч9 –Љ–Љ (-37%), –±–µ–Ј –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П —А–∞–і–Є–Њ—Д–∞—А–Љ–њ—А–µ–њ–∞—А–∞—В–∞. –Т –њ–∞—А–µ–љ—Е–Є–Љ–µ –ї–µ–≥–Ї–Є—Е —Б –і–≤—Г—Е —Б—В–Њ—А–Њ–љ —Б–Њ—Е—А–∞–љ—П—О—В—Б—П –њ–Њ—Б—В–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —Д–∞–Ј–µ –љ–µ–њ–Њ–ї–љ–Њ–є —А–µ–њ–∞—А–∞—Ж–Є–Є, –љ–Њ–≤—Л—Е –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є—Е –Њ—З–∞–≥–Њ–≤ –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ (—А–Є—Б. 6).
–Т –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –њ—А–Є–Љ–µ—А–µ –њ–∞—Ж–Є–µ–љ—В –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е 6 –Љ–µ—Б. –њ–Њ–ї—Г—З–∞–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ—Г—О —В–µ—А–∞–њ–Є—О: –≤–Є–љ–Њ—А–µ–ї–±–Є–љ (–Э–∞–≤–µ–ї—М–±–Є–љ –Ї–∞–њ—Б—Г–ї—Л) + —В–∞—А–≥–µ—В–љ–∞—П —В–µ—А–∞–њ–Є—П —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–±–Њ–Љ. –Я—А–Њ–≤–Њ–і–Є–Љ–∞—П —В–µ—А–∞–њ–Є—П —Е–Њ—А–Њ—И–Њ –њ–µ—А–µ–љ–Њ—Б–Є—В—Б—П, –њ–∞—Ж–Є–µ–љ—В –≤–µ–і–µ—В –∞–Ї—В–Є–≤–љ—Л–є –Њ–±—А–∞–Ј –ґ–Є–Ј–љ–Є.
–Э–∞ –і–∞–љ–љ—Л–є –Љ–Њ–Љ–µ–љ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ—А–Њ–≥—А–µ—Б—Б–Є–Є –±–Њ–ї–µ–Ј–љ–Є –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ. –Т —Б–ї—Г—З–∞–µ —Б–Њ—Е—А–∞–љ–µ–љ–Є—П –і–Њ—Б—В–Є–≥–љ—Г—В–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –њ—А–Є –Њ—З–µ—А–µ–і–љ–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, —Г—З–Є—В—Л–≤–∞—П –Њ–ї–Є–≥–Њ–Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є–є —Е–∞—А–∞–Ї—В–µ—А –±–Њ–ї–µ–Ј–љ–Є, –њ–ї–∞–љ–Є—А–Њ–≤–∞–ї–Њ—Б—М –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ –ї–Њ–Ї–∞–ї—М–љ–Њ–≥–Њ –ї—Г—З–µ–≤–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–є —Г–Ј–µ–ї –Ї–Њ—А–љ—П –ї–µ–≤–Њ–≥–Њ –ї–µ–≥–Ї–Њ–≥–Њ (–і–∞–љ–љ—Л–µ ASCO 2022).
–Ш—В–∞–Ї, —Г –њ–∞—Ж–Є–µ–љ—В–∞ —Б HER2+ –†–Ь–Ц —Б —А–∞–љ–µ–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–є –љ–µ–Њ–∞–і—К—О–≤–∞–љ—В–љ–Њ–є –≥–Њ—А–Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є, –∞–і—К—О–≤–∞–љ—В–љ–Њ–є –•–Ґ + —В–∞—А–≥–µ—В–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є, –∞–і—К—О–≤–∞–љ—В–љ–Њ–є –≥–Њ—А–Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є –Є —А–∞–љ–љ–Є–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –∞–і—К—О–≤–∞–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–±–Њ–Љ, —Б –Ї—А–∞–є–љ–µ —В—П–ґ–µ–ї–Њ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –•–Ґ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –Э–∞–≤–µ–ї—М–±–Є–љ –Ї–∞–њ—Б—Г–ї—Л –Є —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–± –≤ –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є —В–µ—А–∞–њ–Є–Є –Њ–±–µ—Б–њ–µ—З–Є–ї–∞ —З–∞—Б—В–Є—З–љ—Л–є –Њ—В–≤–µ—В, –≤—А–µ–Љ—П –±–µ–Ј –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –±–Њ–ї–µ–Ј–љ–Є –±–Њ–ї–µ–µ 6 –Љ–µ—Б. –Є –≤—Л—Б–Њ–Ї–Њ–µ –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Я—А–Є —В–µ—А–∞–њ–Є–Є –Љ–†–Ь–Ц –Њ—Б–љ–Њ–≤–љ–Њ–є —Ж–µ–ї—М—О —Б—В–∞–љ–Њ–≤–Є—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М, –љ–Њ –Є –≤ –±–Њ–ї—М—И–µ–є –Љ–µ—А–µ –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–∞. –Я—А–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В—Л –њ—А–µ–і–њ–Њ—З–Є—В–∞—О—В –њ–µ—А–Њ—А–∞–ї—М–љ—Г—О —Д–Њ—А–Љ—Г, –Ї–Њ—В–Њ—А–∞—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Љ —Б–Њ—Е—А–∞–љ–Є—В—М –њ—А–Є–≤—Л—З–љ—Л–є –Њ–±—А–∞–Ј –ґ–Є–Ј–љ–Є. –Т–Є–љ–Њ—А–µ–ї–±–Є–љ –Ї–∞–њ—Б—Г–ї—Л –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ —Б —В–∞–Ї—Б–∞–љ–∞–Љ–Є –Є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –і–ї–Є—В–µ–ї—М–љ—Л–є –Ї–Њ–љ—В—А–Њ–ї—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –њ—А–µ–і–Њ—Б—В–∞–≤–ї—П—П –њ–∞—Ж–Є–µ–љ—В–∞–Љ –≤—Б–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤–Є–љ–Њ—А–µ–ї–±–Є–љ —П–≤–ї—П–µ—В—Б—П —Е–Њ—А–Њ—И–Є–Љ –≤—Л–±–Њ—А–Њ–Љ –і–ї—П –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –њ—А–Є –Љ–†–Ь–Ц.
–°–≤–µ–і–µ–љ–Є—П –Њ–± –∞–≤—В–Њ—А–∞—Е:
–Р—А—В–∞–Љ–Њ–љ–Њ–≤–∞ –Х–ї–µ–љ–∞ –Т–ї–∞–і–Є–Љ–Є—А–Њ–≤–љ–∞ вАФ –і.–Љ.–љ., –Ј–∞–≤–µ–і—Г—О—Й–∞—П –Њ—В–і–µ–ї–µ–љ–Є–µ–Љ —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є вДЦ 1 –§–У–С–£ ¬Ђ–Э–Ь–Ш–¶ –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є –Є–Љ. –Э.–Э. –С–ї–Њ—Е–Є–љ–∞¬ї –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є; 115522, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, –Ъ–∞—И–Є—А—Б–Ї–Њ–µ —И., –і. 24; –њ—А–Њ—Д–µ—Б—Б–Њ—А –Ї–∞—Д–µ–і—А—Л –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є –Є –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –†–Э–Ш–Ь–£ –Є–Љ. –Э.–Ш. –Я–Є—А–Њ–≥–Њ–≤–∞ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є; 117321, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Ю—Б—В—А–Њ–≤–Є—В—П–љ–Њ–≤–∞, –і. 1; –Ј–∞–≤–µ–і—Г—О—Й–∞—П –Ї–∞—Д–µ–і—А–Њ–є –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є –Є —В–Њ—А–∞–Ї–∞–ї—М–љ–Њ–є —Е–Є—А—Г—А–≥–Є–Є –§–Я–Ъ –У–С–£–Ч –Ь–Ю –Ь–Ю–Э–Ш–Ъ–Ш –Є–Љ. –Ь.–§. –Т–ї–∞–і–Є–Љ–Є—А—Б–Ї–Њ–≥–Њ; 129110, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –©–µ–њ–Ї–Є–љ–∞, –і. 61/2; ORCID iD 0000-0001-7728-9533.
–Ґ–Ї–∞—З–µ–љ–Ї–Њ –Х–ї–µ–љ–∞ –Т–Є–Ї—В–Њ—А–Њ–≤–љ–∞ вАФ –Ї.–Љ.–љ., –Ј–∞–≤–µ–і—Г—О—Й–∞—П –Њ—В–і–µ–ї–µ–љ–Є–µ–Љ –Ї—А–∞—В–Ї–Њ—Б—А–Њ—З–љ–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –§–У–С–£ ¬Ђ–Э–Ь–Ш–¶ –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є –Є–Љ –Э.–Э. –Я–µ—В—А–Њ–≤–∞¬ї –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є; 197758, –†–Њ—Б—Б–Є—П, –≥. –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, –њ–Њ—Б. –Я–µ—Б–Њ—З–љ—Л–є, —Г–ї. –Ы–µ–љ–Є–љ–≥—А–∞–і—Б–Ї–∞—П, –і. 68; ORCID iD 0000-0001-6375-8335.
–§—А–µ–є–µ—А –Ц–Є–ї—М вАФ –њ—А–Њ—Д–µ—Б—Б–Њ—А, –Њ—В–і–µ–ї–µ–љ–Є–µ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є –Ю–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—В–Є—В—Г—В–∞ –≥—А—Г–њ–њ—Л –њ–∞–ї–ї–Є–∞—В–Є–≤–љ—Л—Е —Г—З—А–µ–ґ–і–µ–љ–Є–є; 69006, –§—А–∞–љ—Ж–Є—П, –≥. –Ы–Є–Њ–љ, –љ–∞–±. –®–∞—А–ї—П –і–µ –У–Њ–ї–ї—П, –і. 200; ORCID iD 0000-0001-6001-164X.
–І–µ—А–љ—П–і—М–µ–≤–∞ –°–≤–µ—В–ї–∞–љ–∞ –Э–Є–Ї–Њ–ї–∞–µ–≤–љ–∞ вАФ –≤—А–∞—З-–Њ–љ–Ї–Њ–ї–Њ–≥ –Њ—В–і–µ–ї–µ–љ–Є—П —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є вДЦ 1 –Ъ–Ю–У–Ъ–С–£–Ч ¬Ђ–¶–µ–љ—В—А –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є –Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є —А–∞–і–Є–Њ–ї–Њ–≥–Є–Є¬ї; 610045, –†–Њ—Б—Б–Є—П, –≥. –Ъ–Є—А–Њ–≤, –њ—А-—В –°—В—А–Њ–Є—В–µ–ї–µ–є, –і. 23.
–Ъ–Њ–љ—В–∞–Ї—В–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П: –Р—А—В–∞–Љ–Њ–љ–Њ–≤–∞ –Х–ї–µ–љ–∞ –Т–ї–∞–і–Є–Љ–Є—А–Њ–≤–љ–∞, e-mail: artamonovae@mail.ru.
–Я—А–Њ–Ј—А–∞—З–љ–Њ—Б—В—М —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є: –љ–Є–Ї—В–Њ –Є–Ј –∞–≤—В–Њ—А–Њ–≤ –љ–µ –Є–Љ–µ–µ—В —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–∞—Е –Є–ї–Є –Љ–µ—В–Њ–і–∞—Е.
–Ъ–Њ–љ—Д–ї–Є–Ї—В –Є–љ—В–µ—А–µ—Б–Њ–≤ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В.
–°—В–∞—В—М—П –њ–Њ—Б—В—Г–њ–Є–ї–∞ 01.08.2022.
–Я–Њ—Б—В—Г–њ–Є–ї–∞ –њ–Њ—Б–ї–µ —А–µ—Ж–µ–љ–Ј–Є—А–Њ–≤–∞–љ–Є—П 17.08.2022.
–Я—А–Є–љ—П—В–∞ –≤ –њ–µ—З–∞—В—М 24.08.2022.
About the authors:
Elena V. Artamonova вАФ Dr. Sc. (Med.), Head of Department of Chemotherapy No. 1, N.N. Blokhin National Medical Research Center of Oncology; 24, Kashirskoe road, Moscow, 115478, Russian Federation; Professor of the Department of Oncology and Radiation Therapy, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; Head of the Department of Oncology and Thoracal Surgery, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0001-7728-9533.
Elena V. Tkachenko вАФ C. Sc. (Med.), Head of the Department of Short-Course Chemotherapy, N.N. Petrov National Medical Research Center of Oncology; 68, Leningradskaya str., settl. Pesochny, Saint Petersburg, 197758, Russian Federation; ORCID iD 0000-0001-6375-8335.
Gilles Freyer вАФ Professor, Medical Oncology Department, Centre Hospitalier Lyon Sud, 200 Quai Charles de Gaulle, 69006, Lyon, France; ORCID iD 0000-0001-6001-164X.
Svetlana N. ChernyadвАЩeva вАФ Oncologist, Chemotherapy Department No. 1, Center of Oncology and Medical Radiology; 23 Stroiteley av., Kirov, 610045, Russian Federation.
Contact information: Elena V. Artamonova, e-mail: artamonovae@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 01.08.2022.
Revised 17.08.2022.
Accepted 24.08.2022.












