–Х. –Э–Є–Ї–Њ–ї–∞–µ–≤
Ye. Nikolaev
–Ш—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –Є–Ј –Ъ–Њ–ї–Њ—А–∞–і—Б–Ї–Њ–≥–Њ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ –≤ –Ф–µ–љ–≤–µ—А–µ –Є –Ю–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞—Г—З–љ–Њ–≥–Њ —Ж–µ–љ—В—А–∞ –Є–Љ. –§—А–µ–і–∞ –•–∞—В—З–Є–љ—Б–Њ–љ–∞ –≤ –°–Є—Н—В–ї–µ –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В, —З—В–Њ –њ–Њ–≤—Л—И–µ–љ–љ—Л–µ —Г—А–Њ–≤–љ–Є –њ—А–Њ—Б—В–∞—В–Њ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ—В–Є–≥–µ–љ–∞ (–Я–°–Р) –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –њ–Њ–Љ–Њ–≥–∞—О—В –≤—Л—П–≤–Є—В—М —А–∞–Ї–Њ–≤—Г—О –Њ–њ—Г—Е–Њ–ї—М, –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Г—О –≤ –њ—А–Њ—Б—В–∞—В–µ, –њ—А–Є –Є—Е —Г—З–µ—В–µ –љ–∞—А—П–і—Г —Б –і–∞–љ–љ—Л–Љ–Є —А–µ–Ї—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ —Б –њ–Њ–Љ–Њ—Й—М—О –њ–∞–ї—М—Ж–µ–≤ (–†–Ш–Я).
–Ю–љ–Є –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є –Љ–µ—В–Њ–і—Л –≤—Л—П–≤–ї–µ–љ–Є—П —А–∞–Ї–∞ –њ—А–Њ—Б—В—Л –њ—Г—В–µ–Љ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є—П 31953 –Љ—Г–ґ—З–Є–љ (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 64 –≥–Њ–і–∞), –њ—А–Њ—И–µ–і—И–Є—Е —Б–Ї—А–Є–љ–Є–љ–≥ –≤ 148 —Ж–µ–љ—В—А–∞—Е –≤–Њ –≤—А–µ–Љ—П –њ—А–Њ–≤–Њ–і–Є–≤—И–µ–є—Б—П –≤ —Б–µ–љ—В—П–±—А—П 1993 –≥. –Э–µ–і–µ–ї–Є –Ј–љ–∞–љ–Є–є –љ–∞—Б–µ–ї–µ–љ–Є—П –Њ —А–∞–Ї–µ –њ—А–Њ—Б—В–∞—В—Л. –Я—А–Њ—В–Њ–Ї–Њ–ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞–ї–Њ—Б—М –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є–µ –†–Ш–Я –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Я–°–Р –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, –≤–Ј—П—В–Њ–є –љ–∞ –∞–љ–∞–ї–Є–Ј —Г –≤—Б–µ—Е –Љ—Г–ґ—З–Є–љ. –Ь—Г–ґ—З–Є–љ–∞–Љ, —Г –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї–Є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ—Л –≤–µ–ї–Є—З–Є–љ—Л –Я–°–Р –±–Њ–ї–µ–µ 4,0 –љ–≥/–Љ–ї –Є/–Є–ї–Є –њ–Њ–і–Њ–Ј—А–µ–≤–∞–ї–Њ—Б—М –љ–∞–ї–Є—З–Є–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –†–Ш–Я, –±—Л–ї–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –і–∞–ї—М–љ–µ–є—И–µ–µ –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ, –≤–Ї–ї—О—З–∞–≤—И–µ–µ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Ї–Њ—Б—В–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –Ї–Њ–Љ–њ—М—О—В–µ—А–љ—Г—О —В–Њ–Љ–Њ–≥—А–∞—Д–Є—О –Є–ї–Є –±–Є–Њ–њ—Б–Є—О.
–Т –Њ–±—Й–µ–є —Б–ї–Њ–ґ–љ–Њ—Б—В–Є —Г 6139 (19%) –Љ—Г–ґ—З–Є–љ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л —Б–≤–µ–і–µ–љ–Є—П –Њ –љ–∞–ї–Є—З–Є–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –ї–Є–±–Њ —В–µ—Б—В–∞ –љ–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Я–°–Р –ї–Є–±–Њ –†–Ш–Я –Є–ї–Є —В–Њ–≥–Њ –Є –і—А—Г–≥–Њ–≥–Њ. –Э–∞ 32 221 –Љ—Г–ґ—З–Є–љ—Г –Є–Љ–µ–ї–Є—Б—М –і–∞–љ–љ—Л–µ –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П. –Я–Њ—З—В–Є —Г –њ–Њ–ї–Њ–≤–Є–љ—Л (47%) –Є–Ј —Н—В–Њ–≥–Њ —З–Є—Б–ї–∞ –Љ—Г–ґ—З–Є–љ –њ–Њ–≤—В–Њ—А–љ—Л–µ —В–µ—Б—В—Л –Я–°–Р –Є/–Є–ї–Є –†–Ш–Я —Г–Ї–∞–Ј—Л–≤–∞–ї–Є –љ–∞ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –Ш–Ј –љ–Є—Е 1307 –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л–Љ –±—Л–ї–∞ –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–∞ –±–Є–Њ–њ—Б–Є—П –Є —Г 59% –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –њ–Њ–≤—Л—И–µ–љ–љ—Л–µ —Г—А–Њ–≤–љ–Є –Я–°–Р, —Г 61% - –і–∞–љ–љ—Л–µ –†–Ш–Я –Њ –љ–∞–ї–Є—З–Є–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –∞ —Г 21% –±—Л–ї–Њ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ –Є —В–Њ, –Є –і—А—Г–≥–Њ–µ. –Ф—А—Г–≥–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —В–∞–Ї–Њ–≤—Л:
–Ф–∞–љ–љ—Л–µ –Ї–∞–Ї —В–µ—Б—В–∞ –Я–°–Р, —В–∞–Ї –Є –†–Ш–Я –Њ –љ–∞–ї–Є—З–Є–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –њ—А–∞–≤–Є–ї—М–љ–Њ –њ—А–µ–і—Б–Ї–∞–Ј—Л–≤–∞–ї–Є —А–∞–Ј–≤–Є—В–Є–µ —А–∞–Ї–∞ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 47% –≤—А–µ–Љ–µ–љ–Є –љ–∞–±–ї—О–і–µ–љ–Є—П.
–Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —В–µ—Б—В–∞ –Я–°–Р –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –†–Ш–Я –њ–Њ–≤—Л—И–∞–ї–Њ —Б—В–µ–њ–µ–љ—М –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є –≤—Л—П–≤–ї–µ–љ–Є—П —А–∞–Ї–∞ –њ–Њ –Љ–µ–љ—М—И–µ–є –Љ–µ—А–µ –љ–∞ 59% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є–µ–Љ —В–Њ–ї—М–Ї–Њ –†–Ш–Я.
–Э–∞–ї–Є—З–Є–µ –њ–Њ–≤—Л—И–µ–љ–љ—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є –Я–°–Р –њ–Њ–Ј–≤–Њ–ї—П–ї–Њ –≤—Л—П–≤–Є—В—М 72% –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л—Е —А–∞–Ї–Њ–≤—Л—Е –Њ–њ—Г—Е–Њ–ї–µ–є, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –њ—А–Є –і–∞–љ–љ—Л—Е –†–Ш–Я –Њ –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Є—Е –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ –≤ 69% —Б–ї—Г—З–∞–µ–≤.
–Ъ–∞–Ї –Є –Њ–ґ–Є–і–∞–ї–Њ—Б—М, –≤—Л—П–≤–ї—П–µ–Љ–Њ—Б—В—М —А–∞–Ї–∞ –±—Л–ї–∞ –њ–Њ—З—В–Є –≤ 5 —А–∞–Ј –ї—Г—З—И–µ —Г –Љ—Г–ґ—З–Є–љ —Б —Г—А–Њ–≤–љ—П–Љ–Є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Я–°–Р –±–Њ–ї–µ–µ 4,0 –љ–≥, —З–µ–Љ —Г –і—А—Г–≥–Є—Е, –Є –≤ 3 —А–∞–Ј–∞ –ї—Г—З—И–µ —Г –Є–Љ–µ–≤—И–Є—Е –і–∞–љ–љ—Л–µ –†–Ш–Я –Њ –љ–∞–ї–Є—З–Є–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, —З–µ–Љ —Г –Њ—Б—В–∞–ї—М–љ—Л—Е.
–Р–≤—В–Њ—А—Л –Њ—В–Љ–µ—З–∞—О—В, —З—В–Њ –≤—А–∞—З–Є –њ—А–Њ—П–≤–ї—П–ї–Є —В–∞–Ї—В–Є—З–љ–Њ—Б—В—М –њ—А–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤–Њ –≤—А–µ–Љ—П –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П. –С–Њ–ї–µ–µ —Б–Њ–≤–µ—А—И–µ–љ–љ—Л–µ –Љ–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞–Ј–љ–∞—З–∞–ї–Є—Б—М —В–Њ–ї—М–Ї–Њ –њ–Њ—Б–ї–µ –њ–Њ–≤—В–Њ—А–љ—Л—Е —В–µ—Б—В–Њ–≤ –Я–°–Р –Є –†–Ш–Я, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є—Е –Њ –љ–∞–ї–Є—З–Є–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є.
–Ы–Є—В–µ—А–∞—В—Г—А–∞:
Crawford ED, De Antoni EP, Etzioni R, et al. Serum prostatspecific antigen and digital rectal examination for early detection of prostate cancer in a national community-based program. Urology 1996;47:863-9.
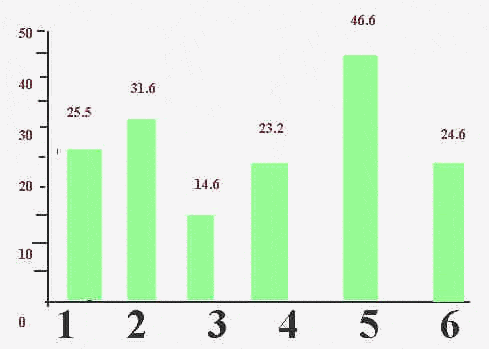
–Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–ї–µ –Ј–љ–∞—З–µ–љ–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є —А–∞–Ї–∞ –њ—А–Њ—Б—В–∞—В—Л.
1 - –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —В–Њ–ї—М–Ї–Њ –†–Ш–Я, —Г–Ї–∞–Ј—Л–≤–∞—О—Й–µ–≥–Њ –љ–∞ –љ–∞–ї–Є—З–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є–Є; 2 - –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —В–Њ–ї—М–Ї–Њ —В–µ—Б—В–∞ –Я–°–Р, –≤—Л—П–≤–Є–≤—И–µ–≥–Њ –µ–≥–Њ —Г—А–Њ–≤–љ–Є > 4,0 –љ–≥; 3 - –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —В–µ—Б—В–∞ –Я–°–Р, –Њ–±–љ–∞—А—Г–ґ–Є–≤—И–µ–≥–Њ –µ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ —Ф 4,0 –љ–≥, –Є –†–Ш–Я, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–µ–≥–Њ –Њ –љ–∞–ї–Є—З–Є–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є;
4 - –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —В–µ—Б—В–∞ –Я–°–Р –њ—А–Є –µ–≥–Њ —Г—А–Њ–≤–љ–µ > 4,0 –љ–≥ –Є –†–Ш–Я, –љ–µ –≤—Л—П–≤–Є–≤—И–µ–≥–Њ –љ–∞–ї–Є—З–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є–Є; 5 - –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —В–µ—Б—В–∞ –Я–°–Р –њ—А–Є –µ–≥–Њ —Г—А–Њ–≤–љ–µ > 4,0 –љ–≥ –Є –†–Ш–Я, –њ–Њ–Ї–∞–Ј–∞–≤—И–µ–≥–Њ –љ–∞–ї–Є—З–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є–Є; 6 - –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —В–µ—Б—В–∞ –Я–°–Р –њ—А–Є –µ–≥–Њ —Г—А–Њ–≤–љ–µ > 4,0 –љ–≥ –Є–ї–Є –†–Ш–Я, –њ–Њ–Ї–∞–Ј–∞–≤—И–µ–≥–Њ –љ–∞–ї–Є—З–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є–Є.
–Я–Ю–°–Ы–Х–Ф–Ю–Т–Р–Ґ–Х–Ы–ђ–Э–Ю–°–Ґ–ђ –•–Ш–Ь–Ш–Ю–Ґ–Х–†–Р–Я–Ш–Ш –Ш –Ы–£–І–Х–Т–Ю–Щ –Ґ–Х–†–Р–Я–Ш–Ш –Я–Ю–°–Ы–Х –©–Р–Ф–ѓ–©–Х–Щ –Ю–Я–Х–†–Р–¶–Ш–Ш –Я–Ю –Я–Ю–Т–Ю–Ф–£ –†–Р–Ъ–Р –Ь–Ю–Ы–Ю–І–Э–Ю–Щ –Ц–Х–Ы–Х–Ч–Ђ –†–Р–Э–Э–Х–Щ –°–Ґ–Р–Ф–Ш–Ш
J. Geerling
–Я–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В—М, –≤ –Ї–Њ—В–Њ—А–Њ–є –њ–∞—Ж–Є–µ–љ—В—Л —Б –Є–љ–≤–∞–Ј–Є–≤–љ—Л–Љ —А–∞–Ї–Њ–Љ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –≤ —А–∞–љ–љ–µ–є —Б—В–∞–і–Є–Є –њ–Њ–ї—Г—З–∞—О—В —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—О –Є –ї—Г—З–µ–≤—Г—О —В–µ—А–∞–њ–Є—О –њ–Њ—Б–ї–µ —Й–∞–і—П—Й–µ–є –Њ–њ–µ—А–∞—Ж–Є–Є –љ–∞ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј–µ, –Љ–Њ–ґ–µ—В –≤–ї–Є—П—В—М –љ–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —А–µ–Ј—Г–ї—М—В–∞—В. –¶–µ–ї—М—О –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Њ –њ—А–Њ–≤–µ—А–Є—В—М, –≤–ї–Є—П–µ—В –ї–Є –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ–Љ—В—М –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –Є –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ—Б–ї–µ —Й–∞–і—П—Й–µ–є –Њ–њ–µ—А–∞—Ж–Є–Є –љ–∞ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј–µ –љ–∞ –Є—Б—Е–Њ–і —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —Б–Є—Б—В–µ–Љ–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤. –≠—В–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б–њ—Л—В–∞–љ–Є–µ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –≤ —З–µ—В—Л—А–µ—Е –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Ж–µ–љ—В—А–∞—Е –С–Њ—Б—В–Њ–љ–∞, –°–®–Р.
–Т –Є—Б–њ—Л—В–∞–љ–Є–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Б I –Є II –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б—В–∞–і–Є–µ–є —А–∞–Ї–∞ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л. –° –Є—О–љ—П 1984–≥. –њ–Њ –Є—О–љ—М 1988 –≥. —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –і–Њ–ї–ґ–љ–Њ –±—Л–ї–Њ –љ–∞–±–ї—О–і–∞—В—М—Б—П –≤–Њ–≤–ї–µ—З–µ–љ–Є–µ –≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –њ–Њ–і–Љ—Л—И–µ—З–љ—Л—Е —Г–Ј–ї–Њ–≤. –° –Є—О–љ—П 1988 –≥. –њ–Њ –і–µ–Ї–∞–±—А—М 1992 –≥. –њ–∞—Ж–Є–µ–љ—В–Ї–Є, —Г –Ї–Њ—В–Њ—А—Л—Е –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–µ —Г–Ј–ї—Л –љ–µ –±—Л–ї–Є –≤–Њ–≤–ї–µ—З–µ–љ–љ—Л–Љ–Є –≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б, –≤–Ї–ї—О—З–∞–ї–Є—Б—М –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –µ—Б–ї–Є –њ–µ—А–≤–Є—З–љ—Л–є —В–µ—Б—В –Њ–њ—Г—Е–Њ–ї–Є –љ–∞ —А–µ—Ж–µ–њ—В–Њ—А—Л —Н—Б—В—А–Њ–≥–µ–љ–∞ –±—Л–ї –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–Љ –Є–ї–Є –µ—Б–ї–Є –±—Л–ї–Є –њ–Њ—А–∞–ґ–µ–љ—Л –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–µ —Б–Њ—Б—Г–і—Л. –Я–∞—Ж–Є–µ–љ—В–Њ–Ї –љ–µ –≤–Ї–ї—О—З–∞–ї–Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Є –љ–∞–ї–Є—З–Є–Є —П–≤–љ–Њ–≥–Њ –Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Є–ї–Є –њ–Њ–і–Љ—Л—И–µ—З–љ–Њ–є —П–Љ–Ї–Є, –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–≥–Њ —А–∞–Ї–∞, –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–є –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –Є–ї–Є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –Є–ї–Є –Њ–њ–∞—Б–љ—Л—Е —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Э–∞—З–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –њ—А–Њ—Ж–µ–і—Г—А–Њ–є –±—Л–ї–Њ –Є—Б—Б–µ—З–µ–љ–Є–µ –Њ–њ—Г—Е–Њ–ї–Є —Б –љ–µ–±–Њ–ї—М—И–Є–Љ –Њ–±–Њ–і–Ї–Њ–Љ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —В–Ї–∞–љ–Є –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л. –Ю–±—Л—З–љ–Њ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –њ–Њ–≤—В–Њ—А–љ–Њ–µ –Є—Б—Б–µ—З–µ–љ–Є–µ. –†–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–ї–Є I –Є–ї–Є II —Г—А–Њ–≤–µ–љ—М –≤—Б–Ї—А—Л—В–Є—П –њ–Њ–і–Љ—Л—И–µ—З–љ–Њ–є —П–Љ–Ї–Є, —Е–Њ—В—П —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є –Њ–њ–µ—А–∞—Ж–Є—П –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М –њ–Њ —Г—Б–Љ–Њ—В—А–µ–љ–Є—О —Е–Є—А—Г—А–≥–∞.
–Я–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є –њ–∞—Ж–Є–µ–љ—В–Ї–∞–Љ –њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ–Њ –љ–∞–Ј–љ–∞—З–∞–ї–Є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—О –і–Њ (n = 122) –Є–ї–Є –њ–Њ—Б–ї–µ (n = 122) –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є.
–Ь–µ–ґ–і—Г –і–≤—Г–Љ—П –≥—А—Г–њ–њ–∞–Љ–Є –љ–µ –±—Л–ї–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л—Е –і–µ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е –Є–ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–∞–Ј–ї–Є—З–Є–є. –Ы—Г—З–µ–≤–∞—П —В–µ—А–∞–њ–Є—П –±—Л–ї–∞ –љ–∞–Ј–љ–∞—З–µ–љ–∞ –≤ –і–Њ–Ј–µ 45–У—А –љ–∞ –≤—Б—О –Љ–Њ–ї–Њ—З–љ—Г—О –ґ–µ–ї–µ–Ј—Г –≤ 25 —Д—А–∞–Ї—Ж–Є—П—Е, –њ–Њ—Б–ї–µ —З–µ–≥–Њ –њ—А–Њ–≤–Њ–і–Є–ї–Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–µ –Њ–±–ї—Г—З–µ–љ–Є–µ –і–Њ–Ј–Њ–є 16 - 18 –У—А –љ–∞ –Њ–±–ї–∞—Б—В—М –њ–µ—А–≤–Є—З–љ–Њ–є –Њ–њ—Г—Е–Њ–ї–Є. –†–µ–≥–Є–Њ–љ–∞—А–љ—Л–µ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–µ —Г–Ј–ї—Л –њ–Њ–і–≤–µ—А–≥–∞–ї–Є—Б—М –Њ–±–ї—Г—З–µ–љ–Є—О –і–Њ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –і–Њ–Ј—Л 50 –У—А. –Ы–µ–Ї–∞—А—Б—В–≤–∞ –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М —Б–Њ–≥–ї–∞—Б–љ–Њ —Б–ї–µ–і—Г—О—Й–Є–Љ —Б—Е–µ–Љ–∞–Љ: –Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В 200 –Љ–≥/–Љ2 –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –љ–∞ 1-–є –Є 15-–є –і–љ–Є, –ї–µ–є–Ї–Њ–≤–Њ—А–Є–љ 10 –Љ–≥/ –Љ2 –њ–µ—А–Њ—А–∞–ї—М–љ–Њ –Ї–∞–ґ–і—Л–µ 6 —З, 12 –і–Њ–Ј, –љ–∞—З–Є–љ–∞—П —Б–Њ 2-–≥–Њ –Є 16-–≥–Њ –і–љ—П, —Д—В–Њ—А—Г—А–∞—Ж–Є–ї 500 –Љ–≥/ –Љ2 –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –≤ 1-–є –і–µ–љ—М, —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і 500 –Љ–≥/ –Љ2 –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –≤ 1-–є –і–µ–љ—М, –њ—А–µ–і–љ–Є–Ј–Њ–љ 40 –Љ–≥/ –Љ2 –≤ –і–µ–љ—М –њ–µ—А–Њ—А–∞–ї—М–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 5 –і–љ–µ–є, –љ–∞—З–Є–љ–∞—П —Б 1-–≥–Њ –і–љ—П, –Є –і–Њ–Ї—Б–Њ—А—Г–±–Є—Ж–Є–љ 45 –Љ–≥/ –Љ2 –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ 3-–є –і–µ–љ—М. –¶–Є–Ї–ї—Л –њ–Њ–≤—В–Њ—А—П–ї–Є—Б—М –Ї–∞–ґ–і—Л–µ 3 –љ–µ–і, –≤—Б–µ–≥–Њ 4 —Ж–Є–Ї–ї–∞. –°—А–µ–і–љ–Є–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П –≤—Л–ґ–Є–≤—И–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б–Њ—Б—В–∞–≤–ї—П–ї 58 –Љ–µ—Б (–Њ—В 10 –і–Њ 124 –Љ–µ—Б).
–Ч–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ–∞—П –њ—П—В–Є–ї–µ—В–љ—П—П —З–∞—Б—В–Њ—В–∞ —А–µ—Ж–Є–і–Є–≤–∞ —А–∞–Ї–∞ –ї—О–±–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є –Њ—В–і–∞–ї–µ–љ–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤ –≤ –≥—А—Г–њ–њ–µ, –њ–Њ–ї—Г—З–Є–≤—И–µ–є –≤–љ–∞—З–∞–ї–µ –ї—Г—З–µ–≤—Г—О —В–µ—А–∞–њ–Є—О, –Є –≤ –≥—А—Г–њ–њ–µ, –Ї–Њ—В–Њ—А–∞—П –њ–Њ–ї—Г—З–Є–ї–∞ –≤–љ–∞—З–∞–ї–µ —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—О, —Б–Њ—Б—В–∞–≤–Є–ї–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 38 –Є 31% (—А = 0,17), 36 –Є 25% (—А = 0,05). –Ю–±—Й–Є–є —Г—А–Њ–≤–µ–љ—М –≤—Л–ґ–Є–≤–∞–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 73 –Є 81% (—А = 0,11).
–Э–µ—Г—В–Њ—З–љ–µ–љ–љ—Л–є –њ—П—В–Є–ї–µ—В–љ–Є–є —Г—А–Њ–≤–µ–љ—М –њ–µ—А–≤—Л—Е —А–µ—Ж–Є–і–Є–≤–Њ–≤ –≤ –≥—А—Г–њ–њ–µ, –≥–і–µ –≤–љ–∞—З–∞–ї–µ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –ї—Г—З–µ–≤–∞—П —В–µ—А–∞–њ–Є—П, –Є –≤ –≥—А—Г–њ–њ–µ, –≥–і–µ –≤–љ–∞—З–∞–ї–µ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—П, —Б–Њ—Б—В–∞–≤–ї—П–ї —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 5 –Є 14% –і–ї—П –Љ–µ—Б—В–љ–Њ–≥–Њ —А–µ—Ж–Є–і–Є–≤–∞ –Є 32 –Є 20% –і–ї—П –Њ—В–і–∞–ї–µ–љ–љ–Њ–≥–Њ –Є–ї–Є —А–µ–≥–Є–Њ–љ–∞—А–љ–Њ–≥–Њ —А–µ—Ж–Є–і–Є–≤–∞ –Є–ї–Є —В–Њ–≥–Њ –Є –і—А—Г–≥–Њ–≥–Њ. –≠—В–Є —А–∞–Ј–ї–Є—З–Є—П –≤ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П—Е —А–∞–Ј–≤–Є—В–Є—П —А–µ—Ж–Є–і–Є–≤–∞ –Є–Љ–µ–ї–Є –њ–Њ–≥—А–∞–љ–Є—З–љ—Г—О —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї—Г—О –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М (—А = 0,07). –†–µ–Ј—Г–ї—М—В–∞—В—Л —Н—В–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞–≤–Њ–і—П—В –љ–∞ –Љ—Л—Б–ї—М, —З—В–Њ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —Б–Є—Б—В–µ–Љ–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤ –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–Њ —Б–љ–∞—З–∞–ї–∞ –љ–∞–Ј–љ–∞—З–∞—В—М –Ї—Г—А—Б —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є, –∞ –Ј–∞—В–µ–Љ –ї—Г—З–µ–≤—Г—О —В–µ—А–∞–њ–Є—О, –∞ –љ–µ –љ–∞–Њ–±–Њ—А–Њ—В.
–Ы–Є—В–µ—А–∞—В—Г—А–∞:
Recht A, Come SE, Craig Henderson I et al. The sequencing of chemotherapy and radiotherapy after conservative surgery for early-stage breast cancer. N Engl J Med 1996;334:1356-61.
–†–Ю–Ы–ђ –Я–Ю–°–Ы–Х–Ю–Я–Х–†–Р–¶–Ш–Ю–Э–Э–Ю–Щ –Ы–£–І–Х–Т–Ю–Щ –Ґ–Х–†–Р–Я–Ш–Ш –Я–†–Ш –Э–Х–Ь–Х–Ы–Ъ–Ю–Ъ–Ы–Х–Ґ–Ю–І–Э–Ю–Ь –†–Р–Ъ–Х –Ы–Х–У–Ъ–Ш–•: –Ь–Э–Ю–У–Ю–¶–Х–Э–Ґ–†–Ю–Т–Ю–Х –†–Р–Э–Ф–Ю–Ь–Ш–Ч–Ш–†–Ю–Т–Р–Э–Э–Ю–Х –Ш–°–Я–Ђ–Ґ–Р–Э–Ш–Х –£ –Я–Р–¶–Ш–Х–Э–Ґ–Ю–Т –°–Ю –°–Ґ–Р–Ф–Ш–ѓ–Ь–Ш –Ч–Р–С–Ю–Ы–Х–Т–Р–Э–Ш–ѓ –Ґ 1-2, N 1-2, M 0
J. Geerling
–°—В–∞–љ–і–∞—А—В–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –Њ–њ–µ—А–∞–±–µ–ї—М–љ—Л–Љ –љ–µ–Љ–µ–ї–Ї–Њ–Ї–ї–µ—В–Њ—З–љ—Л–Љ —А–∞–Ї–Њ–Љ –ї–µ–≥–Ї–Є—Е (–Э–†–Ы) –±–µ–Ј –Њ—В–і–∞–ї–µ–љ–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤ —П–≤–ї—П–µ—В—Б—П —А–µ–Ј–µ–Ї—Ж–Є—П. –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –≤—Л–ґ–Є–≤–∞–љ–Є—П —Б–Є–ї—М–љ–Њ —Б–Њ–Ї—А–∞—Й–∞–µ—В—Б—П, –µ—Б–ї–Є –≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –≤–Њ–≤–ї–µ—З–µ–љ—Л –Љ–µ–і–Є–∞—Б—В–Є–љ–∞–ї—М–љ—Л–µ —Г–Ј–ї—Л, —З—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М —В—Й–∞—В–µ–ї—М–љ–Њ–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Б—В–∞–і–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –і–Њ –Њ–њ–µ—А–∞—Ж–Є–Є. –†–Њ–ї—М –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –љ–µ—П—Б–љ–∞, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е —А–∞–љ–µ–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б–њ—Л—В–∞–љ–Є–є, –≤ —Е–Њ–і–µ –Ї–Њ—В–Њ—А—Л—Е –љ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Б—В–∞–і–Є–є TNM. –¶–µ–ї—М –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П - —Б—А–∞–≤–љ–Є—В—М —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Њ–±–ї—Г—З–µ–љ–Є—П —Б—А–µ–і–Њ—Б—В–µ–љ–Є—П —Б —В–∞–Ї–Њ–≤—Л–Љ–Є –њ—А–Є –µ–≥–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Э–†–Ы —Б—В–∞–і–Є–є –Ґ1-2, N1-2, M0. –Т 16 –±—А–Є—В–∞–љ—Б–Ї–Є—Е –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є —А–∞–і–Є–Њ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е —Ж–µ–љ—В—А–∞—Е (–Њ—В–і–µ–ї–µ–љ–Є—П—Е) –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б–њ—Л—В–∞–љ–Є–µ, –∞–љ–∞–ї–Є–Ј —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Њ–≤–µ–і–µ–љ –њ–Њ –њ—А–Є–љ—Ж–Є–њ—Г "–љ–∞–Љ–µ—А–µ–љ–Є–µ –Є–Ј–ї–µ—З–Є—В—М". –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ–Њ–≥–ї–Є –±—Л—В—М –≤–Ї–ї—О—З–µ–љ—Л –њ–∞—Ж–Є–µ–љ—В—Л –ї—О–±–Њ–≥–Њ –њ–Њ–ї–∞ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –і–Њ 75 –ї–µ—В —Б –Э–†–Ы –ї—О–±–Њ–≥–Њ —В–Є–њ–∞ (–Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –Ї–∞—А—Ж–Є–љ–Њ–Є–і–љ–Њ–є –Њ–њ—Г—Е–Њ–ї–Є) —Б—В–∞–і–Є–Є –Ґ1-2, N1-2, M0. –Ъ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –њ—А–µ–і—К—П–≤–ї—П–ї–Є—Б—М —Б–ї–µ–і—Г—О—Й–Є–µ —В—А–µ–±–Њ–≤–∞–љ–Є—П: –љ–Њ—А–Љ–∞–ї—М–љ–∞—П –Є–ї–Є –њ–Њ—З—В–Є –љ–Њ—А–Љ–∞–ї—М–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–µ—А–µ–і –Њ–њ–µ—А–∞—Ж–Є–µ–є (—Б–Њ—Б—В–Њ—П–љ–Є–µ –ї–µ–≥–Ї–Є—Е –Є —Б–µ—А–і—Ж–∞ –љ–µ –і–Њ–ї–ґ–љ–Њ –њ—А–µ–њ—П—В—Б—В–≤–Њ–≤–∞—В—М –њ—А–Њ–≤–µ–і–µ–љ–Є—О —А–µ–Ј–µ–Ї—Ж–Є–Є), –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–є –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є, —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –Є–ї–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є (–Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є) –≤ —Б–≤—П–Ј–Є —Б –њ—А–Њ—В–µ–Ї–∞—О—Й–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ, –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є–ї–Є –і—А—Г–≥–Є—Е —Б–µ—А—М–µ–Ј–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є, —П–≤–ї—П—О—Й–Є—Е—Б—П –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –і–ї—П —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –Є–ї–Є –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є. –Я–∞—Ж–Є–µ–љ—В–∞–Љ –њ—А–µ–і—Б—В–Њ—П–ї–∞ –Ї—Г—А–∞—В–Є–≤–љ–∞—П —А–µ–Ј–µ–Ї—Ж–Є—П –Є —Г –љ–Є—Е —Б–ї–µ–і–Њ–≤–∞–ї–Њ –≤–Ј—П—В—М –њ—А–Њ–±—Л –Є–Ј –Ї–∞–Ї –Љ–Њ–ґ–љ–Њ –±–Њ–ї—М—И–µ–≥–Њ —З–Є—Б–ї–∞ —Б—В–∞–љ—Ж–Є–є –Є–њ—Б–Є–ї–∞—В–µ—А–∞–ї—М–љ—Л—Е –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤.
–Т –њ–µ—А–Є–Њ–і —Б –Є—О–ї—П 1986 –≥. –њ–Њ –Њ–Ї—В—П–±—А—М 1993 –≥. –њ–Њ—Б—В—Г–њ–Є–ї–Є 308 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (74% - –Љ—Г–ґ—З–Є–љ—Л). –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В —Б–Њ—Б—В–∞–≤–ї—П–ї 62 –≥–Њ–і–∞, –Њ–±—Й–µ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–Њ–ї–µ–µ 85% –±–Њ–ї—М–љ—Л—Е –±—Л–ї–Њ –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ –Є–ї–Є –њ–Њ—З—В–Є –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ, —Г 68% –±—Л–ї –њ–ї–Њ—Б–Ї–Њ–Ї–ї–µ—В–Њ—З–љ—Л–є —А–∞–Ї, 52% –њ–µ—А–µ–љ–µ—Б–ї–Є –њ–љ–µ–≤–Љ–Њ–љ—Н–Ї—В–Њ–Љ–Є—О, —Г 63% –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ —Б—В–∞–і–Є—П N1 –Є —Г 37% - N2 .
–°–њ—Г—Б—В—П 2 –Є 4 –љ–µ–і –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є —З–∞—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–∞ –љ–∞–Ј–љ–∞—З–µ–љ–∞ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–∞—П –ї—Г—З–µ–≤–∞—П —В–µ—А–∞–њ–Є—П (1-—П –≥—А—Г–њ–њ–∞, n = 154), –і—А—Г–≥–Њ–є —З–∞—Б—В–Є - –љ–µ—В (2-—П –≥—А—Г–њ–њ–∞, n = 154). –Я–∞—Ж–Є–µ–љ—В—Л 2-–є –≥—А—Г–њ–њ—Л –љ–µ –њ–Њ–ї—Г—З–∞–ї–Є –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—В–Є–≤–Њ—А–∞–Ї–Њ–≤–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –і–Њ —В–µ—Е –њ–Њ—А, –њ–Њ–Ї–∞ –љ–µ —А–∞–Ј–≤–Є–≤–∞–ї—Б—П —А–µ—Ж–Є–і–Є–≤. –Я–∞—Ж–Є–µ–љ—В—Л 1-–є –≥—А—Г–њ–њ—Л –њ–Њ–ї—Г—З–∞–ї–Є –Ї—Г—А—Б –Њ–±–ї—Г—З–µ–љ–Є—П –љ–∞ –±—А–Њ–љ—Е–Є–∞–ї—М–љ—Г—О –Ї—Г–ї—М—В—О, –Љ–µ–і–Є–∞—Б—В–Є–љ–∞–ї—М–љ—Л–µ —Г–Ј–ї—Л –Є –ї–µ–≥–Њ—З–љ—Л–µ –≤–Њ—А–Њ—В–∞. –Ю–±–ї—Г—З–µ–љ–Є–µ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –Љ–µ—Б—В–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–Њ–є –љ–∞—З–Є–љ–∞–ї–Є —З–µ—А–µ–Ј 4 - 6 –љ–µ–і –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є. –Ф–Њ–Ј–∞ –Њ–±–ї—Г—З–µ–љ–Є—П –љ–∞ —Ж–µ–љ—В—А–∞–ї—М–љ—Г—О —Б—А–µ–і–љ—О—О –ї–Є–љ–Є—О —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 40–У—А –≤ –і–љ–µ–≤–љ—Л—Е —Д—А–∞–Ї—Ж–Є—П—Е, 5 –і–љ–µ–є –≤ –љ–µ–і–µ–ї—О –≤ —В–µ—З–µ–љ–Є–µ 3 –љ–µ–і –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –≤—Л—Б–Њ–Ї–Њ–≤–Њ–ї—М—В–љ–Њ–µ –Є–Ј–ї—Г—З–µ–љ–Є–µ –Є–ї–Є –≥–∞–Љ–Љ–∞-–Є–Ј–ї—Г—З–µ–љ–Є–µ –Є–Ј–Њ—В–Њ–њ–∞ 60–°–Њ.
18 –Є–Ј 154 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ 1-–є –≥—А—Г–њ–њ—Л –љ–µ –љ–∞—З–∞–ї–Є –њ–Њ–ї—Г—З–∞—В—М –ї—Г—З–µ–≤—Г—О —В–µ—А–∞–њ–Є—О, –∞ 15 —З–µ–ї–Њ–≤–µ–Ї –љ–µ –Ј–∞–Ї–Њ–љ—З–Є–ї–Є –љ–∞–Ј–љ–∞—З–µ–љ–љ—Л–є –Ї—Г—А—Б –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ —В–µ–Љ –Є–ї–Є –Є–љ—Л–Љ –њ—А–Є—З–Є–љ–∞–Љ. 221 (72%) –њ–∞—Ж–Є–µ–љ—В —Г–Љ–µ—А, –∞ —Б—А–µ–і–љ–µ–µ –≤—А–µ–Љ—П –љ–∞–±–ї—О–і–µ–љ–Є—П 87 –≤—Л–ґ–Є–≤—И–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 30 –Љ–µ—Б (–Њ—В 7 –Љ–µ—Б –і–Њ 7 –ї–µ—В). –Т–љ–∞—З–∞–ї–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ 2-–є –≥—А—Г–њ–њ—Л –Є–Љ–µ–ї–Њ—Б—М –љ–µ–±–Њ–ї—М—И–Њ–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ: —Б—А–µ–і–љ–µ–µ –≤—А–µ–Љ—П –≤—Л–ґ–Є–≤–∞–љ–Є—П –≤ —Н—В–Њ–є –≥—А—Г–њ–њ–µ —Б–Њ—Б—В–∞–≤–ї—П–ї–Њ 19 –Љ–µ—Б, –∞ –≤ 1-–є - 17,5 –Љ–µ—Б, –љ–Њ –Ј–∞—В–µ–Љ, –њ—А–Є–Љ–µ—А–љ–Њ —З–µ—А–µ–Ј 20 –Љ–µ—Б, –Ї—А–Є–≤—Л–µ –≤—Л–ґ–Є–≤–∞–љ–Є—П –њ–µ—А–µ—Б–µ–Ї–ї–Є—Б—М. –І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –≤—А–µ–Љ–µ–љ–Є, –њ—А–Њ—Е–Њ–і—П—Й–µ–≥–Њ –і–Њ –≤—Л—П–≤–ї–µ–љ–Є—П –Љ–µ—Б—В–љ–Њ–≥–Њ —А–µ—Ж–Є–і–Є–≤–∞, —В–Њ –∞–љ–∞–ї–Є–Ј –њ–Њ–Ї–∞–Ј–∞–ї –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ 1-–є –≥—А—Г–њ–њ—Л: –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї 1,64; –Є–љ—В–µ—А–≤–∞–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є 1,03 - 2,61, —А = 0,04. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ 1-–є –≥—А—Г–њ–њ–µ –Ї–Њ—Б—В–љ—Л–µ –Љ–µ—В–∞—Б—В–∞–Ј—Л –њ–Њ—П–≤–ї—П–ї–Є—Б—М –њ–Њ–Ј–ґ–µ –Є –Љ–µ–љ–µ–µ —З–∞—Б—В–Њ. –Я—А–Є —Б—В–∞–і–Є–Є N1 –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –ї–µ—З–µ–љ–Є—П, –љ–Њ –њ–∞—Ж–Є–µ–љ—В—Л 1-–є –≥—А—Г–њ–њ—Л —Б–Њ —Б—В–∞–і–Є–µ–є N2 –Є–Љ–µ–ї–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞: –Њ–і–Є–љ –ї–Є—И–љ–Є–є –Љ–µ—Б—П—Ж –≤—Л–ґ–Є–≤–∞–љ–Є—П, –±–Њ–ї–µ–µ –њ–Њ–Ј–і–љ–µ–µ –њ–Њ—П–≤–ї–µ–љ–Є–µ –Љ–µ—Б—В–љ—Л—Е —А–µ—Ж–Є–і–Є–≤–Њ–≤ –Є –Ї–Њ—Б—В–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤. –£ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ (69%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–Љ –±—Л–ї–∞ –љ–∞–Ј–љ–∞—З–µ–љ–∞ –Є –љ–∞—З–∞—В–∞ –ї—Г—З–µ–≤–∞—П —В–µ—А–∞–њ–Є—П, –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –њ–Њ–±–Њ—З–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є –љ–∞ –ї–µ—З–µ–љ–Є–µ, —Г 36 —З–µ–ї–Њ–≤–µ–Ї –Њ–љ–Є –±—Л–ї–Є —Б–ї–∞–±—Л–Љ–Є, —Г 45 - —Г–Љ–µ—А–µ–љ–љ—Л–Љ–Є –Є —Г 15 - —Б–Є–ї—М–љ—Л–Љ–Є. –Э–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ —П–≤–ї–µ–љ–Є—П –≤–Ї–ї—О—З–∞–ї–Є —Н–Ј–Њ—Д–∞–≥–Є—В, –і–Є—Б—Д–∞–≥–Є—О, —В–Њ—И–љ–Њ—В—Г, —А–≤–Њ—В—Г, –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –≥–Њ—А–ї–∞ –Є —Б–Њ–љ–ї–Є–≤–Њ—Б—В—М.
–Р–≤—В–Њ—А—Л –і–µ–ї–∞—О—В –≤—Л–≤–Њ–і –Њ–± –Њ—В—Б—Г—В—Б—В–≤–Є–Є —З–µ—В–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є —Б—В–∞–і–Є–Є N1, –љ–Њ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б—В–∞–і–Є–Є N2 –≤–Њ–њ—А–Њ—Б –Њ—Б—В–∞–µ—В—Б—П –љ–µ—А–µ—И–µ–љ–љ—Л–Љ.
–Ы–Є—В–µ—А–∞—В—Г—А–∞:
Medical Research Council Lung Cancer Working Party, prepared by Stephens RJ, Girling DJ, Bleehen NM et al. The role of postoperative radiotherapy in nonsmall cell lung cancer: a multicenter randomised trial in patients with pathologically staged T1-2, N1-2, M0 disease. Br J Cancer 1996;74:632-9.
–†–Р–Э–Ф–Ю–Ь–Ш–Ч–Ш–†–Ю–Т–Р–Э–Э–Ю–Х –Ъ–Ю–Э–Ґ–†–Ю–Ы–Ш–†–Ю–Т–Р–Э–Э–Ю–Х –Ш–°–°–Ы–Х–Ф–Ю–Т–Р–Э–Ш–Х –Ъ–Ю–Э–°–Х–†–Т–Р–Ґ–Ш–Т–Э–Ю–У–Ю –Ы–Х–І–Х–Э–Ш–ѓ –†–Р–Ъ–Р –Ь–Ю–Ы–Ю–І–Э–Ю–Щ –Ц–Х–Ы–Х–Ч–Ђ
J. Geerling
–Я–Њ—П–≤–ї—П–µ—В—Б—П –≤—Б–µ –±–Њ–ї—М—И–µ –і–∞–љ–љ—Л—Е, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є—Е –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Є —А–∞–Ї–µ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –і–≤—Г—Е –≤–Є–і–Њ–≤ –Љ–µ—Б—В–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –Љ–∞—Б—В—Н–Ї—В–Њ–Љ–Є–Є –Є —З–∞—Б—В–Є—З–љ–Њ–≥–Њ –Є—Б—Б–µ—З–µ–љ–Є—П, —А–∞–≤–љ–Њ—Ж–µ–љ–љ—Л. –¶–µ–ї—М—О –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Њ –Њ–њ—А–µ–і–µ–ї–Є—В—М –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –і–ї—П –ґ–µ–љ—Й–Є–љ, –њ–Њ–ї—Г—З–Є–≤—И–Є—Е —Б–Є—Б—В–µ–Љ–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б–Њ–і–µ—А–ґ–∞–љ–Є—П —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ (–†–≠), –њ–Њ—Б–ї–µ –ї–Њ–Ї–∞–ї—М–љ–Њ–є —А–µ–Ј–µ–Ї—Ж–Є–Є –Њ–њ—Г—Е–Њ–ї–Є. –†–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б–њ—Л—В–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ 11 –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Њ—В–і–µ–ї–µ–љ–Є—П—Е —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е —Ж–µ–љ—В—А–Њ–≤ –®–Њ—В–ї–∞–љ–і–Є–Є.
–Т –њ–µ—А–Є–Њ–і —Б 1 –∞–њ—А–µ–ї—П 1985 –≥. –њ–Њ 2 –Њ–Ї—В—П–±—А—П 1991 –≥. –Я–∞—Ж–Є–µ–љ—В–Ї–Є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –і–Њ 70 –ї–µ—В —Б –Є–љ–≤–∞–Ј–Є–≤–љ—Л–Љ —А–∞–Ї–Њ–Љ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (—А–∞–Ј–Љ–µ—А –Њ–њ—Г—Е–Њ–ї–Є 4 —Б–Љ –Є–ї–Є –Љ–µ–љ–µ–µ), —Б–Њ–≥–ї–∞—Б–Є–≤—И–Є–µ—Б—П –љ–∞ —Г—З–∞—Б—В–Є–µ –≤ –Є—Б–њ—Л—В–∞–љ–Є–Є, –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л –≤ –љ–µ–≥–Њ –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –Њ—В—Б—Г—В—Б—В–≤–Є—П –њ–µ—А–≤–Є—З–љ–Њ–є –Њ–њ—Г—Е–Њ–ї–Є –Є–ї–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–Њ–і–Љ—Л—И–µ—З–љ—Л—Е –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤. –С—Л–ї–Є –Є—Б–Ї–ї—О—З–µ–љ—Л –ґ–µ–љ—Й–Є–љ—Л –≤ –њ—А–µ–і–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ —Б –њ–Њ–і–Љ—Л—И–µ—З–љ—Л–Љ–Є —Г–Ј–ї–∞–Љ–Є, –≤–Њ–≤–ї–µ—З–µ–љ–љ—Л–Љ–Є –≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б, –ґ–µ–љ—Й–Є–љ—Л —Б–Њ –≤—В–Њ—А–Њ–є –Њ–њ—Г—Е–Њ–ї—М—О –≤ —В–Њ–є –ґ–µ –Є–ї–Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–Њ–є –≥—А—Г–і–Є, –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Б –Є–љ–≤–∞–Ј–Є–≤–љ—Л–Љ —А–∞–Ї–Њ–Љ –ї—О–±–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –Є —В–µ, –Ї–Њ–Љ—Г –њ–Њ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–Љ –Є –і—А—Г–≥–Є–Љ –њ—А–Є—З–Є–љ–∞–Љ –±—Л–ї–Њ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Њ —Б–Њ–±–ї—О–і–µ–љ–Є–µ –њ—А–Њ—В–Њ–Ї–Њ–ї–∞ –Є—Б–њ—Л—В–∞–љ–Є—П.
–Я–Њ—Б–ї–µ —З–∞—Б—В–Є—З–љ–Њ–≥–Њ –Є—Б—Б–µ—З–µ–љ–Є—П –Њ–њ—Г—Е–Њ–ї–Є (–Ї—А–∞–є 1 —Б–Љ) –Є –Њ—З–Є—Й–µ–љ–Є—П –њ–Њ–і–Љ—Л—И–µ—З–љ–Њ–≥–Њ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Г–Ј–ї–∞ –Є–ї–Є –≤–Ј—П—В–Є—П –њ—А–Њ–±—Л –≤—Б–µ –њ–∞—Ж–Є–µ–љ—В–Ї–Є –њ–Њ–ї—Г—З–∞–ї–Є —Б–Є—Б—В–µ–Љ–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –†–≠ –≤ –њ–µ—А–≤–Є—З–љ–Њ–є –Њ–њ—Г—Е–Њ–ї–Є. –Х—Б–ї–Є –Њ–љ–Њ —Б–Њ—Б—В–∞–≤–ї—П–ї–Њ 20 —Д–Љ–Њ–ї—М/–Љ–≥ –±–µ–ї–Ї–∞ –Є–ї–Є –±–Њ–ї–µ–µ, –њ–∞—Ж–Є–µ–љ—В–Ї–∞–Љ –љ–∞–Ј–љ–∞—З–∞–ї–Є —В–∞–Љ–Њ–Ї—Б–Є—Д–µ–љ –њ–Њ 20 –Љ–≥ –≤ –і–µ–љ—М –≤ —В–µ—З–µ–љ–Є–µ –љ–µ –Љ–µ–љ–µ–µ 5 –ї–µ—В –Є–ї–Є –і–Њ —А–∞–Ј–≤–Є—В–Є—П —А–µ—Ж–Є–і–Є–≤–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ –њ—А–Є —Б–Њ–і–µ—А–ґ–∞–љ–Є–Є –†–≠ –Љ–µ–љ–µ–µ 20 —Д–Љ–Њ–ї—М/–Љ–≥ –±–µ–ї–Ї–∞ –љ–∞–Ј–љ–∞—З–∞–ї–Є —И–µ—Б—В—М 3-–љ–µ–і–µ–ї—М–љ—Л—Е –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л—Е –±–Њ–ї—О—Б–љ—Л—Е –Є–љ—К–µ–Ї—Ж–Є–є —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і–∞ –њ–Њ 600 –Љ–≥, –Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В–∞ –њ–Њ 50 –Љ–≥ –Є —Д—В–Њ—А—Г—А–∞—Ж–Є–ї–∞ –њ–Њ 600 –Љ–≥/–Љ2 (–¶–Ь–§). –Ґ–µ, —Г –Ї–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –†–≠ –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є, –і–Њ–ї–ґ–љ—Л –±—Л–ї–Є –њ–Њ–ї—Г—З–∞—В—М —В–∞–Љ–Њ–Ї—Б–Є—Д–µ–љ. –Ч–∞—В–µ–Љ –Є–Ј 585 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 291 –±—Л–ї–∞ –њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ–Њ –љ–∞–Ј–љ–∞—З–µ–љ–∞ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–∞—П —А–∞–і–Є–Ї–∞–ї—М–љ–∞—П –ї—Г—З–µ–≤–∞—П —В–µ—А–∞–њ–Є—П (50 –У—А –љ–∞ –≥—А—Г–і—М —Б —Г—Б–Є–ї–µ–љ–Є–µ–Љ –љ–∞ –Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–µ –ї–Њ–ґ–µ), –Њ—Б—В–∞–ї—М–љ—Л–µ –љ–µ –њ–Њ–ї—Г—З–∞–ї–Є –љ–Є–Ї–∞–Ї–Њ–≥–Њ –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –ї–µ—З–µ–љ–Є—П. –Ь–µ–ґ–і—Г –і–≤—Г–Љ—П –≥—А—Г–њ–њ–∞–Љ–Є –љ–µ –±—Л–ї–Њ –љ–Є–Ї–∞–Ї–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–∞–Ј–ї–Є—З–Є–є.
–Я—А–Є –њ–µ—А–≤–Є—З–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –њo –њ—А–Є–љ—Ж–Є–њ—Г "–љ–∞–Љ–µ—А–µ–љ–Є–µ –Є–Ј–ї–µ—З–Є—В—М" –≤—Л–ґ–Є–≤–∞–љ–Є–µ –±—Л–ї–Њ –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–Љ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е (–Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї - –Ю–† 0,98; 95% –Ш–Ф 0,67 - 1,44). –Т—Л–ґ–Є–≤–∞–љ–Є–µ –±–µ–Ј –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є –±—Л–ї–Њ –ї—Г—З—И–Є–Љ –≤ –≥—А—Г–њ–њ–µ –њ–Њ–ї—Г—З–Є–≤—И–Є—Е –ї—Г—З–µ–≤—Г—О —В–µ—А–∞–њ–Є—О (–Ю–† 0,54; 95% –Ш–Ф 0,39 - 0,74), –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –±–ї–∞–≥–Њ–і–∞—А—П –Љ–µ–љ—М—И–µ–Љ—Г –Ї–Њ–ї–Є—З–µ—Б—В–≤—Г –ї–Њ–Ї–∞–ї—М–љ–Њ-—А–µ–≥–Є–Њ–љ–∞—А–љ—Л—Е —А–µ—Ж–Є–і–Є–≤–Њ–≤ (–Ю–† 0,2; 95% –Ш–Ф 0,12 - 0,33). –І–∞—Б—В–Њ—В–∞ —А–µ—Ж–Є–і–Є–≤–Њ–≤ –≤ –Є–њ—Б–Є–ї–∞—В–µ—А–∞–ї—М–љ–Њ–є –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј–µ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 24,5% –≤ –≥—А—Г–њ–њ–µ –љ–µ–Њ–±–ї—Г—З–µ–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Є 5,8% –њ–Њ—Б–ї–µ –Њ–±–ї—Г—З–µ–љ–Є—П –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л. –Т –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј –≤–Ї–ї—О—З–Є–ї–Є –і–∞–љ–љ—Л–µ 464 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї (228 –њ–Њ–і–≤–µ—А–≥–ї–Є—Б—М –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є, 236 - –љ–µ—В); –Њ–љ –њ–Њ–і—В–≤–µ—А–і–Є–ї –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є, –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –†–≠. –Э–∞–±–ї—О–і–∞–ї–∞—Б—М –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–∞—П —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —А–∞–Ј–≤–Є—В–Є—О –Љ–µ–љ—М—И–Є—Е –Њ—В–і–∞–ї–µ–љ–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –Њ–±–ї—Г—З–µ–љ–Є—П.
–Р–≤—В–Њ—А—Л –њ—А–Є—Е–Њ–і—П—В –Ї –Ј–∞–Ї–ї—О—З–µ–љ–Є—О, —З—В–Њ –њ–Њ—Б–ї–µ —З–∞—Б—В–Є—З–љ–Њ–≥–Њ –Є—Б—Б–µ—З–µ–љ–Є—П –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ —А–∞–Ї–∞ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –ї—Г—З–µ–≤–∞—П —В–µ—А–∞–њ–Є—П –Њ—Б—В–∞–≤—И–µ–є—Б—П —В–Ї–∞–љ–Є –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –і–∞–ґ–µ –≤ —В–Њ–Љ —Б–ї—Г—З–∞–µ, –µ—Б–ї–Є –њ—А–Њ–≤–Њ–і–Є—В—Б—П —Б–µ–ї–µ–Ї—В–Є–≤–љ–∞—П –≤—Б–њ–Њ–Љ–Њ–≥–∞—В–µ–ї—М–љ–∞—П —Б–Є—Б—В–µ–Љ–љ–∞—П —В–µ—А–∞–њ–Є—П.
–Ы–Є—В–µ—А–∞—В—Г—А–∞:
Forrest A–†, Stewart HJ, Everington D, et al. Randomised controlled trial of conservation therapy for breast cancer: 6 year analysis of the Scottish trial. Lancet 1996;348:708:13.












