Введение
В России заболеваемость в 2018 г. раком орофарингеальной зоны (РОФЗ) составила 28,5 на 100 тыс. населения с индексом накопления 4,8, в Ростовской области эти показатели — 28,3 и 5,2 соответственно. Чаще болеют мужчины в возрасте от 40 до 54 лет, более чем у половины заболевших очаг поражения выявляется в области небных миндалин (63,7%), затем, по убывающей, поражаются корень языка (20,8%), задняя стенка глотки (9,1%) и область мягкого неба (5,2%) [1].
При этом, несмотря на простоту визуальной диагностики, более 50% больных РОФЗ имеют первично местно-распространенные III–IV (T3N0–1M0; T1–3N1–3M0) стадии процесса, сопровождающиеся массивным поражением регионарных лимфатических зон [2, 3].
Возможности самостоятельного стандартного конвенциального лучевого лечения, по сути, единственно адекватного терапевтического пособия при распространенных опухолях, весьма скромные. Общий резорбционный эффект под действием ионизирующего излучения достигается в среднем лишь у 65–70% пациентов, полная регрессия после курса облучения отмечается лишь у каждого 3-го больного, прогрессирование — у каждого 5-го [4–8].
Различные варианты использования цитостатиков, обладающих в т. ч. радиосенсибилизирующими свойствами, несущественно изменяют клиническую ситуацию и сопровождаются заметной токсичностью. В среднем 3- и 5-летняя выживаемость при III–IV стадии РОФЗ находится на уровне 43,4% и 35,5% соответственно [2–11].
Исторически большинство случаев возникновения РОФЗ связывали с употреблением табака и алкоголя и преимущественно у пожилых пациентов. В настоящее время этиопатогенетически развитие РОФЗ сложно не связать с вирусом из семейства Papillomaviridae, который выявляется почти в 70% вновь диагностированных случаев этого заболевания. Установлено, что способный к персистенции вирус папилломы человека (ВПЧ) с онкогенным характером в 30 раз увеличивает риск рака миндалин, блокируя при этом механизмы врожденного и адаптивного противовирусного иммунитета организма-хозяина [12–15].
Среди множества вновь созданных лекарственных препаратов, обладающих противовирусными свойствами, на сегодняшний день нет средств с убедительно доказанным избирательным действием против ВПЧ. Лечение нозологических форм, связанных с папилломавирусной инфекцией, остается сложной и актуальной задачей. Пока не существует противовирусной терапии для борьбы с этими видами рака [16].
Современные профилактические вакцины против ВПЧ активируют иммунитет хозяина, стимулируя выработку антител, специфически нацеленных на капсидные белки ВПЧ [12]. Однако эти вакцины не способны уничтожать клетки, инфицированные ВПЧ, поскольку капсидные белки присутствуют только перед проникновением вируса или в терминально дифференцированном эпителии. Поэтому необходима терапевтическая вакцина, чтобы вызвать клеточно-опосредованные иммунные ответы против вирусных антигенов, которые конститутивно экспрессируются в инфицированных клетках.
В этом плане обоснованный интерес представляет один из представителей новой группы антивирусных препаратов природного происхождения — Аллокин-альфа, синтезированный на основе действующего вещества аллоферон (гистидил-глицил-валил-серил-глицил-гистидил-глицил-глутаминил-гистидил-глицил-валил-гистидил-глицин), который способен индуцировать в организме синтез эндогенных интерферонов и активировать систему функциональной активности естественных клеток-киллеров. Опосредованно через активацию цитотоксической активности иммунокомпетентных клеток проявляется терапевтический эффект Аллокина-альфа по подавлению очагов вирусной инфекции [17–19].
В экспериментах на животных с перевитыми опухолями было выявлено, что помимо способности распознавать и уничтожать очаги вирусной инфекции аллоферон обладает и определенным противоопухолевым действием, впервые обнаруженным в опытах на животных с трансплантированными опухолями [20].
Проведение курса неспецифической иммунотерапии препаратом Аллокин-альфа в ходе лекарственного лечения больных местно-распространенным раком шейки матки при снижении токсичности химиотерапии способствовало переводу 78% больных в резектабельное состояние и увеличению выживаемости больных раком шейки матки [21, 22].
Цель исследования: оценить терапевтические возможности использования препарата Аллокин-альфа при лучевом лечении больных РОФЗ с ВПЧ-позитивным статусом.
Материал и методы
Клинический материал представлен 40 больными РОФЗ III–IV (T3N0–1M0, T1–3N1–3M0) стадий, получавших лучевое лечение в ФГБУ «НМИЦ онкологии» Минздрава России (ранее ФГБУ «РНИОИ» Минздрава России) в период с 2017 по 2019 г.
Критерии включения в исследование: морфологически верифицированный рак с подтвержденным наличием ДНК ВПЧ в мазках с поверхности опухоли; отсутствие признаков органного отдаленного метастазирования; решение консилиума о необходимости проведения 1-м этапом лучевого лечения; отсутствие стандартных противопоказаний к проведению курсов облучения и информированное согласие больного на предлагаемое лечение. Критерии исключения: отсутствие или отрицательные данные по одному из пунктов критериев
включения.
Пациенты распределены на 2 сопоставимые по клиническим параметрам группы. Средний возраст больных составил 54,5±5,6 года (от 40 до 69 лет). Соотношение мужчин и женщин в среднем составило 5,3:1. Стадирование процесса проводилось по системе UICC TNM (7-й пересмотр, 2009) [23].
Основную группу составили 19 больных, из которых 10 (52,6%) имели III (T3N0–1M0) стадию процесса, 6 (31,6%) — IVa (T3N2M0), 3 (15,8%) — IVb (T2N3M0) стадию. В контрольную (ретроспективную) группу вошел 21 пациент, из которых 14 (66,7%) были со стадией III, 5 (23,8%) и 2 (9,5%) — соответственно со стадией IVa
и IVb. В обеих группах чаще имела место локализация опухоли на миндалинах: в 8 (42,2%) случаях в основной группе и в 10 (47,7%) — в контрольной. Поражение корня языка и мягкого неба было соответственно в 5 (26,3%) и 4 (21,0%) случаях в основной группе и по 19% (по 4) случаев — в контрольной группе. На задней стенке глотки опухоль была обнаружена у 2 (10,5%) и 3 (14,3%) пациентов соответственно в основной и контрольной группах.
В обеих группах гистологическая структура опухоли была представлена плоскоклеточным раком различной степени дифференцировки с тенденцией к ороговению в 67,5% (27 из 40), без ороговения — в 25% (10 из 40) и опухоли другого генеза в 7,5% (3 из 40) случаев.
До начала лечения и для контроля клинической эффективности на этапах лучевой терапии все больные подвергались клиническому (визуальные, пальпаторные и др.) и лабораторному обследованию в стандартном объеме для оценки общего состояния и локального статуса. Использовались ларингоскопические исследования, инструментальные методы: ультрасонографическое исследование лимфоузлов, спиральная рентгеновская компьютерная томография (СРКТ) и, по показаниям, магнитно-резонансная томография (МРТ).
Основным методом лечения для больных обеих групп являлось наружное облучение в монорежиме по радикальной программе. После топометрической подготовки с использованием компьютерного томографа Siemens Sonatom Definition AS (Siemens, Германия), изготовления термопластической маски с рентгенконтрастными метками с использованием системы лазерной навигации Lap-Lasers и станции виртуальной симуляции Syngo Via с помощью программного обеспечения Eclips Varian выполнялось определение поля облучения с выведением критических областей из зоны облучения. Расчет и формирование плана лечения в режиме 3D-планирования проводились для линейного ускорителя низких энергий ЛУЭ с энергией 6 МэВ Unique (Varian, США).
Облучение осуществлялось в соответствии с современными клиническими стандартами в конвенциальном режиме разовой очаговой дозы (РОД) 2 Гр ежедневно, 5 фракций в неделю. Применялся расщепленный курс лечения (сплит-курс) и перепланировка лечебного плана в зависимости от клинического эффекта после 1-го этапа облучения. За 2 этапа лечебного курса на первичный очаг подводилась суммарная очаговая доза (СОД) 65–72 Гр. На регионарные зоны лимфогенного метастазирования в зависимости от их поражения при N0–1 СОД составляла 46–50 Гр, при N2–3 — 66 Гр.
Всем пациентам только основной группы с 1-го дня и, в дальнейшем, на этапах лучевого лечения вводили подкожно 1,0 мг препарата Аллокин-альфа (производитель — ФГУП «Гос.НИИ ОЧБ» ФМБА России, владелец регистрационного удостоверения — ООО «Аллоферон»). Находящийся (в сухом виде) в ампуле 1,0 мг Аллокина-альфа растворяли 1,0 мл физиологического раствора. Инъекции Аллокина-альфа осуществляли через день, включая дни, свободные от проведения сеансов облучения, — календарные выходные и праздничные дни. Во время планового перерыва в курсе облучения Аллокин-альфа не вводили. Всего за курс лечения пациенты основной группы получали 24±2,0 мг Аллокина-альфа.
Мазки с поверхности очага поражения для определения ДНК ВПЧ исследовались методом полимеразной цепной реакции с соблюдением санитарных норм до лечения, перед началом 2-го этапа и после завершения запланированного курса лучевой терапии.
Статистическую обработку полученных данных проводили с использованием пакета прикладных программ Statistica 6,0 (StatSoft, США). Оценку значимости различий средних значений показателя осуществляли с использованием t-критерия Стьюдента для независимых выборок. Статистические гипотезы считали достоверными при уровне значимости р<0,05.
Результаты исследования
Сравнение клинических отличий между группами для выявления положительных и отрицательных сторон использования препарата Аллокин-альфа оценивали, прежде всего, по динамике субъективных и объективных признаков заболевания. Необходимо сразу отметить, что введение препарата не сопровождалось болевыми ощущениями и переносилось пациентами без каких бы то ни было побочных реакций.
Изменение характера жалоб больных как показатель субъективного эффекта лечения мы регистрировали до начала облучения и перед началом 2-го этапа облучения. Суммарно при этом все пациенты получали на зону мишени СОД 42±2 изоГр, а больные основной группы — дополнительно 15±1,0 мг Аллокина-альфа. Данные о динамике субъективной симптоматики представлены в таблице 1.
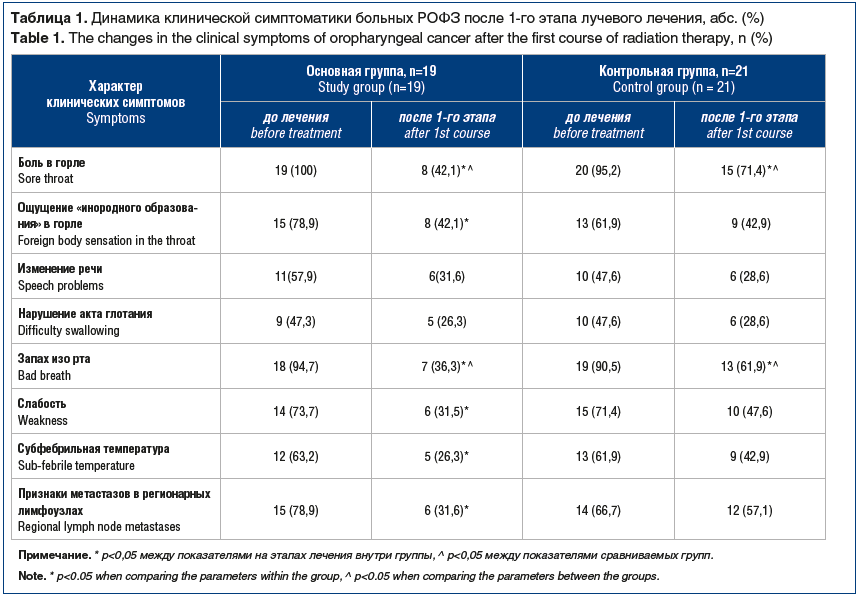
Из данных таблицы 1 видно, что после 1-го этапа лучевого лечения в обеих группах уменьшилось число больных, предъявлявших жалобы на самостоятельные и/или усиливающиеся при глотании боли в горле или иррадирущие в ухо. Однако такую положительную динамику в своем состоянии по сравнению с исходом отметили 57,9% больных в основной группе и 23,8% (в 2,4 раза меньше) в контрольной группе (р<0,05).
Характерная для патологии орофарингеальной области жалоба на постоянное чувство «инородного тела» в горле исчезла практически у каждого 3-го (36,8%, р<0,05) больного из получавших Аллокин-альфа дополнительно к облучению. В контрольной группе это тягостное ощущение перестало беспокоить только 19% пациентов.
Примерно в равной степени в обеих группах отмечена положительная динамика в восстановлении акта глотания и характера речи.
Жалобы на гнилостный запах изо рта до лечения с одинаковой частотой предъявляли больные обеих групп. Этот неприятный субъективный симптом после 1-го этапа лечения сохранился только у каждого 3-го больного (36,3%) в основной группе, а в контрольной — у 61,9% пациентов (в 1,7 раза больше) (р<0,05). Слабость и субфебрильная температура перестали беспокоить 39,6% (р<0,05) больных основной группы (68,5% в исходе и 28,9% после 1-го этапа) и только 21,4% (66,7% в исходе и 45,3% после 1-го этапа) больных, получавших стандартное лечение.
Известно, что в связи с низкой толерантностью к действию ионизирующего излучения уже на уровне очаговых доз 35–40 Гр со стороны слизистых оболочек органов головы и шеи неизбежно возникают лучевые реакции в виде явлений стоматита, эпителиита (мукозита). Это, собственно, и обусловливает необходимость 2–3-недельного перерыва в курсе облучения при этой патологии [24, 25]. Мы проанализировали характер и частоту лучевых реакций в обеих группах наших больных после 1-го этапа облучения. Данные представлены в таблице 2. Выявлено, что больные основной группы, получавшие Аллокин-альфа, легче, чем пациенты со стандартным лечением, переносили курс облучения.

Подтверждением этого может служить частота развития тяжелой лучевой реакции в виде пленчатого эпителиита. У больных основной группы эпителиит 3-й степени сформировался в конце лечения только у 1 (5,3%) больного, в то время как в группе контроля подтвержденный данными орофарингоскопии пленчатый эпителиит имел место в 28,5% случаев (в 5,3 раза чаще; р<0,05). При примерно равной частоте случаев развития островкового эпителиита (2-я степень) в обеих группах у больных основной группы в 2 раза чаще, чем в контроле, возникал лучевой эпителиит 1-й степени (57,9% против 28,5%, р<0,05). С одинаковой частотой по срокам в обеих группах отмечались эритема и сухость кожи зоны облучения.
Всем больным обеих групп проводилось методически идентичное лучевое лечение с адекватным предлучевым топометрическим планированием курса и выбором оптимального распределения полей облучения, аналогичное общепринятое сопроводительное лечение в процессе курса облучения. На фоне этого у больных основной группы отмечена не только существенная положительная динамика в стихании клинической симптоматики, но и сдерживание в определенной степени тяжести лучевых реакций. Не исключено, что эти позиции связаны с использованием Аллокина-альфа на этапах облучения. Вероятность радиопротекторного влияния Аллокина-альфа требует дополнительного исследования.
После планового перерыва продолжительностью 2–3 нед. возобновлялся курс лучевой терапии с переформированием плана облучения в зависимости от клинического эффекта. Всем больным основной группы продолжалось подкожное введение 1,0 мг Аллокина-альфа. На 2-м этапе требовалось в среднем 10±1,0 мг препарата.
Противоопухолевый эффект в обеих группах больных мы оценивали через 1 мес. после завершения курса лечения, после стихания проявлений лучевых реакций и восстановления тканей. Использовали критерии оценки ответа солидных опухолей RECIST 1.1 [26].
Данные о противоопухолевой эффективности в зависимости от варианта лечения представлены в таблице 3.
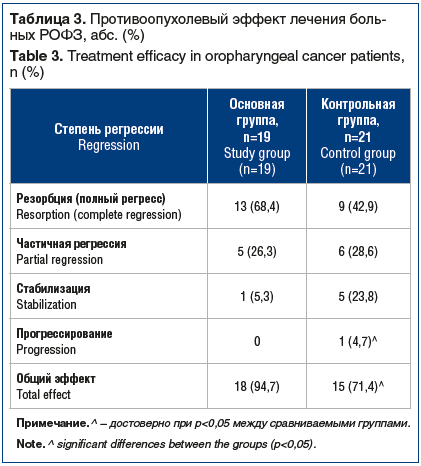
При анализе этих данных обратила на себя внимание высокая противоопухолевая эффективность у больных основной группы. Общий контролируемый эффект уже после 1-го этапа облучения установлен у 94,7% больных, получавших Аллокин-альфа. В контрольной группе подобный эффект выявлен у существенно меньшего числа пациентов — у 71,4% (р<0,05). При этом в основной группе полная регрессия опухоли зафиксирована у 13 больных (68,4%), в контрольной группе — у 9 (42,9%) (р<0,1). Наряду с этим в контрольной группе имелся 1 случай прогрессии рака задней стенки глотки (отдаленный метастаз в легкое) и было в 4,5 раза больше, чем в основной группе, случаев стабилизации (р<0,1).
Нужно отметить, что подавляющее число случаев полной регрессии опухоли составили больные раком миндалины: 8 (61,5%) из 13 в основной группе и 8 (88,8%) из 9 — в контрольной. В основной группе полная регрессия наступила также у 3 больных раком языка и у 2 — раком мягкого неба, в контрольной — еще у 1 пациента со злокачественным новообразованием мягкого неба. Несомненно, в увеличение числа случаев полной регрессии опухоли свой вклад внесла и реакция на лечение лимфогенных метастазов. В основной группе у больных, получавших Аллокин-альфа, уже на 1-м этапе облучения (см. табл. 1) резорбция опухоли в регионарных лимфоузлах была установлена в 47,3% случаев, а в контрольной группе — только в 9,6% (р<0,05).
В рамках данного сообщения мы не анализировали показатели отдаленной выживаемости больных. Однако известный факт о значительном влиянии степени первичной регрессии опухоли, включая реакцию регионарных метастазов на облучение, на окончательные результаты лечения [3, 7, 8] позволяет надеяться на их достаточно высокие значения.
Заключение
Таким образом, предварительные клинические данные свидетельствуют о целесообразности использования противовирусного препарата Аллокин-альфа дополнительно на этапах стандартного лучевого лечения местно-распространенного РОФЗ. Данный препарат хорошо переносится больными, способствует достижению противоопухолевого эффекта, включая влияние на лимфатические зоны, возможно, определяя тем самым судьбу больного. Аллокин-альфа способствует более быстрому стиханию тягостной клинической симптоматики и в определенной степени уменьшает степень лучевых реакций, значительно улучшая качество жизни. Выявленные предположительно радиопротекторные свойства Аллокина-альфа нуждаются в дополнительном исследовании по возможности деинтенсификации лучевых нагрузок.
Необходимы дальнейшие исследования, чтобы понять детальные механизмы взаимодействия между раковыми и иммунными клетками в условиях заражения организма ВПЧ. Лучшее понимание этих взаимодействий поможет разработать новые терапевтические стратегии для преодоления многочисленных барьеров при ВПЧ-опосредованной иммуносупрессии и синергизировать
их с современными исследовательскими терапевтическими средствами для лечения рака, связанного с ВПЧ.
Благодарность
Редакция благодарит компанию ООО «Аллоферон» за оказанную помощь в технической редактуре настоящей публикации.
Acknowledgement
Editorial Board is grateful to LLC “Alloferon” for the assistance in the technical edition of this publication.
Сведения об авторах:
Франциянц Елена Михайловна — д.б.н., профессор, заместитель генерального директора по науке, ФГБУ «НМИЦ онкологии» Минздрава России. 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63, ORCID iD 0000-0003-3618-6890.
Розенко Людмила Яковлевна — д.м.н., профессор, врач-радиотерапевт отделения радиотерапии, ФГБУ «НМИЦ онкологии» Минздрава России. 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63, ORCID iD 0000-0001-7032-8595.
Гусев Владимир Иванович — ведущий специалист по перспективным исследованиям, ООО «Аллоферон», 115162, Россия, г. Москва, ул. Шухова, д. 14, пом. 7, ORCID iD 0000-0001-5551-1287 .
Евсегнеева Ирина Владимировна — директор по развитию, ООО «Аллоферон», 115162, Россия, г. Москва,
ул. Шухова, д. 14, пом. 7, ORCID iD 0000-0001-5435-8938.
Беккер Герман Петрович — генеральный директор, ООО «Аллоферон», 115162, Россия, г. Москва, ул. Шухова, д. 14, пом. 7, ORCID iD 0000-0001-6302-450X.
Гусарева Марина Александровна — к.м.н., заведующая отделением радиотерапии, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63, ORCID iD 0000-0002-9426-9662.
Зыкова Татьяна Алексеевна — к.м.н., заведующая лабораторией вирусологии, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63, ORCID iD 0000-0001-5345-4872.
Донская Алия Катифовна — врач-радиотерапевт отделения радиотерапии, ФГБУ «НМИЦ онкологии» Минздрава России. 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63, ORCID iD 0000-0001-7353-2807.
Крохмаль Юлия Николаевна — к.м.н., врач-радиотерапевт отделения радиотерапии, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63, ORCID iD 0000-0002-3100-339X.
Кошелева Наталия Геннадьевна — врач-радиотерапевт отделения радиотерапии, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63, ORCID iD 0000-0001-7630-1502.
Солнцева Анна Анатольевна — к.м.н., врач-радиотерапевт отделения радиотерапии, ФГБУ «НМИЦ онкологии» Минздрава России. 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63, ORCID iD 0000-0003-4052-3597.
Контактная информация: Кошелева Наталия Геннадьевна, e-mail: natalya.doctorko@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов: Гусев В.И., Евсегнеева И.В., Беккер Г.П. являются сотрудниками компании ООО «Аллоферон». Статья поступила 11.07.2020, поступила после рецензирования 23.07.2020, принята в печать 28.07.2020.
About the authors:
Elena M. Frantsiyants — Doct. of Sci. (Biol.), Deputy General Director for Scientific Work, National Medical Research Center of Oncology, 63, 14th line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0003-3618-6890.
Lyudmila Ya. Rozenko — Doct. of Sci. (Med.), Professor, radiotherapist of the Department of Radiotherapy, National Medical Research Center of Oncology, 63, 14th line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0001-7032-8595.
Vladimir I. Gusev — leading specialist for prospective studies, LLC “Alloferon”, 14 Off. 7, Shukhov str., Moscow, 115162, Russian Federation, ORCID iD 0000-0001-5551-1287.
Irina V. Evstigneeva — Director for Development, LLC “Alloferon”, 14 Off. 7, Shukhov str., Moscow, 115162, Russian Federation, ORCID iD 0000-0001-5435-8938.
German P. Bekker — Director General, LLC “Alloferon”, 14 Off. 7, Shukhov str., Moscow, 115162, Russian Federation, ORCID iD 0000-0001-6302-450X.
Marina A. Gusareva — Cand. of Sci. (Med.), Head of the Department of Radiotherapy, National Medical Research Center of Oncology, 63, 14th line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0002-9426-9662.
Tat’yana A. Zykova — Cand. of Sci. (Med.), Head of the Laboratory of Virology, National Medical Research Center of Oncology, 63, 14th line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0001-5345-4872.
Aliya K. Donskaya — radiotherapist of the Department of Radiotherapy, National Medical Research Center of Oncology, 63, 14th line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0001-7353-2807.
Yuliya N. Krokhmal’ — Cand. of Sci. (Med.), radiotherapist of the Department of Radiotherapy, National Medical Research Center of Oncology, 63, 14th line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0002-3100-339X.
Nataliya G. Kosheleva — radiotherapist of the Department of Radiotherapy, National Medical Research Center of Oncology, 63, 14th line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0001-7630-1502.
Anna A. Solntseva — Cand. of Sci. (Med.), radiotherapist of the Department of Radiotherapy, National Medical Research Center of Oncology, 63, 14th line, Rostov-on-Don, 344037, Russian Federation, ORCID iD 0000-0003-4052-3597.
Contact information: Nataliya G. Kosheleva, e-mail: natalya.doctorko@yandex.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. Conflict of interests: Vladimir I. Gusev, Irina V. Evstigneeva, and German P. Bekker are staff members of LLC “Alloferon”. Received 11.07.2020, revised 23.07.2020, accepted 28.07.2020.












