Статистические аспекты, вопросы канцерогенеза и факторы прогноза
Ежегодно в мире регистрируются 600 тыс. новых больных раком толстой кишки (РТК), половина из них умирает [1].
Ежегодно в мире регистрируются 600 тыс. новых больных раком толстой кишки (РТК), половина из них умирает [1].Отмечается рост заболеваемости в большинстве стран. Заболеваемость РТК в России с 1990 по 2000 год возросла у мужчин при раке ободочной кишки на 18,7%, прямой – 16,2%, а у женщин прирост составил 18,9 и 6,6% соответственно.
В России ежегодно регистрируется более 40 тыс. новых случаев рака толстой кишки (за 2000 год 47530 – первичных больных, умерло 34341 пациентов) [2].
До 6% пациентов от общего числа заболевших имеют наследственную природу болезни. Наследственный РТК включает в себя семейный неполипозный РТК (синдром Линча), а также рак, возникший из наследственных аденоматозных и гамартомных полипов.
Более чем у 90% больных возникает спорадический рак толстой кишки. К самым большим достижениям фундаментальной науки следует отнести идентификацию генетических изменений при спорадическом раке толстой кишки, которая дала возможность приступить к разработке генной терапии этого заболевания.
Впервые модель канцерогенеза РТК была представлена в литературе в 1988 году [3,4]. Ген АРС (аденоматозного полипоза кишки) ответственен за развитие аденом у больных семейным полипозом. Мутация этого гена (потеря аллели в 5–й хромосоме) ведет к гиперпролиферации нормального эпителия. При наследственном РТК потеря аллели в 5–й хромосоме не наблюдается никогда, при спорадическом ненаследственном РТК она отмечается у 30–50% больных.
Образование ранних аденом – второй этап в развитии РТК – связывают с мутированным колоректальным раковым геном ММС (ген, участвующий в передаче сигнальной трансдукции) и метилированием ДНК [5]. Метилирование ДНК необходимо для регуляции экспрессии генов и важно для метаболизма цитозин нуклеотидов. Гипометилирование по современным представлениям дополняет клеточную генетическую нестабильность [6].
Переход ранних аденом в «промежуточные» обусловлен генами ras. Мутации К–ras и N–ras генов обнаруживаются у 45–50% больных РТК. При аденомах размером менее 1 см мутации гена встречаются у 10% больных, при размерах более 1 см – у 50%. Мутации приводят к расстройствам трансдукционных сигналов с клеточной мембраны в ядро клетки [7,8].
Потеря аллели в 18 хромосоме отмечается у 70% больных РТК и 50% больных с поздними аденомами. Потерянная аллель обычно содержит ген DCC (D от слова deleted – потерянный, СС – рак ободочной кишки). DCC – это супрессорный ген, ответственный за процессы клеточной адгезии. Снижение экспрессии гена DCC ведет к метастазированию [9,10]. При развитии РТК важную роль выполняет и ген Р–53. Мутации этого супрессорного гена, тормозящего клеточную прогрессию и трансформацию, приводят к потере контроля над процессом пролиферации [11,12].
Замещение или подавление мутированных генов ras, MMC, P–53 восстановление гена DCC и т.д. – являются вполне достижимыми целями будущего лечения больных РТК.
Возраст – основной фактор риска развития РТК у здорового человека. Так, заболеваемость РТК у 40–летних составляет 8 заболевших, у 60–летних – 150 на 100 тыс. населения.
Доказано, что риск возникновения РТК у лиц, не имеющих предрасполагающих обстоятельств, составляет 1–3%; если у родственников 1–го порядка был РТК, риск повышается до 5%, среди больных язвенным колитом риск развития РТК равен 15–30%; среди пациентов с болезнью Крона – 15%, с неполипозным наследственным колоректальным раком – 15–20%; наследственным семейным полипозом 30–100% [13]. Данные группы риска должны подвергаться обязательным профилактическим осмотрам, что в ряде случаев способствует раннему выявлению РТК. Американское раковое общество рекомендует лицам старше 50 лет пройти тестирование на скрытую кровь и раз в год подвергаться сигмоскопии.
Поскольку РТК часто возникает метахронно, больные, леченные хирургически по поводу РТК, также должны рассматриваться, как группа риска – на предмет возникновения второй опухоли в кишечнике. У 50% таких больных могут возникнуть новые полипы, и в 5% случаев они малигнизируются [14].
Наиболее известный маркер РТК – карциноэмбриональный антиген (СЕА) [15]. Диагностическое и прогностическое значение карциноэмбрионального антигена обсуждается с середины 80–х годов [16,17]. Карциноэмбриональный антиген отнюдь не обязательный маркер – у 40% больных РТК он не выявляется. Этот маркер нельзя назвать и специфическим, поскольку он обнаруживается и при других злокачественных опухолях (раке молочной железы, поджелудочной железы, легкого, яичников и даже саркомах), а также в эмбриональной ткани и незлокачественных заболеваниях (гепатотоксичность, гидронефроз, желчекаменная болезнь) [18].
Высокие цифры СЕА после операции являются признаком нерадикальности последней, возможного рецидива, короткой выживаемости. После радикальных хирургических операций систематическое определение СЕА позволяет выявить в 47% случаев рецидивы, в том числе и бессимптомные [19,20].
Американской гастроэнтерологической ассоциацией в 1989 году сформулирован консенсус по вопросам послеоперационного ведения больных РТК. Его порядок представлен в таблице 1 [21].

Маркер Са–19–9 имеет прогностическое значение при РТК. Если его уровень превышает 37 ед/мл, риск смерти в течение 3 лет после операции увеличивается в 4 раза по сравнению с теми, у кого этот показатель был отрицательным или более низким [22].
При РТК в 28% случаев экспрессируются цитокератинные антигены (СК 17 и 18). Больные, у которых обнаружена экспрессия этих антигенов, имеют наихудший прогноз выживаемости [23]. Вместе с тем цитокератинные антигены стали мишенью для моноклональных антител. В рандомизированном исследовании радикально оперированные пациенты получали раз в месяц адъювантно мышиные антитела против цитокератинного антигена 17 либо плацебо. Летальность сократилась на 30%, а частота рецидивов на 27% [24].
Муцинозные гликопротеины экспрессируют сиалозил –Тn антиген (Sialosyl–Tn). У 86% больных РТК определяется этот маркер. Те, у кого его нет, выжили 5 лет в 100% случаев, пятилетняя выживаемость больных с положительным сиалозил Тн маркером составила 73% [25].
Самой частой формой РТК является аденокарцинома тубулярной или ворсинчатой структуры – 95%. Другие варианты составляют всего 5% (это перстневидноклеточный рак, плоскоклеточный рак, аденоплоскоклеточный рак, мелкоклеточный рак и недифференцированный рак) [26].
Главным прогностическим фактором является стадия рака толстой кишки в момент первичной диагностики. К другим прогностическим факторам относят: возраст, пол, симптомность, наличие опухолевых осложнений, инвазию нервов и сосудов, число пораженных лимфоузлов, степень дифференцировки, высокие цифры ЛДГ и числа лейкоцитов в крови, плоидность ДНК, холецистэктомию в анамнезе, облучение таза в анамнезе. Остановимся на наиболее важных из них.
Чем моложе пациент, тем хуже прогноз [27]. У женщин прогноз лучше, чем у мужчин [28]. Наличие симптомов рака толстой кишки при постановке диагноза усугубляет прогноз. Бессимптомные больные (со случайной диагностикой) живут 5 лет в 71% случаев; больные, имевшие симптомы болезни до первичного диагноза, переживают пять лет в 49% случаев [29]. Наличие опухолевых осложнений (перфорации или непроходимости) ухудшает прогноз. Пятилетняя выживаемость в Дании среди имевших эти осложнения РТК (219 больных) составила 23%, а больных без этих осложнений (732 пациента) – 35% [30].
Опухоли толстой кишки получают потенциал метастазирования после прорастания подслизистого слоя кишечника, богатого лимфатическими сосудами [31]. Если опухоль не прорастает все слои кишечника, метастазы в лимфоузлы обнаруживаются лишь в 10%, если пенетрируется серозная оболочка – в 60% [32]. Если в лимфоузлах обнаруживается реактивная гиперплазия – это хороший прогностический признак [33].
При прорастании серозной оболочки, покрывающей частично прямую кишку и большую часть ободочной кишки, возможна диссеминация по брюшине [34].
Метастазы в печени обнаруживаются на секционном материале в 40% случаев, рак толстой кишки после метастазирования в печень может широко диссеминироваться по органам и тканям – легкие, кости и т.д. [35]. Ведение больных РТК представлено в таблице 1.
Лечение рака толстой кишки
Главным методом лечения РТК остается хирургическая операция. Ее принципы не изменились за много лет и состоят: в удалении опухоли с проксимальным и дистальным запасом неизмененной кишки для элиминации подслизистого лимфатического распространения клеток; удалении региональных брыжеечных лимфоузлов; визуальном интраоперационном стадировании болезни; стремлении минимизировать постхирургические функциональные нарушения.
По современным данным, резектабильность рака ободочной кишки составляет 70–80%, послеоперационная летальность до 5%. Общая пятилетняя выживаемость варьирует от 50 до 70% в разных центрах.
Результаты хирургических операций при раке ободочной кишки в первую очередь зависят от вовлеченности в опухолевый процесс лимфоузлов и стадийности по Dukes.
При негативных лимфоузлах и Dukes A 5 лет выживают 90%, когда нет метастазов в лимфоузлах, но когда опухоль прорастает мышцу (Dukes B), выживают этот срок 80%, при Dukes C этот показатель снижается до 60%.
Если во время операции были удалены пораженные раковой опухолью лимфоузлы, пятилетняя выживаемость различается в зависимости от степени инвазии опухолью стенки кишки – 74% (Dukes A), 48% (Dukes B) – 30% (Dukes C) [36].
Результаты хирургического лечения рака прямой кишки также зависят от вовлеченности лимфоузлов и классификации по Dukes. Считается, что выживают 5 лет 50% больных. Локальные рецидивы возникают у 10% (обычно в первые 2 года).
Особое место занимает хирургия диссеминированных больных. На первом месте стоит хирургическое лечение метастазов в печень. После удаления одиночных метастазов в печень, 5–летняя выживаемость составляет 25%. Перспективной технологией является коагуляционная гипертермия метастазов (Radiofrequency, RF). Чрескожно или интраоперационно в центр метастаза вводится электрод, связанный с радиочастотным генератором. Таким методом обычно лечат метастазы, не превышающие 1,5 см в диаметре [37,38].
В практику хирургии РТК вошли эндоскопические операции, сокращающие сроки пребывания пациентов в больнице, уменьшающие частоту некоторых осложнений. Вместе с тем метод ограниченно позволяет ориентироваться в брюшной полости (исключена возможность пальпации). Операции длительны даже в руках опытных хирургов, нередки случаи неадекватного удаления лимфоузлов [39].
Улучшить результаты хирургического лечения РТК возможно при использовании адъювантной терапии. На 141 больном В и С стадии колоректального рака проведено рандомизированое исследование, в котором сравнивалась пятилетняя выживаемость в контроле, в группе, где больные получали один фторурацил, и в группе, где применялся фторурацил + левамизол. 5 лет прожили в контроле 48% больных, в группе с фторурацилом – 56% и в группе с фторурацилом и левамизолом – 68% [40].
В исследовании, проведенном на 408 больных, было подтверждено, что комбинация левамизола и фторурацила уменьшает частоту рецидивов по сравнению с контролем. Выживаемость достоверно улучшилась лишь при стадии Dukes C [41].
Окончательное мнение среди онкологов по поводу ценности профилактического применения фторурацила и левамизола сложилось после публикации итогов межгруппового международного исследования (Moertel). В группе больных со стадией С летальность сократилась на 33%, а частота рецидивов на 41% по сравнению с контролем [42].
Итак, для адъювантной терапии рака ободочной кишки в стадии С (с вовлечением в опухолевый процесс регионарных лимфоузлов) следующий режим применения фторурацила и левамизола признается стандартным: левамизол 50 мг х 3 раза в день внутрь, 3 дня, каждые 4 недели; фторурацил 450 мг/м2 внутривенно 5 дней, затем с 28 дня один раз в неделю. Лечение проводится в течение года после операции [43].
Тем не менее эта комбинация уступает в популярности режиму фторурацил + кальция фолинат. В четырех крупных рандомизированных исследованиях (в Европе, США и Канаде) было доказано преимущество в выживаемости и безрецидивном течении применения фторурацила и кальций фолината. Разница с контролем по выживаемости составила от 5 до 14%, а по безрецидивному течению от 9 до 15%. Во всех исследованиях эта разница была достоверной [44,45,46,47].
Следующая комбинация признана стандартной для адъювантной терапии рака ободочной кишки в В и С стадиях:
– фторурацил 370–425 мг/м2 внутривенно 1–5 дни,
– кальций фолинат 300 мг/м2 внутривенно 1–5 дни.
Каждые 28 дней, 6 месяцев после операции.
В 1998 г. закончен анализ кооперированного международного сравнения эффективности адъювантной терапии РТК фторурацилом и кальция фолинатом и фторурацилом, кальция фолинатом и левамизолом. Последняя комбинация не улучшила выживаемость. От комбинации фторурацил + кальция фолинат выжило 66%, от комбинации фторурацил + кальция фолинат + левамизол – 67% [48].
В лечении рака прямой кишки, помимо химиотерапии, важная роль отводится лучевой терапии. Гастроинтестинальная исследовательская группа в США осуществила рандомизированное исследование на 277 послеоперационных больных раком прямой кишки в стадиях В и С. Больные были разделены на 4 группы: контроль, облучение таза (40 gy), фторурацил + семустин в течение 18 месяцев, облучение + фторурацил + семустин. После 10 лет наблюдений, статистически достоверной оказалась разница в результатах контроля и группы, где комбинировалось облучение и химиотерапия. Безрецидивное течение было соответственно в 45% и 65%, выживаемость 26% и 45% [49,50].
В исследованиях Северной онкологической группы США (NCCTG) были показаны преимущества комбинации послеоперационного облучения и химиотерапии по сравнению с одним облучением (45 gy). В исследование было включено 240 больных раком прямой кишки в стадиях В и С. Больные наблюдались 7 лет. Безрецидивное течение отмечалось в комбинированной группе в 63%, в чисто лучевой – в 42%, 5 лет прожили соответственно 58% и 47% [51].
Методические модификации применения фторурацила были осуществлены в Гастроинтестинальной исследовательской группе США. 210 больных ректальным раком В и С стадий были разделены на две группы после радикальной операции: 1) облучение (50–54 gy) + фторурацил 500 мг/м2 3 дня во время 1–й и 5–й недель облучения; 2) облучение (50–54 gy) + фторурацил на протяжении облучения 225 мг/м2 в сутки, инфузионно. После 46 месяцев наблюдения и безрецидивное течение, и выживаемость были на 10% выше в группе с продленной инфузией фторурацила, нежели в группе со струйным введением этого препарата (безрецидивное течение 63% и 53%, выживаемость 70% и 60%) [52]. Инфузия фторурацила вместе с послеоперационным облучением считается лучшим методом адъювантной терапии рака прямой кишки.
Крупное Японское контролируемое исследование более чем на 300 больных показало, что 4–х летняя выживаемость на 13% выше в группе, где больные после операции в течение 2 лет получали UFT по 400 мг в сутки, по сравнению с группой пациентов, подвергнутых только операции [53].
Среди еще незаконченных исследований в области адъювантной химиотерапии – сравнение в рамках разных методов введения фторурацила (длительные инфузии или струйные), сравнение эффективности разных сроков адъювантной терапии (начало сразу после операции или отсроченное), продолжительность адъювантной терапии.
В настоящее время идет исследование по сравнению режима De Gramont и этой комбинации + современный противоопухолевый агент из группы кампотоцинов. Исследование не завершено.
Среди новых программ адъювантной терапии при РТК – сравнение раптитрексида и комбинации фторурацил + кальций фолинат после операций по поводу РТК Dukes C стадия.
В США планируется большое кооперированное сравнение эффективности UFT + кальций фолинат и фторурацил + кальций фолинат.
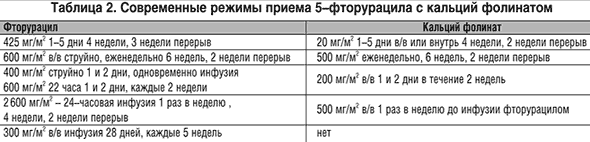
В рамках EORTC организовано сравнительное исследование адъювантной эффективности при опухолях со стадией Dukes C раптитрексида и фторурацила с кальций фолинатом. Современные режимы приема 5–фторурацила с кальций фолинатом представлены в таблице 2.
Идея послеоперационного облучения возникла в связи с довольно высокой констатацией локальных рецидивов до 30% при Т3N0 и 50% при Т3N1 [57]. Кооперированное исследование на большом числе больных выявило лишь уменьшение рецидивов от послеоперационного облучения (50 gy за 7 недель) в группе со стадией Dukes C; у больных со стадиями А и В рецидивы встречались одинаково в обеих группах, у 10% были постлучевые осложнения, на отдаленной выживаемости добавление лучевой терапии не сказалось. Лучше были лишь двухгодичные результаты: после облучения – 82%, в хирургической группе – 67% [58]. Подобные результаты получены и в других рандомизированных исследованиях [59].
Разумеется, лучевой метод является основным при неоперабельном местнораспространенном раке прямой кишки. Обычная доза 55 gy. У половины больных достигаются объективный (уменьшение опухоли) и симптоматический эффекты – уменьшение болей у 80% пациентов, прекращение кровотечения в 70%, тенезмов. 5 лет выживают лишь 5% таких больных. Однако, несомненно, улучшается качество жизни, и в небольшом числе случаев удавалось даже выполнить радикальные операции. При рецидивах рака прямой кишки можно помочь 15% больных, медиана их выживаемости < 2 лет.
Роль лучевой терапии ободочной кишки менее значительна, ее применяют при С2 и В стадиях по Dukes после операций для сокращения локальных рецидивов [60].
Многие годы основным препаратом для лечения РТК считался фторурацил. Хотя с момента синтеза FU прошло около 50 лет, этот препарат не потерял своего значения и в наши дни. Фторурацил способен вызвать объективное улучшение в среднем у 20% больных. Медиана продолжительности ремиссии – 4–5 месяцев, и на выживаемости пациентов этот эффект не сказывается [61,62].
Поскольку фторурацил довольно быстро элиминируется из крови при струйном введении, были разработаны методы инфузий этого препарата. Эффект при длительных инфузиях увеличился до 30%, а токсичноть уменьшилась (за исключением hand–foot синдрома, парестезии и эритродизестезии пальцев рук и ног) [63,64,65,66].
Введение кальций фолината повышает в среднем эффективность фторурацила при РТК до 30–40% [67]. Спорным является вопрос о режимах кальций фолината. Одинаковые результаты достигаются при дозах 20 мг/м2 5 дней подряд и 500 мг/м2 внутривенно еженедельно, при соответствующих дозах фторурацила 425 мг/м2 и 600 мг/м2. В рандомизированных исследованиях при ежедневном введении фторурацила и кальций фолината в малой дозе эффект был 35%, а медиана выживаемости –9,3 мес., при еженедельном назначении обоих препаратов соответственно 31% и 10,7 мес. [68]. Современные режимы FU с LV представлены в таблице 2 [69].
В терапии РТК иногда используются и другие модуляторы эффекта фторурацила: PALA, метотрексат, интерфероны.
В современной практике большое распространение получают оральные фторпирмидины.
Первым препаратом для лечения РТК был фторафур – продраг фторурацила. Эффект близок к FU – в диапазоне 20–25%.
Среди других препаратов, проявляющих интересную противоопухолевую активность при РТК, назовем UFT.
В режиме монотерапии UFT оказался эффективным при раке толстой кишки в 25%. Медиана выживаемости больных – 32 недели [70,71].
После констатации этого факта UFT изучался в Японии, США и межнациональных исследованиях в комбинации с кальций фолинатом. Объективный эффект зарегистрирован в диапазоне 25–42% (в среднем 38%) [72]. Чаще регрессируют метастазы рака толстой кишки в печень, хотя наблюдались эффекты и при метастазах в легкие и кости. Оба препарата вводились внутрь ежедневно в течение 28 дней. UFT по 300 мг/м2 в сутки, кальций фолинат по 150 мг. Суточная доза делилась на 3 приема – каждые 8 часов [73,74,75].
В Испанском исследовании специально оценили эффективность и переносимость UFT у больных раком толстой кишки в возрасте старше 72 лет. Больные получали UFT – 400 мг в сутки и кальций фолинат 45 мг в сутки до токсичности (3–4 степеней). 126 пациентов были включены в исследование (средний возраст 74 года). Рвота зарегистрирована у 14%, диарея – 9%, мукозит в 1 случае, тромбоцитопения у 1 больного; у 4 пациентов (5%) отмечен полный эффект, у 9 – частичный (11,6%), у 22 (28,6%) – длительная стабилизация, медиана выживаемости – 14,4 месяца [76].
Новой разработкой японских ученых является создание очередного модулятора фторурацила – S–1, состоящего из фторафура, урацила и оксолата калия, прерывающего метаболизм FU в нормальных клетках.
При оценке препарата на больных РТК (63 пациента) эффект отмечен в 35,5% (в 27,5% в печени и 39,3% в легких). Гематотоксичность 3 степени наблюдалась в 10% случаев [77].
Новый фторпиримидиновый карбамат – капецитабин, по существу, это продраг, который быстро всасывается из желудка и затем, после ряда промежуточных превращений, активируется в опухолях с помощью опухолевого ангиогенного фактора – тимидин фосфорилазы во фторурацил. Таким образом, основной особенностью действия капецитабина является избирательная активация его в опухоли. Что касается главной мишени, то это опять непрямое торможение тимидилат синтетазы [78].
При раке толстой кишки эффект достигается у 30% больных, усиливается от приема капецитабина с кальций фолинатом [79].
При сравнении САР с FU + LV отмечена большая эффективность первого препарата при равной токсичности и выживаемости [80].
Раптитрексид – прямой ингибитор тимидилат синтетазы также вошел в практику лечения РТК. Cunningham тщательно проанализировал результаты нескольких международных сравнений эффективности раптитрексида и комбинации фторурацил + кальций фолинат. При одинаковой эффективности особенно тяжелые для больных мукозиты, лейкопении и алопеции чаще регистрировались от фторурацила и кальций фолината. 87% больных с колоректальным раком отдали предпочтение раптитрексиду, нежели фторурацилу с кальций фолинатом [81].
Известно, что раптитрексид с фторурацилом обладает выраженным синергизмом. Причем важен порядок применения. При введении в начале фторурацила, а затем раптитрексида синергизм при воздействии на больных колоректальным раком не отмечается [82,83].
Наиболее интенсивно раптитрексид изучался на больных раком толстой кишки. Результаты сравнивались с эффектом фторурацила в комбинации с кальций фолинатом. По материалам 62 центров мира, эффекты от монотерапии раптитрексидом и комбинации фторурацил + кальций фолинат были одинаковыми (19,3% и 16,7%), медиана выживаемости диссеминированных больных в обеих группах была 10 месяцев [84].
В нашей клинике использовались высокие дозы фторурацила (в диапазоне 2000–2600 мг/м2 1 раз в неделю 24–х часовая инфузия, в течение 5 недель). Во вторую и пятую недели вводился Tom в дозе от 2,4 мг/м2. Режим был мало токсичен. Диарея и рвота отмечались у части больных не более чем II степени. Эффективность 48%, медиана выживаемости 13 месяцев.
Из группы камптотецинов при РТК наиболее изучен принотекам. Препарат является ингибитором ядерного энзима топоизомеразы I.
У нелеченных больных раком толстой кишки – эффект, в основном частичный, достигается в 20–32%. Обычно ремиссии продолжаются до 6 месяцев. Наблюдалась регрессия метастазов в легких и печени, а также первичной опухоли [85,86].
Эффект монотерапии принотекамом у леченных ранее больных фторурацилом также демонстрировался, он регистрируется менее чем в 20% случаев. Но описываются даже полные регрессии [87,88,90].
В мультицентровом рандомизированном исследовании на 279 больных, резистентных к фторурацилу, было показано преимущество лечения принотекамом в сравнении с чисто поддерживающей симптоматической терапией. Один год выжило 36,2% больных, получавших принотекам, и 13,8% пациентов, получавших лишь симптоматическую терапию. Вновь продемонстрирована целесообразность применения Cpt–11 в режиме по 250 мг/м2 1 раз в 2 недели при резистентном к фторурацилу РТК. Объективный эффект наблюдался в 13% случаев, медиана ответа – 8,1 месяца. Отмечено снижение карциноэмбрионального антигена более чем 60%. Медиана стабилизации роста опухоли равнялась 4,5 месяцев [91]. Комбинация принотекама и митомицина С была активна у 20% больных РТК, в том числе у 10% регистрировалась полная ремиссия [92].
Особое значение имеют два недавно законченных кооперированных исследования с дизайном FU + LV±Cpt–11. Saltz et al. на 437 больных ранее нелеченным метастатическим РТК показали:
– в группе получавших FU в дозе 425 мг/м2 + LV 20 мг/м2 (оба препарата в течение 5 дней) общий эффект был зарегистрирован в 21% случаев, время до прогрессирования – 4,3 месяца, медиана выживаемости составила 12,6 месяцев;
– в группе, где применялся дополнительно Cpt–11, эффект был 39% (на 18% больше), время до прогрессирования – 7 месяцев (на 62% больше) и медиана выживаемости составила 14,3 месяцев (на 17,5% больше).
Все указанные результаты статистически достоверны [93].
В исследовании Douillard FU применялся либо в режиме de Gramont (400 мг/м2 струйно, затем 600 мг/м2 в течение 22 часов + LV 200 мг/м2; оба препарата вводились 1 раз в 2 недели), либо FU в виде 24–часовых инфузий (по 2300 мг/м2 1 раз в неделю, 6 недель, а LV 200 мг/м2 1 раз в неделю, 6 недель).
Во 2–й группе больные получали один из вышеуказанных режимов FU + LV + Cpt–11 (либо 180 мг/м2 1 раз в две недели вместе с режимом de Gramont, либо по 80 мг/м2 1 раз в неделю вместе с 24–часовым инфузионным еженедельным введением FU (вместе с LV)).
Эффект непосредственный в 1–й группе – 22%, во 2–й – 35% (на 13% выше), время до прогрессирования соответственно 4,4 и 6,7 месяцев (на 52,2% дольше), медиана выживаемости 14,1 и 17,4 месяца (на 23,4% дольше) [94].
Комбинированный анализ этих двух исследований показал, что добавление принотекама к фторурацилу и кальций фолинату на 36% уменьшает риск прогрессирования и на 20% уменьшает риск смерти. Режим признан стандартом 1 линии терапии диссеминированного РТК в США и некоторых других странах [95].
Из новых препаратов, проявивших активность при РТК, отметим оксалиплатин (Оха). Он относится к 3–й генерации ненефротоксических производных платины. Эффект этого препарата в режиме монотерапии не превышал 10%. Однако замечен был синергический эффект с фторурацилом и кальций фолинатом. Он зафиксирован в 46% случаев, а при соблюдении хронобиологических принципов подходит даже к 58%, при медиане выживания в 15 месяцев. Этот FolFox режим (цикл состоит из 2–х дней лечения) выглядит следующим образом: день первый – кальций фолинат 500 мг/м2 внутривенно в 2 часа ночи, оксалиплатин 100 мг/м2 внутривенно тоже в 2 часа ночи, инфузия фторурацила в дозе 1500–2000 мг/м2 длилась 24 часа; день второй – кальций фолинат 500 мг/м2 внутривенно в 2 часа ночи, инфузия фторурацила длилась 24 часа и во вторые сутки в дозе 1,5–2,0 г/м2. Повторный цикл терапии осуществлялся через 2 недели [96,97,98].
Режим Оха 60 мг/м2 в 1 день с 24–часовой инфузией фторурацила по 2,6 г/м2 1 раз в неделю в течение 4 недель и кальций фолината 500 мг/м2 в дни введения FU, а затем повтор через 2 недели был использован в качестве 2–й линии терапии у больных после прогрессирования на режиме монотерапии фторурацилом. Эффект и стабилизация наблюдались у 78% больных. Токсичность была не выражена, диарея и мукозиты у 11% [99].
Комбинация Оха + Cpt–11 считается также одной из самых активных. Описаны эффекты у больных, получавших этот режим, в 43–45% случаев с медианой выживаемости в 16 месяцев [100].
У резистентных к FU больных РТК от комбинации принотекам + Оха удается добиться противоопухолевого ответа в 34% [101].
В последние годы взор онкологов все чаще обращается к фундаментальной науке. Успехи последней в молекулярной биологии, генетике и генной инженерии позволили синтезировать и предоставить в распоряжение клиницистов оружие будущего – препараты целевой терапии.
Есть единичные работы, показывающие возможность увеличения продолжительности жизни больных с распространенным РТК после применения МАВ–17–1А (12 месяцев у получавших этот препарат и лишь 4 месяца в контроле) [102].
Среди новых разработок, предназначенных для лечения РТК на основе идентификации молекулярных мишеней – ингибиторы мутированного супрессорного гена Р–53, васкулярного эндотелиального фактора роста (VEGT), основного фибробластного фактора роста (GFGF), рецепторов эпидермального фактора роста, циклинзависимых киназ, матрикс металлопротеиназ и др. [103].
Заключение
Рак толстой кишки – актуальная проблема из–за высокой заболеваемости и значительной смертности больных. С лечением этой формы рака связаны огромные экономические потери.
Для устранения проблемы необходимо решить ряд социальных задач. Прежде всего это пропаганда здорового образа жизни и правильного питания, а также широкое внедрение в практику скрининга на рак толстой кишки в группах риска и соответственно ранняя диагностика рака.
К лечению заболевших людей необходимо подходить комплексно. Основным методом является хирургический. В последнее десятилетие резектабильность РТК составляет 70–80%, послеоперационная летальность сократилась до 5%. Пятилетние результаты в большинстве стран в диапазоне 50–60%. При ранних стадиях следует шире использовать метод эндоскопического удаления опухолей, позволяющий уменьшить сроки пребывания пациента в стационаре и избежать некоторых послеоперационных осложнений. В хирургии рака прямой кишки использовать сфинктеросохраняющие операции, даже при опухолях нижней трети. При лечении метастазов в печень целесообразно сочетать лекарственное воздействие и операцию.
Все больные с 2«в» и 3 стадией должны получать адъювантную терапию. Стандартными режимами для адъювантной терапии рака ободочной кишки признаны комбинация фторурацила и кальций фолината, при этом достигается улучшение отдаленных результатов на 15–20% по сравнению с контролем. Современное адъювантное лечение рака прямой кишки осуществляется на базе фторурацила и кальций фолината с послеоперационным облучением.
Лучевая терапия включена в стандарт лечения рака прямой кишки для уменьшения стадийности предоперационно, для сокращения частоты локальных рецидивов послеоперационно и как основной метод лечения неоперабельного местнораспространенного рака прямой кишки.
В первую линию терапии диссеминированного рака толстой кишки, базирующуюся на фторурациле и модуляции его эффекта кальций фолинатом, прочно вошли новые препараты принотекам и оксалиплатин. Не обладая перекрестной резистентностью, эти комбинации позволили значительно увеличить медиану продолжительности жизни больных и улучшить ее качество.
Такие пероральные препараты, как фторафур, UFT, капецетабин создали дополнительные возможности для более длительной циркуляции фторурацила в крови и опухолевых клетках.
Генетическая модель канцерогенеза в толстой кишке, составленная после идентификации генетических изменений, открывает конкретные мишени для генной терапии и профилактики рака толстой кишки.
Идет активный поиск решения проблемы лечения рака толстой кишки фундаментальной и клинической онкологией.
1. Mortality Database 1994–1997, WHO, 1999
2. Давыдов М.Н., Аксель Е.Н. «Статистика злокачественных новообразований в России и странах СНГ (состояние онкологической помощи, заболеваемость и смертность)».М., 2002
3. Vogelstein B., Fearon E.R., Hamilton S.R., et.al. «Genetic alterations during colorectal tumor development». N.Engl.j.Med. 1988; 319–525.
4. Fearon E.R., Vogelstein B. «A genetic model for colorectal tumorigenesis».Cell 1990; 6:759–767.
5. Kinzler K., Nibert M., Vogelstein B., et.al. «Identification of gene located chromosome 5q 21 that is mutated in colorectal cancers».Science 1991; 251:1366–1370.
6. Goelz S.E., Vogelstein B., Hamilton S.R., et.al. «Hypomethylation of DNA from benign and malignant human colon neoplasms». Science 1985; 228:187–190.
7. Bos J.L.»Ras oncogenes in human cancer: A review». Canc. Res. 1989; 49:4682–4689.
8. Fearon E.R., Hamilton S.R., Vogelstein B. «Clonal analysis of human colorectal tumors».Science 1987; 238:193–197
9. Fearon E.R., Cho K.R., Nigro J.M., et.al. «Indentification of a chromosome 18q gene which is altered in colorectal cancer».Science 1990; 247:49–56.
10. Zetter B.R. «Adhesion molecules in tumor metastasis». Sem.Canc.Biol.1993; 4:219–229.
11. Yamaguchi A., Kurosaka Y., Fushida S., et.al. «Expression of p53 protein in colorectal cancer and its relationship to short–term prognosis» Canc.1992; 70:2778–2784.
12. Scott N., Sagar P.,Stewart J., et.al. «P–53 in colorectal cancer: clinicopathological correlation and prognostic significance». Br.j.Canc. 1991; 63:317–319.
13. Lynch H.T., Smyrk T.,, Watson P. Et.al. «Hereditary colorectal cancer».Sem.Oncol.1991; 18:337–366.
14. Steele G. «Follow–up plans after «curative» resection of primary colon or rectum cancer». In «Colorectal cancer». Eds.Steele G. And Osteen R.T. NY 1986; 247–279. Lancet 1990; 336:357.
15. Gold P., Freedman S.O. «Specific carcinoembryonic antigens of the human digestive system». J.Exp.Med.1965; 122:467–481.
16. Bates S.E., Longo D.L. «Use of serum tumor markers in cancer diagnosis and management». Sem.in Oncol.1987; 14:102.
17. Northover J. «Carcinoembryonic antigen and recurrent colorectal cancer». Gut. 1986; 27:117–122.
18. Clarke C., Nine K.R., Dykes P.W., et.al. «Carcinoembryonic antigen and smoking». J.Royal Coll.Phys.Lond 1980; 14:227–230.
19. Rocklin M.S., Slomski C.A., Watne A.L. «Postoperative surveillance of patients with carcinoma of the colon and rectum». Am.Surg. 1990, 56:22.
20. Audisio R.A., Setti Carraro P., Segala M., et.al. «Follow–up in colorectal cancer patients: a cost–benefit analysis». Ann Surg.Oncol. 1996; 3:349.
21. Fleischer D.E., Coldberg S.B., Browning T.H., et.al. «Detection and surveillance of colorectal cancer». JAMA 1989; 261:580.
22. Diez M., Cerdan F.J., Pollan M., et.al. «Prognostic significance of pre–operative serum CA–19–9 assay in patients with colorectal carcinoma».Anticanc.Res. 1994; 14:2819–2825.
23. Lindenmann F., Achlimok G., Dirschedl P., et.al. «Prognostic significance of micrometastatic tumour cells in bone marrow of colorectal cancer patients». Lancet 1992; 340:685–689.
24. Riethmuller G., Schneider–Gadicke E., Schlimok G. «Randomized trial of monoclonal antibody for adjuvant therapy of resected Dukes’C colorectal carcinoma». Lancet 1994; 343:1177–1183.
25. Itzkowitz S.H., Yuan M., Montgomery C.K., et.al. «Expression of Tn, Sialosyl–Tn and T antigens in human colon cancer». Canc.Res. 1989; 49:197–204.
26. Jass J., Sobin L. «WHO histological typing of intestinal tumors».1989, Geneva.
27. Regio B., Bussey H.J.R. «The pathology and prognosis of carcinoma of the rectum in the young». Proc.R.Soc.Lond. 1965; 58:789–790.
28. Koch M., McPherson T.A., Egedahl R.D. «Effect of sex and reproductive history on the survival of patients with colorectal cancer». J.Chronic. Dis. 1982; 35:69–72.
29. Beahrs O.H., Sanfelippo I.M. «Factors in the prognosis of colon and rectal cancer». Canc. 1971; 28:213–217.
30. Bulow S. «Colorectal cancer in patients less than 40 years of age in Denmark 1943–1967». Dis.Col.Rect. 1980; 23:327–336.
31. Fenoglio C., et.al. «Distribution of human colonic lymphatics in normal, hyperplastic and adenomatous tissues». Gastroenter. 1973; 64:51–66.
32. Morson B., Dawson J. «Gastrointestinal pathology». Oxford 1979.
33. Talbot J., et.al. «Invasion of veins by carcinoma of the rectum: method of detection, histological features and significance». Histopath. 1981; 5:141–163.
34. Newland R., et.al. «The prognostic value of substaging colorectal carcinoma:a prospective study of 1117 cases with standardized pathology». Canc.1987; 60:852–857.
35. Weiss L., et.al. «Heamatogenous metastatic patterns in colonic carcinoma: an analysis of 1541 necropsies». J.Path. 1986; 150:195–203.
36. Cohen A.M., Shank B., Friedman M.A. Colorectal cancer. In «Cancer Principle a Practice of oncology». Eds. DeVita V.S., et.al. 1989; pp.895–964.
37. Solbiati L., Lerace T., Goldberg S.N., et.al. «Percutaneous US–guided radio–frequency tissue ablation in the treatment of liver metastases». Radiol. 1997, 202:205–210
38. Rossi S., Di Stasi M., Buscarini E., et.al. «Percutaneous RT intersticial thermal ablation in the treatment of hepatic cancer». Am.j.Roentgenol. 1997, 122:759–768.
39. Pazdur R., Coia L., Wagman L.D., Ayoub J.P. «Colorectal and anal cancer». In «Cancer Management: A multidisciplinary approach». Eds. Pazdur R., et.al., 1998; pp.65–93.
40. Windle R., Bell R.E., Shaw D. «Five year results of a randomized trial of adjuvant 5–fluorouracil in colorectal cancer». Br.j.Surg. 1987; 74:569–572.
41. Laurie J.A., Moertel C.G., Fleming T.R., et.al. «Surgical adjuvant therapy of large bowel carcinoma. An evaluation of levamisole and the combination of levamisol and fluorouracil». J.Clin.Oncol. 1989; 7:1447–1456.
42. Moertel C., Fleming T., MacDonald J., et.al. «Fluorouracil plus levamisole as effective adjuvant therapy after resection of stage II colon carcinoma: A final report». Ann Int.Med. 1995; 122:321–326.
43. National Institutes of Health Consensus Conference Adjuvant Therapy for patients with colon and rectal cancer. JAMA 1990; 264:1444–1450.
44. Wolmark N., Rockette H., Fisher B., et.al. «The benefit of leucovorin–modulated fluorouracil as postoperative adjuvant therapy for primary colon cancer: Results from National Surgical Adjuvant Breast and Bowel Project protocol C–03». J.Clin.Oncol. 1993; 11:1979–1987.
45. Erlichman C., Marsoni S., Seitz J., et.al. «Event free and overall survival is increased by FUFA in resected B and C colon cancer: A prospective pooled analysis of 3 randomized trials». Proc.ASCO, 1994; ab.562.
46. O’Connell M., Mailbard J., MacDonald J., et.al. «An intergroup trial of intensive course 5–FU and low dose leucovorin as surgical adjuvant therapy for high risk colon cancer». Proc.ASCO, 1993; ab.522.
47. Trancini G., Petrioli R., Lorenzini L., et.al. «Folinic acid and 5–fluorouracil as adjuvant chemotherapy in colon ca












