Ключевые слова: первичный рак печени, хирургическое лечение, резекция НПВ, артериолизация портальной вены.
Хирургическое лечение остается единственным методом лечения больных первичным раком печени, дающим шанс на значительное продление жизни. Пятилетняя выживаемость больных, подвергшихся хирургическому лечению при гепатоцеллюлярном раке, составляет 40% [1–9]. Наличие цирроза печени значительно ограничивает возможность хирургического вмешательства и ухудшает прогноз [29,30]. Вплоть до 30–40–х годов прошлого века операции на печени считались большой редкостью. Анатомические особенности этого органа, связанные главным образом с богатой его васкуляризацией, являлись главной причиной негативного отношения к попыткам хирургического лечения болезней печени [25–27].
Способы коагуляции,
типичные резекции
В настоящее время имеет место тенденция к увеличению объема хирургического вмешательства при резекциях печени, которое возможно при использовании новейших достижений хирургии. Кроме того, обширная резекция печени на сегодняшний день – основной метод, позволяющий добиться заметного продления жизни, а в ряде случаев и радикального излечения больных с новообразованиями печени, раком проксимальных отделов внепеченочных желчных протоков. В то же время обширные резекции печени продолжают оставаться операциями высокого риска, который обусловлен опасностью как возникновения массивных интраоперационных кровотечений, так и развития тяжелых форм послеоперационной печеночной недостаточности [13,14,25,26].
За последние годы кровопотеря при таких операциях значительно снизилась, но все же остается существенной и, по данным большинства авторов, превышает 2 л [24–26, 28].
Каждая обширная резекция печени должна выполняться с использованием следующего комплекса основополагающих технических принципов [25–27,30]:
• рациональный хирургический доступ, каким является двухподреберный с вертикальным расширением и иссечением мечевидного отростка;
• использование механических ретракторов реберных дуг для обеспечения адекватной экспозиции операционного поля;
• широкая мобилизация печени;
• прецизионный принцип разделения паренхимы печени с использованием кавитационного ультразвукового хирургического аспиратора или гармонического скальпеля;
• применение интраоперационного ультразвукового исследования для контроля за расположением магистральных сосудистых структур печени;
• использование клипаторов для ускорения процесса разделения паренхимы;
• применение аргонового коагулятора, клеевых композиций для обеспечения полноценного паренхиматозного гемостаза;
• использование аппаратов «Cell Saver» при высоком риске кровопотери;
• применение водоструйной хирургии.
Водоструйная хирургия, успешно применяемая уже в течение ряда лет в качестве нового метода анатомического рассечения тканей, основана на возможности дозировки давления водной струи, что позволяет осуществлять разделение тканевых слоев различной эластичности и прочности. При этом отдельные клетки бережно выделяются из тканевой структуры за счет кинетической энергии водной струи. В хирургии печени, например, энергия водной струи используется для селективного разделения паренхимы печени и более плотных кровеносных сосудов и желчных протоков. Более мягкая паренхима печени вымывается, в то время как сетка сосудов остается сохраненной, что позволяет обработать их без сколько–нибудь значительного кровотечения. При выполнении резекции печени с помощью аппарата ERBEJET 2 кровеносные сосуды и желчные протоки отделяют от вымываемой паренхимы, а затем (в зависимости от их величины) коагулируют, клипируют или перекрывают наложением лигатуры. Продолжительность вмешательства по сравнению с другими хирургическими методами значительно меньше и может быть еще более сокращена за счет сочетанного воздействия апплицируемой водной струи и ВЧ–тока. Существенно уменьшаются также интраоперативные кровопотери, что снижает потребность в переливании крови. Пережимание сосудов для прекращения подачи крови к органу (маневр Прингла) обычно не требуется.
Другие преимущества:
• неповрежденные, ровные края зоны диссекции,
• возможность применения методов хирургии открытых полостей и лапароскопии.
Техника выполнения резекции печени. Для проведения резекции левой доли больного укладывают на спину. Доступ в брюшную полость осуществляется правосторонней парамедиальной лапаротомией. В случае необходимости разрез в правом VI межреберье может быть продолжен в форме клюшки и на правую сторону грудной стенки.
Для резекции правой доли печени больного немного поворачивают влево. Доступ в брюшную полость осуществляется правосторонней верхней трансректальной или широкой правосторонней паракостальной лапаротомией. Разрез продолжается и на реберную дугу, в VIII или IX межреберье выполняется торакотомия, немного рассекается и диафрагма. Брюшной и грудной разрезы образуют в целом Т– или Y–образную форму.
Далее в брюшной полости мобилизуют подлежащую резекции долю, отсекая фиксирующие ее связки. Для освобождения левой доли следует перерезать круглую, серповидную, треугольную левую венечную связки печени до нижней полой вены (НПВ), а также печеночно–желудочную связку [16]. Освобождение правой доли печени значительно сложнее. Большая доля вращается влево и к середине. Отсекается правая треугольная связка печени, и в ходе вращения к середине печень отделяется от диафрагмы, до полой вены. Нужно следить за тем, чтобы в ходе этого не повредить правый надпочечник и его сосуды, а также нижнюю полую вену, в которую независимо от крупной печеночной вены вливается 6–8 коротких парных вен (диаметр их достигает 2–4 мм) [17,26,27].
Между «восточной» и «западной» школами существует коренное расхождение в отношении метода проведения собственно резекции.
Резекция печени по «западному» методу. Новейшую хирургическую технику, основывающуюся на современной концепции анатомического строения печени, разработали во Франции Lortat–Jacob, в США Ochsner, Beattie и многие другие хирурги. Суть метода состоит в анатомическом препарировании и в экстрапеченочной перевязке билио–васкулярных образований. Этот метод отвечает принципу, действующему во всех отделах хирургии: перед резекцией органа его нужно скелетировать, анатомически отпрепаровывать подходящие к нему сосуды, дважды перевязать их и после этого пересечь.
«Восточный» метод резекции печени. Ton That Tung (Вьетнам) описывает, что видел в крупной западной клинике резекцию печени, которая продолжалась 9 часов, и видел резекцию, при которой больному в ходе операции перелили 14 литров крови. Им в 1961 году был описан метод, основанный на пережатии гепатодуоденальной связки и внутрипаренхимной диссекции. Этот метод с большими или меньшими изменениями был принят всеми восточными хирургами. По описанию Ton That Tung, правая лобэктомия длится 6 минут, что кажется невероятным, но все же соответствует факту. Во всяком случае, этим хирургом по такому методу проведено множество резекций печени с отличными результатами. Кстати, в ходе каждой операции требовалось перелить всего 800–1000 мл крови.
Преимуществом внутрипаренхимной диссекции является то, что с ее помощью может быть выполнена любая типичная и атипичная резекция печени, при этом жертвовать здоровыми печеночными тканями не приходится. Это очень быстрая и менее шокогенная операция, чем классическая анатомическая резекция. При ее проведении крови требуется не больше, чем при любой обширной операции в брюшной полости.
Ворота печени в течение 10 минут могут быть пережаты безо всякой опасности осложнений [10,18]. Lortat–Jacob и другие хирурги предпринимали попытки охладить печень местным применением солевого раствора температурой 0°С, что при пережатии ворот быстро удается сделать и обеспечивает гипотермическое исключение кровообращения примерно на 30 минут. Однако этот метод сложен и признан излишним, поэтому в настоящее время гипотермию не применяют.
Более редкие формы резекции
печени
Кроме двух описанных методик выполнения резекции печени, существует еще несколько более редких вариантов. Так, венгерский хирург Drobni обновил старый метод «гильотинной» резекции. Часть печени, намеченную для удаления (обычно это латеральные сегменты левой доли), отсекают сконструированным Drobni плексиножом. «Нож» размером с ладонь накладывается на поверхность среза; через плексипластинку хорошо видны перерезанные сосуды и желчные пути, которые, постепенно сдвигая с них нож, прошивают. Для гемостаза могут успешно применяться пуговицы из фибрина, полученного из крови человека, изготовленные Оеrendas и получившие название «Биопласт»; их подкладывают под П–образные швы, захватывающие всю толщу среза, чтобы они не прорезались.
При этом методе никакой препаровки в воротах печени не требуется. Другие хирурги ввели в хирургию печени современные средства сердечно–сосудистой хирургии для снижения опасности резекции печени. Была попытка подключить к больному АИК, но этот метод не оправдал себя. Этот метод делает операцию более надежной, но в то же время значительно усложняет ее. При этом методе в нижнюю полую вену вводится толстая синтетическая трубка, и вена с помощью турникетов надевается на эту трубку над и под печенью. Если сдавливаются и ворота печени, то в результате этого эндолюминального байпасса печень совершенно обескровливается, в нее не поступает ни капли крови ни со стороны первичных, ни со стороны вторичных ворот. Кровь НПВ вместе с кровью почечных вен попадает в правое предсердие. Недостатком метода является то, что из–за введения пластмассовой трубки больного приходится гепаринизировать, что значительно повышает риск кровотечения в постоперационном периоде [19,20].
С целью снижения риска массивной кровопотери широко используется сосудистая реконструкция при массивных резекциях печени, выполняемых как по поводу опухолей печени и опухолей билиопанкреатодуоденальной зоны, так и при трансплантации печени. Резекция печени с сосудистой пластикой обеспечивает необходимую радикальность хирургического вмешательства, лучшую выживаемость и более благоприятное течение послеоперационного периода в сравнении с различными видами резекций печени, выполняемых без сосудистой пластики [11,12,15].
Одним из ярких примеров подобного вмешательства может служить артериолизация портальной вены при левосторонней трисегментэктомии, выполненной по поводу протоковой холангиокарциномы, требующей обширного хирургического вмешательства для достижения необходимой радикальности операции (R0). Есть неопровержимые доказательства того, что резекция R0 дает большую выживаемость [P. Neuhaus, S. Jonas and W.O. Bechstein et al., Extended resections for hilar cholangiocarcinoma, Ann Surg 230 (1999), pp. 808–819]. Обширные резекции позволяют улучшить онкологическую чистоту операций, выполнение которых становится возможным с внедрением в практику современных достижений хирургии, пред– и послеоперационного ухода, позволяющих уменьшить смертность и летальность после больших операций. Недавние исследования показали, что резекция портальной вены с реконструкцией может увеличить шансы на выживание при запущенной протоковой холангиокарциноме, которая раньше считалась неизлечимой. Данная методика применяется в тех случаях, когда необходима резекция портальной вены и печеночной артерии для выполнения радикальных онкологической операций. Применяется зачастую в случаях, признанных неоперабельными.
• Оксигенированная кровь улучшает метаболизм печени в ответ на острую портальную гипертензию, что приводит к ускоренной регенерации гепатоцитов.
• Даже при резекции R1 улучшаются качество и длительность жизни у оперированных по этой методике пациентов по сравнению с неоперированными пациентами.
• Использование артериолизации портальной вены при массивных резекциях печени, хотя и не проходит без риска, в конечном итоге призвано обезопасить пациентов в раннем послеоперационном периоде, повысить число пациентов, качество жизни которых после лечения улучшилось.
Схематичное изображение методики представлено на рисунке 1.
В 2008 году опыт подобных оперативных вмешательств исчерпывался 10 операциями, причем описываемая методика применялась для спасения жизни пациентов. Учитывая полученные хорошие отдаленные результаты, она может быть использована при выполнении обширных резекций печени. Следует отметить, что венозный шунт закрывался самостоятельно, примерно через месяц после выполнения вмешательства, а послеоперационный период сопровождался длительной билирубинемией, значительно не сказывающейся на состоянии пациентов [Alastair L. Young. Etal., Portal Vein Arterialization as a Salvage Procedure During Left Hepatic Trisectionectomy for Hilar Cholangiocarcinoma Journal of the American College of Surgeons, Volume 207, Issue 5, November 2008, Pages e1–e6].
Однако существуют и другие взгляды на артериолизацию портальной вены. В своем эксперименте на крысах K. Schleimer, D.L. Stippel,. et al. наглядно показывает, что длительная артериолизация печени приводит к апоптозу печеночной ткани, длительному восстановлению печеночной ткани и, соответственно, массы тела [Karina Schleimer, Portal Vein Arterialization Increases Hepatocellular Apoptosis and Inhibits Liver; RegenerationJournal of Surgical Research 149, 250–258 (2008)], но следует отметить, что артериовенозный шунт у животных в эксперименте функционировал постоянно в течение 6 недель (в то время как артериовенозный шунт у оперированных пациентов закрывается самостоятельно в течение месяца). Кроме того, существует точка зрения, что инвазивный рост опухолевой ткани стимулирует недостаток кислорода, и, следовательно, при артериолизации портальной вены парциальное давление кислорода в печеночной ткани повысится, что замедлит инвазивный рост опухолевой ткани, причем последующее проведение лучевой терапии будет приносить лучший эффект [Julien Reyal, www.elsevier.com/ locate/mehy].
Следующую методику, достойную внимания, можно обозначить, как изолированное тотальное сжатие НПВ с частичным сохранением кровотока, которое используется при комбинированных резекциях печени и НПВ (рис. 2).
Преимущества методики:
• При использовании данной методики возможно выполнение оперативного вмешательство посредством абдоминального и торакоабдоминального доступа. Торакоабдоминальный доступ целесообразен при опухолях большого размера.
• При использовании данной методики интраоперационно ни у одного пациента не было выявлено тяжелой гипотензии.
• Медиана интенсивного курса лечения составила 7 дней (от 3 до 10) и среднее время пребывания в клинике составило 23 дня (7–27).
• Данная методика позволяет добиться онкологической «чистоты» краев резекции
При данной методике пережатия НПВ минимальны гемодинамические и функциональные печеночные нарушения – в отличие от длительного тотального пережатия НПВ. Техника выполнения особенно полезна в тех случаях, когда в опухолевый процесс вовлечена НПВ и гепатокавальный конфлюэнс, однако эта методика не может быть использована при поражении всех трех гепатокавальных конфлюэнсов. Применяемый метод целесообразен при иссечении огромных опухолей, растущих рядом с НПВ. Пластика резецированной НПВ происходит посредством замещения удаленной части НПВ протезом [Deepak Varma et al., Isolated total caval clamping with «preserved remnant liver perfusion» for combined hepatic and venacaval resection in tumors involving venacava Surgery, Volume 141, Issue 1, january 2007, pages 112–116].
При использовании данной методики значительно снижается кровопотеря, длительность тотального пережатия НПВ, что оказывает существенное положительное влияние на течение послеоперационного периода и реабилитацию больных, перенесших обширное хирургическое вмешательство в объеме расширенной правосторонней гемигепатэктомии [20–23].
При обширных резекциях печени используются различные венозные протезы для обеспечения венозного оттока от остающейся части печени:
• левая печеночная вена,
• правая печеночная вена,
• средняя печеночная вена,
• реканализированная пупочная вена,
• другие: подкожная, нижняя брыжеечная, яичниковая.
Венозные протезы чаще используются для обеспечения венозного оттока из оставшейся части печени. Следует отметить, что в большинестве случаев венозные протезы функционируют в течение некоторого времени (до 1–2 месяцев после операции), позднее венозный отток из печени происходит по формирующимся коллатералям.
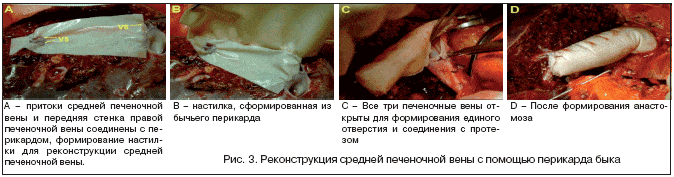
Следующая методика – формирование средней печеночной вены из бесклеточного перикарда быка показывает возможность длительного функционирования венозного протеза (рис. 3). Впервые операция была выполнена в Корее. Примение методики оправдано за счет дешевых материалов, широкого и длительно функционирующего анастомоза, относительной простоты формирования венозных анастомозов.
КТ в послеоперационном периоде показало нормальную функциональность анастомоза, а разница давления в протезе и НПВ составила 1–2 мм рт. ст. Разрывов, инфекции и кальцификации не было. У всех трех пациентов, которым было проведено вышеуказанное оперативное вмешательство, сохранялась нормальная печеночная функция на протяжении 3–6 мес; данные наблюдения за 3–6 мес, поздние наблюдения не публиковались [Bong–Wan Kim et al., Middle hepatic vein reconstruction of right liver graft using the glutaraldehyde–treated acellular bovine pericardium Surgery, Volume 141, Issue 6, june 2007, pages 832–834].
Таким образом, использование современных методик сосудистой пластики позволяет выполнять обширные резекции печени, выполнение которых до использования вышеописанных методик было сопряжено с огромным риском для пациента. Применение описанных способов сосудистой пластики уменьшает частоту послеоперационных осложнений, обеспечивает более гладкое и менее тяжелое течение послеоперационного периода при расширенных операциях на печени, требующих выполнения при массивном распространении опухолевого процесса.


Литература
1. Beazley R.M., Hadjis N., Benjamin I.S. and Blumgart L.H., Clinicopathological aspects of high bile duct cancer: Experience with resection and surgical bypass treatments, Ann Surg 199 (1984), pp. 623–636.
2. Hemming A.W., Reed A.I. and Fujita S. et al., Surgical management of hilar cholangiocarcinoma, Ann Surg 241 (2005), pp. 693–699.
3. Neuhaus P., Jonas S. and Bechstein W.O. et al., Extended resections for hilar cholangiocarcinoma, Ann Surg 230 (1999), pp. 808–819.
4. Witzigmann H., Berr F. and Ringel U. et al., Surgical and palliative management in 184 patients with hilar cholangiocarcinoma, Ann Surg 244 (2006), pp. 230–239.
5. Baton O., Azoulay D. and Delvart V. et al., Major hepatectomy for hilar cholangiocarcinoma type 3 and 4: prognostic factors and long term outcomes, J Am Coll Surg 204 (2007), pp. 250–260.
6. Liu C.L., Fan S.T. and Lo C.M. et al., Improved operative and survival outcomes for surgical treatment of hilar cholangiocarcinoma, Br J Surg 93 (2006), pp. 1488–1494.
7. Kondo S., Hirano S. and Ambo Y. et al., Forty consecutive resections of hilar cholangiocarcinoma with no postoperative mortality and no positive ductal margins: results of a prospective study, Ann Surg 240 (2004), pp. 95–101.
8. W.R. Jarnagin, Fong Y. and DeMatteo R.P. et al., Staging, resectability, and outcome in 225 patients with hilar cholangiocarcinoma, Ann Surg 234 (2001), pp. 507–517.
9. Woo S.M., Ryu J.K. and Lee S.H. et al., Recurrence and prognostic factors of ampullary carcinoma after radical resection: comparison with distal extrahepatic cholangiocarcinoma, Ann Surg Oncol 14 (2007), pp. 3195–3201.
10. Breny T., Mentha G. and Morel P., Total vascular exclusion of the liver for resection of lesions in contact with the cava or hepatic veins, Br J Surg 85 (1998), pp. 485–488.
11. Hemming A.W., Reed A.I. and Langham M.R. et al., Combined resection of the liver and inferior venacava for hepatic malignancy, Ann Surg 239 (2004), pp. 712–721.
12. Belghiti J., Noun R. and Zante E. et al., Portal triad clamping or hepatic vascular exclusion for major liver resection: A controlled study, Ann Surg 224 (1996), pp. 155–161.
13. Abdalla E.K., Noun R. and Belghiti J., Hepatic vascular occlusion: which technique?, Surg Clin N Am 84 (2004), pp. 563–585.
14. Malassagne B., Cherqui D. and Alon R. et al., Safety of selective vascular clamping for major hepatectomies, J Am Coll Surg 187 (1998), pp. 482–486.
15. Smyrniotis V.E., Kostopanagiotou G.G. and Gamaletsos E.L. et al., Total versus selective vascular exclusion in major liver resections, Am J Surg 183 (2002), pp. 173–178.
16. Majno P.E., Mentha G. and Morel P. et al., Arantius’ ligament approach to the left hepatic vein and to the common trunk, J Am Coll Surg 195 (2002), pp. 737–739.
17. Liu C.L., Fan S.T. and Lo C.M. et al., Anterior approach for major right hepatic resection for large hepatocellular carcinoma, Ann Surg 232 (2000), pp. 25–31.
18. Huguet C., Gavelli A., Chieco P.A., Bona S., Harb J., Joseph J.M., Jobard J., Gramaglia M. and Lasserre M., Liver ischemia for hepatic resection: where is the limit?, Surgery 111 (1992), pp. 251–259.
19. Torzilli G., Makuuchi M. and Midorikawa Y. et al., Liver resection without total vascular exclusion: hazardous or beneficial?: An analysis of our experience, Ann Surg 233 (2001), pp. 167–175.
20. Grazi G.L., Maziotti A. and Jovine E. et al., Total vascular exclusion of the liver during hepatic surgery: selective use extensive use or abuse?, Arch Surg 132 (1997), pp. 1104–1109.
21. Yu C.L., Hsieh S.R., Wen M.C. and Wu C.C. et al., Surgical treatment for carcinoma of the suprahepatic inferior venacava, Surgery 133 (2003), pp. 342–344.
22. Ohwada S., Ogawa T. and Kawashima Y. et al., Concomitant major hepatectomy and inferior vena cava reconstruction, J Am Coll Surg 188 (1999), pp. 63–71.
23. Sarmiento J.M., Bower T.C., Cherry K.J., Farnell M.B. and Nagorney D.M., Is combined partial hepatectomy with segmental resection of inferior vena cava justified for malignancy?, Arch Surg 138 (2003), pp. 624–631.
24. Jones R.M., Moulton C.E. and Hardy K.J., Central venous pressure and its effect on blood loss during liver resection, Br J Surg 85 (1998), pp. 1058–1060.
25. Альперович Б.И., Соловьев М.М., Белобородова Э.И. и др. Хирургия печени и желчных путей / Под ред. Б.И. Альперовича. Томск: СГМУ, 1997. 608 с.
26. Вишневский В.А., Кубышкин В.А., Чжао А.В., Икрамов Р.З. Операции на печени. М.: Миклош, 2003.156 с.
27. Журавлев В.А. Большие и предельно большие резекции печени.Киров: Изд–во Сарат. ун–та, 1986. 214 с.
28. Патютко Ю.И., Сагайдак И.В., Котельников А.Г и др. Новые технологии в хирургической гепатологии // Материалы 3–й конф. хирургов–гепатологов. 1995. С. 126–127.
29. Bismuth H., Houssin D., Ornowski J., Merrigi F. Liver resections in cirrhotic patients: a Western experience // World J. Surg. 1986. № 10. Р. 311–317.
30. Franco D., Capussotti I., Smadja C. et al. Resection of hepatocellular carcinimas: Results in 72 European patients with cirrhosis // Gastroenterology. 1990. № 98. Р. 733–738.












