–Т–≤–µ–і–µ–љ–Є–µ
–†–∞–Ї –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (–†–Я–Ц) –Ј–∞–љ–Є–Љ–∞–µ—В –≤—В–Њ—А–Њ–µ –Љ–µ—Б—В–Њ –≤ —Б—В—А—Г–Ї—В—Г—А–µ –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Љ—Г–ґ—Б–Ї–Њ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є. –Т 2016 –≥. –≤—Л—П–≤–ї–µ–љ–Њ 38 371 –љ–Њ–≤—Л–є —Б–ї—Г—З–∞–є —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є 12 523 —Б–ї—Г—З–∞—П—Б–Љ–µ—А—В–Є –Њ—В –љ–µ–≥–Њ [1]. –Я–Њ –і–∞–љ–љ—Л–Љ –Т–Ю–Ч, –≤ 2012 –≥. –≤ –Љ–Є—А–µ –≤—Л—П–≤–ї–µ–љ–Њ 1 094 916 —Б–ї—Г—З–∞–µ–≤ –†–Я–Ц –Є 307 481 —Б–ї—Г—З–∞–є —Б–Љ–µ—А—В–Є [2]. –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –і–Є–∞–≥–љ–Њ–Ј –†–Я–Ц –≤—Л—Б—В–∞–≤–ї—П–µ—В—Б—П –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –њ—А–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ—В–Є–≥–µ–љ–∞ (–Я–°–Р), –і–∞–љ–љ—Л—Е –њ–∞–ї—М—Ж–µ–≤–Њ–≥–Њ —А–µ–Ї—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –±–Є–Њ–њ—Б–Є–Є –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л —Б –Њ—Ж–µ–љ–Ї–Њ–є –њ–ї–Њ—Й–∞–і–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –≤ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е –±–Є–Њ–њ—В–∞—В–∞—Е –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –Њ–њ—Г—Е–Њ–ї–Є (–Њ—Ж–µ–љ–Ї–∞ –њ–Њ —И–Ї–∞–ї–µ –У–ї–Є—Б–Њ–љ–∞).
–Ш—Б—В–Њ—А–Є—П –њ–Њ—П–≤–ї–µ–љ–Є—П –Є —А–∞–Ј–≤–Є—В–Є—П –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–У–Ґ) –†–Я–Ц –љ–∞—З–Є–љ–∞–µ—В—Б—П –≤ 1941 –≥., –Ї–Њ–≥–і–∞ –І–∞—А–ї—М–Ј –•–∞–≥–≥–Є–љ—Б (Charles Huggins) —Б–Њ —Б–≤–Њ–Є–Љ–Є —Г—З–µ–љ–Є–Ї–∞–Љ–Є –Ъ–ї–∞—А–µ–љ—Б–Њ–Љ –Т. –•–Њ–і–ґ–µ—Б–Њ–Љ (Clarence V. Hodges) –Є –£–Є–ї—М—П–Љ–Њ–Љ –£–Њ–ї–ї–µ—Б–Њ–Љ –°–Ї–Њ—В—В–Њ–Љ (William Wallace Scott) –≤—Л—П–≤–Є–ї–Є —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –∞–љ–і—А–Њ–≥–µ–љ–∞–Љ–Є –Є –Ї–ї–µ—В–Ї–∞–Љ–Є –†–Я–Ц. –Ф–∞–ї–µ–µ, –≤ 1971 –≥. –≠–љ–і—А—О –®–∞–ї–ї–Є (Andrew V. Schally) –≤—Л–і–µ–ї–Є–ї, –Њ–њ—А–µ–і–µ–ї–Є–ї —Б—В—А—Г–Ї—В—Г—А—Г –Є —Б–Є–љ—В–µ–Ј –≥–Њ–љ–∞–і–Њ—В—А–Њ–њ–Є–љ-—А–Є–ї–Є–Ј–Є–љ–≥-–≥–Њ—А–Љ–Њ–љ–∞, –Ј–∞ —З—В–Њ –≤ 1977 –≥. –≤–Љ–µ—Б—В–µ —Б –†–Њ–ґ–µ–Љ –У–Є–є–Љ–µ–љ–Њ–Љ (Roger Guillemin) –њ–Њ–ї—Г—З–Є–ї –Э–Њ–±–µ–ї–µ–≤—Б–Ї—Г—О –њ—А–µ–Љ–Є—О [3].
–°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ M. V. Meng et al., –њ—А–Є–Љ–µ—А–љ–Њ 50% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ c –†–Я–Ц –њ–Њ–ї—Г—З–∞—О—В –У–Ґ –љ–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е —Н—В–∞–њ–∞—Е –ї–µ—З–µ–љ–Є—П [4]. –Ю–і–љ–∞–Ї–Њ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –і–µ—Б—П—В–Є–ї–µ—В–Є–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П, –њ–Њ-–њ—А–µ–ґ–љ–µ–Љ—Г —Б—Г—Й–µ—Б—В–≤—Г—О—В —А–∞–Ј–љ–Њ–≥–ї–∞—Б–Є—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –∞–љ–і—А–Њ–≥–µ–љ–љ–Њ–є –і–µ–њ—А–Є–≤–∞—Ж–Є–Є (—Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–∞—П –Є–ї–Є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–∞—П), –≤—А–µ–Љ–µ–љ–Є –љ–∞—З–∞–ї–∞ –У–Ґ (–љ–µ–Љ–µ–і–ї–µ–љ–љ–Њ–µ –Є–ї–Є –Њ—В—Б—А–Њ—З–µ–љ–љ–Њ–µ), —В–Њ—З–Ї–Є –њ—А–Є–ї–Њ–ґ–µ–љ–Є—П –У–Ґ (–≤ —А–µ–ґ–Є–Љ–µ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –∞–љ–і—А–Њ–≥–µ–љ–љ–Њ–є –±–ї–Њ–Ї–∞–і—Л –Є–ї–Є –Љ–Њ–љ–Њ—А–µ–ґ–Є–Љ–µ), –∞ —В–∞–Ї–ґ–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є —Б—Е–µ–Љ—Л –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –У–Ґ (–њ–Њ—Б—В–Њ—П–љ–љ–∞—П –Є–ї–Є –Є–љ—В–µ—А–Љ–Є—В—В–Є—А—Г—О—Й–∞—П).
–У–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–≥–Њ –Є –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–≥–Њ –†–Я–Ц
–У–Ґ –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–≥–Њ –†–Я–Ц –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–µ–і–ї–Њ–ґ–µ–љ–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ, –Ї–Њ—В–Њ—А—Л–µ –Њ—В–Ї–∞–Ј—Л–≤–∞—О—В—Б—П –Њ—В –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Є–ї–Є –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є (–Ы–Ґ). –Я–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П Yu-Ning Wong et al., –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П –Њ–±—Й–∞—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 65вАУ80 –ї–µ—В, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –У–Ґ. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ 16 535 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ –†–Я–Ц –≤—Л—Б–Њ–Ї–Њ–є –Є —Г–Љ–µ—А–µ–љ–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є. –Ъ—А–Є—В–µ—А–Є—П–Љ–Є –≤–Ї–ї—О—З–µ–љ–Є—П –±—Л–ї–Є: –Њ–±—Й–∞—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М >12 –Љ–µ—Б., –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Ы–Ґ –Є–ї–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. —Б –Љ–Њ–Љ–µ–љ—В–∞ –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –і–Є–∞–≥–љ–Њ–Ј–∞ [5].–Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–ї—Г—З–µ–љ—Л –≤ –і—А—Г–≥–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –≤–Ї–ї—О—З–∞–≤—И–µ–Љ 19 271 –њ–∞—Ж–Є–µ–љ—В–∞ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 66 –ї–µ—В –Є —Б—В–∞—А—И–µ. –Я—А–Є —Н—В–Њ–Љ –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –У–Ґ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ —Г—Е—Г–і—И–∞–µ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М 10-–ї–µ—В–љ–µ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є (80,1% –њ—А–Њ—В–Є–≤ 82,6%). –Ю–і–љ–∞–Ї–Њ –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є —Б —Г—З–µ—В–Њ–Љ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –Њ–њ—Г—Е–Њ–ї–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –Љ–Њ–≥—Г—В –Є–Љ–µ—В—М –њ–∞—Ж–Є–µ–љ—В—Л —Б –љ–Є–Ј–Ї–Њ–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ –†–Я–Ц (59,8% –њ—А–Њ—В–Є–≤ 54,3%) [6].
–Т 2004 –≥., M. P. Wirth et al. –Є–Ј—Г—З–∞–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М 150 –Љ–≥ –±–Є–Ї–∞–ї—Г—В–∞–Љ–Є–і–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ –Є –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –†–Я–Ц —Б –Ї–∞—В–µ–≥–Њ—А–Є–µ–є N0. –Т –Њ–±—Й–µ–є —Б–ї–Њ–ґ–љ–Њ—Б—В–Є 8113 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –љ–∞ 2 –≥—А—Г–њ–њ—Л: 1-—П –≥—А—Г–њ–њ–∞ –њ–Њ–ї—Г—З–∞–ї–∞ –±–Є–Ї–∞–ї—Г—В–∞–Љ–Є–і –≤ –і–Њ–Ј–µ 150 –Љ–≥/—Б—Г—В (n=4052), 2-—П –≥—А—Г–њ–њ–∞ вАФ –њ–ї–∞—Ж–µ–±–Њ (n=4061) –≤ –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —А–∞–і–Є–Ї–∞–ї—М–љ–Њ–є –њ—А–Њ—Б—В–∞—В—Н–Ї—В–Њ–Љ–Є–Є (–†–Я–≠), –Ы–Ґ –Є–ї–Є –∞–Ї—В–Є–≤–љ–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ. –Я—А–Є –Љ–µ–і–Є–∞–љ–µ –љ–∞–±–ї—О–і–µ–љ–Є—П 5,4 –≥–Њ–і–∞ –±–Є–Ї–∞–ї—Г—В–∞–Љ–Є–і —Г–ї—Г—З—И–Є–ї –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –±–µ–Ј –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П (–Т–С–Я), –љ–Њ –љ–µ –њ–Њ–≤–ї–Є—П–ї –љ–∞ –Њ–±—Й—Г—О –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –њ–Њ–і–≥—А—Г–њ–њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Њ–±—Й–∞—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Г–ї—Г—З—И–Є–ї–∞—Б—М –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –†–Я–Ц –Є, –љ–∞–Њ–±–Њ—А–Њ—В, —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ –Њ–њ—Г—Е–Њ–ї–µ–≤—Л–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–Љ [7].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ—В –і–∞–љ–љ—Л—Е, –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –У–Ґ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –†–Я–Ц –≥—А—Г–њ–њ—Л –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є EORTC 30891, –≤–Ї–ї—О—З–∞–≤—И–µ–Љ 939 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –†–Я–Ц, —А–∞–Ј–і–µ–ї–µ–љ–љ—Л—Е –љ–∞ 2 –≥—А—Г–њ–њ—Л –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –љ–µ–Љ–µ–і–ї–µ–љ–љ–Њ–≥–Њ –Є–ї–Є –Њ—В—Б—А–Њ—З–µ–љ–љ–Њ–≥–Њ –љ–∞—З–∞–ї–∞ –У–Ґ, –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –У–Ґ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ —Б—В–∞—А—В–Њ–≤—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –Я–°–Р >50 –љ–≥/–Љ–ї –Є/–Є–ї–Є –≤—А–µ–Љ–µ–љ–µ–Љ —Г–і–≤–Њ–µ–љ–Є—П –Я–°–Р <12 –Љ–µ—Б. [8].
–Т —Б–Ї–∞–љ–і–Є–љ–∞–≤—Б–Ї–Њ–Љ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SPCG-7/SFUO-3 (875 –њ–∞—Ж–Є–µ–љ—В–Њ–≤) –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є PR/PR07 (1205 –њ–∞—Ж–Є–µ–љ—В–Њ–≤) –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ —Г–ї—Г—З—И–µ–љ–Є–µ –Њ–±—Й–µ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –†–Я–Ц –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є –У–Ґ —Б –Ы–Ґ [9, 10].
![–†–Є—Б. 1. –Р–ї–≥–Њ—А–Є—В–Љ –ї–µ—З–µ–љ–Є—П –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–≥–Њ –†–Я–Ц [35] –†–Є—Б. 1. –Р–ї–≥–Њ—А–Є—В–Љ –ї–µ—З–µ–љ–Є—П –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–≥–Њ –†–Я–Ц [35]](/upload/medialibrary/ce0/36-1.png)
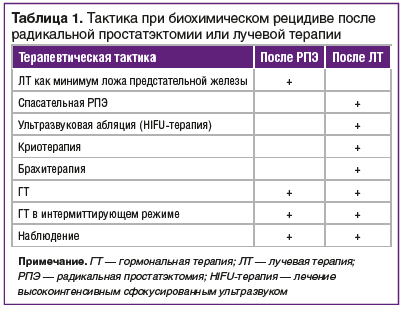
–С–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–є —А–µ—Ж–Є–і–Є–≤ –њ–Њ—Б–ї–µ —А–∞–і–Є–Ї–∞–ї—М–љ–Њ–є –њ—А–Њ—Б—В–∞—В—Н–Ї—В–Њ–Љ–Є–Є –Є–ї–Є –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є
–£ 20вАУ40% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ—Б–ї–µ –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –†–Я–≠ –Є —Г 30вАУ50% –њ–Њ—Б–ї–µ –Ы–Ґ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–є —А–µ—Ж–Є–і–Є–≤ –≤ —В–µ—З–µ–љ–Є–µ 10 –ї–µ—В [13вАУ15]. –Я–Њ–і –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ —А–µ—Ж–Є–і–Є–≤–Њ–Љ –њ–Њ—Б–ї–µ –†–Я–≠ –њ–Њ–і—А–∞–Ј—Г–Љ–µ–≤–∞–µ—В—Б—П –і–≤–∞ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л—Е –њ–Њ–≤—Л—И–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Я–°–Р >0,2 –љ–≥/–Љ–ї, –њ–Њ—Б–ї–µ –Ы–Ґ вАФ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Я–°–Р –љ–∞ 2 –љ–≥/–Љ–ї –Њ—В —Г—А–Њ–≤–љ—П –љ–∞–і–Є—А–∞ [16, 17].–Э–∞–ї–Є—З–Є–µ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —Б—В–∞—А—В–Њ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Я–°–Р, –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–є –Њ–њ—Г—Е–Њ–ї–Є, –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Ї—А–∞—П —А–µ–Ј–µ–Ї—Ж–Є–Є (R1) –Є –Є–љ–і–µ–Ї—Б –У–ї–Є—Б–Њ–љ–∞ вЙ•8 –±–∞–ї–ї–Њ–≤ –њ–Њ–≤—Л—И–∞—О—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М 10-–ї–µ—В–љ–µ–≥–Њ –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ—Ж–Є–і–Є–≤–∞ –њ–Њ—Б–ї–µ –†–Я–≠ –і–Њ 75% [18вАУ20].
–Я—А–Є —А–∞–Ј–≤–Є—В–Є–Є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ—Ж–Є–і–Є–≤–∞ –њ–Њ—Б–ї–µ –†–Я–≠ –Є —Г—А–Њ–≤–љ–µ –Я–°–Р <1 –љ–≥/–Љ–ї –ї—Г—З–µ–≤–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–∞ –≤–≤–Є–і—Г –љ–Є–Ј–Ї–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є; –њ—А–Є —Г—А–Њ–≤–љ–µ –Я–°–Р >1 –љ–≥/–Љ–ї —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –њ–Њ–Ј–Є—В—А–Њ–љ–љ–Њ-—Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є (–Я–≠–Ґ/–Ъ–Ґ) —Б 11–°-—Е–Њ–ї–Є–љ–Њ–Љ –Є–ї–Є —Б –њ—А–Њ—Б—В–∞—В-—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ –Љ–µ–Љ–±—А–∞–љ–љ—Л–Љ –∞–љ—В–Є–≥–µ–љ–Њ–Љ. –Ф–∞–љ–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Я–°–Р –Њ–њ—А–µ–і–µ–ї–µ–љ—Л –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–є —Г—А–Њ–ї–Њ–≥–Њ–≤ (EAU) –≤ 2017 –≥., –Њ–і–љ–∞–Ї–Њ —Б –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ–Љ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ –Њ–њ—Л—В–∞ –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ —Н—В–Є –Ј–љ–∞—З–µ–љ–Є—П –Љ–Њ–≥—Г—В –±—Л—В—М –њ–µ—А–µ—Б–Љ–Њ—В—А–µ–љ—Л –≤ –±–ї–Є–ґ–∞–є—И–µ–µ –≤—А–µ–Љ—П. –Я—А–Є –њ–Њ–≤—Л—И–µ–љ–Є–Є —Г—А–Њ–≤–љ—П –Я–°–Р –њ–Њ—Б–ї–µ –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–є –Ы–Ґ –Є –њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–Є —Б–∞–ї—М–≤–∞–ґ–љ–Њ–є —В–µ—А–∞–њ–Є–Є —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –≤—Л–њ–Њ–ї–љ–µ–љ–Є–µ –Љ—Г–ї—М—В–Є–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–є –Љ–∞–≥–љ–Є—В–љ–Њ-—А–µ–Ј–Њ–љ–∞–љ—Б–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П —Б—Г—Б–њ–Є—Ж–Є–Њ–Ј–љ—Л—Е –Њ–±–ї–∞—Б—В–µ–є –Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П —В–∞—А–≥–µ—В–љ–Њ–є –±–Є–Њ–њ—Б–Є–Є, –∞ —В–∞–Ї–ґ–µ –Я–≠–Ґ/–Ъ–Ґ –і–ї—П –Њ—Ж–µ–љ–Ї–Є –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤ –Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П –Њ—В–і–∞–ї–µ–љ–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤. –Т—Л–њ–Њ–ї–љ—П—В—М –Ъ–Ґ-—Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ –Ї–Њ—Б—В–µ–є, –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –Є –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–µ–є —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Є —Г—А–Њ–≤–љ–µ –Я–°–Р >10 –љ–≥/–Љ–ї –Є–ї–Є –≤—А–µ–Љ–µ–љ–Є —Г–і–≤–Њ–µ–љ–Є—П –Я–°–Р <6 –Љ–µ—Б. –Є —Б–Ї–Њ—А–Њ—Б—В–Є –њ—А–Є—А–Њ—Б—В–∞ –Я–°–Р >0,5 –љ–≥/–Љ–ї/–Љ–µ—Б. [21].
![–†–Є—Б. 2. –Р–ї–≥–Њ—А–Є—В–Љ –ї–µ—З–µ–љ–Є—П –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ—Ж–Є–і–Є–≤–∞ –њ–Њ—Б–ї–µ –†–Я–≠ [35] –†–Є—Б. 2. –Р–ї–≥–Њ—А–Є—В–Љ –ї–µ—З–µ–љ–Є—П –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ—Ж–Є–і–Є–≤–∞ –њ–Њ—Б–ї–µ –†–Я–≠ [35]](/upload/medialibrary/d72/36-3.png)
–У–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –њ—А–Є –≤—В–Њ—А–Є—З–љ–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–Є –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤
–Ф–ї—П –±–Њ–ї—М–љ—Л—Е —Б –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ –њ–Њ–≤–Њ–і—Г –љ–µ–Љ–µ–і–ї–µ–љ–љ–Њ–є –Є–ї–Є –Њ—В—Б—А–Њ—З–µ–љ–љ–Њ–є –У–Ґ –і–Є—Б–Ї—Г—В–∞–±–µ–ї—М–љ—Л. –†–µ—И–µ–љ–Є–µ –і–ї—П –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –†–Я–Ц –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –њ—А–Є–љ—П—В–Њ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –њ–Њ –Ї–∞–ґ–і–Њ–Љ—Г –њ–∞—Ж–Є–µ–љ—В—Г –њ–Њ—Б–ї–µ –Њ—Ж–µ–љ–Ї–Є —А–Є—Б–Ї–Њ–≤ –Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤. –Э–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —П–≤–ї–µ–љ–Є—П –њ—А–Є –У–Ґ (—Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї –Є–љ—Б—Г–ї–Є–љ—Г, —А–Є—Б–Ї –Ї–Њ—Б—В–љ—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤) —В–∞–Ї–ґ–µ –і–Њ–ї–ґ–љ—Л –±—Л—В—М –њ—А–Є–љ—П—В—Л –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ.–Я–∞—Ж–Є–µ–љ—В—Л —Б –Љ–∞–ї—Л–Љ –Њ–±—К–µ–Љ–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є—П –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤ (<2) –Є–Љ–µ—О—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Е–Њ—А–Њ—И–Є–є –њ—А–Њ–≥–љ–Њ–Ј –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –і–∞–ґ–µ –±–µ–Ј –њ—А–Њ–≤–µ–і–µ–љ–Є—П –љ–µ–Ј–∞–Љ–µ–і–ї–Є—В–µ–ї—М–љ–Њ–є –У–Ґ.
–У—А—Г–њ–њ–∞ –∞–≤—В–Њ—А–Њ–≤ –≤–Њ –≥–ї–∞–≤–µ —Б Seiler –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П (–†–Я–≠ —Б —А–∞—Б—И–Є—А–µ–љ–љ–Њ–є —В–∞–Ј–Њ–≤–Њ–є –ї–Є–Љ—Д–∞–і–µ–љ—Н–Ї—В–Њ–Љ–Є–µ–є) —Г –±–Њ–ї—М–љ—Л—Е —Б –Ї–∞—В–µ–≥–Њ—А–Є–µ–є pN+. –С–Њ–ї–µ–µ —З–µ–Љ –њ–Њ–ї–Њ–≤–Є–љ–∞ –±–Њ–ї—М–љ—Л—Е (57%) –Є–Љ–µ–ї–Є –ї–Є—И—М –Њ–і–Є–љ –Љ–µ—В–∞—Б—В–∞–Ј –≤ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Њ–Љ —Г–Ј–ї–µ, –Є 10-–ї–µ—В–љ—П—П –Њ–њ—Г—Е–Њ–ї–µ–≤–Њ-—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–∞—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М —Б–Њ—Б—В–∞–≤–Є–ї–∞ 75% –±–µ–Ј –њ—А–Њ–≤–µ–і–µ–љ–Є—П –У–Ґ.
–Ъ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ —Д–∞–Ї—В–Њ—А–∞–Љ –њ—А–Њ–≥–љ–Њ–Ј–∞ –Њ—В–љ–Њ—Б—П—В –љ–∞–ї–Є—З–Є–µ –±–Њ–ї–µ–µ –Њ–і–љ–Њ–≥–Њ –Љ–µ—В–∞—Б—В–∞–Ј–∞ –≤ –Њ–±–ї–∞—Б—В–Є —В–∞–Ј–∞, –≤—Л—Е–Њ–і –Ј–∞ –њ—А–µ–і–µ–ї—Л –Ї–∞–њ—Б—Г–ї—Л –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Г–Ј–ї–∞, –њ–ї–Њ—В–љ–Њ—Б—В—М –њ–Њ—А–∞–ґ–µ–љ–Є—П –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤ –±–Њ–ї–µ–µ 20%, –Є–љ–≤–∞–Ј–Є—О —Б–µ–Љ–µ–љ–љ—Л—Е –њ—Г–Ј—Л—А—М–Ї–Њ–≤, –Є–љ–і–µ–Ї—Б –У–ї–Є—Б–Њ–љ–∞ 8вАУ10 –±–∞–ї–ї–Њ–≤, –Я–°–Р >50 –љ–≥/–Љ–ї, –≤—А–µ–Љ—П —Г–і–≤–Њ–µ–љ–Є–µ –Я–°–Р <12 –Љ–µ—Б. –≠—В–Є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л –і–Њ–ї–ґ–љ—Л —Г—З–Є—В—Л–≤–∞—В—М—Б—П –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –У–Ґ.
–У–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –њ—А–Є –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–Љ –†–Я–Ц
–Ь–µ–і–Є–∞–љ–∞ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –≤–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ–љ—Л–Љ –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ –†–Я–Ц —Б–Њ—Б—В–∞–≤–ї—П–µ—В 42 –Љ–µ—Б. [25], –Њ–і–љ–∞–Ї–Њ –њ–Њ–њ—Г–ї—П—Ж–Є—П ¬Ђ–Ь1¬ї –Њ—З–µ–љ—М –≥–µ—В–µ—А–Њ–≥–µ–љ–љ–∞. –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –Њ–±—Й–µ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –±—Л–ї–Є –њ—А–µ–і–ї–Њ–ґ–µ–љ—Л –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л, –≤–Ї–ї—О—З–∞—П —З–Є—Б–ї–Њ –Є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є—О –Ї–Њ—Б—В–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤, –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л–µ –Њ—З–∞–≥–Є, —Б—Г–Љ–Љ—Г –±–∞–ї–ї–Њ–≤ –њ–Њ –У–ї–Є—Б–Њ–љ—Г, –Њ—Ж–µ–љ–Ї—Г —Б—В–∞—В—Г—Б–∞ –њ–Њ –Ъ–∞—А–љ–Њ–≤—Б–Ї–Њ–Љ—Г, –Є–љ–Є—Ж–Є–∞–ї—М–љ—Л–є (—Б—В–∞—А—В–Њ–≤—Л–є) –Я–°–Р [26], —Г—А–Њ–≤–µ–љ—М —Й–µ–ї–Њ—З–љ–Њ–є —Д–Њ—Б—Д–∞—В–∞–Ј—Л.–Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ–Є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —П–≤–ї—П—О—В—Б—П —З–Є—Б–ї–Њ –Є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є—П –Ї–Њ—Б—В–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤, –љ–∞–ї–Є—З–Є–µ –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤ [27].
–У–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П вАФ –Є–љ—В–µ–≥—А–∞–ї—М–љ—Л–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В –њ—А–Є –љ–∞—З–∞–ї–µ —Б–Є—Б—В–µ–Љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≥–Њ—А–Љ–Њ–љ-–љ–∞–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –†–Я–Ц.
–У–Ґ –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–∞—Б—М –≤ –Љ–Њ–љ–Њ—А–µ–ґ–Є–Љ–µ –і–ї—П –ї–µ—З–µ–љ–Є—П –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –†–Я–Ц [28, 29]. –Э–Њ–≤—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л —Б –Є–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є –њ—А–Є–Љ–µ–љ—П—В—М –љ–Њ–≤—Л–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –У–Ґ: –У–Ґ + –∞–±–Є—А–∞—В–µ—А–Њ–љ –Є –У–Ґ + –і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї.
–Э–∞ –Љ–Њ–Љ–µ–љ—В –љ–∞–њ–Є—Б–∞–љ–Є—П —Б—В–∞—В—М–Є –≤ –Љ–Є—А–Њ–≤–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ –Њ—В—Б—Г—В—Б—В–≤—Г—О—В –і–∞–љ–љ—Л–µ, —Б—А–∞–≤–љ–Є–≤–∞—О—Й–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –У–Ґ –Є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї —Б –У–Ґ –Є –∞–±–Є—А–∞—В–µ—А–Њ–љ–Њ–Љ –≤ —А–∞–Љ–Ї–∞—Е –Њ–і–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ю–±–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ–Ї–∞–Ј–∞–ї–Є —Б—Е–Њ–ґ–Є–µ –і–∞–љ–љ—Л–µ –њ–Њ —Г–ї—Г—З—И–µ–љ–Є—О –Њ–±—Й–µ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є.
![–†–Є—Б. 3. –Р–ї–≥–Њ—А–Є—В–Љ –ї–µ—З–µ–љ–Є—П –њ—А–Є –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–Љ –†–Я–Ц [35] –†–Є—Б. 3. –Р–ї–≥–Њ—А–Є—В–Љ –ї–µ—З–µ–љ–Є—П –њ—А–Є –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–Љ –†–Я–Ц [35]](/upload/medialibrary/79b/36-4.png)
–У–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П + –∞–±–Є—А–∞—В–µ—А–Њ–љ
C–љ–Є–ґ–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –У–Ґ –Љ–Њ–ґ–µ—В –±—Л—В—М –≤—Л–Ј–≤–∞–љ–Њ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –Ї–Њ–љ–≤–µ—А—Б–Є–µ–є –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ —Б—В–µ—А–Њ–Є–і–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ –≤ –Ї–ї–µ—В–Ї–∞—Е –†–Я–Ц. –†–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ—Б—В—М –і–Њ–±–∞–≤–ї–µ–љ–Є—П –∞–±–Є—А–∞—В–µ—А–Њ–љ–∞ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –±–ї–Њ–Ї–Є—А–Њ–≤–∞–љ–Є—П –≤—Л—И–µ—Г–Ї–∞–Ј–∞–љ–љ–Њ–є –Ї–Њ–љ–≤–µ—А—Б–Є–Є.–Ф–≤–∞ –Ї—А—Г–њ–љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –У–Ґ + –∞–±–Є—А–∞—В–µ—А–Њ–љ —Г –±–Њ–ї—М–љ—Л—Е –≥–Њ—А–Љ–Њ–љ-–љ–∞–Є–≤–љ—Л–Љ –†–Я–Ц.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ LATITUDE
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ LATITUDE –≤–Ї–ї—О—З–∞–ї–Њ 1199 –Љ—Г–ґ—З–Є–љ —Б –≤–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ–љ—Л–Љ –≥–Њ—А–Љ–Њ–љ-–љ–∞–Є–≤–љ—Л–Љ –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ –†–Я–Ц. –Я–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –љ–∞ 2 –≥—А—Г–њ–њ—Л: –У–Ґ + –Р–С–Ш + –њ—А–µ–і–љ–Є–Ј–Њ–љ (–Є—Б—Б–ї–µ–і—Г–µ–Љ–∞—П) –Є –У–Ґ + –њ–ї–∞—Ж–µ–±–Њ (–Ї–Њ–љ—В—А–Њ–ї—М–љ–∞—П). –Я–∞—Ж–Є–µ–љ—В—Л –Њ—В–љ–Њ—Б–Є–ї–Є—Б—М –Ї –≥—А—Г–њ–њ–µ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –Є –Є–Љ–µ–ї–Є –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ 2 –Є–Ј 3-—Е –Ї—А–Є—В–µ—А–Є–µ–≤: –Є–љ–і–µ–Ї—Б –У–ї–Є—Б–Њ–љ–∞ 8 –±–∞–ї–ї–Њ–≤ –Є –±–Њ–ї–µ–µ, —Е–Њ—В—П –±—Л 3 –Ї–Њ—Б—В–љ—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Є–ї–Є –љ–∞–ї–Є—З–Є–µ –Є–Ј–Љ–µ—А—П–µ–Љ—Л—Е –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л—Е –Њ—З–∞–≥–Њ–≤.–Ю–±—Й–∞—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –±—Л–ї–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –≥—А—Г–њ–њ–µ (–љ–µ–і–Њ—Б—В–Є–≥–љ—Г—В–∞—П –Љ–µ–і–Є–∞–љ–∞ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –њ—А–Њ—В–Є–≤ 34,7 –Љ–µ—Б., –Њ—В–љ–Њ—И–µ–љ–Є–µ —А–Є—Б–Ї–Њ–≤ (–Ю–†) 0,62, 95% –Ф–Ш: 0,51вАУ0,76). –†–∞–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Т–С–Я –±—Л–ї–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –њ—А–Є –і–Њ–±–∞–≤–ї–µ–љ–Є–Є –∞–±–Є—А–∞—В–µ—А–Њ–љ–∞ (–Љ–µ–і–Є–∞–љ–∞ 33,0 –Љ–µ—Б. –њ—А–Њ—В–Є–≤ 14,8 –Љ–µ—Б., –Ю–† 0,47, 95% –Ф–Ш: 0,39вАУ0,55). –°—Е–Њ–ґ–Є–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –≤ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ –≤—В–Њ—А–Є—З–љ—Л—Е —Ж–µ–ї–µ–є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –≤—А–µ–Љ—П –і–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є–Є –±–Њ–ї–Є, –≤—А–µ–Љ—П –і–Њ –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ (–Я–°–Р) –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П, –≤—А–µ–Љ—П –і–Њ —А–∞–Ј–≤–Є—В–Є—П —Б–Є–Љ–њ—В–Њ–Љ–љ—Л—Е —Б–Ї–µ–ї–µ—В–љ—Л—Е —Б–Њ–±—Л—В–Є–є, –≤—А–µ–Љ—П –і–Њ —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –Є –≤—А–µ–Љ—П –і–Њ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є–Є –†–Я–Ц. –С—Л–ї–Њ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –±–Њ–ї—М—И–µ–µ —З–Є—Б–ї–Њ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є III —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –Є–ї–Є –≤—Л—И–µ: –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П (22% –њ—А–Њ—В–Є–≤ 10%) –Є –≥–Є–њ–Њ–Ї–∞–ї–Є–µ–Љ–Є—П (10% –њ—А–Њ—В–Є–≤ 4%).
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ STAMPEDE
1917 –Љ—Г–ґ—З–Є–љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –љ–∞ 2 –≥—А—Г–њ–њ—Л: –У–Ґ + –Р–С–Ш + –њ—А–µ–і–љ–Є–Ј–Њ–љ (–Є—Б—Б–ї–µ–і—Г–µ–Љ–∞—П) –Є –У–Ґ –≤ –Љ–Њ–љ–Њ—А–µ–ґ–Є–Љ–µ (–Ї–Њ–љ—В—А–Њ–ї—М–љ–∞—П). –Я–Њ–њ—Г–ї—П—Ж–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–∞ –≥–µ—В–µ—А–Њ–≥–µ–љ–љ–∞ –Є –≤–Ї–ї—О—З–∞–ї–∞ —Б–ї–µ–і—Г—О—Й–Є–µ –Ї–∞—В–µ–≥–Њ—А–Є–Є:–≤–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ (94,9%). –°—О–і–∞ –≤—Е–Њ–і–Є–ї–∞ –≥—А—Г–њ–њ–∞ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ (—Б—В–∞–і–Є—П T3-T4N0M) —Б –Я–°–Р вЙ•40 –љ–≥/–Љ–ї –Є–ї–Є —Б—Г–Љ–Љ–Њ–є –±–∞–ї–ї–Њ–≤ –њ–Њ –У–ї–Є—Б–Њ–љ—Г 8вАУ10 (26,6%), –±–Њ–ї—М–љ—Л–µ —Б –њ–Њ—А–∞–ґ–µ–љ–љ—Л–Љ–Є –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є —Г–Ј–ї–∞–Љ–Є (N1M0 19,2%) –Є –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ (M1 49,1%);
–њ–∞—Ж–Є–µ–љ—В—Л —Б —А–µ—Ж–Є–і–Є–≤–Њ–Љ –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П (–†–Я–≠/–Ы–Ґ): —Б –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ —А–µ—Ж–Є–і–Є–≤–Њ–Љ (1,9%) –Є–ї–Є –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ (3,2%).
–У–ї–∞–≤–љ–∞—П —Ж–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П вАФ –Њ–±—Й–∞—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –Є –Т–С–Я. –Р–љ–∞–ї–Є–Ј –і–∞–љ–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї—Б—П –њ—А–Є –Љ–µ–і–Є–∞–љ–µ –љ–∞–±–ї—О–і–µ–љ–Є—П 14 –Љ–µ—Б. –Ю–±—Й–∞—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –±—Л–ї–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –∞–±–Є—А–∞—В–µ—А–Њ–љ (3-–ї–µ—В–љ—П—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –≥—А—Г–њ–њ–µ 83%, –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є вАФ 76%; –Ю–† 0,63, 95% –Ф–Ш: 0,52вАУ0,76). –†–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є —Б—Е–Њ–ґ–Є –Ї–∞–Ї –і–ї—П –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ, —В–∞–Ї –Є –і–ї—П –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–≥–Њ –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–≥–Њ –†–Я–Ц.
–Т–С–Я –±—Л–ї–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –≥—А—Г–њ–њ–µ (3-–ї–µ—В–љ—П—П –Т–С–Я —Б–Њ—Б—В–∞–≤–Є–ї–∞ 75% –њ—А–Њ—В–Є–≤ 45% –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є; –Ю–† 0,29, 95% –Ф–Ш: 0,25вАУ0,34). –†–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –Ї–∞–Ї –і–ї—П –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ, —В–∞–Ї –Є –і–ї—П –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–≥–Њ –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–≥–Њ –†–Я–Ц.
–У–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П + –і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї
–†–µ–Ј—Г–ї—М—В–∞—В—Л —В—А–µ—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –і–Њ–Ї–∞–Ј–∞–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М (—Г–ї—Г—З—И–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Њ–±—Й–µ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –Є –Т–С–Я) –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –У–Ґ + –і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї —Г –±–Њ–ї—М–љ—Л—Е –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ –≥–Њ—А–Љ–Њ–љ-–љ–∞–Є–≤–љ—Л–Љ –†–Я–Ц. –Ю–і–љ–∞–Ї–Њ —Г–ї—Г—З—И–µ–љ–Є–µ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є —Б–Њ–њ—А—П–ґ–µ–љ–Њ —Б —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–Љ–Є —П–≤–ї–µ–љ–Є—П–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є—П –У–Ґ + –і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –У–Ґ –≤ –Љ–Њ–љ–Њ—А–µ–ґ–Є–Љ–µ –≤—Л–Ј—Л–≤–∞–µ—В –±–Њ–ї—М—И–µ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є, –њ–Њ –і–∞–љ–љ—Л–Љ –≤—Б–µ—Е —В—А–µ—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [27, 30, 31]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є STAMPEDE —З–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є IIIвАУV —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –≥—А—Г–њ–њ–µ (–і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї) —Б–Њ—Б—В–∞–≤–Є–ї–∞ 52% –њ—А–Њ—В–Є–≤ 32% –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є.–І–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –ї–µ–є–Ї–Њ–њ–µ–љ–Є–Є, –њ–Њ –і–∞–љ–љ—Л–Љ –≤—Б–µ—Е —В—А–µ—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —Б–Њ—Б—В–∞–≤–Є–ї–∞ 6вАУ15%. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є STAMPEDE –±—Л–ї–Њ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ 8 —Б–Љ–µ—А—В–µ–є, –≤–µ—А–Њ—П—В–љ–Њ, –∞—Б—Б–Њ—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї, –≤–Ї–ї—О—З–∞—П 5 —Б–Љ–µ—А—В–µ–є –Њ—В –љ–µ–є—В—А–Њ–њ–µ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–µ–њ—Б–Є—Б–∞ –Є 3 —Б–Љ–µ—А—В–Є –Њ—В –њ–љ–µ–≤–Љ–Њ–љ–Є–Є. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є GETUGAFU 15 –±—Л–ї–Њ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ 2 —Б–Љ–µ—А—В–Є –Њ—В –љ–µ–є—В—А–Њ–њ–µ–љ–Є–Є.
–Я—А–Њ–≤–µ–і–µ–љ–Є–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–µ–є
–Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є—П –Ы–Ґ –Є –У–Ґ –∞–Ы–У–†–У (–±—Г—Б–µ—А–µ–ї–Є–љ–Њ–Љ –Є –і—А.) –і–Њ–Ї–∞–Ј–∞–ї–∞ —Б–≤–Њ–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ы–Ґ –≤ –Љ–Њ–љ–Њ—А–µ–ґ–Є–Љ–µ –≤ —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [32вАУ34]. –≠—В–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–Ї–ї—О—З–∞–ї–Є –±–Њ–ї—М–љ—Л—Е –†–Я–Ц –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞, –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ (T3вАУT4, N0-X), —Б —Г—З–µ—В–Њ–Љ —И–Є—А–Њ–Ї–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –Њ—Б—В–∞–ї—М–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ (–Я–°–Р, –Є–љ–і–µ–Ї—Б –У–ї–Є—Б–Њ–љ–∞). –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П EORTC 22863 –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є —Б–і–µ–ї–∞—В—М –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Ы–Ґ + –У–Ґ –њ—А–Є –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–Љ –†–Я–Ц —Б—В–∞–љ–і–∞—А—В–Њ–Љ –ї–µ—З–µ–љ–Є—П.–Р–љ–∞–ї–Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П RTOG 9408 –Є –і—А—Г–≥–Є—Е —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е —А–∞–±–Њ—В –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤—Л–Є–≥—А—Л—И–∞ –≤ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –њ—А–Є –і–Њ–±–∞–≤–ї–µ–љ–Є–Є –У–Ґ –∞–Ы–У–†–У –Ї –Ы–Ґ —Г –±–Њ–ї—М–љ—Л—Е –†–Я–Ц –љ–Є–Ј–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞.
–†–∞–±–Њ—В–∞ Ciezki et al. –і–Њ–Ї–∞–Ј–∞–ї–∞, —З—В–Њ –і–Њ–±–∞–≤–ї–µ–љ–Є–µ –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –У–Ґ –Ї IMRT (–ї—Г—З–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є —Б –Љ–Њ–і—Г–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М—О) –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Г–ї—Г—З—И–Є—В—М –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –≤ –≥—А—Г–њ–њ–µ –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ –†–Я–Ц [35].
–Т—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤–љ–µ –Њ–±–ї—Г—З–∞–µ–Љ–Њ–є –Ј–Њ–љ—Л —В—А–µ–±—Г–µ—В –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞: IMRT c —Н—Б–Ї–∞–ї–∞—Ж–Є–µ–є –°–Ю–Ф (—Б—Г–Љ–Љ–∞—А–љ–Њ–є –Њ—З–∞–≥–Њ–≤–Њ–є –і–Њ–Ј—Л, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ –њ—Г—В–µ–є —А–µ–≥–Є–Њ–љ–∞—А–љ–Њ–≥–Њ –ї–Є–Љ—Д–Њ–Њ—В–Њ–Ї–∞) —Б –і–Њ–±–∞–≤–ї–µ–љ–Є–µ–Љ –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ–Њ–є –У–Ґ. –Я—А–Є —А–∞—Б—З–µ—В–µ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –У–Ґ –≤–∞–ґ–љ–Њ –Њ—Ж–µ–љ–Є–≤–∞—В—М —В–∞–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л, –Ї–∞–Ї –Њ–±—Й–µ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–Њ–ї—М–љ–Њ–≥–Њ, —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л. –°—В–Њ–Є—В –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ EBRT –Є –Ї—А–∞—В–Ї–Њ—Б—А–Њ—З–љ–∞—П –Ы–Ґ –љ–µ —Г–ї—Г—З—И–Є–ї–Є –Њ–±—Й—Г—О –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е –†–Я–Ц –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –≤ –С–Њ—Б—В–Њ–љ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є RTOG 94вАУ13 –Є 86вАУ10. –Т –љ–∞—Б—В–Њ—П—Й–Є–є –Љ–Њ–Љ–µ–љ—В –њ–∞—Ж–Є–µ–љ—В–∞–Љ –Є–Ј —Н—В–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ –і–ї–Є—В–µ–ї—М–љ–∞—П –У–Ґ.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Э–∞–Ј–љ–∞—З–µ–љ–Є–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–Љ –†–Я–Ц –љ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М, –љ–∞–њ—А–Њ—В–Є–≤, –Љ–Њ–ґ–µ—В —Б–љ–Є–Ј–Є—В—М –µ–µ –≤–≤–Є–і—Г –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є.–У–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П —П–≤–ї—П–µ—В—Б—П —Б—В–∞–љ–і–∞—А—В–Њ–Љ –ї–µ—З–µ–љ–Є—П –њ—А–Є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–Љ —А–µ—Ж–Є–і–Є–≤–µ. –Ю–і–љ–∞–Ї–Њ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–µ –≤—А–µ–Љ—П –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є –Њ—Б—В–∞–µ—В—Б—П –Њ—В–Ї—А—Л—В—Л–Љ –≤–Њ–њ—А–Њ—Б–Њ–Љ. –С–Њ–ї–µ–µ –Љ–Њ–ї–Њ–і—Л–Љ –±–Њ–ї—М–љ—Л–Љ —Б —А–Є—Б–Ї–Њ–Љ —А–∞–љ–љ–µ–≥–Њ –Љ–µ—В–∞—Б—В–∞–Ј–Є—А–Њ–≤–∞–љ–Є—П (8вАУ10 –±–∞–ї–ї–Њ–≤ –њ–Њ –У–ї–Є—Б–Њ–љ—Г, –≤—А–µ–Љ—П —Г–і–≤–Њ–µ–љ–Є–µ –Я–°–Р <10вАУ12 –Љ–µ—Б.) —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ —А–∞–љ–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –У–Ґ. –£ –±–Њ–ї—М–љ—Л—Е —Б –±–Њ–ї–µ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –Њ—В—Б—А–Њ—З–µ–љ–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б–Њ–≥–ї–∞—Б–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ –Є –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л—Е –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.
–Я—А–Є –Ї–∞—В–µ–≥–Њ—А–Є–Є pN+ –њ–∞—Ж–Є–µ–љ—В—Г —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –њ—А–µ–і–ї–Њ–ґ–Є—В—М –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Г—О —В–µ—А–∞–њ–Є—О –∞–Ы–У–†–У. –С–Њ–ї—М–љ—Л–Љ —Б –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Љ–µ–љ–µ–µ 2-—Е –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤, –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –≤—Л—Е–Њ–і–∞ –Ј–∞ –њ—А–µ–і–µ–ї—Л –Ї–∞–њ—Б—Г–ї—Л –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Г–Ј–ї–∞ –Є –Я–°–Р <0,1 –љ–≥/–Љ–ї –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –њ–ї–∞–љ–Њ–≤—Л—Е –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л—Е –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –У–Ґ –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є.
–С–Њ–ї—М–љ—Л–Љ –Љ–µ—Б—В–љ–Њ-—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –Є–ї–Є –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ –†–Я–Ц –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б —В–∞–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –Ї–∞–Ї –∞–±–Є—А–∞—В–µ—А–Њ–љ, –і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї. –Ю—В—Б—Г—В—Б—В–≤—Г—О—В –і–∞–љ–љ—Л–µ, —Б—А–∞–≤–љ–Є–≤–∞—О—Й–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –У–Ґ –Є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї —Б –У–Ґ –Є –∞–±–Є—А–∞—В–µ—А–Њ–љ–Њ–Љ –≤ —А–∞–Љ–Ї–∞—Е –Њ–і–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ю–±–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ–Ї–∞–Ј–∞–ї–Є —Б—Е–Њ–ґ–Є–µ –і–∞–љ–љ—Л–µ –њ–Њ —Г–ї—Г—З—И–µ–љ–Є—О –Њ–±—Й–µ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є.
–Т—Л–±–Њ—А –њ—А–µ–њ–∞—А–∞—В–∞ –і–Њ–ї–ґ–µ–љ –±—Л—В—М —Б–і–µ–ї–∞–љ –њ–Њ—Б–ї–µ –Њ–±—Б—Г–ґ–і–µ–љ–Є—П —Б –њ–∞—Ж–Є–µ–љ—В–Њ–Љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Л—Е –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е –і–µ–є—Б—В–≤–Є–є –њ—А–µ–њ–∞—А–∞—В–∞.












