Введение
При опухолях пищеварительного тракта проводят сопроводительную нутриционную поддержку (НП) с целью профилактики метаболических осложнений. Существуют 3 направления сопроводительной нутриционной коррекции: 1) базовая сопроводительная нутритивная коррекция пациентов с онкопатологией в целом; 2) нутриционная реабилитация пациентов с онкопатологией и сопутствующими заболеваниями; 3) нутриционная помощь паллиативным пациентам. В каждом из направлений учитываются известные к настоящему времени основные метаболические синдромы, характерные для онкопациентов. Говоря об особенностях метаболического ответа при раке, следует отметить, что фаза ebb может не иметь очерченной клинической картины и при выраженном окислительном стрессе и угнетении CARS быстро перейти в фазу flow. Присутствие синдрома анорексии-кахексии (САСS) со снижением аппетита, массы тела (более чем на 5% за 6 мес.), индекса мышечной массы приводит к прекахексии, кахексии вплоть до рефрактерной кахексии (от 0 до 100 баллов). Синдром гиперметаболизма-гиперкатаболизма, выражающийся в реакции мышечного протеолиза, саркопении, повышенном уровне цитокинов, росте энергетических и пластических потребностей, высокой скорости окисления липидов, толерантности организма к пищевым веществам при сниженной скорости окисления глюкозы и росте белковых потерь (потери Pt<6 г/сут соответствуют I степени, 12 г/сут — II степени и >12 г/сут — тяжелой степени), ведет к росту индекса нутриционного риска [1]. Благодаря работам Ю.М. Гальперина, А.М. Уголева и их соратников (Л.Н. Костюченко, Т.З. Иванова, М.В. Руденская, М.Я. Симонов и др.) выделен также синдром кишечной недостаточности и определены фундаментальные основы энтеральной зондовой алиментации (принцип химусоподобия как критерий наибольшей усвояемости рационов, учет процессов гетерофазного полостного пищеварения на флоккулах, необходимость коррекции микробиоты кишечника и др.). В целом процессы мышечного катаболизма и механизмы протеолиза описаны во многих исследованиях [2, 3], выявивших пути деградации белка, мышечного истощения за счет убиквитин-протеасомной системы [4], белка дистрофина, ферроптоза, цитоплазматической гипоксии и др. В выборе составов для нутриционного сопровождения существенную роль играют и сведения о метаболизме самой опухолевой клетки. Например, нормальная клетка может усваивать гликоген, а раковая — глюкозу; нормальные клетки мало поглощают фолат, а раковые клетки, имея рецепторы для захвата этого витамина, жадно его поглощают; раковые клетки поглощают бор в 3–4 раза больше, чем здоровые, и т. д.
Принципы подбора программ нутриционной поддержки онкопациентов
Важную роль для прогноза и выбора схем нутриционной коррекции играет содержание общей и внеклеточной воды организма (рост этих параметров свидетельствует о рефрактерности усвоения нутриентов). Важными для расчета НП особенностями онкопроцесса (особенно в условиях паллиатива) оказались также стадия опухолевого процесса [5], тип (объем) выполненной операции [6], исходный нутриционный статус, фаза канцерогенеза (инициация, промоция, прогрессия) [5], режим проводимой химиотерапии [7, 8]. Если эти факторы не учитываются, то могут возникнуть метаболические токсические осложнения. Все это способствовало возникновению нового подхода к нутриционной сопроводительной терапии в комплексном лечении опухолей, учитывающего возможности детоксикационной алиментации.
Одно из значимых направлений современного нутриционного сопровождения в онкологии — иммунонутрициология [9–12], диктующая необходимость включать в структуру сопроводительной нутритивной коррекции нутриенты, влияющие на клеточный и гуморальный иммунитет (рис. 1).
![Рис. 1. Различные нутриенты, влияющие на клеточный и гуморальный иммунитет [13] Рис. 1. Различные нутриенты, влияющие на клеточный и гуморальный иммунитет [13]](/upload/medialibrary/057/37-1.png)
Особое внимание необходимо уделять функциональному резерву органов, лимитирующих усвоение. В частности, в ранее выполненных работах нами показано, что при угнетении функций кишечника следует выбирать тактику постепенного нагнетания пищевой нагрузки (вначале применять солевые энтеральные растворы, затем частично гидролизованные составы и лишь потом постепенно переходить к сбалансированным смесям и высокобелковым высокоэнергетическим рационам [14], что позволяет избежать метаболических осложнений и нежелательных дополнительных токсических эффектов. При выборе программ сопроводительной НП также необходимо обращать внимание на характер и объем оперативного вмешательства [6], учитывать влияние на нутритивный статус сопутствующих заболеваний и применяемых для их лечения препаратов. Например, при введении нутритивных смесей в сочетании с анальгетиками опиоидного действия нужно учитывать тормозное действие последних на перистальтику и, как следствие, на процессы всасывания. При таких условиях в состав нутриционных программ вводят смеси с пищевыми волокнами (лактулозой и др.). При подборе схем сопроводительной НП оценивают и микробиом кишечника. Нам удалось выделить 3 типа его изменений, в зависимости от которых программа НП дополнялась соответствующими фармсредствами. При угнетении активности микробиоты мы вводили в программу препарат оболочек семян подорожника овального или метабиотик, при демпингоподобном синдроме — корректоры двигательной активности, при синдроме избыточного бактериального роста — нифуроксазид или его аналоги.
Как известно, в основе модуляции детоксикационного ответа лежат следующие основные механизмы: 1) монооксигеназная система печени; 2) специфическая и неспецифическая иммунная система; 3) выделительная система почек, кишечника, легких. Поэтому для детоксикационной алиментации в схемы сопроводительной НП рекомендуется вводить корректоры микробиоты (бифидобактерии
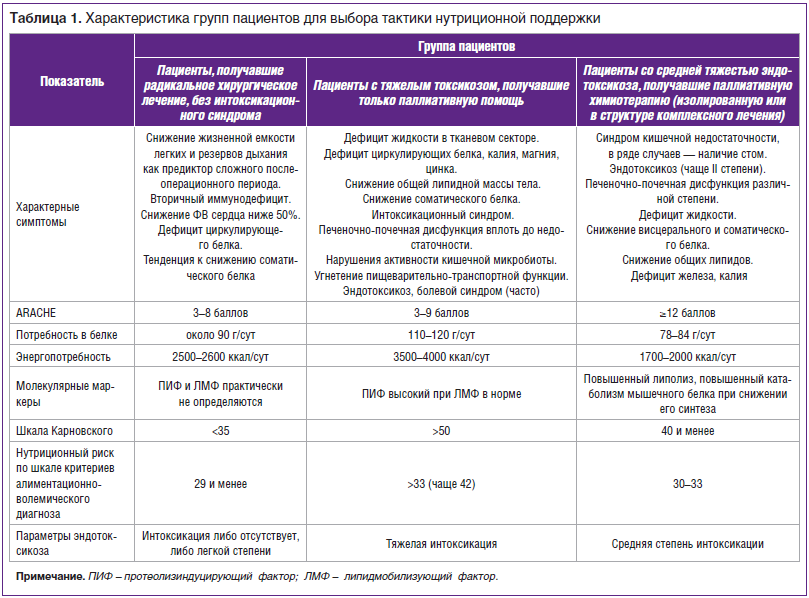
бифидум), противовоспалительные препараты (препараты омега-3 жирных кислот (ЖК)), иммунокорректоры (азоксимера бромид по 6–12 мг 1 р./сут через день в течение 5 дней), нутриенты-детоксиканты (смеси для лечебного питания и иммунопитания до 500 ккал/сут, гепатопротекторы или фосфолипиды в стандартной дозе в течение недели). Остальной необходимый рассчитанный калораж нужно восполнять специализированными сипинговыми смесями для онкопациентов с добавлением диетического рациона. Исходя из перечисленных позиций определяется объем НП и формируются нутриционные программы для онкологических пациентов. В соответствии с обозначенными критериями пациентов подразделяют на группы, каждой из которой соответствуют определенные параметры нутриционного статуса (табл. 1).
Для диагностики и динамического наблюдения за детоксикационной НП следует использовать алиментационно-волемический диагноз. Он включает полное исследование нутриционных параметров и позволяет оценить функциональный резерв органов, лимитирующий усвоение нутриентов, обеспечивающих метаболическую безопасность и предотвращающих развитие интоксикации. По выраженности интоксикацию подразделяют на: 1) легкой степени, которая хорошо поддается терапии; 2) средней степени тяжести с длительным воздействием на системы и органы, с развитием осложнений; 3) тяжелой степени — опасную форму, при которой поражаются все органы и системы, а интенсивный распад опухоли приводит к гибели больного.
Проводя профилактику метаболических осложнений, необходимо учитывать наличие дефицита неэтерифицированных ЖК (НЭЖК), необходимых для синтеза фосфолипидов и построения клеточных структур, в т. ч. митохондрий. Дефицит НЭЖК встречается, по данным литературы, в 30–32% случаев НП и развивается уже через 2–3 дня неправильного парентерального питания без использования липидов (1–2% от калорической потребности надо обеспечивать этими веществами) [15]. В то же время нужно помнить об угрозе синдрома жировой перегрузки (метаболической патологии с развитием гиперлипидемии, лихорадки, гепато- и спленомегалии, анемии, лейкопении, тромбоцитопении, нарушения коагуляции, гемолиза и ретикулоцитоза, отклонения функциональных печеночных тестов). При назначении жировых эмульсий без учета противопоказаний к их назначению (билирубин более 90, липоидный нефроз, гипогликемия, декомпенсированный сахарный диабет и др.) развиваются ятрогенные триглицеридемии. Возможно развитие наведенной азотемии и гипераминоацидемии, когда показаны среды направленного действия (содержащие L-орнитин, L-аспартат).
Исследование эффективности введения сбалансированного инфузионного раствора в схему детоксикационной нутритивной поддержки
Материал и методы
В проспективное слепое исследование включены 57 пациентов с метастазами колоректального рака (КРР) в печень, подвергнутых хирургическому или комбинированному лечению. Все наблюдавшиеся пациенты были сопоставимы по полу и возрасту. В программах нутриционной детоксикации использовали высокобелковые питательные смеси, содержащие омега-3 ЖК, гепатопротектор, аминокислотный состав направленного действия, пробиотики и фосфолипиды. В основной группе (30 пациентов) в программу детоксикационной НП добавляли Ремаксол® из расчета 400 мл со скоростью 40 капель в минуту в течение 10 дней. В контрольной группе (27 пациентов) инфузии Ремаксола не назначались. При этом нутриционную недостаточность оценивали по критериям алиментационно-волемического диагноза, нутриционному риску по NRI. Саркопению оценивали с помощью биоимпедансометрии. Гематологические индексы интоксикации (индексы Кребса, Гаркави, индекс соотношения лейкоцитов и СОЭ — ИЛСОЭ) рассчитывали по рекомендуемым формулам [16–18]. Гепатологические параметры (общий белок, альбумин, билирубин, АЛТ, ЛДГ) определяли по общепринятым методикам. Возможности кишечника в плане детоксикации отслеживали по уровням цитруллина плазмы и активности кишечной микробиоты (по результатам изучения летучих ЖК копрофильтрата). Кроме того, исследовали содержание мочевины и креатинина крови, ее электролитный состав. Тяжесть состояния оценивали по APACHE II, качество жизни — по ECOG. Для объективизации полученных результатов использовали математические методы — факториальный анализ и метод вариационной статистики с применением критерия Стьюдента.
Сопроводительную НП в каждом случае подбирали индивидуально. Описанный нами ранее рост объема внеклеточной и общей жидкости в организме расценивали как прогностически неблагоприятный и также учитывали при инфузионно-нутритивной коррекции, этот фактор влиял на выбор программы именно детоксицирующей алиментации. При этом ятрогенные дисгликемии встречались реже, т. к. инсулинорезистентность даже при хирургическом диабете предусматривала обязательную консультацию пациента эндокринологом [19–20]. В отдельных случаях возникали дизэлектролитемии (дефицит или перегрузка железом, дисбаланс кальция, магния, селена, цинка). В наших наблюдениях у пациентов с КРР чаще встречались корригируемые железодефицитные состояния, тактика при которых нами описана в ряде работ [6]. При выборе сопроводительной НП учитывали также, что в средах парентерального питания нет микро- и макроэлементов. Оценивали выраженность интоксикационного синдрома, который определяет тяжесть состояния, качество жизни и другие функции организма и потребности в нутриентах.
Результаты исследования
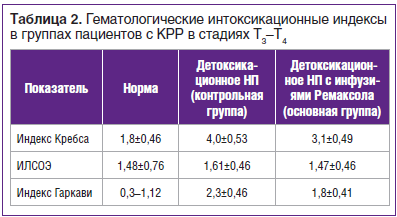
Выявлена связь между нарушениями гомеостаза и развитием эндотоксикоза у пациентов с КРР в стадиях Т3–Т4. Кроме того, определена выраженность гематологических параметров эндотоксикоза при применении традиционной детоксикационной НП и схемы детоксикационной НП с добавлением Ремаксола. Отмечена более выраженная эффективность программы нутриционной детоксикации с применением Ремаксола (табл. 2).
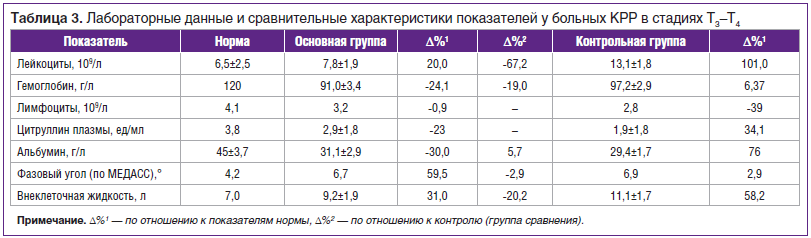
Для большей объективизации течения эндотоксикоза на данном этапе работы мы попытались дать сравнительную количественную оценку его выраженности с привлечением математического аппарата (табл. 3). Для количественной характеристики признаков использовали показатель, отражающий процентное отклонение от нормы исследуемого параметра:
⎛В-А⎞
∆% = -------- 100%,
⎝ А ⎠
где А — начальное, В — измененное значение оцениваемого параметра.
Таким образом, детоксикационная НП с Ремаксолом у оперированных пациентов с КРР, получавших химиотерапию, позволяла более эффективно снижать нарастание нарушений в системе гомеостаза, а частота гепатотоксических осложнений химиотерапии, как и в литературных данных [12], варьировала от 14,3 до 100%. При этом, как видно из факториального анализа, для дальнейшего совершенствования детоксикационных мероприятий может быть использована не только гепатопротекторная коррекция, но и нутритивная, направленная на механизмы кишечной детоксикации, что, как известно, связано с циклом превращений орнитина-цитруллина в безопасную мочевину.
Обсуждение результатов
Следует отметить, что интоксикация, развивающаяся при онкологии, наступает практически у каждого больного. Связано это с тем, что при злокачественных новообразованиях нарушаются процессы нормального метаболизма, и в тканях, и в биологических жидкостях организма накапливаются токсические эндогенные элементы. Эндогенное отравление при онкологии обусловливают одновременно сразу нескольких провоцирующих факторов: а) нарушение процессов метаболизма; б) распад злокачественной опухоли; в) накопление применяемых во время лечения лекарственных препаратов; г) выделение опухолями специфических веществ (PIF и др.), иммуносупрессантов; д) осложнения химио- или лучевой терапии; е) метаболические осложнения нутритивной коррекции. Понятно, что причиной интоксикации организма при онкологии на ранних стадиях является циркуляция продуктов метаболизма клеток новообразования в крови, на поздних стадиях — распад опухоли. При распаде опухоли в крови происходят значимые электролитные и обменные нарушения (табл. 4).
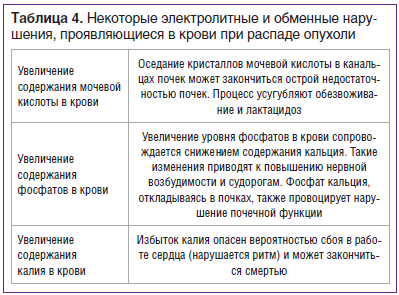
Продукты метаболизма распадающейся опухоли повреждают мембранные структуры нормальных клеток различных органов, инициируют перекисное окисление жиров, образуют опасные частицы — свободные радикалы, в результате повреждающего действия которых у больных, страдающих раком, отмечается склонность к гемолизу эритроцитов, снижается уровень гемоглобина. При интоксикации организма у онкологических больных наблюдаются общие симптомы: головная боль, повышение температуры, тошнота, рвота, неустойчивый стул, пониженный аппетит, слабость, утомляемость, сонливость, ощущение перебоев в сердце, тахикардия, перепады артериального давления, снижение массы тела, бледность, акроцианоз, синюшность губ, одышка, признаки почечной и печеночной недостаточности, лейкоцитоз, повышение СОЭ, снижение уровня белка, эритроцитов и пр.
Профилактика и лечение раковой интоксикации довольно сложны. Необходимо регулярно следить за содержанием электролитов, функцией печени и почек, контролировать уровень гемоглобина и свертывающую способность крови. Необходимо учитывать и дополнительные патогенетические механизмы, участвующие в развитии интоксикации: 1) изменения в гепатоэнтеральной циркуляции;
2) изменения в традиционных детоксикационных системах; 3) сдвиги в спектре микробиоты кишечника. Помимо употребления жидкости в достаточном объеме, своевременного опорожнения кишечника, контроля состояния сердечной деятельности показано детоксикационное питание — еще одно новое направление онконутрициологии.
Для оценки тяжести раковой интоксикации применяют, как правило, стандартные показатели, используя при этом различные шкалы. Оцениваются также степень тяжести гепатотоксичности и частота гепатотоксических реакций при применении различных противоопухолевых препаратов [7]. Традиционно лечение раковой интоксикации симптоматическое, включает, как правило, противорвотные препараты, слабительные средства, клизмы (при неэффективности слабительных препаратов), сорбенты, препараты железа при анемии, нестероидные противовоспалительные, антиаритмические, седативные препараты, энтеросорбцию, при наличии тяжелых электролитных нарушений — гемодиализ или плазмаферез.
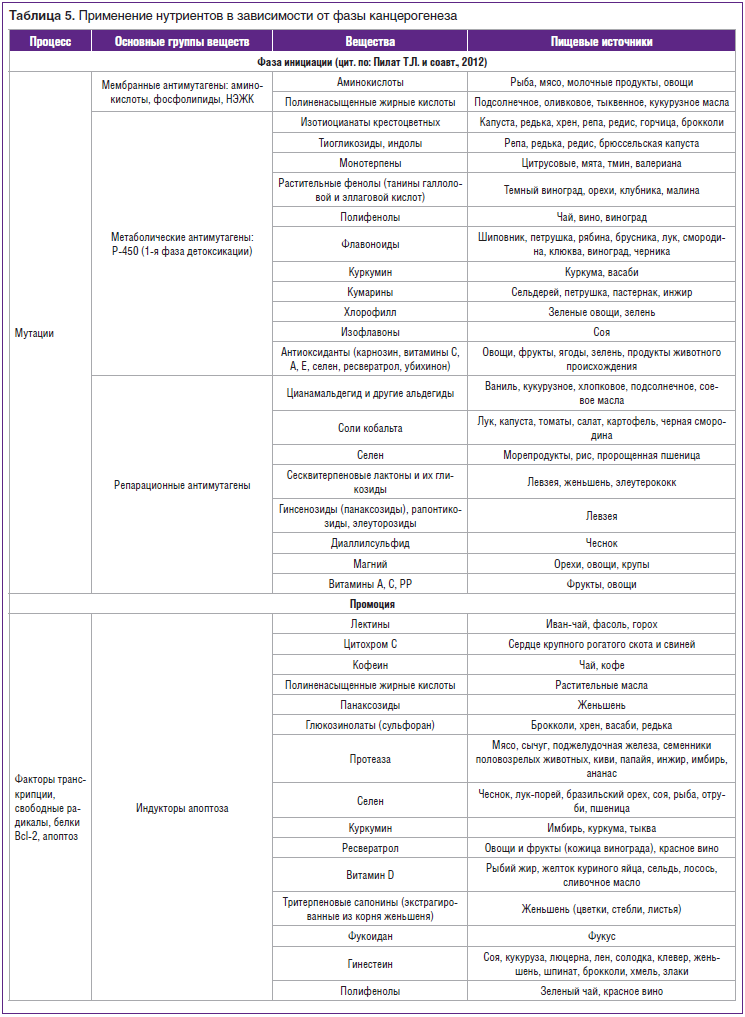
Однако к настоящему времени исследованы и некоторые факторы диеты, влияющие на эндогенную продукцию N-нитрозокомпонентов, многие из которых обладают выраженной канцерогенной и мутагенной активностью. Так, показано, что добавление в пищу бифидогенных факторов — олигосахаридов сои — приводит к значительному снижению содержания общих N-нитрозокомпонентов в фекалиях крыс [21, 22]. Выявлена и детоксикационная роль белков натуральных продуктов за счет специфической системы биоадсорбции для глутатиона [23], липидов омега-3 [24], углеводов через образование глюкуроновой кислоты и НАДФ-Н [25]. Имеется ряд рекомендаций по использованию натуральных нутриентов в зависимости от фазы канцерогенеза (табл. 5).
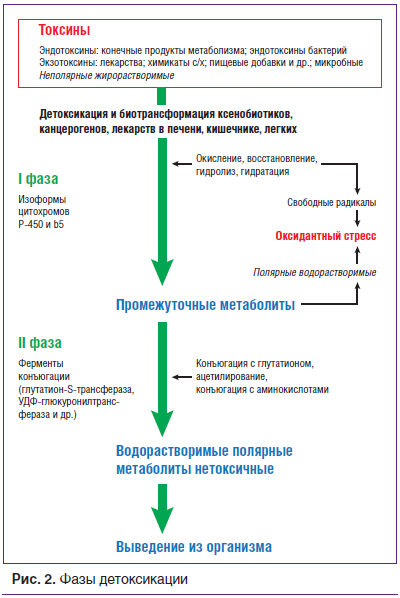
В целом препаратов и нутриентов-детоксикантов гепатопротекторного действия достаточно много, механизм действия их весьма разнообразен. До настоящего времени не сложилась их единая классификация, видимо, из-за того, что их строение и место приложения действия довольно сильно различаются. К гепатопротекторным средствам относят витамины группы В, витамин Е, аминокислоты (особенно карнитин, орнитин, метионин), бетаин, желчегонные препараты, углеводы, флавоноиды, органические кислоты, метилурацил. Эти препараты можно разделить на группы: растительные препараты; препараты животного происхождения; минеральные препараты; синтетические препараты. Разделяют и фармаконутриенты, влияющие на определенную фазу детоксикации. Например, глутамил-цистеинил-глицин динатрия стимулирует ферменты 2-й фазы детоксикации (рис. 2) в клетках печени (гемооксигеназа-1, Г6ФД, глутатионредуктаза) и, как следствие, способствует нейтрализации токсических продуктов, в т. ч. образующихся при гибели раковых клеток. Этот препарат восстанавливает утраченную при химиотерапии и раковой интоксикации чувствительность рецепторов к циркулирующим в крови цитокинам (фактор некроза опухоли, интерлейкин 1 и др.).
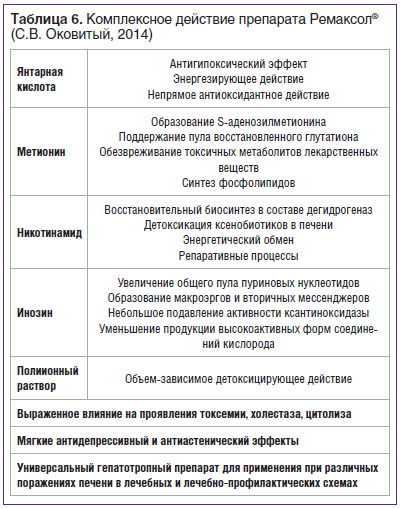
Использованный нами в структуре программы нутриционной детоксикации Ремаксол® обладает одновременно целым рядом эффектов. В состав Ремаксола входят действующие вещества: янтарная кислота (5,28 г), метионин (0,75 г), инозин (2,0 г), никотинамид (0,25 г); N-метилглюкамин (8,725 г) в качестве трансмембранного переносчика, а также вспомогательные вещества: натрия хлорид 6,0 г, калия хлорид 0,3 г, магния хлорид 0,12 г, натрия гидроксид 1,788 г, вода для инъекций до 1 л.
Благодаря такому комплексу удачно подобранных компонентов (табл. 6) Ремаксол®, как показало исследование, успешно включается, помимо корректоров микробиоты, противовоспалительных нутриентов, иммунокорректоров, в протоколы алиментационной детоксикации, что позволяет предотвратить метаболические осложнения при проведении базового лечения КРР.
В последние годы появилась метаболическая эррология — наука о метаболических осложнениях (в т. ч. ятрогенных), к которым можно отнести, как указывалось выше, синдром жировой перегрузки, дефицит НЭЖК [11], наведенную азотемию, гипераминоацидемию, дисгидрии, ятрогенные дисгликемии [19, 20], тяжелую, резистентную к коррекции белково-энергетическую недостаточность [21, 26], дизэлектролитемии (в т. ч. весьма опасный дефицит циркулирующего калия, натрия, магния и др., железодефицит или гемосидероз, дефициты других электролитов и микроэлементов и т. д.). В результате таких осложнений возникают различные дефицитные состояния и интоксикационные синдромы. Их контролю служит одно из направлений метаболической эррологии, объединяющее детоксикационное питание, детоксикационную нутриционную коррекцию, особенно необходимую для пациентов с онкологическими заболеваниями пищеварительного аппарата.
Выводы
Сопроводительная НП — одно из перспективных направлений персонализированного лечения, в частности при опухолях пищеварительного тракта (КРР).
Детоксикационная НП при КРР способствует существенному очищению организма от токсикантов.
Для выведения токсикантов целесообразно дополнять стандартные методики детоксикации составами нутриционного действия для сипинга с детоксицирующими составляющими и гепатопротекторным действием.
Перспективным представляется исследование расширения возможностей детоксикационной НП в структуре терапии сопровождения.












