По данным исследования ECAS (2004), анемия развивается у 39–68% онкологических пациентов, при этом у 75% больных анемия развивается вследствие проведения химиотерапии [1]. Анемия при онкологических заболеваниях (АОЗ) определяется как снижение концентрации гемоглобина ниже нормальных значений, обусловленное как наличием самой опухоли, так и проводимым лечением.
Согласно критериям токсичности по шкале CTC v.4, 1 степень анемии представляет собой снижение концентрации гемоглобина от нормы до 10 г/дл, 2 степень – 8–10 г/дл, 3 степень – 6,5–8 г/дл, 4 степень – наличие жизнеугрожающих состояний.
Анемия у онкологических больных может развиваться вследствие различных причин, наиболее частыми являются:
– недостаток железа и витаминов (чаще всего);
– наличие опухоли (инфильтрация костного мозга, кровотечение, гиперспленизм, анемия хронических заболеваний);
– противоопухолевое лечение (обширная лучевая терапия, проведение химиотерапии и т.д.);
– сопутствующие заболевания (гемоглобинопатии, заболевания почек и др.).
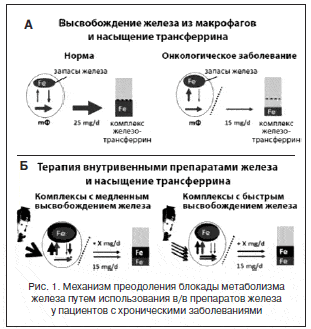
АОЗ является результатом сложных патофизиологических и патохимических процессов, центральная роль в которых отводится синтезируемому в печени универсальному гуморальному регулятору метаболизма железа – пептиду гепсидину. В норме гепсидин, прежде всего, обладает ярко выраженными антибактериальными свойствами и является пептидом каскада реакций ответа острой фазы. Однако благодаря современным генно-инженерным технологиям удалось выяснить, что роль гепсидина в организме значительно многограннее. Так, например, было показано, что гепсидин является отрицательным регулятором захвата железа в тонкой кишке и блокирует железо в макрофагах [2]. Эти данные согласуются с результатами других исследований [3–5]. Е. Nemeth и соавт. исследовали уровень гепсидина и некоторых цитокинов у добровольцев с воспалением, вызванным введением липополисахарида (ЛПС). Было показано, что вскоре после введения агента воспаления происходит увеличение значений провоспалительного цитокина – интерлейкина (ИЛ)-6, а также резко повышаются уровни интерферона (ИФН), фактора некроза опухоли-альфа (ФНОα) и ИЛ-1β. Также отмечается повышение экспрессии мРНК гепсидина в несколько тысяч раз и снижение уровня железа в сыворотке.
В результате этих экспериментов E. Nemeth и соавт. предположили, что ИЛ-1 стимулирует синтез лактоферрина (ЛФ), который связывает железо с большей аффинностью, чем трансферрин, и железо, связанное с ЛФ, захватывается макрофагами и хранится в форме ферритина, тем самым затрудняя соединение железа с эритроидными клетками. Затем повышается уровень ИЛ-6, который активирует экспрессию гепсидина, что приводит к уменьшению абсорбции железа в кишечнике и увеличению его секвестрации в макрофагах. Та же ситуация наблюдается при опухолях: у пациента развивается анемия, повышаются уровни гепсидина, ферритина и ИЛ-6 [6]. Это еще раз подтверждает положение о том, что высокий уровень гепсидина подавляет эритропоэз путем истощения запасов железа. В отдаленном периоде это приводит к абсолютному железодефициту в организме вследствие нарушения его усваиваемости из пищи или применяемых внутрь препаратов. Если гепсидиновый блок существует недолго, то это может привести к функциональному железодефициту – состоянию, при котором железо не может быть эффективно мобилизовано из запасов в ретикулоэндотелиальной системе [7, 8]. По сравнению с ежедневным количеством высвобождаемого из макрофагов 25 мг железа у здоровых людей у пациентов с воспалением эта цифра снижается до ~15 мг в сутки [7]. По данным G. Fillet и соавт., при наличии воспалительного процесса (в т.ч. и опухолевой патологии) снижение высвобождения железа составляет до 44% по сравнению с нормой (рис. 1) [9]. Таким образом, даже у пациентов с достаточными запасами железа могут возникнуть ситуации с уменьшением его доступного количества, особенно в случае быстрого роста числа эритроцитов крови при применении стимуляторов эритропоэза [7].
У таких пациентов могут быть эффективными стабильные карбогидратные комплексы в/в препаратов железа, которые осуществляют высвобождение железа в течение длительного периода времени, так что большие дозы железа могут быть введены однократно, в то время как менее стабильные комплексы быстро разрушаются макрофагами и, таким образом, требуют многократного введения в низких дозах [10].
Таким образом, из вышеописанных механизмов развития анемии и железодефицита при онкологических заболеваниях можно сделать вывод об отсутствии эффективности пероральных лекарственных форм железа у пациентов с АОЗ. Дальнейшими исследованиями данное предположение было подтверждено. Dangsuvan и соавт. в рандомизированном исследовании сравнивали эффективность в/в (сахарат железа) и пероральных препаратов железа для больных, не получавших эритропоэтины. В исследование были включены 44 пациентки с анемией, обусловленной проведением химиотерапии. Потребность в проведении гемотрансфузии (ГТ) в группе пациенток, получавших в/в препарат железа, составила 22,7% в отличие от 63,6% пациенток, получавших пероральный препарат железа [11].
Диагностические маркеры
дефицита железа
Ферритин сыворотки (СФ) крови является наиболее часто используемым диагностическим маркером, который в основном отражает состояние запасов железа, в то время как уровень насыщения трансферрина железом (НТЖ), процентное содержание гипохромных эритроцитов (%HYPO) и содержание гемоглобина в ретикулоцитах (CHr) лучше отражают степень биодоступности железа [7]. Поскольку уровень СФ может повышаться в связи с воспалением или деструкцией гепатоцитов, нормальный или высокий уровень ферритина не обязательно отражает наличие достаточных запасов железа, особенно у онкологических больных [12]. Следовательно, рутинный анализ крови должен также включать исследование уровня С-реактивного белка (СРБ) и аланинаминотрансферазы (АЛАТ) для выявления воспаления или нарушения функции печени. Анализ уровня растворимых рецепторов трансферрина, недавно предложенный для выбора тактики лечения онкологических больных (эритропоэз-стимулирующие препараты (ЭСП), только препараты железа или их комбинация), скорее отражает активность эритропоэза, чем содержание железа, и поэтому не может быть использован для оценки уровня железа при применении ЭСП [13, 14].
Таким образом, в рутинной клинической практике для диагностики дефицита железа необходимо исследовать следующие показатели: уровень сывороточного железа, степень насыщения трансферрина железом и уровень сывороточного ферритина. В настоящее время используют следующие определения нарушений статуса железа:
1) абсолютный дефицит железа: НТЖ <20% и СФ <100 нг/мл;
2) функциональный дефицит железа: НТЖ <20% и ферритин сыворотки 100–800 нг/мл.
В Руководстве NCCN пересмотра 2013 г. в/в введение препаратов железа рекомендуется онкологическим пациентам с абсолютным дефицитом железа (СФ <30 нг/мл и НТЖ <15%). Для пациентов с функциональным дефицитом железа (ферритин сыворотки ≤800 нг/мл и НТЖ <50%) следует предусмотреть назначение в/в препарата железа в комбинации с препаратом, стимулирующим эритропоэз [15]. Согласно рекомендациям ROHS/RUSSCO, абсолютный железодефицит определяется при СФ <100 нг/мл и НТЖ<20%, функциональный железодефицит – при СФ 100–800 нг/мл и НТЖ <20% [16].
Основные методы коррекции
анемии и дефицита железа
при онкологических заболеваниях
В настоящее время для лечения анемии у больных со злокачественными новообразованиями используются ГТ и ЭСП, обычно в сочетании с в/в введением препаратов железа [7].
Проведение ГТ, как правило, используется в случаях выраженной анемии, когда необходимо быстро повысить уровень гемоглобина и значительно уменьшить симптомы анемии. Целью ГТ при хронической гемодинамически стабильной анемии, без острого коронарного синдрома и при отсутствии симптомов, является увеличение уровня гемоглобина до 7–9 г/дл. При наличии симптомов анемии (тахикардия, тахипноэ, гипотензия и т.д.) и уровне гемоглобина <10 г/дл ГТ проводятся для купирования симптомов и коррекции уровня гемоглобина в пределах 8– 10 г/дл. Цель ГТ при остром коронарном синдроме или остром инфаркте миокарда – увеличение уровня Hb ≥10 г/дл. При анемии без выраженной сопутствующей патологии проведение ГТ не требуется [11].
Однако переливание эритроцитарной массы дает кратковременный эффект и сопровождается риском развития целого ряда нежелательных явлений, что отражено в многочисленных международных исследованиях [11]. В частности, L.M. Williamson и соавт. провели анализ 366 случаев серьезных нежелательных реакций и смертельных исходов в Великобритании и Ирландии, связанных с ГТ, и установили, что в 52% случаев переливались несовместимые компоненты крови, в 15% – отмечались острые, а в 14% – отсроченные трансфузионные реакции, в 8% – острая легочная недостаточность, в 6% – посттрансфузионная пурпура, в 3% – инфекции, передаваемые при ГТ, в 2% – реакции «трансплантат против хозяина» [17]. Кроме того, следует отметить, что при проведении ГТ достаточно часто возникают застойная сердечная недостаточность, аллоиммунизация, перегрузка железом, перегрузка объемом, нарушение гомеостаза. Существует риск инфекционных осложнений и развития таких заболеваний, как вирусные гепатиты, ВИЧ и др. A. Khorana и соавт. в исследовании, проведенном с 1995 по 2003 г. в 60 медицинских центрах США, показали, что ГТ значительно увеличивают риски смерти и тромбоэмболических осложнений [18]. Таким образом, переливание крови быстро повышает концентрацию гемоглобина, но не воздействует на основную причину анемии и не подходит для терапии хронической анемии у онкологических больных.
Потребность в ГТ у пациентов с онкологическими заболеваниями может быть снижена путем применения ЭCП, однако гематологический ответ на их применение довольно ограничен (30–75%). Более того, данные клинических исследований, систематических обзоров и метаанализов вызывают беспокойство в связи с увеличением риска возникновения тромбоэмболий и повышением риска смерти у больных при использовании ЭСП, особенно без четких показаний [19].
Согласно действующим клиническим рекомендациям (ESMO, 2010; ASCO, 2010) по лечению анемии у онкологических больных, применение в/в препаратов железа улучшает эффективность терапии ЭСП у пациентов с абсолютным или функциональным железодефицитом [20, 28]. Национальная всеобщая онкологическая сеть (The National Comprehensive Cancer Network – NCCN) предлагает рассматривать возможность применения в/в препаратов железа у пациентов с ФЖД, уровнем сывороточного ферритина до 800 нг/мл при уровне НТЖ менее 50%; наличие активного инфекционного процесса является единственным противопоказанием для их использования. Поскольку у пациентов с анемией и достаточными запасами железа эффект от использования в/в препаратов железа может появиться только после начала терапии ЭСП, у них рекомендуется проводить оценку обмена железа исходно, перед началом каждого цикла химиотерапии и в процессе лечения анемии, для того чтобы своевременно начать применение препаратов железа.
F. Petrelli и соавт. (2011) провели анализ 8 рандомизированных проспективных контролируемых исследований, в которых у онкологических пациентов с анемией сравнивалась эффективность и безопасность применения в/в, пероральных препаратов железа совместно с ЭСП либо только ЭСП без применения препаратов железа. В метаанализ были включены 1606 пациентов. Вероятность достижения гематологического ответа при применении парентеральных препаратов железа составила 1,29 (p=0,0001) и 1,04 (р=0,59) – при приеме пероральных препаратов железа. Также применение парентеральных препаратов железа по сравнению с монотерапией ЭСП способствовало снижению потребности в ГТ (р=0,02) и ускорению достижения ответа. Таким образом, в ходе анализа было показано, что в/в введение препаратов железа в сочетании с ЭСП статистически значимо способствует приросту уровня гемоглобина и уменьшает потребность в ГТ [21].
В настоящее время в России используются 4 препарата железа для в/в введения: карбоксимальтозат железа (КМЖ, «Феринжект®»), сахарат железа, глюконат железа и декстран железа. Использование декстрана железа значительно ограничено в связи с развитием большого числа анафилактических реакций с высокой летальностью в 13,5% случаев [22]. Несколько меньше значимых осложнений вызывает применение глюконата железа, однако токсические эффекты свободного железа, поступающего в кровь, существенно ограничивают его применение в рутинной практике при лечении железодефицитной анемии [29].
Сахарат железа широко используется в клинической практике для восстановления недостатка железа. Он достаточно безопасен и хорошо переносится. Максимальная разовая доза сахарата железа составляет 7 мг/кг, время ее введения – 3,5 ч. Препарат вводится 1–3 раза в неделю [23].
В настоящее время для лечения анемии и дефицита железа широко используется наиболее безопасный и эффективный препарат – карбоксимальтозат железа («Феринжект®»). Его преимуществом является возможность введения высоких доз (до 1000 мг за 1 инфузию) за относительно небольшой промежуток времени (максимальная разовая доза для в/в инъекции – 200 мг – вводится болюсно, максимальная доза для инфузии – 1000 мг – вводится капельно в течение 15 мин.). После парентерального введения макромолекулярный комплекс захватывается ретикулоэндотелиальной системой и распадается на железо и карбоксимальтозу. Железо попадает в кровоток, где связывается с трансферрином и переносится к клеткам организма, в которых используется для синтеза гемоглобина, миоглобина или накапливается в виде ферритина. После введения препарат распределяется в костном мозге и депонируется в ретикулоэндотелиальной системе печени и селезенки. Показанием к проведению терапии является лабораторно подтвержденная железодефицитная анемия. Нежелательные реакции на введение «Феринжекта» развиваются очень редко, что выгодно отличает его от других препаратов железа [24].
Эффективность препарата подтверждена большим количеством клинических исследований. Так, R. Moore и соавт. провели метаанализ 14 рандомизированных клинических исследований, в которых 2348 пациентов получали карбоксимальтозат железа в дозе до 1000 мг в неделю. Пациентам групп сравнения назначали соответственно: сахарат железа в/в (n=384), пероральные препараты железа (п=832) и плацебо (n=762). Длительность лечения составляла от 1 до 24 нед. По сравнению с пероральными препаратами в/в введение карбоксимальтозата железа привело к более значительному увеличению средних уровней гемоглобина, ферритина и степени насыщения трансферрина. В группе пациентов, использующих карбоксимальтозат железа («Феринжект®»), по сравнению с группой, получающей пероральные препараты железа, наблюдалось достоверно значимое снижение частоты желудочно-кишечных расстройств (13 и 32% соответственно), в т.ч. запора, тошноты/рвоты и диареи. В целом результаты метаанализа подтвердили более высокую эффективность и лучшую переносимость карбоксимальтозата железа по сравнению с пероральными препаратами железа [25].
T. Steinmetz и соавт. (2013) провели крупное исследование с участием 639 пациентов с опухолями различной локализации. Пациенты получали карбоксимальтозат железа согласно назначениям лечащего врача. Средняя вводимая доза препарата составила 1000 мг. Прирост уровня гемоглобина был сопоставим у пациентов, получавших только КМЖ и КМЖ совместно с ЭСП. Кроме этого, у пациентов с низким исходным уровнем ферритина (<500 нг/мл), НТЖ (<30%) и гемоглобина (<11 г/дл) гематологический ответ на терапию был более выраженным. При этом в группе пациентов, получавших КМЖ, нежелательные явления развились в 2,3% случаев. Таким образом, была подтверждена важная роль препаратов железа (в частности, КМЖ) в лечении железодефицита и анемии у пациентов с онкологическими заболеваниями [26].
Таким образом, сочетанное использование в/в препаратов железа и рекомбинантных ЭCП является одним из основных методов лечения анемии, обусловленной проведением химиотерапии. При этом отмечается быстрая коррекция уровня гемоглобина, снижается потребность в ГТ, происходит значительное улучшение качества жизни пациентов с анемией [27]. Соблюдение клинических рекомендаций позволит безопасно и эффективно использовать возможности данной терапии и получить от них максимальную пользу.
Литература
1. Ludwig H., Van Belle S., Barret-Lee p. et al. The European Cancer Anaemia Survey (ECAS): A large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients // Eur. J. Cancer. 2004. Vol. 40. P. 2293–2306.
2. Левина А.А., Казюкова Т.В., Цветаева Н.В. и др. Гепсидин как регулятор гомеостаза железа // Педиатрия. 2008. № 87(1). С. 67–74.
3. Steensma D.P. Is anaemia of cancer different from chemotherapy-induced anaemia // J. Clin. Oncol. 2008. Vol. 26. P. 1022–1024.
4. Adamson J. The anaemia of inflammation/malignancy: mechanism and management // Hematol. Am. Soc. Haematol. Educ. Program. 2008. P.159–165.
5. Groopman J., Itri L. Chemotherapy-induced anemia in adults: incidence and treatment // J. Nat. Cancer Inst. 1999. Vol. 91. P. 1616–1634.
6. Nemeth E., Rivera S., Gabayan V et al. IL-6 mediates hypoferremia of inflammation
by inducing the synthesis of the iron regulatory hormone hepcidin // J. Clin. Invest. 2004. Vol. 113. P. 1271–1276.
7. Aapro M., Osteborg A., Gascon P. et al. Prevalence and management of cancer-related anaemia, iron deficiency and the specific role of i.v. iron // Ann. Oncol. 2012. Vol. 23. P. 1954–1962.
8. Weiss G., Goodnough L.T. Anemia of chronic disease // N. Engl. J. Med. 2005. Vol. 352. P. 1011–1023.
9. Fillet G., Beguin Y., Baldelli L. Model of reticuloendothelial iron metabolism in humans: abnormal behavior in idiopathic hemochromatosis and in inflammation // Blood. 1989. Vol. 74. P. 844– 851.
10. Van Wyck D., Anderson J., Johnson K. Labile iron in parenteral iron formulations: a quantitative and comparative study // Nephrol. Dial. Transplant. 2004. Vol. 19. P. 561–565.
11. Dangsuwan P., Manchana T. Blood transfusion reduction with intravenous iron in gynecologic cancer patients receiving chemotherapy // Gynecol. Oncol. 2010. Vol. 116(3). P. 522–525.
12. Beguin Y. Prediction of response and other improvements on the limitations of recombinant human erythropoietin therapy in anemic cancer patients // Haematol. 2002. Vol. 87. P. 1209–1221.
13. Steinmetz H.T., Tsamaloukas A., Schmitz S. et al. A new concept for the differential diagnosis and therapy of anaemia in cancer patients // Support. Care Cancer. 2010. Vol. 19. P. 261–269.
14. Thomas C., Kirschbaum A., Boehm D. et al. The diagnostic plot: a concept for identifying different states of iron deficiency and monitoring the response to epoetin therapy // Med. Oncol. 2006. Vol. 23. P. 23–36.
15. NCCN clinical practice guidelines. Cancer- and chemotherapy-induced anemia. V1 2013. Available at http://www.nccn.org
16. Совет экспертов Российского общества онкогематологов (ROHS), Общества онкологов-химиотерапевтов (RUSSCO), Российская медицинская академия последипломного образования (РМАПО). Клинические рекомендации по лечению анемии у больных злокачественными новообразованиями. М., 2013.
17. Williamson L.M., Lowe S., Love M. Serious Hazards of Transfusion (SHOT) initiative // BMJ. 1999. Vol. 319 (7201). P. 16–19.
18. Khorana A., Francis C., Blumberg N. et al. Blood transfusions, thrombosis and mortality in hospitalized patients with cancer // Arch. Intern. Med. 2008. Vol. 168. P. 2377–2381.
19. Rizzo J.D., Brouwers M., Hurley P. et al. American Society of Hematology/AmericanSociety of Clinical Oncology clinical practice guideline update on the use of epoetin and darbepoetin in adult patients with cancer // Blood. 2010. Vol. 116. P. 4045–4059.
20. Schrijvers D., De Samblanx H., Roila F. Erythropoiesis-stimulating agents in the treatment of anaemia in cancer patients: ESMO Clinical Practice Guidelines for use // Ann. Oncol. 2010. Vol. 21 (Suppl. 5). P. 244–247.
21. Petrelli F., Borgonovo K., Cabiddu M. et al. Addition of iron to erythropoiesis-stimulating agents in cancer patients: a meta-analysis of randomized trials // J. Cancer Res. Clin. Oncol. 2012. Vol. 138. P. 179–187.
22. Faich G., Strobos J. Sodium ferric gluconate complex in sucrose: safer intravenous iron therapy than iron dextrans // Am. J. Kidney Dis. 1999. Vol. 33(3). P. 464–470.
23. Венофер. Инструкция по медицинскому применению.
24. Феринжект. Инструкция по медицинскому применению.
25. Moore R., Gaskell H., Rose P. et al. Meta-analysis of efficacy and safety of intravenous ferric carboxymaltose (Ferinject) from clinical trial reports and published trial data // BMC Blood. Disord. 2011.
26. Steinmetz T., Tschechne B., Harlin O. et al. Clinical experience with ferric carboxymaltose in the treatment of cancer- and chemotherapy-associated anaemia // Ann. Oncol. 2013. Vol. 24. P. 475–482.
27. Птушкин В.В. Анемия в онкологии, подходы к лечению // Современная онкология. 2012. № 1(14). С. 14–18.
28. Rizzo J.D., Brouwers M., Hurley P. et al. American Society of Clinical Oncology/American Society of Hematology Clinical Practice Guideline Update on the Use of Epoetin and Darbepoetin in Adult Patients With Cancer. http://jco.ascopubs.org/cgi/doi/10.1200/JCO.2010.29.2201
29. Crishton R.R., Danielson B.G., Geisser P. Iron therapy with special emphasis on intravenous administration. 4th edition. London, Bioston: International Medical Publishers, 2008.












