Эпителий синусов и носовой полости ответственен за нормальное функционирование мукоцилиарного аппарата, удаляющего патогенные объекты из носовой полости и синусов [1]. Мукоцилиарный клиренс зависит от биологических качеств жидкости, покрывающей дыхательные пути (ЖПДП). Состав ЖПДП регулируется транспортом ионов, в частности ионов хлорида [2]. Нарушения транспорта ионов хлорида приводят к дегидратации ЖПДП и нарушению удаления слизи, что, в частности, имеет место при таком тяжелом заболевании верхних дыхательных путей, как муковисцидоз. Наличие дегидратированной густой слизи повышает риск развития бактериальных инфекций и ведет к хроническому риносинуситу (ХРС), рефрактерному к медикаментозному лечению [3].
Практическим следствием понимания данного механизма стала разработка препаратов, увеличивающих транспорт ионов и, таким образом, улучшающих гидратацию слизи и мукоцилиарный транспорт. Препараты, стимулирующие транспорт ионов хлорида, а точнее те из них, которые активируют регулятор трансмембранной проводимости, функция которого нарушена при муковисцидозе, в настоящее время являются предметом активных исследований. Целый ряд флавоноидов оказывает действие на данный регулятор [4]. Следует отметить, впрочем, что несмотря на многообещающие результаты первых исследований in vitro, количество исследований in vivo продолжает оставаться небольшим, что, в частности, объясняется быстрым метаболизмом многих стимуляторов транспорта ионов хлорида [5].
Синупрет® [Bionorica, LLC, San Clemente, CA] является лекарственным препаратом растительного происхождения, в течение многих лет широко применяемым в лечении синусита, а также острого и хронического бронхита в Германии и других европейских странах. В сочетании с антибактериальными препаратами Синупрет® снижает выраженность острых симптомов синусита [6]. Препарат содержит экстракты 5 растений: цветов самбука (Sambucus nigra, Caprifoliaceae), цветов примулы (Primula veris, Primulaceae), щавеля обыкновенного (Rumex acetosa, Polygonaceae), вербены аптечной (Verbena officinalis, Verbenaceae) и корня горечавки (Gentiana lutea, Gentianaceae). Клинические эффекты данного препарата связывают с содержащимися в нем натуральными биофлавоноидами.
В связи с низкой эффективностью традиционных средств в лечении ХРС лекарственные препараты растительного происхождения приобретают все большую популярность и все чаще используются для лечения риносинуситов [7]. Часть (32%) пациентов с ХРС когда–либо получали растительные препараты в качестве монотерапии или как элемент комбинированного лечения [8]. В то же время молекулярные механизмы действия Синупрета® и других лекарственных препаратов растительного происхождения изучены плохо. Целью настоящего исследования являлось изучение действия Синупрета® на транспорт ионов хлора в культуре эпителия носовой перегородки мыши, а также оценка различия потенциалов в носовом эпителии мыши. Гипотезой, лежавшей в основе нашей работы, являлось предположение о том, что Синупрет® увеличивает перенос ионов хлорида как in vivo, так и in vitro.
Материалы и методы
Проведение настоящего исследования было одобрено местным этическим комитетом.
Клеточные культуры
Мы использовали культуру носового эпителия мыши [7]. Методика получения подобной культуры была нами описана ранее [1,9–12]. Ткани были получены у генетически идентичных мышей С57 и выращены на фильтрах Costar диаметром 6,5 мм (Corning, Kennebunk, ME). Питательную среду удаляли на четвертый день после слияния клеток, после чего культура получала питание со стороны основания. Нами были исследованы 76 фильтров с полностью дифференцированными клетками. Дифференциация наступала в течение 10–14 дней.
Электрофизиология
Растворы и реагенты. Применявшийся нами раствор содержал (в ммоль/л) 120 NaCl, 25 NaHCO3, 3,3 KH2PO4, 0,8 K2HPO4, 1,2 MgCL2, 1,2 CaCl2 и 10 глюкозы. Данный раствор имел рН от 7,3 до 7,4 в атмосфере, состоящей из 95% кислорода и 5% углекислого газа при температуре 37оС. Все реагенты были предоставлены компанией Sigma (St. Louis, MO). Все эксперименты выполняли с низкой концентрацией хлорида (6 ммоль/л). Нами исследованы следующие концентрации препаратов: Синупрет® (1 мкг/мл, 100 мкг/мл, 1000 мкг/мл, 2,5 мг/мл), амилорид (100 мкМ), форсколин (2 мкМ) и INH–172 (10 мкМ). Таблетки Синупрета® растворяли в диметилсульфоксиде (ДМСО), после чего раствор фильтровали для удаления нерастворимых элементов.
Для оценки изменений транспорта ионов использовали методику регистрации изменений электрической проводимости раствора и клеточной культуры. При исследовании различий потенциалов в носовом эпителии мыши мы применяли трехступенчатый протокол, описанный ранее [13]. На первом этапе носовые полости анестезированных мышей промывали раствором Рингера, содержащим 140 ммоль/л NaCl, 5 ммоль/л KCl, 1 ммоль/л MgCl2, 2 ммоль/л CaCl2, 10 ммоль/л HEPES и амилорида 100 мкмоль/л (pH 7,3). Затем вводили раствор с низким содержанием хлорида (ммоль N–метил–D–глюкозамин [НМДГ], 6 ммоль Cl–, pH 7,3). Каналы ионов хлорида активировали Синупретом® в дозе 2,5 мг/мл или форсколином 20 мкмоль/л. В качестве контроля использовали раствор ДМСО. В связи с постоянным присутствием амилорида и полным замещением ионов натрия катионом, не проникающим через мембрану (НМДГ), гиперполяризация являлась следствием секреции хлорида, а не абсорбции катионов. Все анализы проводились вслепую.
Статистический анализ
Статистический анализ полученных данных проводили с применением критерия Стьюдента и дискриминантного анализа.
Результаты
Перемещение ионов хлора значительно вырастало на фоне контакта исследовавшейся культуры клеток с раствором Синупрета®.
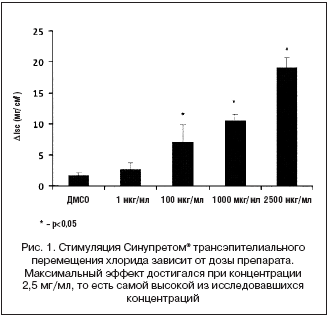
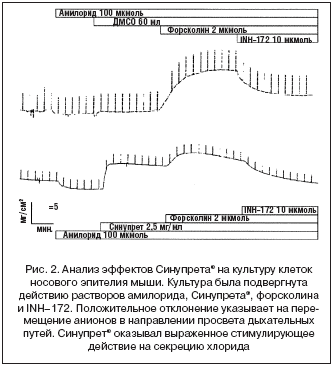
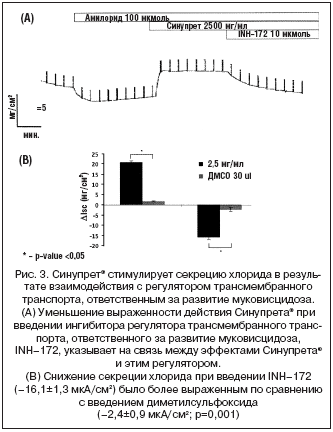
Данный эффект зависел от дозы, и его максимальная выраженность была отмечена при концентрации 2,5 мг/мл (рис. 1). Несмотря на то, что Синупрет вызывал существенную активацию перемещения хлорида, достигаемый уровень не был максимальным, так как добавление форсколина приводило к дальнейшему усилению транспорта (рис. 2). Для того чтобы подтвердить, что действие Синупрета® опосредованно через транспортный механизм, ответственный за развитие муковисцидоза, мы провели дополнительный эксперимент. В этом эксперименте мы блокировали данный транспортный механизм после введения раствора Синупрета®. Это приводило к значительному подавлению вызванной Синупретом® активации перемещения хлорида. Данный факт подтвердил то, что Синупрет® оказывает свое действие в результате взаимодействия именно с этой транспортной системой (рис. 3).
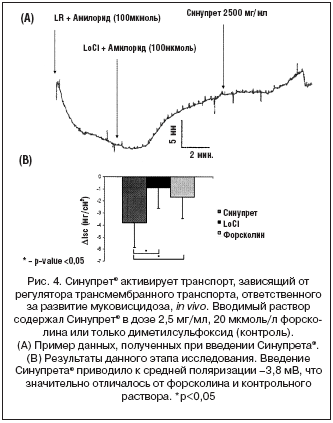
Трансэпителиальное перемещение хлорида in vivo также значительно возрастало в результате действия Синупрета® (n=9; –3,8±1,7 мВ) по сравнению с контрольной группой (n=20; –0,9±1,7 мВ, p=0,0004) (рис. 4). Следует отметить, что вызванное Синупретом® усиление перемещения ионов хлорида было более выраженным по сравнению с таковым при применении форсколина, высокоэффективного и, вероятно, наиболее мощного из известных стимуляторов транспортного механизма, ответственного за развитие муковисцидоза (n=13; –1,65±1,8 мВ, p=0,01).
Обсуждение
Синупрет® применяется в Европе на протяжении уже более чем 70 лет, и его безопасность не вызывает сомнений. С 2003 г. он также появился на рынке США в форме заказов по почте. В 2008 г. Синупрет® стал доступен и в аптечной сети. В Германии Синупрет® был наиболее популярным препаратом для лечения кашля и простуды в 2006 и 2008 гг. и десятым среди наиболее часто выписываемых препаратов в 2003 г. [14].
Экспериментальные исследования показали, что Cинупрет® и его отдельные компоненты обладают муколитической активностью [15] и что его профилактический прием повышает устойчивость к инфекциям дыхательных путей, вызываемым внутриносовым введением вируса Sendai (парагриппа) у мышей [16]. Эффективность Синупрета® также была показана в ряде клинических исследований лечения риносинусита. Рандомизированное плацебо–контролируемое исследование, включавшее 31 пациента [17] с риносинуситом, продемонстрировало существенные улучшения рентгенологической картины и снижение интенсивности головных болей у пациентов, получавших Синупрет® в качестве монотерапии.
В других исследованиях [18] оценивали эффективность Синупрета® в качестве элемента комплексного лечения в сочетании с антибактериальными препаратами и/или деконгестантами в лечении острого риносинусита. Все эти исследования показали более высокую эффективность лечения, включавшего Синупрет®. В двух работах было подтверждено существование статистически значимого преимущества по сравнению с плацебо.
Хотя клинические данные показывают, что Синупрет® может играть важную роль в лечении риносинусита, клеточные механизмы действия данного широко применяемого препарата продолжают оставаться недостаточно изученными.
Регулятор трансмембранного транспорта, ответственный за развитие муковисцидоза, является основным каналом для перемещения хлорида через апикальные мембраны дыхательного эпителия и играет ключевую роль в контроле над состоянием жидкости, покрывающей просвет дыхательных путей. Существенное нарушение функции данного регулятора приводит к развитию муковисцидоза, однако в более легких формах оно может вызывать и другие нарушения, включая последствия вдыхания табачного дыма [1]. Значительные усилия были направлены на поиск молекул, способных взаимодействовать с этим транспортным механизмом [19,20]. Одной из групп подобных веществ являются флавоноиды, что подтверждено в ряде экспериментальных работ [19,21,22].
В настоящем исследовании мы изучили действие Синупрета® на регулятор трансмембранного транспорта, ответственный за развитие муковисцидоза, в культуре носового эпителия мыши, а также in vivo. Полученные нами результаты показали, что Синупрет® оказывает выраженное стимулирующее влияние на этот регулятор в эпителии верхних дыхательных путей. Синупрет® вызывал увеличение секреции ионов хлорида, которое нарастало по мере увеличения концентрации препарата и было максимальным при 2,5 мг/мл (рис. 1).
Обычно флавоноиды в низких концентрациях оказывают стимулирующее действие на транспорт ионов хлорида, а в высоких – угнетающее [21,23]. Однако в настоящей работе мы не обнаружили угнетающих эффектов Синупрета® в исследованных концентрациях. Необходимо отметить, что при применении ДМСО концентрация 2,5 мг/мл является максимальной из технически достижимых.
Тот факт, что эффект от действия Синупрета® в значительной степени устранялся при добавлении вещества, угнетающего регулятор трансмембранного транспорта, ответственный за развитие муковисцидоза, подтверждает связь между действием Синупрета® и данным молекулярным механизмом. Осуществляется ли этот эффект через посредство протеинкиназы А, или вещества, входящие в состав Синупрета®, связываются со специфическими рецепторами, пока не установлено.
Действие Синупрета® на транспорт ионов хлора превосходило таковое для форсколина, являющегося одним из наиболее мощных известных стимуляторов регулятора трансмембранного транспорта, ответственного за развитие муковисцидоза. Таким образом, полученные нами результаты указывают на то, что Синупрет® может являться высокоэффективным стимулятором секреции жидкости и электролитов, а также мукоцилиарного клиренса. Эти данные позволяют по–новому взглянуть на механизм действия этого широко применяемого препарата.
Кроме того, результаты настоящего исследования показывают, что стимуляторы регулятора трансмембранного транспорта, ответственного за развитие муковисцидоза, могут быть применены местно [24] с целью улучшения мукоцилиарного клиренса, нарушенного вследствие инфекционных или воспалительных процессов, включая хронический синусит.
Заключение
Вязкость слизи в значительной степени определяется секрецией ионов хлора эпителием дыхательных путей. Стимуляция подобной секреции представляет возможность улучшения клиренса слизи у пациентов с острым или хроническим риносинуситом. Необходимы эффективные и безопасные препараты, обладающие подобным действием. Безопасность Синупрета® убедительно подтверждена в клинических исследованиях. Данный факт в сочетании с полученными нами данными о стимулирующем действии Синупрета® на регулятор трансмембранного транспорта, ответственный за развитие муковисцидоза, как in vitro, так и in vivo, указывает на необходимость проведения дальнейших исследований этого препарата, в том числе и в качестве средства для местного применения.
Реферат подготовлен к.м.н. В.В. Иремашвили по материалам статьи
F. Virgin, S. Zhang, D. Schuster et al.
«The Bioflavonoid Compound, Sinupret, Stimulates Transepithelial Chloride Transport In Vitro and In Vivo»
The Laryngoscope 120, May 2010: 1051–1056
Литература
1. Cohen N.A., Zhang S., Sharp D.B. et al. Cigarette smoke condensate inhibits transepithelial chloride transport and ciliary beat frequency. Laryngoscope 2009;119:2269–2274.
2. Trout L., King M., Feng W., Inglis S.K., Ballard S.T. Inhibition of airway liquid secretion and its effect on the physical properties of airway mucus. Am J Physiol 1998;274: L258–L263.
3. Moller W., Haussinger K., Ziegler–Heitbrock L., Heyder J. Mucociliary and long–term particle clearance in airways of patients with immotile cilia. Respir Res 2006;7:10.
4. Fischer H., Illek B. Activation of the CFTR CI– channel by trimethoxyflavonc in vitro and in vivo. Cell Physiol Bio–chern 2008;22:685–692.
5. Otake Y., Walle T. Oxidation of the flavonoids galangin and kaempferide by human liver microsomes and CYP1A1, CYP1A2, and CYP2C9. Drug Metab Dispos 2002;30: 103–105.
6. Melzer J., Sailer R., Schapowal A., Brignoli R. Systematic review of clinical data with BNO–101 (Sinupret) in the treatment of sinusitis. Forsch Komplem£titmed 2006;13:78–87.
7. Blanc P.D., Tropin L., Earnest G., Katz P.R., Yelin E.H., Eisner M.D. Alternative therapies among adults with a reported diagnosis of asthma or rhinosinusitis: data from a population–based survey. Chest 2001;120:1461–1 –167.
8. Krouse J.H., Krouse H.J. Patient use of traditional and complementary therapies in treating rhinosinusitis before consulting an otolaryngologist. Laryngoscope 1999;109: 1223–1227.
9. Zhang S., Fortenberry J.A., Cohen N.A., Sorscher E.J., Wood–worth B.A. Comparison of vectorial ion transport in murine airway and human sinonasal air–liquid interface cultures, models lor cystic fibrosis and other airway diseases. Am J. Rhinol Allergy 2009;23:149–152.
10. Woodworth B.A., Tamashiro E., Bhargave G., Cohen N.A., Palmer J.N. An in vitro model of Pseudomonas aeruginosa biofilms on viable airway epithelial cell monolayers. Am J Rhinol 2008;22:235–238.
11. Bhargave G., Woodworth B.A., Xiong G., Wolfe S.G., Antunes M.B., Cohen N.A. Transient receptor potential vanilloid type 4 channel expression in chronic rhinosinusitis. Am J Rhinol 2008;22:7–12.
12. Woodworth B.A., Antunes M.B., Bhargave G., et al. Murinenasal septa for respiratory epithelial air–liquid interface cultures. Biotechniques 2007;43:195–204.
13. Cormet–Boyaka E., Hong J.S., Berdiev B.K., et al. A truncated CFTR protein rescues endogenous (Delta)F508–CFTR and corrects chloride transport in mice. FASEB J 2009;23: 3743–3751.
14. American Botanical Council Web site. Available at: www.herbalgram.org. Accessed August 10, 2009.
15. Chibanguza G., Marz R., Sterner W. The effectiveness and toxicity of a plant secretolytic agent and its component drugs [in German]. Arzneimitlelforschung 1984;34:32–36.
16. Schmolz M., Ottendorfer D., Marz R.W., Sieder C. Enhanced resistance to Sendai virus infection in DBA/2J mice with a botanical drug combination (Sinupret). Int Immuno–pharmacol 2001;1:1841–1848.
17. Richstein A., Mann W. Treatment of chronic sinusitis with Sinupret fin German]. Ther Ggw 1980;119:1055–1060.
18. Guo R., Canter P.H., Ernst E. Herbal medicines for the treatment of rhinosinusitis: a systematic review. Otolaryngol Head Neck Surg 2006;135:'196–506.
19. Illek B., Fischer H., Santos G.F., Widdicombe J.H., Machen T.E., Reenstra W.W. cAMP–independent activation of CFTR CI channels by the tyrosine kinase inhibitor genistein. Am J Physiol 1995;268:C886–C893.
20. Muanprasat C., Sonawane N.D., Salinas D., Taddei A., Galietta L.J., Verkman A.S. Discovery of glycine hydrazide pore–occluding CFTR inhibitors: mechanism, structure–activity analysis, and in vivo efficacy. J Gen Physiol 2004;124:125–137.
21. Illek B., Fischer H. Flavonoids stimulate CI conductance of human airway epithelium in vitro and in vivo. Am J Physiol 1998;275:L902–L910.
22. Illek B., Fischer H., Machen T.E. Alternate stimulation of apical CFTR by genistein in epithelia. Am J Physiol 1996; 270:C265–C275.
23. Illek B., Lizarzaburu M.E., Lee V., Nantz M.H., Kurth . Fischer H. Structural determinants for activation and block of CFTR–mediated chloride currents by apigenin. Am J Physiol Cell Physiol 2000;279:C1838–Ci846.
24. Van Goor F., Hadida S., Grootenhuis P.D., et al. Rescue of CF airway epithelial cell function in vitro by a CFTR potentiator, VX–770. Proc Natl Acad Sci USA 2009; 106:18825–18830.












