Введение
Тяжелая комбинированная иммунная недостаточность (ТКИН) является редким видом первичных иммунодефицитных состояний (ПИДС), при котором нарушаются функции Т- и В-лимфоцитов. Новорожденные с ТКИН подвержены серьезным заболеваниям вирусными и бактериальными инфекциями уже в двухмесячном возрасте [1, 2]. При этом средний возраст постановки иммунологического диагноза в развитых странах составляет в лучшем случае около 4–5 мес. [3–6]. Даже в такой, относительно благоприятной ситуации, когда правильный диагноз ставится достаточно рано, задержка в 2,5 мес. может стать не просто существенной, но фатальной. Было показано, что выживаемость в результате трансплантации гемопоэтических стволовых клеток (ТГСК) детям младше 3,5 мес. жизни значительно выше таковой у пациентов более старшего возраста (94% против 66–69%) [7–9].Менее тяжелые формы первичных иммунодефицитных состояний могут манифестировать с разной симптоматикой и гораздо позже [10, 11], что приводит к задержке в постановке правильного диагноза, назначения правильного лечения и, как следствие, к увеличению инвалидизации и смертности [12], а также к значительным расходам системы здравоохранения [13]. Таким образом, необходимость как можно более ранней постановки диагноза ПИДС не вызывает сомнений [12].
В настоящий момент в России существует система неонатального скрининга, в рамках которой карты Гатри с сухими пятнами крови новорожденных попадают в молекулярно-генетические лаборатории, где проводятся исследования на наличие врожденных заболеваний. Также была разработана эффективная тест-система, которая измеряет уровень TREC — побочного продукта рекомбинации гена Т-клеточного рецептора и KREC — В-клеточного рецептора. Анализ обладает всеми необходимыми для включения в программу неонатального скрининга признаками [14].
В этом обзоре представлены медицинские результаты применения анализа уровня TREC на этапе неонатального скрининга в США, а также приведены расчеты экономической выгоды внедрения анализа для выявления первичных иммунодефицитных состояний в систему неонатального скрининга.
Причины низких уровней TREC у новорожденных
Первый в мире пилотный неонатальный скрининг был запущен в 2008 г. в штате Висконсин (США). С тех пор по состоянию на конец 2016 г. через это обследование прошло не менее 6 093 942 детей, подавляющее количество из которых новорожденные. У 1533 детей были выявлены резко сниженные уровни TREC и 1459 из них — новорожденные.На рисунке 1 представлены 3 группы пациентов, у которых было выявлено низкое содержание TREC: 1) ПИДС, 2) другие известные генетические дефекты и состояния и 3) состояния с неизвестными дефектами.

На рисунках 2 и 3 представлена структура выявленных известных, ведущих к ПИДС генетических дефектов. Обращает на себя внимание то, что такие состояния, как ТКИН, синдром Оменна, синдром Ди Джорджи, мутация IL2RG и ADA1, встречаются значительно чаще остальных.
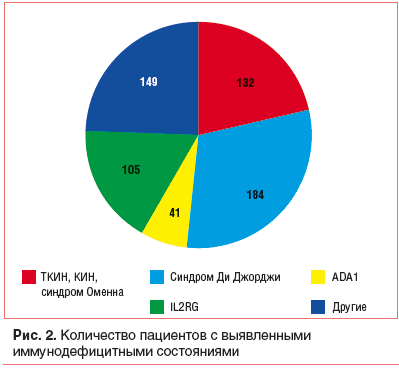
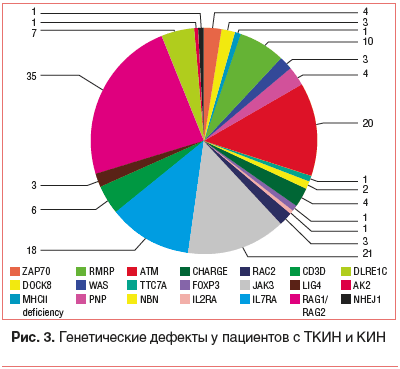
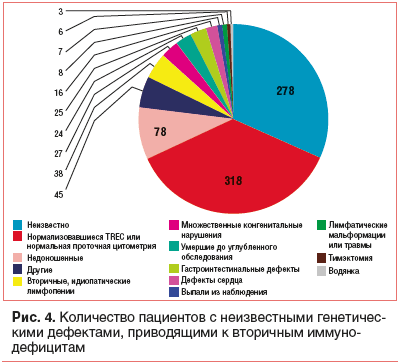
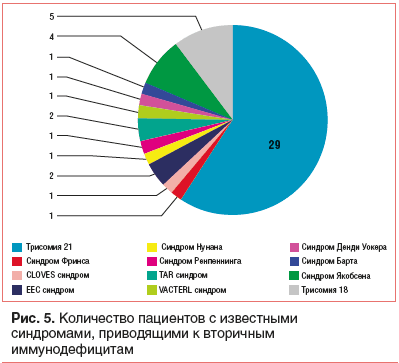
В процессе неонатального скрининга выявлены дети с неизвестным генетическим дефектом (рис. 4) и известными врожденными состояниями, которые приводят к вторичным иммунодефицитам (рис. 5). [15].
Неонатальный скрининг ТКИН в США
Система неонатального скрининга штата Висконсин была первой в мире, в рамках которой стал использоваться анализ для выявления ТКИН [16]. На сегодняшний день более чем в половине штатов США выполняют рутинный полуколичественный анализ крови новорожденных на TREC [17]. Результаты впечатляют: ни один пациент с ТКИН не был пропущен и все дети незамедлительно получили необходимую по жизненным показаниям терапию, что обеспечило высочайший уровень выживаемости — 94% [18–21].Расчет экономической эффективности скрининга в штате Вашингтон, который включил ТКИН в свою программу в 2014 г., очень удобен для экстраполяции результатов на такие регионы России, как Московская область, а также Санкт-Петербург с Ленинградской областью, т. к. уровень рождаемости в данных регионах сопоставим [22, 23].
Как можно убедиться из представленных в таблице 1 данных, частота ТКИН варьирует от 1/46 000 до 1/80 000 живых новорожденных [24], доля раннего обнаружения ТКИН у пациентов составляет чуть более 20% из всех случаев [5, 25], распространенность не связанной с ТКИН Т-клеточной лимфопении от 1/11 600 до 1/16 400 [26], чувствительность и специфичность скринингового теста близки к 100% [7, 17, 24, 27, 28].

При этом общая выживаемость для пациентов с ранним обнаружением ТКИН 85–94%, а с поздним — 38–72% [4, 5, 7, 25–27, 29, 30], цена лабораторного исследования TREC — 3–6 долл. США, а проточной цитометрии — 250 долл. [7]. Дополнительные траты на ведение ребенка с лимфопенией достигают 6000 долл. [7]. Экспертная оценка затрат на лечение умершего до постановки правильного диагноза и назначения правильного лечения составляет до 300 000 долл., ведение ребенка, не прошедшего ТГСК в первые 3,5 мес. жизни, стоит от 300 000 до 1 200 000 долл., что в 10 раз больше трансплантированного в ранние сроки [7, 27, 32, 33].
Также необходимо отдельно отметить цену жизни, которая, по разным оценкам, варьирует от 4 до 13 млн долл. Средняя цена — 9 млн долл. [34].
Расчеты показывают, что при рождаемости 86 600 детей в год и стоимости одного анализа 8,16 долл. на скрининг тратится 741 тыс. долл., что, в свою очередь, снижает стоимость лечения одного ребенка с 457 до 197 тыс. долл. Таким образом, неонатальный скрининг ПИДС не только повышает выявляемость заболевания и выживаемость новорожденных, понижает инвалидизацию и смертность, но и экономит до 43% затрат, т. е. до 316 905 долл. бюджета штата Вашингтон.
Как видно из таблицы 2, если взять самую низкую оценку стоимости жизни, выгода от неонатального скрининга ПИДС составляет до 2 млн долл. в год, а если среднюю, то до 4 млн в год.

Таким образом, коэффициент выгоды от введения полуколичественного анализа TREC в систему неонатального скрининга с учетом всех затрат составляет от 2,71 до 5,31.
Неонатальный скрининг ТКИН во Франции
Экономическую эффективность скрининга в Европе можно оценить на примере Франции. Иммунологическая лаборатория Университетской клиники Нанта может анализировать 2 плашки на 65 пациентов в день. Цена анализа одного пациента зависит от загруженности прибора — чем полнее, тем дешевле. Таким образом, скрининг на одного новорожденного варьирует от 4,69 до 6,79 евро, что не дороже американских аналогов.В таблице 3 представлены данные M.C. Clément et al. [35], согласно которым стоимость лечения пациентов младше и старше 3,5 мес. жизни сходна с представленными выше цифрами.
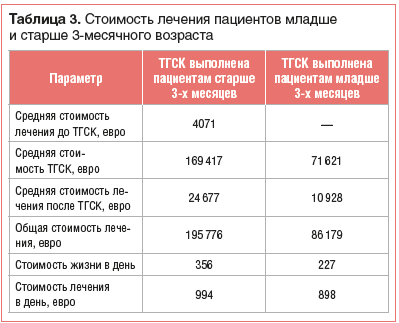
Необходимо отметить, что не только стоимость лечения, но и цена каждого дня жизни трансплантированных до 3-месячного возраста детей значимо ниже.
Заключение
На сегодняшний день известно около двух сотен дефектов, которые приводят к врожденному иммунодефициту, и каждый год выявляется около 30 новых мутаций. Самое большое внимание специалистов приковано к тяжелой комбинированной иммунной недостаточности, поскольку дети именно с этим состоянием заболевают и умирают в первый год жизни.До появления ТКИН в системе неонатального скрининга США считалось, что риск приводящей к нему мутации в европеоидной популяции равен примерно 1 случаю на 100 000 живых новорожденных. Однако нельзя забывать, что дети с первичным иммунодефицитом, у которых часто развиваются аутоиммунные заболевания, оппортунистические инфекции и прочие тяжелые состояния, погибают до того, как им поставят правильный диагноз. Из этого следует, что выявленные случаи ПИДС не отражали реальной эпидемиологической картины.
Теперь, когда исследование TREC и KREC стало доступным, а его эффективность продемонстрирована, внедрение анализа в национальные скрининговые программы всех стран происходит быстрыми темпами. По данным Международной пациентской организации по первичным иммунодефицитам (IPOPI), в настоящий момент выявление первичных иммунодефицитных состояний у новорожденных методом анализа уровня TREC или TREC и KREC в сухих пятнах крови на картах Гатри включено в национальные программы скрининга 9 государств. Пилотные проекты запущены в 13 государствах. Подготовка к старту пилотных проектов ведется в 10 государствах.
Отсутствие единообразия в технологии исследования, его валидации, протоколах оформления, небольшое к настоящему времени количество прошедших раннюю ТГСК пациентов — все это затрудняет оценку экономической эффективности внедрения анализа первичных иммунодефицитных состояний в систему неонатального скрининга. Однако представленные данные подтверждают не только позитивные гуманитарные и медицинские последствия от снижения смертности, сохранения жизни пациентов и создания условий для повышения ее качества, но и безусловную экономическую выгоду, в т. ч. в краткосрочной перспективе.











