В норме после связывания с рецептором на поверхности клетки липопротеиды низкой плотности (ЛПНП), в составе которых, как известно, большая часть холестерина находится в виде эфиров холестерина, проникают в клетку, транспортируются внутри эндосомы, сливаются с лизосомой, где фермент лизосомная кислая липаза осуществляет гидролиз эфиров холестерина и триглицеридов до свободного холестерина и жирных кислот. Внутриклеточное накопление свободного холестерина посредством сложных биохимических механизмов приводит к подавляющему воздействию на рецепторы ЛПНП, уменьшению поступления в клетку и снижению синтеза холестерина, а также усилению его этерификации. Вследствие внутриклеточного накопления жирных кислот ингибируется образование фосфолипидов и триглицеридов [4, 5].
При недостаточности лизосомной кислой липазы нарушается распад эфиров холестерина и триглицеридов и происходит их накопление в лизосомах клеток печени, селезенки, кровеносных сосудов, слизистой тонкого кишечника, надпочечников, на поверхности которых определяется высокая плотность рецепторов ЛПНП.
В гепатоцитах больных с ДЛКЛ увеличение синтеза холестерина приводит к увеличению продукции холестерина липопротеидов очень низкой плотности и его секреции. Это, в свою очередь, стимулирует образование холестерина ЛПНП и, таким образом, может выступать в качестве важного содействующего фактора в развитии гиперхолестеринемии при ДЛКЛ [6].
Отложение эфиров холестерина в ткани печени приводит к мелкокапельной жировой дистрофии (также называемого микровезикулярным стеатозом), что вызывает повреждение клеток печени. Маркером этого повреждения является повышенный уровень трансаминаз (АСТ, АЛТ) в сыворотке крови. Поврежденные гепатоциты замещаются соединительной тканью, развиваются фиброз и цирроз печени. Нарушение функции клеток сопровождается дислипидемией с повышенным уровнем общего холестерина в сыворотке крови, высоким уровнем холестерина ЛПНП, аполипопротеина В, низким уровнем холестерина липопротеинов высокой плотности (ЛПВП), повышенным или нормальным уровнем триглицеридов. Изменения в липидограмме соответствуют изменениям при дислипидемии IIb, что приводит к ускоренному развитию атеросклероза, сердечно-сосудистых нарушений и преждевременной смертности [2, 7].
Отложение эфиров холестерина в клетках слизистой оболочки кишечника вызывает развитие синдрома мальабсорбции, проявляющегося разной степенью выраженности диареи, стеатореи, а также синдромом избыточного бактериального роста, метеоризмом.
Увеличение селезенки может быть связано с накоплением эфиров холестерина в клетках, а также с прогрессированием заболевания, портальной гипертензией.
Возраст начала заболевания и темпы его прогрессирования в значительной степени вариабельны и могут быть связаны с природой лежащих в основе мутаций и количественным показателем остаточной ферментативной активности [8, 9].
Клиника
Исторически выделяют две клинические формы ДЛКЛ (табл. 1). Первая форма характеризуется быстро прогрессирующим течением. В 1956 г. впервые был описан случай тяжелого истощения, гепатоспленомегалии, кальцификации надпочечников с последующим летальным исходом на 1-м месяце жизни [10]. Эта форма болезни получила название болезни Вольмана. Дебют заболевания – от неонатального периода до 3–6 мес. Патологическое накопление липидов в селезенке, надпочечниках, лимфатических узлах, слизистой тонкой кишки, эндотелии сосудов и скелетных мышцах обусловливают характер патологии. Клиническими проявлениями болезни Вольмана являются персистирующая рвота, диарея, стеаторея, иногда желтуха. При осмотре обращает на себя внимание увеличенный в размере живот, что связано не только с гепатоспленомегалией, но и со вздутием кишечника, часто, по причине его паралитической непроходимости. Течение заболевания характеризуется прогрессирующей анемией, субфебрилитетом, задержкой физического и психомоторного развития. Нарастают вялость, апатия, астения, гиперрефлексия. Быстро развиваются фиброз и цирроз печени, связанные с массивным накоплением эфиров холестерина и триглицеридов [11]. При использовании визуализирующих методов исследования (рентгенологических, ультразвуковых) определяются кальцинаты надпочечников у половины больных [12]. Прогрессирующие гипотрофия, неврологические расстройства, надпочечниковая и печеночно-клеточная недостаточность, интеркуррентные инфекции приводят к летальному исходу на первом году жизни. Активность фермента составляет менее 1% от нормы [13]. Летальный исход наступает на фоне быстро прогрессирующей полиорганной недостаточности в возрасте 6–12 мес. [8].
Вторая форма болезни – болезнь накопления эфиров холестерина (БНЭХ). Заболевание впервые было описано в 1963 г., когда Fredrickson [13] сообщил о случае выраженной гиперхолестеринемии, гепатомегалии и накопления эфиров холестерина при исследовании биопсийного материала печени 12-летнего мальчика. Данная форма ДЛКЛ характеризуется более поздним началом клинических проявлений, медленным прогрессированием. Возраст начала болезни варьирует в большом диапазоне – от 2-х до 25 лет, чаще – до 10 лет. Cамое позднее начало клинической манифестации заболевания выявлено у 44-летнего мужчины и 68-летней женщины [2]. Основной симптом – гепатомегалия, обнаруживаемая у подавляющего большинства пациентов [2, 14]. Клинические проявления варьируют от бессимптомного до тяжелого поражения печени. Ранний биохимический маркер поражения печени – синдром цитолиза – проявляется повышенным уровнем АСТ и АЛТ в сыворотке крови от 1,5 до 5–7 норм. При прогрессировании заболевания нарастают спленомегалия, фиброз печени, портальная гипертензия, белково-энергетическая недостаточность. Активность фермента при данной форме заболевания составляет 1–12% от нормы [15]. Заболевание можно заподозрить на основании указанной клинической симптоматики. Проводятся лабораторные и инструментальные исследования.
ДЛКЛ является орфанным заболеванием, в связи с чем распознается не сразу, и многие пациенты длительный период времени наблюдаются с диагнозами: семейная гиперхолестеринемия, семейная комбинированная гиперлипидемия, неалкогольный стеатогепатит, неалкогольная жировая болезнь печени, криптогенный гепатит или цирроз печени. Поэтому знание симптомов данного заболевания, правильная интерпретация клинико-лабораторных результатов позволят в более ранние сроки установить диагноз и назначить патогенетическую терапию.
Диагностика
Обследование пациентов включает целый ряд исследований, которые помогут сориентировать врача в нужном направлении диагностического поиска.В клиническом анализе крови обращают на себя внимание нормоцитарная анемия, переходящая в гипохромную анемию. Анемия более выражена у детей с болезнью Вольмана. У части пациентов с ДЛКЛ определяется повышенная СОЭ. При прогрессировании цирроза печени при ДЛКЛ нарастают лейко- и тромбоцитопения.
Основными биохимическими характеристиками заболевания являются синдром цитолиза, гиперхолестеринемия, дислипидемия (повышение ЛПНП, триглицеридов, аполипопротеина В, снижение ЛПВП) [16]. На стадии цирроза печени о нарастании белково-синтетической недостаточности свидетельствуют гипопротеинемия, гипоальбуминемия, возможно снижение уровня холестерина до нормальных значений.
Основные диагностические маркеры ДЛКЛ, подтверждающие заболевание: дефицит активности лизосомной кислой липазы и мутации гена LIPA (однако в некоторых случаях при использовании стандартных методов клинической диагностики мутации не обнаруживаются) [2]. Уровень лизосомной кислой липазы определяется в сухом пятне крови на специальных фильтрах, применяемых, например, для неонатального скрининга. Преимуществами метода являются небольшой объем образца, транспортировка в специализированные лаборатории при температуре окружающей среды, а также возможность длительного хранения.
Молекулярно-генетическое исследование позволяет выявить мутации в гене LIPA кодирующих и прилегающих интронных областей. Большинство пациентов являются гомозиготами или сложными гетерозиготами по мутациям гена LIPA. У некоторых больных могут иметь место протяженные делеции, не выявляемые при проведении обычного генетического скрининга [2].
Важными визуализирующими методами диагностики являются УЗИ органов брюшной полости и забрюшинного пространства, рентгенография, МРТ.
УЗИ при подозрении на ДЛКЛ оценивает состояние печени, селезенки, надпочечников, диаметра стволов воротной и селезеночной вен. У пациентов с ДЛКЛ определяются увеличение размеров печени (верхне-нижних размеров правой и левой долей), гиперэхогенность и мелкоочаговая диффузная неоднородность паренхимы печени, у части больных – ослабление ультразвука в дистальных отделах паренхимы печени. У части пациентов отмечается увеличение селезенки, а при дальнейшем прогрессировании болезни – расширение ствола воротной и селезеночной вен, что свидетельствует о нарастании портальной гипертензии. При УЗИ можно определить кальцинаты в надпочечниках, которые говорят также в пользу болезни Вольмана.
При проведении рентгенологического исследования органов брюшной полости определяются увеличенные надпочечники полулунной или пирамидной формы с наличием точечных очагов кальцификации по всей паренхиме.
При проведении МРТ органов брюшной полости выявляют гепатоспленомегалию, при болезни Вольмана определяются гипертрофированные брыжеечные и периаортальные лимфатические узлы. Проведение МРТ необходимо для оценки степени жировой дистрофии печени, а также характера течения заболевания и эффективности проводимой патогенетической терапии [17].
При выявлении признаков портальной гипертензии, проводят эзофагогастродуоденоскопию для определения варикозного расширения вен пищевода и оценки риска возможного кровотечения.
Биопсию печени с последующим исследованием морфологической картины рекомендуют, если нет возможности применить иные, неинвазивные методы диагностики ДЛКЛ [18, 19]. При морфологическом исследовании ткани печени определяется стадия заболевания.
Макропрепарат биоптата печени имеет желто-оранжевую окраску, а при проведении гистологического анализа выявляются различные степени портального и перилобулярного фиброза, а также выраженный микровезикулярный стеатоз в связи с накоплением эфиров холестерина и триглицеридов в лизосомах гепатоцитов [20]. Характерная черта – наличие в значительной степени гипертрофированных клеток Купфера и портальных макрофагов с пенистой, окрашиваемой в коричневатый цвет, резко ШИК-положительной цитоплазмой.
Результаты визуализирующих методов обследования и биопсии печени являются диагностическими в отношении ДЛКЛ. Учитывая, что ДЛКЛ – мультисистемное заболевание, при необходимости требуется проведение исследований сердечно-сосудистой системы (ЭКГ, Эхо-КГ, допплерография сосудов головы и шеи и т. д.).
Дифференциальный диагноз проводят с различными болезнями печени, нарушениями липидного обмена. Тактика дифференциального диагноза зависит от формы ДЛКЛ. При болезни Вольмана необходимо исключить все заболевания с гепатоспленомегалией, поражением печени, кишечника, мозга: болезнь Ниманна – Пика, тип IA; болезнь Гоше, тип II; GM1- ганглиозидоз; болезнь Фабера; атипичные формы галактосиалидоза; галактоземию, тип I; наследственную непереносимость фруктозы; тирозинемию, тип I. БНЭХ необходимо дифференцировать с большим количеством различных болезней, протекающих с гепатомегалией, синдромом цитолиза и нарушениями липидного обмена, а также с неалкогольной жировой болезнью печени.
Лечение
Единственным патогенетическим методом лечения является длительная ферментная заместительная терапия препаратом Себелипаза альфа. Лечение ДЛКЛ заключается в восстановлении сниженного уровня фермента для предотвращения накопления эфиров холестерина и триглицеридов и, как следствие, восстановлении нормальной функции органа. Препарат Себелипаза альфа – это рекомбинантная кислая лизосомная липаза человека. Действующее вещество попадает в лизосомы клеток за счет связывания со специфическими рецепторами, где оказывает непосредственный терапевтический эффект. Доза препарата зависит от формы болезни: при болезни Вольмана она составляет 3 мг/кг/сут, при БНЭХ – 1 мг/кг внутривенно капельно. Режим введения при БНЭХ – 1 раз в 2 нед., при болезни Вольмана, при наличии показаний, возможно более частое проведение инфузий – 1 раз в неделю. В клинических исследованиях продемонстрировано улучшение биохимических показателей (нормализация уровня трансаминаз, показателей липидограммы), морфологической картины в биоптатах печени, а также увеличение выживаемости пациентов [21]. Препарат разрешен к применению во многих европейских странах, США, Японии. На территории РФ ожидается регистрация препарата.При отсутствии патогенетической терапии проводится симптоматическая терапия. При нарушении всасывания и задержке развития, а также для коррекции липидного обмена необходима консультация диетолога в целях оптимизации питания. Клинические проявления надпочечниковой недостаточности требуют назначения заместительной гормональной терапии, выраженная анемия и тромбоцитопения – переливания крови и ее компонентов.
Прогноз зависит от формы заболевания и выраженности клинических проявлений. При своевременной диагностике заболевания и начале патогенетической терапии прогноз благоприятный. При болезни Вольмана без проведения фермент-заместительной терапии летальный исход наступает на первом году жизни.
В связи с высоким риском болезни (25%) в семьях, имеющих ребенка с ДЛКЛ, требуется обследование всех детей, т. к. заболевание в течение длительного времени может протекать без выраженной клинической симптоматики.
При наличии в семье ребенка с подтвержденным диагнозом ДЛКЛ для определения риска повторного рождения ребенка с данным заболеванием необходимо медико-генетическое консультирование. Возможна пренатальная диагностика: определение активности кислой липазы в культурах ворсин хориона и молекулярно-генетическое исследование на 9–11-й неделе беременности или исследование амниотической жидкости на 20–22-й неделе [1].
В нашем центре было обследовано 20 детей с ДЛКЛ, все дети – с БНЭХ. Мы неоднократно докладывали о результатах обследования и характере течения болезни [22]. Ниже приведен клинический случай ДЛКЛ у мальчика с установленным диагнозом ДЛКЛ.
Клинический случай ДЛКЛ (БНЭХ)
Ребенок от первой беременности, протекавшей на фоне многоводия, роды первые, срочные, физиологические. Вес при рождении 3460 г, длина 52 см. Оценка по шкале Апгар 8/9 баллов. Находился на грудном вскармливании до 1 года 3-х месяцев. Профилактические прививки проведены по календарю вакцинации. Перенесенные заболевания: ОРЗ 2–3 раза в год. Семейный анамнез: у отца – артериальная гипертензия, желчнокаменная болезнь (холецистэктомия), у бабушки по линии матери – желчнокаменная болезнь, холецистэктомия.В возрасте 3-х лет при подготовке к плановой аденомэктомии в биохимическом анализе крови было выявлено повышение АЛТ до 182 ед/л, АСТ до 159 ед/л. Печень увеличена на +2–2,5 см, селезенка увеличена на +0,5 см. Выставлен диагноз: дискинезия желчевыводящих путей. Реактивный панкреатит. Гепатомегалия. В 3,5 года при повторном обследовании получены следующие результаты: печень увеличена на +4-5 см, селезенка - на +2–3 см, АЛТ 286 ед/л, АСТ 176 ед/л. Исключены хронические вирусные гепатиты, болезнь Вильсона, дефицит a1-антитрипсина и целиакия. В дальнейшем у ребенка сохранялся синдром цитолиза, отмечалось нарастание размеров печени и селезенки. В 4,5 года: печень увеличена на +5–6 см, селезенка – на +3 см. По данным эластографии: стадия фиброза F1-F2 (по METAVIR). По данным УЗИ брюшной полости: увеличение размеров печени и селезенки, диффузная неоднородность, поглощение ультразвука на 1/4. МРТ брюшной полости: печень расположена обычно, в размерах значительно увеличена преимущественно за счет правой доли. Наибольший передне-задний размер – 130 мм (правая доля), 50 мм (левая доля), вертикальный на уровне правой доли – 156 мм, левой доли – 49 мм. Контуры ровные, четкие. Селезенка увеличена, 110×93×37 мм, контуры четкие, ровные, паренхима однородная. Желчный пузырь, поджелудочная железа, почки, надпочечники не изменены.
В возрасте 5 лет печень выступала на 7–8 см, селезенка – на 2–3 см из-под края реберной дуги. Впервые проведено исследование липидограммы в 6 лет: холестерин 5,65–6,18–6,28 ммоль/л, ЛПНП 6,5 ммоль/л, ЛПВП 0,92 ммоль/л. В этом же возрасте по данным УЗИ брюшной полости выявлены: гепатоспленомегалия, диффузная неоднородность и гиперэхогенность паренхимы печени, расширение диаметра стволов воротной и селезеночной вен. При КТ брюшной полости обнаружены диффузные изменения паренхимы печени по типу жировой дистрофии. Эзофагогастродуоденоскопия: терминальный эзофагит, гастрит, дуоденит. Варикозного расширения вен пищевода не было обнаружено. Ребенку проведена пункционная биопсия печени. Результаты морфологического исследования биоптата: в срезе определяются до 6 полных и неполных портальных трактов, 4 портальных тракта фиброзированы, 3 порто-портальные септы, 2 свободно лежащие септы. Зоны перипортального перицеллюлярного фиброза, гепатоциты разделены на розетки, скудные лимфоидные инфильтраты в этих зонах. Небольшие зоны перигепатоцеллюлярного фиброза в дольках. Гепатоциты округлой формы, часть их несколько увеличены в размерах, балочное строение не определяется. Гепатоциты имеют очень светлую, мелкозернистую цитоплазму, большинство содержат вакуоли. При проведении ШИК-реакции обнаружено накопление ШИК-позитивного вещества в гепатоцитах, вакуоли остаются хорошо различимы. Заключение: морфологическая картина болезней накопления. Можно подозревать накопление эфиров холестерина. Явления хронического перипортального гепатита низкой степени активности без учета склероза, вероятно реактивного характера. Индекс гистологической активности по Knodell – 4 балла (I-А, II-C, III-B). Индекс склероза по Десмет – 2 балла (умеренный перигепатоцеллюлярный фиброз). Поэтому было проведено исследование лизосомной кислой липазы в клетках крови: ее уровень составил 27,8 нМ/мг/час (норма 30–118 нМ/мг/час, лейкоциты), что послужило поводом для проведения молекулярно-генетического исследования. Методом прямого автоматического секвенирования исследованы все кодирующие экзоны (2–10) гена LIPA, а также прилегающие интронные области. В экзоне 7 выявлена мутация с.796G>T в гетерозиготном состоянии, приводящая к преждевременной терминации трансляции аминокислотной последовательности р.Gly266Х. В экзоне 8 выявлена мутация с.894G<A в гетерозиготном состоянии, приводящая к нарушению сплайсинга.
На основании анамнеза, результатов клинико-лабораторного обследования (цитолиз, гепатоспленомегалия, гиперхолестеринемия, снижение уровня кислой липазы), а также молекулярно-генетического исследования крови был установлен диагноз: ДЛКЛ. Болезнь накопления эфиров холестерина.
По жизненным показаниям ребенку в возрасте 6 лет 10 мес. рекомендовано проведение патогенетической терапии незарегистрированным в России препаратом Себелипаза альфа в дозе 1 мг/кг внутривенно капельно 1 раз в 2 нед. Длительность терапии в настоящее время составляет 15 мес. На фоне фермент-заместительной терапии, которую ребенок переносит удовлетворительно (побочных эффектов не зарегистрировано), отмечается уменьшение размеров печени и селезенки: печень выступает на 3 см из-под края реберной дуги по правой среднеключичной линии, селезенка не пальпируется. Наблюдается снижение уровня активности трансаминаз (рис. 1). По данным УЗИ, несмотря на сохраняющуюся гепатоспленомегалию, признаков портальной гипертензии не выявлено.
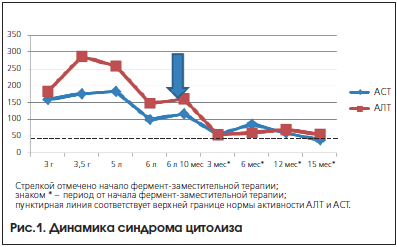
Течение заболевания у мальчика с ДЛКЛ характеризуется наличием гепатоспленомегалии, быстрым прогрессированием с формированием признаков портальной гипертензии к 6-летнему возрасту, синдромом цитолиза, минимальным повышением уровня холестерина, более выраженным увеличением ЛПНП и хорошим ответом на проведение фермент-заместительной терапии, что требует ее продолжения. Препарат назначается для предотвращения развития тяжелых инвалидизирующих осложнений.
Заключение
Таким образом, при ДЛКЛ наблюдается прогрессирующее поражение печени с гепатомегалией, повышенным уровнем трансаминаз, микровезикулярным стеатозом. Низкая распространенность, неспецифичность клинико-лабораторных признаков болезни объясняют ее недостаточную выявляемость.Следует помнить, что болезнь Вольмана необходимо исключить у любого ребенка первых месяцев жизни с постоянной рвотой или диареей, отставанием в развитии, гепатоспленомегалией, синдромом мальабсорбции. Выявление увеличенных надпочечников с кальцификацией – прямое показание к исследованию уровня кислой лизосомной липазы и молекулярно-генетическому исследованию. Идентичность липидных профилей при БНЭХ с большой группой заболеваний, особенно при выявлении синдрома цитолиза, свидетельствует о том, что необходимо исключать ДЛКЛ, если предполагаются наследственные нарушения липидного обмена.











