Многими авторами атеросклероз определяется как хроническое (воспалительное, аутоиммунное, метаболическое, дегенеративное, системное) заболевание [1–10].
Академики И.В. Давыдовский [11] и Ю.М. Лопухин [12] отвергают нозологическую сущность атеросклероза. По их мнению, атеросклероз — проблема не медицинская, а биологическая, в более узком смысле — геронтологическая. Патологоанатом И.В. Давыдовский [11] называет атеросклероз естественным возрастным процессом, который начинается в детстве и которого не миновать никому. Атеросклероз — это биологическое явление, закономерный процесс развития живого организма от жизни к смерти. По мнению М.Х. Шогеновой и соавт. [13], атеросклероз является патофизиологическим состоянием.
Между здоровьем и болезнью существуют переходные (донозологические) состояния. Таким донозологическим, сопровождающим жизнь человека явлением может быть атеросклероз (патофизиологическое состояние, которое на разных этапах жизни может осложняться нозологическими состояниями — заболеваниями).
В большинстве случаев атеросклероз является основой cердечно-сосудистых заболеваний:
ишемической болезни сердца (стенокардии, ин-
фаркта миокарда, аритмии);
цереброваскулярных заболеваний (транзиторной ишемической атаки, ишемического инсульта);
атеросклероза аорты;
атеросклероза мезентериальных артерий;
атеросклероза периферических артерий;
атеросклероза почечных артерий [4].
В настоящее время получены неопровержимые доказательства признаков атеросклероза (в виде липидных пятен или полосок на стенках артериальных сосудов) уже в раннем детстве [14–16]. Сложилось убеждение, что атеросклероз — детское заболевание, которое проявляется в более позднем возрасте [17]. В связи с этим профилактика атеросклероза должна начинаться с детства.
Эффективность мероприятий по профилактике атеросклероза значительно возрастает при их проведении на доклиническом этапе проявлений заболевания. Особое внимание при организации профилактических мероприятий следует уделять выявлению факторов риска развития и определению биохимических маркеров атерогенных нарушений. Среди факторов риска наиболее значимыми являются: семейная предрасположенность, гиперлипидемия (гиперхолестеринемия), артериальная гипертензия, сахарный диабет, неблагоприятная экологическая обстановка, малоподвижный образ жизни, пре- и постнатальная гипотрофия, ожирение, курение, эмоциональное перенапряжение, гипотиреоз.
Общие представления о патогенезе атеросклероза
В настоящее время нет единой общепринятой теории атеросклероза.Согласно современным представлениям, ведущую роль в патогенезе атеросклероза (атерогенезе) играет окислительный стресс, возникающий вследствие повышенного образования свободных радикалов: активных кислородных метаболитов (АКМ) и продуктов перекисного окисления липидов (ПОЛ). В условиях окислительного стресса в крови происходит окисление богатых холестерином (ХС) липопротеинов низкой плотности (ЛПНП) [13, 18]. Окисленные ЛПНП активно захватываются эндотелиальными клетками с помощью скавенджер-рецепторов и переносятся в субэндотелиальное пространство. Основной процесс клеточного окисления ЛПНП происходит в субэндотелиальном слое под влиянием АКМ, секретируемых моноцитами, Т-лимфоцитами. При этом усиливается повреждение эндотелия, уменьшается образование окиси азота и простациклина, увеличивается синтез эндотелина и тромбоксана А2, в результате чего возникает эндотелиальная дисфункция, повышается сосудистая проницаемость, усиливается адгезия (прилипание) к эндотелию тромбоцитов и моноцитов. Последние в большом количестве проникают во внутреннюю оболочку сосудов, где превращаются в макрофаги и начинают активно продуцировать цитокины (интерлейкин-1, фактор некроза опухоли, тромбоцитарный фактор роста (ТцФР) и др.), усиливающие воспалительный процесс за счет стимуляции клеточной пролифирации, лейкоцитарной инфильтрации и миграции клеток.
Макрофаги, поглощая окисленные ЛПНП, превращаются в нагруженные липидами ксантомные («пенистые») клетки. В результате этих процессов происходит утолщение интимы, чему способствует и накопление в ней гладкомышечных клеток и межклеточного вещества. Гладкомышечные клетки под влиянием ТцФР мигрируют во внутреннюю оболочку сосудов, пролиферируют, синтезируют коллагеновые, эластические волокна, протеогликаны, в результате чего формируется основа атеросклеротической бляшки. Из межклеточного вещества образуется фиброзная покрышка, под которой располагаются ксантомные клетки, секретирующие факторы роста. При распаде ксантомных клеток освобождается богатая липидами атероматозная масса.
Окисляясь, ЛПНП приобретают антигенные свойства и вызывают повышенную продукцию антител, что ведет к развитию аутоиммунного воспалительного процесса [19]. При этом окислительный стресс и воспаление стимулируют друг друга по принципу замкнутого круга [19–21].
Таким образом, ведущим универсальным патогенетическим механизмом развития атеросклероза является окислительный стресс. Атеросклероз целесообразно рассматривать как проявление аутоиммунного процесса, ассоциированного с хроническим стрессом. Мы пришли к заключению, что наиболее адекватной, отражающей все стороны его патогенеза, является стрессовая теория. Эту теорию, по мнению А. Эйнштейна, цитируемого Б.Г. Кузнецовым [22], можно рассматривать как «единую теорию медицины». Именно «единая теория медицины» должна лежать в основе теории атеросклероза. В 1935 г. А.Д. Сперанский [23] в своей работе «Элементы построения теории медицины» писал: «До тех пор, пока природа всех без исключения патологических процессов не будет объединена каким-либо общим признаком, пока к методу разделения болезней по различию мы не добавим метод объединения их по сходству, у нас не будет теории медицины». И еще: «Организм на огромное количество повреждающих факторов отвечает относительно небольшим набором стандартных форм реагирования». По сути дела, наш соотечественник предопределил рождение стрессовой теории. На следующий год Г. Селье [24, 25] сформулировал теорию стресса. Стандартную форму реагирования организма на различные повреждающие факторы он назвал «общим адаптационным синдромом», а под понятием «стресс» понимал «неспецифический ответ организма на любое предъявляемое ему требование». Некоторые авторы под стрессом понимают чрезвычайное воздействие на жи-
вой организм. Мы считаем наиболее правильным такое определение: «Стресс – это неспецифическая реакция организма, адаптивная по своей сути, возникающая на любое повреждение, способное вызвать нарушение гомеостаза».
Адаптационно-компенсаторные реакции при стрессе
Физиологическое значение стрессовой реакции в основном заключается в энергетическом обеспечении специфических компонентов адаптации. При стрессе отмечается активизация как защитных (антистрессовых) процессов, так и повреждающих [26]. Адаптационные реакции в организме осуществляются благодаря альтернативному взаимодействию противоположностей, в первую очередь катаболических и анаболических процессов, направленных на образование и сохранение энергии. Взаимодействуют альтернативные процессы по принципу обратных связей [26]. По нашему мнению [27], описанное явление можно назвать «законом альтернативного взаимодействия».При хроническом стрессе включаются механизмы долговременной адаптации. На первых этапах развития хронического стресса отмечается умеренное повышение в крови уровня катехоламинов и глюкокортикостероидов (ГКС) и достаточно выраженное уменьшение содержания инсулина. В связи с этим ткани становятся более чувствительными к действию стрессреализующих гормонов, а состояние резистентности достигается на фоне менее выраженного катаболического повреждения тканей [28]. Такое соотношение отмеченных гормонов способствует преобладанию в организме энерготропных (катаболических) реакций, способных привести к истощению защитных механизмов. С целью сохранения себя организм в соответствии с генетическими программами мобилизует качественно новые адаптационно-компенсаторные реакции. Трофотропные реакции направлены на повышение пластических и энергетических ресурсов, реорганизацию тканевых, клеточных и субклеточных структур, изменение метаболических процессов. При этом продукты распада одних структур индуцируют синтез других, необходимых для формирования устойчивости в данный момент [29].
Анаболическая стадия стресс-реакции, возникающая вслед за катаболической и характеризующаяся длительной активацией синтеза нуклеиновых кислот и белка, способствует развитию долговременной адаптации. В соответствии с концепцией П.К. Анохина [30] под влиянием «страха истощения» в центральной нервной системе (в первую очередь в вентромедиальных ядрах гипоталамуса) образуется центр с опережающей стратегией поведения, в результате чего повышается активность вагоинсулярного аппарата, увеличивается сдвиг в сторону липидного обмена, усиливается синтез жира с отложением его в депо. Кроме того, активизация трофотропных (анаболических) реакций возникает и в результате реципрокных взаимоотношений между симпатоадреналовой и вагоинсулярной системами. Смена стадий может провоцироваться и гуморально-метаболическими сдвигами. Так, под влиянием ГКС повышается содержание глюкозы, инсулина и гормона роста, в результате чего в крови увеличивается содержание триглицеридов и свободных жирных кислот [31], что способствует усилению холинергических свойств крови за счет снижения активности ацетилхолинэстеразы, уменьшения связывания ацетилхолина эритроцитами. При этом в крови повышается содержание ацетилхолина и гистамина. Последние стимулируют синтез адренокортикотропного гормона, адреналина, а инсулин повышает активность симпатико-адреналовой системы.
Смена стадий развития хронического стресса наглядно демонстрируется результатами наших исследований [32–34], которые отражают разные стороны адаптационно-компенсаторных реакций у детей с недостаточной и избыточной массой тела.
Характер адаптационно-компенсаторных реакций у детей с недостаточной массой тела
По данным исследования функционального состояния вегетативной нервной системы нами [35, 36] установлено, что у детей с пре- и постнатальной гипотрофией I и II сте-пени возникает нарастающая симпатикотония, которая при III степени сменяется ваготонией, т. е. надсегментарный уровень вегетативной регуляции сменяется сегментарным, автономным уровнем. При оценке функционального состояния коры надпочечников у детей с пре- и постнатальной гипотрофией в большинстве случаев определялись два типа реакции: дисфункция и гипофункция коры надпочечников. При первом типе отмечалось повышение уровня ГКС и снижение уровня минералокортикостероидов. При втором типе наблюдалось отчетливое уменьшение и ГКС и минералокортикостероидов. По нашему мнению [32, 35], первый тип реакции коры надпочечников, который определялся у детей с I и II степенью гипотрофии, может рассматриваться в качестве маркера хронического стресса в стадии резистентности. Второй тип, который отмечался у детей с III степенью гипотрофии, свидетельствует об истощении функции коры надпочечников и указывает на стадию декомпенсации хронического стресса (срыв адаптации). «Целесообразность» установленной нами дисфункции коры надпочечников заключается, прежде всего, в энергетическом обеспечении механизмов долговременной адаптации. Это связано с переключением метаболизма на преимущественно липидный обмен.
Для детей с гипотрофией характерна гиперлипидемия [35], которая, по мнению ряда авторов [28, 32, 37], является признаком хронического стресса. При I и II сте-
пени гипотрофии гиперлипидемия в основном связана с увеличением общих липидов, триглицеридов, ХС, эфиров ХС и фосфолипидов, при III степени — с повышением уровня неэстерифицированных жирных кислот за счет плохой их утилизации. Отмеченные признаки дислипидемии являются маркерами атеросклероза.
Под влиянием ГКС усиливается биосинтез фосфолипидов в основном за счет фосфатидилхолина, необходимого для стабилизации клеточных мембран [38]. При II степени гипотрофии, в отличие от I и III степени, установлено достоверное повышение уровня лизофосфатидилхолина при одновременном уменьшении содержания фосфатидилхолина. Это свидетельствует о том, что при II степени гипотрофии отмечаются наиболее выраженные признаки дестабилизации клеточных мембран, наиболее значительное напряжение адаптационно-компенсаторных механизмов. В целях сохранения жизнедеятельности клеток организм переключается на новый уровень адаптации за счет децентрализации регуляции и перехода на автономные, эволюционно более древние механизмы регуляции, что мы и наблюдали при III степени гипотрофии.
Таким образом, полученные нами данные позволяют рассматривать гипотрофию как проявление хронической стрессовой реакции, осуществляющей энергетическое обеспечение адаптационно-компенсаторных механизмов за счет использования нейтрального жира из жировых депо, что сопровождается развитием атерогенных нарушений.
У детей с целиакией при наличии у них гипотрофии I и II cтепени мы также выявляли дисфункцию коры надпочечников с повышенным синтезом ГКС и пониженным — минералокортикостероидов. Если же у этих детей на фоне аглиадиновой диеты и лечения возникала избыточная масса тела, то у них дисфункция коры надпочечников характеризовалась преобладанием секреции минералокортикостероидов. Соотношение лизофосфатидилхолина к фосфатидилхолину у детей с недостаточной и избыточной массой тела было одинаковым и достоверно большим, чем у детей контрольной группы. Это указывает на наличие признаков окислительного стресса. Приведенные данные свидетельствуют о том, что у детей с целиакией при смене недостаточной массы тела на избыточную явно просматриваются две стадии: стадия с преобладанием активности катаболических (энерготропных) процессов и стадия с преобладанием активности анаболических (трофотропных) процессов.
Более глубокое представление о закономерностях развития и течения хронического стресса можно получить при исследовании клеточного энергообмена. С этой целью рекомендуется определение ферментного статуса лейкоцитов [39]. Функции лейкоцитов в первую очередь зависят от интенсивности окислительного фосфорилирования, осуществляемого в митохондриях. Цитохимическим маркером указанного процесса является сукцинатдегидрогеназа (СДГ) — ключевой фермент цикла Кребса. Важную роль в обеспечении окислительного фосфорилирования играет α-глицерофосфатдегидрогеназа (α-ГФДГ), которая участвует в «челночном» механизме переноса ионов водорода из цитоплазмы в митохондрии клетки, осуществляя связь гликолиза в цитоплазме с биологическим окислением в митохондриях. Этот фермент принимает активное участие в биосинтезе триглицеридов и фосфолипидов. Выраженность катаболических процессов в клетках можно оценивать с помощью определения активности кислой фосфатазы (КФ) и лактатдегидрогеназы (ЛДГ). КФ — показатель дестабилизации лизосомальных мембран, ЛДГ — индикатор анаэробного гликолиза, катализирующего взаимопревращение лактата и пирувата [40]. Ферментные системы лейкоцитов достаточно объективно отражают адаптационные процессы при стрессовых состояниях [41]. Установлено, что при хроническом стрессе повышается активность кислой и щелочной фосфатаз, но снижается активность СДГ и α-ГФДГ [42].
Цитохимический анализ активности некоторых митохондриальных ферментов лимфоцитов периферической крови по методу Пирса в модификации Р.П. Нарциссова [43] нами проводился у 158 детей с гипотрофией (у 111 — с пренатальной), в возрасте от 1 до 12 мес. Гипотрофия I степени диагностирована у 77, II степени — у 68, III степени — у 13 детей. Контрольную группу составили 23 ребенка с нормальными массо-ростовыми показателями.
При оценке изменений активности ферментов в зависимости от периода возникновения и степени гипотрофии установлено, что у детей с пре- и постнатальной гипотрофией I–III степени активность СДГ и α-ГФДГ была достоверно (р<0,05) снижена, а активность КФ — достоверно (р<0,05) повышена.
Снижение активности СДГ у детей с гипотрофией свидетельствует об угнетении окислительно-восстановительных процессов, обусловленных накоплением продуктов липидного обмена, в т. ч. продуктов ПОЛ. Это связано с переключением обмена веществ при гипотрофии с преимущественно углеводного на преимущественно липидный [35]. Однако усиленное привлечение липидов для энергетического обеспечения организма ограничивается депрессией окислительного фосфорилирования, что указывает на наличие механизмов обратной связи на уровне клеточного метаболизма. Снижение активности α-ГФДГ свидетельствует о нарушении окислительного фосфорилирования, липосинтеза и дестабилизации клеточных мембран при гипотрофии.
Достоверное (в большинстве случаев) различие цитохимических показателей при II и III степени гипотрофии объясняется переключением регуляции с центрального на автономный уровень, что наблюдалось при III степени.
Полученные нами данные указывают на атерогенный характер изменений в организме у детей с гипотрофией, ассоциированный с хроническим стрессовым состоянием.
Характер адаптационно-компенсаторных реакций у детей с ожирением
Признаки хронического стресса на разных иерархических уровнях мы выявляли и у детей с ожирением [27, 34, 44]. Под нашим наблюдением находились 150 детей и подростков в возрасте от 10 до 15 лет. Из них 83 ребенка были с ожирением, среди которых у 65 определялась первичная артериальная гипертензия (ПАГ). Среди 67 детей без ожирения ПАГ зафиксирована у 36, а 31 ребенок (без ожирения и ПАГ) составил контрольную группу.У всех детей, помимо общепринятых лабораторно-клинических и традиционных биохимических показателей, оценивались данные липидограммы крови и углеводного обмена. У большинства детей определялись гормоны щитовидной железы (ТТГ, свободный Т3, свободный Т4), инсулин, С-пептид, адреналин, норадреналин, дигидроксифенилаланин, дофамин, ванилилминдальная кислота, гомованилиновая кислота. Кроме того, использовались методы исследования: ЭКГ, кардиоинтервалография (КИГ), суточное мониторирование артериального давления (АД), ЭхоКГ, цитохимический анализ активности некоторых митохондриальных ферментов лимфоцитов периферической крови (СДГ, α-ГФДГ, ЛДГ).
При оценке показателей КИГ, характеризующих состояние вегетативной нервной системы (ВНС), мы по предложенной нами методике [33] выделяли фазы напряженной адаптации (ФНА), относительной компенсации (ФОК) и декомпенсации (ФД). Для ФНА характерно одинаковое повышение активности симпатического и парасимпатического отделов ВНС; для ФОК при высокой активности симпатического отдела характерно недостаточное компенсаторное повышение активности парасимпатического отдела; для ФД на фоне повышения активности симпатического отдела характерно снижение активности парасимпатического отдела.
При ПАГ у детей с ожирением симпатикотония встречалась в 1,5 раза чаще, чем у детей без ожирения, а у детей с ожирением без ПАГ — в 2,5 раза чаще, чем у детей без ожирения и ПАГ. При ПАГ у детей как с ожирением, так и у детей без ожирения ФД определялась в 70% случаев, что связано с некомпенсированной гиперсимпатикотонией. Обращает на себя внимание достаточно частое (24%) обнаружение ФНА у детей с ожирением. По нашему мнению, это результат усиления ренин-ангиотензин-альдостероновой системы (РААС), которая «подпитывает» ВНС и обеспечивает ее адаптацию по механизму обратной связи. В результате оценки изменений уровня катехоламинов, их предшественников и метаболитов нами установлено, что при ПАГ у детей с ожирением отмечается тенденция к нарастанию образования адреналина и кортизола [44]. Кроме того, у этих детей установлены более высокие показатели средних значений С-пептида, индекса инсулинорезистентности и инсулина.
Высокая функциональная активность надпочечников (коркового и мозгового слоев) и щитовидной железы определяют выраженную симпатикотоническую направленность вегетативного гомеостаза у детей с ожирением без ПАГ. Из литературы известно, что гиперсимпатикотония может быть причиной развития окислительного стресса, инсулинорезистентности, гиперинсулинемии, гиперлипидемии и т. д. [45, 46]. В свою очередь, гиперинсулинемия оказывает рестимулирующее действие на симпатическую нервную систему, замыкая порочный круг формирования ожирения [44, 47, 48]. Помимо стимуляции симпатической нервной системы, инсулин усиливает продукцию катехоламинов, повышает активность РААС, способствует увеличению содержания в эндотелии сосудов ионов натрия и кальция [46–48].
Таким образом, характер вегетативных и гормонально-метаболических изменений у детей с ожирением свидетельствует о трофотропной стадии хронического стресса, при которой гормональная система «подпитывает» ВНС, что обеспечивает стабилизацию функционирования последней и поддерживает постоянство внутренней среды организма.
При анализе липидного спектра крови у детей с ожирением (по сравнению с детьми контрольной группы) достоверно больше оказались показатели общего ХС (р=0,037), триглицеридов (р=0,03), индекса атерогенности (р=0,004), а меньше — липопротеинов высокой плотности (ЛПВП) (р=0,049). Повышение уровня ЛПНП у детей с ожирением, по сравнению с детьми контрольной группы, было недостоверным.
При оценке активности лейкоцитарных ферментов у детей с ожирением нами установлена достоверная их взаимосвязь с основными метаболическими и функциональными показателями [27, 34]. У половины детей с ожирением определялась гиперактивация СДГ (ФНА), у 1/3 — гиперактивация, сдерживаемая ее внутренним ингибированием (ФОК), у 1/5 — снижение активности (ФД). В контрольной группе примерно у половины детей отмечалась нормальная активность СДГ, у 1/4 — повышенная и у 1/4 — сниженная.
По данным корреляционного анализа, показатель активности СДГ коррелирует с уровнем среднего систолического АД (r=0,6; р<0,05). Это можно объяснить тем, что активность данного фермента «весьма чувствительно отражает уровень адренергической регуляции в организме», благодаря чему обеспечивается повышение АД [49]. Кроме того, у детей с ожирением показатель активности данного фермента коррелирует с концентрацией инсулина (r=–0,5; р<0,05) и С-пептида (r=–0,7; р<0,05), а также с индексом инсулинорезистентности (r=–0,5; р<0,05) в крови. Можно предположить, что эти данные указывают на угнетение активности фермента под влиянием вагоинсулярной системы, гипергликемии. Снижение активности СДГ является одним из компонентов патогенеза инсулинорезистентности, а последняя — одним из факторов атерогенеза.
У детей с ожирением определялось снижение активности α-ГФДГ. Установлена прямая корреляция показателя активности α-ГФДГ с уровнем триглицеридов (r=0,7; р<0,05) и отрицательная – с уровнем С-пептида (r=–0,6; р<0,05) в крови. Эти данные указывают на дестабилизацию клеточных мембран под влиянием триглицеридов, а следовательно, на снижение чувствительности рецепторов и развитие инсулинорезистентности, что обусловливает компенсаторное усиление образования инсулина.
При оценке активности ЛДГ у детей с ожирением отмечалось ее повышение. Изменения активности ЛДГ указывают на высокую катаболическую активность метаболизма у наблюдаемых нами детей, развитие метаболического ацидоза, который сопровождается угнетением окислительного фосфорилирования [50, 51]. Активность ЛДГ коррелирует с уровнями С-пептида (r=–0,4; р<0,05), ХС (r=0,5; р<0,05) и ЛПНП (r=0,5; р<0,05). Следовательно, в условиях метаболического ацидоза угнетается синтез инсулина и усиливается атерогенез.
Авторы полагают, что у детей с ожирением имеется дестабилизация клеточных мембран. В этих условиях возникает усиление активности анаэробного гликолиза, на что указывает повышение активности ЛДГ, а также компенсаторное усиление окислительно-восстановительных процессов, о чем свидетельствует гиперактивация СДГ. На фазовый характер изменений указывает смена гипер-, нормо- и гипоактивности ферментов.
По нашим данным [52], у детей с ожирением и ПАГ определяется значительное уменьшение эндотелийзависимой вазодилатации (ЭЗВД) и утолщение комплекса интима-медиа общей сонной артерии. Величина этих показателей коррелирует с массой тела ребенка и выраженностью ПАГ. Кроме того, установлена обратная корреляционная связь значения ЭЗВД с индексом инсулинорезистентности и уровнем ЛПВП. Эти данные свидетельствуют о связи атерогенеза с эндотелиальной дисфункцией.
При оценке состояния детей с недостаточной и избыточной массой тела установлены однотипные ответы на разных уровнях организма, характер изменения которых отличается фазностью развития. Как у детей с гипотрофией, так и у детей с ожирением при оценке вегетативного гомеостаза часто определяется гиперсимпатикотония, в гормональном статусе — повышение уровня стрессреализующих гормонов, при оценке показателей крови и лимфоцитарных ферментов — гиперлипидемия, признаки окислительного стресса и дестабилизации клеточных мембран. Перечисленные изменения указывают на состояние хронического стресса, в развитии которого можно выделить энерготропную и трофотропную стадии. Высокая симпатико-адреналовая активность у детей с ожирением должна рассматриваться как компенсаторная реакция альтернативной системы. Именно альтернативное взаимодействие противоположностей обусловливает фазовый характер течения стрессовой реакции. На основании данных исследования клинических проявлений, функционального состояния вегетативной нервной системы, эндокринного и метаболического статуса, маркеров стадий и их фаз нами предложена классификация хронического стресса (табл. 1) [33].

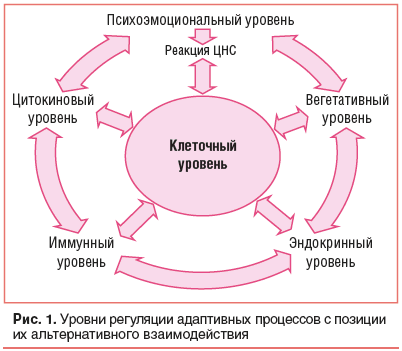
Важнейшую роль в патогенезе хронического стресса играют метаболические расстройства на уровне наиболее древних клеточных структур (митохондрий, клеточных мембран). Изменяясь первыми при патологическом воздействии, они стимулируют включение адаптационных реакций в эволюционно более молодых «надстроенных» системах: цитокиновой, иммунной, гормональной, вегетативной, центральной нервной системах (рис. 1) [27].
Патогенетическое обоснование применения препаратов L-карнитина для коррекции атерогенных нарушений у детей
При коррекции атерогенных нарушений у детей с целью предупреждения ранних осложнений атеросклероза особое внимание необходимо уделять нормализации клеточного энергообмена, усилению антиоксидантных реакций. В этом плане одним из лучших метаболических средств являются препараты L-карнитина. Основная их функция — биоэнергетическая. Физиологическое действие L-карнитина связано с участием в регуляции жирового, белкового и углеводного обмена. Анаболическое (трофотропное) действие карнитина объясняется его способностью повышать чувствительность тканей к инсулину, оптимизировать метаболизм фосфолипидов, усиливать секрецию и ферментативную активность желудочного и кишечного соков. В литературе описаны многочисленные его эффекты: энерготропный и трофотропный, антигипоксический, антиоксидантный, стрессопротективный, мембраностабилизирующий, дезинтоксикационный, противовоспалительный, кардиопротекторный, нейропротекторный и др. [53, 54].Особого внимания заслуживают сведения о влиянии карнитина на атерогенные процессы. По данным литературы [55], карнитин способствует снижению уровня триглицеридов, общего ХС, ЛПНП, увеличению содержания ЛПВП. В связи с этим он может препятствовать развитию атеросклероза [56, 57]. В последние годы появились работы, в основном экспериментальные, в которых утверждается, что карнитин может быть связан с синтезом проатерогенных веществ в организме. Они образуются в кишечнике в результате метаболизма карнитина некоторыми кишечными микроорганизмами. Однако не все исследователи подтверждают эти данные [58].
В своей работе мы широко пользуемся лекарственным препаратом L-карнитина Элькар®, разработанным отечественной компанией ООО «ПИК-ФАРМА» и выпускаемым в виде 30% раствора (300 мг/мл) для приема внутрь. Препарат назначаем с учетом суточного ритма в дозе 30–50 мг/кг в сутки. Детям с ожирением препарат назначаем утром (энерготропный эффект), а детям с гипотрофией — во второй половине дня (трофотропный эффект). После проведенного лечения отмечается улучшение клинических и метаболических показателей. Кроме препаратов L-карнитина при атерогенных нарушениях у детей целесообразно использовать препараты тиоктовой кислоты, фолиевой и янтарной кислот, бисфосфонаты, препараты витамина D, другие витамины, обладающие антиоксидантным действием.
Заключение
В результате анализа многочисленных литературных источников и собственных данных можно прийти к заключению, что атеросклероз по своей природе является проявлением хронического стресса, протекающего волнообразно со сменой стадий и фаз в своем развитии. При стрессе отмечается активизация как защитных (антистрессовых, в первую очередь анаболических, трофотропных) процессов, так и повреждающих (катаболических, энерготропных). Эти процессы практически никогда не бывают в состоянии равновесия. Они обеспечиваются многочисленными реакциями, связанными с альтернативным взаимодействием противоположностей, что является внутренним источником движения, процессов циклического, ритмического развития организма.При хроническом стрессе, являющемся патогенетической основой атеросклероза, организация лечебных и профилактических мероприятий должна проводиться с учетом установленных стадий и фаз его развития. Это позволяет индивидуализировать подход к выбору этих мероприятий.











