Введение
Стрептококковая инфекция, вызванная β-гемолитическим стрептококком группы А (БГСА), распространена повсеместно. В мире около 18 млн человек страдают от серьезных заболеваний, связанных с БГСА. Ежегодно регистрируется около 1,78 млн новых случаев [1]. БГСА — один из основных патогенов человека, значимый фактор заболеваемости и смертности при инфекционных заболеваниях [2]. БГСА выступает частой причиной широкого спектра инфекций у младенцев, детей и взрослых. Стрептококковые инфекции, вызванные БГСА, долгое время ассоциировались с развитием серьезных болезней и смертностью, но к середине ХХ в. произошло заметное снижение заболеваемости и тяжести таких инфекций. Однако за последние 15 лет наблюдается возрождение тяжелых инвазивных стрептококковых инфекций [3]. К ним относятся некротический фасциит, миозит, синдром токсического шока и стрептококковая бактериемия. Существует общее мнение, что количество и тяжесть как гнойных, так и негнойных осложнений стрептококковой инфекции увеличились [4]. В обзоре представлена современная информация о стрептококковой инфекции, спектре постстрептококковых кардиальных и некардиальных заболеваний, описаны подходы к ранней диагностике.
Распространенность стрептококковых инфекций и их диагностика — современное состояние проблемы
Увеличение числа осложнений стрептококковой инфекции частично объясняется изменением эпидемиологии стрептококковых инфекций, повышением вирулентности возбудителя и, возможно, снижением чувствительности БГСА к широко используемым антибиотикам. БГСА-инфекция передается воздушно-капельным путем и склонна к быстрому развитию. Проведенный недавно ретроспективный эпидемиологический анализ данных официальной статистической отчетности о заболеваемости и распространенности наиболее значимых форм инфекции, вызванной БГСА, за 2009–2016 гг. показал, что ежегодная заболеваемость составляет 1,8 млн человек, среди них более 500 тыс. (38%) — дети до 14 лет. В группу риска входят подростки [5]. Отмечен достоверный рост распространенности хронических болезней миндалин и аденоидов как среди детей, так и среди взрослого населения. В США 5–15% взрослых и 15–35% детей, страдающих фарингитом, заражены БГСА. Число случаев стрептококкового тонзиллита в мире составляет более 616 млн в год, но при этом диагностируется только у 30% всех пациентов, обращающихся за медицинской помощью по поводу лихорадки и боли в горле [6].
В 2020 г. был проведен анализ среднего темпа прироста показателей заболеваемости населения России хроническим фарингитом, назофарингитом, синуситом и ринитом в период 1996–2007 гг. Отмечена тенденция повышения среднего темпа прироста, которая сохраняется до настоящего времени и составляет +6% и +4% в группе детей (1–14 лет) и взрослых соответственно [2].
В отличие от острого фарингита, при котором преобладающей является вирусная этиология, острый тонзиллит чаще вызван стрептококковой инфекцией. Симптомы БГСА-инфекции пересекаются с признаками бактериального (не связанного с БГСА) и вирусного острого фарингита, что усложняет диагностику. Тщательное медицинское обследование и сбор анамнеза пациента явля feтся отправной точкой для диагностики БГСА. После сбора анамнеза и завершения физикального обследования пациента можно использовать следующие методики для установления наличия инфекции БСГА: системы клинической оценки, экспресс-тесты на обнаружение антигенов, посев из горла (с поверхности миндалин), тесты амплификации нуклеиновых кислот [7]. Наибольшее значение в разграничении БГСА-тонзиллита с другими нозологиями имеют лихорадка ≥38 °С, отсутствие кашля, отечность миндалин и наличие в них экссудата, увеличение и болезненность подчелюстных лимфоузлов. Эти симптомы составляют основу предложенного R. Centor и модифицированного W. McIsaak клинического алгоритма, который был апробирован на большой группе пациентов [8]. Приведенный клинический алгоритм (табл. 1) может быть рекомендован для решения вопроса о назначении эмпирической антимикробной терапии при невозможности дальнейшей этиологической верификации диагноза.

Существенная роль в диагностике стрептококковой инфекции, вызванной БГСА, отводится лабораторным методам, преимущества и недостатки которых представлены в таблице 2 [9–11].
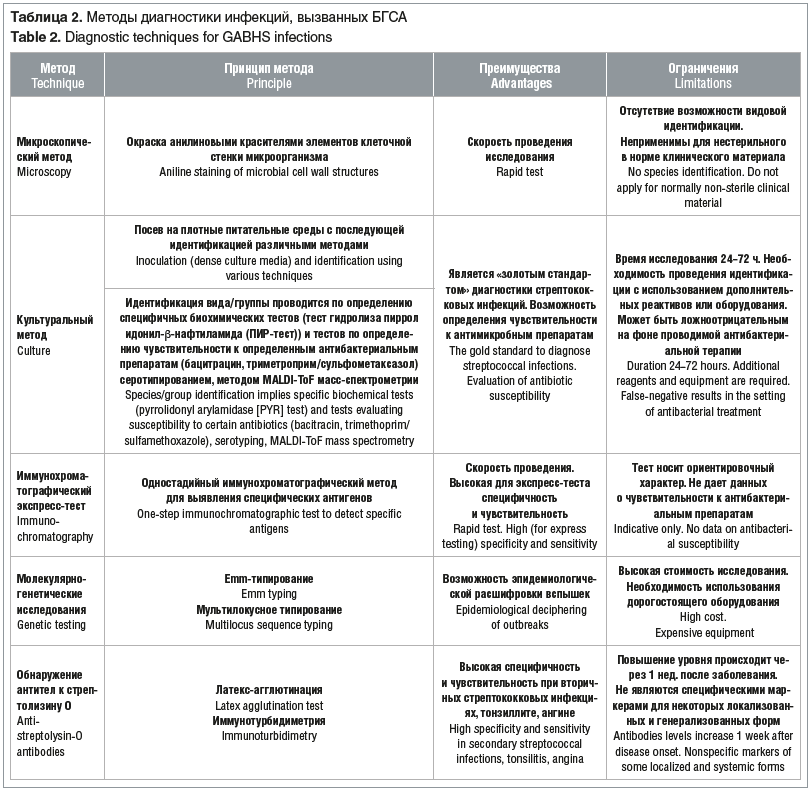
Среди некультуральных методов наибольшее распространение получил иммунохроматографический экспресс-тест на антиген БГСА, зарегистрированный в РФ в 2010 г. Результаты маркетинговых исследований свидетельствуют о необходимости внедрения этого теста в широкую клиническую практику [5]. Тем не менее вопросы этиологической диагностики БГСА-фарингита не имеют удовлетворительного решения ввиду частого носительства БГСА у детей — дЦ e 26% [12], при котором использование лабораторных тестов не позволяет отличить это состояние от БГСА-фарингита.
Некардиальные проявления стрептококковой инфекции и их диагностика
Жизнеугрожающие состояния, вызванные БГСА, связаны с инвазивной инфекцией, критерием которой является выделение данного вида стрептококка из любой стерильной в норме ткани [13]. В структуру инвазивных форм, вызванных БГСА, входят скарлатина (36%), флегмона (39%), некротический фасциит (7,5%), пневмония (14,1%), первичная бактериемия (19,6%), синдром токсического шока (2,7%) [14–16].
Частота инвазивных форм, вызванных БГСА, составляет 2,45 случая на 100 000 населения в странах с высоким уровнем дохода, но описаны сезонные колебания и временное увеличение конкретных типов возбудителя, летальность от которых может достигать 100% [17]. Так, по данным Центра по контролю и профилактике заболеваний США, летальность от инвазивных форм в 2015 г. составила 0,49 случая на 100 000 населения (заболеваемость — 4,8 на 100 000 населения) [18]. В России наибольшее число случаев стрептококковой инфекции было зарегистрировано в 2014 г., из них 5 случаев септицемии со смертельным исходом [19].
Инвазивные инфекции связаны с особыми видами Streptococcus pyogenes, продуцирующими стрептококковый пиогенный экзотоксин — семейство бактериальных суперантигенов, включающих классический токсин скарлатины (S. pyogenes exotocsine A, C), специфическую сериновую протеиназу и набор недавно открытых суперантигенов стрептококка, например митогенный фактор. Суперантигены — это мощные иммуностимуляторы, вызывающие пролиферацию Т-лимфоцитов с последующим выбросом воспалительных цитокинов, с которыми связано развитие шока и полиорганной недостаточности [20]. Заболеваемость синдромом стрептококкового токсического шока (СТШ) составляет 1–5 случаев на 100 000 населения, что подтверждено несколькими популяционными исследованиями [21]. Эта форма характеризуется внезапным и очень быстрым возникновением симптомов и сопровождается септицемией [22]. СТШ гораздо чаще возникает при поверхностном поражении кожи (импетиго, порезы, ожоги, раны), чем при БГСА-фарингите [23]. Необходимо учесть, что развитию СТШ при повреждении мягких тканей может предшествовать значительно более выраженный болевой синдром, который можно считать предиктором СТШ. Известны критерии стандартного случая СТШ. Это выделение S. pyogenes в сочетании с гипотонией и, как минимум, двумя признаками полиорганной недостаточности. При выделении S. pyogenes из нестерильного локуса и отсутствии другой идентифицированной этиологии заболевания СТШ следует считать вероятным. При выделении S. pyogenes из стерильного локуса СТШ является подтвержденным. Риск летальности от СТШ до 50–100% возникает при его ассоциации с некротизирующим фасциитом и миозитом. Следует отметить, что, по мнению многих исследователей, в настоящее время СТШ может протекать в более легкой форме и не сопровождаться некрозом мягких тканей и выраженной гипотонией [24].
Стрептококковая пневмония чаще развивается у детей, ее удельный вес составляет около 10% среди очаговых пневмeeний другой этиологии. Основные симптомы: лихорадка, кашель, одышка; возможные осложнения —гнойный плеврит, перикардит, гломерулонефрит. Среди взрослого населения стрептококковая пневмония встречается в 1–4% случаев, у детей раннего возраста — в 20% случаев [25]. Чаще всего развивается сегментарная или интерстициальная пневмония. В легочной ткани стрептококк поражает межальвеолярные перегородки. Стрептококковая инфекция распространяется по лимфатической системе и гематогенным путем, вызывая образование выпота серозного или гнойного характера. У 60% детей развиваются парапневмонический плеврит и эмпиема плевры, у 35% пациентов — гнойный перикардит, легочные абсцессы в зоне пневмонического очага. У новорожденных стрептококковая инфекция может сопровождаться внутриутробным сепсисом с развитием дыхательных расстройств. Диагноз стрептококковой пневмонии подтверждается результатами бактериологического посева мокроты. При условии проведения своевременной антибиотикотера efии течение стрептококковой пневмонии благоприятное, летальность невысокая.
Скарлатина относится к одним из актуальных классических проявлений БГСА в педиатрии. За последние 50 лет отмечен рост заболеваемости скарлатиной во всем мире, которая в 2015 г. достигла 17,5 тыс. случаев. Так, в Великобритании за последние 3 года зарегистрированы даже эпидемии скарлатины [26]. В Южной Корее увеличилось число больных скарлатиной с 0,3 на 100 000 населения в 2008 г. до 13,7 на 100 000 населения в 2015 г. Ученые связывают этот факт с циркуляцией высоковирулентного штамма [27]. В России заболеваемость скарлатиной среди детского населения в последние годы достоверно уменьшилась с 240,7 до 129,7 на 100 000 населения [19].
К иммунопатологическим формам относят острую ревматическую лихорадку (ОРЛ), постстрептококковый гломерулонефрит (ПГ), постстрептококковые аутоиммунные заболевания центральной нервной системы, в том числе нейропсихические расстройства. Существующие варианты заболевания вызываются различными штаммами стрептококка. Каждый тип стрептококковой инфекции имеет свой уникальный набор клинических проявлений [20].
Постстрептококковый гломерулонефрит может сопровождаться быстрым ухудшением функции почек из-за воспалительной реакции, в основе которой лежит реакция гиперчувствительности III типа, вызванная нефрогенными штаммами БГСА. Заболевание поражает клубочки и мелкие кровеносные сосуды почек. ПГ чаще всего проявляется у детей через 1–2 нед. после боли в горле или через 6 нед. после кожной инфекции (импетиго) [28]. Связанный с нефритом рецептор плазмина (Nephritis-Associated Plasmin Receptor, NAPlr) и стрептококковый пирогенный экзотоксин B (Streptococcal Pyrogenic Exotoxin B, SPeB) служат двумя общими антигенами, связанными с патогенезом ПГ. Они приводят к гипокомплементемии и обладают сродством к плазмину и белкам клубочков. Клиническая картина ПГ может варьировать от субклинического течения до почечной недостаточности, требующей заместительной почечной терапии [29]. ПГ обычно проявляется такими призна eaами нефритического синдрома, как гематурия, олигурия, гипертензия и отеки. Реже проявления могут имитировать нефротический синдром со значительной протеинурией [30].
За последние три десятилетия заболеваемость ПГ значительно снизилась в развитых странах, таких как США, Великобритания, страны Центральной Европы и Япония. Причина такого прогресса заключается в антибиотикопрофилактике и улучшении гигиенического состояния. В этих странах ПГ чаще встречается у взрослых пациентов, страдающих хроническими тяжелыми заболеваниями [31]. Тем не менее до сих пор стрептококковая инфекция остается самой частой причиной гломерулонефрита у детей в США [32]. Более высокую заболеваемость ПГ можно отметить в развивающихся странах из-за увеличения кожных инфекций (пиодермии). Так, ПГ является наиболее частой причиной повреждения почек у детей на Ближнем Востоке, в Африке, Австралии. Ежегодно отмечается прирост новых случаев ПГ в развивающихся странах — от 8,5 до 28,5 на 100 000 человек [30–32]. Около 97% зарегистрированных случаев ПГ приходится на неблагополучные страны. Болезнь чаще всего поражает детей в возрасте от 3 до 12 лет (с пиком заболеваемости в возрасте от 5 до 6 лет) и пожилых людей старше 60 лет. Прогноз ПГ благоприятный, особенно у детей, полное выздоровление обычно наступает в течение 6–8 нед. Рецидивы наблюдаются редко, и болезнь обычно не приводит к осложнениям. Исключение составляют взрослые пациенты, у них в 50% случаев может наблюдаться снижение функции почек, гипертония или стойкая протеинурия [33].
Постстрептококковый артрит (ПА) характеризуется внезапным появлением боли в суставах (чаще — крупных) через 7–10 дней после перенесенного фарингита. Как правило, ПА асимметричный и немигрирующий, продолжающийся от 8 до 156 дней и сопровождающийся припухлостью, синовитом, подтвержденным при помощи ультразвукового исследования. ПА отличается от мигрирующего артрита при ОРЛ отсутствием других критериев Джонса, характерных для ОРЛ. Маркеры воспаления, как правило, менее выражены, чем при ОРЛ, а нестероидные противовоспалительные препараты гораздо менее эффективны [34]. Посевы и иммунологические исследования крови через 1 мес. и более после лечения дали отрицательные результаты в 90,5% случаев.
В 1998 г. был описан новый синдром, названный PANDAS (детское аутоиммунное нейропсихиатрическое заболевание, связанное со стрептококками группы А, Pediatric Autoimmune Neuropsychiatric Disorder Associated with Streptococcus). Через 3 мес. после повторного эпизода фарингита, вызванного БГСА, внезапно появляются неприятные мысли и желание часто мыть руки без видимой причины, меняется мимика, возникают тикообразные гиперкинезы [35]. Исследование американских ученых показало, что множественные инфекции БГСА в течение одного года увеличивают риск нейропсихиатрических симптомов, но при этом в других исследованиях не продемонстрировано подобной взаимосвязи [36, 37]. Было предложено пять клинических критериев для диагностики: обсессивно-компульсивное расстройство или тики; начало препубертатного синдрома; эпизодическое течение, характеризующееся острым тяжелым началом и резким обострением симптомов; неврологические нарушения, такие как хореиформные движения во время обострения симптомов; временная взаимосвязь между
БГСА-инфекцией и обострением симптомов. Исход данного синдрома во многом зависит от обеспечения индивидуального подхода к лечению [38].
Принципом антибиотикотерапии острых БГСА-инфекций является предпочтительное использование β-лактамных препаратов. Из пероральных препаратов фармакокинетическими преимуществами в виде большей биодоступности перед ампициллином и феноксиметилпенициллином обладает амоксициллин. Из цефалоспоринов наиболее подходящими являются препараты I поколения. Макролиды рассматриваются как препараты резерва при непереносимости β-лактамов. К их недостаткам можно отнести меньшую эффективность, частично обусловленную возрастающей резистентностью. Использование фторхинолонов I поколения нерационально ввиду их неэффективности, а спектр действия левофлоксацина — наиболее известного респираторного фторхинолона — представляется избыточным, к тому же нежелательные эффекты наблюдаются чаще, чем у β-лактамов [39].
Проблема диагностики хронической ревматической болезни сердца на современном этапе
Заболеваемость хронической ревматической болезнью сердца (ХРБС) в последние годы имеет достоверную тенденцию к росту. Этой формой стрептококковой инфекции в среднем заболевают в 5 раз чаще, чем ОРЛ. Изучение эпидемиологии ОРЛ за период 2009–2016 гг. показало отсутствие тенденции к снижению распространенности данного заболевания, тогда как с 1996 по 2007 г. она достоверно снижалась [5]. Анализ эпидемической ситуации по стрептококковой инфекции в России в последние годы показал, что наиболее высокий уровень заболеваемости ОРЛ в РФ (5,9 на 100 000 населения) отмечается среди подростков. Этот факт позволяет отнести данный возраст к группе риска. Кроме этого, выявлен достоверный рост показателей заболеваемости ХРБС с 2009 по 2016 г. [39]. Можно отметить менее выраженный рост ОРЛ и ее долгосрочного осложнения — ХРБС в странах с высоким уровнем доходов, в основном из-за улучшения социально-экономического положения населения и эффективного инфекционного контроля с помощью бензатина пенициллина [40]. Тем не менее в нескольких развитых странах, таких как Австралия и Новая Зеландия, ХРБС остается актуальной проблемой, особенно для коренных народов, например австралийских аборигенов, в основном из-за плохой доступности медицинских ресурсов [41]. В странах с низким и средним уровнем доходов ХРБС остается серьезной проблемой здравоохранения из-за перенаселения, плохой гигиены и низкой приверженности вторичной профилактике [42]. По оценке D.A. Watkins et al. [37], в 2015 г. во всем мире было диагностировано около 33,4 млн случаев ХРБС, при этом менее 1% случаев приходилось на страны с высоким уровнем доходов. Число лет жизни с поправкой на инвалидность из-за ХРБС составляет 0,43% от общемирового количества лет жизни с поправкой на инвалидность по любой причине. Самая высокая стандартизованная по возрасту смертность наблюдалась в Океании, Южной Азии и Центральной Африке к югу от Сахары, в то время как наибольшее количество смертей от ХРБС, в порядке убывания, наблюдалось в Индии, Китае и Пакистане [39]. В Латинской Америке значительная часть населения подвержена высокому риску ХРБС [43]. Интересный пример являет Бразилия, где наблюдалось впечатляющее снижение заболеваемости и смертности от ХРБС, в то время как ее распространенность (от 1 до 7 случаев на 1000 населения) оставалась высокой по сравнению с развитыми странами (0,1–0,4 случая на 1000 школьников) [44]. Рецидивирующие эпизоды ОРЛ почти у 60% пациентов приводят к ХРБС, проявлением которой является поражение клапанного аппарата. Обычно это происходит через 10–20 лет после первоначального заболевания, но тяжелые случаи ОРЛ могут вызвать повреждение сердечных клапанов в остром периоде, когда у ребенка еще сохраняются симптомы [45].
Осложнения ХРБС включают сердечную недостаточность, эмболический инсульт, эндокардит и фибрилляцию предсердий [46]. Формирующаяся сердечная недостаточность вследствие клапанных поражений, возникающих в том числе и при латентном течении кардита, практически рефрактерна к консервативному лечению [47].
В течение последнего десятилетия интерес к ранней диагностике ХРБС для предотвращения рецидивов ОРЛ привел к увеличению числа скрининговых исследований на основе эхокардиографии (ЭхоКГ) [48]. Более того, крупномасштабный скрининг с использованием портативного ЭхоКГ-оборудования становится все более осуществимым и чрезвычайно эффективн
'fbм в регионах с высокой распространенностью заболевания [2]. Ранние популяционные эпидемиологические исследования распространенности ХРБС опирались в основном на клинические исследования [47]. Первая программа скрининга, в которой участвовали 16 развивающихся стран, полагалась исключительно на аускультацию сердца для диагностики ХРБС. Впоследствии скрининг ХРБС начал включать ЭхоКГ для подтверждения заболевания в клинически подозреваемых случаях [49]. Аускультация сердца имеет низкую чувствительность и специфичность для диагностики ХРБС. Последующие исследования неизменно подчеркивали превосходство ЭхоКГ в выявлении субклинического течения болезни [49].
Принимая во внимание проблемы, связанные с крупномасштабным скринингом, и критерии, используемые при диагностике ХРБС, Всемирная федерация сердца (WHF) разработала научно обоснованный подход к стандартизации ЭхоКГ-параметров для диагностики ХРБС [50]. Эти текущие критерии учитывают как морфологические, так и функциональные изменения клапанов сердца и предназначены для повышения точности диагностики ХРБС у детей без ОРЛ в анамнезе [43]. Недавно было показано, что распространенность субклинической ХРБС в 7–8 раз выше, чем распространенность клинически манифестного заболевания [51].
Обнаруженная при ЭхоКГ-исследовании ХРБС определяется как латентная в том случае, если отсутствуют аускультативные признаки вальвулита, предшествующей ОРЛ или известной ХРБС [52]. Предыдущие исследования естественного течения латентной ХРБС выявили прогрессирование клапанных поражений за относительно короткий период наблюдения [53]. В исследованиях с использованием ЭхоКГ применяются разные критерии определения прогрессирования, что, несомненно, должно стать поводом для разработки стандартного подхода [54]. Большинство детей с пограничными или умеренно выраженными ЭхоКГ-признаками латентной ХРБС подвергаются риску прогрессирования заболевания [53], особенно при наличии выраженных клапанных поражений [55]. Необходимость раннего начала долговременного лечения бензатина бензилпенициллином обусловлена хорошо доказанной эффективностью в предотвращении прогрессирования клапанных поражений [56].
Глобальный план действий ВОЗ нацелен на сокращение на 25% преждевременной смертности от неинфекционных заболеваний к 2025 г. Контроль и профилактика ХРБС будут играть важную роль в достижении этой цели [46, 57]. Имеющиеся на сегодняшний день данные свидетельствуют о том, что в обозримом будущем человечество не сможет избавиться от БГСА-инфекции. Волнообразный характер заболеваемости ОРЛ, очевидно обусловленный эпизодическим преобладанием ревматогенных штаммов БГСА, требует постоянного внимания клиницистов, обозначая ревматическую болезнь сердца как неисчезающую проблему.
Заключение
Распознавание и лечение стрептококковых инфекций было и остается актуальной проблемой педиатрии. Хотя понимание патогенеза заболеваний, вызванных БГСА, в последние годы значительно улучшилось, ключевые вопросы еще предстоит решить. Профилактика и раннее лечение стрептококковых инфекций — наиболее важные шаги в снижении частоты этих заболеваний.
Комплексный анализ эпидемических показателей и исходов постстрептококковых заболеваний демонстрирует высокую распр остраненность нераспознанной ОРЛ с исходом в ХРБС. В современных условиях ЭхоКГ-скрининг призван сыграть ключевую роль в повышении точности диагностики, осуществлении глобального контроля над ХРБС и уменьшении бремени болезни.
Сведения об авторах:
Санталова Галина Владимировна — д.м.н., профессор, заведующая кафедрой факультетской педиатрии ФГБОУ ВО СамГМУ Минздрава России; 443099, Россия, г. Самара, ул. Чапаевская, д. 89; ORCID iD 0000-0002-6078-2361.
Лебедев Петр Алексеевич — д.м.н., профессор, заведующий кафедрой терапии Института профессионального образования ФГБОУ ВО СамГМУ Минздрава России; 443099, Россия, г. Самара, ул. Чапаевская, д. 89; ORCID iD 0000-0003-3501-2354.
Гаранин Андрей Александрович — к.м.н., ассистент кафедры пропедевтической терапии ФГБОУ ВО СамГМУ Минздрава России; 443099, Россия, г. Самара, ул. Чапаевская, д. 89; ORCID iD 0000-0001-6665-1533.
Лямин Артем Владимирович — д.м.н., доцент, доцент кафедры общей и клинической микробиологии, иммунологии и аллергологии ФГБОУ ВО СамГМУ Минздрава России; 443099, Россия, г. Самара, ул. Чапаевская, д. 89; ORCID iD 0000-0002-5905-1895.
Кузин Максим Эдуардович — ординатор кафедры факультетской педиатрии ФГБОУ ВО СамГМУ Минздрава России; 443099, Россия, г. Самара, ул. Чапаевская, д. 89; ORCID iD 0000-0003-4656-3995.
Контактная информация: Гаранин Андрей Александрович, e-mail: sameagle@yandex.ru.
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 30.07.2021.
Поступила после рецензирования 24.08.2021.
Принята в печать 16.09.2021.
About the authors:
Galina V. Santalova — Dr. Sc. (Med.), Professor, Head of the Department of Faculty Pediatrics, Samara State Medical University; 89, Chapaevskaya str., Samara, 443099, Russian Federation; ORCID iD 0000-0002-6078-2361.
Petr A. Lebedev — Dr. Sc. (Med.), Professor, Head of the Department of Therapy of the Institute of Professional Education, Samara State Medical University; 89, Chapaevskaya str., Samara, 443099, Russian Federation; ORCID iD 0000-0003-3501-2354.
Andrey A. Garanin — C. Sc. (Med.), assistant of the Department of Propedeutic Therapy, Samara State Medical University; 89, Chapaevskaya str., Samara, 443099, Russian Federation; ORCID iD 0000-0001-6665-1533.
Artem A. Lyamin — Dr. Sc. (Med.), Associate Professor, associate professor of the Department of General and Clinical Microbiology, Immunology, and Allergology, Samara State Medical University; 89, Chapaevskaya str., Samara, 443099, Russian Federation; ORCID iD 0000-0002-5905-1895.
Maxim E. Kuzin — resident of the Department of Faculty Pediatrics, Samara State Medical University; 89, Chapaevskaya str., Samara, 443099, Russian Federation; ORCID iD 0000-0003-4656-3995.
Contact information: Andrey A. Garanin, e-mail: sameagle@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 30.07.2021.
Revised 24.08.2021.
Accepted 16.09.2021.











