
–ě—Ā—ā—Ä—č–Ķ –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–Ķ —Ä–Ķ–į–ļ—Ü–ł–ł (–ě–ź–†) ‚ÄĒ —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–į—Ź –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—Ź, —Ā –ļ–ĺ—ā–ĺ—Ä–ĺ–Ļ –ī–Ķ—ā–ł –Ņ—Ä–ĺ—Ö–ĺ–ī—Ź—ā –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ –≤ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź—Ö –į–Ľ–Ľ–Ķ—Ä–≥–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ą–ł–Ľ—Ź. –ě–ź–† —á–į—Ā—ā–ĺ –ĺ—ā–Ĺ–ĺ—Ā—Ź—ā –ļ –Ĺ–Ķ–ĺ—ā–Ľ–ĺ–∂–Ĺ—č–ľ —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł—Ź–ľ –ļ–į–ļ –≤–Ķ—Ā—Ć–ľ–į —Ā–Ķ—Ä—Ć–Ķ–∑–Ĺ—É—é –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ—É, —ā—Ä–Ķ–Ī—É—é—Č—É—é —Ā–ļ–ĺ—Ä–Ķ–Ķ —ć–ļ—Ā—ā—Ä–Ķ–Ĺ–Ĺ–ĺ–Ļ, —á–Ķ–ľ –Ņ–Ľ–į–Ĺ–ĺ–≤–ĺ–Ļ –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł–ł. –ü—Ä–ł—á–ł–Ĺ–į–ľ–ł –ě–ź–† —Ā—ā–į–Ĺ–ĺ–≤—Ź—ā—Ā—Ź –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –Ņ—Ä–ĺ–ī—É–ļ—ā—č –Ņ–ł—ā–į–Ĺ–ł—Ź –ł –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č. –ü–ĺ –ī–į–Ĺ–Ĺ—č–ľ –Ņ—É–Ī–Ľ–ł–ļ–į—Ü–ł–Ļ –Ņ–ĺ—Ā–Ľ–Ķ–ī–Ĺ–ł—Ö –Ľ–Ķ—ā, —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –į–Ľ–Ľ–Ķ—Ä–≥–ł–ł, –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ —Ä–Ķ–į–ļ—Ü–ł—Ź–ľ–ł –Ĺ–Ķ–ľ–Ķ–ī–Ľ–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ —ā–ł–Ņ–į –Ĺ–į –Ņ–ł—Č–Ķ–≤—č–Ķ –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ—č, —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ—ā 0,1‚Äď7,0%, –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü–į ‚ÄĒ 15,3‚Äď31,0% –ł –≤ –ļ–į–∂–ī–ĺ–ľ –≤—ā–ĺ—Ä–ĺ–ľ —Ā–Ľ—É—á–į–Ķ —Ā–ĺ—á–Ķ—ā–į–Ķ—ā—Ā—Ź —Ā –į–Ĺ–≥–ł–ĺ–ĺ—ā–Ķ–ļ–ĺ–ľ. –•—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–į—Ź –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü–į —É –ī–Ķ—ā–Ķ–Ļ –≤ –ĺ–Ī—Č–Ķ–Ļ –Ņ–ĺ–Ņ—É–Ľ—Ź—Ü–ł–ł –≤ —Ā—Ä–Ķ–ī–Ĺ–Ķ–ľ –≤—Ā—ā—Ä–Ķ—á–į–Ķ—ā—Ā—Ź —É 0,1‚Äď3% [1‚Äď9]. –ü—Ä–ĺ–ī—É–ļ—ā—č –Ņ–ł—ā–į–Ĺ–ł—Ź –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ —á–į—Ā—ā–ĺ –≤—č–∑—č–≤–į—é—ā –ě–ź–† ‚ÄĒ –Ņ–ł—Č–Ķ–≤—É—é –į–Ľ–Ľ–Ķ—Ä–≥–ł—é. –õ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–į—Ź –į–Ľ–Ľ–Ķ—Ä–≥–ł—Ź —Ā—Ä–Ķ–ī–ł –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č—Ö —Ā –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–ľ–ł —Ä–Ķ–į–ļ—Ü–ł—Ź–ľ–ł –≤—Ā—ā—Ä–Ķ—á–į–Ķ—ā—Ā—Ź –≤ 5‚Äď10% —Ā–Ľ—É—á–į–Ķ–≤. –†–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –ļ–ĺ–∂–Ĺ—č—Ö –Ĺ–Ķ–∂–Ķ–Ľ–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö —Ä–Ķ–į–ļ—Ü–ł–Ļ —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ—ā 2,2%; –į–Ĺ—ā–ł–Ī–ł–ĺ—ā–ł–ļ–ł —Ā—ā–į–Ĺ–ĺ–≤—Ź—ā—Ā—Ź –ł—Ö –Ņ—Ä–ł—á–ł–Ĺ–ĺ–Ļ –≤ 7% —Ā–Ľ—É—á–į–Ķ–≤, –Ņ—Ä–ł—á–Ķ–ľ –Ņ–ĺ–≤—ā–ĺ—Ä–Ĺ—č–Ķ —Ä–Ķ–į–ļ—Ü–ł–ł –≥–ł–Ņ–Ķ—Ä—á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł —Ä–į–∑–≤–ł–≤–į—é—ā—Ā—Ź —É 42% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤: —É 28% ‚ÄĒ –Ĺ–į —ā—É –∂–Ķ –≥—Ä—É–Ņ–Ņ—É –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤, –Ņ—Ä–ł —ć—ā–ĺ–ľ —ā–ĺ–Ľ—Ć–ļ–ĺ 10% –ĺ—ā –≤—Ā–Ķ—Ö –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —Ä–Ķ–į–ļ—Ü–ł–Ļ –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ—č –ł—Ā—ā–ł–Ĺ–Ĺ–ĺ–Ļ –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ļ –≥–ł–Ņ–Ķ—Ä—á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć—é [4, 10‚Äď13]. –ě–ź–† –≤–ĺ–∑–Ĺ–ł–ļ–į—é—ā –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ —É –Ľ–ł—Ü —Ā –≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ņ—Ä–Ķ–ī—Ä–į—Ā–Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć—é, –Ľ–ł—Ü–į –ľ—É–∂—Ā–ļ–ĺ–≥–ĺ –Ņ–ĺ–Ľ–į –Ņ–ĺ–ī–≤–Ķ—Ä–∂–Ķ–Ĺ—č –ł–ľ –≤ 2 —Ä–į–∑–į —á–į—Č–Ķ [2, 3].
–¶–Ķ–Ľ—Ć –ī–į–Ĺ–Ĺ–ĺ–≥–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź ‚ÄĒ –≤—č—Ź—Ā–Ĺ–ł—ā—Ć –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä—É—é—Č–ł—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ (–ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–≤ –ł–Ľ–ł –Ņ—Ä–ĺ–ī—É–ļ—ā–ĺ–≤ –Ņ–ł—ā–į–Ĺ–ł—Ź) –Ĺ–į –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ—É—é –ļ–į—Ä—ā–ł–Ĺ—É –ł —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –ĺ—Ā—ā—Ä—č—Ö –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł—Ö (–ě–ź–†) –ł –Ņ—Ā–Ķ–≤–ī–ĺ–į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł—Ö —Ä–Ķ–į–ļ—Ü–ł–Ļ (–ü–ź–†).
–ú–į—ā–Ķ—Ä–ł–į–Ľ –ł –ľ–Ķ—ā–ĺ–ī—č
–†–Ķ—ā—Ä–ĺ—Ā–Ņ–Ķ–ļ—ā–ł–≤–Ĺ–ĺ–Ķ —Ā—Ä–į–≤–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ĺ –Ĺ–į –Ī–į–∑–Ķ 23-–≥–ĺ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –ď–Ē–ö–Ď —Ā–≤. –í–Ľ–į–ī–ł–ľ–ł—Ä–į (–ú–ĺ—Ā–ļ–≤–į). –ü—Ä–ĺ–į–Ĺ–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ—č –≤—č–Ņ–ł—Ā–ļ–ł –ł–∑ –ł—Ā—ā–ĺ—Ä–ł–Ļ –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł 192 –ī–Ķ—ā–Ķ–Ļ –≤ –≤–ĺ–∑—Ä–į—Ā—ā–Ķ –ĺ—ā 6 –ľ–Ķ—Ā. –ī–ĺ 17 –Ľ–Ķ—ā 11 –ľ–Ķ—Ā. —Ā –ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č–ľ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ –ī–ł–į–≥–Ĺ–ĺ–∑–ĺ–ľ: ¬ę–ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü–į¬Ľ –ł–Ľ–ł ¬ę–ĺ—ā–Ķ–ļ –ö–≤–ł–Ĺ–ļ–Ķ¬Ľ, –Ĺ–į—Ö–ĺ–ī–ł–≤—ą–ł—Ö—Ā—Ź –Ĺ–į –Ľ–Ķ—á–Ķ–Ĺ–ł–ł –≤ 2010‚Äď2017 –≥–≥. –í—č–Ī–ĺ—Ä–ļ–į –Ņ—Ä–ĺ–ł–∑–≤–Ķ–ī–Ķ–Ĺ–į –Ņ—Ä–ĺ–ł–∑–≤–ĺ–Ľ—Ć–Ĺ–ĺ –ł–∑ –ļ–ĺ–ľ–Ņ—Ć—é—ā–Ķ—Ä–Ĺ–ĺ–≥–ĺ –į—Ä—Ö–ł–≤–į –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź. –Ē–ĺ–Ľ—Ź –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –ě–ź–†/–ü–ź–†, –Ņ—Ä–ĺ–Ľ–Ķ—á–Ķ–Ĺ–Ĺ—č—Ö –≤ —Ā–Ņ–Ķ—Ü–ł–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–ľ –į–Ľ–Ľ–Ķ—Ä–≥–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–ľ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł–ł, –Ķ–∂–Ķ–≥–ĺ–ī–Ĺ–ĺ —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ—ā 13‚Äď18,2% –ł –∑–į –Ņ–ĺ—Ā–Ľ–Ķ–ī–Ĺ–ł–Ķ 7 –Ľ–Ķ—ā –≤—č—Ä–ĺ—Ā–Ľ–į –Ĺ–į 5,2%. –í–Ķ—Ä–ł—Ą–ł–ļ–į—Ü–ł—Ź –ī–ł–į–≥–Ĺ–ĺ–∑–į –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–į—Ā—Ć —Ā–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –§–Ķ–ī–Ķ—Ä–į–Ľ—Ć–Ĺ—č–ľ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł—Ź–ľ –Ņ–ĺ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–Ķ –ł –Ľ–Ķ—á–Ķ–Ĺ–ł—é –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č –ł –ĺ—ā–Ķ–ļ–į –ö–≤–ł–Ĺ–ļ–Ķ (2013, 2015, 2018) —Ā –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł–Ķ–ľ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ļ—Ä–ł—ā–Ķ—Ä–ł–Ķ–≤ –ł —Ā–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ –ļ–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į-–Ĺ–ł–Ļ [1, 2, 7, 8]. –Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –≤ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –ĺ—Ā–Ĺ–ĺ–≤–Ĺ–ĺ–Ļ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ –ī–ł–į–≥–Ĺ–ĺ–∑ ¬ę–ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü–į¬Ľ –ł–ľ–Ķ–Ľ–ł 41,7% –ī–Ķ—ā–Ķ–Ļ, ¬ę–ĺ—ā–Ķ–ļ –ö–≤–ł–Ĺ–ļ–Ķ¬Ľ ‚ÄĒ 15,6%, —É 42,7% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ě–ź–†/–ü–ź–† –Ņ—Ä–ĺ—ā–Ķ–ļ–į–Ľ–į –ĺ–ī–Ĺ–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ —Ā —Ā–ł–ľ–Ņ—ā–ĺ–ľ–į–ľ–ł –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č –ł –į–Ĺ–≥–ł–ĺ–ĺ—ā–Ķ–ļ–į.–ü—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ĺ –ĺ–Ī—Č–Ķ–ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ķ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –ł –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–Ĺ–ĺ–Ķ ‚ÄĒ –į–Ĺ–į–Ľ–ł–∑ –ļ—Ä–ĺ–≤–ł —Ā –ĺ—Ü–Ķ–Ĺ–ļ–ĺ–Ļ –Ľ–Ķ–Ļ–ļ–ĺ—Ü–ł—ā–į—Ä–Ĺ–ĺ–Ļ —Ą–ĺ—Ä–ľ—É–Ľ—č –ł —ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ–ł–ł (91% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤), –Ņ–Ķ—á–Ķ–Ĺ–ĺ—á–Ĺ—č—Ö –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ (69%). –° —É—á–Ķ—ā–ĺ–ľ —Ā–Ľ–ĺ–∂–Ĺ–ĺ—Ā—ā–ł –ī–ł—Ą—Ą–Ķ—Ä–Ķ–Ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł —Ä–Ķ—Ü–ł–ī–ł–≤–ł—Ä—É—é—Č–ł—Ö –ě–ź–†/–ü–ź–† –≤ –Ņ–Ľ–į–Ĺ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ (–Ņ–ĺ –Ņ–ĺ–ļ–į–∑–į–Ĺ–ł—Ź–ľ) –≤–ļ–Ľ—é—á–į–Ľ–ł—Ā—Ć: –į–Ľ–Ľ–Ķ—Ä–≥–ĺ–ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–į (—Ā —É—á–Ķ—ā–ĺ–ľ —Ā—ā–į–ī–ł–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź); –£–ó–ė –Ī—Ä—é—ą–Ĺ–ĺ–Ļ –Ņ–ĺ–Ľ–ĺ—Ā—ā–ł, –Ņ–ł—Č–Ķ–≤–ĺ–ī–į –ł –∂–Ķ–Ľ—É–ī–ļ–į (7,3%); —ć–∑–ĺ—Ą–į–≥–ĺ–≥–į—Ā—ā—Ä–ĺ–ī—É–ĺ–ī–Ķ–Ĺ–ĺ—Ā–ļ–ĺ–Ņ–ł—Ź (12%); —Ā–Ķ—Ä–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź (7,8%) –Ĺ–į –į–Ĺ—ā–ł—ā–Ķ–Ľ–į –ļ –ł–Ĺ—Ą–Ķ–ļ—Ü–ł–ĺ–Ĺ–Ĺ—č–ľ –į–≥–Ķ–Ĺ—ā–į–ľ (¬ę–į—ā–ł–Ņ–ł—á–Ĺ—č–ľ¬Ľ –≤–Ĺ—É—ā—Ä–ł–ļ–Ľ–Ķ—ā–ĺ—á–Ĺ—č–ľ –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–į–ľ, –≤–ł—Ä—É—Ā–į–ľ); –ļ–ĺ–Ĺ—Ā—É–Ľ—Ć—ā–į—Ü–ł–ł –≤—Ä–į—á–Ķ–Ļ —Ā–ľ–Ķ–∂–Ĺ—č—Ö —Ā–Ņ–Ķ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ—Ā—ā–Ķ–Ļ ‚ÄĒ –ĺ—ā–ĺ–Ľ–į—Ä–ł–Ĺ–≥–ĺ–Ľ–ĺ–≥–į, –≥–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ–ĺ–≥–į, –ī–Ķ—Ä–ľ–į—ā–ĺ–Ľ–ĺ–≥–į.
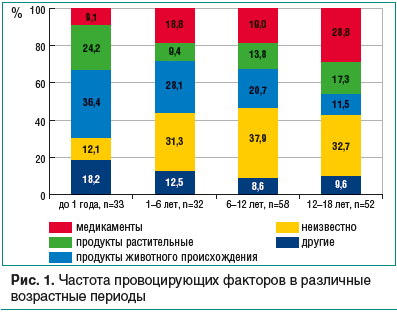
–í—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ –į–Ĺ–į–Ľ–ł–∑ anamnesis vitae et morbi –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, —ā—Č–į—ā–Ķ–Ľ—Ć–Ĺ–ĺ –ł–∑—É—á–Ķ–Ĺ—č –ł –Ņ—Ä–ĺ–į–Ĺ–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ—č —Ą–į–ļ—ā–ĺ—Ä—č, –Ĺ–Ķ–Ņ–ĺ—Ā—Ä–Ķ–ī—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ —Ā–Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä–ĺ–≤–į–≤—ą–ł–Ķ –ě–ź–†/–ü–ź–†. –ü—Ä–Ķ–ī–Ņ–ĺ–Ľ–į–≥–į–Ķ–ľ—č–Ķ –Ņ—Ä–ł—á–ł–Ĺ—č –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –ļ–ĺ–Ĺ–ļ—Ä–Ķ—ā–ł–∑–ł—Ä–ĺ–≤–į–Ĺ—č —Ä–ĺ–ī–ł—ā–Ķ–Ľ—Ź–ľ–ł –Ľ–ł—ą—Ć –≤ 73% —Ā–Ľ—É—á–į–Ķ–≤, –≤ 52 (27%) —Ā–Ľ—É—á–į—Ź—Ö –ĺ–Ĺ–ł –ĺ—Ā—ā–į–Ľ–ł—Ā—Ć –Ĺ–Ķ–ł–∑–≤–Ķ—Ā—ā–Ĺ—č–ľ–ł –≤–≤–ł–ī—É –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł—Ź –Ņ–ĺ–Ľ–Ĺ–ĺ–Ļ –ł–Ĺ—Ą–ĺ—Ä–ľ–į—Ü–ł–ł –ĺ –Ņ–ł—Č–Ķ–≤–ĺ–ľ —Ä–į—Ü–ł–ĺ–Ĺ–Ķ —Ä–Ķ–Ī–Ķ–Ĺ–ļ–į, –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ļ –Ņ–ĺ–Ľ–ł–Ņ—Ä–į–≥–ľ–į–∑–ł–ł, –ĺ—ā—Ā—Ä–ĺ—á–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ. –Ě–Ķ–≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā—Ć –≤–Ķ—Ä–ł—Ą–ł–ļ–į—Ü–ł–ł –Ņ—Ä–ł—á–ł–Ĺ—č –ě–ź–†/–ü–ź–† —Ä–ĺ—Ā–Ľ–į —Ā –≤–ĺ–∑—Ä–į—Ā—ā–ĺ–ľ —Ä–Ķ–Ī–Ķ–Ĺ–ļ–į, –Ņ–ł–ļ –Ĺ–Ķ–ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ņ—Ä–ł—ą–Ķ–Ľ—Ā—Ź –Ĺ–į 6‚Äď12 –Ľ–Ķ—ā ‚ÄĒ 37,9% (—Ä–ł—Ā. 1). –£ —á–į—Ā—ā–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ—Ä–ł—á–ł–Ĺ—č –Ĺ–Ķ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–ĺ–≤–į–Ľ–ł –ļ—Ä–ł—ā–Ķ—Ä–ł—Ź–ľ —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –≥—Ä—É–Ņ–Ņ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź, –Ņ–ĺ—ć—ā–ĺ–ľ—É –ľ—č –ł—Ā–ļ–Ľ—é—á–ł–Ľ–ł –ł–∑ –į–Ĺ–į–Ľ–ł–∑–į 17 –ł—Ā—ā–ĺ—Ä–ł–Ļ –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł. –í –≥—Ä—É–Ņ–Ņ—É –ł—Ā–ļ–Ľ—é—á–Ķ–Ĺ–ł—Ź –Ņ–ĺ–Ņ–į–Ľ–ł –ī–Ķ—ā–ł —Ā —Ą–ł–∑–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü–Ķ–Ļ –Ĺ–į —Ö–ĺ–Ľ–ĺ–ī –ł —Ā–ĺ–Ľ–Ĺ—Ü–Ķ, —É–ļ—É—Ā—č –Ĺ–į—Ā–Ķ–ļ–ĺ–ľ—č—Ö, –ļ—Ä–į—Ā–ļ—É –ī–Ľ—Ź –≤–ĺ–Ľ–ĺ—Ā (—Ö–Ĺ—É) –ł —ā—É–į–Ľ–Ķ—ā–Ĺ–ĺ–Ķ –ľ—č–Ľ–ĺ —Ā —Ü–ł—ā—Ä—É—Ā–ĺ–≤—č–ľ–ł –ī–ĺ–Ī–į–≤–ļ–į–ľ–ł, —Ä–Ķ–į–ļ—Ü–ł—Ź–ľ–ł –Ĺ–į –≤–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ —ā—É–Ī–Ķ—Ä–ļ—É–Ľ–ł–Ĺ–į –ł –į–ī—Ā–ĺ—Ä–Ī–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—É—é –ī–ł—Ą—ā–Ķ—Ä–ł–Ļ–Ĺ–ĺ-—Ā—ā–ĺ–Ľ–Ī–Ĺ—Ź—á–Ĺ—É—é –≤–į–ļ—Ü–ł–Ĺ—É (–ī–į–Ĺ–Ĺ—č–Ķ –Ņ—Ä–ł—á–ł–Ĺ—č —É–ļ–į–∑–į–Ĺ—č –≤–ľ–Ķ—Ā—ā–Ķ —Ā –Ņ–ł—Č–Ķ–≤—č–ľ–ł –Ņ–ĺ–≥—Ä–Ķ—ą–Ĺ–ĺ—Ā—ā—Ź–ľ–ł).
–Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –ł—Ā—Ö–ĺ–ī—Ź –ł–∑ –Ņ–ĺ—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ —Ü–Ķ–Ľ–ł –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź —Ā—Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ—č –≥—Ä—É–Ņ–Ņ—č —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź: –≥—Ä—É–Ņ–Ņ–į 1 ‚ÄĒ 46 –ī–Ķ—ā–Ķ–Ļ —Ā —Ä–Ķ–į–ļ—Ü–ł—Ź–ľ–ł –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ļ –≥–ł–Ņ–Ķ—Ä—á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺc—ā–ł (–†–õ–ď), —ā. –Ķ. —Ā –ě–ź–†/–ü–ź–†, –≤–ĺ–∑–Ĺ–ł–ļ—ą–ł–ľ–ł –Ĺ–į —Ą–ĺ–Ĺ–Ķ –Ņ—Ä–ł–Ķ–ľ–į –ł–Ľ–ł –ļ–ĺ–Ĺ—ā–į–ļ—ā–į —Ā —Ä–į–∑–Ľ–ł—á–Ĺ—č–ľ–ł –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–ľ–ł –≤–Ķ—Č–Ķ—Ā—ā–≤–į–ľ–ł; –≥—Ä—É–Ņ–Ņ–į 2 ‚ÄĒ 77 –ī–Ķ—ā–Ķ–Ļ —Ā –ě–ź–†/–ü–ź–†, —Ä–į–∑–≤–ł–≤—ą–ł–ľ–ł—Ā—Ź –≤ –ĺ—ā–≤–Ķ—ā –Ĺ–į –Ņ—Ä–ł–Ķ–ľ –Ņ—Ä–ĺ–ī—É–ļ—ā–ĺ–≤ –Ņ–ł—ā–į–Ĺ–ł—Ź.
–†–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –ł –ĺ–Ī—Ā—É–∂–ī–Ķ–Ĺ–ł–Ķ
–†–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ –ī–Ķ—ā–Ķ–Ļ –Ņ–ĺ –≤–ĺ–∑—Ä–į—Ā—ā—É –≤ –≥—Ä—É–Ņ–Ņ–į—Ö —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–ĺ –Ĺ–į —Ä–ł—Ā. 2. –ě—ā–ľ–Ķ—á–į–Ķ—ā—Ā—Ź –≤—č—Ā–ĺ–ļ–ł–Ļ –Ņ—Ä–ĺ—Ü–Ķ–Ĺ—ā (–≤ 4 —Ä–į–∑–į –Ī–ĺ–Ľ—Ć—ą–Ķ) –ī–Ķ—ā–Ķ–Ļ –≥—Ä—É–ī–Ĺ–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į –≤ –≥—Ä—É–Ņ–Ņ–Ķ —Ā –Ņ–ł—Č–Ķ–≤—č–ľ–ł –ě–ź–†/–ü–ź–†, –Ĺ–į–Ņ—Ä–ĺ—ā–ł–≤, –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā—ā–į—Ä—ą–Ķ 12 –Ľ–Ķ—ā –≤ 2,2 —Ä–į–∑–į –Ī–ĺ–Ľ—Ć—ą–Ķ –≤ –≥—Ä—É–Ņ–Ņ–Ķ —Ā –†–õ–ď. –Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –ī–Ķ—ā–ł –ľ–Ľ–į–ī—ą–Ķ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į —á–į—Č–Ķ –Ņ–ĺ–ī–≤–Ķ—Ä–∂–Ķ–Ĺ—č –Ņ–ł—Č–Ķ–≤—č–ľ –ě–ź–†/–ü–ź–†, –į –Ņ–ĺ–ī—Ä–ĺ—Ā—ā–ļ–ł ‚ÄĒ –†–õ–ď. –ď–Ķ–Ĺ–ī–Ķ—Ä–Ĺ—č–Ķ —Ä–į–∑–Ľ–ł—á–ł—Ź —Ā—Ä–Ķ–ī–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –ě–ź–†/–ü–ź–† –Ņ—Ä–ĺ—Ź–≤–ł–Ľ–ł—Ā—Ć –Ľ–ł–ī–Ķ—Ä—Ā—ā–≤–ĺ–ľ –ľ–į–Ľ—Ć—á–ł–ļ–ĺ–≤ (–Ĺ–į 14 –ł 20% –Ī–ĺ–Ľ—Ć—ą–Ķ –≤ –≥—Ä—É–Ņ–Ņ–į—Ö 1 –ł 2 —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ).

–°—Ä–į–≤–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ –į–Ĺ–į–Ľ–ł–∑ –Ņ—Ä–ł—á–ł–Ĺ, —Ā–Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä–ĺ–≤–į–≤—ą–ł—Ö –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ –ł –Ņ—Ä–Ķ–ī—ą–Ķ—Ā—ā–≤—É—é—Č–ł–Ķ —Ä–Ķ–į–ļ—Ü–ł–ł, –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ—Ź–Ķ—ā –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ –ł–Ĺ—ā–Ķ—Ä–Ķ—Ā–Ĺ—É—é –ł –Ņ—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ł –∑–Ĺ–į—á–ł–ľ—É—é —á–į—Ā—ā—Ć –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź. –ė–∑—É—á–Ķ–Ĺ–ł–Ķ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–į –Ņ–ĺ–ļ–į–∑–į–Ľ–ĺ, —á—ā–ĺ –≤ –≥—Ä—É–Ņ–Ņ–Ķ 1 (–†–õ–ď) –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü–į (–ł–Ľ–ł –į–Ĺ–≥–ł–ĺ–ĺ—ā–Ķ–ļ) –≤ –ĺ—ā–≤–Ķ—ā –Ĺ–į –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā—č —Ä–į–∑–≤–ł–Ľ–į—Ā—Ć —É 26,1% –ī–Ķ—ā–Ķ–Ļ, –Ņ—Ä–ł—á–Ķ–ľ —á–Ķ—ā–≤–Ķ—Ä—ā—Ć –ł–∑ –Ĺ–ł—Ö –Ņ–ĺ–≤—ā–ĺ—Ä–ł–Ľ–ł –Ņ—Ä–Ķ–ī—č–ī—É—Č–ł–Ķ –ĺ—ą–ł–Ī–ļ–ł (–Ņ—Ä–ł–Ķ–ľ –į–Ĺ—ā–ł–Ī–ł–ĺ—ā–ł–ļ–į –ł –∂–į—Ä–ĺ–Ņ–ĺ–Ĺ–ł–∂–į—é—Č–Ķ–≥–ĺ —Ā—Ä–Ķ–ī—Ā—ā–≤–į –Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤–Ķ –ł–Ī—É–Ņ—Ä–ĺ—Ą–Ķ–Ĺ–į). –ü—Ä–Ķ–ī—ą–Ķ—Ā—ā–≤—É—é—Č–ł–Ķ —Ä–Ķ–į–ļ—Ü–ł–ł –Ĺ–į –Ņ–ł—Č—É –≤ —ć—ā–ĺ–Ļ –≥—Ä—É–Ņ–Ņ–Ķ –ł–ľ–Ķ–Ľ–ł –Ľ–ł—ą—Ć 10,9% –ī–Ķ—ā–Ķ–Ļ. –í –≥—Ä—É–Ņ–Ņ–Ķ 2 (–ě–ź–†/–ü–ź–† –Ĺ–į –Ņ—Ä–ĺ–ī—É–ļ—ā—č –Ņ–ł—ā–į–Ĺ–ł—Ź) —Ä–Ķ–į–ļ—Ü–ł—Ź –Ĺ–į –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā—č –≤ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–Ķ –≤—Ā—ā—Ä–Ķ—á–į–Ľ–į—Ā—Ć –≤ 2,6 —Ä–į–∑–į (10,2%) —Ä–Ķ–∂–Ķ, –į –Ĺ–į –Ņ–ł—Č—É –≤ 3,3 —Ä–į–∑–į (36,4%) —á–į—Č–Ķ. –Ě–į—Ā—ā–ĺ—Ä–į–∂–ł–≤–į–Ķ—ā, —á—ā–ĺ —É 14,3% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ (–ļ–į–∂–ī—č–Ļ 7-–Ļ –Ī–ĺ–Ľ—Ć–Ĺ–ĺ–Ļ) –Ņ–ĺ–≤—ā–ĺ—Ä–Ĺ–ĺ —Ä–į–∑–≤–ł–Ľ–ł—Ā—Ć —Ā–ł–ľ–Ņ—ā–ĺ–ľ—č –ě–ź–†/–ü–ź–† –Ĺ–į —ā–Ķ –∂–Ķ –Ņ—Ä–ĺ–ī—É–ļ—ā—č, –Ĺ–į –ļ–ĺ—ā–ĺ—Ä—č–Ķ —Ä–į–Ĺ–Ķ–Ķ —É–∂–Ķ –Ī—č–Ľ–į —Ä–Ķ–į–ļ—Ü–ł—Ź: —Ź–Ļ—Ü–į, –ľ–ĺ—Ä–ļ–ĺ–≤—Ć, –ĺ—Ä–Ķ—Ö–ł, —Ā–Ķ–ľ–Ķ—á–ļ–ł, –ľ–ĺ—Ä–Ķ–Ņ—Ä–ĺ–ī—É–ļ—ā—č. –Ě–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ –∑–į–ľ–Ķ—ā–ł—ā—Ć, —á—ā–ĺ –ł–∑ 10 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ĺ–į–Ľ–ł—á–ł–Ķ–ľ –Ņ—č–Ľ—Ć—Ü–Ķ–≤–ĺ–Ļ –į–Ľ–Ľ–Ķ—Ä–≥–ł–ł –≤ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–Ķ —É 6 –ī–Ķ—ā–Ķ–Ļ –Ĺ–į—Ā—ā–ĺ—Ź—Č–į—Ź –ě–ź–† –ľ–ĺ–≥–Ľ–į –Ī—č—ā—Ć –Ņ–Ķ—Ä–Ķ–ļ—Ä–Ķ—Ā—ā–Ĺ–ĺ–Ļ, —ā. –Ķ. —Ā–Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–Ļ –Ņ—Ä–ĺ–ī—É–ļ—ā–į–ľ–ł –Ņ–ł—ā–į–Ĺ–ł—Ź (–ľ–ĺ—Ä–ļ–ĺ–≤—Ć, –ĺ—Ä–Ķ—Ö–ł, —Ą—Ä—É–ļ—ā—č, —Ā–ĺ–ļ–ł, —Ą—Ä—É–ļ—ā–ĺ–≤—č–Ļ —á–į–Ļ). –Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, —á–Ķ—ā–ļ–ĺ –Ņ—Ä–ĺ—Ā–Ľ–Ķ–∂–ł–≤–į–Ķ—ā—Ā—Ź –Ņ—Ä–Ķ–Ķ–ľ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä—É—é—Č–ł—Ö –ě–ź–†/–ü–ź–† —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ –≤ –ī–ł–Ĺ–į–ľ–ł–ļ–Ķ —Ä–Ķ—Ü–ł–ī–ł–≤–ĺ–≤ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź.
–ź–Ĺ–į–Ľ–ł–∑ –Ņ—Ä–ł—á–ł–Ĺ, —Ā–Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä–ĺ–≤–į–≤—ą–ł—Ö –Ĺ–į—Ā—ā–ĺ—Ź—Č—É—é –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł—é, –Ņ—Ä–ĺ–ī–Ķ–ľ–ĺ–Ĺ—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ľ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ķ –∑–Ĺ–į—á–ł–ľ–ĺ—Ā—ā–ł –Ņ—Ä–ł—á–ł–Ĺ–Ĺ—č—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ –≤ –∑–į–≤–ł—Ā–ł–ľ–ĺ—Ā—ā–ł –ĺ—ā –≤–ĺ–∑—Ä–į—Ā—ā–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į (—Ā–ľ. —Ä–ł—Ā. 1). –ě–Ī—Ä–į—Č–į–Ķ—ā –Ĺ–į —Ā–Ķ–Ī—Ź –≤–Ĺ–ł–ľ–į–Ĺ–ł–Ķ —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł–Ķ –≤ 2 —Ä–į–∑–į –∑–Ĺ–į—á–ł–ľ–ĺ—Ā—ā–ł –Ņ–ł—Č–Ķ–≤—č—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ (—Ā 60,6% —É –ī–Ķ—ā–Ķ–Ļ –ī–ĺ 1 –≥–ĺ–ī–į –∂–ł–∑–Ĺ–ł –ī–ĺ 28,8% —É –ī–Ķ—ā–Ķ–Ļ –≤ –≤–ĺ–∑—Ä–į—Ā—ā–Ķ —Ā—ā–į—Ä—ą–Ķ 12 –Ľ–Ķ—ā) –ł —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –≤ 3 —Ä–į–∑–į —Ä–ĺ–Ľ–ł –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö —Ā—Ä–Ķ–ī—Ā—ā–≤ (—Ā 9,1 –ī–ĺ 28,8% —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ) –≤ —Ä–į–∑–≤–ł—ā–ł–ł –ě–ź–†/–ü–ź–† –Ņ–ĺ –ľ–Ķ—Ä–Ķ –≤–∑—Ä–ĺ—Ā–Ľ–Ķ–Ĺ–ł—Ź —Ä–Ķ–Ī–Ķ–Ĺ–ļ–į. –°—Ä–Ķ–ī–ł –Ņ—Ä–ł—á–ł–Ĺ –Ņ–ł—Č–Ķ–≤—č—Ö —Ä–Ķ–į–ļ—Ü–ł–Ļ —É –ī–Ķ—ā–Ķ–Ļ –≥—Ä—É–ī–Ĺ–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į –Ņ—Ä–Ķ–≤–į–Ľ–ł—Ä—É—é—ā –Ņ—Ä–ĺ–ī—É–ļ—ā—č –∂–ł–≤–ĺ—ā–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–∂–ī–Ķ–Ĺ–ł—Ź (36,4%): –ľ–ĺ–Ľ–ĺ–ļ–ĺ –ł —Ā–ľ–Ķ—Ā–ł –Ĺ–į –ļ–ĺ—Ä–ĺ–≤—Ć–Ķ–ľ –ľ–ĺ–Ľ–ĺ–ļ–Ķ, —Ź–Ļ—Ü–į, –ľ—Ź—Ā–ĺ (–ļ—É—Ä–ł—Ü–į, –ł–Ĺ–ī–Ķ–Ļ–ļ–į, –≥–ĺ–≤—Ź–ī–ł–Ĺ–į), —Ä—č–Ī–į. –ü–ĺ—Ā–Ľ–Ķ 12 –Ľ–Ķ—ā –ł—Ö –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –Ņ–į–ī–į–Ķ—ā –ī–ĺ 11,5% (—Ä—č–Ī–į, –ļ—Ä–Ķ–≤–Ķ—ā–ļ–ł, –ļ–ĺ–Ľ–Ī–į—Ā—č). –ě—ā–ľ–Ķ—ā–ł–ľ, —á—ā–ĺ —Ā–Ņ–Ķ–ļ—ā—Ä —Ä–į—Ā—ā–ł—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –Ņ—Ä–ĺ–ī—É–ļ—ā–ĺ–≤, –Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä—É—é—Č–ł—Ö –ě–ź–†/–ü–ź–† —É –ī–Ķ—ā–Ķ–Ļ, –Ņ–ĺ—á—ā–ł –Ĺ–Ķ –ľ–Ķ–Ĺ—Ź–Ķ—ā—Ā—Ź —Ā –≤–ĺ–∑—Ä–į—Ā—ā–ĺ–ľ: —Ą—Ä—É–ļ—ā—č (–į–Ī—Ä–ł–ļ–ĺ—Ā—č, –Ņ–Ķ—Ä—Ā–ł–ļ–ł, —Ź–Ī–Ľ–ĺ–ļ–ł), —Ź–≥–ĺ–ī—č –ł —Ā–ĺ–ļ–ł –ł–∑ –Ĺ–ł—Ö, –ĺ—Ä–Ķ—Ö–ł –ł —Ā–Ķ–ľ–Ķ—á–ļ–ł, –ĺ–ī–Ĺ–į–ļ–ĺ —Ä–į—Ā—ą–ł—Ä—Ź–Ķ—ā—Ā—Ź –∑–į —Ā—á–Ķ—ā —Ą—Ä—É–ļ—ā–ĺ–≤ —ć–ļ–∑–ĺ—ā–ł—á–Ķ—Ā–ļ–ł—Ö —Ā–ĺ—Ä—ā–ĺ–≤ (—Ü–ł—ā—Ä—É—Ā–ĺ–≤—č—Ö, –ļ–ł–≤–ł), –ľ–Ķ–ī–į, —Ā–Ņ–Ķ—Ü–ł–Ļ.
–°–Ľ–Ķ–ī—É–Ķ—ā –∑–į–ľ–Ķ—ā–ł—ā—Ć, —á—ā–ĺ —Ä–ĺ–ī–ł—ā–Ķ–Ľ–ł –Ņ—Ä–Ķ–ī–Ķ–Ľ—Ć–Ĺ–ĺ –≤–Ĺ–ł–ľ–į—ā–Ķ–Ľ—Ć–Ĺ—č –≤ —É—Ö–ĺ–ī–Ķ –∑–į –ī–Ķ—ā—Ć–ľ–ł –≥—Ä—É–ī–Ĺ–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į –ł –Ņ–ĺ—á—ā–ł –≤—Ā–Ķ–≥–ī–į –∑–Ĺ–į—é—ā –Ņ—Ä–ł—á–ł–Ĺ—É –ě–ź–†/–ü–ź–†. –ó–į—Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ĺ—č –Ķ–ī–ł–Ĺ–ł—á–Ĺ—č–Ķ —Ā–Ľ—É—á–į–ł —Ä–Ķ–į–ļ—Ü–ł–Ļ –Ĺ–į –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā—č (—Ą–Ķ–Ĺ—Ā–Ņ–ł—Ä–ł–ī, –Ļ–ĺ–ī), –Ņ—Ä–ł—á–Ķ–ľ —ć—ā–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č –Ī—č–Ľ–ł –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ—č —Ā –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ–ľ –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ—č—Ö –Ņ–ĺ–ļ–į–∑–į–Ĺ–ł–Ļ, –ĺ–ī–Ĺ–į–ļ–ĺ –ĺ—ą–ł–Ī–ĺ–ļ —Ā –Ņ–ĺ–≤—ā–ĺ—Ä–Ĺ—č–ľ –Ņ—Ä–ł–Ķ–ľ–ĺ–ľ —ć—ā–ł—Ö —Ā—Ä–Ķ–ī—Ā—ā–≤ –Ĺ–Ķ –ĺ—ā–ľ–Ķ—á–Ķ–Ĺ–ĺ. –í –≤–ĺ–∑—Ä–į—Ā—ā–Ķ —Ā—ā–į—Ä—ą–Ķ 12 –Ľ–Ķ—ā –≤–ĺ–∑—Ä–į—Ā—ā–į–Ķ—ā –∑–Ĺ–į—á–ł–ľ–ĺ—Ā—ā—Ć –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤, –Ņ—Ä–ł—á–Ķ–ľ —Ā—Ä–Ķ–ī–ł –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ—č—Ö –Ņ—Ä–ł—á–ł–Ĺ —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä—É—é—ā—Ā—Ź –ĺ–Ī—Č–ł–Ķ —Ä–Ķ–į–ļ—Ü–ł–ł –Ĺ–į —ā–ĺ–Ņ–ł—á–Ķ—Ā–ļ–ł–Ķ –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–Ķ —Ā—Ä–Ķ–ī—Ā—ā–≤–į (–≥—Ä–į–ľ–ł—Ü–ł–ī–ł–Ĺ C + —Ü–Ķ—ā–ł–Ľ–Ņ–ł—Ä–ł–ī–ł–Ĺ–ł—Ź —Ö–Ľ–ĺ—Ä–ł–ī, –į–ľ–ł–Ľ–ľ–Ķ—ā–į–ļ—Ä–Ķ–∑–ĺ–Ľ + –ī–ł—Ö–Ľ–ĺ—Ä–Ī–Ķ–Ĺ–∑–ł–Ľ–ĺ–≤—č–Ļ —Ā–Ņ–ł—Ä—ā, —Ą—Ä–į–ľ–ł—Ü–Ķ—ā–ł–Ĺ), –į —ā–į–ļ–∂–Ķ –Ņ—Ä–ĺ–ī—É–ļ—ā—č –Ī—č—ā–ĺ–≤–ĺ–Ļ —Ö–ł–ľ–ł–ł –ľ–Ķ—Ā—ā–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź (–Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–į, –ļ—Ä–Ķ–ľ—č, –ľ—č–Ľ–ĺ, –ļ—Ä–į—Ā–ļ–į –ī–Ľ—Ź –≤–ĺ–Ľ–ĺ—Ā ‚ÄĒ —Ö–Ĺ–į).
–Ē–Ķ—ā–į–Ľ—Ć–Ĺ—č–Ļ –į–Ĺ–į–Ľ–ł–∑ –Ņ—Ä–ł—á–ł–Ĺ –ě–ź–†/–ü–ź–† —É –ī–Ķ—ā–Ķ–Ļ —Ā –†–õ–ď (–≥—Ä—É–Ņ–Ņ–į 1) –Ņ–ĺ–ļ–į–∑–į–Ľ, —á—ā–ĺ —Ä–ĺ–ī–ł—ā–Ķ–Ľ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ—Ä–ł —Ā–Ī–ĺ—Ä–Ķ anamnesis morbi –≤ –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–Ķ —Ā–Ľ—É—á–į–Ķ–≤ (80%) –ļ–ĺ–Ĺ–ļ—Ä–Ķ—ā–Ĺ–ĺ —É–ļ–į–∑—č–≤–į—é—ā –ĺ–ī–Ĺ–ĺ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–Ĺ–ĺ–Ķ –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ķ —Ā—Ä–Ķ–ī—Ā—ā–≤–ĺ, –≤—č–∑—č–≤–į—é—Č–Ķ–Ķ —Ä–Ķ–į–ļ—Ü–ł—é, –į –≤ –≥—Ä—É–Ņ–Ņ–Ķ 2 (–Ņ–ł—Č–Ķ–≤—č–Ķ —Ä–Ķ–į–ļ—Ü–ł–ł) ‚ÄĒ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–Ĺ–į—Ź –Ņ—Ä–ł—á–ł–Ĺ–į –ł–∑–≤–Ķ—Ā—ā–Ĺ–į –Ľ–ł—ą—Ć –≤ 53% —Ā–Ľ—É—á–į–Ķ–≤.
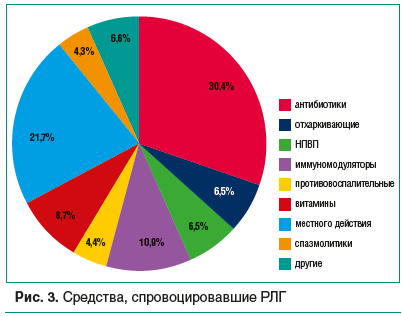
–í –≥—Ä—É–Ņ–Ņ–Ķ 1 (–ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ—č–Ķ –ě–ź–†/–ü–ź–†) —É –ļ–į–∂–ī–ĺ–≥–ĺ —ā—Ä–Ķ—ā—Ć–Ķ–≥–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –Ņ—Ä–ł—á–ł–Ĺ–ĺ–Ļ —Ā—ā–į–Ľ –Ņ—Ä–ł–Ķ–ľ –į–Ĺ—ā–ł–Ī–ł–ĺ—ā–ł–ļ–ĺ–≤ (30,4%), –Ľ–ł–ī–Ķ—Ä–į–ľ–ł –ĺ–ļ–į–∑–į–Ľ–ł—Ā—Ć –į–ľ–ł–Ĺ–ĺ–Ņ–Ķ–Ĺ–ł—Ü–ł–Ľ–Ľ–ł–Ĺ—č (86%), —á—ā–ĺ –∑–į–ļ–ĺ–Ĺ–ĺ–ľ–Ķ—Ä–Ĺ–ĺ –≤–≤–ł–ī—É –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź —Ā–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č—Ö —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł–Ļ –ĺ –Ņ–ĺ—Ä—Ź–ī–ļ–Ķ –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –į–Ĺ—ā–ł–Ī–į–ļ—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –Ņ—Ä–ł —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ—č—Ö –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź—Ö –ī–Ķ—ā—Ā–ļ–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į (–ī—č—Ö–į—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –ł –ľ–ĺ—á–Ķ–≤—č–≤–ĺ–ī—Ź—Č–Ķ–Ļ —Ā–ł—Ā—ā–Ķ–ľ, –õ–ě–†-–ĺ—Ä–≥–į–Ĺ–ĺ–≤) (—Ä–ł—Ā. 3). –ė–Ĺ—ā–Ķ—Ä–Ķ—Ā–Ĺ–ĺ, —á—ā–ĺ –Ņ–ĺ–Ľ–ĺ–≤–ł–Ĺ—É —Ā–Ľ—É—á–į–Ķ–≤ —Ä–Ķ–į–ļ—Ü–ł–Ļ (–≤–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ, –ü–ź–†) –Ĺ–į –į–ľ–ł–Ĺ–ĺ–Ņ–Ķ–Ĺ–ł—Ü–ł–Ľ–Ľ–ł–Ĺ—č —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–ł —Ä–Ķ–į–ļ—Ü–ł–ł –Ĺ–į –∑–į—Č–ł—Č–Ķ–Ĺ–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č (–ļ–Ľ–į–≤—É–Ľ–į–Ĺ–į—ā—č), –Ņ–ĺ—Ā–ļ–ĺ–Ľ—Ć–ļ—É –ļ–Ľ–į–≤—É–Ľ–į–Ĺ–ĺ–≤–į—Ź –ļ–ł—Ā–Ľ–ĺ—ā–į –Ņ–ĺ–ī–į–≤–Ľ—Ź–Ķ—ā –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ –Ņ–Ķ—á–Ķ–Ĺ–ł (–ľ–Ķ—ā–ł–Ľ—ā—Ä–į–Ĺ—Ā—Ą–Ķ—Ä–į–∑—č –ł –ī–ł–į–ľ–ł–Ĺ–ĺ–ļ—Ā–ł–ī–į–∑—č), –Ĺ–į—Ä—É—ą–į—Ź –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ –≥–ł—Ā—ā–į–ľ–ł–Ĺ–į. –ē—Č–Ķ —É 14% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ä–į–∑–≤–ł–Ľ–į—Ā—Ć –ě–ź–†/–ü–ź–† –Ĺ–į –ľ–į–ļ—Ä–ĺ–Ľ–ł–ī—č (—ć—Ä–ł—ā—Ä–ĺ–ľ–ł—Ü–ł–Ĺ, –į–∑–ł—ā—Ä–ĺ–ľ–ł—Ü–ł–Ĺ) [12, 13, 22]. –ė–ľ–ľ—É–Ĺ–ĺ–ľ–ĺ–ī—É–Ľ—Ź—ā–ĺ—Ä—č (—ā–ł–Ľ–ĺ—Ä–ĺ–Ĺ, –Ī–Ķ–Ĺ–∑–ĺ–ļ–į–ł–Ĺ + –ł–Ĺ—ā–Ķ—Ä—Ą–Ķ—Ä–ĺ–Ĺ –į–Ľ—Ć—Ą–į-2b + —ā–į—É—Ä–ł–Ĺ, –ł–Ĺ—ā–Ķ—Ä—Ą–Ķ—Ä–ĺ–Ĺ –į–Ľ—Ć—Ą–į-2b) —Ā—ā–į–Ľ–ł –Ņ—Ä–ł—á–ł–Ĺ–ĺ–Ļ –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č/–į–Ĺ–≥–ł–ĺ–ĺ—ā–Ķ–ļ–į —É 10,9% –ī–Ķ—ā–Ķ–Ļ, –≤–ł—ā–į–ľ–ł–Ĺ—č ‚ÄĒ —É 8,7%, –ĺ—ā—Ö–į—Ä–ļ–ł–≤–į—é—Č–ł–Ķ —Ā—Ä–Ķ–ī—Ā—ā–≤–į (–į—Ü–Ķ—ā–ł–Ľ—Ü–ł—Ā—ā–Ķ–ł–Ĺ, –Ī—Ä–ĺ–ľ–≥–Ķ–ļ—Ā–ł–Ĺ + –≥–≤–į–Ļ—Ą–Ķ–Ĺ–Ķ–∑–ł–Ĺ + —Ā–į–Ľ—Ć–Ī—É—ā–į–ľ–ĺ–Ľ, –į–ľ–Ī—Ä–ĺ–ļ—Ā–ĺ–Ľ) ‚ÄĒ —É 6,5%, –Ě–ü–í–ü (–ł–Ī—É–Ņ—Ä–ĺ—Ą–Ķ–Ĺ, –Ņ–į—Ä–į—Ü–Ķ—ā–į–ľ–ĺ–Ľ) ‚ÄĒ —É 6,5%, –Ņ—Ä–ĺ—ā–ł–≤–ĺ–≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ķ (—Ą–Ķ–Ĺ—Ā–Ņ–ł—Ä–ł–ī) ‚ÄĒ —É 4,4%, —Ā–Ņ–į–∑–ľ–ĺ–Ľ–ł—ā–ł–ļ–ł (–ľ–Ķ—ā–į–ľ–ł–∑–ĺ–Ľ –Ĺ–į—ā—Ä–ł—Ź + –Ņ–ł—ā–ĺ—Ą–Ķ–Ĺ–ĺ–Ĺ + —Ą–Ķ–Ĺ–Ņ–ł–≤–Ķ—Ä–ł–Ĺ–ł—Ź –Ī—Ä–ĺ–ľ–ł–ī, –ī—Ä–ĺ—ā–į–≤–Ķ—Ä–ł–Ĺ) ‚ÄĒ —É 4,3% (–≤ —ā. —á. –ī–Ķ–≤–ĺ—á–ļ–ł 17 –Ľ–Ķ—ā, –Ņ—Ä–ł–Ĺ–ł–ľ–į–≤—ą–ł–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č –Ņ–ĺ –Ņ–ĺ–≤–ĺ–ī—É –Ī–ĺ–Ľ–Ķ–≤–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į –Ņ—Ä–ł –ľ–Ķ–Ĺ—Ā—ā—Ä—É–į—Ü–ł—Ź—Ö), –ī—Ä—É–≥–ł–Ķ (–ī–ł–Ņ–ł—Ä–ł–ī–į–ľ–ĺ–Ľ, —Ü–ł–Ĺ–Ĺ–į—Ä–ł–∑–ł–Ĺ, —Ą—ā–į–Ľ–ł–Ľ—Ā—É–Ľ—Ć—Ą–į—ā–ł–į–∑–ĺ–Ľ) ‚ÄĒ —É 6,5%. –ė–Ĺ—ā–Ķ—Ä–Ķ—Ā–Ĺ–ĺ, —á—ā–ĺ 21,7% –ī–Ķ—ā–Ķ–Ļ –ĺ—ā–≤–Ķ—ā–ł–Ľ–ł –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ–ĺ–Ļ —Ä–Ķ–į–ļ—Ü–ł–Ķ–Ļ –Ĺ–į –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–Ķ —Ā—Ä–Ķ–ī—Ā—ā–≤–į –ľ–Ķ—Ā—ā–Ĺ–ĺ–≥–ĺ –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź (–Ļ–ĺ–ī, –į–ľ–ł–Ľ–ľ–Ķ—ā–į–ļ—Ä–Ķ–∑–ĺ–Ľ + –ī–ł—Ö–Ľ–ĺ—Ä–Ī–Ķ–Ĺ–∑–ł–Ľ–ĺ–≤—č–Ļ —Ā–Ņ–ł—Ä—ā, –≥—Ä–į–ľ–ł—Ü–ł–ī–ł–Ĺ C + —Ü–Ķ—ā–ł–Ľ–Ņ–ł—Ä–ł–ī–ł–Ĺ–ł—Ź —Ö–Ľ–ĺ—Ä–ł–ī, —Ą—É–∑–į—Ą—É–Ĺ–≥–ł–Ĺ, —Ą—Ä–į–ľ–ł—Ü–Ķ—ā–ł–Ĺ, –ī–Ķ–ļ—Ā–Ņ–į–Ĺ—ā–Ķ–Ĺ–ĺ–Ľ).
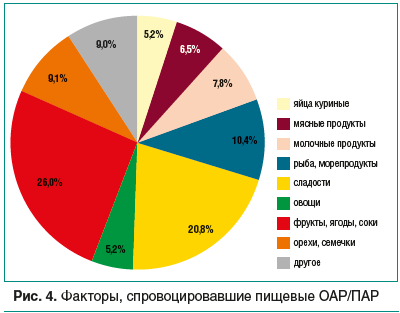
–í –≥—Ä—É–Ņ–Ņ–Ķ 2 —Ą–į–ļ—ā–ĺ—Ä–į–ľ–ł –Ņ–ł—Č–Ķ–≤—č—Ö –ě–ź–†/–ü–ź–† —Ā—ā–į–Ľ–ł –Ņ—Ä–ĺ–ī—É–ļ—ā—č –∂–ł–≤–ĺ—ā–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–∂–ī–Ķ–Ĺ–ł—Ź (—Ź–Ļ—Ü–į, –ľ—Ź—Ā–ĺ, –ľ–ĺ–Ľ–ĺ—á–Ĺ—č–Ķ –Ņ—Ä–ĺ–ī—É–ļ—ā—č, —Ä—č–Ī–į –ł –ļ—Ä–Ķ–≤–Ķ—ā–ļ–ł) ‚ÄĒ 30% —Ā–Ľ—É—á–į–Ķ–≤, —Ä–į—Ā—ā–ł—ā–Ķ–Ľ—Ć–Ĺ–į—Ź –Ņ–ł—Č–į ‚ÄĒ 40,3%, —Ā–Ľ–į–ī–ĺ—Ā—ā–ł –≤ –≤–ł–ī–Ķ –ļ–ĺ–Ĺ—Ą–Ķ—ā, —ą–ĺ–ļ–ĺ–Ľ–į–ī–į, –ľ–ĺ—Ä–ĺ–∂–Ķ–Ĺ–ĺ–≥–ĺ ‚ÄĒ 20,8%, –ī—Ä—É–≥–į—Ź –Ņ–ł—Č–į ‚ÄĒ –Ľ–į–Ņ—ą–į –Ī—č—Ā—ā—Ä–ĺ–≥–ĺ –Ņ—Ä–ł–≥–ĺ—ā–ĺ–≤–Ľ–Ķ–Ĺ–ł—Ź, —Ą–į—Ā—ā-—Ą—É–ī (—Ä–ĺ–ī–ł—ā–Ķ–Ľ–ł –Ĺ–Ķ —Ā–ľ–ĺ–≥–Ľ–ł –≤—č–ī–Ķ–Ľ–ł—ā—Ć –ļ–ĺ–Ĺ–ļ—Ä–Ķ—ā–Ĺ—č–Ļ –Ņ—Ä–ł—á–ł–Ĺ–Ĺ—č–Ļ –Ņ–ł—Č–Ķ–≤–ĺ–Ļ –ł–Ĺ–≥—Ä–Ķ–ī–ł–Ķ–Ĺ—ā). –ü–ł—Č–Ķ–≤—č–Ķ —Ä–Ķ–į–ļ—Ü–ł–ł —É –ļ–į–∂–ī–ĺ–≥–ĺ 4-–≥–ĺ —Ä–Ķ–Ī–Ķ–Ĺ–ļ–į (26%) –≤—č–∑—č–≤–į—é—ā —Ą—Ä—É–ļ—ā—č, —Ź–≥–ĺ–ī—č, —Ā–ĺ–ļ–ł, –ľ–ĺ—Ä—Ā—č –ł —á–į–ł —Ā —Ą—Ä—É–ļ—ā–ĺ–≤—č–ľ–ł –ī–ĺ–Ī–į–≤–ļ–į–ľ–ł, –ĺ–≤–ĺ—Č–ł (–ļ–į—Ä—ā–ĺ—Ą–Ķ–Ľ—Ć), –į —É –ļ–į–∂–ī–ĺ–≥–ĺ 10-–≥–ĺ ‚ÄĒ –ĺ—Ä–Ķ—Ö–ł –ł —Ā–Ķ–ľ–Ķ—á–ļ–ł (9,1%) (—Ä–ł—Ā. 4).
–ź–Ĺ–į–Ľ–ł–∑ –ļ–Ľ–ł–Ĺ–ł–ļ–ĺ-–į–Ĺ–į–ľ–Ĺ–Ķ—Ā—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ī–į–Ĺ–Ĺ—č—Ö –Ņ–ĺ–ļ–į–∑–į–Ľ, —á—ā–ĺ –ĺ—ā—Ź–≥–ĺ—Č–Ķ–Ĺ–ł–Ķ —Ā–Ķ–ľ–Ķ–Ļ–Ĺ–ĺ–Ļ –į–Ľ–Ľ–Ķ—Ä–≥–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ĺ–į—Ā–Ľ–Ķ–ī—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł —É –ī–Ķ—ā–Ķ–Ļ —Ā –ě–ź–†/–ü–ź–† –≤—Ā—ā—Ä–Ķ—á–į–Ľ–ĺ—Ā—Ć –Ĺ–Ķ—á–į—Ā—ā–ĺ (–Ľ–ł—ą—Ć —É –ļ–į–∂–ī–ĺ–≥–ĺ 6-–≥–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į), —á—ā–ĺ –ľ–ĺ–∂–Ķ—ā —Ā–≤–ł–ī–Ķ—ā–Ķ–Ľ—Ć—Ā—ā–≤–ĺ–≤–į—ā—Ć –ĺ –≤—č—Ā–ĺ–ļ–ĺ–Ļ —á–į—Ā—ā–ĺ—ā–Ķ –Ĺ–Ķ–į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ņ—Ä–ł—Ä–ĺ–ī—č –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź. –í –Ľ–ł—á–Ĺ–ĺ–ľ –į–Ľ–Ľ–Ķ—Ä–≥–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–ľ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–Ķ —É 28,1% –ī–Ķ—ā–Ķ–Ļ –≤—č—Ź–≤–Ľ–Ķ–Ĺ—č: –į—ā–ĺ–Ņ–ł—á–Ķ—Ā–ļ–ł–Ļ –ī–Ķ—Ä–ľ–į—ā–ł—ā (–ź–Ē) (15,2 –ł 18,2% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –≥—Ä—É–Ņ–Ņ–į–ľ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź) –ł —Ä–Ķ—Ā–Ņ–ł—Ä–į—ā–ĺ—Ä–Ĺ–į—Ź –į–Ľ–Ľ–Ķ—Ä–≥–ł—Ź: –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–į—Ź –į—Ā—ā–ľ–į, –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–Ļ —Ä–ł–Ĺ–ł—ā, –Ņ–ĺ–Ľ–Ľ–ł–Ĺ–ĺ–∑ (13 –ł 16,9% —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –≥—Ä—É–Ņ–Ņ–į–ľ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź), –Ņ–ĺ –Ņ–ĺ–≤–ĺ–ī—É —á–Ķ–≥–ĺ –ļ –ľ–ĺ–ľ–Ķ–Ĺ—ā—É –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–Ļ –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł–ł –ī–Ķ—ā–ł —É–∂–Ķ —Ā–ĺ—Ā—ā–ĺ—Ź–Ľ–ł –Ĺ–į –ī–ł—Ā–Ņ–į–Ĺ—Ā–Ķ—Ä–Ĺ–ĺ–ľ —É—á–Ķ—ā–Ķ —É –į–Ľ–Ľ–Ķ—Ä–≥–ĺ–Ľ–ĺ–≥–į. –ė–Ĺ—ā–Ķ—Ä–Ķ—Ā–Ĺ–ĺ, —á—ā–ĺ –Ņ—Ä–ł –Ņ–ł—Č–Ķ–≤–ĺ–Ļ –į–Ľ–Ľ–Ķ—Ä–≥–ł–ł –≤ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–Ķ –≤ 2 —Ä–į–∑–į —á–į—Č–Ķ —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ľ—Ā—Ź –ź–Ē (—á—ā–ĺ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤—É–Ķ—ā –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–ł—é –ĺ–Ī ¬ę–į—ā–ĺ–Ņ–ł—á–Ķ—Ā–ļ–ĺ–ľ –ľ–į—Ä—ą–Ķ¬Ľ) [2, 3, 14], –į –Ņ—Ä–ł –į–Ĺ–≥–ł–ĺ–ĺ—ā–Ķ–ļ–į—Ö (–≤ –ĺ–Ī–Ľ–į—Ā—ā–ł –Ľ–ł—Ü–į) —É –ļ–į–∂–ī–ĺ–≥–ĺ 5-–≥–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –ĺ–Ī–Ĺ–į—Ä—É–∂–ł–≤–į–Ľ—Ā—Ź –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–Ļ —Ä–ł–Ĺ–ł—ā (–≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ, –Ņ—Ä–Ķ–ī—ą–Ķ—Ā—ā–≤—É—é—Č–į—Ź —Ā–Ķ–Ĺ—Ā–ł–Ī–ł–Ľ–ł–∑–į—Ü–ł—Ź —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –Ĺ–ĺ—Ā–ĺ-, —Ä–ĺ—ā–ĺ–≥–Ľ–ĺ—ā–ļ–ł –ł–≥—Ä–į–Ķ—ā –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—É—é —Ä–ĺ–Ľ—Ć –≤ –Ī—É–ī—É—Č–ł—Ö –Ņ—Ä–ĺ–≤–ĺ–ļ–į—Ü–ł—Ź—Ö –ě–ź–†).
–ď–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–į—Ź –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—Ź (—Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ
–≥–į—Ā—ā—Ä–ł—ā, –≥–į—Ā—ā—Ä–ĺ–ī—É–ĺ–ī–Ķ–Ĺ–ł—ā, —Ą—É–Ĺ–ļ—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ—č–Ķ —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤–į –∂–Ķ–Ľ—á–Ķ–≤—č–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź, –∂–Ķ–Ľ—á–Ĺ–ĺ–ļ–į–ľ–Ķ–Ĺ–Ĺ–į—Ź –Ī–ĺ–Ľ–Ķ–∑–Ĺ—Ć, –≥–į—Ā—ā—Ä–ĺ—ć–∑–ĺ—Ą–į–≥–Ķ–į–Ľ—Ć–Ĺ–į—Ź —Ä–Ķ—Ą–Ľ—é–ļ—Ā–Ĺ–į—Ź –Ī–ĺ–Ľ–Ķ–∑–Ĺ—Ć) –≤—č—Ź–≤–Ľ–Ķ–Ĺ–į –≤ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–Ķ —É 8,7 –ł 6,5% –ī–Ķ—ā–Ķ–Ļ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –≥—Ä—É–Ņ–Ņ–į–ľ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź, –Ņ–ĺ –Ņ–ĺ–≤–ĺ–ī—É —á–Ķ–≥–ĺ –ī–ĺ –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–Ļ –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č –Ĺ–į–Ī–Ľ—é–ī–į–Ľ–ł—Ā—Ć –≥–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ–ĺ–≥–ĺ–ľ. –ě–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź, –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–Ĺ—č–Ķ –≤ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł–ł –≤ —Ä–į–ľ–ļ–į—Ö –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ–ĺ–ł—Ā–ļ–į –Ņ—Ä–ł—á–ł–Ĺ –ě–ź–†/–ü–ź–†, –ĺ–Ī–Ĺ–į—Ä—É–∂–ł–Ľ–ł —ć–∑–ĺ—Ą–į–≥–ł—ā —É 11 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ (5,7%) –ł —ć—Ä–ĺ–∑–ł–≤–Ĺ—č–Ļ –Ī—É–Ľ—Ć–Ī–ł—ā —É 5 (3,1%). –ě—Ā—ā—Ä–ĺ—ā–į –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–ł –Ė–ö–Ę –Ĺ–į –ľ–ĺ–ľ–Ķ–Ĺ—ā –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ –ě–ź–†/–ü–ź–† –ĺ—ā—Ä–į–∂–į–Ķ—ā –Ņ–ĺ—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ –į–≥—Ä–Ķ—Ā—Ā–ł–≤–Ĺ–ĺ–≥–ĺ –ļ–ĺ–Ĺ—ā–į–ļ—ā–į (—Ā –Ņ–ł—Č–Ķ–Ļ, –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–ĺ–ľ), –Ĺ–ĺ –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ, —á—ā–ĺ –Ņ—Ä–Ķ–ī—ą–Ķ—Ā—ā–≤–ĺ–≤–į–≤—ą–Ķ–Ķ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł–Ķ —Ā–Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä–ĺ–≤–į–Ľ–ĺ –Ņ–ł—Č–Ķ–≤—É—é (–Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—É—é) –į–≥—Ä–Ķ—Ā—Ā–ł—é —Ā —Ä–į–∑–≤–ł—ā–ł–Ķ–ľ –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č/–į–Ĺ–≥–ł–ĺ–ĺ—ā–Ķ–ļ–į [12]. –ė–ľ–Ķ–Ĺ–Ĺ–ĺ —ć—ā–ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź —Ā–ĺ —Ā—ā–ĺ—Ä–ĺ–Ĺ—č –≥–į—Ā—ā—Ä–ĺ–ī—É–ĺ–ī–Ķ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ļ –∑–ĺ–Ĺ—č –Ī—č–Ľ–ł —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ—č –ī–Ľ—Ź –ī–Ķ—ā–Ķ–Ļ —Ā —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ–Ļ –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü–Ķ–Ļ (–≤ 3 —Ä–į–∑–į —á–į—Č–Ķ –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā –Ľ–ĺ–ļ–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł –ĺ—ā–Ķ–ļ–į–ľ–ł –ö–≤–ł–Ĺ–ļ–Ķ).
–ö—Ä–ĺ–ľ–Ķ –Ņ—Ä–ĺ—á–Ķ–≥–ĺ, 2,6% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ł–ľ–Ķ–Ľ–ł –ł–Ĺ—Ą–Ķ–ļ—Ü–ł–ĺ–Ĺ–Ĺ—č–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź (–ļ–ł—ą–Ķ—á–Ĺ—É—é –ł–Ĺ—Ą–Ķ–ļ—Ü–ł—é, –≤–ł—Ä—É—Ā –≠–Ņ—ą—ā–Ķ–Ļ–Ĺ–į ‚ÄĒ –Ď–į—Ä—Ä, —Ü–ł—ā–ĺ–ľ–Ķ–≥–į–Ľ–ĺ–≤–ł—Ä—É—Ā–Ĺ—É—é –ł–Ĺ—Ą–Ķ–ļ—Ü–ł—é) –≤ –Ņ—Ä–Ķ–ī–ī–≤–Ķ—Ä–ł–ł –ě–ź–†/–ü–ź–†, —á—ā–ĺ –ī–ĺ–ļ–į–∑–į–Ĺ–ĺ –Ņ–ĺ–Ľ–ĺ–∂–ł—ā–Ķ–Ľ—Ć–Ĺ—č–ľ–ł —Ā–Ķ—Ä–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–ľ–ł —ā–Ķ—Ā—ā–į–ľ–ł.
–Ē–Ķ—ā–ł —Ā –ě–ź–†/–ü–ź–† –≤ –ĺ—Ā—ā—Ä–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ľ–ł—Ā—Ć –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ —ć–ļ—Ā—ā—Ä–Ķ–Ĺ–Ĺ–ĺ, –Ņ–ł–ļ –Ņ–ĺ—Ā—ā—É–Ņ–Ľ–Ķ–Ĺ–ł—Ź –≤ —Ā—ā–į—Ü–ł–ĺ–Ĺ–į—Ä –Ņ—Ä–ł—Ö–ĺ–ī–ł–Ľ—Ā—Ź –Ĺ–į 2‚Äď3-–Ķ —Ā—É—ā –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź (–Ī–ĺ–Ľ–Ķ–Ķ 50%) –Ĺ–Ķ–∑–į–≤–ł—Ā–ł–ľ–ĺ –ĺ—ā –Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä—É—é—Č–ł—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ (—Ä–ł—Ā. 5). –ě–ī–Ĺ–į–ļ–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č —Ā –†–õ–ď (–ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ —Ā –ļ–Ľ–ł–Ĺ–ł–ļ–ĺ–Ļ –į–Ĺ–≥–ł–ĺ–ĺ—ā–Ķ–ļ–į) –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ľ–ł—Ā—Ć –Ī—č—Ā—ā—Ä–Ķ–Ķ ‚ÄĒ –Ĺ–į 4‚Äď5-–Ķ —Ā—É—ā –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł –≤—Ā–Ķ —É–∂–Ķ –Ĺ–į—Ö–ĺ–ī–ł–Ľ–ł—Ā—Ć –Ĺ–į –Ī–ĺ–Ľ—Ć–Ĺ–ł—á–Ĺ–ĺ–ľ —Ä–Ķ–∂–ł–ľ–Ķ, –į –Ņ—Ä–ł –Ņ–ł—Č–Ķ–≤–ĺ–Ļ –Ņ—Ä–ĺ–≤–ĺ–ļ–į—Ü–ł–ł (–ł –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź—Ö –≤ –≤–ł–ī–Ķ –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č) 5,2% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ—Ä–ĺ–ī–ĺ–Ľ–∂–į–Ľ–ł –Ņ–ĺ—Ā—ā—É–Ņ–į—ā—Ć –≤ –Ī–ĺ–Ľ—Ć–Ĺ–ł—Ü—É –≤ –Ņ–Ľ–į–Ĺ–ĺ–≤–ĺ–ľ –Ņ–ĺ—Ä—Ź–ī–ļ–Ķ –Ĺ–į 2‚Äď4-–Ļ –Ĺ–Ķ–ī. –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –Ĺ–į –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ (–Ņ–ĺ –Ĺ–į–Ņ—Ä–į–≤–Ľ–Ķ–Ĺ–ł—é —É—á–į—Ā—ā–ļ–ĺ–≤–ĺ–≥–ĺ –≤—Ä–į—á–į –ł–Ľ–ł —É–∑–ļ–ĺ–≥–ĺ —Ā–Ņ–Ķ—Ü–ł–į–Ľ–ł—Ā—ā–į) –ī–Ľ—Ź –≤—č—Ź—Ā–Ĺ–Ķ–Ĺ–ł—Ź –Ņ—Ä–ł—á–ł–Ĺ —Ä–Ķ—Ü–ł–ī–ł–≤–ł—Ä—É—é—Č–ł—Ö –≤—č—Ā—č–Ņ–į–Ĺ–ł–Ļ.

–ü—Ä–Ķ–ī—Ā—ā–į–≤–Ľ—Ź–Ķ—ā –ł–Ĺ—ā–Ķ—Ä–Ķ—Ā –ī–ł–Ĺ–į–ľ–ł–ļ–į —Ā–Ķ–∑–ĺ–Ĺ–Ĺ–ĺ–Ļ –Ĺ–į–≥—Ä—É–∑–ļ–ł –Ņ—Ä–ĺ—Ą–ł–Ľ—Ć–Ĺ–ĺ–≥–ĺ –į–Ľ–Ľ–Ķ—Ä–≥–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –ī–Ķ—ā—Ć–ľ–ł —Ā –ě–ź–†/–ü–ź–†, —á—ā–ĺ –≤–Ķ—Ā—Ć–ľ–į –Ľ–ĺ–≥–ł—á–Ĺ–ĺ –≤—č—Ź–≤–Ľ—Ź–Ķ—ā —Ā–≤—Ź–∑—Ć —Ā –Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä—É—é—Č–ł–ľ–ł —Ą–į–ļ—ā–ĺ—Ä–į–ľ–ł. –†–ł—Ā—É–Ĺ–ĺ–ļ 6 –ī–Ķ–ľ–ĺ–Ĺ—Ā—ā—Ä–ł—Ä—É–Ķ—ā —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–ł—Ä—É–Ķ–ľ—č—Ö —Ā –Ņ–ł—Č–Ķ–≤—č–ľ–ł —Ä–Ķ–į–ļ—Ü–ł—Ź–ľ–ł, –≤ —Ź–Ĺ–≤–į—Ä–Ķ ‚ÄĒ —Ą–Ķ–≤—Ä–į–Ľ–Ķ, —Ā –ľ–į–ļ—Ā–ł–ľ—É–ľ–ĺ–ľ –≤ –Ľ–Ķ—ā–Ĺ–Ķ–Ķ –≤—Ä–Ķ–ľ—Ź (–ł—é–Ĺ—Ć ‚ÄĒ —Ā–Ķ–Ĺ—ā—Ź–Ī—Ä—Ć), —á—ā–ĺ, –≤–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ, –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į—é—Č–ł–ľ —É–Ņ–ĺ—ā—Ä–Ķ–Ī–Ľ–Ķ–Ĺ–ł–Ķ–ľ —Ą—Ä—É–ļ—ā–ĺ–≤ –ł –ĺ–≤–ĺ—Č–Ķ–Ļ –≤ —ā–Ķ–Ņ–Ľ—č–Ļ —Ā–Ķ–∑–ĺ–Ĺ –≥–ĺ–ī–į –ł —á–į—Ā—ā—č–ľ–ł –ī–ł–Ķ—ā–ł—á–Ķ—Ā–ļ–ł–ľ–ł –Ņ–ĺ–≥—Ä–Ķ—ą–Ĺ–ĺ—Ā—ā—Ź–ľ–ł –≤ –Ņ–Ķ—Ä–ł–ĺ–ī –∑–ł–ľ–Ĺ–ł—Ö –ł –Ľ–Ķ—ā–Ĺ–ł—Ö —ą–ļ–ĺ–Ľ—Ć–Ĺ—č—Ö –ļ–į–Ĺ–ł–ļ—É–Ľ. –ß–į—Ā—ā–ĺ—ā–į –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł–Ļ –ī–Ķ—ā–Ķ–Ļ —Ā –†–õ–ď —É–≤–Ķ–Ľ–ł—á–ł–≤–į–Ķ—ā—Ā—Ź –≤ —Ö–ĺ–Ľ–ĺ–ī–Ĺ–ĺ–Ķ –≤—Ä–Ķ–ľ—Ź –≥–ĺ–ī–į, —Ā –Ņ–ł–ļ–ĺ–ľ –≤ –ļ–ĺ–Ĺ—Ü–Ķ –Ľ–Ķ—ā–į (–≤ –į–≤–≥—É—Ā—ā–Ķ), —á—ā–ĺ —Ā–≤—Ź–∑–į–Ĺ–ĺ —Ā –ī–ł–Ĺ–į–ľ–ł–ļ–ĺ–Ļ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ķ–ľ–ĺ—Ā—ā–ł —Ā–Ķ–∑–ĺ–Ĺ–Ĺ—č–ľ–ł –≤–ł—Ä—É—Ā–Ĺ—č–ľ–ł –ł–Ĺ—Ą–Ķ–ļ—Ü–ł—Ź–ľ–ł (—Ä–Ķ—Ā–Ņ–ł—Ä–į—ā–ĺ—Ä–Ĺ—č–ľ–ł –∑–ł–ľ–ĺ–Ļ, –ļ–ł—ą–Ķ—á–Ĺ—č–ľ–ł –Ľ–Ķ—ā–ĺ–ľ).

–ź–Ĺ–į–Ľ–ł–∑ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ –ě–ź–†/–ü–ź–† –≤ —Ā—Ä–į–≤–Ĺ–ł–≤–į–Ķ–ľ—č—Ö –≥—Ä—É–Ņ–Ņ–į—Ö –Ņ–ĺ–ļ–į–∑–į–Ľ –Ņ—Ä–Ķ–≤–į–Ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –≥—Ä—É–Ņ–Ņ—č 1 (–†–õ–ď) –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č (52%), —Ā–ĺ—á–Ķ—ā–į–Ĺ–ł–Ķ –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č —Ā –ĺ—ā–Ķ–ļ–į–ľ–ł –ö–≤–ł–Ĺ–ļ–Ķ (–Ķ—Č–Ķ 26,1%), –ł–∑–ĺ–Ľ–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–Ļ –į–Ĺ–≥–ł–ĺ–ĺ—ā–Ķ–ļ –Ĺ–į–Ī–Ľ—é–ī–į–Ľ—Ā—Ź —É —ć—ā–ł—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ľ–ł—ą—Ć –≤ 6,5% —Ā–Ľ—É—á–į–Ķ–≤. –í –≥—Ä—É–Ņ–Ņ–Ķ 2 (–ī–Ķ—ā–ł —Ā –Ņ–ł—Č–Ķ–≤–ĺ–Ļ –į–Ľ–Ľ–Ķ—Ä–≥–ł–Ķ–Ļ) –ĺ—ā–Ķ–ļ –ö–≤–ł–Ĺ–ļ–Ķ –Ī–Ķ–∑ –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č –≤—Ā—ā—Ä–Ķ—á–į–Ľ—Ā—Ź –≤ 3 —Ä–į–∑–į —á–į—Č–Ķ (16,9%) –ł –≤ 2 —Ä–į–∑–į —á–į—Č–Ķ –ł–ľ–Ķ–Ľ–ĺ –ľ–Ķ—Ā—ā–ĺ —Ā–ĺ—á–Ķ—ā–į–Ĺ–ł–Ķ –Ķ–≥–ĺ —Ā –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü–Ķ–Ļ (–Ķ—Č–Ķ 53,2%).
–ü—Ä–Ķ–ī—Ā—ā–į–≤–Ľ—Ź–Ķ—ā –ł–Ĺ—ā–Ķ—Ä–Ķ—Ā –į–Ĺ–į–Ľ–ł–∑ —á–į—Ā—ā–ĺ—ā—č —Ä–į–∑–Ľ–ł—á–Ĺ–ĺ–Ļ –Ľ–ĺ–ļ–į–Ľ–ł–∑–į—Ü–ł–ł –ĺ—ā–Ķ–ļ–į –ö–≤–ł–Ĺ–ļ–Ķ –≤ –≥—Ä—É–Ņ–Ņ–į—Ö —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź (—Ä–ł—Ā. 7). –Ě–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ –ĺ—ā–ľ–Ķ—ā–ł—ā—Ć, —á—ā–ĺ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ—É—é –ļ–į—Ä—ā–ł–Ĺ—É –į–Ĺ–≥–ł–ĺ–ĺ—ā–Ķ–ļ–ĺ–≤ (–ł–∑–ĺ–Ľ–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č—Ö –ł–Ľ–ł —Ā–ĺ—á–Ķ—ā–į–Ĺ–Ĺ—č—Ö —Ā –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü–Ķ–Ļ) –Ņ—Ä–ł –ě–ź–†/–ü–ź–† –ł–ľ–Ķ–Ľ–ł 58,3% –ī–Ķ—ā–Ķ–Ļ, –Ņ—Ä–ł—á–Ķ–ľ –ĺ–ī–Ĺ–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–į—Ź –ł—Ö –Ľ–ĺ–ļ–į–Ľ–ł–∑–į—Ü–ł—Ź –≤ —Ä–į–∑–Ĺ—č—Ö (–į—Ā–ł–ľ–ľ–Ķ—ā—Ä–ł—á–Ĺ—č—Ö) —á–į—Ā—ā—Ź—Ö —ā–Ķ–Ľ–į –Ĺ–į–Ī–Ľ—é–ī–į–Ľ–į—Ā—Ć —É –ļ–į–∂–ī–ĺ–≥–ĺ 3-–≥–ĺ. –ě—ā–Ķ–ļ–ł –≤ –ĺ–Ī–Ľ–į—Ā—ā–ł –≥–ĺ–Ľ–ĺ–≤—č (–Ľ–ł—Ü–ĺ, –≤–Ķ–ļ–ł, –≥—É–Ī—č, —É—ą–ł) –ł–ľ–Ķ–Ľ–ł 93,8% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –ĺ—ā–Ķ–ļ–ł –≤ –ĺ–Ī–Ľ–į—Ā—ā–ł –ļ–ĺ–Ĺ–Ķ—á–Ĺ–ĺ—Ā—ā–Ķ–Ļ (–ļ–ł—Ā—ā–ł, —Ā—ā–ĺ–Ņ—č, —Ā—É—Ā—ā–į–≤—č) –≤—Ā—ā—Ä–Ķ—á–į–Ľ–ł—Ā—Ć –≤ 3 —Ä–į–∑–į —Ä–Ķ–∂–Ķ (32,3%).

–Ě–į —Ä–ł—Ā—É–Ĺ–ļ–Ķ 7 –≤–ł–ī–Ĺ–ĺ, —á—ā–ĺ –Ņ—Ä–ł –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ–ĺ–Ļ –Ņ—Ä–ĺ–≤–ĺ–ļ–į—Ü–ł–ł –ĺ—ā–Ķ–ļ–ł –Ľ–ł—Ü–į –≤—Ā—ā—Ä–Ķ—á–į–Ľ–ł—Ā—Ć —á–į—Č–Ķ, —á–Ķ–ľ –Ņ—Ä–ł –Ņ–ł—Č–Ķ–≤–ĺ–Ļ, –ĺ–ī–Ĺ–į–ļ–ĺ –ĺ—ā–Ķ–ļ–ł –≥—É–Ī –ł —Ź–∑—č–ļ–į –≤—ā—Ä–Ķ—á–į–Ľ–ł—Ā—Ć –≤ 3,3 —Ä–į–∑–į —Ä–Ķ–∂–Ķ, —á—ā–ĺ, –≤–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ, –ĺ—ā—Ä–į–∂–į–Ķ—ā –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł —ā–Ķ—Ö–Ĺ–ł–ļ–ł –Ņ—Ä–ł–Ķ–ľ–į –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤ ‚ÄĒ –Ī—č—Ā—ā—Ä–ĺ–Ķ –Ņ—Ä–ĺ–≥–Ľ–į—ā—č–≤–į–Ĺ–ł–Ķ —ā–į–Ī–Ľ–Ķ—ā–ļ–ł (–ļ–į–Ņ—Ā—É–Ľ—č, —Ā—É—Ā–Ņ–Ķ–Ĺ–∑–ł–ł), –į –Ĺ–Ķ —ā—Č–į—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ –Ņ–Ķ—Ä–Ķ–∂–Ķ–≤—č–≤–į–Ĺ–ł–Ķ –Ņ–ł—Č–ł (—á—ā–ĺ —É–≤–Ķ–Ľ–ł—á–ł–≤–į–Ķ—ā –≤—Ä–Ķ–ľ—Ź –ļ–ĺ–Ĺ—ā–į–ļ—ā–į —Ā –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ–ĺ–ľ). –ė–Ĺ—ā–Ķ—Ä–Ķ—Ā–Ĺ–ĺ, —á—ā–ĺ —Ā—Ä–Ķ–ī–ł –ł–∑–ĺ–Ľ–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č—Ö –ĺ—ā–Ķ–ļ–ĺ–≤ –ö–≤–ł–Ĺ–ļ–Ķ –ł—Ö —á–į—Ā—ā–ĺ—ā–į –≤ –ĺ–Ī–Ľ–į—Ā—ā–ł –≥–ĺ–Ľ–ĺ–≤—č —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ľ–į 85%, –į –≤ –ĺ–Ī–Ľ–į—Ā—ā–ł –ļ–ĺ–Ĺ–Ķ—á–Ĺ–ĺ—Ā—ā–Ķ–Ļ –ĺ–Ĺ–ł –≤—Ā—ā—Ä–Ķ—á–į–Ľ–ł—Ā—Ć –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —Ä–Ķ–∂–Ķ. –ě—ā–Ķ–ļ –ľ–ĺ—ą–ĺ–Ĺ–ļ–ł –≤ –Ĺ–į—ą–Ķ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –Ĺ–į–Ī–Ľ—é–ī–į–Ľ—Ā—Ź —É 2 –ľ–į–Ľ—Ć—á–ł–ļ–ĺ–≤ –ł–∑ –ĺ–Ī–Ķ–ł—Ö –≥—Ä—É–Ņ–Ņ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź. –ú—č –Ĺ–Ķ –ĺ–Ī–Ĺ–į—Ä—É–∂–ł–Ľ–ł —É –Ĺ–į—ą–ł—Ö –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –ĺ—ā–Ķ–ļ–į –Ņ–ĺ–ī—Ā–ļ–Ľ–į–ī–ļ–ĺ–≤–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ—Ā—ā–≤–į –≥–ĺ—Ä—ā–į–Ĺ–ł, –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ, –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ —Ä–Ķ–ī–ļ–ĺ—Ā—ā–ł –Ņ–ĺ–ī–ĺ–Ī–Ĺ–ĺ–Ļ –Ľ–ĺ–ļ–į–Ľ–ł–∑–į—Ü–ł–ł –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ĺ—ā–Ķ–ļ–į –ł–Ľ–ł –≤–≤–ł–ī—É –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –≤ —Ā–≤—Ź–∑–ł —Ā —ā—Ź–∂–Ķ—Ā—ā—Ć—é —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł—Ź –≤ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ —Ä–Ķ–į–Ĺ–ł–ľ–į—Ü–ł–ł.
–Ē–Ķ—ā–į–Ľ—Ć–Ĺ—č–Ļ –į–Ĺ–į–Ľ–ł–∑ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –ļ—Ä–ĺ–≤–ł –ī–Ķ–ľ–ĺ–Ĺ—Ā—ā—Ä–ł—Ä—É–Ķ—ā –≤ –ĺ—Ā—ā—Ä–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –Ľ–Ķ–Ļ–ļ–ĺ—Ü–ł—ā–ĺ–∑ (–≤—č—ą–Ķ 9√ó109) –≤ –ļ—Ä–ĺ–≤–ł —É 58,7 –ł 54,5% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ (–≤ –≥—Ä—É–Ņ–Ņ–į—Ö 1 –ł 2 —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ), –Ņ—Ä–ł—á–Ķ–ľ –Ņ—Ä–ł —Ä–į–∑–≤–ł—ā–ł–ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ–į—Ä—ā–ł–Ĺ—č –Ņ–ĺ —ā–ł–Ņ—É –ĺ—ā–Ķ–ļ–į –ö–≤–ł–Ĺ–ļ–Ķ –Ľ–Ķ–Ļ–ļ–ĺ—Ü–ł—ā–ĺ–∑ –ł–ľ–Ķ–Ľ–ł 85,7% –ī–Ķ—ā–Ķ–Ļ. –•–į—Ä–į–ļ—ā–Ķ—Ä–Ķ–Ĺ —Ź—Ä–ļ–ł–Ļ –Ĺ–Ķ–Ļ—ā—Ä–ĺ—Ą–ł–Ľ—Ć–Ĺ—č–Ļ —Ā–ī–≤–ł–≥ –Ľ–Ķ–Ļ–ļ–ĺ—Ü–ł—ā–į—Ä–Ĺ–ĺ–Ļ —Ą–ĺ—Ä–ľ—É–Ľ—č –ī–Ľ—Ź –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –ě–ź–†/–ü–ź–†, –ļ–ĺ—ā–ĺ—Ä—č–Ļ —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –ĺ—ā–Ķ–ļ–ĺ–ľ –ö–≤–ł–Ĺ–ļ–Ķ –Ĺ–į–Ī–Ľ—é–ī–į–Ľ—Ā—Ź —á–į—Č–Ķ, —á–Ķ–ľ –Ņ—Ä–ł –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü–Ķ (71,5% –Ņ—Ä–ĺ—ā–ł–≤ 64,2%), –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ, –≤–≤–ł–ī—É –Ī–ĺ–Ľ–Ķ–Ķ –į–ļ—ā–ł–≤–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –≥–Ľ—é–ļ–ĺ–ļ–ĺ—Ä—ā–ł–ļ–ĺ–ł–ī–į–ľ–ł (–ď–ö–°). –£ —ā—Ä–Ķ—Ö –ī–Ķ—ā–Ķ–Ļ –ĺ–Ī–Ĺ–į—Ä—É–∂–Ķ–Ĺ–į –Ľ–Ķ–Ļ–ļ–ĺ–Ņ–Ķ–Ĺ–ł—Ź (–Ĺ–ł–∂–Ķ 4√ó109). –£–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ–į—Ź —ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ–ł—Ź (–ĺ—ā 6 –ī–ĺ 11%) –≤ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–ľ –į–Ĺ–į–Ľ–ł–∑–Ķ –ļ—Ä–ĺ–≤–ł –≤—č—Ź–≤–Ľ–Ķ–Ĺ–į –Ľ–ł—ą—Ć —É 5 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –≤ –ĺ—Ā—ā—Ä–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ä–Ķ–į–ļ—Ü–ł–ł, —á—ā–ĺ –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–į–Ķ—ā —Ö–Ķ–ľ–ĺ—ā–į–ļ—Ā–ł—Ā —ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ–ĺ–≤ –≤ —ā–ļ–į–Ĺ–ł, –≤ –ĺ—á–į–≥ –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź. –ö—Ä–ĺ–ľ–Ķ —ā–ĺ–≥–ĺ, —Ā–Ľ–Ķ–ī—É–Ķ—ā –Ņ–ĺ–ľ–Ĺ–ł—ā—Ć, —á—ā–ĺ –į–ļ—ā–ł–≤–Ĺ–į—Ź –ď–ö–°-—ā–Ķ—Ä–į–Ņ–ł—Ź –Ņ–ĺ–ī–į–≤–Ľ—Ź–Ķ—ā –Ņ—Ä–ĺ–ī—É–ļ—Ü–ł—é —ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ–ĺ–≤.
–ź–Ĺ–į–Ľ–ł–∑ –Ī–ł–ĺ—Ö–ł–ľ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ –ļ—Ä–ĺ–≤–ł –≤—č—Ź–≤–ł–Ľ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–Ķ –Ņ—Ä–ĺ–ī—É–ļ—Ü–ł–ł –ĺ–ī–Ĺ–ĺ–≥–ĺ –ł–∑ –ľ–į—Ä–ļ–Ķ—Ä–ĺ–≤ –∑–į—Č–ł—ā–Ĺ–ĺ–Ļ –ĺ—Ā—ā—Ä–ĺ–Ļ —Ā–ł—Ā—ā–Ķ–ľ–Ĺ–ĺ–Ļ –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ —Ä–Ķ–į–ļ—Ü–ł–ł ‚ÄĒ –°-—Ä–Ķ–į–ļ—ā–ł–≤–Ĺ–ĺ–≥–ĺ –Ī–Ķ–Ľ–ļ–į –ĺ—ā 6 –ī–ĺ 20 –ľ–≥/–Ľ —É 20,5% (—É –ĺ–ī–Ĺ–ĺ–≥–ĺ —Ä–Ķ–Ī–Ķ–Ĺ–ļ–į 13 –Ľ–Ķ—ā —Ā –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü–Ķ–Ļ —Ā –Ņ–ĺ–∑–ī–Ĺ–ł–ľ –Ņ–ĺ—Ā—ā—É–Ņ–Ľ–Ķ–Ĺ–ł–Ķ–ľ ‚ÄĒ 50 –ľ–≥/–Ľ). –ė—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –Ņ–Ķ—á–Ķ–Ĺ–ĺ—á–Ĺ—č—Ö —Ą—É–Ĺ–ļ—Ü–ł–Ļ –Ņ—Ä–ĺ–ī–Ķ–ľ–ĺ–Ĺ—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ľ–ĺ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–Ķ –ĺ–Ī—Č–Ķ–≥–ĺ –Ī–ł–Ľ–ł—Ä—É–Ī–ł–Ĺ–į (–Ī–ĺ–Ľ–Ķ–Ķ 20 –ľ–ļ–ľ–ĺ–Ľ—Ć/–Ľ) –Ľ–ł—ą—Ć —É 3 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, —É—Ä–ĺ–≤–Ĺ—Ź –į–Ľ–į–Ĺ–ł–Ĺ–į–ľ–ł–Ĺ–ĺ—ā—Ä–į–Ĺ—Ā—Ą–Ķ—Ä–į–∑—č (–Ī–ĺ–Ľ–Ķ–Ķ 45 –ē–ī/–Ľ) —É 8,3% –ī–Ķ—ā–Ķ–Ļ (–ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ–ĺ –ī–ĺ 124‚Äď183 –ē–ī/–Ľ), –į—Ā–Ņ–į—Ä—ā–į—ā–į–ľ–ł–Ĺ–ĺ—ā—Ä–į–Ĺ—Ā—Ą–Ķ—Ä–į–∑—č (–Ī–ĺ–Ľ–Ķ–Ķ 45 –ē–ī/–Ľ) —É 35,6% –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö (–ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ–ĺ –ī–ĺ 178,9 –ē–ī/–Ľ), –Ņ—Ä–ł—á–Ķ–ľ —Ą—É–Ĺ–ļ—Ü–ł—Ź –Ņ–Ķ—á–Ķ–Ĺ–ł (–≥–Ľ–į–≤–Ĺ–ĺ–≥–ĺ –ĺ—Ä–≥–į–Ĺ–į –ī–Ķ—ā–ĺ–ļ—Ā–ł–ļ–į—Ü–ł–ł, –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ–į, —ć–Ľ–ł–ľ–ł–Ĺ–į—Ü–ł–ł) –Ī–ĺ–Ľ—Ć—ą–Ķ —Ā—ā—Ä–į–ī–į–Ľ–į –Ņ—Ä–ł –†–õ–ď –ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ–į—Ä—ā–ł–Ĺ–Ķ –Ņ–ĺ —ā–ł–Ņ—É —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ–Ļ –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č. –£–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –Ņ–Ķ—á–Ķ–Ĺ–ł –ł —Ā–Ķ–Ľ–Ķ–∑–Ķ–Ĺ–ļ–ł –Ĺ–ł —É –ļ–ĺ–≥–ĺ –ł–∑ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ĺ–Ķ –ĺ—ā–ľ–Ķ—á–Ķ–Ĺ–ĺ.
–ź–Ľ–Ľ–Ķ—Ä–≥–ĺ—ā–Ķ—Ā—ā–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ (—Ā–ļ–į—Ä–ł—Ą–ł–ļ–į—Ü–ł–ĺ–Ĺ–Ĺ—č–Ķ –Ņ—Ä–ĺ–Ī—č) –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ĺ –Ľ–ł—ą—Ć —É 7 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ (3,6%) –≥—Ä—É–Ņ–Ņ—č 2, –Ņ–ĺ—Ā—ā—É–Ņ–ł–≤—ą–ł—Ö –≤ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ –≤ –Ņ–Ľ–į–Ĺ–ĺ–≤–ĺ–ľ –Ņ–ĺ—Ä—Ź–ī–ļ–Ķ, —á–Ķ—Ä–Ķ–∑ 3‚Äď4 –Ĺ–Ķ–ī. –ĺ—ā –Ĺ–į—á–į–Ľ–į –Ņ–Ķ—Ä–≤—č—Ö –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ –ě–ź–†/–ü–ź–†: –≤—č—Ź–≤–Ľ–Ķ–Ĺ—č –Ķ–ī–ł–Ĺ–ł—á–Ĺ—č–Ķ –Ņ–ĺ–Ľ–ĺ–∂–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ķ –Ņ—Ä–ĺ–Ī—č (1+, 2+) –Ĺ–į –∂–ł–≤–ĺ—ā–Ĺ—č–Ķ (–Ī–Ķ–Ľ–ĺ–ļ –ļ—É—Ä–ł–Ĺ–ĺ–≥–ĺ —Ź–Ļ—Ü–į, –ļ—É—Ä–ł—Ü—É), —Ä–į—Ā—ā–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ķ (—Ź–Ī–Ľ–ĺ–ļ–ĺ, –ļ–ł–≤–ł, –į—Ä–į—Ö–ł—Ā) –Ņ—Ä–ĺ–ī—É–ļ—ā—č; –Ī—č—ā–ĺ–≤–į—Ź —Ā–Ķ–Ĺ—Ā–ł–Ī–ł–Ľ–ł–∑–į—Ü–ł—Ź –ļ —ć–Ņ–ł–ī–Ķ—Ä–ľ–ł—Ā—É –ļ–ĺ—ą–ļ–ł ‚ÄĒ —É –ĺ–ī–Ĺ–ĺ–≥–ĺ –Ī–ĺ–Ľ—Ć–Ĺ–ĺ–≥–ĺ. –í –į–Ĺ–į–ľ–Ĺ–Ķ–∑–Ķ —Ā–Ķ–Ĺ—Ā–ł–Ī–ł–Ľ–ł–∑–į—Ü–ł—Ź –ļ –Ņ—č–Ľ—Ć—Ü–Ķ –ĺ–Ī–Ĺ–į—Ä—É–∂–Ķ–Ĺ–į —É 22 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ (11,5%), –ļ –ľ–ĺ–ľ–Ķ–Ĺ—ā—É –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł–ł 10 –ł–∑ –Ĺ–ł—Ö –ł–ľ–Ķ–Ľ–ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ –ī–ł–į–≥–Ĺ–ĺ–∑ ¬ę–Ņ–ĺ–Ľ–Ľ–ł–Ĺ–ĺ–∑¬Ľ, –ĺ–ī–Ĺ–į–ļ–ĺ –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź –ě–ź–†/–ü–ź–† –Ĺ–Ķ —Ā–ĺ–≤–Ņ–į–ī–į–Ľ–ł —Ā —Ā–Ķ–∑–ĺ–Ĺ–ĺ–ľ –Ņ—č–Ľ–Ķ–Ĺ–ł—Ź –Ņ—Ä–ł—á–ł–Ĺ–Ĺ–ĺ-–∑–Ĺ–į—á–ł–ľ—č—Ö —Ä–į—Ā—ā–Ķ–Ĺ–ł–Ļ. –£ 3 –ī–Ķ—ā–Ķ–Ļ –ľ–Ľ–į–ī—ą–Ķ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ĺ —Ā–Ķ—Ä–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ķ —ā–Ķ—Ā—ā–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ (—Ā—ā–į–Ĺ–ī–į—Ä—ā–Ĺ–į—Ź –Ņ–Ķ–ī–ł–į—ā—Ä–ł—á–Ķ—Ā–ļ–į—Ź –Ņ–į–Ĺ–Ķ–Ľ—Ć), —Ā–Ķ–Ĺ—Ā–ł–Ī–ł–Ľ–ł–∑–į—Ü–ł—Ź –ļ —ć–Ņ–ł—ā–Ķ–Ľ–ł—é –ļ–ĺ—ą–ļ–ł –Ĺ–ł–∑–ļ–ĺ–≥–ĺ —É—Ä–ĺ–≤–Ĺ—Ź –ĺ–Ī–Ĺ–į—Ä—É–∂–Ķ–Ĺ–į —É –ĺ–ī–Ĺ–ĺ–≥–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į. –°–Ľ–Ķ–ī—É–Ķ—ā –∑–į–ľ–Ķ—ā–ł—ā—Ć, —á—ā–ĺ —É—Ä–ĺ–≤–Ķ–Ĺ—Ć —Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ķ—Ā–ļ–ł—Ö IgE –≤ –ĺ—Ā—ā—Ä–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ä–Ķ–į–ļ—Ü–ł–ł –ľ–ĺ–∂–Ķ—ā –Ī—č—ā—Ć –≤ –Ņ—Ä–Ķ–ī–Ķ–Ľ–į—Ö –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ–ĺ–Ļ –Ĺ–ĺ—Ä–ľ—č, –Ņ–ĺ—Ā–ļ–ĺ–Ľ—Ć–ļ—É IgE-–į–Ĺ—ā–ł—ā–Ķ–Ľ–į –Ĺ–Ķ —Ü–ł—Ä–ļ—É–Ľ–ł—Ä—É—é—ā –≤ –ļ—Ä–ĺ–≤–ĺ—ā–ĺ–ļ–Ķ, –į —Ą–ł–ļ—Ā–ł—Ä—É—é—ā—Ā—Ź –≤ —ą–ĺ–ļ–ĺ–≤–ĺ–ľ –ĺ—Ä–≥–į–Ĺ–Ķ –≤–≤–ł–ī—É –≤—č—Ā–ĺ–ļ–ĺ–Ļ —ā—Ä–ĺ–Ņ–Ĺ–ĺ—Ā—ā–ł –ļ —ā–ļ–į–Ĺ–Ķ–≤—č–ľ –ļ–Ľ–Ķ—ā–ļ–į–ľ; —É—Ä–ĺ–≤–Ķ–Ĺ—Ć —Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ķ—Ā–ļ–ł—Ö IgE —É –ľ–į–Ľ–Ķ–Ĺ—Ć–ļ–ł—Ö –ī–Ķ—ā–Ķ–Ļ –Ķ—Č–Ķ –ĺ—á–Ķ–Ĺ—Ć –Ĺ–ł–∑–ļ–ł–Ļ, –į —É —Ā—ā–į—Ä—ą–ł—Ö –ī–Ķ—ā–Ķ–Ļ –ľ–ĺ–∂–Ķ—ā –ĺ—ā—Ä–į–∂–į—ā—Ć –Ĺ–Ķ –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ—É—é –Ņ—Ä–ł—Ä–ĺ–ī—É, –į –Ņ–į—Ä–į–∑–ł—ā–į—Ä–Ĺ—É—é –ł–Ĺ–≤–į–∑–ł—é; –Ĺ–į–ļ–ĺ–Ĺ–Ķ—Ü, –ĺ—ā—Ä–ł—Ü–į—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā –į–Ľ–Ľ–Ķ—Ä–≥–ĺ—ā–Ķ—Ā—ā–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –ľ–ĺ–∂–Ķ—ā —Ā–≤–ł–ī–Ķ—ā–Ķ–Ľ—Ć—Ā—ā–≤–ĺ–≤–į—ā—Ć –ĺ IgE-–Ĺ–Ķ–∑–į–≤–ł—Ā–ł–ľ–ĺ–Ļ –į–Ľ–Ľ–Ķ—Ä–≥–ł–ł –ł–Ľ–ł –ĺ –Ņ—Ā–Ķ–≤–ī–ĺ–į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ä–Ķ–į–ļ—Ü–ł–ł [1‚Äď3].
–°–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –Ņ—Ä–ł–Ĺ—Ź—ā–ĺ–ľ—É –Ņ—Ä–ĺ—ā–ĺ–ļ–ĺ–Ľ—É –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –≤—Ā–Ķ–ľ –ī–Ķ—ā—Ź–ľ –Ĺ–į–∑–Ĺ–į—á–į–Ľ–ł—Ā—Ć –≥–ł–Ņ–ĺ–į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ–Ĺ–į—Ź (–ł –Ņ–ĺ –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā–ł —ć–Ľ–ł–ľ–ł–Ĺ–į—Ü–ł–ĺ–Ĺ–Ĺ–į—Ź) –ī–ł–Ķ—ā–į, –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ—č–Ļ –≤–ĺ–ī–Ĺ—č–Ļ —Ä–Ķ–∂–ł–ľ, –į–Ĺ—ā–ł–≥–ł—Ā—ā–į–ľ–ł–Ĺ–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č II –Ņ–ĺ–ļ–ĺ–Ľ–Ķ–Ĺ–ł—Ź –≤ –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ–ĺ–Ļ –ī–ĺ–∑–ł—Ä–ĺ–≤–ļ–Ķ; 15% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –≤ –Ņ–Ķ—Ä–≤—č–Ķ 2 —Ā—É—ā –Ņ—Ä–Ķ–Ī—č–≤–į–Ĺ–ł—Ź –≤ —Ā—ā–į—Ü–ł–ĺ–Ĺ–į—Ä–Ķ –Ņ–ĺ–Ľ—É—á–į–Ľ–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č I –Ņ–ĺ–ļ–ĺ–Ľ–Ķ–Ĺ–ł—Ź (–Ņ–į—Ä–Ķ–Ĺ—ā–Ķ—Ä–į–Ľ—Ć–Ĺ–ĺ). –ü–ĺ—ā—Ä–Ķ–Ī–Ĺ–ĺ—Ā—ā—Ć –≤ —ā–Ķ—Ä–į–Ņ–ł–ł –ď–ö–° —É –ł—Ā—Ā–Ľ–Ķ–ī—É–Ķ–ľ—č—Ö –ī–Ķ—ā–Ķ–Ļ –Ī—č–Ľ–į –≤—č—Ā–ĺ–ļ–ĺ–Ļ (85,4%) –Ĺ–Ķ–∑–į–≤–ł—Ā–ł–ľ–ĺ –ĺ—ā –Ņ—Ä–ł—á–ł–Ĺ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź, –≤–≤–ł–ī—É —ā—Ź–∂–Ķ—Ā—ā–ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ, —ā—Ä–Ķ–Ī—É—é—Č–ł—Ö –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł–ł –ī–Ľ—Ź –ĺ–ļ–į–∑–į–Ĺ–ł—Ź —ć–ļ—Ā—ā—Ä–Ķ–Ĺ–Ĺ–ĺ–Ļ –Ņ–ĺ–ľ–ĺ—Č–ł. –ě–ī–Ĺ–į–ļ–ĺ —Ü–Ķ–Ľ–Ķ—Ā–ĺ–ĺ–Ī—Ä–į–∑–Ĺ–ĺ –∑–į–ľ–Ķ—ā–ł—ā—Ć, —á—ā–ĺ –Ņ—Ä–ł –†–õ–ď –ł –ĺ—ā–Ķ–ļ–Ķ –ö–≤–ł–Ĺ–ļ–Ķ –≤ –ĺ—Ā—ā—Ä–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ —Ā–ł—Ā—ā–Ķ–ľ–Ĺ–į—Ź –≥–ĺ—Ä–ľ–ĺ–Ĺ–į–Ľ—Ć–Ĺ–į—Ź —ā–Ķ—Ä–į–Ņ–ł—Ź –Ī—č–Ľ–į –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–į –≤ 100% —Ā–Ľ—É—á–į–Ķ–≤, –Ņ—Ä–ł—á–Ķ–ľ –Ī–ĺ–Ľ–Ķ–Ķ –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–ľ –ļ—É—Ä—Ā–ĺ–ľ, –Ĺ–Ķ–∂–Ķ–Ľ–ł –Ņ—Ä–ł –Ņ–ł—Č–Ķ–≤–ĺ–Ļ –į–Ľ–Ľ–Ķ—Ä–≥–ł–ł. –ź–Ĺ–į–Ľ–ł–∑ –Ņ–ĺ–ļ–į–∑–į–Ľ, —á—ā–ĺ –ļ–ĺ—Ä–ĺ—ā–ļ–ł–Ķ –ļ—É—Ä—Ā—č –ď–ö–°-—ā–Ķ—Ä–į–Ņ–ł–ł (–≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –Ņ–Ķ—Ä–≤—č—Ö —Ā—É—ā–ĺ–ļ, –ł –ī–į–∂–Ķ –ĺ–ī–Ĺ–ĺ–ļ—Ä–į—ā–Ĺ–ĺ) –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź–Ľ–ł—Ā—Ć –≤ 9 —Ä–į–∑ —á–į—Č–Ķ –Ņ—Ä–ł –Ņ–ł—Č–Ķ–≤—č—Ö –ě–ź–†/–ü–ź–† (19,5% —Ā–Ľ—É—á–į–Ķ–≤), —á–Ķ–ľ –Ņ—Ä–ł –†–õ–ď (2,2%). –ü—Ä–ł—á–Ķ–ľ –Ņ—Ä–ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ–į—Ä—ā–ł–Ĺ–Ķ –į–Ĺ–≥–ł–ĺ–ĺ—ā–Ķ–ļ–į 3 –ī–Ĺ–Ķ–Ļ –≥–ĺ—Ä–ľ–ĺ–Ĺ–ĺ—ā–Ķ—Ä–į–Ņ–ł–ł –Ī—č–Ľ–ĺ –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ –ī–Ľ—Ź –ļ—É–Ņ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –ĺ—Ā—ā—Ä–ĺ—ā—č –ě–ź–†/–ü–ź–† —É 80% –ī–Ķ—ā–Ķ–Ļ, –į –Ņ—Ä–ł –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü–Ķ ‚ÄĒ —É 50% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤. –í –ĺ—Ā—ā—Ä–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ —ā–Ķ—Ä–į–Ņ–ł—Ź –ď–ö–° –Ī–ĺ–Ľ–Ķ–Ķ 7 –ī–Ĺ–Ķ–Ļ –ī–Ķ—ā—Ź–ľ –Ĺ–Ķ –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–į—Ā—Ć. –°–Ľ–Ķ–ī—É–Ķ—ā –∑–į–ľ–Ķ—ā–ł—ā—Ć, —á—ā–ĺ 2,2‚Äď12% –ī–Ķ—ā–Ķ–Ļ —Ā –ě–ź–†/–ü–ź–† (–Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ —á–į—Ā—ā–ĺ –Ņ—Ä–ł —Ä–Ķ–į–ļ—Ü–ł—Ź—Ö –Ĺ–į –Ņ–ł—Č—É —Ā –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ–į—Ä—ā–ł–Ĺ–ĺ–Ļ —Ä–Ķ—Ü–ł–ī–ł–≤–ł—Ä—É—é—Č–Ķ–Ļ –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č) –≤ –ď–ö–° –Ĺ–Ķ –Ĺ—É–∂–ī–į–Ľ–ł—Ā—Ć.
–ė–Ĺ—Ą—É–∑–ł–ĺ–Ĺ–Ĺ–į—Ź —ā–Ķ—Ä–į–Ņ–ł—Ź –Ņ–ĺ—ā—Ä–Ķ–Ī–ĺ–≤–į–Ľ–į—Ā—Ć 19,1% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –≤ –Ĺ–į—á–į–Ľ–Ķ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź —Ā —Ü–Ķ–Ľ—Ć—é –ī–Ķ–∑–ł–Ĺ—ā–ĺ–ļ—Ā–ł–ļ–į—Ü–ł–ł –ł –≤–ĺ—Ā—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–ł—Ź –ľ–ł–ļ—Ä–ĺ—Ü–ł—Ä–ļ—É–Ľ—Ź—Ü–ł–ł (—Ā –≤–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ–ľ –≥–ĺ—Ä–ľ–ĺ–Ĺ–ĺ–≤ –≤–Ĺ—É—ā—Ä–ł–≤–Ķ–Ĺ–Ĺ–ĺ), –Ņ—Ä–ł—á–Ķ–ľ –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ—Ā—ā—Ć –≤ –ł–Ĺ—ā–Ķ–Ĺ—Ā–ł–≤–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –≤–ĺ–∑–Ĺ–ł–ļ–į–Ľ–į –≤ 2 —Ä–į–∑–į —á–į—Č–Ķ –Ņ—Ä–ł –†–õ–ď —Ā –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ–į—Ä—ā–ł–Ĺ–ĺ–Ļ –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ–ĺ–Ļ –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č.
–ú—č –Ņ—Ä–ĺ–į–Ĺ–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ľ–ł –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć —Ā—ā–į—Ü–ł–ĺ–Ĺ–į—Ä–Ĺ–ĺ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –ě–ź–†/–ü–ź–† –≤ –∑–į–≤–ł—Ā–ł–ľ–ĺ—Ā—ā–ł –ĺ—ā —Ö–į—Ä–į–ļ—ā–Ķ—Ä–į –Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä—É—é—Č–ł—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤, –ĺ–ļ–į–∑–į–Ľ–ĺ—Ā—Ć, —á—ā–ĺ –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –≤ –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ —Ā—ā–Ķ–Ņ–Ķ–Ĺ–ł –∑–į–≤–ł—Ā–ł—ā –ĺ—ā –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–Ķ–Ļ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź (—Ä–ł—Ā. 8). –í—č—Ź–≤–Ľ–Ķ–Ĺ–ĺ, —á—ā–ĺ –Ņ–ĺ–Ľ–ĺ–≤–ł–Ĺ–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –≤—č–Ņ–ł—Ā—č–≤–į—é—ā—Ā—Ź –ł–∑ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –≤ –Ņ–Ķ—Ä–≤—č–Ķ 3 –ī–Ĺ—Ź —Ā—ā–į—Ü–ł–ĺ–Ĺ–į—Ä–Ĺ–ĺ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź (50 –ł 49,4% —Ā –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ–ĺ–Ļ –ł –Ņ–ł—Č–Ķ–≤–ĺ–Ļ –ě–ź–†/–ü–ź–† —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ) –Ĺ–Ķ–∑–į–≤–ł—Ā–ł–ľ–ĺ –ĺ—ā –Ņ—Ä–ł—á–ł–Ĺ–Ĺ–ĺ–≥–ĺ —Ą–į–ļ—ā–ĺ—Ä–į. –í 1-–Ķ —Ā—É—ā –≤ 3 —Ä–į–∑–į —á–į—Č–Ķ –≤—č–Ņ–ł—Ā—č–≤–į—é—ā—Ā—Ź –ī–Ķ—ā–ł —Ā –Ņ–ł—Č–Ķ–≤–ĺ–Ļ –Ņ—Ä–ĺ–≤–ĺ–ļ–į—Ü–ł–Ķ–Ļ –ě–ź–†/–ü–ź–† (–Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –Ņ–ĺ —ā—Ä–Ķ–Ī–ĺ–≤–į–Ĺ–ł—é —Ä–ĺ–ī–ł—ā–Ķ–Ľ–Ķ–Ļ) –≤ —Ā–≤—Ź–∑–ł —Ā –Ī—č—Ā—ā—Ä–ĺ–Ļ —Ā—ā–į–Ī–ł–Ľ–ł–∑–į—Ü–ł–Ķ–Ļ —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł—Ź –ł –≤ 5 —Ä–į–∑ —á–į—Č–Ķ ‚ÄĒ —Ā –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ–į—Ä—ā–ł–Ĺ–ĺ–Ļ –ĺ–≥—Ä–į–Ĺ–ł—á–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ĺ—ā–Ķ–ļ–į –ö–≤–ł–Ĺ–ļ–Ķ.

–Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–Ĺ—č–Ķ –≤ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł —Ā—Ä–į–≤–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ķ –ī–į–Ĺ–Ĺ—č–Ķ –Ĺ–į–≥–Ľ—Ź–ī–Ĺ–ĺ –ī–Ķ–ľ–ĺ–Ĺ—Ā—ā—Ä–ł—Ä—É—é—ā –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä—É—é—Č–Ķ–≥–ĺ —Ą–į–ļ—ā–ĺ—Ä–į (–Ņ—Ä–ĺ–ī—É–ļ—ā–ĺ–≤ –Ņ–ł—ā–į–Ĺ–ł—Ź –ł–Ľ–ł –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤ –ł —Ö–ł–ľ–ł—á–Ķ—Ā–ļ–ł—Ö –≤–Ķ—Č–Ķ—Ā—ā–≤) –Ĺ–į –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ—É—é –ļ–į—Ä—ā–ł–Ĺ—É –ě–ź–†/–ü–ź–† –ł –ī–ł–Ĺ–į–ľ–ł–ļ—É —Ā–ł–ľ–Ņ—ā–ĺ–ľ–ĺ–≤ –Ĺ–į —Ą–ĺ–Ĺ–Ķ –Ņ—Ä–ĺ–≤–ĺ–ī–ł–ľ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł.
–ó–į–ļ–Ľ—é—á–Ķ–Ĺ–ł–Ķ
–†–Ķ—ā—Ä–ĺ—Ā–Ņ–Ķ–ļ—ā–ł–≤–Ĺ—č–Ļ –į–Ĺ–į–Ľ–ł–∑, –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–Ĺ—č–Ļ –≤ —Ö–ĺ–ī–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź, –į–ļ—Ü–Ķ–Ĺ—ā–ł—Ä–ĺ–≤–į–Ľ –Ĺ–į—ą–Ķ –≤–Ĺ–ł–ľ–į–Ĺ–ł–Ķ –Ĺ–į –Ĺ–Ķ–ļ–ĺ—ā–ĺ—Ä—č—Ö –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ź—Ö –ļ–Ľ–ł–Ĺ–ł–ļ–ł –ł —ā–Ķ—á–Ķ–Ĺ–ł—Ź –ě–ź–†/–ü–ź–† —É –ī–Ķ—ā–Ķ–Ļ, —á—ā–ĺ, –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ, –ī–į—Ā—ā –Ņ—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ł–Ķ –ĺ—Ä–ł–Ķ–Ĺ—ā–ł—Ä—č –≤ –ī–ł—Ą—Ą–Ķ—Ä–Ķ–Ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–Ķ –ł —ā–į–ļ—ā–ł–ļ–Ķ –ī–į–Ľ—Ć–Ĺ–Ķ–Ļ—ą–Ķ–≥–ĺ –≤–Ķ–ī–Ķ–Ĺ–ł—Ź –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤. –Ę–į–ļ, –Ņ–ł—Č–Ķ–≤–į—Ź —Ä–Ķ–į–ļ—Ü–ł—Ź —á–į—Č–Ķ –≤–ĺ–∑–Ĺ–ł–ļ–į–Ķ—ā –≤ –ľ–Ľ–į–ī—ą–Ķ–ľ –ī–Ķ—ā—Ā–ļ–ĺ–ľ –≤–ĺ–∑—Ä–į—Ā—ā–Ķ, —Ä–Ķ–∂–Ķ –Ĺ–į–Ī–Ľ—é–ī–į–Ķ—ā—Ā—Ź —É –Ņ–ĺ–ī—Ä–ĺ—Ā—ā–ļ–ĺ–≤ ‚ÄĒ –Ĺ–į –Ņ—Ä–ĺ–ī—É–ļ—ā—č –∂–ł–≤–ĺ—ā–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–∂–ī–Ķ–Ĺ–ł—Ź –ł –ĺ–≤–ĺ—Č–ł. –ö —Ą—Ä—É–ļ—ā–į–ľ, –≤—č–∑—č–≤–į—é—Č–ł–ľ –ě–ź–†/–ü–ź–†, –ĺ—ā–Ĺ–ĺ—Ā—Ź—ā—Ā—Ź –≤ –ĺ—Ā–Ĺ–ĺ–≤–Ĺ–ĺ–ľ —ć–ļ–∑–ĺ—ā–ł—á–Ķ—Ā–ļ–ł–Ķ —Ā–ĺ—Ä—ā–į. –£ –ļ–į–∂–ī–ĺ–≥–ĺ 10-–≥–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä—É—é—ā —Ä–Ķ–į–ļ—Ü–ł—é –ĺ—Ä–Ķ—Ö–ł –ł–Ľ–ł —Ā–Ķ–ľ–Ķ—á–ļ–ł. –í –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ–į—Ä—ā–ł–Ĺ–Ķ –į–Ĺ–≥–ł–ĺ–ĺ—ā–Ķ–ļ–ł –≤—Ā—ā—Ä–Ķ—á–į—é—ā—Ā—Ź —á–į—Ā—ā–ĺ, –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ –ĺ—ā–Ķ–ļ–ł –≥—É–Ī –ł —Ź–∑—č–ļ–į (–ł–∑-–∑–į —Ä–į–∑–Ľ–ł—á–Ĺ–ĺ–Ļ ¬ę—ā–Ķ—Ö–Ĺ–ł–ļ–ł¬Ľ –Ņ—Ä–ł–Ķ–ľ–į –Ņ–ł—Č–ł –ł –Ņ—Ä–ł–Ķ–ľ–į –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤). –ď–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł—Ź —Ā –ļ–Ľ–ł–Ĺ–ł–ļ–ĺ–Ļ –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č –Ĺ–Ķ—Ä–Ķ–ī–ļ–ĺ –∑–į—ā—Ź–≥–ł–≤–į–Ķ—ā—Ā—Ź –≤–≤–ł–ī—É –Ĺ–Ķ—Ā—ā–į–Ī–ł–Ľ—Ć–Ĺ–ĺ–≥–ĺ —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —ć—Ą—Ą–Ķ–ļ—ā–į, –Ĺ–ĺ –Ņ—Ä–ł –Ņ–ł—Č–Ķ–≤—č—Ö –ĺ—ā–Ķ–ļ–į—Ö –ī–Ķ—ā–ł –≤—č–Ņ–ł—Ā—č–≤–į—é—ā—Ā—Ź –Ī—č—Ā—ā—Ä–ĺ. –†–õ–ď —É—á–į—Č–į—é—ā—Ā—Ź —Ā –≤–ĺ–∑—Ä–į—Ā—ā–ĺ–ľ, —á–į—Ā—ā–ĺ –≤—Ā—ā—Ä–Ķ—á–į—é—ā—Ā—Ź —Ä–Ķ–į–ļ—Ü–ł–ł –Ĺ–į –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č –ľ–Ķ—Ā—ā–Ĺ–ĺ–≥–ĺ –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź. –ü—Ä–Ķ–≤–į–Ľ–ł—Ä—É–Ķ—ā –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–į—Ź –ļ–į—Ä—ā–ł–Ĺ–į –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ–ĺ–Ļ –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č —Ā –Ņ–ĺ–≤—Ä–Ķ–∂–ī–Ķ–Ĺ–ł–Ķ–ľ –Ī–į—Ä—Ć–Ķ—Ä–Ĺ–ĺ–Ļ —Ą—É–Ĺ–ļ—Ü–ł–ł –Ņ–Ķ—á–Ķ–Ĺ–ł –ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ķ–ľ –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–Ĺ—č—Ö –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ, –ļ–ĺ–≥–ī–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–ł—Ä—É—é—ā—Ā—Ź –≤ —Ä–į–Ĺ–Ĺ–ł–Ķ —Ā—Ä–ĺ–ļ–ł (–ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ —Ā –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź–ľ–ł –į–Ĺ–≥–ł–ĺ–ĺ—ā–Ķ–ļ–ĺ–≤).–Ę–Ķ—Ä–į–Ņ–ł—Ź –į–Ĺ—ā–ł–≥–ł—Ā—ā–į–ľ–ł–Ĺ–Ĺ—č–ľ–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–į –ļ–į–ļ –Ņ—Ä–ł –ě–ź–†, —ā–į–ļ –ł –Ņ—Ä–ł –ü–ź–†. –ď–ö–° —ā—Ä–Ķ–Ī—É—é—ā—Ā—Ź –≤ 100% —Ā–Ľ—É—á–į–Ķ–≤ –Ņ—Ä–ł –†–õ–ď, –į –ł–Ĺ—Ą—É–∑–ł–ĺ–Ĺ–Ĺ–į—Ź —ā–Ķ—Ä–į–Ņ–ł—Ź –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź–Ķ—ā—Ā—Ź —á–į—Č–Ķ —É –ī–Ķ—ā–Ķ–Ļ —Ā —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ–Ļ –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü–Ķ–Ļ, —Ā—ā–į—Ü–ł–ĺ–Ĺ–į—Ä–Ĺ–ĺ–Ķ –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ –Ī–ĺ–Ľ–Ķ–Ķ –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ –ł–∑-–∑–į —Ä–Ķ—Ü–ł–ī–ł–≤–ł—Ä—É—é—Č–ł—Ö –≤—č—Ā—č–Ņ–į–Ĺ–ł–Ļ –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ —Ä–Ķ—Ü–ł—Ä–ļ—É–Ľ—Ź—Ü–ł–ł –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—ā–ĺ–≤.
–ź–Ĺ–į–Ľ–ł–∑ —Ą–ĺ–Ĺ–ĺ–≤–ĺ–Ļ –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł –Ņ–ĺ–ļ–į–∑–į–Ľ, —á—ā–ĺ —Ä–ĺ–Ľ—Ć —Ā–Ķ–ľ–Ķ–Ļ–Ĺ–ĺ–Ļ –ĺ—ā—Ź–≥–ĺ—Č–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –į–Ľ–Ľ–Ķ—Ä–≥–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–į –≤ —Ä–į–∑–≤–ł—ā–ł–ł –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č –ł –į–Ĺ–≥–ł–ĺ–ĺ—ā–Ķ–ļ–į –Ĺ–Ķ–≤–Ķ–Ľ–ł–ļ–į –≤–≤–ł–ī—É –Ņ—Ä–Ķ–≤–į–Ľ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –≤ –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ–∑–Ķ –Ĺ–Ķ–ł–ľ–ľ—É–Ĺ–Ĺ—č—Ö —Ä–Ķ–į–ļ—Ü–ł–Ļ. –Ě–į–Ņ—Ä–ĺ—ā–ł–≤, –Ĺ–į–Ľ–ł—á–ł–Ķ –ź–Ē –ł –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ä–ł–Ĺ–ł—ā–į –≤ –Ľ–ł—á–Ĺ–ĺ–ľ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–Ķ —Ā —Ā–Ķ–Ĺ—Ā–ł–Ī–ł–Ľ–ł–∑–į—Ü–ł–Ķ–Ļ (–ĺ–Ī—Č–Ķ–Ļ –ł –ľ–Ķ—Ā—ā–Ĺ–ĺ–Ļ), –Ņ—Ä–Ķ–ī—ą–Ķ—Ā—ā–≤—É—é—Č–Ķ–Ļ –ě–ź–†, –≤–Ľ–ł—Ź–Ķ—ā –Ĺ–į –Ķ–Ķ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ—É—é –ļ–į—Ä—ā–ł–Ĺ—É: –ź–Ē —á–į—Ā—ā–ĺ —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É–Ķ—ā —Ä–į–∑–≤–ł—ā–ł—é –ļ—Ä–į–Ņ–ł–≤–Ĺ–ł—Ü—č, –į –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–Ļ —Ä–ł–Ĺ–ł—ā ‚ÄĒ –Ľ–ĺ–ļ–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ–ĺ–≥–ĺ –į–Ĺ–≥–ł–ĺ–ĺ—ā–Ķ–ļ–į –≤ –ĺ–Ī–Ľ–į—Ā—ā–ł —Ä–ĺ—ā–ĺ- –ł –Ĺ–ĺ—Ā–ĺ–≥–Ľ–ĺ—ā–ļ–ł.
–ė—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –Ņ–ĺ–∑–≤–ĺ–Ľ–ł–Ľ–ĺ –≤—č—Ź–≤–ł—ā—Ć —Ā–Ķ–∑–ĺ–Ĺ–Ĺ—č–Ķ –≤–∑–į–ł–ľ–ĺ—Ā–≤—Ź–∑–ł –ě–ź–†/–ü–ź–† —Ā –Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä—É—é—Č–ł–ľ–ł —Ą–į–ļ—ā–ĺ—Ä–į–ľ–ł –ł –ļ–ĺ—Ä—Ä–Ķ–Ľ—Ź—Ü–ł—é –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –≤–Ķ—Č–Ķ—Ā—ā–≤ —Ā —Ü–ł—Ä–ļ–į–ī–Ĺ—č–ľ–ł —Ä–ł—ā–ľ–į–ľ–ł —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–ł—Ź –ł–Ĺ—Ą–Ķ–ļ—Ü–ł–ĺ–Ĺ–Ĺ—č—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ, –į –Ņ–ł—Č–Ķ–≤—č—Ö ‚ÄĒ —Ā –Ņ–ł—Č–Ķ–≤—č–ľ–ł –Ņ—Ä–ł—Ā—ā—Ä–į—Ā—ā–ł—Ź–ľ–ł –ł –Ņ–ĺ–≥—Ä–Ķ—ą–Ĺ–ĺ—Ā—ā—Ź–ľ–ł.
–ü—Ä–ĺ—Ā–Ľ–Ķ–∂–Ķ–Ĺ–į –Ņ—Ä–Ķ–Ķ–ľ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä—É—é—Č–ł—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ –≤ –ł—Ā—ā–ĺ—Ä–ł—Ź—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź: –≤ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–Ķ –ī–Ķ—ā–Ķ–Ļ —Ā –Ņ–ł—Č–Ķ–≤—č–ľ–ł –ě–ź–†/–ü–ź–†, –ļ–į–ļ –Ņ—Ä–į–≤–ł–Ľ–ĺ, –ī–ĺ –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł–ł —É–∂–Ķ –ł–ľ–Ķ–Ľ–ł—Ā—Ć —Ä–Ķ–į–ļ—Ü–ł–ł –Ĺ–į –Ņ—Ä–ĺ–ī—É–ļ—ā—č –Ņ–ł—ā–į–Ĺ–ł—Ź, –į –Ņ—Ä–ł –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö ‚ÄĒ –Ĺ–į –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā—č. –ź–Ĺ–į–Ľ–ł–∑ –Ņ—Ä–ĺ–ī–Ķ–ľ–ĺ–Ĺ—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ľ –≤—č—Ā–ĺ–ļ—É—é —á–į—Ā—ā–ĺ—ā—É (27%) –ě–ź–†/–ü–ź–† –≤ —Ā–ł—ā—É–į—Ü–ł—Ź—Ö, –ļ–ĺ–≥–ī–į —Ä–ĺ–ī–ł—ā–Ķ–Ľ–ł –Ĺ–Ķ –ľ–ĺ–≥–Ľ–ł –≤–Ķ—Ä–ł—Ą–ł—Ü–ł—Ä–ĺ–≤–į—ā—Ć –Ņ—Ä–ł—á–ł–Ĺ—É, —ā–Ķ—Ä—Ź–Ľ–ł –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ć –ł–Ľ–ł –Ĺ–Ķ –ĺ–ļ–į–∑—č–≤–į–Ľ–ł –ī–ĺ–Ľ–∂–Ĺ–ĺ–≥–ĺ –≤–Ĺ–ł–ľ–į–Ĺ–ł—Ź —Ä–į—Ü–ł–ĺ–Ĺ—É –Ņ–ł—ā–į–Ĺ–ł—Ź —Ä–Ķ–Ī–Ķ–Ĺ–ļ–į, –į —ā–į–ļ–∂–Ķ –Ņ—Ä–ł –Ņ–ĺ–Ľ–ł–Ņ—Ä–į–≥–ľ–į–∑–ł–ł. –í—č—Ź–≤–Ľ–Ķ–Ĺ–Ĺ—č–Ķ —Ā–Ľ—É—á–į–ł –Ņ–ĺ–≤—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ł–Ķ–ľ–į –Ņ—Ä–ł—á–ł–Ĺ–Ĺ—č—Ö –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö —Ā—Ä–Ķ–ī—Ā—ā–≤ –ł –Ņ—Ä–ĺ–ī—É–ļ—ā–ĺ–≤ –Ņ–ł—ā–į–Ĺ–ł—Ź, —É–∂–Ķ –ĺ–ī–Ĺ–į–∂–ī—č —Ā–Ņ—Ä–ĺ–≤–ĺ—Ü–ł—Ä–ĺ–≤–į–≤—ą–ł—Ö –ě–ź–†/–ü–ź–†, –ī–ĺ–Ľ–∂–Ĺ—č –≤—č–∑—č–≤–į—ā—Ć –Ĺ–į—Ā—ā–ĺ—Ä–ĺ–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –≤–≤–ł–ī—É —Ä–ł—Ā–ļ–į —Ä–į–∑–≤–ł—ā–ł—Ź –∂–ł–∑–Ĺ–Ķ—É–≥—Ä–ĺ–∂–į—é—Č–Ķ–≥–ĺ —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł—Ź (–≤ —á–į—Ā—ā–Ĺ–ĺ—Ā—ā–ł, –į–Ĺ–į—Ą–ł–Ľ–į–ļ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —ą–ĺ–ļ–į –Ņ—Ä–ł –ł—Ā—ā–ł–Ĺ–Ĺ–ĺ–Ļ –į–Ľ–Ľ–Ķ—Ä–≥–ł–ł). –õ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č, –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ —á–į—Ā—ā–ĺ –≤—č–∑—č–≤–į—é—Č–ł–Ķ –ě–ź–†/–ü–ź–† (–į–Ĺ—ā–ł–Ī–ł–ĺ—ā–ł–ļ–ł, –∂–į—Ä–ĺ–Ņ–ĺ–Ĺ–ł–∂–į—é—Č–ł–Ķ, –ĺ—ā—Ö–į—Ä–ļ–ł–≤–į—é—Č–ł–Ķ, –Ņ—Ä–ĺ—ā–ł–≤–ĺ–≤–ł—Ä—É—Ā–Ĺ—č–Ķ), —Ź–≤–Ľ—Ź—é—ā—Ā—Ź —ą–ł—Ä–ĺ–ļ–ĺ –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź–Ķ–ľ—č–ľ–ł —Ā—Ä–Ķ–ī—Ā—ā–≤–į–ľ–ł –Ī–Ķ–∑—Ä–Ķ—Ü–Ķ–Ņ—ā—É—Ä–Ĺ–ĺ–≥–ĺ –ĺ—ā–Ņ—É—Ā–ļ–į, —á—ā–ĺ –Ņ–ĺ–≤—č—ą–į–Ķ—ā —Ä–ł—Ā–ļ –Ī–Ķ—Ā–ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ć–Ĺ–ĺ–≥–ĺ —Ā–į–ľ–ĺ–Ľ–Ķ—á–Ķ–Ĺ–ł—Ź. –ö—Ä–ĺ–ľ–Ķ —ā–ĺ–≥–ĺ, –Ĺ–Ķ–∑–Ĺ–į–Ĺ–ł–Ķ –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ –Ņ–Ķ—Ä–Ķ–ļ—Ä–Ķ—Ā—ā–Ĺ–ĺ–Ļ –į–Ľ–Ľ–Ķ—Ä–≥–ł–ł, –Ņ—Ä–į–≤–ł–Ľ –Ņ–ł—ā–į–Ĺ–ł—Ź –ł –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –ī–Ķ—ā–Ķ–Ļ —Ā –Ņ–ĺ–Ľ–Ľ–ł–Ĺ–ĺ–∑–ĺ–ľ —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É–Ķ—ā –Ņ—Ä–ĺ–≤–ĺ–ļ–į—Ü–ł–ł –ě–ź–†.











