–Т–≤–µ–і–µ–љ–Є–µ
–Т–∞–ґ–љ—Л–Љ –≤–Њ–њ—А–Њ—Б–Њ–Љ –љ–∞–±–ї—О–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ–Є –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є –Њ—А–≥–∞–љ–Њ–≤ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ —П–≤–ї—П—О—В—Б—П –≤–Њ–њ—А–Њ—Б—Л –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є (–У–Т–Ш) —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —В–Њ–њ–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Є–Љ–µ—О—Й–Є—Е –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–є –≤—Л—Б–Њ–Ї–Є–є –њ—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є.
–С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —Н–њ–Є–Ј–Њ–і–Њ–≤ –Њ—Б—В—А—Л—Е —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є (–Ю–†–Ш), –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є—Е —Г –і–µ—В–µ–є, –Є–Љ–µ—О—В –≤–Є—А—Г—Б–љ–Њ–µ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є–µ [1]. –Т –ї–Є—В–µ—А–∞—В—Г—А–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –і–∞–љ–љ—Л–µ –Њ —А–Њ–ї–Є —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –У–Т–Ш —Г –і–µ—В–µ–є —Б —А–µ–Ї—Г—А—А–µ–љ—В–љ—Л–Љ–Є –Ю–†–Ш [2, 3] –Є –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–µ—В–µ–є —Б —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ–Є –Ю–†–Ш –љ–∞ –У–Т–Ш [4].
–Я—А–Њ–≤–µ–і–µ–љ–љ—Л–µ –љ–∞–Љ–Є —А–∞–љ–µ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Б—А–µ–і–Є –і–µ—В–µ–є —Б –∞–Ї—В–Є–≤–љ–Њ–є –У–Т–Ш (–≤–Є—А—Г—Б –≥–µ—А–њ–µ—Б–∞ —З–µ–ї–Њ–≤–µ–Ї–∞ (–Т–У–І) 6–Р/–Т, –≤–Є—А—Г—Б –≠–њ—И—В–µ–є–љ–∞ вАФ –С–∞—А—А (–Т–≠–С), —Ж–Є—В–Њ–Љ–µ–≥–∞–ї–Њ–≤–Є—А—Г—Б (–¶–Ь–Т), –≤–Є—А—Г—Б –њ—А–Њ—Б—В–Њ–≥–Њ –≥–µ—А–њ–µ—Б–∞ 1-–≥–Њ —В–Є–њ–∞ (–Т–Я–У-1)) —З–µ—А–µ–Ј 3 –Љ–µ—Б. –љ–∞–±–ї—О–і–µ–љ–Є—П –Њ—В –љ–∞—З–∞–ї–∞ –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–Я–Т–Ґ) —Г 89 (84%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї –њ–Њ–ї—Г—З–µ–љ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В (—Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ю–†–Ш вАФ —Г 20 –і–µ—В–µ–є, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Ю–†–Ш –≤ —В–µ—З–µ–љ–Є–µ 3 –Љ–µ—Б. вАФ —Г 69 –і–µ—В–µ–є). –Ш–љ—Д–µ–Ї—Ж–Є—П, –≤—Л–Ј–≤–∞–љ–љ–∞—П –Т–У–І-6–Р/–Т, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —Г 35% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Т–≠–С вАФ —Г 12%, –Т–Я–У-1 вАФ —Г 9%, –¶–Ь–Т вАФ —Г 3%. –У–Т–Ш —Б–Њ—З–µ—В–∞–љ–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Є–Љ–µ–ї–Є –Љ–µ—Б—В–Њ —Г 41% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є–Ј –љ–Є—Е –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Л—П–≤–ї—П–ї–Њ—Б—М —Б–Њ—З–µ—В–∞–љ–Є–µ –Т–У–І-6–Р/–Т + –Т–≠–С вАФ —Г 23%, —А–µ–ґ–µ –Т–У–І-6–Р/–Т + –Т–Я–У-1 вАФ —Г 9%, –Т–У–І-6–Р/–Т + –Т–≠–С + –Т–Я–У-1 вАФ —Г 5%, –Т–У–І-6–Р/–Т + –¶–Ь–Т вАФ —Г 2%, –Т–У–І-6–Р/–Т + –Т–≠–С + –¶–Ь–Т вАФ —Г 2%.
–Я–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ї—Г—А—Б–∞ –Я–Т–Ґ —Б–љ–Є–ґ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –У–Т–Ш –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ —Г 79 (76%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—Г 59 –Є–Ј –љ–Є—Е –њ–Њ—Б–ї–µ —В–µ—А–∞–њ–Є–Є –±—Л–ї–Є –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ—Л –ї–∞—В–µ–љ—В–љ—Л–µ —Д–Њ—А–Љ—Л –У–Т–Ш, —Г 20 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –У–Т–Ш —Б–Њ—З–µ—В–∞–љ–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –ї–∞—В–µ–љ—В–љ–Њ–є —Б—В–∞–ї–∞ –Њ–і–љ–∞ –Є–Ј –У–Т–Ш). –Ґ–Њ –µ—Б—В—М –і–Є–љ–∞–Љ–Є–Ї–∞ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ј–∞–њ–∞–Ј–і—Л–≤–∞–ї–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (—А–Є—Б. 1) [5].
![–†–Є—Б. 1. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞ –њ–µ—А–≤–Њ–Љ —Н—В–∞–њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П [5] Fig. 1. Efficacy of the administered therapy during the first stage of the trial [5] –†–Є—Б. 1. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞ –њ–µ—А–≤–Њ–Љ —Н—В–∞–њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П [5] Fig. 1. Efficacy of the administered therapy during the first stage of the trial [5]](/upload/medialibrary/167/618-1.png)
–І–µ—А–µ–Ј 3 –Љ–µ—Б. –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Я–Т–Ґ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є–љ–Њ–Ј–Є–љ–∞ –њ—А–∞–љ–Њ–±–µ–Ї—Б, –∞—Ж–Є–Ї–ї–Њ–≤–Є—А, –≤–∞–ї–∞—Ж–Є–Ї–ї–Њ–≤–Є—А –±—Л–ї –њ—А–Њ–≤–µ–і–µ–љ –∞–љ–∞–ї–Є–Ј –і–Є–љ–∞–Љ–Є–Ї–Є —З–∞—Б—В–Њ—В—Л —Н–њ–Є–Ј–Њ–і–Њ–≤ –Ю–†–Ш –Ј–∞ –њ–µ—А–Є–Њ–і, –њ—А–Њ—И–µ–і—И–Є–є —Б –љ–∞—З–∞–ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П. –Э–∞ –Љ–Њ–Љ–µ–љ—В –љ–∞—З–∞–ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П 77% –і–µ—В–µ–є –њ–Њ—Б–ї–µ –Ї—Г—А—Б–∞ –Я–Т–Ґ –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –њ—А—П–Љ–Њ–≥–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –Ј–∞ –њ—А–µ–і—Л–і—Г—Й–Є–µ 3 –Љ–µ—Б. –љ–µ –±–Њ–ї–µ–ї–Є –Ю–†–Ш –љ–Є —А–∞–Ј—Г, 23% –і–µ—В–µ–є –±–Њ–ї–µ–ї–Є 1вАУ2 —А–∞–Ј–∞ –≤ –Љ–µ—Б—П—Ж —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –±–Њ–ї–µ–µ 38 ¬∞–°, –њ–Њ–ї—Г—З–∞–ї–Є —В–Њ–ї—М–Ї–Њ –Љ–µ—Б—В–љ—Г—О —В–µ—А–∞–њ–Є—О (—В. –µ. –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –њ—А–Њ—В–µ–Ї–∞–ї–Њ –ї–µ–≥—З–µ, —З–µ–Љ –і–Њ —В–µ—А–∞–њ–Є–Є). –£ –і–µ—В–µ–є, –Ї–Њ—В–Њ—А—Л–µ –љ–µ –њ–Њ–ї—Г—З–∞–ї–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –У–Т–Ш, —З–µ—А–µ–Ј 3 –Љ–µ—Б. –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г–ї—Г—З—И–µ–љ–Є–µ –≤ 11% —Б–ї—Г—З–∞–µ–≤, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і–Є–љ–∞–Љ–Є–Ї–Є вАФ –≤ 44%, —Г—Е—Г–і—И–µ–љ–Є–µ вАФ –≤ 44%, –∞ —З–µ—А–µ–Ј 6 –Љ–µ—Б. —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є—П –Є–Љ–µ–ї–∞ –Љ–µ—Б—В–Њ —Г 100% –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е. –Ю—В—Б—Г—В—Б—В–≤–Є–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є –Т–У–І-6–Р/–Т —Г –і–µ—В–µ–є —Б —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ–Є –Ю–†–Ш –Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Њ–є –Ї–ї–Є–љ–Є–Ї–Њ-–ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ–Њ—Б–ї–µ –Ї—Г—А—Б–∞ –Я–Т–Ґ –≤–µ–і–µ—В –Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—О —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –≤ 100% —З–µ—А–µ–Ј 6 –Љ–µ—Б. –≠—В–Њ—В —Д–∞–Ї—В –Њ–±—К—П—Б–љ—П–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Ї–ї–Є–љ–Є–Ї–Њ-–ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П —Б–Њ—Б—В–Њ—П–љ–Є—П –і–µ—В–µ–є, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ї–ї–Є–љ–Є-—З–µ—Б–Ї–Є –Љ–∞–љ–Є—Д–µ—Б—В–љ—Л–µ —Д–Њ—А–Љ—Л –У–Т–Ш –Љ–Є–љ–Є–Љ—Г–Љ –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. [5].
–Я–∞–љ–∞–≤–Є—А¬Ѓ вАФ –ї–Є–љ–µ–є–Ї–∞ —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П —Б —И–Є—А–Њ–Ї–Є–Љ —Б–њ–µ–Ї—В—А–Њ–Љ –∞–љ—В–Є–≤–Є—А—Г—Б–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П. –Я–∞–љ–∞–≤–Є—А¬Ѓ —П–≤–ї—П–µ—В—Б—П –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л–Љ –њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і–Њ–Љ, –Ї–Њ—В–Њ—А—Л–є –њ–Њ–ї—Г—З–µ–љ –Є–Ј —А–∞—Б—В–µ–љ–Є—П Solanum tuberosum (–њ–∞—Б–ї–µ–љ –Ї–ї—Г–±–љ–µ–љ–Њ—Б–љ—Л–є). –Ф–µ–є—Б—В–≤—Г—О—Й–Є–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ —П–≤–ї—П—О—В—Б—П –≤—Л—Б–Њ–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і–љ—Л–µ —З–∞—Б—В–Є—Ж—Л. S. Stobun et al. [6] –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –Я–∞–љ–∞–≤–Є—А¬Ѓ –≤ 4вАУ8 —А–∞–Ј —Г—Б–Є–ї–Є–≤–∞–µ—В —Б–µ–Ї—А–µ—Ж–Є—О –Р–Ґ–§ –Є —Д–∞–Ї—В–Њ—А–∞ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –Љ–Є–≥—А–∞—Ж–Є–Є –Љ–∞–Ї—А–Њ—Д–∞–≥–Њ–≤ –Ї–ї–µ—В–Ї–∞–Љ–Є HL-60. –Ф–∞–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ –∞–Ї—В–Є–≤–љ—Л–Љ —Д–∞–≥–Њ—Ж–Є—В–Њ–Ј–Њ–Љ —З–∞—Б—В–Є—Ж –Я–∞–љ–∞–≤–Є—А–∞ –Ї–ї–µ—В–Ї–∞–Љ–Є.
–†–Њ—Б—Б–Є–є—Б–Ї–Є–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П–Љ–Є –±—Л–ї–∞ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Я–∞–љ–∞–≤–Є—А¬Ѓ (—Б—Г–њ–њ–Њ–Ј–Є—В–Њ—А–Є–Є —А–µ–Ї—В–∞–ї—М–љ—Л–µ) —Г –і–µ—В–µ–є —Б –Ю–†–Ш –Є –≥—А–Є–њ–њ–Њ–Љ. –Т –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є –Я–∞–љ–∞–≤–Є—А¬Ѓ, –±—Л—Б—В—А–µ–µ –љ–∞—Б—В—Г–њ–∞–ї–Њ –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є–µ, –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л, –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є –Є –Ї–∞—В–∞—А–∞–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є. –Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –і–∞–љ–љ—Л–Љ–Є –∞–љ–Ї–µ—В–Є—А–Њ–≤–∞–љ–Є—П –њ–Њ –Ш–љ—В–µ–≥—А–∞–ї—М–љ–Њ–є —И–Ї–∞–ї–µ –Њ—Ж–µ–љ–Ї–Є —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–µ–љ–љ–Њ—Б—В–Є —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –ї–µ—З–µ–љ–Є—П (Integrative Medicine. Patient Satisfaction, IMPSS) –њ–Њ–ї–љ–∞—П —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–µ–љ–љ–Њ—Б—В—М —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –ї–µ—З–µ–љ–Є—П —А–Њ–і–Є—В–µ–ї—П–Љ–Є/—Г—Б—Л–љ–Њ–≤–Є—В–µ–ї—П–Љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–Љ–µ—З–∞–ї–∞—Б—М –≤ 80% —Б–ї—Г—З–∞–µ–≤ –≤ –≥—А—Г–њ–њ–µ –Я–∞–љ–∞–≤–Є—А–∞ –Є –≤ 25% —Б–ї—Г—З–∞–µ–≤ –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ [7]. –†–∞–љ–µ–µ –Т.–Ш. –Ъ—Г–Ј–љ–µ—Ж–Њ–≤ –Є —Б–Њ–∞–≤—В. [8] –њ—А–Њ–≤–µ–ї–Є –Њ—Ж–µ–љ–Ї—Г —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Я–∞–љ–∞–≤–Є—А–∞ –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є–Є –Ю–†–Ш —Г –≤–Ј—А–Њ—Б–ї—Л—Е. –Р–≤—В–Њ—А—Л –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–њ—А–µ—П –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї —Б–Њ–Ї—А–∞—Й–µ–љ–Є—О –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 3,35 –і–љ—П, —Г–Љ–µ–љ—М—И–µ–љ–Є—О –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ї–Є—Е–Њ—А–∞–і–Ї–Є, –Ї–∞—В–∞—А–∞–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –≥–Њ–ї–Њ–≤–љ–Њ–є –±–Њ–ї–Є, –Ї–∞—И–ї—П, –Њ–Ј–љ–Њ–±–∞, –љ–∞—Б–Љ–Њ—А–Ї–∞, —Б–ї–∞–±–Њ—Б—В–Є. –Я—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є —Б—А–µ–і—Б—В–≤–∞ —Б –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є —Ж–µ–ї—М—О –Є–Љ–µ–ї–Њ –Љ–µ—Б—В–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–њ—А–µ—П –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В –њ—А–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є –≥—А–Є–њ–њ–∞ –Є –Ю–†–Ш —Г –≤–Ј—А–Њ—Б–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞ –Є–Ј—Г—З–∞–ї–∞—Б—М –Ы.–Ш. –Ґ–Ї–∞—З–µ–љ–Ї–Њ –Є —Б–Њ–∞–≤—В. [9]. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б–њ—А–µ—П –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Њ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—О –Ї–∞—В–∞—А–∞–ї—М–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є: –±–Њ–ї–Є –Є –њ–µ—А—И–µ–љ–Є—П –≤ –≥–Њ—А–ї–µ –Є –≥–Є–њ–µ—А–µ–Љ–Є–Є —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є, –Њ–Ї–∞–Ј—Л–≤–∞–ї–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Љ–µ—Б—В–љ—Л–є –Є–Љ–Љ—Г–љ–Є—В–µ—В (sIgA), —Б–Њ–Ї—А–∞—Й–∞–ї–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–µ–±—Л–≤–∞–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–Њ–Ї–∞–Ј–∞–љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Є –Ю–†–Ш —Б–њ—А–µ—П –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В —Г –≤–Ј—А–Њ—Б–ї—Л—Е, –∞ —В–∞–Ї–ґ–µ —А–µ–Ї—В–∞–ї—М–љ—Л—Е —Б—Г–њ–њ–Њ–Ј–Є—В–Њ—А–Є–µ–≤ –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В —Г –і–µ—В–µ–є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Б–њ—А–µ—П –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В —Г –і–µ—В–µ–є —Б –У–Т–Ш —А–∞–љ–µ–µ –љ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М.
–¶–µ–ї—М –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –∞–љ–∞–ї–Є–Ј –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Є –≤–Є—А—Г—Б–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ —Б–њ—А–µ—П –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Ю–†–Ш —Г –і–µ—В–µ–є –љ–∞ —Д–Њ–љ–µ —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –У–Т–Ш.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Т –љ–∞–±–ї—О–і–∞—В–µ–ї—М–љ—Г—О –њ—А–Њ–≥—А–∞–Љ–Љ—Г –≤–Ї–ї—О—З–∞–ї–Є—Б—М –і–µ—В–Є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 1 –і–Њ 12 –ї–µ—В –і–Њ –љ–∞—З–∞–ї–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А—П–Љ–Њ–≥–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П —Б –ґ–∞–ї–Њ–±–∞–Љ–Є –љ–∞ –µ–ґ–µ–Љ–µ—Б—П—З–љ—Л–µ –Ю–†–Ш –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е 3 –Љ–µ—Б. –ї–Є–±–Њ —Б –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–є —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–µ–є –У–Т–Ш, –∞ —В–∞–Ї–ґ–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б —Б–Њ—Е—А–∞–љ—П—О—Й–Є–Љ—Б—П –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ –Ф–Э–Ъ –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б–Њ–≤ –Є–Ј —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є –Є–ї–Є —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є –Є –Ї—А–Њ–≤–Є –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Ї—Г—А—Б–∞ –Я–Т–Ґ. –Ъ—А–Є—В–µ—А–Є—П–Љ–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П –±—Л–ї–Є: –≤–Њ–Ј—А–∞—Б—В –Љ–µ–љ–µ–µ 1 –≥–Њ–і–∞ –Є —Б—В–∞—А—И–µ 12 –ї–µ—В; –Њ—В—Б—Г—В—Б—В–≤–Є–µ –µ–ґ–µ–Љ–µ—Б—П—З–љ—Л—Е –Ю–†–Ш; –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–є —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –У–Т–Ш –і–Њ –љ–∞—З–∞–ї–∞ –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –ї–Є–±–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤—Л–і–µ–ї–µ–љ–Є—П –Ф–Э–Ъ –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б–Њ–≤ –Є–Ј —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є –Є–ї–Є —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є –Є –Ї—А–Њ–≤–Є –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Ї—Г—А—Б–∞ –Я–Т–Ґ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А—П–Љ–Њ–≥–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П; –љ–∞–ї–Є—З–Є–µ –њ–µ—А–≤–Є—З–љ—Л—Е –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є.
–Э–∞–±–ї—О–і–µ–љ–Є–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Њ—Б—М –≤ —В–µ—З–µ–љ–Є–µ 3 –Љ–µ—Б. –Т—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –Ї–ї–Є–љ–Є–Ї–Њ-–ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ. –Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –У–Т–Ш –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–∞—Б—М —Б–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є, –∞ —В–∞–Ї–ґ–µ –Љ–µ—В–Њ–і–Њ–Љ –Я–¶–†. –Ь–µ—В–Њ–і–Њ–Љ –Я–¶–† —Б –≥–Є–±—А–Є–і–Є–Ј–∞—Ж–Є–Њ–љ–љ–Њ-—Д–ї—Г–Њ—А–µ—Б—Ж–µ–љ—В–љ–Њ–є –і–µ—В–µ–Ї—Ж–Є–µ–є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –∞–љ–∞–ї–Є–Ј–∞ –≤ —А–µ–ґ–Є–Љ–µ —А–µ–∞–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –≤ –Њ–±—А–∞–Ј—Ж–∞—Е –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є, –Љ–∞–Ј–Ї–∞—Е –Є–Ј —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є –≤—Л—П–≤–ї—П–ї–Є –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ –Њ–њ—А–µ–і–µ–ї—П–ї–Є –Ф–Э–Ъ –¶–Ь–Т, –Т–У–І-6–Р/–Т, –Т–≠–С. –Я–¶–†-–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –љ–∞–±–Њ—А–Њ–≤ —А–µ–∞–≥–µ–љ—В–Њ–≤, —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Л—Е –≤ –§–С–£–Э –¶–Э–Ш–Ш –≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є–Є –†–Њ—Б–њ–Њ—В—А–µ–±–љ–∞–і–Ј–Њ—А–∞. –Ь–µ—В–Њ–і–Њ–Љ –Ш–§–Р –Њ–њ—А–µ–і–µ–ї—П–ї–Є –≤–Є—А—Г—Б-—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ Ig –Ь –Є G –Ї –±–µ–ї–Ї–∞–Љ –Т–Я–У-1, –Т–≠–С, –¶–Ь–Т, –Т–У–І-6–Р/–Т.
–Т—Б–µ–≥–Њ –±—Л–ї–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Њ 76 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 0 –і–Њ 14 –ї–µ—В, –Љ–µ–і–Є–∞–љ–∞ –≤–Њ–Ј—А–∞—Б—В–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 5 (IQR 2-8) –ї–µ—В: 35 (46,1%) –і–µ–≤–Њ—З–µ–Ї –Є 41 (53,9%) –Љ–∞–ї—М—З–Є–Ї.
–Ю–±—Й–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 1.

–Ю—Б–љ–Њ–≤–љ—Г—О –≥—А—Г–њ–њ—Г —Б–Њ—Б—В–∞–≤–Є–ї–Є 49 –і–µ—В–µ–є, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В —Б–њ—А–µ–є –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –≤ –≥—А—Г–њ–њ—Г —Б—А–∞–≤–љ–µ–љ–Є—П –≤–Ї–ї—О—З–µ–љ—Л 27 –і–µ—В–µ–є. –°—Е–µ–Љ–∞ –њ—А–Є–µ–Љ–∞ вАФ –њ–Њ 1вАУ2 –≤–њ—А—Л—Б–Ї–∞ –≤ –≥–Њ—А–ї–Њ –њ–Њ—Б–ї–µ –µ–і—Л –љ–∞ 14 –і–љ–µ–є, 14 –і–љ–µ–є –њ–µ—А–µ—А—Л–≤, –Ј–∞—В–µ–Љ 14 –і–љ–µ–є –њ–Њ–≤—В–Њ—А–Є—В—М (–≤—Б–µ–≥–Њ 3 –Ї—Г—А—Б–∞). –У—А—Г–њ–њ—Л –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –њ–Њ –≤–Њ–Ј—А–∞—Б—В—Г –њ–Њ–ї—Г, –Њ—Б–љ–Њ–≤–љ—Л–Љ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ, –∞ —В–∞–Ї–ґ–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є —В–µ—А–∞–њ–Є–Є (—В–∞–±–ї. 2).

–Ъ—А–Є—В–µ—А–Є—П–Љ–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є (—В–∞–±–ї. 3), –Ї–Њ—В–Њ—А—Л–µ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –±—Л–ї–Є: –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М, –Њ—Ж–µ–љ–Ї–∞ —Г—А–Њ–≤–љ—П –≤—Л–і–µ–ї–µ–љ–Є—П –Ф–Э–Ъ –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б–Њ–≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ –Є –Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ –≤ —А–Њ—В–Њ–≥–ї–Њ—В–Ї–µ –і–Њ –Є –њ–Њ—Б–ї–µ —В–µ—А–∞–њ–Є–Є —Б–њ—А–µ–µ–Љ –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В, –≤–Є—А—Г—Б–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –њ—А—П–Љ—Л—Е –Є –љ–µ–њ—А—П–Љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, –Ї–∞–Ї —Б—Г–Љ–Љ–∞—А–љ–∞—П, —В–∞–Ї –Є –њ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є–Љ –≤–Є—А—Г—Б–∞–Љ –Њ—В–і–µ–ї—М–љ–Њ (–Т–≠–С, –¶–Ь–Т, –Т–У–І-6–Р/–Т).

–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –њ—А–Њ–≤–Њ–і–Є–ї—Б—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ–≥—А–∞–Љ–Љ—Л StatTech v. 2.8.8 (—А–∞–Ј—А–∞–±–Њ—В—З–Є–Ї вАФ –Ю–Ю–Ю ¬Ђ–°—В–∞—В—В–µ—Е¬ї, –†–Њ—Б—Б–Є—П). –Ъ–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Њ–њ–Є—Б—Л–≤–∞–ї–Є—Б—М –Ї–∞–Ї —Б—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П (M) –Є —Б—В–∞–љ–і–∞—А—В–љ—Л–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П (SD) —Б —Г–Ї–∞–Ј–∞–љ–Є–µ–Љ –≥—А–∞–љ–Є—Ж 95% –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є–љ—В–µ—А–≤–∞–ї–∞ (95% –Ф–Ш) (–њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–Є) –Є–ї–Є –Ї–∞–Ї –Љ–µ–і–Є–∞–љ—Л (Me) –Є –Љ–µ–ґ–Ї–≤–∞—А—В–Є–ї—М–љ—Л–µ –і–Є–∞–њ–∞–Ј–Њ–љ—Л (IQR) (–њ—А–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–Є, –Њ—В–ї–Є—З–љ–Њ–Љ –Њ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ). –Ъ–∞—В–µ–≥–Њ—А–Є–∞–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ–њ–Є—Б—Л–≤–∞–ї–Є—Б—М —Б —Г–Ї–∞–Ј–∞–љ–Є–µ–Љ –∞–±—Б–Њ–ї—О—В–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –Є –њ—А–Њ—Ж–µ–љ—В–љ—Л—Е –і–Њ–ї–µ–є. –°—А–∞–≤–љ–µ–љ–Є–µ –і–≤—Г—Е –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –≥—А—Г–њ–њ –њ–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ–Љ—Г –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—О, –Є–Љ–µ—О—Й–µ–Љ—Г –љ–Њ—А–Љ–∞–ї—М–љ–Њ–µ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ, –≤—Л–њ–Њ–ї–љ—П–ї–Њ—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О t-–Ї—А–Є—В–µ—А–Є—П –°—В—М—О–і–µ–љ—В–∞, –µ—Б–ї–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Њ—В–ї–Є—З–∞–ї–Њ—Б—М –Њ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ вАФ —Б –њ–Њ–Љ–Њ—Й—М—О U-–Ї—А–Є—В–µ—А–Є—П –Ь–∞–љ–љ–∞ вАФ –£–Є—В–љ–Є. –°—А–∞–≤–љ–µ–љ–Є–µ –њ—А–Њ—Ж–µ–љ—В–љ—Л—Е –і–Њ–ї–µ–є –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ —З–µ—В—Л—А–µ—Е–њ–Њ–ї—М–љ—Л—Е —В–∞–±–ї–Є—Ж —Б–Њ–њ—А—П–ґ–µ–љ–љ–Њ—Б—В–Є –≤—Л–њ–Њ–ї–љ—П–ї–Њ—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –Ї—А–Є—В–µ—А–Є—П —Е–Є-–Ї–≤–∞–і—А–∞—В –Я–Є—А—Б–Њ–љ–∞, —В–Њ—З–љ–Њ–≥–Њ –Ї—А–Є—В–µ—А–Є—П –§–Є—И–µ—А–∞. –°—А–∞–≤–љ–µ–љ–Є–µ –њ—А–Њ—Ж–µ–љ—В–љ—Л—Е –і–Њ–ї–µ–є –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ –Љ–љ–Њ–≥–Њ–њ–Њ–ї—М–љ—Л—Е —В–∞–±–ї–Є—Ж —Б–Њ–њ—А—П–ґ–µ–љ–љ–Њ—Б—В–Є –≤—Л–њ–Њ–ї–љ—П–ї–Њ—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –Ї—А–Є—В–µ—А–Є—П —Е–Є-–Ї–≤–∞–і—А–∞—В –Я–Є—А—Б–Њ–љ–∞.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Я—А–Є –≤–Ї–ї—О—З–µ–љ–Є–Є –≤ –љ–∞–±–ї—О–і–∞—В–µ–ї—М–љ—Г—О –њ—А–Њ–≥—А–∞–Љ–Љ—Г –≤—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ—А–µ–і—К—П–≤–ї—П–ї–Є –ґ–∞–ї–Њ–±—Л –љ–∞ –µ–ґ–µ–Љ–µ—Б—П—З–љ—Л–µ –Ю–†–Ш, —Б—Г–±—Д–µ–±—А–Є–ї–Є—В–µ—В, –і–ї–Є—В–µ–ї—М–љ—Г—О –Ј–∞–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М –љ–Њ—Б–∞ –Є –і—А. –Я–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ –Є–ї–Є —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –ґ–∞–ї–Њ–± –±—Л–ї–Њ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ —Г 38 (77,6%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –Є 15 (55,6%) –і–µ—В–µ–є –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П, –∞–Ї—В–Є–≤–љ—Л–µ –ґ–∞–ї–Њ–±—Л —Б–Њ—Е—А–∞–љ—П–ї–Є—Б—М —Г 11 (22,4%) –Є 12 (44,4%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (—А=0,046).
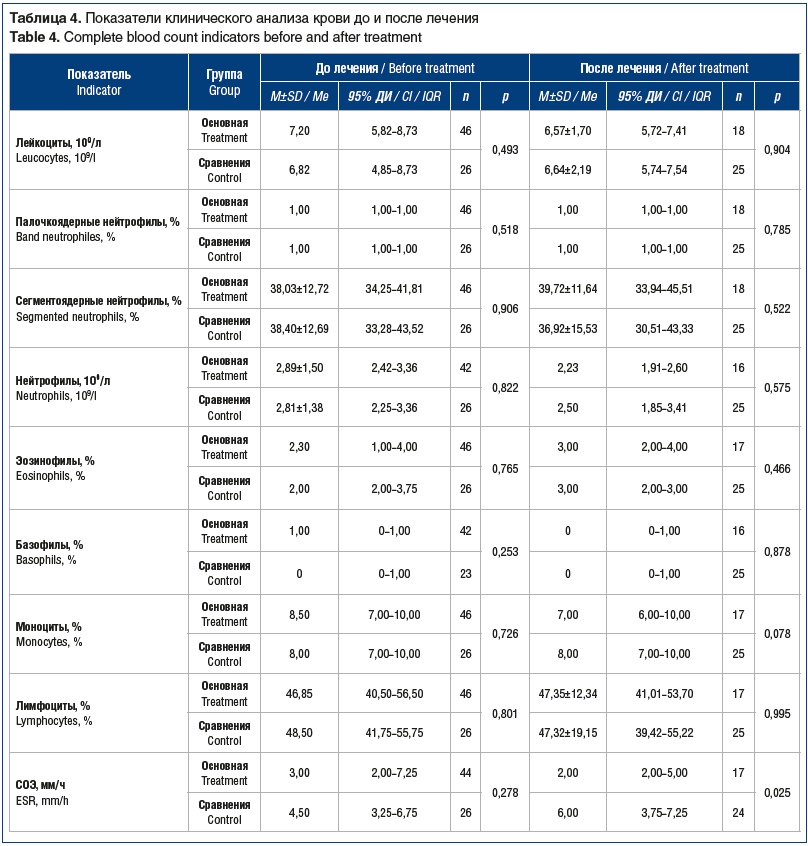
–Я–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Ї—А–Њ–≤–Є –і–Њ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –≤ —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л—Е –≥—А—Г–њ–њ–∞—Е. –Я–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —З–∞—Й–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –њ–Њ–≤—Л—И–µ–љ–Є–µ –°–Ю–≠, –∞ —В–∞–Ї–ґ–µ –љ–∞–±–ї—О–і–∞–ї—Б—П –Љ–Њ–љ–Њ—Ж–Є—В–Њ–Ј, —З—В–Њ, –≤–µ—А–Њ—П—В–љ–Њ, —Б–≤—П–Ј–∞–љ–Њ —Б —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–µ–є –У–Т–Ш (—В–∞–±–ї. 4).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Б–њ—А–µ—П –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В —Г –і–µ—В–µ–є —Б —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ–Є –Ю–†–Ш –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —Б –њ—А—П–Љ—Л–Љ –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є—О –ґ–∞–ї–Њ–± –Є –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є —Б–∞–Љ–Њ—З—Г–≤—Б—В–≤–Є—П –≤ 77,6% —Б–ї—Г—З–∞–µ–≤ (–≤ 1,5 —А–∞–Ј–∞ —З–∞—Й–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П), —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П —Г 11 (40,7%) –і–µ—В–µ–є —Б–Њ—Е—А–∞–љ—П–ї–Є—Б—М –ґ–∞–ї–Њ–±—Л, —Г 1 (3,7%) –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –њ–Њ—П–≤–ї–µ–љ–Є–µ –љ–Њ–≤—Л—Е –ґ–∞–ї–Њ–±.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Є –≤–Ї–ї—О—З–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Ї—А–Њ–≤–Є –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –≤ —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л—Е –≥—А—Г–њ–њ–∞—Е. –Р–љ–∞–ї–Є–Ј –і–Є–љ–∞–Љ–Є–Ї–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –і–Њ –Є –њ–Њ—Б–ї–µ —В–µ—А–∞–њ–Є–Є –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –љ–µ –≤—Л—П–≤–Є–ї –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є. –Ю–і–љ–∞–Ї–Њ –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П –њ–Њ–≤—Л—И–µ–љ–Є–µ –°–Ю–≠ –Є –Љ–Њ–љ–Њ—Ж–Є—В–Њ–Ј –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П —А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї–Є—Б—М —З–∞—Й–µ, —З–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л.
–Э–∞ –Љ–Њ–Љ–µ–љ—В –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л—Е –≥—А—Г–њ–њ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –≤—Л–і–µ–ї–µ–љ–Є–µ –Њ–і–љ–Њ–≥–Њ –Є–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б–Њ–≤ –≤ –Љ–∞—В–µ—А–Є–∞–ї–µ –Є–Ј —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є. –Т —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ –≤–Є—А—Г—Б–Њ–≤—Л–і–µ–ї–µ–љ–Є—П –≤ —А–Њ—В–Њ–≥–ї–Њ—В–Ї–µ –њ—А–µ–Њ–±–ї–∞–і–∞–ї –Т–У–І-6–Р/–Т вАФ —Г 64 (82%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (–Є–Ј –љ–Є—Е —Г 39 (61%) –≤ –Љ–Њ–љ–Њ–≤–∞—А–Є–∞–љ—В–µ), –Т–≠–С вАФ —Г 26 (39%) (–Є–Ј –љ–Є—Е —Г 6 (23%) –≤ –Љ–Њ–љ–Њ–≤–∞—А–Є–∞–љ—В–µ), –¶–Ь–Т вАФ —Г 12 (16%) (–Є–Ј –љ–Є—Е —Г 5 (41%) –≤ –Љ–Њ–љ–Њ–≤–∞—А–Є–∞–љ—В–µ).
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –≤—Л–і–µ–ї–µ–љ–Є—П –≤–Є—А—Г—Б–Њ–≤ –≤ –Љ–∞—В–µ—А–Є–∞–ї–µ –Є–Ј —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –Ф–Э–Ъ –≤–Є—А—Г—Б–Њ–≤ –≤ —А–Њ—В–Њ–≥–ї–Њ—В–Ї–µ –љ–µ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–ї–∞—Б—М —Г 37 (75,5%) –і–µ—В–µ–є, 1 –≤–Є—А—Г—Б –≤—Л–і–µ–ї–µ–љ —Г 10 (20,4%) –і–µ—В–µ–є, 2 –≤–Є—А—Г—Б–∞ вАФ —Г 2 (4,1%).
–Т –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –≤—Л–і–µ–ї–µ–љ–Є—П –≤–Є—А—Г—Б–Њ–≤ –Є–Ј —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–Њ 16 (59,3%), 1 –≤–Є—А—Г—Б –Њ–±–љ–∞—А—Г–ґ–µ–љ —Г 10 (37,0%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, 2 –≤–Є—А—Г—Б–∞ вАФ —Г 1 (3,7%) –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ–Њ–≥–Њ (—А<0,001) (—В–∞–±–ї. 5).

–Я—А–Њ–≤–µ–і–µ–љ –∞–љ–∞–ї–Є–Ј –≤—Л–і–µ–ї–µ–љ–Є—П –Ї–∞–ґ–і–Њ–≥–Њ –Є–Ј –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –≤–Є—А—Г—Б–Њ–≤ –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Я–¶–†-–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ. –Ф–Э–Ъ –Т–У–І-6–Р/–Т –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –і–Њ –ї–µ—З–µ–љ–Є—П –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–ї–∞—Б—М —Г 40 (81,6%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П вАФ —Г 10 (20,4%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П вАФ —Г 24 (88,9%) –Є 10 (37,0%) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–µ–є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –і–Њ–ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ –Т–У–І-6–Р/–Т –≤ –Ї–∞–ґ–і–Њ–є –Є–Ј –≥—А—Г–њ–њ (—А<0,001). –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –і–Њ–ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ –Ф–Э–Ъ –Т–У–І-6–Р/–Т –≤ —А–Њ—В–Њ–≥–ї–Њ—В–Ї–µ –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Т–У–І-6–Р/–Т —З–∞—Й–µ –≤—Л–і–µ–ї—П–µ—В—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П вАФ 10 (37%) –њ—А–Њ—В–Є–≤ 10 (20,4%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В —Б–њ—А–µ–є (—А=0,173).
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Љ–µ–і–Є–∞–љ–∞ –≤–Є—А—Г—Б–љ–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Є –Т–У–І-6–Р/–Т –≤ —А–Њ—В–Њ–≥–ї–Њ—В–Ї–µ –і–Њ –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–∞ 645,0 (IQR 399,00вАУ1600,00) –Ї–Њ–њ–Є–є/–Љ–ї, –∞ –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П вАФ 399,00 (IQR 0,00вАУ775,00) –Ї–Њ–њ–Є–є/–Љ–ї, (—А=0,084).
–Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –Ф–Э–Ъ –Т–≠–С –і–Њ –ї–µ—З–µ–љ–Є—П –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–ї–∞—Б—М —Г 19 (38,8%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П вАФ —Г 1 (2,0%) –њ–∞—Ж–Є–µ–љ—В–∞, —Б–љ–Є–ґ–µ–љ–Є–µ –і–Њ–ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ –≤–Є—А—Г—Б–∞ –±—Л–ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ (—А<0,001); –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П вАФ —Г 7 (25,9%) –Є 1 (3,7%) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (—А=0,034).
–Т—Л–і–µ–ї–µ–љ–Є–µ –¶–Ь–Т –Є–Ј –Љ–∞—В–µ—А–Є–∞–ї–∞ —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є —Г –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —А–µ–ґ–µ, —З–µ–Љ –Т–≠–С –Є –Т–У–І-6–Р/–Т. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –±—Л–ї–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О –і–Њ–ї–Є –і–µ—В–µ–є, —Г –Ї–Њ—В–Њ—А—Л—Е –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–ї—Б—П –≤–Є—А—Г—Б –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П: –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ вАФ —Б 8 (16,3%) –і–Њ 3 (6,1%) –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П (—А=0,059), –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П вАФ —Б 6 (22,2%) –і–Њ 1 (3,7%).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В —Б–њ—А–µ–є –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –≤—Л–і–µ–ї–µ–љ–Є—П –Ф–Э–Ъ –Т–≠–С, –¶–Ь–Т –Є –Т–У–І-6–Р/–Т –Є–Ј —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є. –Э–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –њ–Њ–ї—Г—З–µ–љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Т–У–І-6–Р/–Т.
–Э–∞ –Љ–Њ–Љ–µ–љ—В –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –∞–љ—В–Є-–Т–Я–У-1, -2 –Є –∞–љ—В–Є-–¶–Ь–Т IgM —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л—Е –≥—А—Г–њ–њ –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є. –Р–љ—В–Є-–Т–У–І-6–Р/–Т IgM –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –і–Њ –ї–µ—З–µ–љ–Є—П –≤—Л—П–≤–ї—П–ї–Є—Б—М —Г 1 –њ–∞—Ж–Є–µ–љ—В–∞, –∞–љ—В–Є-VCA –Т–≠–С IgM –≤—Л—П–≤–ї–µ–љ—Л —Г 2 –і–µ—В–µ–є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –Є —Г 1 —А–µ–±–µ–љ–Ї–∞ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П –і–Њ —В–µ—А–∞–њ–Є–Є. –Я–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П IgM –Ї –∞–љ–∞–ї–Є–Ј–Є—А—Г–µ–Љ—Л–Љ –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б–∞–Љ –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ. –Ь–µ–і–Є–∞–љ–∞ –∞–љ—В–Є-–Т–У–І-6–Р/–Т IgG –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –і–Њ –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–∞ 630,00 (IQR 190,00вАУ1200,00), –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П вАФ 0 (IQR 0,00вАУ350,00) (—А=0,008).
–С—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ–Њ–і–Ї–ї—О—З–µ–љ–Є–µ –Ї –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б–њ—А–µ—П –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–ї–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Г—А–Њ–≤–µ–љ—М –∞–љ—В–Є-–Т–Я–У-1, -2, –∞–љ—В–Є-–Т–≠–С, –∞–љ—В–Є-–¶–Ь–Т IgG, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –∞–љ—В–Є-–Т–У–І-6–Р/–Т IgG –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –≤ –і–Є–љ–∞–Љ–Є–Ї–µ.
–Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Њ—Ж–µ–љ–Ї–Є –і–∞–љ–љ—Л—Е –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–Њ –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є –Є –њ–Њ—Б–ї–µ –љ–µ–µ –±—Л–ї–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —Б—В–∞–і–Є—П –У–Т–Ш. –Р–Ї—В–Є–≤–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є –Є–љ—Д–µ–Ї—Ж–Є–Є —Б—З–Є—В–∞–ї–Є —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є—О –У–Т–Ш, –њ—А–Њ—П–≤–ї—П—О—Й—Г—О—Б—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ –љ–∞–ї–Є—З–Є–µ–Љ –∞–љ—В–Є-–У–Т–Ш IgM, –Ф–Э–Ъ –Є/–Є–ї–Є –∞–љ—В–Є–≥–µ–љ–Њ–≤ –≤–Є—А—Г—Б–∞ –≤ –Ї—А–Њ–≤–Є. –Ъ –љ–µ–∞–Ї—В–Є–≤–љ—Л–Љ —Д–Њ—А–Љ–∞–Љ –Є–љ—Д–µ–Ї—Ж–Є–Є –Њ—В–љ–Њ—Б–Є–ї–Є –≤—Л—П–≤–ї–µ–љ–Є–µ –∞–љ—В–Є-–У–Т–Ш IgG –≤ –Ї—А–Њ–≤–Є –Є/–Є–ї–Є –Ф–Э–Ъ –У–Т–Ш –≤ —А–Њ—В–Њ–≥–ї–Њ—В–Ї–µ.
–Ш–Ј–Љ–µ–љ–µ–љ–Є–µ —Б—В–∞–і–Є–Є –У–Т–Ш –і–Њ –Є –њ–Њ—Б–ї–µ —В–µ—А–∞–њ–Є–Є —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–Є –і–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –≤–Є–і–∞ –У–Т–Ш –Є —Б—Г–Љ–Љ–∞—А–љ–Њ: –Ї–∞–Ї ¬Ђ–ї—Г—З—И–µ¬ї (–њ–µ—А–µ—Е–Њ–і –≤ –љ–µ–∞–Ї—В–Є–≤–љ—Г—О —Б—В–∞–і–Є—О), ¬Ђ—Е—Г–ґ–µ¬ї (–њ–µ—А–µ—Е–Њ–і –≤ –∞–Ї—В–Є–≤–љ—Г—О —Б—В–∞–і–Є—О), ¬Ђ–±–µ–Ј –Є–Ј–Љ–µ–љ–µ–љ–Є—П¬ї (—Б–Њ—Е—А–∞–љ–µ–љ–Є–µ —В–Њ–є –ґ–µ —Б—В–∞–і–Є–Є).
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 2.

–Т–∞–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –±—Л–ї–Є –њ–∞—Ж–Є–µ–љ—В—Л, —Г –Ї–Њ—В–Њ—А—Л—Е –Њ—В–Љ–µ—З–µ–љ–∞ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є–љ—Д–µ–Ї—Ж–Є–Є, –≤—Л–Ј–≤–∞–љ–љ–Њ–є –Т–У–І-6–Р/–Т. –Т –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П —В–∞–Ї–Є–µ –љ–∞–±–ї—О–і–µ–љ–Є—П –њ—А–µ–Њ–±–ї–∞–і–∞–ї–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–Њ–є: 14 (28,5%) –њ—А–Њ—В–Є–≤ 5 (18,8%), —А>0,05.
–Ш—В–Њ–≥–Њ–≤–Њ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –У–Т–Ш –љ–∞ —Д–Њ–љ–µ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Г–Љ–µ–љ—М—И–µ–љ–Є—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є–љ—Д–µ–Ї—Ж–Є–Є –≤ —Б–ї—Г—З–∞–µ –Љ–Њ–љ–Њ-–У–Т–Ш –Є –њ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Е–Њ—В—П –±—Л –Њ–і–љ–Њ–є –Є–Ј –У–Т–Ш.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 3.

–Ю—В—А–Є—Ж–∞—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, –Њ—В—А–∞–ґ–∞—О—Й–Є—Е —Б—Г–Љ–Љ–∞—А–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –У–Т–Ш, –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –љ–µ –њ–Њ–ї—Г—З–∞–ї–Є –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В —Б–њ—А–µ–є, вАФ 37%, —З—В–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –і–µ—В–µ–є, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В —Б–њ—А–µ–є, вАФ 6,1% (—А<0,001).
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–У–µ—А–њ–µ—Б–≤–Є—А—Г—Б–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є —П–≤–ї—П—О—В—Б—П –њ–µ—А–≤–Є—З–љ–Њ-—Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ–ї–µ–є–Њ—В—А–Њ–њ–љ—Л–Љ–Є –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є, —Б–љ–Є–ґ–∞—О—Й–Є–Љ–Є –Є–Љ–Љ—Г–љ–љ—Г—О —А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Љ–∞–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –Ш–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ –і–µ—В—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ, –∞ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –Љ–∞—А–Ї–µ—А—Л –Є–љ—Д–µ–Ї—Ж–Є–Є —Б–Њ—Е—А–∞–љ—П—О—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–є –ґ–Є–Ј–љ–Є.
–†–µ–Ї—Г—А—А–µ–љ—В–љ—Л–µ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є —Б–Њ—Ж–Є–∞–ї—М–љ–Њ –Ј–љ–∞—З–Є–Љ—Л–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –≤ –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Є –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ —Б–≤—П–Ј–∞–љ—Л —Б —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–µ–є –У–Т–Ш [10, 11].
–Я—А–Њ–≤–µ–і–µ–љ–Є–µ –Ї—Г—А—Б–Њ–≤ –Я–Т–Ґ –њ–Њ–Ї–∞–Ј–∞–ї–Њ —Б–≤–Њ—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М [4], –Њ–і–љ–∞–Ї–Њ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї—Г—А—Б–Њ–≤ –Њ–≥—А–∞–љ–Є—З–µ–љ–∞ –≤ —Б–≤—П–Ј–Є —Б –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤. –° —Г—З–µ—В–Њ–Љ –≤—Л—Б–Њ–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ–љ—В–∞ —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –У–Т–Ш —З–µ—А–µ–Ј 3 –Є 6 –Љ–µ—Б. –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Я–Т–Ґ –≤—Б—В–∞–µ—В –≤–Њ–њ—А–Њ—Б –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –±–µ–Ј–Њ–њ–∞—Б–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –У–Т–Ш —Б –њ–Њ–Љ–Њ—Й—М—О, –љ–∞–њ—А–Є–Љ–µ—А, —Б–њ—А–µ—П –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В.
–Т—Л–і–µ–ї–µ–љ–Є–µ –Ф–Э–Ъ –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б–Њ–≤ –≤ –Љ–∞—В–µ—А–Є–∞–ї–µ –Љ–∞–Ј–Ї–Њ–≤ –Є–Ј —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є —П–≤–ї—П–µ—В—Б—П —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ –Љ–∞—А–Ї–µ—А–Њ–Љ –У–Т–Ш –Є –љ–µ –≤—Б–µ–≥–і–∞ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ [12]. –Ю–і–љ–∞–Ї–Њ –Є–Љ–µ–љ–љ–Њ —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Є –і–ї–Є—В–µ–ї—М–љ–Њ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –њ–Њ—Б–ї–µ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—П –Ф–Э–Ъ –Є/–Є–ї–Є –∞–љ—В–Є–≥–µ–љ–Њ–≤ –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б–Њ–≤ –Є–Ј –Ї—А–Њ–≤–Є.
–£—З–Є—В—Л–≤–∞—П –≤—Л—И–µ—Б–Ї–∞–Ј–∞–љ–љ–Њ–µ, –Љ—Л –њ—А–Є–Љ–µ–љ–Є–ї–Є —Б–њ—А–µ–є —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В, –Є–Љ–µ—О—Й–Є–є –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М (–≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б–Њ–≤), –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –¶–Ь–Т, –Т–≠–С, –Т–У–І-6–Р/–Т. –У—А—Г–њ–њ—Г —Б—А–∞–≤–љ–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–Є –њ–∞—Ж–Є–µ–љ—В—Л, —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–µ —Б –Њ–њ—Л—В–љ–Њ–є –≥—А—Г–њ–њ–Њ–є –њ–Њ –≤–Њ–Ј—А–∞—Б—В–љ—Л–Љ–Є –Є –≥–µ–љ–і–µ—А–љ—Л–Љ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ, –∞ —В–∞–Ї–ґ–µ –њ–Њ —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ –≤—Л—П–≤–ї–µ–љ–љ—Л—Е —Г –љ–Є—Е –У–Т–Ш, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є–µ –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В —Б–њ—А–µ–є –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ.
–Э–∞–Љ–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ –і–Є–љ–∞–Љ–Є–Ї–µ –ґ–∞–ї–Њ–±, –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –У–Т–Ш –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤–Ї–ї—О—З–∞–≤—И–µ–≥–Њ –њ—А—П–Љ—Л–µ –Є –љ–µ–њ—А—П–Љ—Л–µ –Љ–µ—В–Њ–і—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є. –Т–Є—А—Г—Б–љ–∞—П –љ–∞–≥—А—Г–Ј–Ї–∞ –Ф–Э–Ъ –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б–Њ–≤ –≤ –Љ–∞—В–µ—А–Є–∞–ї–µ –Љ–∞–Ј–Ї–Њ–≤ –Є–Ј —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є –і–Њ –Є –њ–Њ—Б–ї–µ —В–µ—А–∞–њ–Є–Є –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –Њ–њ—А–µ–і–µ–ї—П–ї–∞—Б—М –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є –Я–¶–†.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–њ—А–µ—П –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –У–Т–Ш —Г –і–µ—В–µ–є —Б —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ–Є –Ю–†–Ш –њ—А–Є–≤–Њ–і–Є—В –Ї –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ—Г —Г–ї—Г—З—И–µ–љ–Є—О —Б–Њ—Б—В–Њ—П–љ–Є—П –≤ 77,6% —Б–ї—Г—З–∞–µ–≤ –њ—А–Њ—В–Є–≤ 55,6% —Б–ї—Г—З–∞–µ–≤ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П. –Э–∞–Ј–љ–∞—З–µ–љ–Є–µ –і–∞–љ–љ–Њ–≥–Њ —Б–њ—А–µ—П –њ–∞—Ж–Є–µ–љ—В–∞–Љ, —Г –Ї–Њ—В–Њ—А—Л—Е –≤—Л–і–µ–ї—П–µ—В—Б—П –Ф–Э–Ъ –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б–Њ–≤ –≤ —А–Њ—В–Њ–≥–ї–Њ—В–Ї–µ, –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –≤–Є—А—Г—Б–љ–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Є –≤–і–≤–Њ–µ –≤ —Н—В–Њ–Љ –ї–Њ–Ї—Г—Б–µ. –Э–∞–Є–±–Њ–ї—М—И–Є–є —Н—Д—Д–µ–Ї—В –њ–Њ–ї—Г—З–µ–љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є, –≤—Л–Ј–≤–∞–љ–љ–Њ–є –Т–У–І-6–Р/–Т. –Я–Њ –і–∞–љ–љ—Л–Љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–њ—А–µ—П –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —З–∞—Й–µ –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї –њ–µ—А–µ—Е–Њ–і—Г –У–Т–Ш –≤ –ї–∞—В–µ–љ—В–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞–ї–Њ –У–Т–Ш –≤ –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –ї–∞—В–µ–љ—В–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є –њ–Њ—Б–ї–µ –Ї—Г—А—Б–∞ –Я–Т–Ґ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А—П–Љ–Њ–≥–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ —Е–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ј–≤–Њ–ї—П—О—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –Я–∞–љ–∞–≤–Є—А¬Ѓ –Ш–љ–ї–∞–є—В —Б–њ—А–µ–є –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –У–Т–Ш –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б—В–∞—А—И–µ 1 –≥–Њ–і–∞ —Б –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ –Ф–Э–Ъ –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б–Њ–≤ –≤ –Љ–∞—В–µ—А–Є–∞–ї–µ –Љ–∞–Ј–Ї–Њ–≤ –Є–Ј —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є.
–°–≤–µ–і–µ–љ–Є—П –Њ–± –∞–≤—В–Њ—А–∞—Е:
–Ь–µ–ї–µ—Е–Є–љ–∞ –Х–ї–µ–љ–∞ –Т–∞–ї–µ—А–Є–µ–≤–љ–∞ вАФ –і.–Љ.–љ., –і–Њ—Ж–µ–љ—В –њ–Њ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ—Б—В–Є ¬Ђ–њ–µ–і–Є–∞—В—А–Є—П¬ї, –≤.–љ.—Б. –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –§–С–£–Э –¶–Э–Ш–Ш –≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є–Є –†–Њ—Б–њ–Њ—В—А–µ–±–љ–∞–і–Ј–Њ—А–∞; 111123, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Э–Њ–≤–Њ–≥–Є—А–µ–µ–≤—Б–Ї–∞—П, –і. 3–Р; –≤—А–∞—З-–њ–µ–і–Є–∞—В—А –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Њ—В–і–µ–ї–µ–љ–Є—П –У–Р–£–Ч –Ь–Ю ¬Ђ–•–Є–Љ–Ї–Є–љ—Б–Ї–∞—П –Ю–С¬ї; 141407, –†–Њ—Б—Б–Є—П, –≥. –•–Є–Љ–Ї–Є, –Ъ—Г—А–Ї–Є–љ—Б–Ї–Њ–µ —И–Њ—Б—Б–µ, –і. 11; ORCID iD 0000-0002-9238-9302.
–Ь—Г–Ј—Л–Ї–∞ –Р–љ–љ–∞ –Ф—А–∞–≥–Є–µ–≤–љ–∞ вАФ –Ї.–Љ.–љ., —Б.–љ.—Б. –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –§–С–£–Э –¶–Э–Ш–Ш –≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є–Є –†–Њ—Б–њ–Њ—В—А–µ–±–љ–∞–і–Ј–Њ—А–∞; 111123, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Э–Њ–≤–Њ–≥–Є—А–µ–µ–≤—Б–Ї–∞—П, –і. 3–Р; OR–°ID iD 0000-0002-2269-2533.
–°–Њ–ї–і–∞—В–Њ–≤–∞ –Х–≤–≥–µ–љ–Є—П –Ѓ—А—М–µ–≤–љ–∞ вАФ –Љ.–љ.—Б. –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –§–С–£–Э –¶–Э–Ш–Ш –≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є–Є –†–Њ—Б–њ–Њ—В—А–µ–±–љ–∞–і–Ј–Њ—А–∞; 111123, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Э–Њ–≤–Њ–≥–Є—А–µ–µ–≤—Б–Ї–∞—П, –і. 3–Р; ORCID iD 0000-0002-0683-8010.
–®–∞–ї–±–∞—А–Њ–≤–∞ –Ґ–∞—В—М—П–љ–∞ –Т–∞—Б–Є–ї—М–µ–≤–љ–∞ вАФ –ї–∞–±–Њ—А–∞–љ—В-–Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –§–С–£–Э –¶–Э–Ш–Ш –≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є–Є –†–Њ—Б–њ–Њ—В—А–µ–±–љ–∞–і–Ј–Њ—А–∞; 111123, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Э–Њ–≤–Њ–≥–Є—А–µ–µ–≤—Б–Ї–∞—П, –і. 3–Р; ORCID iD 0000-0003-3659-3592.
–Ъ–Њ–љ—В–∞–Ї—В–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П: –Ь–µ–ї–µ—Е–Є–љ–∞ –Х–ї–µ–љ–∞ –Т–∞–ї–µ—А—М–µ–≤–љ–∞, e-mail: e.melekhina@mail.ru.
–Я—А–Њ–Ј—А–∞—З–љ–Њ—Б—В—М —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є: –љ–Є–Ї—В–Њ –Є–Ј –∞–≤—В–Њ—А–Њ–≤ –љ–µ –Є–Љ–µ–µ—В —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–∞—Е –Є–ї–Є –Љ–µ—В–Њ–і–∞—Е.
–Ъ–Њ–љ—Д–ї–Є–Ї—В –Є–љ—В–µ—А–µ—Б–Њ–≤ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В.
–°—В–∞—В—М—П –њ–Њ—Б—В—Г–њ–Є–ї–∞ 23.08.2022.
–Я–Њ—Б—В—Г–њ–Є–ї–∞ –њ–Њ—Б–ї–µ —А–µ—Ж–µ–љ–Ј–Є—А–Њ–≤–∞–љ–Є—П 15.09.2022.
–Я—А–Є–љ—П—В–∞ –≤ –њ–µ—З–∞—В—М 10.10.2022
About the authors:
Elena V. Melekhina вАФ Dr. Sc. (Med.), associate professor in pediatrics, leading researcher of the Clinical Department of Infectious Diseases, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; pediatrician of the Infectious Diseases Department, Khimki
Regional Hospital; 11, Kurkinskoe road, Khimki, 141407, Russian Federation; ORCID iD 0000-0002-9238-9302.
Anna D. Muzyka вАФ C. Sc. (Med.), senior researcher of the Clinical Department of Infectious Diseases, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; OR–°ID iD 0000-0002-2269-2533.
Evgeniya Yu. Soldatova вАФ junior researcher of the Clinical Department of Infectious Diseases, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0002-0683-8010.
Tatyana V. Shalbarova вАФ researcher technician of the Clinical Department of Infectious Diseases, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0003-3659-3592.
Contact information: Elena V. Melekhina, e-mail: e.melekhina@mail.ru.
Financial Disclosure: no authors have a financial or property
interest in any material or method mentioned.
There is no conflict of interests.
Received 23.08.2022.
Revised 15.09.2022.
Accepted 10.10.2022.











