Введение
Состояние микробиома кишечника может оказывать влияние на весь организм посредством системы передачи сигналов между кишечником и мозгом [1]. Нарушения со стороны микробиома связаны с различными заболеваниями [2–4]. Микробиом кишечника считается одной из наиболее важных микробиот, способных влиять на весь организм.
Ненадлежащее применение антибиотиков (например, при вирусной инфекции) может нанести вред пациенту, поскольку антибиотики влияют на микробиоту [5] и приводят к ее нарушениям, зачастую способным негативно влиять на здоровье пациента в течение продолжительного периода. Кроме того, ненадлежащее применение антибиотиков повышает риск развития устойчивости к противомикробным препаратам [6–8], что, по оценочным данным, привело к 1,27 млн смертей во всем мире в 2019 г. [9].
Все большую популярность приобретает стратегия рационального использования антибиотиков, т. е. ответственного и эффективного их применения [10–13]. Центры по контролю и профилактике заболеваний (CDC) устанавливают цель антибиотикотерапии — «совершенствование процедур назначения антибиотиков врачами и их применения пациентами, направленное на назначение и применение данных препаратов исключительно при необходимости ... чтобы гарантировать корректный выбор препарата, дозы и продолжительности лечения, если антибиотик необходим» [14].
Стратегия рационального использования антибиотиков особенно актуальна в лечении детей, поскольку воздействие на микробиоту у них может способствовать появлению заболеваний в более позднем возрасте [15, 16]. Настоящий обзор подготовлен, чтобы подчеркнуть роль лекарственных растительных препаратов в реализации стратегии рационального использования антибактериальных препаратов с низким риском неблагоприятного воздействия на микробиоту и самочувствие пациентов педиатрической популяции.
Вызванные антибиотиками нарушения микробиоты и их последствия у детей
Применение антибиотиков, особенно в раннем детстве, оказывает значительное влияние на состав микробиоты. Наиболее распространенные эффекты применения антибиотиков включают снижение разнообразия микробиоты кишечника, значительное увеличение численности Proteobacteria и увеличение отношения Firmicutes/Bacteroidetes. Последствия перинатального воздействия антибиотиков или воздействия антибиотиков в младенчестве могут сохраняться в течение многих лет [16, 17].
При анализе 436 диад «мать — ребенок», которых наблюдали до достижения детьми возраста 7 лет, N.T. Mueller et al. [18] установили, что у детей, которые подвергались воздействию антибиотиков в II–III триместрах беременности, риск развития ожирения был на 84% (33–154%) выше, чем у детей, которые не подвергались воздействию антибиотиков. В крупном датском популяционном исследовании была отмечена связь между антибактериальной терапией матери во время беременности и последующими госпитализациями родившихся детей в инфекционные отделения (отношение рисков (ОР) 1,18, 95% доверительный интервал от 1,17 до 1,19) [19]. Применение антибиотиков у младенцев ведет к изменениям микробиома, которые вызывают изменение иммунного ответа на патогены и вакцины, а также повышают восприимчивость к инфекциям в более позднем возрасте [15].
Проведение антибактериальной терапии детям первого года жизни имеет связь с последующим повышением индекса массы тела и ожирением, чего не наблюдается у детей, которым антибактериальную терапию не проводили [20].
Применение антибиотиков у детей связано с развитием таких заболеваний, как бронхиальная астма, ювенильный артрит, сахарный диабет 1 типа, болезнь Крона и психические заболевания [17].
Таким образом, в педиатрии особенно высока потребность в более безопасных терапевтических средствах по сравнению с антибиотиками.
Лекарственные препараты растительного происхождения как безопасная альтернатива для лечения неосложненных инфекций
Лекарственные средства на основе лекарственного растительного сырья или экстрактов растений, как правило, демонстрируют положительное соотношение пользы и риска и являются конкурентоспособной альтернативой для лечения неосложненных инфекций [21]. Их эффективность основана на многоцелевом подходе [22–24]. Для многих распространенных и рецидивирующих инфекций, таких как инфекции мочеполовой системы или инфекции верхних и нижних дыхательных путей, доступны эффективные и безопасные варианты лечения растительными препаратами [25–28]. Важно отметить, что исследования применения данных препаратов демонстрируют их эффективность — уменьшается выраженность симптомов и, соответственно, потребность в применении антибиотиков, — а также благоприятный профиль безопасности. Более того, по результатам данных исследований лекарственные препараты растительного происхождения были включены в рекомендации по лечению риносинусита, острого и хронического кашля [12, 29–31] и инфекций мочевыводящих путей в качестве целесообразной и адекватной терапевтической альтернативы [10].
Биологически активные вещества, содержащиеся в препаратах растительного происхождения
Лекарственные препараты растительного происхождения представляют собой многокомпонентные смеси, содержащие большое количество зачастую неидентифицированных действующих веществ. Однако удалось установить некоторые компоненты, обладающие соответствующей фармакологической активностью. Например, исследованиями in vitro была продемонстрирована противовирусная активность различных компонентов лекарственных растений, например кверцетина, карвакрола или теафлавинов, а также антибактериальная активность флавоноидов, изотиоцианидов, гидрохинона и умбеллиферона [32–34]. Противовоспалительная активность флавоноидов, таких как апигенин, кверцетин и кемпферол, а также ряда других растительных компонентов, например урсоловой кислоты, бетулиновой кислоты и ресвератрола, была подробно описана [35–37]. Применение лекарственных препаратов растительного происхождения, содержащих те или иные вещества, обладающие противовирусной, антибактериальной или противовоспалительной активностью, является перспективным и эффективным вариантом лечения распространенных и неосложненных инфекционных заболеваний.
Лечение респираторных инфекций лекарственными препаратами растительного происхождения: Бронхипрет® и Синупрет®
Респираторные инфекции особенно распространены у младенцев и детей младшего возраста, и болеть ими дети могут до нескольких раз в год [38]. Респираторные инфекции связаны с частым обращением к врачу и избыточным применением антибиотиков [39]. Более того, применение антибиотиков и частота обращений к врачу коррелируют [40]. Отказ от антибиотиков в целях сохранения микробиоты отвечает принципам стратегии рационального использования антибактериальных препаратов и несет пользу для пациента, поскольку микробиота играет важную роль в защите хозяина от респираторных инфекций [41].
Двумя примерами комбинаций лекарственных трав являются тимьян и плющ, или тимьян и примула (как в препарате Бронхипрет®, «Бионорика СЕ», Германия) для лечения острого бронхита [42, 43], или первоцвет, желтая горечавка, черная бузина, обыкновенный щавель и вербена (как в экстракте Синупрет®, «Бионорика СЕ», Германия) для лечения инфекций придаточных пазух носа / риносинусита [44, 45].
Эффективность препарата Бронхипрет® на основе тимьяна была продемонстрирована в двух перспективных двойных слепых плацебо-контролируемых клинических исследованиях с участием взрослых пациентов [42, 43]. В дополнение к противовоспалительному и противовирусному эффекту [46] комбинации тимьяна и плюща или тимьяна и примулы также продемонстрировали способность регулировать секрецию слизи при остром и хроническом бронхите и бронхиолите [47–49].
Эффективность и безопасность препаратов Бронхипрет® и Бронхипрет® ТП в педиатрической популяции изучены в ряде зарубежных и российских исследований, результаты которых приведены в обзоре А.В. Щулькина [50]. Показано, что лекарственные растительные препараты Бронхипрет® и Бронхипрет® ТП являются эффективными и безопасными средствами для лечения острых и хронических воспалительных заболеваний дыхательных путей, сопровождающихся кашлем и образованием мокроты (трахеит, трахеобронхит и бронхит) у детей старше 3 мес. Автор отмечает, что препараты эффективны в монотерапии простудного кашля и вирусного бронхита в качестве альтернативы синтетическим муколитикам, могут эффективно дополнять обоснованную антибактериальную терапию бронхита и повышать ее клиническую пользу, ускорять и облегчать процесс выздоровления пациентов различного возраста, обладая при этом очень хорошим профилем безопасности.
Эффективность и безопасность лекарственного растительного препарата Синупрет® экстракт были продемонстрированы в двойном слепом рандомизированном плацебо-контролируемом исследовании с участием взрослых пациентов [44]. У детей, страдавших острыми синуситами, применение препарата Синупрет® сироп эффективно облегчало симптомы заболевания. Кроме того, наблюдалось уменьшение частоты назначения антибиотиков у детей, получавших Синупрет® сироп, по сравнению с детьми, не получавшими данный препарат [51]. При использовании Синупрета для лечения острого синусита у детей отмечались уменьшение числа койко-дней, более быстрая нормализация температуры (по сравнению с группами, получавшими стандартную терапию), сокращалось число пункций [52].
В доклиническом исследовании, результаты которого ранее не были опубликованы, изучали влияние на микробиом кишечника мышей комбинаций растительных экстрактов и антибиотиков, используемых для лечения респираторных инфекций. Были использованы серии препарата № 2811 (смесь спиртового сухого экстракта Thymi herba и сухого экстракта Primulae radix) и № 1011 (спиртовой сухой экстракт смеси Gentianae radix, Primulae flos, Rumicis herba, Sambuci flos и Verbenae herba), которые являются основой для препарата Бронхипрет® таблетки, покрытые пленочной оболочкой, и препарата Синупрет® экстракт. Чтобы проанализировать влияние данных комбинаций растительных трав и антибиотиков первой линии на микробиом кишечника при лечении респираторных инфекций, исследовали состав фекального микробиома мышей методом секвенирования следующего поколения (NGS) бактериальных генов 16S рРНК в соответствии с операционной процедурой с контролем качества [53]. Ежедневно мышам перорально вводили антибиотик амоксициллин / клавулановая кислота, или моксифлоксацин, или растительные экстракты № 2811 (однократный эквивалент рекомендуемой суточной дозы для человека препарата Бронхипрет® таблетки, покрытые пленочной оболочкой, «Бионорика СЕ», Германия) или № 1011 (однократный эквивалент рекомендуемой суточной дозы для человека препарата Синупрет® экстракт, «Бионорика СЕ», Германия). В контрольной группе давали воду без добавления каких-либо субстанций, которую использовали в качестве плацебо. Через 7 дней лечения взяли образцы кала четырех животных в каждой группе (рис. 1).
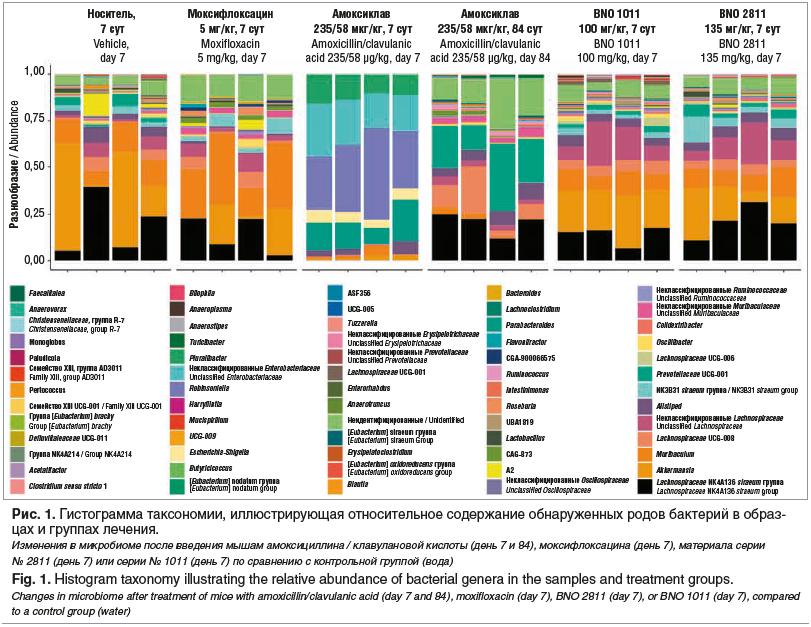
Анализ микробиома методом NGS выявил значительное изменение бактериального состава на фоне лечения антибиотиками, тогда как микробиом мышей, которым давали растительные экстракты, был аналогичен таковому у животных в контрольной группе, не получавших активных субстанций (см. рис. 1). Наиболее значительное воздействие отмечено после введения амоксициллина / клавулановой кислоты, которое привело к заметному снижению бактериального разнообразия, сопровождавшемуся доминированием лишь нескольких видов микроорганизмов (Enterobacteriaceae, Escherichia, Shigella, Parabacteroides, Robinsoniella). Для дальнейшей оценки долгосрочного воздействия на кишечный микробиом применение у мышей амоксициллина / клавулановой кислоты было прекращено и образцы фекалий повторно анализировали еще через 11 нед. После такого длительного периода микробный состав снова изменился, но не вернулся к исходному состоянию. Кроме того, после прекращения лечения такие потенциально полезные виды, как Akkermansia muciniphila, не появлялись вновь. Таким образом, лечение антибиотиками привело к длительным изменениям бактериального микробиома.
Лечение инфекций мочевыводящих путей лекарственными препаратами растительного происхождения: Канефрон® Н
Для лечения неосложненных инфекций мочевыводящих путей (ИМП) лекарственным растительным препаратом применяется препарат Канефрон® Н («Бионорика СЕ», Германия), в состав которого в качестве активной фармацевтической субстанции входит фитокомбинация серии № 2103 Rosmarini folium, Centaurii herba и Levistici radix.
Эффективность препарата была продемонстрирована в двойном слепом плацебо-контролируемом рандомизированном клиническом исследовании [54]. В дополнение к этому эффективность препарата в условиях реальной клинической практики была показана в недавно опубликованном исследовании, проведенном на основе анализа более 160 000 случаев лечения ИМП антибиотиками или препаратом Канефрон® Н из базы данных клинических случаев [55]. Результаты этого исследования согласуются с результатами указанного выше клинического исследования [54]. Доля пациентов, которым потребовалось назначение дополнительных антибиотиков в период с 1-го по 30-й день лечения, была почти идентичной в обеих группах. Кроме того, после лечения лекарственным растительным препаратом частота спорадических или частых рецидивирующих эпизодов ИМП снизилась. Потребность в дополнительном лечении антибиотиками с 31-го по 356-й день была выше в группе пациентов, получавших антибиотики на начальном этапе лечения неосложненной ИМП [55]. Это может быть обусловлено способностью антибиотиков изменять специфическую микробиоту. Считается, что здоровая микробиота кишечника, влагалища и мочевыводящих путей защищает от ИМП; соответственно, дисбактериоз мог быть связан с развитием ИМП [56].
В ряде исследований изучено применение препарат Канефрон® Н у детей. Н.И. Аверьянова и соавт. [57] in vitro показали, что растительный лекарственный препарат, в состав которого входят экстракты травы золототысячника, корней любистока и листьев розмарина, продемонстрировал антимикробную активность в отношении основного возбудителя ИМП — Escherichia coli, а также в отношении ряда других микроорганизмов, высеянных из мочи детей в острой фазе пиелонефрита в диагностически значимой концентрации. В исследовании Т.С. Вознесенской и соавт. [58] у детей с острым пиелонефритом применение препарата Канефрон® Н в первые 3 мес. после окончания терапии антибиотиками способствовало снижению риска рецидивов заболевания по сравнению с показателем у детей, которым после окончания курса антибиотикотерапии не проводили профилактику рецидива. Применение препарата Канефрон® Н в комплексе с антибактериальными препаратами способствовало исчезновению симптомов острого цистита у детей. Использование препарата Канефрон® Н у детей с острым циститом на протяжении 3 мес. существенно снижало частоту рецидивов заболевания и увеличивало долю пациентов, находившихся в состоянии ремиссии [59]. Пролонгированное применение препарата Канефрон® Н на фоне санаторно-курортного лечения позволило повысить эффективность лечения хронического пиелонефрита за счет ренопротективного эффекта, связанного с его способностью подавлять образование провоспалительных и проапоптоидных цитокинов, ликвидировать дисбаланс между про- и противовоспалительными, про- и противоапоптоидными факторами, а также сочетанного противовоспалительного, диуретического, спазмолитического, вазодилатирующего и антибактериального действия. На основании результатов исследований можно сделать вывод о благоприятном профиле безопасности препарата [60].
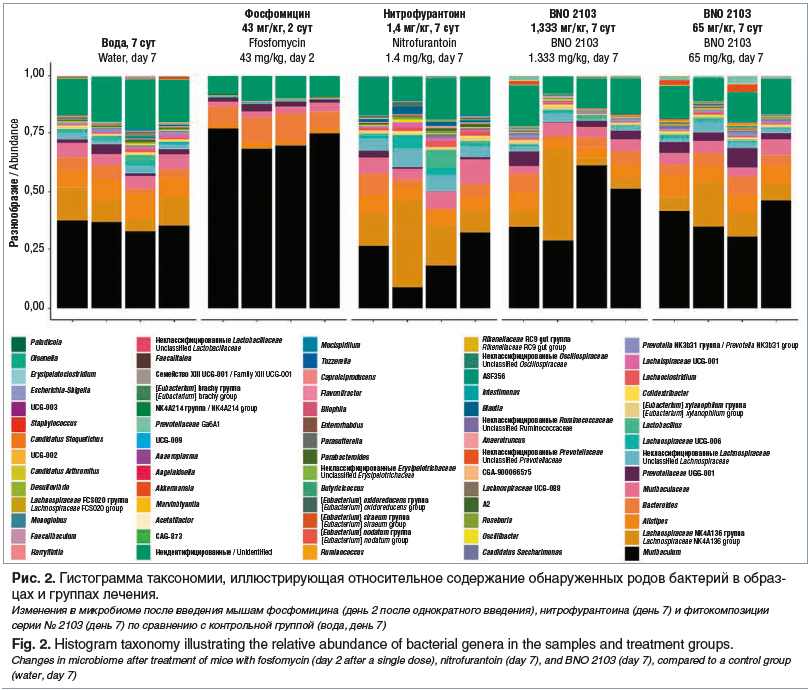
Влияние фитопрепарата Канефрон® Н на кишечную микробиоту было изучено в доклиническом исследовании K.G. Naber et al. [61]. Образцы фекалий мышей исследовали методом секвенирования следующего поколения бактериальных генов 16S рРНК в соответствии с операционной процедурой с контролем качества [53]. В течение 7 дней мышам ежедневно перорально вводили антибиотик нитрофурантоин, воду (в качестве препарата плацебо без добавления каких-либо субстанций — контрольная группа), фитокомбинацию серии № 2103 или однократную дозу антибиотика фосфомицин в день 1. Доза фитокомбинации серии № 2103 составляла 65 и 1333 мг/кг, что эквивалентно однократной и двадцатикратной рекомендуемой дозе препарата Канефрон® для человека. Каждая группа исследования включала по четыре животных; исследовали образцы кала, собранные до начала лечения, на 2-й день (у мышей, получавших фосфомицин) или на 7-й день лечения (остальные группы). Результаты секвенирования выявили значительные изменения в составе микробиома кишечника на фоне лечения нитрофурантоином. В экспериментальной группе фосфомицина изменения были более выраженными: при однократном приеме некоторые бактериальные семейства полностью исчезли из микробиома кишечника и не восстановились в течение последующих дней без лечения. У мышей, получавших фитотерапевтическую композицию, разнообразие кишечных бактерий в основном сохранилось и было аналогично таковому у животных контрольной группы, получавших воду (без добавления каких-либо субстанций). Даже при введении 20-кратной рекомендуемой дозы для человека микробиом кишечника мышей практически не изменялся (рис. 2). Эти результаты подтверждают щадящее воздействие композиции серии № 2103 на микробиоту и дополняют существующую совокупность свидетельств благоприятного профиля безопасности фитокомбинации.
Заключение
По мере расширения нашего понимания роли микробиоты и ее взаимосвязи с общим состоянием здоровья и устойчивостью организма к заболеваниям стало очевидно, что при выборе подходящей терапии инфекций необходимо способствовать сохранению микробиоты. С целью предотвращения ненадлежащего использования антибиотиков необходимо большее внимание уделять вопросам профилактики заболеваний (соблюдение гигиены, вакцинация), дифференциальной диагностики заболеваний (вирусная или бактериальная этиология заболевания), коммуникативным стратегиям «врач — пациент». Растительные препараты могут быть альтернативой антибиотикам и нестероидным противовоспалительным препаратам (НПВП) для лечения неосложненных инфекций мочевыводящих и дыхательных путей. Важно отметить, что данные о лечении ИМП указывают на то, что лекарственные препараты растительного происхождения могут обеспечить сопоставимую с антибиотиками и НПВП эффективность и имеют в целом благоприятный профиль безопасности. Это может быть обусловлено тем, что лечение препаратами растительного происхождения не оказывает влияния на микробиом кишечника, как было показано в доклинических исследованиях. Однако лекарственные препараты растительного происхождения не всегда могут заменить антибиотики. При неосложненных инфекциях отсроченное назначение антибиотиков с началом терапии лекарственными растительными препаратами целесообразно для снижения частоты применения антибиотиков. Крайне важным представляется прекращение ненадлежащего применения антибиотиков, особенно при наличии терапевтических альтернатив.











