–І–∞—Б—В–Њ—В–∞ –С–Р –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞ —Г –і–µ—В–µ–є —Б —Б–µ–Љ–µ–є–љ–Њ–є –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М—О –Ї –∞—В–Њ–њ–Є–Є. –Ю–±–Њ—Б—В—А–µ–љ–Є—П –С–Р –њ—А–Њ–≤–Њ—Ж–Є—А—Г—О—В—Б—П –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–Љ–Є —В—А–Є–≥–≥–µ—А–∞–Љ–Є, –≤–Ї–ї—О—З–∞—П –≤–Є—А—Г—Б–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є, –∞–ї–ї–µ—А–≥–µ–љ—Л, —Д–Є–Ј–Є—З–µ—Б–Ї—Г—О –љ–∞–≥—А—Г–Ј–Ї—Г, —В–∞–±–∞—З–љ—Л–є –і—Л–Љ –Є –і—А—Г–≥–Є–µ –њ–Њ–ї–ї—О—В–∞–љ—В—Л. –£ –і–µ—В–µ–є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є –Њ–±—Б—В—А—Г–Ї—Ж–Є–Є (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ —Б–≤–Є—Б—В—П—Й–µ–µ –і—Л—Е–∞–љ–Є–µ –Є –Ї–∞—И–µ–ї—М) –љ–µ—А–µ–і–Ї–Њ –≤–Њ–Ј–љ–Є–Ї–∞—О—В —Г–ґ–µ –≤ –њ–µ—А–≤—Л–µ –Љ–µ—Б—П—Ж—Л –ґ–Є–Ј–љ–Є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–∞ —Д–Њ–љ–µ –Є–љ—Д–µ–Ї—Ж–Є–є –љ–Є–ґ–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є, –љ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –і–Є–∞–≥–љ–Њ–Ј –С–Р –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –Њ–±—Л—З–љ–Њ –ї–Є—И—М –њ–Њ—Б–ї–µ 5 –ї–µ—В, –њ–Њ—Н—В–Њ–Љ—Г —А–∞–љ–љ—П—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞, –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ –Є –ї–µ—З–µ–љ–Є–µ –С–Р –њ—А–Є–Њ–±—А–µ—В–∞—О—В –Њ—Б–Њ–±–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ [10].
–С–Р —Г –і–µ—В–µ–є –Љ–Њ–ґ–љ–Њ –Њ–њ–Є—Б–∞—В—М –Ї–∞–Ї –њ–Њ–≤—В–Њ—А—П—О—Й–Є–µ—Б—П —Н–њ–Є–Ј–Њ–і—Л –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є –Њ–±—Б—В—А—Г–Ї—Ж–Є–Є –Є –≥–Є–њ–µ—А—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є –њ—А–Є –љ–∞–ї–Є—З–Є–Є —В–∞–Ї–Є—Е –њ—А–Њ–≤–Њ—Ж–Є—А—Г—О—Й–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –Ї–∞–Ї —Д–Є–Ј–Є—З–µ—Б–Ї–∞—П –љ–∞–≥—А—Г–Ј–Ї–∞, –Ї–Њ–љ—В–∞–Ї—В —Б –∞–ї–ї–µ—А–≥–µ–љ–Њ–Љ –Є –≤–Є—А—Г—Б–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є. –Я—А–Є —Н—В–Њ–Љ —Б–ї–µ–і—Г–µ—В –Є–Љ–µ—В—М –≤ –≤–Є–і—Г, —З—В–Њ —Г –і–µ—В–µ–є —А–∞–љ–љ–µ–≥–Њ –Є –і–Њ—И–Ї–Њ–ї—М–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Б —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ–Є –њ—А–Є—Б—В—Г–њ–∞–Љ–Є –Ї–∞—И–ї—П –Є–ї–Є —Б–≤–Є—Б—В—П—Й–µ–≥–Њ –і—Л—Е–∞–љ–Є—П —Н—В–Є —Б–Є–Љ–њ—В–Њ–Љ—Л —З–∞—Б—В–Њ –љ–Њ—Б—П—В —В—А–∞–љ–Ј–Є—В–Њ—А–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А –Є –≤ 60% —Б–ї—Г—З–∞–µ–≤ –Є—Б—З–µ–Ј–∞—О—В –Ї —И–Ї–Њ–ї—М–љ–Њ–Љ—Г –≤–Њ–Ј—А–∞—Б—В—Г. –Т—А–∞—З–Є –і–Њ–ї–ґ–љ—Л –њ—А–Њ–≤–Њ–і–Є—В—М –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Г—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г –С–Р —Б –і—А—Г–≥–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є —Б–Њ —Б—Е–Њ–і–љ–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Њ–є, —Г—З–Є—В—Л–≤–∞—П –≤–∞—А–Є–∞–±–µ–ї—М–љ–Њ—Б—В—М –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –њ–Њ–≤—В–Њ—А—П—О—Й–Є—Е—Б—П –њ—А–Є—Б—В—Г–њ–Њ–≤ —Б–≤–Є—Б—В—П—Й–µ–≥–Њ –і—Л—Е–∞–љ–Є—П —Г –і–µ—В–µ–є —А–∞–љ–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ [2, 10].
–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –њ—А–µ–і–ї–∞–≥–∞–µ—В—Б—П –≤—Л–і–µ–ї–µ–љ–Є–µ –Њ—В–і–µ–ї—М–љ—Л—Е —Д–µ–љ–Њ—В–Є–њ–Њ–≤ –С–Р, —З—В–Њ –Є–љ–Њ–≥–і–∞ –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј–∞—В—М—Б—П —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ—Л–Љ. –≠—В–Њ –љ–µ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є—В –њ–Њ–љ–Є–Љ–∞–љ–Є—О –С–Р –Ї–∞–Ї –µ–і–Є–љ–Њ–є –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ—Л, –љ–Њ —Г—В–Њ—З–љ—П–µ—В –љ–µ–Ї–Њ—В–Њ—А—Л–µ –µ–µ —В–Є–њ–Њ–≤—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –≥—А—Г–њ–њ–∞—Е –і–µ—В–µ–є, –њ–Њ–Љ–Њ–≥–∞—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –≤—Л–±–Њ—А—Г –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Я–Њ–і —Д–µ–љ–Њ—В–Є–њ–∞–Љ–Є –С–Р —Б–ї–µ–і—Г–µ—В –њ–Њ–љ–Є–Љ–∞—В—М –≤—Л–і–µ–ї–µ–љ–Є–µ –Њ—В–і–µ–ї—М–љ—Л—Е –Ї–Њ–≥–Њ—А—В –і–µ—В–µ–є —Б –≤–Њ–Ј—А–∞—Б—В–љ—Л–Љ–Є, –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –њ—А–Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ, –њ–Њ–і–±–Њ—А–µ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є –љ–∞–±–ї—О–і–µ–љ–Є—П —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е. –Ґ–∞–Ї, –С–Р –Є–Љ–µ–µ—В –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Г –і–µ—В–µ–є —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, –≥–∞—Б—В—А–Њ—Н–Ј–Њ—Д–∞–≥–µ–∞–ї—М–љ–Њ–є —А–µ—Д–ї—О–Ї—Б–љ–Њ–є –±–Њ–ї–µ–Ј–љ—М—О, –±—А–Њ–љ—Е–Њ—Б–њ–∞–Ј–Љ–Њ–Љ –њ—А–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –љ–∞–≥—А—Г–Ј–Ї–µ, –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є –і—А—Г–≥–Є—Е –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є. –§–µ–љ–Њ—В–Є–њ –∞—Б—В–Љ—Л –Ј–∞–≤–Є—Б–Є—В —В–∞–Ї–ґ–µ –Њ—В —Е–∞—А–∞–Ї—В–µ—А–∞ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П (—Н–Њ–Ј–Є–љ–Њ—Д–Є–ї—М–љ–Њ–µ, –љ–µ—Н–Њ–Ј–Є–љ–Њ—Д–Є–ї—М–љ–Њ–µ).
–Т–Њ–Ј—А–∞—Б—В – –Њ–і–Є–љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤, –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є—Е —Д–µ–љ–Њ—В–Є–њ –С–Р —Г –і–µ—В–µ–є. –Ф–µ–±—О—В –С–Р —Г 70–80% –±–Њ–ї—М–љ—Л—Е –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї —А–∞–љ–љ–µ–Љ—Г –і–µ—В—Б–Ї–Њ–Љ—Г –≤–Њ–Ј—А–∞—Б—В—Г. –С–Р —Г –і–µ—В–µ–є —А–∞–љ–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (0–2 –≥–Њ–і–∞) –Њ—В–ї–Є—З–∞–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –≤–∞—А–Є–∞–±–µ–ї—М–љ–Њ—Б—В—М—О, –њ—А–Є —Н—В–Њ–Љ –Њ–љ–∞ —Б–Њ—Е—А–∞–љ—П–µ—В —З–µ—А—В—Л –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –†–∞–љ–љ–µ–Љ—Г —А–∞–Ј–≤–Є—В–Є—О –С–Р —Г –і–µ—В–µ–є –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–∞—П —Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–∞—Ж–Є—П –њ–ї–Њ–і–∞ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є —Д–µ—В–Њ–њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–≥–Њ –±–∞—А—М–µ—А–∞, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–є —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П–Љ–Є. –Э–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—В –њ—А–Њ—Д–µ—Б—Б–Є–Њ–љ–∞–ї—М–љ—Л–µ –≤—А–µ–і–љ–Њ—Б—В–Є, –∞–Ї—В–Є–≤–љ–Њ–µ –Є –њ–∞—Б—Б–Є–≤–љ–Њ–µ —В–∞–±–∞–Ї–Њ–Ї—Г—А–µ–љ–Є–µ –Љ–∞—В–µ—А–Є. –°—А–µ–і–Є —Д–∞–Ї—В–Њ—А–Њ–≤ –њ–Њ—Б—В–љ–∞—В–∞–ї—М–љ–Њ–є —Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–∞—Ж–Є–Є –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–µ—В –Є–Ј–±—Л—В–Њ—З–љ–∞—П –∞–љ—В–Є–≥–µ–љ–љ–∞—П —Н–Ї—Б–њ–Њ–Ј–Є—Ж–Є—П –≤ –њ–µ—А–≤—Л–µ –≥–Њ–і—Л –ґ–Є–Ј–љ–Є —А–µ–±–µ–љ–Ї–∞ [2].
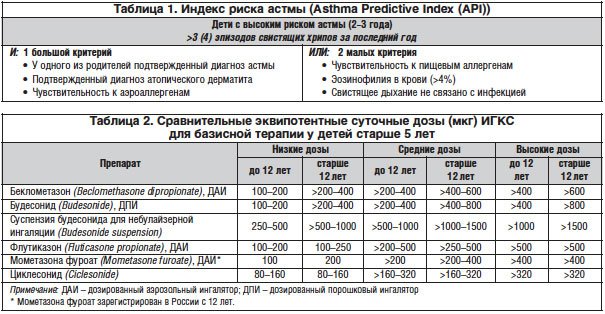
–£ –і–µ—В–µ–є –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞ –ґ–Є–Ј–љ–Є –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є —Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–Є—А—Г—О—Й–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —П–≤–ї—П—О—В—Б—П –њ–Є—Й–µ–≤—Л–µ –∞–ї–ї–µ—А–≥–µ–љ—Л (–Ї—Г—А–Є–љ—Л–є –±–µ–ї–Њ–Ї, –±–µ–ї–Њ–Ї –Ї–Њ—А–Њ–≤—М–µ–≥–Њ –Љ–Њ–ї–Њ–Ї–∞, –њ—И–µ–љ–Є—Ж–∞ –Є –і—А—Г–≥–Є–µ –Ј–ї–∞–Ї–Є, —А—Л–±–∞, –Њ—А–µ—Е–Є, –Ї–∞–Ї–∞–Њ, —Ж–Є—В—А—Г—Б–Њ–≤—Л–µ), –±—Л—В–Њ–≤—Л–µ –∞–ї–ї–µ—А–≥–µ–љ—Л. –°–µ–љ—Б–Є–±–Є–ї–Є–Ј–∞—Ж–Є—П –Ї –∞–ї–ї–µ—А–≥–µ–љ–∞–Љ –і–Њ–Љ–∞—И–љ–µ–є –њ—Л–ї–Є –Є –Ї–ї–µ—Й–∞–Љ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤ —Н—В–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –±–Њ–ї—М–љ—Л—Е. –£ 3–4-–ї–µ—В–љ–Є—Е –і–µ—В–µ–є –≤–Њ–Ј—А–∞—Б—В–∞–µ—В —А–Њ–ї—М –њ—Л–ї—М—Ж–µ–≤—Л—Е –∞–ї–ї–µ—А–≥–µ–љ–Њ–≤, —Б–њ–µ–Ї—В—А –Ї–Њ—В–Њ—А—Л—Е —А–∞–Ј–ї–Є—З–µ–љ –≤ —А–∞–Ј–љ—Л—Е –Ї–ї–Є–Љ–∞—В–Њ-–≥–µ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е –Ј–Њ–љ–∞—Е. –£ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –і–µ—В–µ–є –њ–Њ—П–≤–ї–µ–љ–Є—О –њ–µ—А–≤—Л—Е —В–Є–њ–Є—З–љ—Л—Е –њ—А–Є—Б—В—Г–њ–Њ–≤ —Н–Ї—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–є –Њ–і—Л—И–Ї–Є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ—А–µ–і—И–µ—Б—В–≤—Г—О—В –њ—А–Њ—П–≤–ї–µ–љ–Є—П –∞—В–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ—А–Љ–∞—В–Є—В–∞, –Њ—Б—В—А—Л–µ –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л–µ –њ–Є—Й–µ–≤—Л–µ –њ—А–Њ–і—Г–Ї—В—Л, –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В—Л (–≤ –≤–Є–і–µ —Н–Ї–Ј–∞–љ—В–µ–Љ, –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л, –Њ—В–µ–Ї–∞ –Ъ–≤–Є–љ–Ї–µ), –њ–Њ–≤—В–Њ—А–љ—Л–µ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Я–Њ–і–Њ–±–љ—Л–µ –љ–∞—З–∞–ї—М–љ—Л–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–є –∞–ї–ї–µ—А–≥–Є–Є –љ–µ—А–µ–і–Ї–Њ —А–∞—Б—Ж–µ–љ–Є–≤–∞—О—В—Б—П –≤—А–∞—З–∞–Љ–Є –Ї–∞–Ї –Њ—Б—В—А—Л–µ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–µ –≤–Є—А—Г—Б–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є, –±—А–Њ–љ—Е–Є—В—Л, –њ–љ–µ–≤–Љ–Њ–љ–Є–Є. –С–Њ–ї—М–љ—Л—Е –њ—А–Є —Н—В–Њ–Љ –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ –ї–µ—З–∞—В –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є, —З—В–Њ –ї–Є—И—М —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–∞—Ж–Є–Є, –њ—А–Њ—П–≤–ї—П—О—Й–µ–є—Б—П —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –≤–∞—А–Є–∞–љ—В–∞–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є –∞–ї–ї–µ—А–≥–Є–Є. –Я–Њ–і–Њ–±–љ–∞—П —Н—В–∞–њ–љ–Њ—Б—В—М –≤ —Б–Љ–µ–љ–µ —Б–њ–µ–Ї—В—А–∞ —Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–∞—Ж–Є–Є —Г –і–µ—В–µ–є —А–∞–љ–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Е–Њ—В—П –Є —Е–∞—А–∞–Ї—В–µ—А–љ–∞ (—В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–є «–∞—В–Њ–њ–Є—З–µ—Б–Ї–Є–є –Љ–∞—А—И»), –Њ–і–љ–∞–Ї–Њ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –і–∞–ї–µ–Ї–Њ –љ–µ –≤—Б–µ–≥–і–∞. –Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П —Г –і–µ—В–µ–є, –±–Њ–ї—М–љ—Л—Е –С–Р, –≤—Б–µ —З–∞—Й–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П —А–∞–љ–љ—П—П —Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–∞—Ж–Є—П –Ї —И–Є—А–Њ–Ї–Њ–Љ—Г —Б–њ–µ–Ї—В—А—Г –∞–ї–ї–µ—А–≥–µ–љ–Њ–≤ (–њ–Њ–ї–Є—Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–∞—Ж–Є—П). –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–µ –і–Њ–Ї—Г–Љ–µ–љ—В—Л –њ—А–µ–і–ї–∞–≥–∞—О—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Є–љ–і–µ–Ї—Б —А–Є—Б–Ї–∞ –∞—Б—В–Љ—Л –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П —Д–∞–Ї—В–Њ—А–Њ–≤, –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–Є—Е –Ї –С–Р –≤ —А–∞–љ–љ–µ–Љ –і–µ—В—Б—В–≤–µ (—В–∞–±–ї. 1) [1, 2, 10].
–Т —Б–≤—П–Ј–Є —Б –∞–љ–∞—В–Њ–Љ–Њ-—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –і–µ—В–µ–є —А–∞–љ–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (—Г–Ј–Ї–Є–є –њ—А–Њ—Б–≤–µ—В –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ –і–µ—А–µ–≤–∞, —Б–ї–∞–±–Њ—А–∞–Ј–≤–Є—В—Л–є –Љ—Л—И–µ—З–љ—Л–є —Б–ї–Њ–є, –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —А–∞–Ј–≤–Є—В–Є–µ –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л—Е –Є –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—Г–і–Њ–≤) –±—А–Њ–љ—Е–Њ—Б–њ–∞–Ј–Љ –Њ–±—Л—З–љ–Њ –љ–µ —П–≤–ї—П–µ—В—Б—П —Г –љ–Є—Е –≤–µ–і—Г—Й–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Њ–±–Њ—Б—В—А–µ–љ–Є–є –С–Р. –Э–∞ –њ–µ—А–≤–Њ–µ –Љ–µ—Б—В–Њ –≤—Л—Б—В—Г–њ–∞—О—В –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –±—А–Њ–љ—Е–Њ–≤, –µ–µ –Њ—В–µ–Ї –Є –≥–Є–њ–µ—А—Б–µ–Ї—А–µ—Ж–Є—П —Б–ї–Є–Ј–Є. –Я—А–Њ–≤–Њ–Ї–∞—Ж–Є—П –Њ–±—Б—В—А—Г–Ї—Ж–Є–Є –±—А–Њ–љ—Е–Њ–≤ –Њ—Б—В—А–Њ–є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–µ–є, –Њ–і–љ–Њ—В–Є–њ–љ–∞—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞, —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ–±—К–µ–і–Є–љ—П—О—В—Б—П –≤ —Д–µ–љ–Њ—В–Є–њ – –≤–Є—А—Г—Б-–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Г—О –С–Р. –°—Е–Њ–і—Б—В–≤–Њ —Б –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ—Л–Љ –±—А–Њ–љ—Е–Є—В–Њ–Љ (–±—А–Њ–љ—Е–Є–∞–ї—М–љ–∞—П –Њ–±—Б—В—А—Г–Ї—Ж–Є—П –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ —Б–≤—П–Ј–∞–љ–∞ —Б –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є) –≤–µ—Б—М–Љ–∞ –Ј–∞—В—А—Г–і–љ—П–µ—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј. –С–Р –≤ —А–∞–љ–љ–µ–Љ –≤–Њ–Ј—А–∞—Б—В–µ —З–∞—Б—В–Њ –љ–µ —А–∞—Б–њ–Њ–Ј–љ–∞–µ—В—Б—П, –Є –±–Њ–ї—М–љ—Л–µ –ї–µ—З–∞—В—Б—П –љ–µ—А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ [3].
–£ –і–µ—В–µ–є –і–Њ—И–Ї–Њ–ї—М–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –≥–ї–∞–≤–љ—Л–Љ –Ї—А–Є—В–µ—А–Є–µ–Љ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Д–µ–љ–Њ—В–Є–њ–∞ –∞—Б—В–Љ—Л —П–≤–ї—П–µ—В—Б—П –њ–µ—А—Б–Є—Б—В–Є—А–Њ–≤–∞–љ–Є–µ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –≥–Њ–і–∞. –Т —Н—В–Њ–є –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –≥—А—Г–њ–њ–µ –≤–Є—А—Г—Б—Л —П–≤–ї—П—О—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ–Є —В—А–Є–≥–≥–µ—А–∞–Љ–Є. –Т–Њ–Ј–Љ–Њ–ґ–љ–∞ –њ—А–Њ–≤–Њ–Ї–∞—Ж–Є—П –њ—А–Є—Б—В—Г–њ–Њ–≤ –С–Р —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Њ–є. –Э–µ—А–µ–і–Ї–Њ –Ї–Њ–ґ–љ—Л–µ –њ—А–Њ–±—Л —Б –∞–ї–ї–µ—А–≥–µ–љ–∞–Љ–Є –Є–ї–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е IgE-–∞–љ—В–Є—В–µ–ї –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ–Њ–і—В–≤–µ—А–і–Є—В—М –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї—Г—О –њ—А–Є—А–Њ–і—Г –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Я—А–Є –і–µ—В–∞–ї—М–љ–Њ–Љ –Њ–њ—А–Њ—Б–µ –≤—Л—П–≤–ї—П–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–∞—П –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—П –Љ–µ–ґ–і—Г –Ї–Њ–љ—В–∞–Ї—В–Њ–Љ —Б –∞–ї–ї–µ—А–≥–µ–љ–Њ–Љ –Є –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤. –Э–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —В–Њ–≥–Њ, —Г–і–∞–ї–Њ—Б—М –≤—Л—П–≤–Є—В—М –њ—А–Є—З–Є–љ–љ–Њ-–Ј–љ–∞—З–Є–Љ—Л–є –∞–ї–ї–µ—А–≥–µ–љ –Є–ї–Є –љ–µ—В, –≤–∞–ґ–љ—Л–Љ –і–ї—П –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –і–Є–∞–≥–љ–Њ–Ј–∞ –≤ —Н—В–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ —П–≤–ї—П–µ—В—Б—П –Њ—В—З–µ—В–ї–Є–≤—Л–є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А–Њ–≤ –Є –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ—Л—Е –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤ (–Ш–У–Ъ–°), –∞ —В–∞–Ї–ґ–µ –≤–Њ–Ј–≤—А–∞—В —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –њ–Њ—Б–ї–µ –Њ—В–Љ–µ–љ—Л —Н—В–Њ–є —В–µ—А–∞–њ–Є–Є [7, 9].
–Я—А–Є—Б—В—Г–њ—Л —Г –і–µ—В–µ–є 6–12 –ї–µ—В —В–∞–Ї–ґ–µ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –њ—А–Њ–≤–Њ—Ж–Є—А—Г—О—В—Б—П –∞–ї–ї–µ—А–≥–µ–љ–∞–Љ–Є, —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–Љ–Є –≤–Є—А—Г—Б–∞–Љ–Є, —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Њ–є. –Я—А–Є –≤—Л–±–Њ—А–µ –ї–µ—З–µ–љ–Є—П —Б–ї–µ–і—Г–µ—В –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ —Г—З–Є—В—Л–≤–∞—В—М —Б—В–µ–њ–µ–љ—М —В—П–ґ–µ—Б—В–Є –њ—А–µ–і—И–µ—Б—В–≤–Њ–≤–∞–≤—И–µ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Т –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ —В—П–ґ–µ—Б—В—М —В–µ—З–µ–љ–Є—П –С–Р –љ–µ—А–µ–і–Ї–Њ –Љ–µ–љ—П–µ—В—Б—П, —Г –Њ—В–і–µ–ї—М–љ—Л—Е –і–µ—В–µ–є –њ—А–Є—Б—В—Г–њ—Л –≤–Њ–Њ–±—Й–µ –њ–Њ—П–≤–ї—П—О—В—Б—П –≤–њ–µ—А–≤—Л–µ, —З–∞—Б—В—М –і–µ—В–µ–є «–њ–µ—А–µ—А–∞—Б—В–∞–µ—В» –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ. –°–Є–Љ–њ—В–Њ–Љ—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–Љ–µ–љ—М—И–∞—О—В—Б—П –Є –і–∞–ґ–µ –Є—Б—З–µ–Ј–∞—О—В. –°–ї–Њ–ґ–љ–Њ—Б—В—М –≤–µ–і–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Н—В–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ —Г –Љ–љ–Њ–≥–Є—Е –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤ –≤—А–µ–і–љ—Л—Е –њ—А–Є–≤—Л—З–µ–Ї (—В–∞–±–∞–Ї–Њ–Ї—Г—А–µ–љ–Є—П), –љ–µ–Ї—А–Є—В–Є—З–љ–Њ–є –Њ—Ж–µ–љ–Ї–Њ–є –Є–Љ–Є —Б–≤–Њ–µ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П, –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –њ—А–µ–µ–Љ—Б—В–≤–µ–љ–љ–Њ—Б—В–Є –Є –љ–µ—А–µ–≥—Г–ї—П—А–љ–Њ—Б—В—М—О –≤—А–∞—З–µ–±–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П, –љ–Є–Ј–Ї–Њ–є –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М—О —В–µ—А–∞–њ–Є–Є.
–Ч–∞–і–∞—З–∞–Љ–Є –ї–µ—З–µ–љ–Є—П –С–Р —П–≤–ї—П—О—В—Б—П –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ —А–µ–Љ–Є—Б—Б–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Њ–±–Њ—Б—В—А–µ–љ–Є–є. –Я–Њ–і—Е–Њ–і—Л –Ї –ї–µ—З–µ–љ–Є—О –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П —Б—В–µ–њ–µ–љ—М—О —В—П–ґ–µ—Б—В–Є –Є –Ї–Њ–љ—В—А–Њ–ї—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –°–Њ–≥–ї–∞—Б–љ–Њ –≤—Л—А–∞–±–Њ—В–∞–љ–љ—Л–Љ –њ–Њ–і—Е–Њ–і–∞–Љ –≤ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–є –њ–µ–і–Є–∞—В—А–Є–Є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –С–Р –њ–Њ —В—П–ґ–µ—Б—В–Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–Љ –≤—А–∞—З–∞–Љ –Њ–±–µ—Б–њ–µ—З–Є—В—М –њ–Њ–і–±–Њ—А —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ —А–∞–Ј–ї–Є—З–љ—Л–µ –≤–Њ–Ј—А–∞—Б—В–љ—Л–µ –њ–µ—А–Є–Њ–і—Л, —Б–Њ—Е—А–∞–љ–Є—В—М –њ—А–µ–µ–Љ—Б—В–≤–µ–љ–љ–Њ—Б—В—М –њ—А–Є –њ–µ—А–µ—Е–Њ–і–µ –Ї –≤–Ј—А–Њ—Б–ї—Л–Љ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–∞–Љ –Є –њ—А–Њ–≤–Њ–і–Є—В—М –∞–і–µ–Ї–≤–∞—В–љ—Г—О —Н–Ї—Б–њ–µ—А—В–љ—Г—О –Њ—Ж–µ–љ–Ї—Г [2, 4].
–†–∞–Ј–≤–Є—В–Є–µ —В—П–ґ–µ–ї—Л—Е –Њ–±–Њ—Б—В—А–µ–љ–Є–є –С–Р –Љ–Њ–ґ–µ—В –њ—А–µ–і—Б—В–∞–≤–ї—П—В—М —Г–≥—А–Њ–Ј—Г –і–ї—П –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ–Њ–≥–Њ, –њ—А–Є—З–µ–Љ —В—П–ґ–µ–ї–Њ–µ –Њ–±–Њ—Б—В—А–µ–љ–Є–µ –Љ–Њ–ґ–µ—В —А–∞–Ј–≤–Є—В—М—Б—П –њ—А–Є –ї—О–±–Њ–є —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є —В–µ—З–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –С–Р – —А–µ–∞–ї—М–љ–Њ —Г–≥—А–Њ–ґ–∞—О—Й–µ–µ –ґ–Є–Ј–љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, —З—В–Њ –Ј–∞—Б—В–∞–≤–ї—П–µ—В —Г–і–µ–ї—П—В—М –Њ—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –≤–Њ–њ—А–Њ—Б–∞–Љ –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –Є —Б–Њ—Ж–Є–∞–ї—М–љ–Њ–є –њ–Њ–і–і–µ—А–ґ–Ї–Є –±–Њ–ї—М–љ—Л—Е. –Ґ–Њ–ї—М–Ї–Њ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –Є —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є —Г –і–µ—В–µ–є, –±–Њ–ї—М–љ—Л—Е –С–Р, –Љ–Њ–ґ–µ—В –±—Л—В—М –і–Њ—Б—В–Є–≥–љ—Г—В–∞ —Г—Б—В–Њ–є—З–Є–≤–∞—П —А–µ–Љ–Є—Б—Б–Є—П.
–Ю—Б–љ–Њ–≤–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –С–Р —П–≤–ї—П–µ—В—Б—П –±–∞–Ј–Є—Б–љ–∞—П (–њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П) —В–µ—А–∞–њ–Є—П, –њ–Њ–і –Ї–Њ—В–Њ—А–Њ–є –њ–Њ–љ–Є–Љ–∞—О—В —А–µ–≥—Г–ї—П—А–љ–Њ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї—Г–њ–Є—А—Г—О—Й–Є—Е –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є. –С–∞–Ј–Є—Б–љ–∞—П —В–µ—А–∞–њ–Є—П –љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ —Б —Г—З–µ—В–Њ–Љ —В—П–ґ–µ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–∞ –Љ–Њ–Љ–µ–љ—В –Њ—Б–Љ–Њ—В—А–∞ –±–Њ–ї—М–љ–Њ–≥–Њ, –Ї–Њ—А—А–Є–≥–Є—А—Г–µ—В—Б—П –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –і–Њ—Б—В–Є–≥–∞–µ–Љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞. –Ю–±—К–µ–Љ –±–∞–Ј–Є—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —В—П–ґ–µ—Б—В—М—О –Є —Г—А–Њ–≤–љ–µ–Љ –Ї–Њ–љ—В—А–Њ–ї—П –С–Р, –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –±–Њ–ї—М–љ—Л—Е –і–µ—В–µ–є, —Е–∞—А–∞–Ї—В–µ—А–Њ–Љ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є [2, 4, 10].
–§–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л –і–µ–ї—П—В—Б—П –љ–∞ —Б—А–µ–і—Б—В–≤–∞ –±–∞–Ј–Є—Б–љ–Њ–є (–њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є) —В–µ—А–∞–њ–Є–Є –Є —Б—А–µ–і—Б—В–≤–∞ –љ–µ–Њ—В–ї–Њ–ґ–љ–Њ–є –њ–Њ–Љ–Њ—Й–Є. –Т–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –≤ –±—А–Њ–љ—Е–∞—Е –≤—Л—П–≤–ї—П–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –≤–Њ –≤—А–µ–Љ—П –Њ–±–Њ—Б—В—А–µ–љ–Є—П, –љ–Њ –Є –≤ —Д–∞–Ј–µ —А–µ–Љ–Є—Б—Б–Є–Є, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –і–ї–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–є –С–Р.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Ш–У–Ъ–° – –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –і–ї—П –ї–µ—З–µ–љ–Є—П –С–Р, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –љ–∞–Ј–љ–∞—З–∞—В—М—Б—П —Б 6-–Љ–µ—Б—П—З–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (—В–∞–±–ї. 2). –Ю–љ–Є —Б–њ–Њ—Б–Њ–±–љ—Л –њ–Њ–і–∞–≤–ї—П—В—М –Ї–∞–Ї –Њ—Б—В—А–Њ–µ, —В–∞–Ї –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ. –£–Љ–µ–љ—М—И–µ–љ–Є–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –Ш–У–Ъ–° –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ –±—А–Њ–љ—Е–Њ–≤ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Є—Е –≥–Є–њ–µ—А—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, —З–∞—Б—В–Њ—В—Л –Њ–±–Њ—Б—В—А–µ–љ–Є–є –С–Р, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –і–Њ—Б—В–Є–ґ–µ–љ–Є—О —А–µ–Љ–Є—Б—Б–Є–Є, —Г–Љ–µ–љ—М—И–∞–µ—В —Б–Љ–µ—А—В–љ–Њ—Б—В—М –Њ—В –С–Р [5, 11].
–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –Ш–У–Ъ–° (–±–µ–Ї–ї–Њ–Љ–µ—В–∞–Ј–Њ–љ –і–Є–њ—А–Њ–њ–Є–Њ–љ–∞—В, –±—Г–і–µ—Б–Њ–љ–Є–і, —Д–ї—Г—В–Є–Ї–∞–Ј–Њ–љ–∞ –њ—А–Њ–њ–Є–Њ–љ–∞—В, –Љ–Њ–Љ–µ—В–∞–Ј–Њ–љ, —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і) –Њ—В–ї–Є—З–∞—О—В—Б—П –њ–Њ –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є –Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–µ –Њ–±—Й–µ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ [8]. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ш–У–Ъ–° –њ—А–Є —В—П–ґ–µ–ї–Њ–Љ —В–µ—З–µ–љ–Є–Є (–љ–µ –Љ–µ–љ–µ–µ 6–8 –Љ–µ—Б.), –Њ–і–љ–∞–Ї–Њ –і–∞–ґ–µ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–є —А–µ–Љ–Є—Б—Б–Є–Є –њ–Њ—Б–ї–µ –Њ—В–Љ–µ–љ—Л –Ш–У–Ъ–° –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –≤–Њ–Ј–Њ–±–љ–Њ–≤–ї–µ–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Э–∞—З–∞–ї—М–љ–∞—П –і–Њ–Ј–∞ –Ш–У–Ъ–° –љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ —В—П–ґ–µ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –њ—А–Є –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є –Ї–Њ–љ—В—А–Њ–ї—П –і–Њ–Ј–∞ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –і–Њ –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є. –£ –і–µ—В–µ–є –ї—О–±–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –њ—А–Є –њ—А–∞–≤–Є–ї—М–љ–Њ –≤—Л–±—А–∞–љ–љ–Њ–Љ –Є–љ–≥–∞–ї—П—В–Њ—А–µ –Є —Б–Њ–±–ї—О–і–µ–љ–Є–Є —В–µ—Е–љ–Є–Ї–Є –Є–љ–≥–∞–ї—П—Ж–Є–Є —Б–Є–Љ–њ—В–Њ–Љ—Л –С–Р —Г–Љ–µ–љ—М—И–∞—О—В—Б—П, –∞ –ї–µ–≥–Њ—З–љ–∞—П —Д—Г–љ–Ї—Ж–Є—П –±—Л—Б—В—А–Њ (—З–µ—А–µ–Ј 1–2 –љ–µ–і.) —Г–ї—Г—З—И–∞–µ—В—Б—П –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –љ–Є–Ј–Ї–Є—Е –Є —Б—А–µ–і–љ–Є—Е –і–Њ–Ј –Ш–У–Ъ–° (—В. –µ. 250–500 –Љ–Ї–≥ –±—Г–і–µ—Б–Њ–љ–Є–і–∞ –µ–ґ–µ–і–љ–µ–≤–љ–Њ). –Ґ–Њ–ї—М–Ї–Њ –љ–µ–±–Њ–ї—М—И–Њ–Љ—Г —З–Є—Б–ї—Г –і–µ—В–µ–є —В—А–µ–±—Г—О—В—Б—П –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –Ш–У–Ъ–°. –Э–∞–њ—А–Є–Љ–µ—А, –Ї—Г—А–µ–љ–Є–µ —Г—Е—Г–і—И–∞–µ—В –Њ—В–≤–µ—В –љ–∞ –Ш–У–Ъ–°, –њ–Њ—Н—В–Њ–Љ—Г –Ї—Г—А—П—Й–Є–Љ –њ–Њ–і—А–Њ—Б—В–Ї–∞–Љ –Љ–Њ–ґ–µ—В –њ–Њ—В—А–µ–±–Њ–≤–∞—В—М—Б—П –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –њ—А–µ–њ–∞—А–∞—В–∞ [2, 10].
–Я—А–Є —Б–Њ–Ј–і–∞–љ–Є–Є –љ–Њ–≤—Л—Е –Ш–У–Ъ–° –і–ї—П –ї–µ—З–µ–љ–Є—П –∞—Б—В–Љ—Л —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–Њ–≤—Л—И–µ–љ–∞ –њ—Г—В–µ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Б—А–µ–і—Б—В–≤ –і–Њ—Б—В–∞–≤–Ї–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ HFA-—В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є, –Ї–Њ—В–Њ—А–∞—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—М –Љ–µ–ї–Ї–Є–µ –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ—Л–µ —З–∞—Б—В–Є—Ж—Л, —Б–њ–Њ—Б–Њ–±–љ—Л–µ –і–Њ—Б—В–Є–≥–∞—В—М –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є; –њ—А–Њ–і–ї–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –ї–µ–≥–Ї–Є—Е –±–ї–∞–≥–Њ–і–∞—А—П –ї–Є–њ–Є–і–љ—Л–Љ —Б–≤—П–Ј—П–Љ —Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–µ–і–ї–µ–љ–љ–Њ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞–µ–Љ–Њ–≥–Њ –Ј–∞–њ–∞—Б–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –Є —Б–Њ–Ј–і–∞–љ–Є—П –≤—Л—Б–Њ–Ї–Њ–ї–Є–њ–Њ—Д–Є–ї—М–љ—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –ї–µ–≥–Ї–Њ –њ—А–Њ–љ–Є–Ї–∞—В—М –≤ –Ї–ї–µ—В–Ї–Є; –њ–Њ–≤—Л—И–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б –њ–Њ–Љ–Њ—Й—М—О –≤—Л—Б–Њ–Ї–Њ–≥–Њ —Б—А–Њ–і—Б—В–≤–∞ –Ї —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ. –С–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Љ–Њ–ґ–µ—В –±—Л—В—М —Г–ї—Г—З—И–µ–љ–∞ –њ—Г—В–µ–Љ —Б–љ–Є–ґ–µ–љ–Є—П —Б–Є—Б—В–µ–Љ–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Ј–∞ —Б—З–µ—В —Г–Љ–µ–љ—М—И–µ–љ–Є—П –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є, –±—Л—Б—В—А–Њ–≥–Њ –≤—Л–≤–µ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Є–Ј —Б–Є—Б—В–µ–Љ–љ–Њ–є —Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—П —Б–≤—П–Ј–Є —Б –±–µ–ї–Ї–∞–Љ–Є –њ–ї–∞–Ј–Љ—Л [18, 19].
–¶–Є–Ї–ї–µ—Б–Њ–љ–Є–і – –Ш–У–Ъ–°, –њ—А–µ–њ–∞—А–∞—В –љ–Њ–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –і–ї—П –ї–µ—З–µ–љ–Є—П –і–µ—В–µ–є, —Б—В—А–∞–і–∞—О—Й–Є—Е –С–Р. –¶–Є–Ї–ї–µ—Б–Њ–љ–Є–і –Њ—В–ї–Є—З–∞–µ—В—Б—П –≤—Л—Б–Њ–Ї–Њ–є –ї–µ–≥–Њ—З–љ–Њ–є –і–µ–њ–Њ–Ј–Є—Ж–Є–µ–є, –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ —Б–≤—П–Ј—Л–≤–∞–љ–Є—П —Б –±–µ–ї–Ї–∞–Љ–Є –њ–ї–∞–Ј–Љ—Л –Є –±—Л—Б—В—А—Л–Љ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–Њ–Љ. –Ю–±—К–µ–і–Є–љ–µ–љ–љ—Л–µ –≤–Љ–µ—Б—В–µ, —Н—В–Є —Б–≤–Њ–є—Б—В–≤–∞ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –≤—Л—Б–Њ–Ї–Є–є –њ—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞, –њ—А–Є —Н—В–Њ–Љ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М [12]. –Т –†–Њ—Б—Б–Є–Є –Њ–љ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ –њ–Њ–і —В–Њ—А–≥–Њ–≤—Л–Љ –љ–∞–Ј–≤–∞–љ–Є–µ–Љ –Р–ї—М–≤–µ—Б–Ї–Њ.
–¶–Є–Ї–ї–µ—Б–Њ–љ–Є–і –Є–Љ–µ–µ—В —А—П–і —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤, –њ—А–Є–≤–ї–µ–Ї–∞—О—Й–Є—Е –Ї –љ–µ–Љ—Г –≤–љ–Є–Љ–∞–љ–Є–µ –≤—А–∞—З–µ–є [13, 14]. –¶–Є–Ї–ї–µ—Б–Њ–љ–Є–і – –љ–µ–∞–Ї—В–Є–≤–љ–Њ–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є–µ-–њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї (–њ—А–Њ–ї–µ–Ї–∞—А—Б—В–≤–Њ), –±—Л—Б—В—А–Њ –∞–Ї—В–Є–≤–Є—А—Г—О—Й–µ–µ—Б—П –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е –ї–µ–≥–Ї–Є—Е –њ—А–Є —Г—З–∞—Б—В–Є–Є —Н—Б—В–µ—А–∞–Ј. –Р–Ї—В–Є–≤–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ –і–µ—Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і (–і–µ-CIC) –Є–Љ–µ–µ—В –≤—Л—Б–Њ–Ї–Њ–µ —Б—А–Њ–і—Б—В–≤–Њ –Ї –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–љ—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ, —П–≤–ї—П–µ—В—Б—П –≤—Л—Б–Њ–Ї–Њ–ї–Є–њ–Њ—Д–Є–ї—М–љ—Л–Љ –Є –Њ–±—А–∞–Ј—Г–µ—В –Ї–Њ–љ—К—О–≥–∞—В—Л –ї–Є–њ–Є–і–Њ–≤ –≤ –ї–µ–≥–Ї–Є—Е, —З—В–Њ –њ—А–Њ–і–ї–µ–≤–∞–µ—В —Б—А–Њ–Ї –µ–≥–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Є–Љ–µ–љ—П—В—М –µ–≥–Њ 1 —А./—Б—Г—В. –Т—Л—Б–Њ–Ї–∞—П –ї–µ–≥–Њ—З–љ–∞—П –Є –љ–Є–Ј–Ї–∞—П –Њ—А–Њ—Д–∞—А–Є–љ–≥–µ–∞–ї—М–љ–∞—П –і–µ–њ–Њ–Ј–Є—Ж–Є—П –Њ–њ—А–µ–і–µ–ї—П—О—В –≤—Л—Б–Њ–Ї—Г—О –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Є–Љ–µ–љ–љ–Њ –≤ –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В—П—Е –Є –љ–Є–Ј–Ї–Є–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї –Њ—А–Њ—Д–∞—А–Є–љ–≥–µ–∞–ї—М–љ—Л—Е –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —П–≤–ї–µ–љ–Є–є. –¶–Є–Ї–ї–µ—Б–Њ–љ–Є–і –Є–Љ–µ–µ—В –љ–Є–Ј–Ї—Г—О –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М (1%), –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Б–≤—П–Ј—Л–≤–∞–љ–Є—П —Б –±–µ–ї–Ї–∞–Љ–Є (~99%) –≤ —Б–Є—Б—В–µ–Љ–љ–Њ–Љ –Ї—А–Њ–≤–Њ—В–Њ–Ї–µ, —З—В–Њ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В –µ–≥–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ —Б —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤ –Ј–∞ –њ—А–µ–і–µ–ї–∞–Љ–Є –ї–µ–≥–Ї–Є—Е, –Є, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤—Л—Б–Њ–Ї–Є–є —Б–Є—Б—В–µ–Љ–љ—Л–є –Ї–ї–Є—А–µ–љ—Б. –¶–Є–Ї–ї–µ—Б–Њ–љ–Є–і —П–≤–ї—П–µ—В—Б—П —Г–ї—М—В—А–∞–Љ–µ–ї–Ї–Њ–і–Є—Б–њ–µ—А—Б–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ, —В. –µ. —Б–Њ—Б—В–Њ–Є—В –Є–Ј –Љ–µ–ї–Ї–Є—Е —З–∞—Б—В–Є—Ж. –Ш—Е —Б—А–µ–і–љ–Є–є –і–Є–∞–Љ–µ—В—А – –Њ—В 1,1 –Љ–Ї–Љ (–і–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П: –і–Є–∞–Љ–µ—В—А —З–∞—Б—В–Є—Ж —Д–ї—Г—В–Є–Ї–∞–Ј–Њ–љ–∞ – 3,5 –Љ–Ї–Љ, –±—Г–і–µ—Б–Њ–љ–Є–і–∞ – 2,8 –Љ–Ї–Љ). –С–ї–∞–≥–Њ–і–∞—А—П –Љ–µ–љ—М—И–µ–Љ—Г —А–∞–Ј–Љ–µ—А—Г –Є–љ–≥–∞–ї–Є—А—Г–µ–Љ—Л—Е —З–∞—Б—В–Є—Ж –Є –љ–Є–Ј–Ї–Њ–є —Б–Ї–Њ—А–Њ—Б—В–Є –њ–Њ—В–Њ–Ї–∞ —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і –ї—Г—З—И–µ –і–Њ—Б—В–∞–≤–ї—П–µ—В—Б—П –≤ –Љ–µ–ї–Ї–Є–µ –і—Л—Е–∞—В–µ–ї—М–љ—Л–µ –њ—Г—В–Є, –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–є –Ї–Њ–љ—В—А–Њ–ї—М –∞—Б—В–Љ—Л –Љ–Њ–ґ–µ—В –±—Л—В—М –і–Њ—Б—В–Є–≥–љ—Г—В –њ—А–Є –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є—Е —Б—Г—В–Њ—З–љ—Л—Е –і–Њ–Ј–∞—Е [12–14].
–Ь–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г –і–µ—В–µ–є 4–11 –ї–µ—В —Б –С–Р –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є, —З—В–Њ —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і (–Р–ї—М–≤–µ—Б–Ї–Њ) –≤ –і–Њ–Ј–∞—Е 40, 80 –Є 160 –Љ–Ї–≥ 1 —А./—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 12 –љ–µ–і. –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–∞–µ—В —Б–Є–Љ–њ—В–Њ–Љ—Л –С–Р, —Г–ї—Г—З—И–∞–µ—В —Д—Г–љ–Ї—Ж–Є—О –ї–µ–≥–Ї–Є—Е –Є –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –і–µ—В–µ–є —Б –С–Р –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ. –Ч–љ–∞—З–Є–Љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ –≤ –і–Њ–Ј–∞—Е 40 –Є 80 –Љ–Ї–≥. –Т—Б–µ –і–Њ–Ј—Л —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ (–Р–ї—М–≤–µ—Б–Ї–Њ) –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Є —Е–Њ—А–Њ—И–Њ –њ–µ—А–µ–љ–Њ—Б–Є–ї–Є—Б—М [18].
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –њ—А–Є–Љ–µ—А
–С–Њ–ї—М–љ–Њ–є –Ф., 11 –ї–µ—В, –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Б –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ «–С–Р —Б—А–µ–і–љ–µ–є —В—П–ґ–µ—Б—В–Є» –≤ —В–µ—З–µ–љ–Є–µ 2 –ї–µ—В. –Я–Њ–ї—Г—З–∞–µ—В (–љ–µ—А–µ–≥—Г–ї—П—А–љ–Њ) –±–∞–Ј–Є—Б–љ—Г—О —В–µ—А–∞–њ–Є—О –±–µ–Ї–ї–Њ–Љ–µ—В–∞–Ј–Њ–љ–Њ–Љ 100 –Љ–Ї–≥/—Б—Г—В. –Я—А–Є—Б—В—Г–њ—Л –±—А–Њ–љ—Е–Њ–Њ–±—Б—В—А—Г–Ї—Ж–Є–Є (—Б—Г—Е–Њ–є –Ї–∞—И–µ–ї—М, –Ј–∞—В—А—Г–і–љ–µ–љ–љ–Њ–µ –і—Л—Е–∞–љ–Є–µ, –Њ–і—Л—И–Ї–∞) –≤–Њ–Ј–љ–Є–Ї–∞—О—В –њ—А–Є –Ї–Њ–љ—В–∞–Ї—В–µ —Б –∞–ї–ї–µ—А–≥–µ–љ–Њ–Љ, —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –љ–∞–≥—А—Г–Ј–Ї–µ 2–3 —А./–љ–µ–і., –Ї—Г–њ–Є—А—Г—О—В—Б—П 1–2 –Є–љ–≥–∞–ї—П—Ж–Є—П–Љ–Є —Б–∞–ї—М–±—Г—В–∞–Љ–Њ–ї–∞. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ —А–µ–±–µ–љ–Њ–Ї –±—Л–ї –Ї–Њ–љ—Б—Г–ї—М—В–Є—А–Њ–≤–∞–љ –∞–ї–ї–µ—А–≥–Њ–ї–Њ–≥–Њ–Љ –њ–Њ –Љ–µ—Б—В—Г –ґ–Є—В–µ–ї—М—Б—В–≤–∞.
–Ю–±—Й–µ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–Њ–µ. –Ъ–Њ–ґ–љ—Л–µ –њ–Њ–Ї—А–Њ–≤—Л –±–ї–µ–і–љ—Л–µ, —Б—Г—Е–Є–µ. –Э–Њ—Б–Њ–≤–Њ–µ –і—Л—Е–∞–љ–Є–µ —Г–Љ–µ—А–µ–љ–љ–Њ –Ј–∞—В—А—Г–і–љ–µ–љ–Њ. –Ъ–∞—В–∞—А–∞–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –≤ –Ј–µ–≤–µ –љ–µ—В. –Т –ї–µ–≥–Ї–Є—Е –і—Л—Е–∞–љ–Є–µ –ґ–µ—Б—В–Ї–Њ–µ, –њ—А–Њ–≤–Њ–і–Є—В—Б—П —А–∞–≤–љ–Њ–Љ–µ—А–љ–Њ, —Е—А–Є–њ–Њ–≤ –љ–µ—В. –Ґ–Њ–љ—Л —Б–µ—А–і—Ж–∞ —П—Б–љ—Л–µ, —А–Є—В–Љ–Є—З–љ—Л–µ. –Р–Ф – 110/60 –Љ–Љ —А—В. —Б—В. –Ц–Є–≤–Њ—В –Љ—П–≥–Ї–Є–є, –±–µ–Ј–±–Њ–ї–µ–Ј–љ–µ–љ–љ—Л–є. –Я–µ—З–µ–љ—М –љ–µ —Г–≤–µ–ї–Є—З–µ–љ–∞. –§–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Њ—В–њ—А–∞–≤–ї–µ–љ–Є—П –≤ –љ–Њ—А–Љ–µ. –Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Д—Г–љ–Ї—Ж–Є–Є –≤–љ–µ—И–љ–µ–≥–Њ –і—Л—Е–∞–љ–Є—П (–§–Т–Ф) –≤—Л—П–≤–ї–µ–љ–∞ —Г–Љ–µ—А–µ–љ–љ–∞—П –Њ–±—Б—В—А—Г–Ї—Ж–Є—П. –Я—А–Њ–±–∞ —Б –±—А–Њ–љ—Е–Њ–ї–Є—В–Є–Ї–Њ–Љ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П. –Т –Ї–∞—З–µ—Б—В–≤–µ –±–∞–Ј–Є—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞–Ј–љ–∞—З–µ–љ –Р–ї—М–≤–µ—Б–Ї–Њ 80 –Љ–Ї–≥ 1 —А./—Б—Г—В.
–Я—А–Є –њ–Њ–≤—В–Њ—А–љ–Њ–є –Ї–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є–Є —З–µ—А–µ–Ј 1 –Љ–µ—Б. —Б–Њ—Б—В–Њ—П–љ–Є–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–ї—Г—З—И–Є–ї–Њ—Б—М, —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –±—А–Њ–љ—Е–Њ–Њ–±—Б—В—А—Г–Ї—Ж–Є–Є –љ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М, —А–µ–±–µ–љ–Њ–Ї –њ–µ—А–µ—Б—В–∞–ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М β2-–∞–≥–Њ–љ–Є—Б—В—Л –Ї–Њ—А–Њ—В–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П. –Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є: –§–Т–Ф – –≤ –љ–Њ—А–Љ–µ. –†–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В—М –±–∞–Ј–Є—Б–љ—Г—О —В–µ—А–∞–њ–Є—О –Р–ї—М–≤–µ—Б–Ї–Њ –≤ –і–Њ–Ј–µ 80 –Љ–Ї–≥/—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б.
–Я—А–Є–≤–µ–і–µ–љ–љ—Л–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –њ—А–Є–Љ–µ—А —Б–Њ–≥–ї–∞—Б—Г–µ—В—Б—П —Б –і–∞–љ–љ—Л–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ –Ї–Њ—В–Њ—А—Л—Е –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ —Г –і–µ—В–µ–є 6–11 –ї–µ—В —Б –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–µ–є –С–Р —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і –≤ –і–Њ–Ј–∞—Е 40, 80, 160 –Љ–Ї–≥ –±—Л–ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ, —З–µ–Љ –њ–ї–∞—Ж–µ–±–Њ, –≤ —Г–ї—Г—З—И–µ–љ–Є–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Њ–±—К–µ–Љ–∞ —Д–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤—Л–і–Њ—Е–∞ –Ј–∞ –њ–µ—А–≤—Г—О —Б–µ–Ї—Г–љ–і—Г –Є –±–∞–ї–ї–Њ–≤ –Њ—Ж–µ–љ–Ї–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –∞—Б—В–Љ—Л (—А<0,01); 80 –Є 160 –Љ–Ї–≥ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Б–љ–Є–ґ–∞–ї–Є –Њ–±—К–µ–Љ (—З–∞—Б—В–Њ—В—Г) –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б–Ї–Њ—А–Њ–є –њ–Њ–Љ–Њ—Й–Є –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ–ї–∞—Ж–µ–±–Њ (—А<0,025) [12]. –Ю—В–Љ–µ—З–∞–ї–Є—Б—М —Е–Њ—А–Њ—И–∞—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –≥–Є–њ–Њ—В–∞–ї–∞–Љ–Њ-–≥–Є–њ–Њ—Д–Є–Ј–∞—А–љ–Њ-–љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤—Г—О —Б–Є—Б—В–µ–Љ—Г —Г –і–µ—В–µ–є. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б–њ–µ–є—Б–µ—А–∞ –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ (–Р–ї—М–≤–µ—Б–Ї–Њ), –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Н—В–Є—Е –і–≤—Г—Е —А–µ–ґ–Є–Љ–Њ–≤ –ї–µ—З–µ–љ–Є—П –љ–µ —В—А–µ–±–Њ–≤–∞–ї–Є –Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–Ї–Є –і–Њ–Ј—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–Љ–µ–љ—П–≤—И–Є—Е —А–∞–Ј–ї–Є—З–љ—Г—О —В–µ—Е–љ–Є–Ї—Г –Є–љ–≥–∞–ї—П—Ж–Є–Є [15].
–Т–ї–Є—П–љ–Є–µ –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ –љ–∞ —А–Њ—Б—В –і–µ—В–µ–є —Б –ї–µ–≥–Ї–Њ–є –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–µ–є –∞—Б—В–Љ–Њ–є –Є–Ј—Г—З–∞–ї–Њ—Б—М –≤ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –і–≤–Њ–є–љ–Њ–Љ —Б–ї–µ–њ–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤ 85 –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е —Ж–µ–љ—В—А–∞—Е –°–®–Р, –Т–µ–љ–µ—Б—Г—Н–ї—Л, –Р—А–≥–µ–љ—В–Є–љ—Л –Є –І–Є–ї–Є (12.2000–09.2004) [16]. –Я–Њ—Б–ї–µ –њ–Њ–ї—Г–≥–Њ–і–Њ–≤–Њ–≥–Њ –≤–≤–Њ–і–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ (661 —А–µ–±–µ–љ–Њ–Ї) –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 5,0 –і–Њ 8,5 –≥–Њ–і–∞ –±—Л–ї–Є –љ–∞–Ј–љ–∞—З–µ–љ—Л –ї–Є–±–Њ —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і –≤ –і–Њ–Ј–∞—Е 40 –Є–ї–Є 160 –Љ–Ї–≥, –ї–Є–±–Њ –њ–ї–∞—Ж–µ–±–Њ 1 —А./—Б—Г—В —Г—В—А–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ 52 –љ–µ–і. –Ш—Б—Е–Њ–і–љ–Њ –Є —З–µ—А–µ–Ј 1 –≥–Њ–і –Њ–њ—А–µ–і–µ–ї—П–ї–Є –ї–Є–љ–µ–є–љ—Г—О —Б–Ї–Њ—А–Њ—Б—В—М —А–Њ—Б—В–∞ –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–Є–Њ–і–∞ –ї–µ—З–µ–љ–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Є–Ј–Љ–µ—А–µ–љ–Є—П —Г—А–Њ–≤–љ—П —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –≤ –Љ–Њ—З–µ –Ј–∞ 24 –Є 10 —З (–љ–Њ—З—М—О), –і–∞–љ–љ—Л—Е —Б–њ–Є—А–Њ–Љ–µ—В—А–Є–Є, —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є–Є –Ї–Њ—Б—В–µ–є –Ј–∞–њ—П—Б—В—М—П –Є –Њ—Ж–µ–љ–Ї–Є –љ–µ–≥–∞—В–Є–≤–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –ї–µ—З–µ–љ–Є—П. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ —Б—А–µ–і–љ–µ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –і–ї–Є–љ—Л —В–µ–ї–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–Њ—Б—М –≤ –≥—А—Г–њ–њ–∞—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і –Є –њ–ї–∞—Ж–µ–±–Њ. –Ф–∞–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤–ї–Є—П–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ —А–Њ—Б—В –і–µ—В–µ–є.
–Ы–µ—З–µ–љ–Є–µ –і–µ—В–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ 6–12 –ї–µ—В, —Б—В—А–∞–і–∞—О—Й–Є—Е –ї–µ–≥–Ї–Њ–є –С–Р, —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–Њ–Љ (–Р–ї—М–≤–µ—Б–Ї–Њ) –≤ —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј–µ 320 –Љ–Ї–≥ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–Њ—Б—М —Б –Љ–µ–љ—М—И–Є–Љ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ —Б–Ї–Њ—А–Њ—Б—В—М —А–Њ—Б—В–∞ –љ–Њ–≥–Є –Є —Б—Г—В–Њ—З–љ—Г—О —Б–µ–Ї—А–µ—Ж–Є—О –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є —Д–ї—Г—В–Є–Ї–∞–Ј–Њ–љ–Њ–Љ 375 –Љ–≥/—Б—Г—В [17].
–Я–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б–Є—Б—В–µ–Љ–љ—Л–є –њ—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ (–Р–ї—М–≤–µ—Б–Ї–Њ) 1 —А./—Б—Г—В –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –Њ—Б–Њ–±–µ–љ–љ–Њ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ, —В. –Ї. –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –≤–ї–Є—П–љ–Є—П –љ–∞ —Д—Г–љ–Ї—Ж–Є—О –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤ –Є —А–Њ—Б—В —А–µ–±–µ–љ–Ї–∞. –¶–Є–Ї–ї–µ—Б–Њ–љ–Є–і (–Р–ї—М–≤–µ—Б–Ї–Њ) —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ —Б –њ–ї–∞—Ж–µ–±–Њ –Ї–∞–Ї –њ–Њ –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є, —В–∞–Ї –Є –њ–Њ –љ–Є–Ј–Ї–Њ–є —З–∞—Б—В–Њ—В–µ –Љ–µ—Б—В–љ—Л—Е –Њ—А–Њ—Д–∞—А–Є–љ–≥–µ–∞–ї—М–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ—А–Њ–ї–µ–Ї–∞—А—Б—В–≤–∞, –Ї–Њ—В–Њ—А–Њ–µ –њ–µ—А–µ—Е–Њ–і–Є—В –≤ –∞–Ї—В–Є–≤–љ—Г—О —Д–Њ—А–Љ—Г –≤ –ї–µ–≥–Ї–Є—Е, –∞ –љ–µ –≤ –≥–ї–Њ—В–Ї–µ, —Б–≤–Њ–і–Є—В –Ї –Љ–Є–љ–Є–Љ—Г–Љ—Г —З–∞—Б—В–Њ—В—Г —Н—В–Є—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –±–µ–Ј –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Б–њ–µ–є—Б–µ—А–∞ –Є–ї–Є –њ–Њ–ї–Њ—Б–Ї–∞–љ–Є—П —А—В–∞ [18, 20, 21].
–Ф–µ—В—П–Љ —Б—В–∞—А—И–µ 6 –ї–µ—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ –µ–ґ–µ–і–љ–µ–≤–љ–∞—П –і–Њ–Ј–∞ 80–160 –Љ–Ї–≥ –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ –Є–ї–Є 80 –Љ–Ї–≥ 2 —А./—Б—Г—В. –Я—А–µ–њ–∞—А–∞—В –Љ–Њ–ґ–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П —Б–Њ —Б–њ–µ–є—Б–µ—А–Њ–Љ –Є–ї–Є –±–µ–Ј –љ–µ–≥–Њ. –Х—Б–ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б–њ–µ–є—Б–µ—А–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ, —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Є–Љ–µ–љ—П—В—М —Б–њ–µ–є—Б–µ—А AeroChamberPlus. –£ –і–µ—В–µ–є —Б—В–∞—А—И–µ 12 –ї–µ—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ–∞—П –µ–ґ–µ–і–љ–µ–≤–љ–∞—П –і–Њ–Ј–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ—В 160 –і–Њ 640 –Љ–Ї–≥, –і–Њ–Ј—Г 640 –Љ–Ї–≥ —Б–ї–µ–і—Г–µ—В –і–µ–ї–Є—В—М –љ–∞ 2 –њ—А–Є–µ–Љ–∞ –≤ —Б—Г—В–Ї–Є.
–Я—А–Є –≤—Л–±–Њ—А–µ –њ—А–µ–њ–∞—А–∞—В–∞ –і–ї—П –±–∞–Ј–Є—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –С–Р –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П —Б—В—Г–њ–µ–љ—З–∞—В—Л–є –њ–Њ–і—Е–Њ–і —Б —Г—З–µ—В–Њ–Љ —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –µ—Б–ї–Є –њ–∞—Ж–Є–µ–љ—В –љ–µ –њ–Њ–ї—Г—З–∞–ї —В–µ—А–∞–њ–Є–Є, –Є –і–Њ—Б—В–Є–≥–љ—Г—В–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞, –µ—Б–ї–Є –њ–∞—Ж–Є–µ–љ—В –њ–Њ–ї—Г—З–∞–µ—В –ї–µ—З–µ–љ–Є–µ (—А–Є—Б. 1). –Я—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Н—Д—Д–µ–Ї—В–∞, —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–∞ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Б –і—А—Г–≥–Є–Љ–Є –Ї–ї–∞—Б—Б–∞–Љ–Є –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г—О—Й–µ–є —В–µ—А–∞–њ–Є–Є (β2-–∞–≥–Њ–љ–Є—Б—В—Л –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П, –Р–Ы–Ґ), –∞ –љ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –і–Њ–Ј—Л –Ш–У–Ъ–°. –Я—А–Є –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є –Ї–Њ–љ—В—А–Њ–ї—П –љ–∞–і –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–Њ–і–Є—В—М –Ї–Њ—А—А–µ–Ї—Ж–Є—О —В–µ—А–∞–њ–Є–Є –Ї–∞–ґ–і—Л–µ 3 –Љ–µ—Б., –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–Є –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Љ–љ–Њ–≥–Є–µ —А–Њ–і–Є—В–µ–ї–Є –Њ—В–Љ–µ–љ—П—О—В –њ—А–µ–њ–∞—А–∞—В—Л –і–ї—П –±–∞–Ј–Є—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Э–∞ –≤—Б–µ—Е —Б—В—Г–њ–µ–љ—П—Е –њ—А–Њ–≤–Њ–і—П—В—Б—П –Ј–∞–љ—П—В–Є—П –≤ –∞—Б—В–Љ–∞-—И–Ї–Њ–ї–∞—Е: –і–µ—В–Є –Њ–±—Г—З–∞—О—В—Б—П –і—Л—Е–∞—В–µ–ї—М–љ—Л–Љ —Г–њ—А–∞–ґ–љ–µ–љ–Є—П–Љ, –љ–∞—З–Є–љ–∞—О—В –Ј–∞–љ–Є–Љ–∞—В—М—Б—П —Б–њ–Њ—А—В–Њ–Љ, –Є–Љ –њ—А–Є–≤–Є–≤–∞—О—В—Б—П –љ–∞–≤—Л–Ї–Є –Ј–∞–Ї–∞–ї–Є–≤–∞–љ–Є—П; –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –Љ–µ—В–Њ–і—Л –Ї–ї–Є–Љ–∞—В–Њ—В–µ—А–∞–њ–Є–Є, —Б–∞–љ–∞—В–Њ—А–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ, —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П [2, 10].
–Я—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–ї–µ–і—Г–µ—В —А–µ–≥—Г–ї—П—А–љ–Њ –Њ—Б–Љ–∞—В—А–Є–≤–∞—В—М —А–Њ—В–Њ–≤—Г—О –њ–Њ–ї–Њ—Б—В—М, –Є–Ј–Љ–µ—А—П—В—М —А–Њ—Б—В, –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ –Є –њ—А–Њ–≤–Њ–і–Є—В—М –і–µ–љ—Б–Є—В–Њ–Љ–µ—В—А–Є—О, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤, –љ–µ–Њ–±—Е–Њ–і–Є–Љ —В–∞–Ї–ґ–µ –Њ—Б–Љ–Њ—В—А –Њ–Ї—Г–ї–Є—Б—В–Њ–Љ. –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –Є —А–Њ–і–Є—В–µ–ї–Є –і–Њ–ї–ґ–љ—Л –њ–Њ–ї—Г—З–Є—В—М –Њ—Б–љ–Њ–≤–љ—Г—О –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О –Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є, –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–µ –љ–∞–≤—Л–Ї–Є –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є —Б–∞–Љ–Њ–Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. National Asthma Education and Prevention Program. Expert Panel Report 3 (EPR-3): Guidelines for the Diagnosis and Management of Asthma-Summary Report 2007 // J. Allergy Clin. Immunol. 2007. Vol. 120. вДЦ 5. Suppl. P. 194–138.
2. –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П –њ—А–Њ–≥—А–∞–Љ–Љ–∞ «–С—А–Њ–љ—Е–Є–∞–ї—М–љ–∞—П –∞—Б—В–Љ–∞ —Г –і–µ—В–µ–є. –°—В—А–∞—В–µ–≥–Є—П –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞». 4-–µ –Є–Ј–і. –Ь., 2012.
3. –®–∞—В–∞–ї–Є–љ–∞ –°.–Ш., –Э.–У. –Ъ–Њ–ї–Њ—Б–Њ–≤–∞. –Ш–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ—Л–µ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і—Л –≤ –ї–µ—З–µ–љ–Є–Є –Ї—А—Г–њ–∞ —Г –і–µ—В–µ–є // –Ь–µ–і–Є—Ж–Є–љ—Б–Ї–Є–є —Б–Њ–≤–µ—В. 2014. вДЦ 6. –°. 31–34.
4. –У–µ–њ–њ–µ –Э.–Р., –®–∞—В–∞–ї–Є–љ–∞ –°.–Ш., –Ъ–Њ–ї–Њ—Б–Њ–≤–∞ –Э.–У., –Ь–∞—И—Г–Ї–Њ–≤–∞ –Э.–У., –Ь–∞–ї—Л—И–µ–≤ –Т.–°. –Ъ–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –±—Г–і–µ—Б–Њ–љ–Є–і/—Д–Њ—А–Љ–Њ—В–µ—А–Њ–ї –≤ –Ї–Њ–љ—В—А–Њ–ї–µ –Њ–±–Њ—Б—В—А–µ–љ–Є–є –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є –∞—Б—В–Љ—Л —Г –і–µ—В–µ–є // –Ф–Њ–Ї—В–Њ—А.–†—Г. –Я–µ–і–Є–∞—В—А–Є—П. –У–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—П. 2013. вДЦ 3 (81). –°. 16–22.
5. Leung D.Y.M., Bloom J.W. Update on glucocorticoid action and resistance // J Allergy Clin Immunol. 2003. Vol. 111. –†. 3–22.
6. Malmstrom K., Rodriguez-Gomez G., Guerra J. et al. Oral montelukast, inhaled beclomethasone, and placebo for chronic asthma // Ann Intern Med. 1999. Vol. 130, –†. 487– 495.
7. Szefler S.J., Martin R.J., King T.S. et al. Significant variability in response to inhaled corticosteroids for persistent asthma // J Allergy Clin Immunol. 2002. Vol.109. –†. 410–418.
8. Lipworth B.J. Systemic adverse effects of inhaled corticosteroid therapy. A systematic review and meta-analysis // Arch Intern Med. 1999. Vol. 159. –†. 941–955.
9. Sont J.K., Willems L.N.A., Bel E.H. et al. Clinical control and histopathologic outcome of asthma when using airway hyperresponsiveness as an additional guide to long-term treatment // Am J Respir Crit Care Med. 1999. Vol. 159. –†. 1043–1051.
10. Global Strategy for Asthma Management and Prevention. Global Initiative for Asthma (GINA), 2011. Global Initiative for Asthma. http://www.ginasthma.org.
11. Myron J. Zitt. Symposium Cont. Properties of the Ideal Corticosteroid Therapy // Allergy and Asthma Proc. 2005. Vol. 26. –†. 173–182.
12. Nave R., McCracken N. Metabolism of ciclesonide in the upper and lower airways: review of available data // J Asthma Allergy. 2008 Sep 7. Vol. 1. –†. 11–18.
13. Nycomed. Alvesco Product Monograph. 2007.
14. Gelfand E.W., Georgitis J.W., Noonan M., Ruff M.E. Once-daily ciclesonide in children: efficacy and safety in asthma // J Pediatr. 2006. Vol. 148. –†. 377–383.
15. Pedersen S., Hirsch S., Engelstätter R. Efficacy and safety of ciclesonide MDI for the treatment of asthma in children aged 6-11 years – impact of spacer use // Am J Respir Crit Care Med. 2009. Vol. 179. A4798.
16. Skoner D.P., Maspero J., Banerji D. et al. Assessment of the Long–term Safety of Inhaled Ciclesonide on Growth in Children With Asthma // Pediatrics. 2008 Vol. 121. N 1. January 2008. –†. 1–14.
17. Agertoft L. et al. Lower-leg growth rates in children asthma during treatment with ciclesonide and fluticasone propionate // Pediatr Allergy Immunol. 2010. Vol. 21. –†. 199–205.
18. Kramer S., Rottier B.L., Scholten R.J.P.M., Boluyt N. ThisCiclesonide versus other inhaled corticosteroids for chronic asthma in children (Review) The Cochrane Library. 2013. Issue 2.
19. Dahl R. Ciclesonide for the treatment of asthma // Therapeutics and Clinical Risk Management. 2006. Vol. 2 (1). –†. 25–37.
20. Paunovic Z. Comparison of ciclesonide and fluticasone propionate in the treatment of children with persistent asthma. Proceedings of the 29th Congress of the European Academy of Allergy and Clinical Immunology; 2010 June 5-9; London.
21. Von Berg A., Engelstatter R., Minic P., Sreckovic M., Garcia-Garcia M.L., Latos T. et al. Comparison of the efficacy and safety of ciclesonide 160 microg once daily versus budesonide 400 microg once daily in children with asthma // Pediatric Allergy and Immunology. 2007. Vol. 18 (5). –†. 391–400.











