Определение. ОГЭ – разжиженный (жидкий или неоформленный) стул и/или увеличение частоты стула (больше 3 дефекаций за 24 ч), в сочетании или без лихорадки либо рвоты. При этом изменение консистенции стула является более четким индикатором диареи, чем частота стула, особенно в первые месяцы жизни ребенка. Продолжительность острой диареи не должна быть больше 7 дней. О затяжном течении гастроэнтерита можно говорить при длительности диареи больше 7, но менее 14 дней [3].
Эпидемиология. В Европе у каждого ребенка до 3–х лет регистрируется от 0,5 до 2 эпизодов диареи в год. ОГЭ считается основной причиной госпитализаций в стационар детей раннего возраста. Основным этиологическим агентом ОГЭ являются вирусы: прежде всего ротавирус, затем норовирус и астровирус [4]. Также вирусы являются ведущим этиологическим агентом ОГЭ у детей до 5 лет (табл. 2). После начала вакцинации в Европе изменилась распространенность ротавирусного гастроэнтерита. Например, в Финляндии, где в 2009 г. началась кампания по проведению вакцинации, отмечены снижение заболеваемости на 82% и уменьшение числа госпитализаций в связи с ротавирусной инфекцией на 76% [5]. Однако в тех странах, где введена вакцинация от ротавируса, растет доля норовирусной инфекции. В Южной Европе на 2-м месте после ротавирусного гастроэнтерита регистрируются бактериальные кишечные инфекции (Campylobacter, Salmonella).
Российскими учеными было проанализировано 1898 случаев ОГЭ (2005–2007 гг.). Ротавирусная этиология ОГЭ была идентифицирована у 35% детей моложе 3 лет. Самая высокая заболеваемость (71,8%) ротавирусным ОГЭ была отмечена у детей до 1 года. Авторы отметили высокую частоту (45,5%) микст-инфекции. Чаще всего встречалась ассоциация вирусов (ротавирус с норовирусом или астровирусом), а также с бактериальной инфекцией (сальмонелла, шигелла, энтероинвазивная кишечная палочка, кампилобактер) [6].
В руководстве ESPGHAN (2014) указано, что ротавирус – это основная причина развития острой диареи у детей (уровень доказательности III, C).
Отмечено, что основными этиологическими факторами развития затяжной диареи являются:
• Rotavirus, Norovirus, Astrovirus, Escherichia coli (уровень доказательности III, C);
• Lamblia (уровень доказательности I, A);
• Cryptosporidium и Entamoeba histolytica (уровень доказательности III, C).
К числу основных факторов риска, определяющих тяжесть течения заболевания, относятся возраст ребенка [7], вид вскармливания [8], преморбидный фон и социоэкономические условия проживания ребенка [9–11]. В руководстве представлена степень доказательности для основных факторов риска:
• высокая частота дегидратации у детей младше 6 мес. при ротавирусном гастроэнтерите (уровень доказательности III, C);
• высокий риск развития тяжелого и затяжного течения гастроэнтерита у детей младше 6 мес. (уровень доказательности II, B) – для развивающихся стран;
• показано, что преимущественно грудное вскармливание снижает риск развития ОГЭ у детей раннего возраста – положение для европейских стран (уровень доказательности III, C);
• раннее отлучение от груди может быть фактором риска тяжелого гастроэнтерита или влиять на продолжительность диареи – положение для развивающихся стран (уровень доказательности III, C);
• иммунодефицит является фактором риска развития диареи, тяжелой степени и затяжного течения (уровень доказательности III, C);
• мальнутриция и иммунодефицитное состояние являются предрасполагающими факторами затяжного течения паразитарного гастроэнтерита – положение для развивающихся стран (уровень доказательности III, C);
• Clostridium difficile является основной причиной развития тяжелых форм диареи, хронических заболеваний, таких как воспалительные заболевания кишечника и злокачественные новообразования (уровень доказательности III, C);
• лихорадка, рвота, наличие слизи в кале – факторы, ассоциированные с затяжным течением диареи (уровень доказательности III, C);
• дети, посещающие организованные коллективы, имеют высокий риск тяжелого течения гастроэнтерита по сравнению с детьми, не посещающими коллективы (уровень доказательности III, C);
• низкий социально-экономический статус предполагает затяжное и тяжелое течение ОГЭ (уровень доказательности III, C).
Вопросы диагностики острых кишечных инфекций до настоящего времени остаются дискутабельными. Клиническая картина заболевания может быть довольно вариабельна, при этом трудно выделить отдельные симптомы, которые могли бы свидетельствовать об этиологии гастроэнтерита. В практике отечественных педиатров ведущее место в алгоритме диагностики ОГЭ занимает бактериологическое исследование фекалий. Данный подход расходится с рекомендациями ESPGHAN, поскольку идентификация бактериального возбудителя наблюдается редко, результаты бактериологического исследования педиатр нередко получает тогда, когда пациент уже выздоровел. Немаловажное значение имеет высокая стоимость бактериологических исследований. В руководстве ESPGHAN приведена упрощенная таблица, на основании которой можно попытаться на основании анализа клинической симптоматики определить характер диареи – вирусный или бактериальный (табл. 3) [12, 13].
Таким образом, рутинное микробиологическое исследование с целью выявления этиологического фактора комитет ESPGHAN не рекомендует [14].
Микробиологическое исследование кала рекомендуется проводить:
• детям моложе 3 мес.;
• пациентам с токсическим шоком и сепсисом;
• при наличии диареи (более 10 р./сут), лихорадки, кровянистого стула;
• пациентам с иммунодефицитными состояниями;
• при наличии хронической патологии;
• детям, приехавшим из-за границы;
• в случае эпидемии;
• при наличии хронической диареи.
Таким образом, основные положения руководства ESPGHAN (2014) по диагностикe ОГЭ заключаются в следующем [15–17]:
• для установки диагноза «острый гастроэнтерит» обычно не требуется проведение специальных диагностических тестов (уровень доказательности Vb, D);
• основные гематологические маркеры не могут служить диагностическим маркером для дифференцировки вирусной и бактериальной диареи. С-реактивный белок и прокальцитониновый тест не рекомендуются в качестве диагностического маркера бактериальной кишечной инфекции (уровень доказательности Vb, D);
• биохимические тесты для оценки дегидратации не являются точными, они используются для приблизительной оценки состояния больного (уровень доказательности III,C);
• единственный лабораторный анализ, который может быть полезен для оценки степени дегидратации более 5%, – это определение содержания бикарбонатов в сыворотке крови (уровень доказательности III, C);
• содержание электролитов крови нужно определять всем детям с тяжелой дегидратацией (перед инфузионной терапией и во время нее), т. к. гипо- и гипернатриемия могут влиять на скорость введения инфузионных растворов (уровень доказательности Va, D);
• эндоскопическое и гистологическое исследования проводятся только для дифференциальной диагностики ОГЭ и воспалительного заболевания кишечника (уровень доказательности Vb, D).
С учетом вариабельности клинической картины, низкой информативности бактериологического исследования, а также недостаточной специфичности результатов дополнительных лабораторных исследований необходим единый алгоритм ведения детей с ОГЭ, в основе которого будет оценка тяжести состояния ребенка, что поможет врачу выработать тактику лечения. Основополагающим фактором, определяющим тяжесть состояния ребенка при ОГЭ, является степень дегидратации. Безусловно, лучший критерий степени обезвоживания – процент потери веса по сравнению с исходной массой. В соответствии с рекомендациями ВОЗ, в зависимости от степени обезвоживания пациенты могут быть разделены на 3 группы [18, 19]:
1) дегидратация минимальная или отсутствует (потеря менее 3% от первоначальной массы тела);
2) дегидратация легкой и средней степени тяжести (потеря 3–9% от первоначальной массы тела);
3) дегидратация тяжелая (потеря более 9% от первоначальной массы).
К сожалению, данные о массе ребенка до начала заболевания не всегда доступны педиатру и родителям, поэтому на практике приходится ориентироваться на клинические проявления заболевания. ESPGHAN рекомендует использовать клиническую шкалу дегидратации (Clinical Dehydration Scale – CDS) в качестве простого метода оценки степени тяжести заболевания, где 0 баллов – дегидратация отсутствует, от 1 до 4 баллов – легкая дегидратация, 5–8 баллов соответствуют дегидратации средней и тяжелой степени тяжести (табл. 4) [20]. Тяжесть заболевания рекомендуется оценивать по модифицированной шкале VESIKARI [21], где легкая степень тяжести соответствует 0–8 баллам, от 9 до 11 баллов – средняя степень, более 11 – тяжелая степень тяжести болезни (табл. 5).
Основные положения руководства ESPGHAN (2014) для оценки дегидратации и тяжести заболевания [22–24]:
• лучшим критерием оценки степени обезвоживания является процент потери веса по сравнению с исходным (уровень доказательности Vb, D);
• определение степени тяжести дегидратации необходимо для разработки тактики терапии (уровень доказательности I, A);
• клиническими маркерами дегидратации могут служить данные о частоте мочеиспускания ребенка (если диурез не снижен, то нет данных о дегидратации) (уровень доказательности Vb);
• наиболее полезным индивидуальным диагностическим критерием оценки степени тяжести дегидратации служат: время наполнения капилляров, время расправления кожной складки и частота дыхания (уровень доказательности III, C) (табл. 6).
Лечение. Ключевым моментом терапии пациентов с ОГЭ вне зависимости от этиологии заболевания является пероральная регидратация растворами с осмолярностью 225–260 м/осм/л, которые должны быть назначены как можно раньше.
Данные систематического обзора, включающие результаты 16 рандомизированных клинических исследований (РКИ) с участием 1545 детей в возрасте до 15 лет с клиническим диагнозом «острый гастроэнтерит», показали, что при своевременном проведении оральной регидратации достоверно реже отмечаются побочные эффекты дегидратации и возникает необходимость проведения в/в регидратации (RR 0,36; 95% ДИ 0,14–0,89), а также значительно сокращается продолжительность пребывания в стационаре (в среднем на 21 ч) [25].
Основные положения руководства ESPGHAN (2014) по пероральной регидратации:
• пероральная регидратация низкоосмолярными оральными регидратационными растворами (ОРР) должна использоваться в качестве первой линии терапии у детей с ОГЭ (легкая и среднетяжелая формы) (уровень доказательности I, А);
• если проведение пероральной регидратации не представляется возможным, ее нужно осуществлять через назогастральный зонд, что является столь же эффективным (уровень доказательности I, А);
• раннее начало пероральной регидратации уменьшает необходимость проведения в/в инфузионной терапии (уровень доказательности I, А);
• охлажденный или замороженный раствор, гелеобразный раствор для пероральной регидратации переносится лучше (уровень доказательности III, C);
• возможно добавление ароматизирующих веществ или меда в раствор для пероральной регидратации; однако недостаточно доказательств для рекомендации обогащенных пероральных регидратационных растворов в терапии ОГЭ (уровень доказательности II, B).
Современные рекомендации ESPGHAN (2014) по составу ОРР отличаются от ранее предложенных ВОЗ, особенно это касается осмолярности растворов и содержания натрия (табл. 7).
Данные метаанализа, включавшего результаты 8 РКИ, в которых проводилась оценка эффективности стандартного ОРР, рекомендованного ВОЗ, с ОРР со сниженной осмолярностью, показал, что инфузионной терапии потребовалось достоверно меньше (RR 0,59; 95% ДИ 0,45–0,79). У этих детей не наблюдалась гипонатриемия по сравнению с детьми, которые принимали гипоосмолярный ОРР, рекомендованный ВОЗ [26]. В России выбор ОРР невелик, в аптечном ассортименте они представлены непостоянно. Состав некоторых ОРР приведен в таблице 8.
Рекомендации руководства ESPGHAN (2014) по питанию детей с ОГЭ включают следующие положения:
• рекомендуется раннее возобновление кормления после регидратационной терапии. Необходимы дальнейшие исследования для определения продолжительности прекращения кормления и влияния на частоту и консистенцию стула, физическое развитие (уровень доказательности I, A);
• не следует прекращать кормление детей более чем на 4–6 ч после начала регидратации (уровень доказательности I, A);
• грудное вскармливание должно быть продолжено во время течения ОГЭ и регидратации (уровень доказательности III, C);
• безлактозные смеси рекомендуются только детям до 5 лет, находящимся в стационаре (уровень доказательности I, A);
• применение сухарей, риса в питании детей с ОГЭ не рекомендуется, т. к. эффективность данной диеты не была изучена (уровень доказательности I, A);
• напитки с высоким содержанием сахара не рекомендуются при ОГЭ (уровень доказательности III, C).
По данным метаанализа (4 РКИ), раннее возобновление кормления после регидратации детей с ОГЭ сокращает продолжительность диареи на 0,43 дня (95% ДИ 0,74–0,12) [27].
Эффективность применения медикаментозной терапии при ОГЭ у детей продолжает обсуждаться. Основные положения медикаментозной терапии в руководстве ESPGHAN представлены ниже:
• противорвотные препараты не рекомендуется использовать при ОГЭ (уровень доказательности II, B);
• применение противорвотного средства ондансетрона может быть эффективным у детей со рвотой, однако нужны дополнительные исследования для оценки безопасности данного препарата (уровень доказательности II, B) [28];
• лоперамид не рекомендуется в лечении ОГЭ у детей (уровень доказательности II, B) [29];
• смектит диоктаэдрический может быть использован в терапии ОГЭ (уровень доказательности II, B) [30];
• смектит совместно с Lactobacillus GG (LGG) или только LGG в равной степени эффективны в терапии ОГЭ у детей раннего возраста (уровень доказательности II, B);
• другие сорбенты не рекомендуются в терапии ОГЭ (уровень доказательности III, C);
• рацекадотрил может быть использован в терапии ОГЭ, поскольку уменьшает секрецию слизистой кишечника и увеличивает абсорбцию (уровень доказательности II, B) [31];
• висмута субсалицилат не рекомендуется у детей с ОГЭ (уровень доказательности III, C);
• микроэлемент цинк рекомендуется включить в схемы лечения ОГЭ в развивающихся странах (уровень доказательности I, A).
Пробиотики в лечении ОГЭ (табл. 9) [32–35]:
• активная терапия пробиотиками совместно с оральной регидратацией уменьшает продолжительность и выраженность симптомов гастроэнтерита, однако рекомендуются не все пробиотики (уровень доказательности I, A);
• новые научные данные показывают возможность сокращения продолжительности основных клинических симптомов ОГЭ при приеме пробиотиков (уровень доказательности I, A);
• пробиотики Lactobacillus GG и Saccharomyces boulardii могут быть использованы совместно с оральной регидратацией у детей с ОГЭ (уровень доказательности I, A).
Российскими исследователями проведен ряд работ, указывающих на целесообразность стартовой терапии, предусматривающей использование сочетания пероральной регидратации, пробиотиков и сорбентов при ОГЭ вирусной этиологии. Ретроспективный анализ эффективности терапии такого ОГЭ продемонстрировал, что наиболее эффективной стартовой терапией ОГЭ, вызванного аденовирусом, является сочетание пероральной регидратации с сорбентами и пробиотиками [36]. У детей с ОГЭ норовирусной этиологии основные симптомы болезни быстро купировались при сочетании пероральной регидратации и пробиотиков [37].
К сожалению, в России и Азербайджане по-прежнему при ОГЭ педиатры в 70% случаев шаблонно, вне зависимости от этиологии диареи, назначают антибиотики. В ряде работ указывается на нецелесообразность назначения антибактериальной терапии при ОГЭ вирусной этиологии [36, 37]. Показано, что ведение больных с водянистой диареей без использования антибиотиков вполне оправданно, а назначение антибактериальной терапии по поводу сопутствующей бактериальной инфекции не влияет на сроки купирования ОГЭ.
Эмпирическая антибактериальная терапия не рекомендуется (табл. 10), поскольку:
• недостаточно данных об эффективности антибиотиков при ОГЭ (бактериальном);
• установлено несоответствие восприимчивости возбудителей in vivo и in vitro;
• в мире отмечается глобальный рост бактериальной резистентности к антибиотикам;
• есть риск индуцирования состояния здорового носительства в случае инфекции Salmonella.
Таким образом, в руководстве ESPGHAN (2014) выдвинуто следующее положение о необходимости проведения антибактериальной терапии [38–40]:
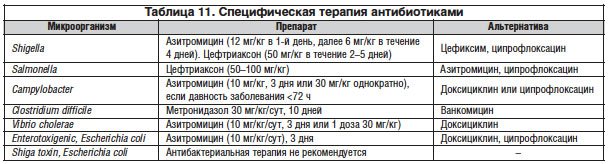
• антибактериальная терапия рекомендуется при бактериальном гастроэнтерите: Shigella spp., Campylobacter spp., Salmonella enterica (уровень доказательности Va, B);
• детям с водянистой диареей антибактериальная терапия не назначается, если нет эпидемиологических данных о возможной холерной инфекции (уровень доказательности Vb, D);
• кровянистая диарея с/без лихорадки может указать на шигеллез или сальмонеллез (уровень доказательности Va, D);
• предпочтительно применение оральных антибиотиков.
Парентеральное назначение антибиотиков рекомендуется:
• при невозможности орального приема (неукротимая рвота, ступор);
• при тяжелой токсемии, бактериемии или подозрении на бактериемию;
• пациентам с иммунодефицитом, если гастроэнтерит сопровождается лихорадкой;
• детям до 3-месячного возраста с лихорадкой (табл. 11).
Антимикробная терапия паразитарного гастроэнтерита:
• антимикробная терапия в основном не назначается, однако паразитарная инфекция может влиять на тяжесть состояния (уровень доказательности III, C);
• лечить тяжелые формы лямблиоза рекомендуется метронидазолом, альбендазолом или тинидазолом (уровень доказательности III,C);
• лечение криптоспоридиоза нитазоксанидом нужно проводить только у детей с иммунодефицитом (уровень доказательности III,C);
• в терапии амебиазного колита применяется метронидазол (уровень доказательности III, C).
В некоторых отечественных публикациях можно встретить рекомендации по использованию ферментотерапии, противовирусных препаратов. Однако европейские эксперты данные препараты не рекомендуют к использованию, учитывая отсутствие убедительных доказательств их эффективности.






Литература
1. Горелов А.В., Милютина Л.Н., Усенко Д.В. Клинические рекомендации по диагностике и лечению ОКИ у детей. М., 2005.106 с.
2. Guarino A., Albano F., Ashkenazi Sh., Gendrel D., Hoekstra J.H., Shamir R., Szajewska H. European Society for Paediatric Gastroenterology, Hepatology, and Nutrition/European Society for Paediatric Infectious Diseases Evidence-based Guidelines for the Management of Acute Gastroenteritis in Children in Europe // Journal of Pediatric Gastroenterology and Nutrition. 2008. Vol. 46. Р. 81–184.
3. Baqui A.H., Black R.E., Yunus M. et al. Methodological issues in diarrhoeal diseases epidemiology: definition of diarrhoeal episodes // Int J Epidemiol. 1991. Vol. 20. Р. 1057–1063.
4. De Wit M.A., Koopmans M.P., Kortbeek L.M. et al. Etiology of gastroenteritis in sentinel general practices in the Netherlands // Clin Infect Dis. 2001. Vol. 33. Р. 280–288.
5. Vesikari T., Uhari M., Renko M., Hemming M., Salminen M., Torcel-Pagnon L., Bricout H., Simondon F. Impact and effectiveness of RotaTeq® vaccine based on 3 years of surveillance following introduction of a rotavirus immunization program in Finland // Pediatr Infect Dis J. 2013 Dec. Vol. 32 (12). Р. 1365–1373.
6. Zhirakovskaia E.V., Maleev W., Klemashova W., Bodnev S.A., Korsakova T.G., Tiknov A.L.. Rotaviruses in younger children in Novosibirsk in 2005-2007:detection and genotyping // Zh microbial Epidemiolog Immunbiol. 2008. Vol. 4. Р. 12–16.
7. Albano F., Bruzzese E., Bella A. et al. Rotavirus and not age determines gastroenteritis severity in children: a hospital-based study // Eur J Pediatr. 2007. Vol. 166. Р. 241–247.
8. Quigley M.A., Kelly Y.J., Sacker A. Breastfeeding and hospitalization for diarrheal and respiratory infection in the United Kingdom Millennium Cohort Study // Pediatrics. 2007. Vol. 119. Р. 837–842.
9. Rosenfeldt V., Vesikari T., Pang X.L. et al. Viral etiology and incidence of acute gastroenteritis in young children attending day-care centers // Pediatr Infect Dis J. 2005. Vol. 24. Р. 962–965.
10. Louhiala P.J., Jaakkola N., Ruotsalainen R. et al. Day-care centers and diarrhea: a public health perspective // J Pediatr. 1997. Vol. 131. Р. 476–479.
11. Ethelberg S., Olesen B., Neimann J. et al. Risk factors for diarrhea among children in an industrialized country // Epidemiology. 2006. Vol. 17. Р. 24–30.
12. Uhnoo I., Olding-Stenkvist E., Kreuger A. Clinical features of acute gastroenteritis associated with rotavirus, enteric adenoviruses and bacteria // Arch Dis Child. 1986. Vol. 61. Р. 732–738.
13. Jonas A., Yahav J., Soudry A. Clinical features of viral and bacterial gastroenteritis in hospitalized children // Isr J Med Sci. 1982. Vol. 18. Р. 753–759.
14. Liu L.J., Yang Y.J., Kuo P.H. et al. Diagnostic value of bacterial stool cultures and viral antigen tests based on clinical manifestations of acute gastroenteritis in pediatric patients // Eur J Clin Microbiol Infect Dis. 2005. Vol. 24. Р. 559–561.
15. Borgnolo G., Barbone F., Guidobaldi G. et al. C-reactive protein in viral and bacterial gastroenteritis in childhood // Acta Paediatr. 1996. Vol. 85. Р. 670–674.
16. Cadwgan A.M., Watson W.A., Laing R.B. et al. Presenting clinical features and C-reactive protein in the prediction of a positive stool culture in patients with diarrhoea // J Infect. 2000. Vol. 41. Р. 159–161.
17. Korczowski B., Szybist W. Serum procalcitonin and C-reactive protein in children with diarrhoea of various aetiologies // Acta Paediatr. 2004. Vol. 93. Р. 169–173.
18. The treatment of diarrhoea—a manual for physicians and other senior health workers Geneva, Switzerland: World Health Organization, 2005.
19. King C.K., Glass R., Bresee J.S. et al. Managing acute gastroenteritis among children: oral rehydration, maintenance and nutritional therapy // MMWR Recomm Rep. 2003. Vol. 52. Р. 1–16.
20. Fortin J., Parent M.A. Dehydration scoring system for infants // J Trop Pediatr Environ Child Health. 1978. Vol. 24. Р. 110–114.
21. Ruuska T., Vesikari T. Rotavirus disease in Finnish children: use of numerical scores for clinical severity of diarrhoeal episodes // Scand J Infect Dis. 1990. Vol. 22. Р. 259–267.
22. Steiner M.J., DeWalt D.A., Byerley J.S. Is this child dehydrated? // JAMA. 2004. Vol. 291. Р. 2746–2754.
23. Duggan C., Refat M., Hashem M. et al. How valid are clinical signs of dehydration in infants? // J Pediatr Gastroenterol Nutr. 1996. Vol. 22. Р. 56–61.
24. Saavedra J.M., Harris G.D., Li S. et al. Capillary refilling (skin turgor) in the assessment of dehydration // Am J Dis Child. 1991. Vol. 145. Р. 296–298.
25. Fonseca B.K., Holdgate A., Craig J.C. Enteral vs intravenous rehydration therapy for children with gastroenteritis: meta-analysis of randomized controlled trials // Arch pediatr Adolesc Med. 2004. Vol. 158. Р. 483–490.
26. Hahn S., Kim S., Garner P. Reduced osmolarity oral rehydration solution for treating dehydration caused by acute diarrhoea in children // Cochrane Database Syst Rev. 2002. CD002847.
27. Walker-Smith J.A., Sandhu B.K., Isolauri E. et al. Guidelines prepared by the ESPGAN Working Group on Acute Diarrhoea. Recommendations for feeding in childhood gastroenteritis. European Society of Pediatric Gastroenterology and Nutrition // J Pediatr Gastroenterol Nutr. 1997. Vol. 24. Р. 619–620.
28. Alhashimi D., Alhashimi H., Fedorowicz Z. Antiemetics for reducing vomiting related to acute gastroenteritis in children and adolescents // Cochrane Database Syst Rev. 2006. CD005506.
29. Li S.T., Grossman D.C., Cummings P. Loperamide therapy for acute diarrhea in children: systematic review and meta-analysis // PLoS Med. 2007. Vol. 4. Р. 98.
30. Szajewska H., Dziechciarz P., Mrukowicz J. Meta-analysis: smectite in the treatment of acute infectious diarrhoea in children // Aliment Pharmacol Ther. 2006. Vol. 23. Р. 217–227.
31. Cojocaru B., Bocquet N., Timsit S. et al. Effect of racecadotril in the management of acute diarrhea in infants and children [in French] // Arch Pediatr. 2002. Vol. 9. Р. 774–779.
32. Szajewska H., Skorka A., Ruszczynski M. et al. Meta-analysis: Lactobacillus GG for treating acute diarrhoea in children // Aliment Pharmacol Ther. 2007. Vol. 25. Р. 871–881.
33. Huang J.S., Bousvaros A., Lee J.W. et al. Efficacy of probiotic use in acute diarrhea in children: a meta-analysis // Dig Dis Sci. 2002. Vol. 47. Р. 2625–2634.
34. Van Niel C.W., Feudtner C., Garrison M.M. et al. Lactobacillus therapy for acute infectious diarrhea in children: a meta-analysis // Pediatrics. 2002. Vol. 109. Р. 678–684.
35. Allen S.J., Okoko B., Martinez E. et al. Probiotics for treating infectious diarrhoea. Cochrane Database Syst Rev 2004. CD003048.
36. Дорошина Е.А. Клинико-эпидемиологические особенности и вопросы терапии норовирусной инфекции у детей: Автореф. дисс….к.м.н. М., 2010. 113 с.
37. Козина Г.А. Клинико-эпидиомологические особенности и вопросы терапии острых кишечных инфекций аденовирусной этиологии у детей: Автореф. дисс…. к.м.н. М., 2010. 153 с.
38. Basualdo W., Arbo A. Randomized comparison of azithromycin versus cefixime for treatment of shigellosis in children // Pediatr Infect Dis J. 2003. Vol. 22. Р. 374–377.
39. Miron D., Torem M., Merom R. et al. Azithromycin as an alternative to nalidixic acid in the therapy of childhood shigellosis // Pediatr Infect Dis J. 2004. Vol. 23. Р. 367–368.
40. Martin J.M., Pitetti R., Maffei F. et al. Treatment of shigellosis with cefixime: two days vs. five days // Pediatr Infect Dis J. 2000. Vol. 19. Р. 522–526.











