Введение
Наследственные нарушения окисления жирных кислот (МКБ-10: Е71.3) — группа наследственных ферментопатий, обусловленных биаллельными мутациями в генах, кодирующих энзимы каскада митохондриального β-окисления жирных кислот. Клинические проявления заболеваний этой группы крайне вариабельны. С точки зрения патогенеза недостаточная продукция кетоновых тел в сочетании с ингибированием глюконеогенеза, из-за низкого уровня ацил-КоА, во время катаболических состояний (голодание, инфекции и т. д.) может вызывать типичные проявления в виде гипокетотической гипогликемии, сопровождающейся симптомами печеночной недостаточности и гипераммониемией. Дебют заболевания, как правило, происходит в позднем младенчестве. Накопление токсичных длинноцепочечных ацилкарнитинов, особенно при нарушениях окисления длинноцепочечных жирных кислот, может вызвать тяжелый неонатальный лактат-ацидоз, кардиомиопатию и гепатопатию. Более мягкие формы могут дебютировать в позднем возрасте патологией скелетных мышц в виде мышечной слабости, болей и рецидивирующего рабдомиолиза [1].
К заболеваниям с нарушением окисления жирных кислот относят ряд редких нозологических форм (их частота составляет от 1–9:100 000 до 1:1 000 000 новорожденных):
дефицит ацил-КоА-дегидрогеназы жирных кислот с длинной углеродной цепью (deficiency of long-chain 3-hydroxyl-CoA dehydrogenase, LCHAD) —
наследственное аутосомно-рецессивное заболевание, обусловленное биаллельными мутациями в гене HADHA, характеризующееся ранней кардиомиопатией, гипогликемией, нейропатией, пигментной дегенерацией сетчатки и, иногда, внезапной смертью;
недостаточность митохондриального трифункционального белка (mitochondrial trifunctional protein deficiency, MTPD) — аутосомно-рецессивное заболевание, обусловленное биаллельными мутациями в генах HADHA и HADHВ. Выделяют следующие клинические формы: неонатальную кардиомиопатическую, неонатальную с поражением печени и легкую с поздней манифестацией и преимущественным поражением скелетных мышц;
дефицит ацил-КоА-дегидрогеназы жирных кислот с очень длинной углеродной цепью (deficiency of very long-chain acyl-CoA dehydrogenase, VLCAD) — редкое наследственное аутосомно-рецессивное заболевание, обусловленное мутациями гена ACADVL. Клинически это заболевание можно разделить
на 3 формы: 1) тяжелую раннюю форму с высокой частотой кардиомиопатии и высокой смертностью; 2) промежуточную форму с началом в детском возрасте, обычно с гипокетотической гипогликемией и более благоприятным исходом; 3) взрослую миопатическую форму с изолированным поражением скелетных мышц, рабдомиолизом и миоглобинурией, которая наблюдается после физической нагрузки или голодания;
дефицит карнитин-пальмитоилтрансферазы I, II (carnitine palmitoyltransferase I, II deficiency, СРТ I, II) — аутосомно-рецессивные заболевания, обусловленные биаллельными мутациями в генах СРТI и СРТII. Выделяют генерализованную младенческую и мышечную формы. Генерализованная младенческая форма дебютирует в неонатальном периоде или на первом году жизни. У больных с летальной неонатальной формой наблюдаются респираторный дистресс-синдром, кардиомегалия, гепатомегалия, печеночная недостаточность. Мышечная форма манифестирует приступами мышечных болей, мышечной слабости и миоглобинурией как реакцией на физическую нагрузку;
дефицит карнитин-ацилкарнитинтранслоказы (carnitine-acylcarnitine translocase deficiency, CACTD) — аутосомно-рецессивное заболевание, обусловленное биаллельными мутациями в гене SLC25A20. Клинические симптомы заболевания включают неврологические нарушения, кардиомиопатию, нарушение сердечного ритма, миопатию и гепатопатию. Дебют заболевания приходится, как правило, на неонатальный возраст с быстро прогрессирующим ухудшением состояния и высокой смертностью. Редко встречаются более поздние, мягкие клинические формы [2].
Основными методами лабораторной диагностики этих заболеваний являются физико-химические: тандемная масс-спектрометрия (МС/МС) с определением уровня специфических ацилкарнитинов и общего карнититина, а также газовая хроматография мочи с определением в ней концентрации дикарбоновых кислот [1, 3].
Для подтверждения диагноза и проведения медико-генетического консультирования выполняется молекулярно-генетическое исследование.
Терапия пациентов с наследственным нарушением обмена жирных кислот с длинной и очень длинной углеродной цепью носит комплексный характер. Она основана, главным образом, на коррекции метаболических нарушений с помощью диеты. Важной задачей диетотерапии являются профилактика голодания, предупреждение гипогликемии и минимально допустимое снижение поступления с пищей патогенетически значимых жирных кислот (в данном случае жирных кислот с длинной и очень длинной углеродной цепью) и их источников [1, 3, 4].
Всем пациентам независимо от возраста необходим индивидуальный рацион, желательно с использованием специализированных смесей с жировым компонентом, представленным среднецепочечными триглицеридами, в т. ч. продукт «Моноген» [4].
Исследуемый продукт (ИП) «Моноген» предназначен для диетического лечебного питания при нарушениях, требующих снижения потребления длинноцепочечных триглицеридов (ДЦТ) и высокого уровня потребления среднецепочечных триглицеридов (СЦТ), таких как дефекты окисления длинноцепочечных жирных кислот: недостаточность длинноцепочечной ацил-КоА-дегидрогеназы жирных кислот (LCHAD), недостаточность митохондриального трифункционального белка (MTPD), недостаточность очень длинноцепочечной ацил-КоА-дегидрогеназы жирных кислот (VLCAD), дефицит карнитин-пальмитоилтрансферазы I, II (СРТ I, II), дефицит карнитин-ацилкарнитинтранслоказы (CACT).
Продукт «Моноген» — полноценная по составу сухая смесь, содержащая сывороточные белки, с низким содержанием ДЦТ и высоким содержанием среднецепочечных триглицеридов.
Цель исследования: оценить эффективность и переносимость специализированного продукта диетического лечебного питания «Моноген» при нарушениях обмена жирных кислот с длинной и очень длинной углеродной цепью у детей.
Материал и методы
На базе ФГБНУ «МГНЦ» в амбулаторных условиях проведено открытое проспективное неконтролируемое исследование.
В исследование включены 5 девочек с подтвержденным диагнозом «нарушение митохондриального β-окисления жирных кислот». У одной девочки диагностирован дефицит ацил-КоА-дегидрогеназы жирных кислот с очень длинной углеродной цепью, обусловленный биаллельными мутациями в гене ACADVL, у четырех — дефицит ацил-КоА-дегидрогеназы жирных кислот с длинной углеродной цепью, обусловленный биаллельными мутациями в гене HADHA.
Родители или иные законные представители детей предоставили письменное информированное согласие на участие в исследовании.
Возраст детей на момент включения в исследование в среднем составил 35±14 мес. (от 14 до 49 мес.). Родились доношенными четыре девочки, одна девочка родилась на сроке 30 нед. с антропометрическими показателями, соответствующими гестационному возрасту. Средняя масса доношенных детей при рождении составила 2840±417 г, длина тела — 48±2,38 см. Первые признаки заболевания у двоих детей появились в первые сутки жизни, еще у двоих — в 7 мес. Одной девочке диагноз установлен на доклинический стадии по результатам расширенного неонатального скрининга, проводимого в г. Москве. Среди симптомов заболевания отмечались трудности вскармливания (n=1), мышечная гипотония (n=1), судороги (n=2), летаргия (n=2) вплоть до комы (n=1), гипогликемия (n=4). Снижение уровня глюкозы крови было выраженным — до 0,5±0,12 ммоль/л (норма 3,3–5,5 ммоль/л). У одного ребенка диагностирована кардиомиопатия.
При проведении МС/МС выявлено повышение уровня специфических ацилкарнитинов: у четырех детей с дефицитом ацил-КоА-дегидрогеназы жирных кислот с длинной углеродной цепью были повышены: С16-ОН до 0,65±0,45 мкМ/л (норма 0–0,18 мкМ/л), С18-ОН до 0,64±0,47 мкМ/л (норма 0–0,18 мкМ/л) и С18:1-ОН до 0,88±0,41 мкМ/л (норма 0–0,18 мкМ/л). У ребенка с дефицитом ацил-КоА-дегидрогеназы жирных кислот с очень длинной углеродной цепью было повышено содержание С14:1 до 2,806 мкМ/л (норма 0–0,41 мкМ/л) и С14 до 1,19 мкМ/л (норма 0–0,515 мкМ/л).
Диагноз детям был установлен в короткие сроки, в среднем не более 3 нед. после появления симптомов заболевания, и подтвержден молекулярно-генетическим методом. Патогенетическая терапия была начата сразу после установления диагноза.
Для оценки эффективности ИП определяли уровни специфических ацилкарнитинов в крови. Оценка переносимости основывалась на частоте и тяжести развившихся в ходе исследования нежелательных явлений, в т. ч. аллергических реакций, а также наличии изменений показателей жизненно важных функций в сравнении с исходным уровнем. Анализировалась удовлетворенность врачом и родителями пациентов проводимой терапией с помощью анкетирования.
Длительность исследования составила 30±2 дня, за это время было предусмотрено два визита к врачу-исследователю: визит 1 — включение в исследование; визит 2 — через 30 дней (дополнительные визиты назначались по показаниям). В ходе визитов проводили сбор информации (жалобы, анамнез, данные физикального осмотра с оценкой физического развития, анализ медицинской документации), а также определяли уровень ацилкарнитинов в крови.
Сбор и анализ жалоб, анамнеза жизни и заболевания проводили путем непосредственного опроса пациентов или их родителей, изучения медицинской документации (историй болезни, амбулаторных карт и пр.). Оценка соматического статуса включала в себя осмотр с анализом общего состояния и самочувствия пациентов, состояния слизистого и кожного покровов, функций отдельных органов и систем: сердечно-сосудистой, дыхательной, мочевыводящей, желудочно-кишечного тракта и др. Оценивали наличие/отсутствие диспепсических явлений, аллергических реакций, отказов от употребления ИП.
Анализ физического развития проводили с использованием модулей программы WHO Anthroplus 2009 на основании оценки антропометрических показателей, массы и длины тела, которые измеряли с помощью стандартизированных электронных весов и ростомеров. Показатели Z-scores массы тела к возрасту, длины тела к возрасту оценивали перед началом диетического лечения и на фоне диетического лечения ИП. Оценка физического развития наблюдаемых пациентов базировалась на диагностике отклонений величин антропометрических показателей от медианы стандартной популяции (Z-scores). Согласно стандартам WHO Anthroplus 2009 средневозрастными показателями Z-score массы и длины тела считали показатели в пределах ±2SD (standard deviation — стандартное отклонение).
Оценку неврологического статуса и психомоторного развития выполняли по методикам, используемым для определения уровня эмоционального, психического, моторного, речевого развития детей [5].
Детям при первом визите был выдан ИП в количестве, необходимом на весь период исследования.
Расчет питания осуществляли в соответствии с клиническими рекомендациями Минздрава России [4]. Для назначения и коррекции диетотерапии проводили анализ фактического питания, включая режим питания, разовый и суточный объем, характеристику съеденной пищи. Оценивали пищевую ценность лечебных рационов с подсчетом основных нутриентов (белков, жиров и углеводов). Сравнение проводили с Нормами физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации.
Определение уровней специфических ацилкарнитинов крови проводили дважды: до начала лечения и при его завершении. Для анализа использовали периферическую кровь, взятую на карточку-фильтр (форма № 903). Забор образцов крови осуществляли утром натощак не ранее чем через 3 ч после еды. Анализ осуществлялся методом MC/MC.
Удовлетворенность врачом и пациентом (родителем) результатами диетотерапии оценивали методом анкетирования с помощью 5-балльной шкалы, в которой 1 балл соответствует оценке «Полностью неудовлетворен», а 5 — оценке «Полностью удовлетворен». Основными критериями оценки были: удовлетворенность проводимым лечением, удовлетворенность быстротой уменьшения симптомов и удовлетворенность общим состоянием здоровья на фоне проводимого лечения. Суммировались баллы по трем критериям, максимальный балл соответствовал 15, минимальный — 3.
Статистическую обработку полученных данных проводили с помощью стандартных методов статистической обработки и пакета компьютерных программ Statistica, Microsoft office. Показатели представлены в виде средней (M) и стандартного отклонения (SD). Достоверность различий между группами определяли с помощью непараметрического критерия Манна — Уитни. Различия считали статистически значимыми при р<0,05.
Результаты и обсуждение
В связи с расширением неонатального скрининга огромное значение имеет и расширение нутритивных возможностей в педиатрической практике для проведения специализированной диетотерапии детей с нарушениями обмена жирных кислот с длинной и очень длинной углеродной цепью. Известно, что дети с дефицитом ацил-КоА-дегидрогеназы жирных кислот с длинной и очень длинной углеродной цепью нуждаются в дополнительной дотации СЦТ, и в рационе на них должно приходиться около 15–25% от общего количества калорий [6, 7]. Обычные смеси, предназначенные для питания детей с нарушениями функционирования желудочно-кишечного тракта и обогащенные СЦТ, не могут обеспечить необходимую потребность при нарушениях митохондриального β-окисления жирных кислот. Это первое исследование по оценке эффективности и переносимости специализированного продукта «Моноген» при нарушениях обмена жирных кислот с длинной и очень длинной углеродной цепью у детей.
В связи с низкой частотой заболеваний данной группы в исследование было включено лишь небольшое число пациентов.
На протяжении 30±2 дня все пациенты успешно принимали ИП. Диспепсических явлений, нарушений стула, аллергических реакций и других нежелательных явлений в ходе всего исследования не зарегистрировано ни у одного ребенка. Несколько улучшились показатели физического развития: Z-score массы тела к возрасту на визите 1 составил -0,24±1,52 SD, на визите 2 — -0,08±1,48 SD; Z-score роста к возрасту — -1,13±1,39 и -0,81±1,53 соответственно.
Отрицательной динамики показателей соматического и неврологического статуса не было ни в одном наблюдении. У одной девочки купировались срыгивания, отмеченные на визите 1.
Уровень глюкозы крови до и после назначения ИП был нормальным и составил соответственно 4,26±0,42 ммоль/л и 4,52±0,38 ммоль/л (норма 3,3–5,5 ммоль/л). Показатель рН крови находился в пределах референсных значений значений.
Со стороны специфических биохимических маркеров (ацилкарнитинов) у детей с дефицитом ацил-КоА-дегидрогеназы жирных кислот с длинной углеродной цепью установлено некоторое снижение средних величин, все показатели находились в пределах допустимых значений (табл. 1). При сравнении этих показателей в начале исследования и при его завершении статистически значимого различия не получено (р=0,5). Это обусловлено тем, что дети и до включения в исследование получали ИП, но нерегулярно.
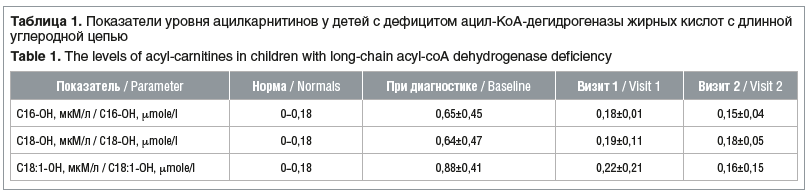
У ребенка с дефицитом ацил-КоА-дегидрогеназы жирных кислот с очень длинной углеродной цепью концентрация С14:1 на визите 1 составила 0,4 мкМ/л, на визите 2 — 0,19 мкМ/л (норма 0–0,41 мкМ/л); концентрация С14:1 оставалась в норме и составила 0,19 мкМ/л (норма 0–0,515 мкМ/л) до и после применения ИП.
Жесткое ограничение в рационе ДЦТ может привести к их дефициту и развитию патологии сетчатки. В связи с этим ИП содержит эссенциальные жирные кислоты, чтобы обеспечить физиологическую потребность в них. Ни у одного пациента патологии сетчатки выявлено не было.
Удовлетворенность родителей (законных представителей) детей и врача проводимым лечением соответствовала высоким показателям (14,4±0,89 и 13,4±2,19 балла соответственно).
Заключение
Настоящее исследование показало высокую клиническую эффективность и переносимость специализированного продукта диетического лечебного питания «Моноген» при нарушениях обмена жирных кислот с длинной и очень длинной углеродной цепью у детей, что выразилось в снижении уровней специфических ацилкарнитинов после начала лечения и поддержании их в пределах безопасных значений. Нежелательных явлений не возникло ни у одного ребенка. Физическое развитие пациентов соответствовало средневозрастным показателям. Более того, показана высокая удовлетворенность проводимой терапией как со стороны родителей (законных представителей) детей, так и со стороны врача. Таким образом, ИП «Моноген» полностью соответствует требованиям к диетотерапии больных детей, страдающих наследственными нарушениями обмена жирных кислот с длинной и очень длинной углеродной цепью, и может быть рекомендован для включения в схемы их лечения.
Сведения об авторах:
Наталия Александровна Семенова — к.м.н., врач-генетик высшей категории, старший научный сотрудник ФГБНУ «МГНЦ»; 115522, Россия, г. Москва, ул. Москворечье, д. 1; ORCID iD 0000-0001-7041-045X.
Елена Андреевна Шестопалова — врач-генетик высшей категории ФГБНУ «МГНЦ»; 115522, г. Москва, ул. Москворечье, д. 1; ORCID iD 0000-0003-2151-6025.
Сергей Иванович Куцев — д.м.н., профессор, член-корреспондент РАН, директор ФГБНУ «МГНЦ»; 115522, Россия, г. Москва, ул. Москворечье, д. 1; ORCID iD 0000-0002-3133-8018.
Контактная информация: Семенова Наталия Александровна, e-mail: Semenova@med-gen.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов: исследование проведено при поддержке компании Nutricia. Статья поступила 10.11.2020, поступила после рецензирования 03.12.2020, принята в печать 28.12.2020.











