–Т —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ –љ–∞–Ј–≤–∞–љ–Є—П –≥—А—Г–њ–њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ—А—П–Љ–Њ —Г–Ї–∞–Ј—Л–≤–∞—О—В –љ–∞ –Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П. –Ґ–∞–Ї, –≤ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є–Є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —В–∞–Ї–Є–µ —В–µ—А–Љ–Є–љ—Л, –Ї–∞–Ї α––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л, β––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л, –±–ї–Њ–Ї–∞—В–Њ—А—Л —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞, –Є–љ–≥–Є–±–Є—В–Њ—А—Л –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–њ—А–µ–≤—А–∞—Й–∞—О—Й–µ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ –Є —В.–і. –Я—А–Є —Н—В–Њ–Љ –Ј–∞—П–≤–ї–µ–љ–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –≥—А—Г–њ–њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞–њ—А—П–Љ—Г—О —Б–≤—П–Ј–∞–љ —Б –Є—Е —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ. –Э–∞–њ—А–Є–Љ–µ—А, β––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л, —Б–Њ–µ–і–Є–љ—П—П—Б—М —Б —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л–Љ–Є –≤ —Б–µ—А–і—Ж–µ –Њ–і–љ–Њ–Є–Љ–µ–љ–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є, –њ—А–µ–њ—П—В—Б—В–≤—Г—О—В –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—О –љ–∞ –љ–Є—Е –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ–∞. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П —З–Є—Б–ї–Њ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є —Б–µ—А–і—Ж–∞. –Т —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, —Н—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–љ–Є–ґ–µ–љ–Є—О –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –њ—А–Є—Б—В—Г–њ–∞ —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–Є —Г –±–Њ–ї—М–љ—Л—Е —Б —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є (–∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П, –Ш–С–° –Є —В.–і.).
–°–Њ–≤–µ—А—И–µ–љ–љ–Њ –Є–љ–∞—П —Б–Є—В—Г–∞—Ж–Є—П —Б–ї–Њ–ґ–Є–ї–∞—Б—М –≤ –њ—Б–Є—Е–Є–∞—В—А–Є–Є. –Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ—Г–±–ї–Є–Ї–∞—Ж–Є—П—Е –Њ—В—А–Є—Ж–∞–µ—В—Б—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ—А–Є–љ–Є–Љ–∞—В—М –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ [1]. –Я—А–Є —Н—В–Њ–Љ —Г—В–≤–µ—А–ґ–і–∞—О—В, —З—В–Њ —Б—А–Њ–і—Б—В–≤–Њ –Ї —А–∞–Ј–љ—Л–Љ —В–Є–њ–∞–Љ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –љ–µ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–і–њ–Њ—Б—Л–ї–Ї–Њ–є –і–ї—П –±–Њ–ї—М—И–µ–є –Є–ї–Є –Љ–µ–љ—М—И–µ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М «–њ–Њ–і–±–Њ—А —В–µ—А–∞–њ–Є–Є –≤ –Ї–∞–ґ–і–Њ–Љ –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–Љ —Б–ї—Г—З–∞–µ … –ї–Є—И—М –њ—Г—В–µ–Љ –њ—А–Њ–± –Є –Њ—И–Є–±–Њ–Ї» [22]. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –∞–≤—В–Њ—А—Л –Є–і—Г—В –µ—Й–µ –і–∞–ї—М—И–µ, —Г—В–≤–µ—А–ґ–і–∞—П, —З—В–Њ –≤—Б–µ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Є (–≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –і–µ–є—Б—В–≤–Є—П) «–Є–Љ–µ—О—В –±–Њ–ї—М—И–µ —Б—Е–Њ–і—Б—В–≤–∞, —З–µ–Љ —А–∞–Ј–ї–Є—З–Є–є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–Є–Љ–µ—А–љ–Њ –Њ–і–Є–љ–∞–Ї–Њ–≤—Л –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є» [1]. –Я–Њ—Н—В–Њ–Љ—Г –њ—А–µ–њ–∞—А–∞—В—Л –Љ–Њ–ґ–љ–Њ –ї–µ–≥–Ї–Њ –Љ–µ–љ—П—В—М –і—А—Г–≥ –љ–∞ –і—А—Г–≥–∞, —Б–Њ–±–ї—О–і–∞—П –ї–Є—И—М –њ—А–∞–≤–Є–ї–Њ —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ—Б—В–Є –і–Њ–Ј. –Ф–ї—П —Н—В–Њ–≥–Њ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ «—В–∞–±–ї–Є—Ж—Л –∞–Љ–Є–љ–∞–Ј–Є–љ–Њ–≤—Л—Е —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–Њ–≤», —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ—В–Њ—А—Л—Е —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В –і–Њ–Ј–Є—А–Њ–≤–Ї—Г –ї—О–±–Њ–≥–Њ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–∞, –∞–і–µ–Ї–≤–∞—В–љ—Г—О 100 –Љ–≥ —Е–ї–Њ—А–њ—А–Њ–Љ–∞–Ј–Є–љ–∞ [13].
–Х—Б–ї–Є —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–∞–Љ–Є –Є–ї–Є —Е–Њ—В—П –±—Л –Є—Е –≥—А—Г–њ–њ–∞–Љ–Є –≤—Б–µ –ґ–µ –њ—А–Є–Ј–љ–∞—О—В—Б—П, —В–Њ –љ–∞–Ј–≤–∞–љ–Є—П –њ–Њ—Б–ї–µ–і–љ–Є—Е –Њ—В—А–∞–ґ–∞—О—В –≤—Б–µ —З—В–Њ —Г–≥–Њ–і–љ–Њ, —В–Њ–ї—М–Ї–Њ –љ–µ –Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П. –Ю—З–µ–љ—М —З–∞—Б—В–Њ, –љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Є–≤–Њ–і—П—В —Е–Є–Љ–Є—З–µ—Б–Ї—Г—О –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А—Г –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (—Д–µ–љ–Њ—В–Є–∞–Ј–Є–љ—Л, —В–Є–Њ–Ї—Б–∞–љ—В–µ–љ—Л, –±—Г—В–Є—А–Њ—Д–µ–љ–Њ–љ—Л, –Ј–∞–Љ–µ—Й–µ–љ–љ—Л–µ –±–µ–љ–Ј–∞–Љ–Є–і—Л, –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л–µ –і–Є–±–µ–љ–Ј–µ–њ–Є–љ–∞, –±–µ–љ–Ј–Є–Ј–Њ–Ї—Б–∞–Ј–Њ–ї–∞, –і–Є–≥–Є–і—А–Њ–Є–љ–і–Њ–ї–Њ–љ–∞, –Ї–≤–Є–љ–Њ–ї–Є–љ–Њ–љ–∞, —Д–µ–љ–Є–ї–Є–љ–і–Њ–ї–∞ –Є —В.–і.) [6,8]. –Ь–µ–ґ–і—Г —В–µ–Љ —Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –љ–∞–Ј–≤–∞–љ–Є—П –љ–µ —Б–њ–Њ—Б–Њ–±–љ—Л –Њ—В—А–∞–Ј–Є—В—М —А–∞–Ј–ї–Є—З–Є—П –≤ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞—Е –і–µ–є—Б—В–≤–Є—П –Є —В–µ–Љ –±–Њ–ї–µ–µ –≤ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–∞—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤, –∞ —В–∞–Ї–ґ–µ –≤ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П—Е –і–ї—П –Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П. –Ф–µ–ї–Њ –≤ —В–Њ–Љ, —З—В–Њ –Њ—Б–љ–Њ–≤–љ—Л–µ –њ–Њ–ї–µ–Ј–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –њ—А–µ–њ–∞—А–∞—В–∞ —Б–≤—П–Ј–∞–љ—Л –љ–µ —Б—В–Њ–ї—М–Ї–Њ —Б–Њ —Б—В—А–Њ–µ–љ–Є–µ–Љ –µ–≥–Њ –Љ–Њ–ї–µ–Ї—Г–ї—Л (—З—В–Њ —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ –Є –Њ—В—А–∞–ґ–∞–µ—В —Е–Є–Љ–Є—З–µ—Б–Ї–∞—П –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А–∞), —Б–Ї–Њ–ї—М–Ї–Њ —Б–Њ —Б—В—А—Г–Ї—В—Г—А–Њ–є –µ–µ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ —Г—З–∞—Б—В–Ї–∞ (—З–µ–≥–Њ —Н—В–∞ –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А–∞ –љ–µ –Њ—В—А–∞–ґ–∞–µ—В), –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–µ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ —Б —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –Є–ї–Є —Д–µ—А–Љ–µ–љ—В–∞–Љ–Є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –њ–∞—Ж–Є–µ–љ—В–∞ [20]. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, —Н—В–Є –∞–Ї—В–Є–≤–љ—Л–µ —Г—З–∞—Б—В–Ї–Є –Љ–Њ–≥—Г—В –±—Л—В—М —Б—Е–Њ–і–љ—Л —Г –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А–µ –Њ—В–љ–Њ—Б—П—В—Б—П –Ї —А–∞–Ј–љ—Л–Љ –≥—А—Г–њ–њ–∞–Љ. –Т —Б–Є–ї—Г —Н—В–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В—Л, –Њ—В–љ–Њ—Б—П—Й–Є–µ—Б—П –Ї —А–∞–Ј–ї–Є—З–љ—Л–Љ —Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ –≥—А—Г–њ–њ–∞–Љ (–љ–∞–њ—А–Є–Љ–µ—А, –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Д–µ–љ–Њ—В–Є–∞–Ј–Є–љ—Л –Є —В–Є–Њ–Ї—Б–∞–љ—В–µ–љ—Л), –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Њ–і–Є–љ –Є —В–Њ—В –ґ–µ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В (–∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–є, —Б–µ–і–∞—В–Є–≤–љ—Л–є) [6]. –Ш, –љ–∞–Њ–±–Њ—А–Њ—В, —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е —Г—З–∞—Б—В–Ї–Њ–≤ –Љ–Њ–ї–µ–Ї—Г–ї—Л —Г –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ –Є–Ј –Њ–і–љ–Њ–є —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –≥—А—Г–њ–њ—Л –Љ–Њ–≥—Г—В —Б–Є–ї—М–љ–Њ –Њ—В–ї–Є—З–∞—В—М—Б—П. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Њ–і–љ–Є —В–Є–Њ–Ї—Б–∞–љ—В–µ–љ—Л (–Ї–ї–Њ–њ–Є–Ї—Б–Њ–ї) –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –і–ї—П –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –Њ—Б—В—А–Њ–≥–Њ –њ—А–Є—Б—В—Г–њ–∞ —И–Є–Ј–Њ—Д—А–µ–љ–Є–Є, –∞ –і—А—Г–≥–Є–µ (—Е–ї–Њ—А–њ—А–Њ—В–Є–Ї—Б–µ–љ) – –љ–µ—В [3].
–Э–∞—А—П–і—Г —Б —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А–Њ–є –і–ї—П –Њ–±–Њ–Ј–љ–∞—З–µ–љ–Є—П –≥—А—Г–њ–њ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В —В–∞–Ї–Є–µ —В–µ—А–Љ–Є–љ—Л, –Ї–∞–Ї —В–Є–њ–Є—З–љ—Л–µ (—В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ, –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є–µ, –Њ—В–љ–Њ—Б—П—Й–Є–µ—Б—П –Ї –њ–µ—А–≤–Њ–Љ—Г –њ–Њ–Ї–Њ–ї–µ–љ–Є—О, –≥–µ–љ–µ—А–∞—Ж–Є–Є) –Є –∞—В–Є–њ–Є—З–љ—Л–µ (–Њ—В–љ–Њ—Б—П—Й–Є–µ—Б—П –Ї –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П–Љ, –≥–µ–љ–µ—А–∞—Ж–Є—П–Љ) –њ—А–µ–њ–∞—А–∞—В—Л [2,7]. –Ю–і–љ–∞–Ї–Њ —Н—В–Є –њ–Њ–љ—П—В–Є—П —П–≤–љ–Њ –Ј–∞–Є–Љ—Б—В–≤—Г—О—В—Б—П –Є–Ј –∞—А—Б–µ–љ–∞–ї–∞ –Љ–∞—Б—Б–Є—А–Њ–≤–∞–љ–љ—Л—Е —А–µ–Ї–ї–∞–Љ–љ—Л—Е –Ї–Њ–Љ–њ–∞–љ–Є–є –њ–Њ –њ—А–Њ–і–∞–ґ–µ –љ–Њ–≤—Л—Е —В–Њ–≤–∞—А–Њ–≤ (–љ–∞–њ—А–Є–Љ–µ—А, —Н–ї–µ–Ї—В—А–Њ–љ–љ—Л—Е –≥–∞–і–ґ–µ—В–Њ–≤ I Pad, –Ї–∞–ґ–і–∞—П –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—П –Ї–Њ—В–Њ—А—Л—Е –њ–Њ–ї—Г—З–∞–µ—В –љ–∞–Ј–≤–∞–љ–Є–µ –Њ—З–µ—А–µ–і–љ–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П). –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –Њ–љ–Є –љ–µ —В–Њ–ї—М–Ї–Њ –љ–µ –Њ—В—А–∞–ґ–∞—О—В –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ (–∞ —В–µ–Љ –±–Њ–ї–µ–µ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –Є –њ–Њ–Ї–∞–Ј–∞–љ–Є—П), –љ–Њ –Є –≤–Њ–Њ–±—Й–µ –ї–Є—И–µ–љ—Л –≤—Б—П–Ї–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Љ—Л—Б–ї–∞.
–Э–µ—Б–ї—Г—З–∞–є–љ–Њ, —З—В–Њ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –њ–Њ–њ—Л—В–Ї–Є —Б–Ї–Њ–ї—М–Ї–Њ––ї–Є–±–Њ –≤–љ—П—В–љ–Њ —Б—Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞—В—М —Б—Г—В—М —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г —А–∞–Ј–љ—Л–Љ–Є –њ–Њ–Ї–Њ–ї–µ–љ–Є—П–Љ–Є –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ —А–∞–Ј –Ј–∞ —А–∞–Ј–Њ–Љ —В–µ—А–њ—П—В –љ–µ—Г–і–∞—З—Г. –Э–∞–њ—А–Є–Љ–µ—А, –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П —Г—В–≤–µ—А–ґ–і–∞–ї–Є, —З—В–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (–≤—В–Њ—А–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П) —Н—Д—Д–µ–Ї—В–Є–≤–љ–µ–µ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е (–њ–µ—А–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П). –Ю–і–љ–∞–Ї–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –љ–µ –≤—Л—П–≤–Є–ї–Є –Є—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –Ї–∞–Ї –њ–Њ –Њ–±—Й–µ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є, —В–∞–Ї –Є –њ–Њ –≤–ї–Є—П–љ–Є—О –љ–∞ –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –Є —Б–Њ—Ж–Є–∞–ї—М–љ—Л–µ –Є—Б—Е–Њ–і—Л [10]. –°—З–Є—В–∞–ї–Є —В–∞–Ї–ґ–µ, —З—В–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Њ—В–ї–Є—З–∞—О—В—Б—П –Њ—В —Б—В–∞—А—Л—Е (–Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є—Е) –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Њ–є —Б—В–µ–њ–µ–љ—М—О —Б—А–Њ–і—Б—В–≤–∞ –Ї –і–Њ—Д–∞–Љ–Є–љ–Њ–≤—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ 2 —В–Є–њ–∞ (D2) –Є —Б—А–Њ–і—Б—В–≤–Њ–Љ –Ї —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ –і—А—Г–≥–Є—Е —В–Є–њ–Њ–≤. –Ю–і–љ–∞–Ї–Њ –Є —Н—В–Њ «–њ—А–∞–≤–Є–ї–Њ» –љ–µ –≤—Л–њ–Њ–ї–љ—П–µ—В—Б—П. –Ґ–∞–Ї, –∞—А–Є–њ–Є–њ—А–∞–Ј–Њ–ї (—Б–∞–Љ–Њ–µ –њ–Њ—Б–ї–µ–і–љ–µ–µ –њ–Њ–Ї–Њ–ї–µ–љ–Є–µ) –і–∞–ґ–µ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї (–њ–µ—А–≤–Њ–µ –њ–Њ–Ї–Њ–ї–µ–љ–Є–µ) –њ–Њ –∞—Д—Д–Є–љ–Є—В–µ—В—Г (—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –њ—А–Є—Б–Њ–µ–і–Є–љ—П—В—М—Б—П) –Ї D2–—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ [15]. –Ь–љ–Њ–≥–Є–µ —В–Є–њ–Є—З–љ—Л–µ –Є –∞—В–Є–њ–Є—З–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (–≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —А–Є—Б–њ–µ—А–Є–і–Њ–љ –Є –њ–µ—А—Д–µ–љ–∞–Ј–Є–љ) —Б—Е–Њ–і–љ—Л –і—А—Г–≥ —Б –і—А—Г–≥–Њ–Љ –њ–Њ –њ—А–Њ—Д–Є–ї—О –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ —А–∞–Ј–љ—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л (—В–∞–±–ї. 1).
–Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ—В–љ—О–і—М –љ–µ –Њ–Ј–љ–∞—З–∞—О—В —В–Њ–≥–Њ, —З—В–Њ –≤ –њ—Б–Є—Е–Є–∞—В—А–Є–Є (–≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –і—А—Г–≥–Є—Е –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е –љ–∞—Г–Ї) –љ–µ –њ—А–µ–і–њ—А–Є–љ–Є–Љ–∞–ї–Є—Б—М –њ–Њ–њ—Л—В–Ї–Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М –≥—А—Г–њ–њ—Л –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –і–µ–є—Б—В–≤–Є—П. –Э–∞–њ—А–Њ—В–Є–≤, —В–∞–Ї–Є–µ –њ–Њ–њ—Л—В–Ї–Є –і–µ–ї–∞–ї–Є—Б—М —А–µ–≥—Г–ї—П—А–љ–Њ. –Э–∞–њ—А–Є–Љ–µ—А, –≤ —Б–µ—А–µ–і–Є–љ–µ –њ—А–Њ—И–ї–Њ–≥–Њ –≤–µ–Ї–∞ –і–ї—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –Њ —В–Њ–Љ, —З—В–Њ —Б—Г—Й–µ—Б—В–≤—Г—О—В –љ–µ–Ї–Є–µ –Њ—Б–љ–Њ–≤–љ—Л–µ –њ—Б–Є—Е–Њ—В—А–Њ–њ–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –≤—Л—П–≤–ї—П—О—В—Б—П –≤ –љ–∞–Є–±–Њ–ї–µ–µ —В–Є–њ–Є—З–љ–Њ–є —Д–Њ—А–Љ–µ –Ї–∞–Ї —Г –±–Њ–ї—М–љ—Л—Е, –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л, —В–∞–Ї –Є —Г –Ј–і–Њ—А–Њ–≤—Л—Е [6]. –≠—В–Є —Б–≤–Њ–є—Б—В–≤–∞ – –Ј–∞—В–Њ—А–Љ–∞–ґ–Є–≤–∞—О—Й–µ–µ –Є —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–µ–µ, –њ—А–Њ—В–Є–≤–Њ—Б—В–Њ—П—В –і–≤—Г–Љ –Њ—Б–љ–Њ–≤–љ—Л–Љ —В–Є–њ–∞–Љ –њ—Б–Є—Е–Њ–њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Є–љ–і—А–Њ–Љ–Њ–≤, –њ—А–Њ—В–µ–Ї–∞—О—Й–Є—Е —Б –≤–Њ–Ј–±—Г–ґ–і–µ–љ–Є–µ–Љ –Є —В–Њ—А–Љ–Њ–ґ–µ–љ–Є–µ–Љ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Ш—Б—Е–Њ–і—П –Є–Ј —Н—В–Є—Е –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–є, –≤—Л–і–µ–ї—П–ї–Є (–∞ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –∞–≤—В–Њ—А—Л –і–µ–ї–∞—О—В —Н—В–Њ –Є –њ–Њ —Б–Є—Е –њ–Њ—А) —Б–µ–і–∞—В–Є–≤–љ—Л–µ (–ї–µ–≤–Њ–Љ–µ–њ—А–Њ–Љ–∞–Ј–Є–љ, —Е–ї–Њ—А–њ—А–Њ–Љ–∞–Ј–Є–љ, –њ—А–Њ–Љ–∞–Ј–Є–љ, —Е–ї–Њ—А–њ—А–Њ—В–Є–Ї—Б–µ–љ, –∞–ї–Є–Љ–µ–Љ–∞–Ј–Є–љ, –њ–µ—А–Є—Ж–Є–∞–Ј–Є–љ) –Є –∞–Ї—В–Є–≤–Є–Ј–Є—А—Г—О—Й–Є–µ (–і–µ–Ј–Є–љ–≥–Є–±–Є—А—Г—О—Й–Є–µ) (—Б—Г–ї—М–њ–Є—А–Є–і, –Ї–∞—А–±–Є–і–Є–љ –Є –і—А.) —Б—А–µ–і—Б—В–≤–∞ [8,9].
–Ь–µ–ґ–і—Г —В–µ–Љ, –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Б—В–∞–ї–Њ —П—Б–љ–Њ, —З—В–Њ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ (—А–∞–≤–љ–Њ –Ї–∞–Ї –Є –Љ–љ–Њ–≥–Є—Е –і—А—Г–≥–Є—Е –њ—Б–Є—Е–Њ—В—А–Њ–њ–љ—Л—Е —Б—А–µ–і—Б—В–≤) –Љ–Њ–≥—Г—В –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б–љ–Є–ґ–∞—В—М —Б–Є–љ–∞–њ—В–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Г –Њ–і–љ–Є—Е –љ–µ–є—А–Њ–љ–Њ–≤ (—В–Њ—А–Љ–Њ–Ј–Є—В—М –Є—Е) –Є –њ–Њ–≤—Л—И–∞—В—М –µ–µ —Г –і—А—Г–≥–Є—Е (–∞–Ї—В–Є–≤–Є–Ј–Є—А–Њ–≤–∞—В—М –Є—Е) [20]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤—Л—П—Б–љ–Є–ї–Њ—Б—М, —З—В–Њ –њ—А–Є –Њ–і–љ–Є—Е –Є —В–µ—Е –ґ–µ –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞—Е (—И–Є–Ј–Њ—Д—А–µ–љ–Є—П, —В—А–µ–≤–Њ–ґ–љ—Л–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є —В.–і.) –Љ–Њ–ґ–µ—В –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –љ–∞–±–ї—О–і–∞—В—М—Б—П –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Њ–і–љ–Є—Е —Б—В—А—Г–Ї—В—Г—А –Љ–Њ–Ј–≥–∞ –Є –≥–Є–њ–Њ—Д—Г–љ–Ї—Ж–Є—П –і—А—Г–≥–Є—Е, –љ–µ –≥–Њ–≤–Њ—А—П —Г–ґ–µ –Њ —В–Њ–Љ, —З—В–Њ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Б—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –њ—Б–Є—Е–Њ—В—А–Њ–њ–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ —А–µ–∞–ї–Є–Ј—Г—О—В—Б—П –ї–Є—И—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ—Б–Є—Е–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є. –Х—Б–ї–Є —Н—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –±—Г–і—Г—В –њ—А–Є–љ–Є–Љ–∞—В—М –Ј–і–Њ—А–Њ–≤—Л–µ –ї–Є—Ж–∞, —В–Њ —Б–ї–µ–і—Г–µ—В –Њ–ґ–Є–і–∞—В—М —В–Њ–ї—М–Ї–Њ —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤: –њ–Њ–≤–µ–і–µ–љ—З–µ—Б–Ї–Њ–є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є, —Н–Ї—Б—В—А–∞–њ–Є—А–∞–Љ–Є–і–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, –∞–Ї–∞—В–Є–Ј–Є–Є –Є —В.–і. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –і–µ–є—Б—В–≤–Є—П, —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –Є –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ —Б–ї–µ–і—Г–µ—В –Њ–њ–Є—Б—Л–≤–∞—В—М —Б –њ–Њ–Љ–Њ—Й—М—О –Њ—Б–љ–Њ–≤–љ—Л—Е –њ—Б–Є—Е–Њ—В—А–Њ–њ–љ—Л—Е —Б–≤–Њ–є—Б—В–≤. –° —Н—В–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –≤—Л–і–µ–ї–µ–љ–Є–µ –≤ –Њ—В–і–µ–ї—М–љ—Л–µ –≥—А—Г–њ–њ—Л –Ј–∞—В–Њ—А–Љ–∞–ґ–Є–≤–∞—О—Й–Є—Е (—Б–µ–і–∞—В–Є–≤–љ—Л—Е) –Є –∞–Ї—В–Є–≤–Є–Ј–Є—А—Г—О—Й–Є—Е (–і–µ–Ј–Є–љ–≥–Є–±–Є—А—Г—О—Й–Є—Е) –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ –Є–Љ–µ–µ—В –Ј–љ–∞—З–µ–љ–Є–µ –ї–Є—И—М –і–ї—П –Є—Б—В–Њ—А–Є–Є –Љ–µ–і–Є—Ж–Є–љ—Л.
–Я–Њ–њ—Л—В–Ї–Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М –≥—А—Г–њ–њ—Л –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–є –Њ–± –Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–µ –і–µ–є—Б—В–≤–Є—П –њ—А–µ–і–њ—А–Є–љ–Є–Љ–∞—О—В—Б—П –Є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П. –Т –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Є–Љ–µ—А–∞ –Љ–Њ–ґ–љ–Њ –њ—А–Є–≤–µ—Б—В–Є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—О, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Г—О –≤ —Б–њ—А–∞–≤–Њ—З–љ–Є–Ї–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤—А–∞—З–∞ –њ–Њ –њ—Б–Є—Е–Є–∞—В—А–Є–Є [6]. –Т —Н—В–Њ–Љ —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–µ –≤—Л–і–µ–ї—П—О—В—Б—П 6 –≥—А—Г–њ–њ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤:
1) —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ (–Є–Ј–±–Є—А–∞—В–µ–ї—М–љ—Л–µ) –±–ї–Њ–Ї–∞—В–Њ—А—Л –і–Њ—Д–∞–Љ–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≤—В–Њ—А–Њ–≥–Њ –Є —В—А–µ—В—М–µ–≥–Њ —В–Є–њ–Њ–≤ (D2, –Є D3): —Б—Г–ї—М–њ–Є—А–Є–і, –∞–Љ–Є—Б—Г–ї—М–њ—А–Є–і, –≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї;
2) —Б–Є–ї—М–љ—Л–µ –±–ї–Њ–Ї–∞—В–Њ—А—Л (–∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л) D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, c–ї–∞–±–Њ –Є–ї–Є —Г–Љ–µ—А–µ–љ–љ–Њ –±–ї–Њ–Ї–Є—А—Г—О—Й–Є–µ —Б–µ—А–Њ—В–Њ–љ–Є–љ–Њ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л –≤—В–Њ—А–Њ–≥–Њ —В–Є–њ–∞, –њ–Њ–і—В–Є–њ–∞ –Р (5––Э–Ґ2A) –Є –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ–Њ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л –њ–µ—А–≤–Њ–≥–Њ —В–Є–њ–∞ –Є–ї–Є α1––∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А—Л (α1): —В—А–Є—Д–ї—Г–Њ–њ–µ—А–∞–Ј–Є–љ, —Д–ї—Г–њ–µ–љ—В–Є–Ї—Б–Њ–ї, —Д–ї—Г—Д–µ–љ–∞–Ј–Є–љ, –Ј—Г–Ї–ї–Њ–њ–µ–љ—В–Є–Ї—Б–Њ–ї, –њ–µ—А—Д–µ–љ–∞–Ј–Є–љ –Є –і—А.;
3) –њ–Њ–ї–Є–≤–∞–ї–µ–љ—В–љ—Л–µ, –љ–µ–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ–Њ –±–ї–Њ–Ї–Є—А—Г—О—Й–Є–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤: —Е–ї–Њ—А–њ—А–Њ–Љ–∞–Ј–Є–љ, –ї–µ–≤–Њ–Љ–µ–њ—А–Њ–Љ–∞–Ј–Є–љ, —Е–ї–Њ—А–њ—А–Њ—В–Є–Ї—Б–µ–љ, —В–Є–Њ—А–Є–і–∞–Ј–Є–љ –Є –і—А.;
4) —Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ –±–ї–Њ–Ї–Є—А—Г—О—Й–Є–µ D2– –Є 5––Э–Ґ2–Р–—А–µ—Ж–µ–њ—В–Њ—А—Л (–≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –њ–Њ—Б–ї–µ–і–љ–Є–µ) –Є –≤ —Г–Љ–µ—А–µ–љ–љ–Њ–є —Б—В–µ–њ–µ–љ–Є α1––∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А—Л: —А–Є—Б–њ–µ—А–Є–і–Њ–љ, –Ј–Є–њ—А–∞—Б–Є–і–Њ–љ, –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ –Є —Б–µ—А—В–Є–љ–і–Њ–ї;
5) –њ–Њ–ї–Є–≤–∞–ї–µ–љ—В–љ—Л–µ, –љ–µ–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ–Њ –±–ї–Њ–Ї–Є—А—Г—О—Й–Є–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (–њ—А–Є—З–µ–Љ —Б–µ—А–Њ—В–Њ–љ–Є–љ–Њ–≤—Л–µ 5––Э–Ґ2–Р –±–ї–Њ–Ї–Є—А—Г—О—В—Б—П —Б–Є–ї—М–љ–µ–µ, —З–µ–Љ –і–Њ—Д–∞–Љ–Є–љ–Њ–≤—Л–µ D2 –Є D3): –Ї–ї–Њ–Ј–∞–њ–Є–љ, –Њ–ї–∞–љ–Ј–∞–њ–Є–љ –Є –Ї–≤–µ—В–Є–∞–њ–Є–љ;
6) —З–∞—Б—В–Є—З–љ—Л–µ (–њ–∞—А—Ж–Є–∞–ї—М–љ—Л–µ) –∞–≥–Њ–љ–Є—Б—В—Л (–≤–Њ–Ј–±—Г–і–Є—В–µ–ї–Є) D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤: –∞—А–Є–њ–Є–њ—А–∞–Ј–Њ–ї.
–Ґ–µ—А–Љ–Є–љ «–њ–∞—А—Ж–Є–∞–ї—М–љ—Л–є –∞–≥–Њ–љ–Є—Б—В» –Њ–Ј–љ–∞—З–∞–µ—В, —З—В–Њ –њ—А–µ–њ–∞—А–∞—В –≤–Њ–Ј–±—Г–ґ–і–∞–µ—В —А–µ—Ж–µ–њ—В–Њ—А —Б–ї–∞–±–µ–µ, –љ–µ–ґ–µ–ї–Є –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–є –і–ї—П –љ–µ–≥–Њ –∞–≥–Њ–љ–Є—Б—В – –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—В—В–µ—А (–≤ –і–∞–љ–љ–Њ–Љ —Б–ї—Г—З–∞–µ –і–Њ—Д–∞–Љ–Є–љ).
–Я—А–Є —Н—В–Њ–Љ —Б—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –њ—А–µ–њ–∞—А–∞—В—Л 1––є –Є 2––є –≥—А—Г–њ–њ –≤ –љ–µ–±–Њ–ї—М—И–Є—Е –і–Њ–Ј–∞—Е –Њ–Ї–∞–Ј—Л–≤–∞—О—В —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–µ–µ (–і–µ–Ј–Є–љ–≥–Є–±–Є—А—Г—О—Й–µ–µ) –і–µ–є—Б—В–≤–Є–µ, –∞ –≤ –≤—Л—Б–Њ–Ї–Є—Е – –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Њ–µ. –Т 3––є –≥—А—Г–њ–њ–µ –Њ—Б–љ–Њ–≤–љ—Л–µ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л —Б–≤–Њ–і—П—В—Б—П –Ї —Б–µ–і–∞—В–Є–≤–љ–Њ–Љ—Г –Є —Б—А–µ–і–љ–µ–Љ—Г –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Њ–Љ—Г. –Я—А–µ–њ–∞—А–∞—В—Л 4––є –Є 5––є –≥—А—Г–њ–њ—Л, –љ–∞—А—П–і—Г —Б –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ, –Ї–Њ—А—А–Є–≥–Є—А—Г—О—В –љ–µ–≥–∞—В–Є–≤–љ—Г—О —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї—Г –Є –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П. –Э–∞–Ї–Њ–љ–µ—Ж, –і–ї—П 6––є –≥—А—Г–њ–њ—Л —Е–∞—А–∞–Ї—В–µ—А–љ—Л –∞–љ—В–Є–љ–µ–≥–∞—В–Є–≤–љ—Л–є, –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–Є–≤–љ—Л–є –Є –Ї–Њ–≥–љ–Є—В–Њ—В—А–Њ–њ–љ—Л–є —Н—Д—Д–µ–Ї—В—Л.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–∞ 6 –≥—А—Г–њ–њ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ –њ—А–Є—Е–Њ–і–Є—В—Б—П –њ—П—В—М –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –і–µ–є—Б—В–≤–Є—П (–≤ 3––є –Є 5––є –Њ–љ–Є —Б—Е–Њ–ґ–Є) –Є 6 —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤. –Ю–і–Є–љ –Є–Ј –љ–Є—Е – –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–є – —Е–∞—А–∞–Ї—В–µ—А–µ–љ –і–ї—П –њ—П—В–Є –Є–Ј —И–µ—Б—В–Є –≥—А—Г–њ–њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Ґ–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ 1––є –Є 2––є, –∞ —В–∞–Ї–ґ–µ 4––є –Є 5––є –≥—А—Г–њ–њ—Л –љ–µ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є, —Е–Њ—В—П –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –і–µ–є—Б—В–≤–Є—П –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ —А–∞–Ј–љ—Л–µ. –Э–∞–њ—А–Њ—В–Є–≤, –≤ 3––є –Є 5––є –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –і–µ–є—Б—В–≤–Є—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —В–Њ–ґ–і–µ—Б—В–≤–µ–љ–љ—Л, –∞ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л – —А–∞–Ј–љ—Л–µ. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П, —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є –Є –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–∞ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ —Г–ї–∞–≤–ї–Є–≤–∞–µ—В—Б—П.
–Т —Н—В–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ –≤–∞–ґ–љ–Њ –њ–Њ–љ—П—В—М, –њ–Њ—З–µ–Љ—Г —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–љ–∞—П –њ–Њ–њ—Л—В–Ї–∞ –Є –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ –µ–є —Г—Б–Є–ї–Є—П –љ–µ —Г–≤–µ–љ—З–∞–ї–Є—Б—М —Г—Б–њ–µ—Е–Њ–Љ. –Х—Б–ї–Є –Њ–њ—П—В—М –≤–µ—А–љ—Г—В—М—Б—П –Ї –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–Љ—Г –≤—Л—И–µ –њ—А–Є–Љ–µ—А—Г, —Б—В–∞–љ–Њ–≤–Є—В—Б—П –Њ—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –њ—А–Є –Њ–њ–Є—Б–∞–љ–Є–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –і–µ–є—Б—В–≤–Є—П —А–∞–Ј–љ—Л—Е –≥—А—Г–њ–њ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В –µ–і–Є–љ—Л–є –њ—А–Є–љ—Ж–Є–њ –≤—Л–±–Њ—А–∞ –Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А—Г—О—Й–µ–≥–Њ –њ—А–Є–Ј–љ–∞–Ї–∞. –Э–∞–њ—А–Є–Љ–µ—А, –њ–µ—А–≤–∞—П –≥—А—Г–њ–њ–∞ –≤—Л–і–µ–ї—П–µ—В—Б—П –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–є –±–ї–Њ–Ї–∞–і—Л –і–≤—Г—Е —В–Є–њ–Њ–≤ –і–Њ—Д–∞–Љ–Є–љ–Њ–≤—Л—Е (D2 –Є D3) —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. 2–—П, 4–—П –Є 5–—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В—Б—П –і—А—Г–≥ –Њ—В –і—А—Г–≥–∞ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П –∞—Д—Д–Є–љ–Є—В–µ—В–∞ (—Б—А–Њ–і—Б—В–≤–∞) –Ї –і–Њ—Д–∞–Љ–Є–љ–Њ–≤—Л–Љ (D2), —Б–µ—А–Њ—В–Њ–љ–Є–љ–Њ–≤—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ –≤—В–Њ—А–Њ–≥–Њ —В–Є–њ–∞, –њ–Њ–і—В–Є–њ–∞ A. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, 2–—П –Є 4–—П –≥—А—Г–њ–њ—Л —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –µ—Й–µ –Є —Б—А–Њ–і—Б—В–≤–Њ–Љ –Ї α1––∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ. 3–—О –Є 5–—О –Њ—В–ї–Є—З–∞–µ—В –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ —А–∞–Ј–љ—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л. –Я—А–Є —Н—В–Њ–Љ —Б–Њ–≤–µ—А—И–µ–љ–љ–Њ –љ–µ–њ–Њ–љ—П—В–љ–Њ, –њ–Њ—З–µ–Љ—Г –і–ї—П –Њ–±–Њ–Ј–љ–∞—З–µ–љ–Є—П –≥—А—Г–њ–њ –≤—Л–±—А–∞–љ—Л –Є–Љ–µ–љ–љ–Њ —Н—В–Є —А–µ—Ж–µ–њ—В–Њ—А—Л, –∞ –љ–µ –Ї–∞–Ї–Є–µ––ї–Є–±–Њ –і—А—Г–≥–Є–µ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–∞–ї–Є—Ж–Њ —П–≤–љ–∞—П –њ–Њ–њ—Л—В–Ї–∞ —Б–Њ–≤–Љ–µ—Б—В–Є—В—М –≤ –њ—А–µ–і–µ–ї–∞—Е –Њ–і–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ (–±–ї–Њ–Ї–∞–і–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤) –Є —Г—Б—В–∞—А–µ–≤—И–Є–µ (–Њ—Б–љ–Њ–≤–љ—Л–µ –њ—Б–Є—Е–Њ—В—А–Њ–њ–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞) –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–µ –і–µ–є—Б—В–≤–Є—П –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤.
–Ф–∞–ї–µ–µ, –≤ —Н—В–Њ–є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є —П–≤–љ–Њ –љ–µ —Г—З–Є—В—Л–≤–∞–µ—В—Б—П –Љ–љ–Њ–≥–Њ–ї–µ—В–љ–Є–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤. –Э–∞–њ—А–Є–Љ–µ—А, –≤ –Њ–і–љ—Г –≥—А—Г–њ–њ—Г –њ–Њ–њ–∞–ї–Є —Б—Г–ї—М–њ–Є—А–Є–і –Є –≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї. –Ю–і–љ–∞–Ї–Њ —Н—В–Њ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –і–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В—Л –љ–∞ –њ—А–∞–Ї—В–Є–Ї–µ. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –≤ —В–µ—З–µ–љ–Є–µ –≤–Њ—В —Г–ґ–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–µ—Б—П—В–Є–ї–µ—В–Є–є —Б—Г–ї—М–њ–Є—А–Є–і –љ–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –і–ї—П –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –Њ—Б—В—А—Л—Е –њ—Б–Є—Е–Њ–Ј–Њ–≤ –њ—А–Є —И–Є–Ј–Њ—Д—А–µ–љ–Є–Є [3]. –Э–∞–њ—А–Њ—В–Є–≤, –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї–∞ –≤–њ–Њ–ї–љ–µ –≤–Њ—Б—В—А–µ–±–Њ–≤–∞–љ –≤ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–Љ —Б–ї—Г—З–∞–µ –Ї–∞–Ї –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ, —В–∞–Ї –Є –Ј–∞ —А—Г–±–µ–ґ–Њ–Љ [2,3].
–Э–∞–Ї–Њ–љ–µ—Ж, –љ–∞—Г—З–љ—Л–є –њ–Њ–і—Е–Њ–і –Ї –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Є—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ —А–µ—Ж–µ–њ—В–Њ—А—Л) —Б–∞–Љ—Л–Љ –њ—А–Є—З—Г–і–ї–Є–≤—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ —Б–Њ–≤–Љ–µ—Й–µ–љ –Ј–і–µ—Б—М —Б –Љ–∞—А–Ї–µ—В–Є–љ–≥–Њ–≤—Л–Љ. –Ы–µ–≥–Ї–Њ –Ј–∞–Љ–µ—В–Є—В—М, —З—В–Њ –њ–µ—А–≤—Л–µ —В—А–Є –≥—А—Г–њ–њ—Л –≤–Ї–ї—О—З–∞—О—В –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ «—В–Є–њ–Є—З–љ—Л–µ» –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Є, –∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ – «–∞—В–Є–њ–Є—З–љ—Л–µ». –Ч–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –µ—Б–ї–Є –Є–Ј–±–µ–ґ–∞—В—М —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –њ—А–Њ–Љ–∞—Е–Њ–≤, –≤–њ–Њ–ї–љ–µ –Љ–Њ–ґ–љ–Њ –њ—А–Є–є—В–Є –Ї –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –≥—А—Г–њ–њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–є –љ–∞ –Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞—Е –і–µ–є—Б—В–≤–Є—П, –Ї–Њ—В–Њ—А—Л–µ –±—Г–і—Г—В —З–µ—В–Ї–Њ –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞—В—М —Б —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є –Є –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П.
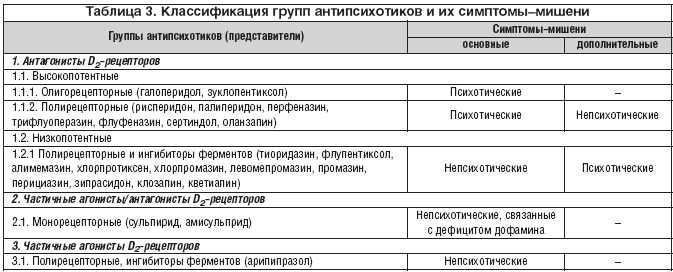
–Я–µ—А–µ—Е–Њ–і—П —В–µ–њ–µ—А—М —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ –Ї –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤, —Г–Ї–∞–ґ–µ–Љ, —З—В–Њ –≤ –µ–µ –Њ—Б–љ–Њ–≤—Г –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–ї–Њ–ґ–Є—В—М –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ D2–—А–µ—Ж–µ–њ—В–Њ—А—Л. –Ф–µ–ї–Њ –≤ —В–Њ–Љ, —З—В–Њ –≤—Б–µ –Є–Ј–≤–µ—Б—В–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–≥–Њ –Ї–ї–∞—Б—Б–∞ –њ—Б–Є—Е–Њ—В—А–Њ–њ–љ—Л—Е —Б—А–µ–і—Б—В–≤ —В–∞–Ї –Є–ї–Є –Є–љ–∞—З–µ —Б–≤—П–Ј—Л–≤–∞—О—В—Б—П —Б –і–∞–љ–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ (—В–∞–±–ї. 1) –±–ї–Њ–Ї–Є—А—Г—О—В —Н—В–Є —А–µ—Ж–µ–њ—В–Њ—А—Л (–∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л): –≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї, –Ј—Г–Ї–ї–Њ–њ–µ–љ—В–Є–Ї—Б–Њ–ї –Є –і—А. –Ю–і–Є–љ – –∞—А–Є–њ–Є–њ—А–∞–Ј–Њ–ї – —Г–Љ–µ—А–µ–љ–љ–Њ (—Б–ї–∞–±–µ–µ –Є—Е «–њ—А–Є—А–Њ–і–љ–Њ–≥–Њ» –∞–≥–Њ–љ–Є—Б—В–∞ –і–Њ—Д–∞–Љ–Є–љ–∞) –Є—Е –≤–Њ–Ј–±—Г–ґ–і–∞–µ—В (–њ–∞—А—Ж–Є–∞–ї—М–љ—Л–µ –∞–≥–Њ–љ–Є—Б—В—Л). –Х—Й–µ –і–≤–∞ – —Б—Г–ї—М–њ–Є—А–Є–і –Є –∞–Љ–Є—Б—Г–ї—М–њ—А–Є–і – –±–ї–Њ–Ї–Є—А—Г—О—В D2 –—А–µ—Ж–µ–њ—В–Њ—А—Л –≤ –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј–∞—Е, –∞ –≤ –љ–Є–Ј–Ї–Є—Е —П–≤–ї—П—О—В—Б—П –њ–∞—А—Ж–Є–∞–ї—М–љ—Л–Љ–Є –∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є.
–£ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –≤–Њ–Ј–і–µ–є—Б—В–≤–Њ–≤–∞—В—М –љ–∞ D2–—А–µ—Ж–µ–њ—В–Њ—А—Л —П–≤–ї—П–µ—В—Б—П –≤–Њ–Њ–±—Й–µ (–Є–ї–Є –њ–Њ—З—В–Є) –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П (—В–∞–±–ї. 1). –Ъ —В–∞–Ї–Є–Љ –Љ–Њ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ –Љ–Њ–ґ–љ–Њ –Њ—В–љ–µ—Б—В–Є —Б—Г–ї—М–њ–Є—А–Є–і –Є –∞–Љ–Є—Б—Г–ї—М–њ—А–Є–і (–њ–∞—А—Ж–Є–∞–ї—М–љ—Л–µ –∞–≥–Њ–љ–Є—Б—В—Л/–∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л). –Т —Н—В–Њ–Љ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ї —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ—Л–Љ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–∞–Љ –±–ї–Є–Ј–Ї–Є –Є –і–≤–∞ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞ D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤: –≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї –Є –Ј—Г–Ї–ї–Њ–њ–µ–љ—В–Є–Ї—Б–Њ–ї. –Э–∞—А—П–і—Г —Б –±–ї–Њ–Ї–∞–і–Њ–є —Г–њ–Њ–Љ—П–љ—Г—В—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Њ–љ–Є –ї–Є—И—М —Б–ї–∞–±–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—В –љ–∞ –∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А—Л –њ–µ—А–≤–Њ–≥–Њ —В–Є–њ–∞ (α1). –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –Є—Е –Љ–Њ–ґ–љ–Њ –љ–∞–Ј–≤–∞—В—М –Њ–ї–Є–≥–Њ—А–µ—Ж–µ–њ—В–Њ—А–љ—Л–Љ–Є.
–£ –Њ—Б—В–∞–ї—М–љ—Л—Е –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ –≤—Л—П–≤–ї—П—О—В—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –і–µ–є—Б—В–≤–Є—П –≤ –≤–Є–і–µ —Б—А–Њ–і—Б—В–≤–∞ –Ї–Њ –Љ–љ–Њ–≥–Є–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ (–њ–Њ–ї–Є—А–µ—Ж–µ–њ—В–Њ—А–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л) –Є–ї–Є —Д–µ—А–Љ–µ–љ—В–∞–Љ (–Є–љ–≥–Є–±–Є—В–Њ—А—Л —Д–µ—А–Љ–µ–љ—В–Њ–≤) (—В–∞–±–ї. 1). –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –њ—А–µ–њ–∞—А–∞—В—Л –Љ–Њ–≥—Г—В –±—Л—В—М –њ–∞—А—Ж–Є–∞–ї—М–љ—Л–Љ–Є –∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є –Є–ї–Є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є —Б–µ—А–Њ—В–Њ–љ–Є–љ–Њ–≤—Л—Е (–њ–µ—А–≤–Њ–≥–Њ —В–Є–њ–∞, –њ–Њ–і—В–Є–њ–∞ –Р: 5–H–Ґ1–Р; –≤—В–Њ—А–Њ–≥–Њ —В–Є–њ–∞ –њ–Њ–і—В–Є–њ–Њ–≤ –Р –Є –°: 5––Э–Ґ2–Р, 5––Э–Ґ2–°; —В—А–µ—В—М–µ–≥–Њ, —И–µ—Б—В–Њ–≥–Њ –Є —Б–µ–і—М–Љ–Њ–≥–Њ —В–Є–њ–Њ–≤: 5––Э–Ґ3, 5––Э–Ґ6, 5––Э–Ґ7); –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є –≥–Є—Б—В–∞–Љ–Є–љ–Њ–≤—Л—Е (–њ–µ—А–≤–Њ–≥–Њ —В–Є–њ–∞: Hi1) –Є –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ–Њ–≤—Л—Е (–њ–µ—А–≤–Њ–≥–Њ –Є –≤—В–Њ—А–Њ–≥–Њ —В–Є–њ–Њ–≤: α1, α2) —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –Є–Ј –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ –Є–љ–≥–Є–±–Є—А—Г—О—В —Д–µ—А–Љ–µ–љ—В—Л (–Є–љ–≥–Є–±–Є—В–Њ—А—Л —Д–µ—А–Љ–µ–љ—В–Њ–≤), –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–Є–µ –Њ–±—А–∞—В–љ—Л–є –Ј–∞—Е–≤–∞—В –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—В—В–µ—А–Њ–≤ –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ–∞ (NA), –і–Њ—Д–∞–Љ–Є–љ–∞ (DA) –Є–ї–Є —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞ (5––Э–Ґ). –Э–∞–±–Њ—А –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –і–µ–є—Б—В–≤–Є—П –≤–Њ –Љ–љ–Њ–≥–Њ–Љ –Є–љ–і–Є–≤–Є–і—Г–∞–ї–µ–љ –і–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ (—В–∞–±–ї. 1). –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, —Н—В–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л (–≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ D2–—А–µ—Ж–µ–њ—В–Њ—А—Л) —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В —Б–Ї–Њ—А–µ–µ –Ї–Њ–љ–Ї—А–µ—В–љ—Л–є –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, —Б–∞–Љ–Њ –љ–∞–ї–Є—З–Є–µ/–Њ—В—Б—Г—В—Б—В–≤–Є–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ—Л—Е —Б–≤–Њ–є—Б—В–≤ (–Љ–Њ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–љ—Л–µ, –Њ–ї–Є–≥–Њ—А–µ—Ж–µ–њ—В–Њ—А–љ—Л–µ, –њ–Њ–ї–Є—А–µ—Ж–µ–њ—В–Њ—А–љ—Л–µ, –Є–љ–≥–Є–±–Є—В–Њ—А—Л —Д–µ—А–Љ–µ–љ—В–Њ–≤) —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ –Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А—Г—О—Й–Є–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–Љ –≥—А—Г–њ–њ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –∞, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Љ–Њ–ґ–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –њ—А–Є —Б–Њ–Ј–і–∞–љ–Є–Є –Є—Е –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є.
–Я–µ—А–µ—Е–Њ–і—П —В–µ–њ–µ—А—М –Ї —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–∞–Љ, –Ї–Њ—В–Њ—А—Л–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –і–µ–є—Б—В–≤–Є—П –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤, —Г–Ї–∞–ґ–µ–Љ, —З—В–Њ –Є—Е —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї—Г–њ–Є—А–Њ–≤–∞—В—М –±—А–µ–і –Є –≥–∞–ї–ї—О—Ж–Є–љ–∞—Ж–Є–Є —Б–≤—П–Ј–∞–љ–∞ —Б –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ –њ–Њ–≤—Л—И–µ–љ–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –і–Њ—Д–∞–Љ–Є–љ–∞ –≤ –Љ–µ–Ј–Њ–ї–Є–Љ–±–Є—З–µ—Б–Ї–Њ–є —Б–Є—Б—В–µ–Љ–µ [20]. –Ю—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –і–ї—П —Н—В–Њ–≥–Њ –ї—Г—З—И–µ –≤—Б–µ–≥–Њ –њ–Њ–і—Е–Њ–і—П—В –њ—А–µ–њ–∞—А–∞—В—Л––∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л, –±–ї–Њ–Ї–Є—А—Г—О—Й–Є–µ D2–—А–µ—Ж–µ–њ—В–Њ—А—Л. –Я—А–Є —Н—В–Њ–Љ –і–Њ—Д–∞–Љ–Є–љ –љ–µ —Б–Љ–Њ–ґ–µ—В —Б–Њ–µ–і–Є–љ–Є—В—М—Б—П —Б —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –Є –Њ–Ї–∞–Ј–∞—В—М —Б–≤–Њ–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –≤–ї–Є—П–љ–Є–µ. –Ш –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤—Л—П–≤–ї–µ–љ–∞ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Љ–µ–ґ–і—Г –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –±–ї–Њ–Ї–Є—А–Њ–≤–∞–љ–љ—Л—Е D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤. –Я—А–Є—З–µ–Љ —Н—В–∞ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –љ–µ –љ–Њ—Б–Є—В —Е–∞—А–∞–Ї—В–µ—А–∞ –њ—А–Њ—Б—В–Њ–є –њ—А—П–Љ–Њ–є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є. –Ґ–∞–Ї, –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В —Г –њ–Њ–і–∞–≤–ї—П—О—Й–µ–≥–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –ї–Є—И—М –њ—А–Є –±–ї–Њ–Ї–∞–і–µ –±–Њ–ї–µ–µ 65% D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ [16]. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –і–Њ–ї—П –≤—Л–Ї–ї—О—З–µ–љ–љ—Л—Е (–Ј–∞–±–ї–Њ–Ї–Є—А–Њ–≤–∞–љ–љ—Л—Е) —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –і–Њ–Ј –њ—А–µ–њ–∞—А–∞—В–∞ —П–≤–ї—П–µ—В—Б—П –µ–≥–Њ –≤–∞–ґ–љ–µ–є—И–µ–є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Њ–є. –Ь–µ–ґ–і—Г —В–µ–Љ, –Њ–і–љ–Є –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Є (–љ–∞–њ—А–Є–Љ–µ—А, –≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї, –Ј—Г–Ї–ї–Њ–њ–µ–љ—В–Є–Ї—Б–Њ–ї, —А–Є—Б–њ–µ—А–Є–і–Њ–љ –Є –і—А.) –≤ —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –і–Њ–Ј–Є—А–Њ–≤–Ї–∞—Е —П–≤–љ–Њ —Б–њ–Њ—Б–Њ–±–љ—Л «–≤–Ј—П—В—М –љ–∞ —Б–µ–±—П –±–Њ–ї—М—И—Г—О –і–Њ–ї—О» [4]. –Ф—А—Г–≥–Є–µ, –љ–∞–њ—А–Є–Љ–µ—А, –Њ–ї–∞–љ–Ј–∞–њ–Є–љ, –±–ї–Њ–Ї–Є—А—Г—О—В –њ—А–Є–Љ–µ—А–љ–Њ —Б—В–Њ–ї—М–Ї–Њ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, —Б–Ї–Њ–ї—М–Ї–Њ —Н—В–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –і–ї—П —А–∞–Ј–≤–Є—В–Є—П –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞.
–°—Г—Й–µ—Б—В–≤—Г–µ—В, –Њ–і–љ–∞–Ї–Њ, –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —З–Є—Б–ї–Њ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ (–љ–∞–њ—А–Є–Љ–µ—А, –Ї–ї–Њ–Ј–∞–њ–Є–љ, –Ї–≤–µ—В–Є–∞–њ–Є–љ), –љ–µ —Б–њ–Њ—Б–Њ–±–љ—Л—Е «–Ј–∞–Ї—А—Л—В—М —Б–Њ–±–Њ–є» 65% D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ [2,17]. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –њ—А–µ–њ–∞—А–∞—В—Л –Є–Ј —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є –≥—А—Г–њ–њ—Л (–∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤) –Љ–Њ–≥—Г—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М—Б—П –љ–∞ –≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л–µ (–±–ї–Њ–Ї–Є—А—Г—О—Й–Є–µ –±–Њ–ї–µ–µ 65% —Н—В–Є—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤) –Є –љ–Є–Ј–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л–µ (–±–ї–Њ–Ї–Є—А—Г—О—Й–Є–µ –Љ–µ–љ–µ–µ 65% –і–∞–љ–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤). –Я–Њ–љ—П—В–љ–Њ, —З—В–Њ –ї–Є—И—М –њ–µ—А–≤—Л–µ –Є–Ј —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ (–≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л–µ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л) —Б–њ–Њ—Б–Њ–±–љ—Л —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Њ–≤–∞—В—М –љ–∞ –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤—В–Њ—А—Л–µ (–љ–Є–Ј–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л–µ) – –љ–µ—В.
–Ш–Ј —Н—В–Њ–≥–Њ –Њ–±—Й–µ–≥–Њ –њ—А–∞–≤–Є–ї–∞ —Б—Г—Й–µ—Б—В–≤—Г–µ—В, –Њ–і–љ–∞–Ї–Њ, –Њ–і–љ–Њ –≤–∞–ґ–љ–Њ–µ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ, —Б–≤—П–Ј–∞–љ–љ–Њ–µ —Б —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–Љ–Є «–њ—Б–Є—Е–Њ–Ј–∞–Љ–Є –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є». –Ш—Е –њ–∞—В–Њ–≥–µ–љ–µ–Ј –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –њ–Њ–њ—Л—В–Ї–∞–Љ–Є –і–Њ—Д–∞–Љ–Є–љ–Њ–≤—Л—Е –љ–µ–є—А–Њ–љ–Њ–≤ «–Њ–±–Њ–є—В–Є» –±–ї–Њ–Ї–∞–і—Г, –≤—Л–Ј–≤–∞–љ–љ—Г—О –≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л–Љ–Є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Ф–ї—П —Н—В–Њ–≥–Њ –љ–µ–є—А–Њ–љ—Л –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ –њ–Њ–≤—Л—И–∞—О—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М —Г–Ї–∞–Ј–∞–љ–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Ї –і–Њ—Д–∞–Љ–Є–љ—Г –Є –і–∞–ґ–µ —Б–Є–љ—В–µ–Ј–Є—А—Г—О—В –љ–Њ–≤—Л–µ. –Т –Є—В–Њ–≥–µ, —А–∞–љ–Њ –Є–ї–Є –њ–Њ–Ј–і–љ–Њ –±–ї–Њ–Ї–∞–і–∞ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –њ—А–Њ—А–≤–∞–љ–љ–Њ–є, –Є –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –Њ–±–Њ—Б—В—А—П—О—В—Б—П. –Э–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ –і–Њ–Ј—Л –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–∞ –≤—А–Њ–і–µ –±—Л –≤–Њ–Ј–≤—А–∞—Й–∞–µ—В –Ї–Њ–љ—В—А–Њ–ї—М –љ–∞–і —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ –±–Њ–ї—М–љ–Њ–≥–Њ. –Э–Њ –Ј–∞—В–µ–Љ –≤—Л—И–µ–Њ–њ–Є—Б–∞–љ–љ–∞—П —Б–Є—В—Г–∞—Ж–Є—П –њ–Њ–≤—В–Њ—А—П–µ—В—Б—П. –†–∞–Ј–Њ—А–≤–∞—В—М –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–є –њ–Њ—А–Њ—З–љ—Л–є –Ї—А—Г–≥ –Љ–Њ–ґ–љ–Њ –ї–Є—И—М –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –љ–Є–Ј–Ї–Њ–њ–Њ—В–µ–љ—В–љ–Њ–≥–Њ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–∞, –љ–∞–њ—А–Є–Љ–µ—А –Ї–ї–Њ–Ј–∞–њ–Є–љ–∞, –љ–µ —Б–њ–Њ—Б–Њ–±–љ–Њ–≥–Њ –Ј–∞–±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М –і–∞–ґ–µ 50% D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Я—А–Є —Н—В–Њ–Љ —В–∞–Ї–∞—П «—Б–ї–∞–±–Њ—Б—В—М» –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–µ–≤—А–∞—Й–∞–µ—В—Б—П –≤ –µ–≥–Њ —Б–Є–ї—Г, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –љ–µ–є—А–Њ–љ –≤ —Н—В–Є—Е «–Њ–±–ї–µ–≥—З–µ–љ–љ—Л—Е» —Г—Б–ї–Њ–≤–Є—П—Е —Б–љ–Є–ґ–∞–µ—В –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М —Б–≤–Њ–µ–є «–±–Њ—А—М–±—Л» —Б —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–µ–є.
–Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –і—А—Г–≥–Є—Е –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –њ–Њ–і—Е–Њ–і–Є—В –і–ї—П –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤. –Ґ–∞–Ї, —Б—Г–ї—М–њ–Є—А–Є–і –Є –∞–Љ–Є—Б—Г–ї—М–њ—А–Є–і (–њ–∞—А—Ж–Є–∞–ї—М–љ—Л–µ –∞–≥–Њ–љ–Є—Б—В—Л/–∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л) –≤—Л—Б—В—Г–њ–∞—О—В –≤ –Ї–∞—З–µ—Б—В–≤–µ –±–ї–Њ–Ї–∞—В–Њ—А–∞ D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –ї–Є—И—М –≤ –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї–Є—Е —Б—Г—В–Њ—З–љ—Л—Е –і–Њ–Ј–∞—Е, –∞ –≤ –љ–Є–Ј–Ї–Є—Е – —П–≤–ї—П—О—В—Б—П –Є—Е –њ–∞—А—Ж–Є–∞–ї—М–љ—Л–Љ–Є –∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –≤—Б–µ–≥–і–∞ —Б–Њ—Е—А–∞–љ—П—О—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –і–Њ—Д–∞–Љ–Є–љ–Њ–≤–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Я—А–Є—З–µ–Љ –≥—А–∞–љ–Є—Ж—Л —Н—В–Є—Е –і–Њ–Ј –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —В–Њ—З–љ–Њ –љ–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л. –Ш–Љ–µ—О—В—Б—П —В–Њ–ї—М–Ї–Њ –Њ—В—А—Л–≤–Њ—З–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ —В–Њ–Љ, —З—В–Њ –∞–Љ–Є—Б—Г–ї—М–њ—А–Є–і –≤—Л—Б—В—Г–њ–∞–µ—В –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞ D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≤ —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј–µ, –њ—А–µ–≤—Л—И–∞—О—Й–µ–є 40 –Љ–≥ –љ–∞ –Ї–Є–ї–Њ–≥—А–∞–Љ–Љ –Љ–∞—Б—Б—Л —В–µ–ї–∞ [18]. –Ю–і–љ–∞–Ї–Њ –Њ—Б—В–∞–µ—В—Б—П –љ–µ —П—Б–љ—Л–Љ, —П–≤–ї—П–µ—В—Б—П –ї–Є –≤ —В–∞–Ї–Њ–Љ —Б–ї—Г—З–∞–µ —Н—В–Њ—В –њ—А–µ–њ–∞—А–∞—В –≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л–Љ –Є–ї–Є –љ–Є–Ј–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л–Љ. –Ш–љ—Л–Љ–Є —Б–ї–Њ–≤–∞–Љ–Є, –љ–µ–Є–Ј–≤–µ—Б—В–љ–Њ, –Љ–Њ–ґ–љ–Њ –ї–Є –і–∞–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В —Б —Г—Б–њ–µ—Е–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ—А–Є –ї–µ—З–µ–љ–Є–Є –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є–ї–Є –љ–µ—В.
–Т –і–Њ–Ј–µ –Њ—В 10 –і–Њ 40 –Љ–≥ –љ–∞ –Ї–Є–ї–Њ–≥—А–∞–Љ–Љ –Љ–∞—Б—Б—Л —В–µ–ї–∞ —Б–≤–Њ–є—Б—В–≤–∞ –∞–Љ–Є—Б—Г–ї—М–њ—А–Є–і–∞ –љ–Њ—Б—П—В –љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А. –Ш–љ—Л–Љ–Є —Б–ї–Њ–≤–∞–Љ–Є, –њ—А–µ–њ–∞—А–∞—В –Љ–Њ–ґ–µ—В –±—Л—В—М –Ї–∞–Ї –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–Љ, —В–∞–Ї –Є –њ–∞—А—Ж–Є–∞–ї—М–љ—Л–Љ –∞–≥–Њ–љ–Є—Б—В–Њ–Љ D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –µ–≥–Њ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –љ–µ–њ—А–µ–і—Б–Ї–∞–Ј—Г–µ–Љ. –Э–∞–Ї–Њ–љ–µ—Ж, –≤ —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј–µ –Љ–µ–љ–µ–µ 10 –Љ–≥ –љ–∞ –Ї–Є–ї–Њ–≥—А–∞–Љ–Љ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –∞–Љ–Є—Б—Г–ї—М–њ—А–Є–і –≤–Њ–Њ–±—Й–µ –љ–µ —Б–њ–Њ—Б–Њ–±–µ–љ –±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М —Н—В–Є —А–µ—Ж–µ–њ—В–Њ—А—Л, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —П–≤–ї—П–µ—В—Б—П –Є—Е –њ–∞—А—Ж–Є–∞–ї—М–љ—Л–Љ –∞–≥–Њ–љ–Є—Б—В–Њ–Љ. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –і–µ–є—Б—В–≤—Г–µ—В –µ—Й–µ –Њ–і–Є–љ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї – –∞—А–Є–њ–Є–њ—А–∞–Ј–Њ–ї. –≠—В–Њ—В –њ—А–µ–њ–∞—А–∞—В –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –і–Њ–Ј—Л —П–≤–ї—П–µ—В—Б—П –њ–∞—А—Ж–Є–∞–ї—М–љ—Л–Љ –∞–≥–Њ–љ–Є—Б—В–Њ–Љ D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –љ–µ –Љ–Њ–ґ–µ—В –Є—Е –±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М (—В–∞–±–ї. 1).
–Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –љ–µ–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ —Б–≤—П–Ј–∞–љ—Л —Б –Њ—Б—В–∞–ї—М–љ—Л–Љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є –і–µ–є—Б—В–≤–Є—П –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—В —А–∞–Ј–љ–Њ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–Љ –≤–ї–Є—П–љ–Є—П–Љ –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–љ—Л—Е –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—В—В–µ—А–Њ–≤ (—Г–ґ–µ —Г–њ–Њ–Љ—П–љ—Г—В—Л—Е DA, NA, 5–HT, –∞ —В–∞–Ї–ґ–µ γ––∞–Љ–Є–љ–Њ–Љ–∞—Б–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л – GABA, –≥–Є—Б—В–∞–Љ–Є–љ–∞ – Hi, –∞—Ж–µ—В–Є–ї—Е–Њ–ї–Є–љ–∞ – Ach) (—В–∞–±–ї. 1 –Є 2). –≠—В–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В —Г –≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л—Е –Є –љ–Є–Ј–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л—Е –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤, –њ–∞—А—Ж–Є–∞–ї—М–љ—Л—Е –∞–≥–Њ–љ–Є—Б—В–Њ–≤/–∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ –њ–∞—А—Ж–Є–∞–ї—М–љ—Л—Е –∞–≥–Њ–љ–Є—Б—В–Њ–≤, –љ–Њ –і–∞–ї–µ–Ї–Њ –љ–µ –≤ —А–∞–≤–љ–Њ–є –Љ–µ—А–µ (—В–∞–±–ї. 1). –£ –њ–∞—А—Ж–Є–∞–ї—М–љ—Л—Е –∞–≥–Њ–љ–Є—Б—В–Њ–≤/–∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ (–Љ–Њ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л) –Њ–љ–Є –Ї–Њ–љ—Ж–µ–љ—В—А–Є—А—Г—О—В—Б—П –≤–Њ–Ї—А—Г–≥ –µ–і–Є–љ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –і–µ–є—Б—В–≤–Є—П – —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –њ–Њ–≤—Л—И–∞—В—М —А–∞–љ–µ–µ —Б–љ–Є–ґ–µ–љ–љ—Г—О –і–Њ—Д–∞–Љ–Є–љ–Њ–≤—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –њ–Њ–і–Њ–±—А–∞–љ–љ—Л—Е –љ–Є–Ј–Ї–Є—Е —Б—Г—В–Њ—З–љ—Л—Е –і–Њ–Ј. –£ –Њ—Б—В–∞–ї—М–љ—Л—Е –≥—А—Г–њ–њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –±–Њ–ї—М—И–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –і–µ–є—Б—В–≤–Є—П, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є—Е –Є–Љ –≤–ї–Є—П—В—М –љ–∞ –љ–µ–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л (–њ–Њ–ї–Є—А–µ—Ж–µ–њ—В–Њ—А–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Є –Є–љ–≥–Є–±–Є—В–Њ—А—Л —Д–µ—А–Љ–µ–љ—В–Њ–≤). –Ю–і–љ–∞–Ї–Њ —Г —Н—В–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –Љ–Њ–ґ–µ—В –±—Л—В—М —А–∞–Ј–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, —Б–ї–µ–і—Г–µ—В —Г—З–Є—В—Л–≤–∞—В—М, —З—В–Њ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ —Д–µ—А–Љ–µ–љ—В–Њ–≤ –≤–ї–Є—П–µ—В –љ–∞ –Њ–±–Љ–µ–љ –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—В—В–µ—А–Њ–≤ –≤ –±–Њ–ї—М—И–µ–є –Љ–µ—А–µ, –љ–µ–ґ–µ–ї–Є –∞–љ—В–∞–≥–Њ–љ–Є–Ј–Љ –Є–ї–Є –∞–≥–Њ–љ–Є–Ј–Љ –Ї —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Љ–љ–Њ–≥–Є–µ –Є–Ј —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –і–µ–є—Б—В–≤–Є—П (–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –±–ї–Њ–Ї–∞–і—Л –≥–Є—Б—В–∞–Љ–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–µ–є —Б–µ–і–∞—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В) –≤–њ–Њ–ї–љ–µ –Љ–Њ–≥—Г—В –≤—Б—В—Г–њ–∞—В—М –≤ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–µ –Ї–∞–Ї –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є, —В–∞–Ї –Є —Б –±–ї–Њ–Ї–∞–і–Њ–є D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Э–∞–њ—А–Є–Љ–µ—А, —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–∞ –∞–Ї—В–Є–≤–Є–Ј–Є—А–Њ–≤–∞—В—М –і–Њ—Д–∞–Љ–Є–љ–Њ–≤—Л–µ –љ–µ–є—А–Њ–љ—Л –Ј–∞ —Б—З–µ—В –≤—Л–±—А–Њ—Б–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–≥–Њ –љ–µ–є—А–Њ–Љ–µ–і–Є–∞—В–Њ—А–∞ —Б–љ–Є–ґ–∞–µ—В—Б—П –≤ —Г—Б–ї–Њ–≤–Є—П—Е –±–ї–Њ–Ї–∞–і—Л –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–≥–Њ —З–Є—Б–ї–∞ –і–Њ—Д–∞–Љ–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Ґ–∞ –ґ–µ –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ—Б—В—М –Ї–∞—Б–∞–µ—В—Б—П –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ–Њ–≤—Л—Е –љ–µ–є—А–Њ–љ–Њ–≤ –Є –∞–љ—В–∞–≥–Њ–љ–Є–Ј–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –Ї α1––∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ.
–° —Г—З–µ—В–Њ–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –Љ–Њ–ґ–љ–Њ –Ј–∞–Ї–ї—О—З–Є—В—М, —З—В–Њ –Њ–ї–Є–≥–Њ—А–µ—Ж–µ–њ—В–Њ—А–љ—Л–µ –≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л–µ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≤–µ—Б—М–Љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ (—В–∞–±–ї. 3). –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≤–ї–Є—П–љ–Є—П –љ–∞ –љ–µ–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ —Г —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –µ–і–Є–љ—Б—В–≤–µ–љ–љ–Њ–є –Љ–Є—И–µ–љ—М—О –і–ї—П —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є –≥—А—Г–њ–њ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —П–≤–ї—П—О—В—Б—П –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л.
–Я–Њ–ї–Є—А–µ—Ж–µ–њ—В–Њ—А–љ—Л–µ –≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л–µ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —В–∞–Ї–ґ–µ –∞–Ї—В–Є–≤–љ—Л –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≤–ї–Є—П–љ–Є—П –љ–∞ –љ–µ–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П —А–∞–Ј–љ—Л—Е –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ —Г –љ–Є—Е –љ–Њ—Б–Є—В —Г–Љ–µ—А–µ–љ–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А (–љ–µ —Б–њ–Њ—Б–Њ–±–љ—Л –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М —Д–µ—А–Љ–µ–љ—В—Л, –∞–Ї—В–Є–≤–љ–Њ –±–ї–Њ–Ї–Є—А—Г—О—В –і–Њ—Д–∞–Љ–Є–љ–Њ–≤—Л–µ –Є –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ–Њ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л). –Т –Є—В–Њ–≥–µ —Н—В–Є —Б–≤–Њ–є—Б—В–≤–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ—Г–ґ–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М —Б–Ї–Њ—А–µ–µ –Ї–∞–Ї –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї –Є—Е –Њ—Б–љ–Њ–≤–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є – –Ї—Г–њ–Є—А–Њ–≤–∞—В—М –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л.
–Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –љ–Є–Ј–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л—Е –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≤–ї–Є—П—В—М –љ–∞ –љ–µ–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –љ–Њ—Б–Є—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А (–њ–Њ–ї–Є—А–µ—Ж–µ–њ—В–Њ—А–љ–Њ—Б—В—М, —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М —Д–µ—А–Љ–µ–љ—В—Л, —Б–ї–∞–±–∞—П –±–ї–Њ–Ї–∞–і–∞ –і–Њ—Д–∞–Љ–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤). –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П —Б–Є–ї—М–љ–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ—Б–љ–Њ–≤–љ–Њ–є –Љ–Є—И–µ–љ–Є –і–ї—П —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤—Л—Б—В—Г–њ–∞—О—В –љ–µ–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л, –∞ –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ – –ї–Є—И—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е.
–Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ–∞—А—Ж–Є–∞–ї—М–љ—Л–µ –∞–≥–Њ–љ–Є—Б—В—Л/–∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –Њ—Б–љ–Њ–≤–љ—Л–Љ –Є –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –і–ї—П –Є—Е –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —П–≤–ї—П–µ—В—Б—П —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ–љ–∞—П –≥—А—Г–њ–њ–∞ –љ–µ–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ –і–Њ—Д–∞–Љ–Є–љ–Њ–≤–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є.
–Э–∞–Ї–Њ–љ–µ—Ж, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –µ–і–Є–љ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ–∞—А—Ж–Є–∞–ї—М–љ–Њ–≥–Њ –∞–≥–Њ–љ–Є—Б—В–∞ D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≤–ї–Є—П—В—М –љ–∞ –љ–µ–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –љ–Њ—Б–Є—В –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є (–≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –ї—О–±—Л–Љ–Є –Є–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є) —Е–∞—А–∞–Ї—В–µ—А (–њ–Њ–ї–Є—А–µ—Ж–µ–њ—В–Њ—А–љ–Њ—Б—В—М, —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М —Д–µ—А–Љ–µ–љ—В—Л, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –±–ї–Њ–Ї–∞–і—Л –і–Њ—Д–∞–Љ–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤). –Э–∞–њ—А–Њ—В–Є–≤, –њ–Њ—В–µ–љ—Ж–Є–∞–ї –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤—Л–≥–ї—П–і–Є—В –љ–∞–Є–Љ–µ–љ–µ–µ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л–Љ —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –і–µ–є—Б—В–≤–Є—П. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –Њ—Б–љ–Њ–≤–љ—Л–Љ –Є –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞—А–Є–њ–Є–њ—А–∞–Ј–Њ–ї–∞ —П–≤–ї—П–µ—В—Б—П —И–Є—А–Њ–Ї–Є–є –Ї—А—Г–≥ –љ–µ–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Њ–±–Љ–µ–љ–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—В—В–µ—А–Њ–≤.
–Ч–∞–≤–µ—А—И–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї—Г –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є, —Г–Ї–∞–ґ–µ–Љ, —З—В–Њ –Њ–љ–∞ –≤–њ–Њ–ї–љ–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –Ї–∞–Ї —В–µ–Њ—А–Є–Є, —В–∞–Ї –Є –і–∞–љ–љ—Л–Љ –Њ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –Њ–љ–∞ –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ—Б–љ–Њ–≤–∞–љ–∞ –љ–∞ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П—Е –Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞—Е –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (—В–∞–±–ї. 1) –Є –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ (—В–∞–±–ї. 2) [2,6,13,15,19,20]. –І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –њ—Б–Є—Е–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є, —В–Њ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Ї—А—Г–њ–љ—Л—Е –∞–љ–Ї–µ—В–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –љ–µ–і–∞–≤–љ–Њ –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ, –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –ї–Є—И—М –Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ–µ —З–Є—Б–ї–Њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П —Г –±–Њ–ї—М–љ—Л—Е —И–Є–Ј–Њ—Д—А–µ–љ–Є–µ–є –≤ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –і–Њ–Ј–∞—Е [3,5]. –Я—А–Є—З–µ–Љ –≤—Б–µ –Њ–љ–Є –Њ—В–љ–Њ—Б—П—В—Б—П –Ї –≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л–Љ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞–Љ D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (–≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї, –Ј—Г–Ї–ї–Њ–њ–µ–љ—В–Є–Ї—Б–Њ–ї, —В—А–Є—Д–ї—Г–Њ–њ–µ—А–∞–Ј–Є–љ, —А–Є—Б–њ–µ—А–Є–і–Њ–љ, –Њ–ї–∞–љ–Ј–∞–њ–Є–љ, —Д–ї—Г—Д–µ–љ–∞–Ј–Є–љ). –°—Г—В–Њ—З–љ—Л–µ –і–Њ–Ј–Є—А–Њ–≤–Ї–Є –Њ—Б—В–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–Є–Ј–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л—Е –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ –Є –њ–∞—А—Ж–Є–∞–ї—М–љ—Л—Е –∞–≥–Њ–љ–Є—Б—В–Њ–≤/–∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ – —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–Є–ґ–µ. –≠—В–∞ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М –њ—А–∞–Ї—В–Є–Ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ –Љ–Њ–ґ–µ—В –±—Л—В—М –Є–љ—В–µ—А–њ—А–µ—В–Є—А–Њ–≤–∞–љ–∞ —Б–ї–µ–і—Г—О—Й–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ. –Я—Г—В–µ–Љ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –њ—А–Њ–± –Є –Њ—И–Є–±–Њ–Ї –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–µ –њ—Б–Є—Е–Є–∞—В—А—Л –Њ—В–Њ–±—А–∞–ї–Є –њ—А–µ–њ–∞—А–∞—В—Л, —Б–њ–Њ—Б–Њ–±–љ—Л–µ –≤ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –і–Њ–Ј–∞—Е –Ї—Г–њ–Є—А–Њ–≤–∞—В—М –љ–∞–Є–±–Њ–ї–µ–µ —П—А–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П —И–Є–Ј–Њ—Д—А–µ–љ–Є–Є – –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л (–Ї—Г–њ–Є—А—Г—О—Й–∞—П —В–µ—А–∞–њ–Є—П), –∞ –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ – –љ–∞–і–µ–ґ–љ–Њ —Б–Њ—Е—А–∞–љ—П—В—М —Н—В–Њ—В —Н—Д—Д–µ–Ї—В (–њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–∞—П —В–µ—А–∞–њ–Є—П). –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В—Л —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–ї–Є —Б–њ–Є—Б–Њ–Ї –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –љ–µ –≤–њ–Њ–ї–љ–µ –њ—А–Є–≥–Њ–і–љ—Л—Е –і–ї—П —Г–Ї–∞–Ј–∞–љ–љ–Њ–є —Ж–µ–ї–Є. –Э–Њ —Н—В–Є–Љ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–∞–Љ, —А–∞–Ј —Г–ґ–µ –Њ–љ–Є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П, —В–∞–Ї–ґ–µ –љ–∞—И–ї–Њ—Б—М –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ. –Я—А–Є—З–µ–Љ, –њ–Њ –≤—Б–µ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є, –Њ–љ–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –Є—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –љ–∞ –љ–µ–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л.
–†–∞—Б—Б–Љ–Њ—В—А–µ–љ–љ–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –≤–∞–ґ–љ–∞ –Ї–∞–Ї –≤ —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Њ–Љ, —В–∞–Ї –Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–Љ –њ–ї–∞–љ–µ. –Я—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ –≤–∞–ґ–љ–Њ, —З—В–Њ –≤ –њ—Б–Є—Е–Є–∞—В—А–Є–Є –Љ–Њ–≥—Г—В –±—Л—В—М —Б —Г—Б–њ–µ—Е–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ—Л —В–µ –ґ–µ –њ–Њ–і—Е–Њ–і—Л –Ї –∞–љ–∞–ї–Є–Ј—Г —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є, —З—В–Њ –Є –≤ –і—А—Г–≥–Є—Е –Њ—В—А–∞—Б–ї—П—Е –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е –Ј–љ–∞–љ–Є–є. –Ю—З–µ–≤–Є–і–љ–Њ —В–∞–Ї–ґ–µ, —З—В–Њ —В–µ—А–Љ–Є–љ «–∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Є» –љ–µ –≤–њ–Њ–ї–љ–µ —Г–і–∞—З–µ–љ –і–ї—П –Њ–±–Њ–Ј–љ–∞—З–µ–љ–Є—П –≤—Б–µ–≥–Њ —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–љ–Њ–≥–Њ –Ї–ї–∞—Б—Б–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Э–∞–њ–Њ–Љ–љ–Є–Љ, —З—В–Њ –і–∞–ґ–µ –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–µ –њ—Б–Є—Е–Є–∞—В—А—Л, –њ–Њ –≤—Б–µ–є –≤–Є–і–Є–Љ–Њ—Б—В–Є, —Е–Њ—А–Њ—И–Њ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–µ–±–µ, —З—В–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —З–Є—Б–ї–Њ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ –≤–Њ–Њ–±—Й–µ –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –і–ї—П –ї–µ—З–µ–љ–Є—П –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤. –Я–Њ—Н—В–Њ–Љ—Г —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ—Л–є –Ї–ї–∞—Б—Б –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ї—Г—З—И–µ –Њ–±–Њ–Ј–љ–∞—З–Є—В—М –Ї–∞–Ї –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞, –Њ–±–ї–∞–і–∞—О—Й–Є–µ –∞—Д—Д–Є–љ–Є—В–µ—В–Њ–Љ (—Б—А–Њ–і—Б—В–≤–Њ–Љ) –Ї D2–—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ.
–Ґ–∞–Ї–Њ–µ «–Є—Б–њ—А–∞–≤–ї–µ–љ–Є–µ –Є–Љ–µ–љ» –Љ–Њ–ґ–µ—В –Є–Љ–µ—В—М –±–Њ–ї—М—И–Њ–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ. –Э–µ —Б–µ–Ї—А–µ—В, —З—В–Њ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –∞–Ї—В–Є–≤–љ–Њ–µ «–≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ» –≤—А–∞—З–µ–є –љ–µ–њ—Б–Є—Е–Є–∞—В—А–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Д–µ—Б—Б–Є–є –≤ –ї–µ—З–µ–љ–Є–µ –љ–µ–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ (–і–µ–њ—А–µ—Б—Б–Є–Є, —В—А–µ–≤–Њ–≥–∞ –Є —В.–і.). –Я—А–Є –≤—Б–µ–є –љ–µ–Њ–і–љ–Њ–Ј–љ–∞—З–љ–Њ—Б—В–Є —Н—В–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –Ј–∞–Љ–µ—В–Є–Љ, —З—В–Њ –і–ї—П –ї–µ—З–µ–љ–Є—П —Ж–µ–ї–Њ–≥–Њ —А—П–і–∞ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤ —Б—В—А—Г–Ї—В—Г—А–µ –і–∞–љ–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є —Г–ґ–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П (–∞–ї–Є–Љ–µ–Љ–∞–Ј–Є–љ, —В–Є–Њ—А–Є–і–∞–Ј–Є–љ, —Б—Г–ї—М–њ–Є—А–Є–і –Є —В.–і.) –Є–ї–Є –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –Љ–Њ–≥—Г—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –Љ–љ–Њ–≥–Є–µ –љ–Є–Ј–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л–µ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л, –њ–∞—А—Ж–Є–∞–ї—М–љ—Л–µ –∞–≥–Њ–љ–Є—Б—В—Л/–∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л –Є–ї–Є –њ–∞—А—Ж–Є–∞–ї—М–љ—Л–µ –∞–≥–Њ–љ–Є—Б—В—Л. –Х—Б–ї–Є –і–ї—П –Є—Е –Њ–±–Њ–Ј–љ–∞—З–µ–љ–Є—П –њ—А–Њ–і–Њ–ї–ґ–∞—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —В–µ—А–Љ–Є–љ «–∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї», —В–Њ —Н—В–Њ –≤—Л–Ј–Њ–≤–µ—В –љ–µ–њ–Њ–љ–Є–Љ–∞–љ–Є–µ (–∞ —В–Њ –Є –Њ—В–Ї—А–Њ–≤–µ–љ–љ—Л–є —Б—В—А–∞—Е) —Г –≤—А–∞—З–µ–є –Є –Њ—А–≥–∞–љ–Є–Ј–∞—В–Њ—А–Њ–≤ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П. –Э–∞–њ—А–Њ—В–Є–≤, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ–Њ–љ—П—В–Є—П «–њ—А–µ–њ–∞—А–∞—В—Л, –Њ–±–ї–∞–і–∞—О—Й–Є–µ –∞—Д—Д–Є–љ–Є—В–µ—В–Њ–Љ –Ї D2–—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ», —Б –і–∞–ї—М–љ–µ–є—И–Є–Љ —А–∞–Ј—К—П—Б–љ–µ–љ–Є–µ–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –і–µ–є—Б—В–≤–Є—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Б—А–µ–і—Б—В–≤–∞ (–њ–Њ–ї–Є—А–µ—Ж–µ–њ—В–Њ—А–љ—Л–µ, –Є–љ–≥–Є–±–Є—В–Њ—А—Л —Д–µ—А–Љ–µ–љ—В–Њ–≤ –Є —В.–і.) –±—Г–і–µ—В –≤–њ–Њ–ї–љ–µ –≤ —А—Г—Б–ї–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л –Є –њ–Њ–Ј–≤–Њ–ї–Є—В —Б–љ—П—В—М –Љ–љ–Њ–≥–Є–µ –≤–Њ–њ—А–Њ—Б—Л.
–Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–є –њ–Њ–і—Е–Њ–і –Ї –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є —Б—А–µ–і—Б—В–≤, –Њ–±–ї–∞–і–∞—О—Й–Є—Е –∞—Д—Д–Є–љ–Є—В–µ—В–Њ–Љ –Ї D2–—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ, –њ–Њ–ї–љ–Њ—Б—В—М—О –ї–Є—И–µ–љ —А–µ–Ї–ї–∞–Љ–љ—Л—Е —В–µ—А–Љ–Є–љ–Њ–≤ (–њ–Њ–Ї–Њ–ї–µ–љ–Є–µ, –≥–µ–љ–µ—А–∞—Ж–Є—П –Є —В.–і.). –Ю–і–љ–∞–Ї–Њ –Њ–љ –љ–∞—А—П–і—Г —Б –і–∞–љ–љ—Л–Љ–Є –Њ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–∞—Е –≤–њ–Њ–ї–љ–µ –≥–Њ–і–Є—В—Б—П –Є –і–ї—П —А–µ—И–µ–љ–Є—П –Љ–∞—А–Ї–µ—В–Є–љ–≥–Њ–≤—Л—Е –њ—А–Њ–±–ї–µ–Љ. –Ф–Њ–њ—Г—Б—В–Є–Љ, —З—В–Њ —В—А–µ–±—Г–µ—В—Б—П –Њ–±—К—П—Б–љ–Є—В—М, –њ–Њ—З–µ–Љ—Г –Њ–ї–∞–љ–Ј–∞–њ–Є–љ –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П —П–≤–ї—П–µ—В—Б—П —Б–∞–Љ—Л–Љ –њ–Њ–њ—Г–ї—П—А–љ—Л–Љ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–Љ –≤–Њ –Љ–љ–Њ–≥–Є—Е —Б—В—А–∞–љ–∞—Е –Љ–Є—А–∞, –≤–Ї–ї—О—З–∞—П –°–®–Р [12].
–Ю–±—А–∞—В–Є–Љ—Б—П –Ї –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є. –°–Њ–≥–ї–∞—Б–љ–Њ –µ–є –Њ–ї–∞–љ–Ј–∞–њ–Є–љ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ—Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–љ –Ї–∞–Ї –≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л–є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, –Њ–±–ї–∞–і–∞—О—Й–Є–є –њ–Њ–ї–Є—А–µ—Ж–µ–њ—В–Њ—А–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –Њ–љ –≤–њ–Њ–ї–љ–µ –Љ–Њ–ґ–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –і–ї—П –ї–µ—З–µ–љ–Є—П –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є. –Т–∞–ґ–љ–Њ —В–∞–Ї–ґ–µ, —З—В–Њ —А–µ–∞–ї–Є–Ј–∞—Ж–Є—П –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П (–≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Є–љ—Л—Е –≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л—Е –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤) –Ј–∞ —Б—З–µ—В –±–ї–Њ–Ї–∞–і—Л –ї–Є—И—М –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ —З–Є—Б–ї–∞ D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Ґ–Њ–≥–і–∞ –Њ—Б—В–∞–≤—И–Є–µ—Б—П —Б–≤–Њ–±–Њ–і–љ—Л–Љ–Є D2–—А–µ—Ж–µ–њ—В–Њ—А—Л –Њ–Ї–∞–Ј—Л–≤–∞—О—В—Б—П –і–Њ—Б—В—Г–њ–љ—Л–Љ–Є –і–ї—П —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є –њ—А–Њ–і–Њ—Д–∞–Љ–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ –њ—А–µ–њ–∞—А–∞—В–∞, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –∞–љ—В–∞–≥–Њ–љ–Є–Ј–Љ–Њ–Љ —Б–µ—А–Њ—В–Њ–љ–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ 5––Э–Ґ2–Р –Є 5––Э–Ґ2–° (—В–∞–±–ї. 1 –Є 2). –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –Њ–ї–∞–љ–Ј–∞–њ–Є–љ (–≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Є–љ—Л—Е –≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л—Е –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤) —Б –±–Њ–ї—М—И–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –Љ–Њ–ґ–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –њ—А–Є –ї–µ—З–µ–љ–Є–Є –љ–µ–≥–∞—В–Є–≤–љ—Л—Е –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–µ–њ–∞—А–∞—В –≤–њ–Њ–ї–љ–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —Б—А–∞–Ј—Г –і–≤—Г–Љ –њ–Њ–і—Е–Њ–і–∞–Љ –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ –њ—А–Є —И–Є–Ј–Њ—Д—А–µ–љ–Є–Є. –Ю–і–Є–љ –Є–Ј –љ–Є—Е (–±–Њ–ї–µ–µ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–є) –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В, —З—В–Њ –Њ—Б–љ–Њ–≤–љ–∞—П –Ј–∞–і–∞—З–∞ —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ – –ї–µ—З–Є—В—М –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞, –∞ –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –љ–µ –і–Њ–њ—Г—Б–Ї–∞—В—М –Є—Е —А–µ—Ж–Є–і–Є–≤–∞. –Ф—А—Г–≥–Њ–є –њ–Њ–і—Е–Њ–і (–±–Њ–ї–µ–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є) —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Є –љ–µ —В–Њ–ї—М–Ї–Њ –і–ї—П –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –њ—Б–Є—Е–Њ–Ј–∞, –љ–Њ –Є –і–ї—П –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –Я—А–Є—З–µ–Љ –Њ–љ–Њ –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –љ–µ —В–Њ–ї—М–Ї–Њ –љ–∞ –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–µ —А–µ—Ж–Є–і–Є–≤–∞ –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤, –љ–Њ –Є –љ–∞ —Г–≥–ї—Г–±–ї–µ–љ–Є–µ –і–Њ—Б—В–Є–≥–љ—Г—В–Њ–є —А–µ–Љ–Є—Б—Б–Є–Є —Г –±–Њ–ї—М–љ—Л—Е —И–Є–Ј–Њ—Д—А–µ–љ–Є–µ–є –Ј–∞ —Б—З–µ—В —В–µ—А–∞–њ–Є–Є –љ–µ–≥–∞—В–Є–≤–љ—Л—Е –Є –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤.
–Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –њ—А–µ–њ–∞—А–∞—В–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –њ–Њ—П–≤–ї–µ–љ–Є—О –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –њ–Њ –њ–µ—А–µ–≤–Њ–і—Г –±–Њ–ї—М–љ—Л—Е —Б —А–∞–Ј–љ—Л—Е –≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л—Е –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –љ–∞ –Њ–ї–∞–љ–Ј–∞–њ–Є–љ [11]. –Я—А–Є —Н—В–Њ–Љ —Б–њ–Њ—А—П—В –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Њ —В–Њ–Љ, –Ї–∞–Ї —В–∞–Ї–Њ–є –њ–µ—А–µ–≤–Њ–і –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М (—А–Є—Б. 1), —В–Њ–≥–і–∞ –Ї–∞–Ї –µ–≥–Њ —Ж–µ–ї–Є –≤–њ–Њ–ї–љ–µ –Њ—З–µ–≤–Є–і–љ—Л.
–Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Њ–ї–Є–≥–Њ—А–µ—Ж–µ–њ—В–Њ—А–љ—Л—Е –≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л—Е –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ D2–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (–≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї, –Ј—Г–Ї–ї–Њ–њ–µ–љ—В–Є–Ї—Б–Њ–ї) –Њ–ї–∞–љ–Ј–∞–њ–Є–љ –Љ–Њ–ґ–µ—В —Б —Г—Б–њ–µ—Е–Њ–Љ –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –і—А—Г–≥–Є—Е –њ–Њ–ї–Є—А–µ—Ж–µ–њ—В–Њ—А–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б–≤–Њ–µ–є –≥—А—Г–њ–њ—Л (—А–Є—Б–њ–µ—А–Є–і–Њ–љ, –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ, –њ–µ—А—Д–µ–љ–∞–Ј–Є–љ, —В—А–Є—Д–ї—Г–Њ–њ–µ—А–∞–Ј–Є–љ, —Д–ї—Г—Д–µ–љ–∞–Ј–Є–љ, —Б–µ—А—В–Є–љ–і–Њ–ї) –µ–≥–Њ —И–∞–љ—Б—Л –љ–∞ —Г–≥–ї—Г–±–ї–µ–љ–Є–µ —А–µ–Љ–Є—Б—Б–Є–Є —Г –±–Њ–ї—М–љ—Л—Е —И–Є–Ј–Њ—Д—А–µ–љ–Є–µ–є –Ј–∞ —Б—З–µ—В –ї–µ—З–µ–љ–Є—П –љ–µ–≥–∞—В–Є–≤–љ—Л—Е –Є –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤—Л–≥–ї—П–і—П—В –±–Њ–ї–µ–µ –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–Љ–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–ї–∞–љ–Ј–∞–њ–Є–љ –Њ–±–ї–∞–і–∞–µ—В (–≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –і—А—Г–≥–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —Б–≤–Њ–µ–є –≥—А—Г–њ–њ—Л) –љ–∞–Є–±–Њ–ї—М—И–Є–Љ —З–Є—Б–ї–Њ–Љ –Є–Ј—Г—З–µ–љ–љ—Л—Е –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –і–µ–є—Б—В–≤–Є—П (—В–∞–±–ї. 1). –Я—А–Є—З–µ–Љ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Є–Ј –љ–Є—Е –љ–Њ—Б—П—В —П–≤–љ–Њ —Г–љ–Є–Ї–∞–ї—М–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А. –Ґ–∞–Ї, –Њ–ї–∞–љ–Ј–∞–њ–Є–љ —Б–њ–Њ—Б–Њ–±–µ–љ –±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М —Б–µ—А–Њ—В–Њ–љ–Є–љ–Њ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л —В—А–µ—В—М–µ–≥–Њ —В–Є–њ–∞ (5––Э–Ґ3) (—В–∞–±–ї. 1), –≤—Б–ї–µ–і—Б—В–≤–Є–µ —З–µ–≥–Њ –Њ–љ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–Њ—Б—В—Г –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є GABA––љ–µ–є—А–Њ–љ–Њ–≤ (—В–∞–±–ї. 2). –≠—В–Њ —Б–≤–Њ–є—Б—В–≤–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г—Б–Є–ї–Є–≤–∞–µ—В –µ–≥–Њ –њ—А–Њ—В–Є–≤–Њ—В—А–µ–≤–Њ–ґ–љ—Л–µ –Є —Б–µ–і–∞—В–Є–≤–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л (—Б–≤—П–Ј–∞–љ–љ—Л–µ —В–∞–Ї–ґ–µ —Б –±–ї–Њ–Ї–∞–і–Њ–є Hi1 –Є α1–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤) –Є –Ј–∞—З–∞—Б—В—Г—О –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –Ї–∞–Ї –≤ –њ—А–µ–і–µ–ї–∞—Е –Ј–∞—А–µ–≥–Є—Б—В—А–Њ–≤–∞–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞–љ–Є–є (—Г –±–Њ–ї—М–љ—Л—Е —И–Є–Ј–Њ—Д—А–µ–љ–Є–µ–є, –±–Є–њ–Њ–ї—П—А–љ—Л–Љ –∞—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–Њ–Љ), —В–∞–Ї –Є (–Ї —Б–Њ–ґ–∞–ї–µ–љ–Є—О) –≤–љ–µ –Є—Е (–њ—А–Є —В—А–µ–≤–Њ–ґ–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞—Е).
–Ю—Б—В–∞–ї—М–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–∞ —Е–Њ—В—П –Є –љ–µ –љ–Њ—Б—П—В —Г–љ–Є–Ї–∞–ї—М–љ–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞, —В–∞–Ї–ґ–µ –љ–µ –Њ—З–µ–љ—М —З–∞—Б—В–Њ –≤—Б—В—А–µ—З–∞—О—В—Б—П —Г –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤. –Ь–µ–ґ–і—Г —В–µ–Љ –Њ–љ–Є –Њ—З–µ–љ—М –≤–∞–ґ–љ—Л –і–ї—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞. –Ґ–∞–Ї, –Њ–ї–∞–љ–Ј–∞–њ–Є–љ –Є –µ—Й–µ –і–≤–∞ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—П —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є –≥—А—Г–њ–њ—Л –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ (—В–∞–±–ї. 1) —Б–њ–Њ—Б–Њ–±–љ—Л –±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М —Б–µ—А–Њ—В–Њ–љ–Є–љ–Њ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л —И–µ—Б—В–Њ–≥–Њ —В–Є–њ–∞ (5––Э–Ґ6), —З—В–Њ –Њ—В–Ї—А—Л–≤–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –і–ї—П –њ–Њ–≤—Л—И–µ–љ–Є—П –∞—Ж–µ—В–Є–ї—Е–Њ–ї–Є–љ–Њ–≤–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є (—В–∞–±–ї. 2). –Ю—З–µ–≤–Є–і–љ–Њ, —З—В–Њ —Н—В–Њ —П–≤–ї—П–µ—В—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–Є –≤–Њ–Ј–±—Г–ґ–і–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–µ–Љ–µ–љ—Ж–Є–µ–є. –Э–∞–Ї–Њ–љ–µ—Ж, –Њ–ї–∞–љ–Ј–∞–њ–Є–љ, –љ–∞—А—П–і—Г —Б –µ—Й–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –±–ї–Њ–Ї–Є—А—Г–µ—В —Б–µ—А–Њ—В–Њ–љ–Є–љ–Њ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л –≤—В–Њ—А–Њ–≥–Њ –Є —Б–µ–і—М–Љ–Њ–≥–Њ —В–Є–њ–Њ–≤ (—В–∞–±–ї. 1). –≠—В–Є —Б–≤–Њ–є—Б—В–≤–∞ –љ–∞–і–µ–ї—П—О—В –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –≤–ї–Є—П—В—М –љ–∞ —Ж–Є—А–Ї–∞–і–Є–∞–љ–љ—Л–µ —А–Є—В–Љ—Л, —З—В–Њ –ї–µ–≥–Ї–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М –≤–Њ—Б—В—А–µ–±–Њ–≤–∞–љ–Њ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –±–Є–њ–Њ–ї—П—А–љ–Њ–≥–Њ –∞—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ (—В–∞–±–ї. 2). –Ш –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –Њ–ї–∞–љ–Ј–∞–њ–Є–љ —Б—В–∞–ї –Њ—З–µ–љ—М —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –њ—А–Є –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є–Є —В–µ—А–∞–њ–Є–Є —Г–Ї–∞–Ј–∞–љ–љ–Њ–є –њ—Б–Є—Е–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –Т –≤–∞—А—М–Є—А—Г—О—Й–Є—Е—Б—П –і–Њ–Ј–∞—Е (–Њ—В 3 –і–Њ 12 –Љ–≥) –Њ–љ –≤—Е–Њ–і–Є—В –≤ —Б–Њ—Б—В–∞–≤ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –°–Є–Љ–±–Є–∞–Ї—Б, –≤–Ї–ї—О—З–∞—О—Й–µ–≥–Њ —В–∞–Ї–ґ–µ –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В —Д–ї—Г–Њ–Ї—Б–µ—В–Є–љ (–≤ –і–Њ–Ј–∞—Е 25 –Є–ї–Є 50 –Љ–≥). –≠—В–Њ –ї–µ–Ї–∞—А—Б—В–≤–Њ, –Ї–Њ—В–Њ—А–Њ–≥–Њ –њ–Њ–Ї–∞ –µ—Й–µ –љ–µ—В –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ, –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–Њ –і–ї—П –ї–µ—З–µ–љ–Є—П –і–µ–њ—А–µ—Б—Б–Є–є –њ—А–Є –±–Є–њ–Њ–ї—П—А–љ–Њ–Љ –∞—Д—Д–µ–Ї—В–Є–≤–љ–Њ–Љ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–µ –Є–ї–Є –ї—О–±—Л—Е —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е –Ї —В–µ—А–∞–њ–Є–Є –і–µ–њ—А–µ—Б—Б–Є–≤–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є [21].
–Т —Б–≤–µ—В–µ –і–∞–љ–љ—Л—Е –Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–µ –і–µ–є—Б—В–≤–Є—П –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–µ —Г—З–Є—В—Л–≤–∞—О—В—Б—П –≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є, —Б—В–∞–љ–Њ–≤–Є—В—Б—П —П—Б–љ–Њ, –њ–Њ—З–µ–Љ—Г —Н—В–Њ—В –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї –і–Њ—Б—В–Є–≥ —В–∞–Ї–Њ–є –њ–Њ–њ—Г–ї—П—А–љ–Њ—Б—В–Є. –Ґ–µ –ґ–µ –і–∞–љ–љ—Л–µ –і–∞—О—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–Њ–љ—П—В—М, –Ј–∞—З–µ–Љ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Є–µ –Ї–Њ–Љ–њ–∞–љ–Є–Є —Б—В—А–µ–Љ—П—В—Б—П –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤—Л–≤–µ—Б—В–Є –љ–∞ —А—Л–љ–Ї–Є —А–∞–Ј–љ—Л—Е —Б—В—А–∞–љ –і–ґ–µ–љ–µ—А–Є–Ї–Є –њ—А–µ–њ–∞—А–∞—В–∞. –Ъ –њ—А–Є–Љ–µ—А—Г, –≤ –†–Њ—Б—Б–Є–Є —Б–Њ–≤—Б–µ–Љ –љ–µ–і–∞–≤–љ–Њ –њ–Њ—П–≤–Є–ї—Б—П –њ—А–µ–њ–∞—А–∞—В –≠–≥–Њ–ї–∞–љ–Ј–∞ («–≠–≥–Є—Б», –Т–µ–љ–≥—А–Є—П), —З—М—П –±–Є–Њ—Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ—Б—В—М –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–Љ—Г –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї—Г –±—Л–ї–∞ –і–Њ–Ї–∞–Ј–∞–љ–∞ –≤ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ–Љ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Њ–є –ї–∞–±–Њ—А–∞—В–Њ—А–Є–µ–є Algorithm Pharma –≤ –Ъ–∞–љ–∞–і–µ –≤ 2008 –≥. –Ю—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –њ–Њ—П–≤–ї–µ–љ–Є–µ –і–ґ–µ–љ–µ—А–Є–Ї–Њ–≤ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –≤–њ–Њ–ї–љ–µ –ї–Њ–≥–Є—З–љ—Л–Љ —Б—В—А–µ–Љ–ї–µ–љ–Є–µ–Љ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–Љ–њ–∞–љ–Є–є —Б–Њ–≤–Љ–µ—Б—В–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –њ–Њ–њ—Г–ї—П—А–љ–Њ—Б—В—М —Е–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ–Њ–≥–Њ, –љ–Њ –і–Њ—А–Њ–≥–Њ–≥–Њ –±—А–µ–љ–і–∞ —Б —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Њ–є –і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Б—А–µ–і—Б—В–≤–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤–ї–Є—П–љ–Є—П –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є –Є Cmax —Г–ґ–µ —З–µ—А–µ–Ј 5–8 —З –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ–µ—А–µ–≤–Њ–і–∞ –±–Њ–ї—М–љ—Л—Е, —А–∞–љ–µ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Є–љ—К–µ–Ї—Ж–Є–Є –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–∞, –љ–∞ —В–∞–±–ї–µ—В–Ї–Є –≠–≥–Њ–ї–∞–љ–Ј–∞ –±–µ–Ј –њ–Њ—В–µ—А–Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є.
–Э–∞–Ї–Њ–љ–µ—Ж, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –љ–Њ—Б–Є—В –Њ—В–Ї—А—Л—В—Л–є —Е–∞—А–∞–Ї—В–µ—А. –Ю–љ–∞ –≤–њ–Њ–ї–љ–µ –і–Њ–њ—Г—Б–Ї–∞–µ—В –њ–Њ—П–≤–ї–µ–љ–Є–µ –і—А—Г–≥–Є—Е –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤, —З–µ–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –љ–µ –±—Г–і–µ—В —Б–≤—П–Ј–∞–љ —Б –∞—Д—Д–Є–љ–Є—В–µ—В–Њ–Љ –Ї D2–—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ. –Я—А–µ–і–њ–Њ–ї–Њ–ґ–Є–Љ, —З—В–Њ –≤ –±–ї–Є–ґ–∞–є—И–µ–µ –≤—А–µ–Љ—П –±—Г–і–µ—В –њ–Њ–ї–љ–Њ—Б—В—М—О —А–∞—Б–Ї—А—Л—В–∞ —А–Њ–ї—М –љ–µ–є—А–Њ–Љ–µ–і–Є–∞—В–Њ—А–∞ –≥–ї—Г—В–∞–Љ–∞—В–∞ –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤. –Я–Њ—П–≤–Є—В—Б—П –њ—А–µ–њ–∞—А–∞—В, —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—Й–Є–є –Є–Љ–µ–љ–љ–Њ –љ–∞ —Н—В–Њ—В –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—В—В–µ—А, –∞ –љ–µ –љ–∞ –Њ–±–Љ–µ–љ –і–Њ—Д–∞–Љ–Є–љ–∞. –Ю—З–µ–≤–Є–і–љ–Њ, –Њ–і–љ–∞–Ї–Њ, —З—В–Њ —Н—В–Њ—В —Д–∞–Ї—В –љ–Є–Ї–∞–Ї –љ–µ —Б–Љ–Њ–ґ–µ—В –њ–Њ–≤–ї–Є—П—В—М –љ–∞ –∞–і–µ–Ї–≤–∞—В–љ–Њ—Б—В—М –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤, –Њ–±–ї–∞–і–∞—О—Й–Є—Е –∞—Д—Д–Є–љ–Є—В–µ—В–Њ–Љ –Ї D2–—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –±—Г–і–µ—В –ї–Є—И—М –Ї–Њ–љ—Б—В–∞—В–Є—А–Њ–≤–∞—В—М, —З—В–Њ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–Љ –Љ–Њ–ґ–µ—В –±—Л—В—М –љ–µ —В–Њ–ї—М–Ї–Њ –≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ—Л–є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В —Н—В–Є—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, –љ–Њ –Є –≥–ї—Г—В–∞–Љ–∞—В–µ—А–≥–Є—З–µ—Б–Ї–Є–є –њ—А–µ–њ–∞—А–∞—В.
![–Ґ–∞–±–ї–Є—Ж–∞ 1. –Ь–µ—Е–∞–љ–Є–Ј–Љ—Л –і–µ–є—Б—В–≤–Є—П –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ [2,6,13,15,19,20]](/data/articles/Image/t20/n29/1449-1.gif)
![–Ґ–∞–±–ї–Є—Ж–∞ 2. –Э–∞—А—Г—И–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є (↓ вАУ —Б–љ–Є–ґ–µ–љ–Є–µ, ↑ вАУ –њ–Њ–≤—Л—И–µ–љ–Є–µ) —А–∞–Ј–ї–Є—З–љ—Л—Е –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—В—В–µ—А–Њ–≤, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б —Н—В–Є–Љ —Б–Є–Љ–њ—В–Њ–Љ—Л, –∞ —В–∞–Ї–ґ–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –Є—Е –Ї–Њ—А—А–µ–Ї—Ж–Є–Є —Б –њ–Њ–Љ–Њ—Й—М—О –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤ [17,18]](/data/articles/Image/t20/n29/1449-2.gif)
![–†–Є—Б. 1. ¬Ђ–Ш–Ј–±–µ–≥–∞–є –љ–µ–њ—А–∞–≤–Є–ї—М–љ—Л—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ –њ–µ—А–µ–≤–Њ–і–∞¬ї [14]. –Ю–±—К—П—Б–љ–µ–љ–Є–µ –≤ —В–µ–Ї—Б—В–µ](/data/articles/Image/t20/n29/1449-4.gif)
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –С–Є–ї–µ–љ—Б–Ї–Є–є –Т.–°., –Я–µ–і–∞–Ї –Р.–Р. –Ґ–Є–њ–Є—З–љ—Л–µ/–∞—В–Є–њ–Є—З–љ—Л–µ –љ–µ–є—А–Њ–ї–µ–њ—В–Є–Ї–Є, –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В—Л (—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–∞—П —В–∞–Ї—В–Є–Ї–∞ –њ—А–Є –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е). http://anatoliypedak.blogspot.com/
2. –Ф–ґ–Њ–љ—Б –Я.–С., –С–∞–Ї–ї–Є –Я.–§. –®–Є–Ј–Њ—Д—А–µ–љ–Є—П: –Ї–ї–Є–љ. –†—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ / –Я–µ—А. —Б –∞–љ–≥–ї.; –њ–Њ–і. —А–µ–і. –њ—А–Њ—Д. –°.–Э. –Ь–Њ—Б–Њ–ї–Њ–≤–∞. – –Ь.: –Ь–µ–і–њ—А–µ—Б—Б–Є–љ—Д–Њ—А–Љ, 2008. – 192 —Б.
3. –Ф—А–Њ–±–Є–ґ–µ–≤ –Ь.–Ѓ., –Э–∞—А–Ї–µ–≤–Є—З –Х.–Ь. –Я—А–Њ–≥—А–∞–Љ–Љ–∞ –Ю–Ъ–°–Р–Э–Р. –Ъ–∞–Ї–Њ–є –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї –ї—Г—З—И–µ? // –Ю–±–Њ–Ј—А–µ–љ–Є–µ –њ—Б–Є—Е–Є–∞—В—А–Є–Є –Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ—Б–Є—Е–Њ–ї–Њ–≥–Є–Є –Є–Љ. –Т.–Ь. –С–µ—Е—В–µ—А–µ–≤–∞.– 2008. – вДЦ 3. – –°. 43–48.
4. –Ф—А–Њ–±–Є–ґ–µ–≤ –Ь.–Ѓ., –Ю–≤—З–Є–љ–љ–Є–Ї–Њ–≤ –Р.–Р. –Р–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Є: –Љ–µ–љ—П–µ–Љ —Б—В–∞—А—Л–µ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –љ–∞ –љ–Њ–≤—Г—О –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—О? //–°–Њ—Ж–Є–∞–ї—М–љ–∞—П –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –њ—Б–Є—Е–Є–∞—В—А–Є—П. – 2010. – –Ґ. 18, вДЦ 2. – –°. 80–85.
5. –Ъ–Њ–Ј—Л—А–µ–≤ –Т.–Э., –°–Љ—Г–ї–µ–≤–Є—З –Р.–С., –Ф—А–Њ–±–Є–ґ–µ–≤ –Ь.–Ѓ. –Є –і—А. –Я—Б–Є—Е–Њ—В—А–Њ–њ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞, –њ—А–Є–Љ–µ–љ—П—О—Й–Є–µ—Б—П –≤ –њ—Б–Є—Е–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–Љ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ (–∞—Б–њ–µ–Ї—В—Л —Д–∞—А–Љ–∞–Ї–Њ—Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є–Є) // –Ц—Г—А–љ. –љ–µ–≤—А–Њ–ї. –Є –њ—Б–Є—Е–Є–∞—В—А–Є–Є. – 2003. – –Ґ. 127, вДЦ 11. – –°. 89– 96.
6. –Я—Б–Є—Е–Є–∞—В—А–Є—П: —Б–њ—А–∞–≤–Њ—З–љ–Є–Ї –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤—А–∞—З–∞ / –Я–Њ–і —А–µ–і. –њ—А–Њ—Д. –Р.–У. –У–Њ—Д–Љ–∞–љ–∞. – 2––µ –Є–Ј–і., –њ–µ—А–µ—А–∞–±. – –Ь.: –Ь–Х–Ф–њ—А–µ—Б—Б–Є–љ—Д–Њ—А–Љ. 2010. – 608 —Б.
7. –°–Љ—Г–ї–µ–≤–Є—З –Р.–С. –Ы–µ—З–µ–љ–Є–µ –≤—П–ї–Њ—В–µ–Ї—Г—Й–µ–є —И–Є–Ј–Њ—Д—А–µ–љ–Є–Є // –Я—Б–Є—Е–Є–∞—В—А–Є—П –Є –њ—Б–Є—Е–Њ—Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П. 2000. – вДЦ 2(5) http://old.consilium–medicum.com/media/psycho/00_05/134.shtml.
8. –°–њ—А–∞–≤–Њ—З–љ–Њ–µ —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ –њ–Њ –њ—Б–Є—Е–Њ—Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є. –Я—Б–Є—Е–Њ—Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є –њ—А–Њ—В–Є–≤–Њ—Н–њ–Є–ї–µ–њ—В–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л, —А–∞–Ј—А–µ—И–µ–љ–љ—Л–µ –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –≤ –†–Њ—Б—Б–Є–Є / –Я–Њ–і —А–µ–і. –°.–Э. –Ь–Њ—Б–Њ–ї–Њ–≤–∞. – 2––µ –Є–Ј–і. –Ь. : –С–Ш–Э–Ю–Ь , 2004. – 304 —Б.
9. –°—В–∞–љ–і–∞—А—В—Л –Њ–Ї–∞–Ј–∞–љ–Є—П –њ–Њ–Љ–Њ—Й–Є –±–Њ–ї—М–љ—Л–Љ —И–Є–Ј–Њ—Д—А–µ–љ–Є–µ–є / –Я–Њ–і —А–µ–і. –Т.–Э. –Ъ—А–∞—Б–љ–Њ–≤–∞, –Ш.–ѓ. –У—Г—А–Њ–≤–Є—З–∞, –°.–Э. –Ь–Њ—Б–Њ–ї–Њ–≤–∞, –Р.–С. –®–Љ—Г–Ї–ї–µ—А–∞. – –Ь., 2006 http://www.labclinpharm.ru/35.html.
10. –®–Љ—Г–Ї–ї–µ—А –Р.–С. –Я—А–Њ–±–ї–µ–Љ–∞ —И–Є–Ј–Њ—Д—А–µ–љ–Є–Є –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е: –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Є –і–Є—Б–Ї—Г—Б—Б–Є–Њ–љ–љ—Л–µ –≤–Њ–њ—А–Њ—Б—Л. – –Ь.: –Ш–Ф «–Ь–µ–і–њ—А–∞–Ї—В–Є–Ї–∞––Ь», 2011. – 84 —Б.
11. –ѓ—Б—В—А–µ–±–Њ–≤ –Ф.–Т., –Р–≤–µ–і–Є—Б–Њ–≤–∞ –Р.–°. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –∞—Б–њ–µ–Ї—В—Л —В–µ—А–∞–њ–Є–Є –∞—В–Є–њ–Є—З–љ—Л–Љ–Є –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –љ–∞ –њ—А–Є–Љ–µ—А–µ –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–∞. –°–Њ–≤—А–µ–Љ–µ–љ–љ–∞—П —В–µ—А–∞–њ–Є—П –≤ –њ—Б–Є—Е–Є–∞—В—А–Є–Є –Є –љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є 2012. вДЦ 2, —Б. 10–14.
12. Antipsychotic Drug Market http://www.wikinvest.com/concept/Antipsychotic_Drug_Market).
13. Bazire S. The professionals’ pocket handbook and aide memoire. – Fivepin. Salisbury, 2005. – 392 p.
14. Correll C.U. Real–life switching strategies with second–generation antipsychotics // J. Clin. Psychiatry. 2006. Vol. 67(1). P. 160–161.
15. Correll C.U. Antipsychotic Use in Children and Adolescents: Minimizing Adverse Effects to Maximize Outcomes // J. Amer. Acad. Child and Adolescent Psych. 2008. Vol. 47(1). P. 9–20.
16. Kapur S., Zipursky R., Jones C. et al. Relationship between dopamine D(2) occupancy, clinical response, and side effects: a double–blind PET study of first–episode schizophrenia // Amer. J. Psychiatry. 2000. Vol. 157. P. 514–520.
17. Kapur S., Zipursky R., Jones C. et al. Positron emission tomography study of quetiapine in schizophrenia: a preliminary finding of an antipsychotic effect with only transiently high dopamine D2 receptor occupancy // Arch. Gen. Psychiatry. 2000. Vol. 57(6). P. 553–559.
18. M–Њ..ller H.J. Amisulpride: limbic specificity and the mechanism of antipsychotic atypicality // Prog. Neuropsychopharmacol. Biol. Psychiatry. 2003. Vol. 27(7). P. 1101–1111.
19. Osman A.A., Khurasani M.H. Lethal catatonia and neuroleptic malignant syndrome. A dopamine receptor shutdown hypothesis // Brit. J. Psychiatry. 1994.1 Vol. 65. P. 548–550.
20. Stahl S.M. Stahl's essential psychopharmacology: neuroscientific basis and practical application. – 3 nd ed. – Cambridge University Press, 2008. – 1117 P.
21. Symbyax Prescribing Information. Eli Lilly and Company, 2010. http://pi.lilly.com/us/symbyax–pi.pd
22. Tandon R., Nasrallah H., Keshavan M.S. Shizophrenia, «just the facts». 5. Treatment and prevention. Past, present and future // Schizophr. Res. 2010. Vol. 122. P. 1–23.












