Несмотря на существенные достижения в терапии муковисцидоза, диагностика заболевания все еще остается не на должном уровне. В Российском центре МВ на учете состоит около 2200 больных, а предполагаемое их число в стране – более 12000. По данным нашего центра (наблюдаются дети до 18 лет) возраст, в котором впервые был установлен диагноз муковисцидоза, колебался от первого дня жизни до 17,5 лет, составив в среднем по группе 2,54±0,62 года [2].
До настоящего времени сохраняются объективные сложности ранней диагностики заболевания, связанные как с клинической гетерогенностью проявлений основного дефекта в гене МВТР (регулятор белка трансмембранной проводимости муковисцидоза), низкой частотой распространенности большинства мутаций, нахождением их преимущественно в компаундном состоянии, так и с проблемой проведения потового теста. Генетический полиморфизм заболевания, наряду с влиянием факторов внешней среды, обусловливает выраженное фенотипическое разнообразие форм МВ от тяжелых до субклинических, при последних хлориды потовой жидкости могут быть пограничными и даже нормальными. По нашим данным, среди российских больных (до 18 лет) положительный потовый тест отмечался у 89,2%, пограничные цифры – у 10,3%, а отрицательный потовый тест у 0,5% [2].
У больных МВ в неонатальном периоде течение заболевания может быть малосимптомным или бессимптомным. Обнаружение в 70–е годы XX века повышенного уровня иммунореактивного трипсина (ИРТ) в плазме крови больных МВ послужило началом массового скрининга новорожденных на данное заболевание [4]. Первым этапом во всех протоколах является определение ИРТ в высушенном пятне крови новорожденного. Повышение в первую неделю жизни в крови ИРТ является весьма чувствительным (85–90%), но не специфичным признаком. Поэтому обязателен второй этап обследования (повторный тест на ИРТ на 3–4–й неделе жизни), позволяющий исключить здоровых детей [5]. Практически во всех протоколах неонатального скрининга в качестве основного этапа используется потовая проба – золотой стандарт прижизненной диагностики МВ. Особое значение потовый тест приобретает в случае неинформативности ДНК–диагностики [6].
В соответствии с рекомендациями Всемирной Организации Здравоохранения при неонатальном скрининге учитываются такие факторы, как тяжесть проявления заболеваний, частота их распространения, а также простота и достоверность применяемых методов диагностики, наличие доступных и эффективных средств лечения. Муковисцидоз не полностью отвечает этим требованиям и, тем не менее, в развитых странах он включен в перечень наследственных болезней, подлежащих неонатальному скринингу (Франция, Дания, Австрия, Новая Зеландия, Великобритания, США, Австралия, Италия, Испания, Бельгия, Польша, Чехия) [6,7].
С 2006 года в ряде регионов, а с первого января 2007 года во всех субъектах Российской Федерации, в рамках национального приоритетного проекта «Здоровье», проводится массовый скрининг новорожденных на муковисцидоз. Как правило, скрининг на МВ интегрируется в уже существующие программы. Так, и в нашей стране МВ, наряду с фенилкетонурией, галактоземией, гипотиреозом и адреногенитальным синдромом, был включен в перечень наследственных заболеваний подлежащих обязательному неонатальному скринингу. Протокол скрининга на МВ в России включает 4 этапа: ИРТ, повторный ИРТ, потовый тест и ДНК–диагностику, причем только первые три являются обязательными. Потовая проба – ключевой компонент протокола скрининга на МВ.
В настоящее время в большинстве европейских центров для подтверждения диагноза используют определение концентрации хлоридов в поте биохимическим методом (Гибсон–Кук, 1959), который до сих пор считается золотым стандартом прижизненной диагностики муковисцидоза. Тест позволяет количественно определить концентрацию хлора и натрия в потовой жидкости. У большинства здоровых детей концентрации натрия и хлора в поте не превышают 40 ммоль/л, а нередко не достигают и 20 ммоль/л. В случае пограничных значений (40–60 ммоль/л) требуется повторное проведение потовой пробы. Диагностическими считаются значения, превышающие 60 ммоль/л, хотя у большинства больных муковисцидозом детей концентрация хлора оказывается выше 80 ммоль/л.
Сложностью классического теста является его четырехэтапность и необходимость достаточной навески пота, используемой для расчетов. При навесках от 50 до 100 мг увеличивается вероятность получения ложноположительных результатов, поэтому потовую пробу рекомендуется повторить. Навеска обязательно должна быть отражена в записи результатов потового теста. При соблюдении необходимых условий данный тест позволяет получить точные результаты. Ошибки обычно связаны с такими техническими погрешностями, как недостаточная очистка кожных покровов, неаккуратность при сборе пота, транспортировке и взвешивании фильтров, определении концентрации электролитов. Для избежания ошибок и как следствие – гипо– (до 30%) и гипердиагностики (до 50%) МВ, потовую пробу необходимо проводить в медицинских центрах и лабораториях, в которых накоплен достаточный опыт регулярного проведения таких исследований: не менее 3–4 анализов в неделю.
В последние годы разработаны аппараты, которые позволяют унифицировать методику, упростить и удешевить ее проведение, уменьшить количество пота, необходимое для проведения теста, время его постановки.
В РФ зарегистрированы и успешно применяются две системы для анализа проводимости пота. Система для сбора и анализа пота Macroduct в комплексе с потовым анализатором Sweat–Chek фирмы Вескор (США) позволяет провести потовую пробу вне лаборатории, время сбора пота составляет 30 минут, успешно применяется у детей первых месяцев жизни. Специально для обследования новорожденных фирмой Вескор был разработан аппарат Nanoduct, объединяющий в себе систему для стимуляции потоотделения путем электрофореза 0,1% пилокарпина и анализатор проводимости пота. Для теста необходимо минимальное количество потовой жидкости (всего 3–6 мкл), что делает этот аппарат незаменимым при обследовании новорожденных в рамках массового скрининга. Важно помнить, что проводимость пота определяется совокупностью всех ионов, присутствующих в потовой жидкости (калий, натрий, хлор, бикарбонат, аммоний и др.), и полученный результат превышает истинную концентрацию хлоридов натрия и калия примерно на 15–20 ммоль/л (рис. 1). Таким образом, положительными считаются результаты выше 80 ммоль/л, а показатели 60–80 ммоль/л – пограничными, менее 60 ммоль/л – отрицательные.
При отрицательном результате потовой пробы (менее 40 ммоль/л при классическом методе Гибсона–Кука и/или 60 ммоль/л при работе с потовыми анализаторами) ребенок в течение первого года жизни наблюдается по месту жительства с диагнозом неонатальная гипертрипсиногенемия для исключения случаев гиподиагностики.
В случае пограничных результатов потового теста (40–60 ммоль/л – Гибсон–Кук и 60–80 ммоль/л – потовые анализаторы) потовую пробу следует повторить 2–3 раза. Кроме того, целесообразна ДНК–диагностика. Генетическое обследование в РФ в настоящее время осуществляется лишь в ряде регионов. Доступность его ограничена еще и высокой стоимостью (ДНК анализ на 23 мутации гена МВТР, встречающихся у больных МВ в России стоит 2500–3000 рублей).
При положительном результате потовой пробы, а также при обнаружении мутаций гена МВТР (при пограничном результате потовой пробы) ребенку ставится диагноз МВ. В сомнительных случаях могут помочь дополнительные методы обследования (анализ кала на панкреатическую эластазу 1, микроскопическое копрологическое исследование, компьютерная томография или рентгенография органов грудной клетки, посев мазка из зева на микрофлору).
Постановка диагноза МВ, равно как и приглашение семьи для проведения потовой пробы после положительных тестов на ИРТ, является большой психологической проблемой для родителей, особенно когда это касается новорожденных без клинических проявлений заболевания. В странах, где скрининг новорожденных проводится в течение нескольких лет, процедура сообщения результатов обследования родителям отработана до мелочей. Мы считаем эту тактику оправданной и рекомендуем ее внедрение в региональных центрах МВ.
Как подчеркивается в Европейском консенсусе по диагностике и лечению МВ, подробные и щадящие объяснения диагноза следует давать в присутствии обоих родителей, акцентируя внимание на существенное улучшение прогноза, успешных разработках новых методов лечения, необходимости длительного активного диспансерного наблюдения у специалистов регионального (межрегионального) центра МВ [8]. Кроме того, не рекомендуется сообщать о подтверждении диагноза МВ семье накануне выходных или праздничных дней. Следует предоставить номера телефонов, по которым можно обратиться родителям при их беспокойстве и/или в экстренных случаях. В течение первых дней с момента установки диагноза ребенок должен быть детально обследован для оценки общего состояния и тяжести заболевания, после чего необходимо назначить лечение и дать заключение об инвалидности. Особое внимание нужно уделить образованию членов семьи больного МВ. Образовательная программа должна начинаться с подробного обсуждения заболевания, включая патофизиологию вовлеченных органов, осложнения, обоснование терапии, генетические механизмы и прогноз в аспекте возможных вариантов его течения и выживаемости. Для получения дополнительной информации следует сообщить родителям адреса соответствующих интернет–сайтов, одновременно заверив их, что специалисты готовы и в будущем ответить на все их вопросы. Очень важно подчеркивать готовность сотрудников центра МВ прийти на помощь и их доступность. Стратегию терапии нужно объяснять в оптимистичной манере, подчеркивая успех в предотвращении или, как минимум, замедлении развития осложнений. Также необходимо обсудить в доступной форме текущие и будущие направления научных исследований, что помогает повысить мотивацию и вселяет надежду. В ряде случаев родителям может потребоваться консультация психолога. Членам семей больных МВ следует предложить обратиться в генетическую службу. Показано проведение потовых проб у сибсов.
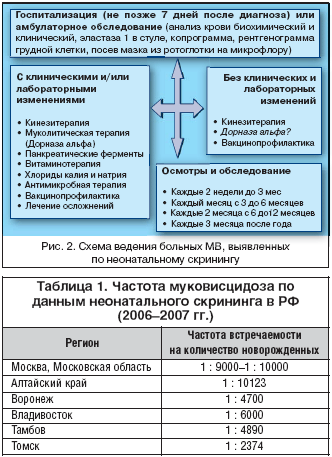
По данным МЗ и СР РФ, за 2006–2007 годы в России было обследовано 1 965 320 новорожденных. По данным, полученным из всех регионов РФ, выявлено 185 случаев МВ. Предварительная частота заболевания по России составляет 1 : 10 623 новорожденных. Следует отметить, что еще не всем детям с повторными высокими значениями ИРТ проведены потовые пробы, т.к. по разным причинам родители отказываются от данного исследования. Следовательно, истинная частота МВ в России будет выше, и эта частота будет варьировать по регионам (табл. 1).
Европейской ассоциацией МВ создана рабочая группа по неонатальному скринингу, в 2007 году в нее вошла и Россия. Задачей этой группы является анализ данных разных стран и регионов Европы и оптимизация программ по скринингу.
Результаты скрининга на МВ в России могут быть оценены только через несколько лет. В странах, где скрининг проводится уже около 20 лет (Италия, Франция, Англия), удалось снизить среднюю частоту МВ на 30–50% [9].
Для контроля за состоянием больного МВ, в том числе за новорожденными без клинических проявлений заболевания, необходимо регулярное наблюдение специалистами центра МВ (рис. 2). По нашему мнению, осмотры должны проводиться каждые 2 недели до 3–х месяцев жизни ребенка, далее ежемесячно до полугода, каждые 2 месяца с полугода до 1 года и далее ежеквартально. При условии полного комплексного обследования ребенка в условиях специализированного стационара или регионального центра МВ сразу после подтверждения диагноза, в течение последующих месяцев, особенно важно динамическое наблюдение за прибавкой массы тела, результатами копрологического исследования (не менее 1 раза в месяц до 1 года), показателями панкреатической эластазы 1 в стуле (каждые полгода при изначальных нормальных значениях), результатами исследования микрофлоры в посеве мазка из ротоглотки и клиническими анализами крови (1 раз в 3 месяца). В случае развития обострения бронхолегочного процесса или отсутствия желаемого контроля над симптомами заболевания может потребоваться и дополнительное обследование (рентгенографическое исследование легких или компьютерная томография, липидограмма кала, биохимический анализ крови, протеинограмма и др.).
Классический муковисцидоз характеризуется прогрессированием бронхолегочных изменений, панкреатической дисфункцией, увеличением хлоридов пота и мужским бесплодием. До 20% новорожденных с МВ имеют мекониальный илеус. Другие диагностируются с иными проявлениями, начиная от периода новорожденности и до взрослого состояния.
Лечение больного МВ ребенка нужно начинать сразу после постановки диагноза. Объем терапии зависит от клинических проявлений и результатов лабораторных и инструментальных методов обследования (рис. 2). Всем новорожденным и детям первых месяцев жизни с МВ показана кинезитерапия, независимо от наличия у них признаков бронхолегочного поражения. У грудных детей применяется пассивная техника кинезитерапии, включающая терапевтические положения, контактное дыхание, легкую вибрацию, поглаживания, а также занятия на мяче. На этом этапе очень важен тесный контакт с ребенком, все занятия должны быть приятны малышу. У детей с малейшими симптомами бронхиальной обструкции кинезитерапия применяется в комплексе с муколитическими препаратами и бронходилататорами.
По данным Verhaeghe C. с соавт. (Бельгия), в легочной ткани плодов с МВ отмечено достоверное повышение уровня провоспалительных белков, что говорит о раннем начале воспалительных процессов, предшествующих развитию инфекции [10]. В связи с этим, на наш взгляд, оправдано раннее назначение Пульмозима (Дорназа альфа, «Ф.Хоффманн–Ля Рош Лтд.», Швейцария) в связи с наличием у этого препарата наряду с выраженным муколитическим эффектом, противовоспалительного действия, характеризующегося снижением в бронхоальвеолярной жидкости маркеров воспаления (нейтрофильная эластаза, интерлейкин–8).
Всем новорожденным с МВ, имеющим клинические проявления кишечного синдрома (49%) или низкие показатели фекальной эластазы 1, показана заместительная терапия микросферическими панкреатическими ферментами с Рн–чувствительной оболочкой под контролем копрограммы, частоты и характера стула, ежемесячной прибавки веса. Обязательным является назначение жирорастворимых витаминов [11].
В заключение следует отметить, что 2006–2007 годы в России, безусловно, войдут в историю значимыми государственными решениями вопросов ранней диагностики и лекарственного обеспечения больных МВ всех возрастов. Беспрецедентное решение Правительства РФ и соответствующий Приказ МЗ и СР РФ №185 о включении МВ в перечень наследственных заболеваний, подлежащих обязательному скринингу новорожденных, следует признать поворотным пунктом в кардинальном решении ранней диагностики муковисцидоза.
Закон «О внесении изменений в Федеральный закон N 238–ФЗ «О Федеральном бюджете на 2007 год« с последующим распоряжением Правительства РФ N 1328–р утвердил Дорназу альфа, как препарат, централизованно закупаемый за счет средств федерального бюджета лекарственных средств, предназначенных для лечения больных муковисцидозом на 2008–2009 годы. Т.е. наиболее дорогостоящий препарат Дорназа альфа будет предоставляться всем больным при наличии диагноза муковисцидоз, вне зависимости от наличия инвалидности. В совокупности с продолжением действия национальной программы дополнительного лекарственного обеспечения (ДЛО) жизненно важными медикаментами больных МВ создается реальная возможность значительного повышения не только качества, но и средней продолжительности их жизни.
Еще раз хотелось бы подчеркнуть, что для получения ощутимых результатов по улучшению жизни больных МВ, сопоставимых с экономически развитыми странами, необходимо понимание государством важности не только своевременного выявления больных МВ, но и создания необходимых условий для их наблюдения и лечения на всей территории России.

Литература
1. Dodge JA, Lewis PA, Stanton M et al. Cystic fibrosis mortality and survival in the United Kingdom, 1947 to 2003// Eur Respir J. 2006 Dec 20.
2. Муковисцидоз. Современные достижения и актуальные проблемы. Метод. рекомендации. Издание второе (первое 2001) переработанное и дополненное / Капранов Н.И., Каширская Н.Ю., Воронкова А.Ю. и др. М.: 2005. – 109 с.;
3. Капранов Н.И. Муковисцидоз – современное состояние проблемы//Пульмонология 2006, с. 3–11 (приложение по муковисцидозу).
4. Crossley JR, Elliott RB, Smith PA. Dried–blood spot screening for cystic fibrosis in the newborn. Lancet 1979;1(8114):472–4
5. Rock MJ, Mishler EH, Farrell PM et al. Newborn screening for cystic fibrosis is complicated by agerelated decline in immunoreactive trypsinogen levels. Pediatrics 1990;85(6):1001–7
6. Parad RB, Comeau AM, Dorkin HL et al. Sweat testing infants detected by cystic fibrosis newborn screening. J Pediatr 2005;147(3 Suppl):S69–72
7. Wilcken B. Newborn screening for cystic fibrosis: techniques and strategies. J Inherit Metab Dis. 2007 Aug;30(4):537–43
8. Kerem E., Conway S., Elborn S., Heijerman H. Standards of care for patients with cystic fibrosis: a European consensus // Journal of Cystic Fibrosis 4 (2005) 7 – 26
9. Bush A., Gotz M. Cystic fibrosis// Chapter 15, p. 234–289 In Eur Resp Mon, 2006; 37.
10. Verhaeghe C, Delbecque K, de Leval L, et al . Early inflammation in the airways of a cystic fibrosis foetus // J Cyst Fibros. 2007 Jul;6(4):304–8
11. Koscik RL, Lai HJ, Laxova A. et al. Preventing early, prolonged vitamin E deficiency: an opportunity for better cognitive outcomes via early diagnosis through neonatal screening. J.Pediatr 2005;147(3Suppl):S51–6












