Введение
Ревматоидный артрит (РА) — аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом), а в ряде случаев — внесуставными поражениями [1]. Лечение заболевания предполагает применение базисных противовоспалительных препаратов (метотрексат, лефлуномид, сульфасалазин, гидроксихлорохин) с возможным кратковременным использованием глюкокортикостероидов. Однако у части пациентов (30–40%) такая терапия не позволяет достичь ремиссии или низкой активности артрита. Последние два десятилетия ознаменовались внедрением в практику лечения РА сначала генно-инженерных биологических препаратов (ГИБП), а затем и таргетных синтетических базисных противовоспалительных препаратов (тсБПВП).
В настоящее время в Российской Федерации для лечения РА зарегистрировано 5 ГИБП, относящихся к классу ингибиторов фактора некроза опухоли (инфликсимаб, адалимумаб, этанерцепт, цертолизумаб пэгол, голимумаб), 4 ингибитора интерлейкина-6 (3 ингибитора рецепторов ИЛ-6: тоцилизумаб, сарилумаб, левилимаб и блокатор ИЛ-6 олокизумаб), блокатор костимуляции Т-лимфоцитов абатацепт, анти-В-клеточный препарат ритуксимаб и 3 тсБПВП из класса ингибиторов JAK-киназ (тофацитиниб, барицитиниб, упадацитиниб).
Применение этих средств позволило значимо улучшить лечение пациентов с РА, не ответивших в достаточной мере на базисную терапию. Однако применение ГИБП и тсБПВП может быть связано с риском развития нежелательных явлений (НЯ). Обширные рандомизированные регистрационные исследования [2–4] выявили повышение риска различных неблагоприятных событий при лечении таргетными препаратами в сравнении с группами пациентов, получавших плацебо. Однако ввиду ряда особенностей рандомизированных исследований (строгий отбор пациентов, относительно небольшая продолжительность, ограничения на сопутствующую терапию) истинные риски НЯ могут в них существенно недооцениваться. Для более реалистического их описания лучше всего подходят масштабные наблюдательные исследования, проводимые в условиях реальной клинической практики.
Целью исследования стали описание и анализ НЯ, наблюдаемых у пациентов с РА на фоне лечения ГИБП и тсБПВП в условиях реальной клинической практики.
Материал и методы
В исследование был включен 661 пациент с достоверным диагнозом РА (по критериям ACR 1987 [5] и/или EULAR 2010 [6]), которые получали таргетные иммуносупрессивные препараты в г. Москве за счет бюджетных средств и были включены в Московский единый регистр артритов (МЕРА).
МЕРА начал свою работу с 2012 г. При включении в регистр все пациенты заполняли опросники о самочувствии, ранее проводимой терапии, сопутствующих заболеваниях. На каждом визите пациент заполнял опросники о значимых событиях, произошедших с момента предыдущего визита, с указанием даты начала и окончания события, об изменениях, произошедших в медикаментозной терапии, о перенесенных немедикаментозных лечебных вмешательствах.
Статистический анализ проводился с помощью пакета статистических программ IBM SPSS Statistics 22 (IBM Corporation, 1989–2013). Использовались методы описательной статистики.
Результаты исследования
Общий объем наблюдения составил 2288,2 пациенто-лет. Среди пациентов женщин было 567 (85,8%), мужчин — 94 (14,2%), средний возраст составил 58,7±12,9 года, средний возраст на момент начала заболевания РА — 43±13,0 лет, средняя продолжительность болезни составила 14,6 года (табл. 1).
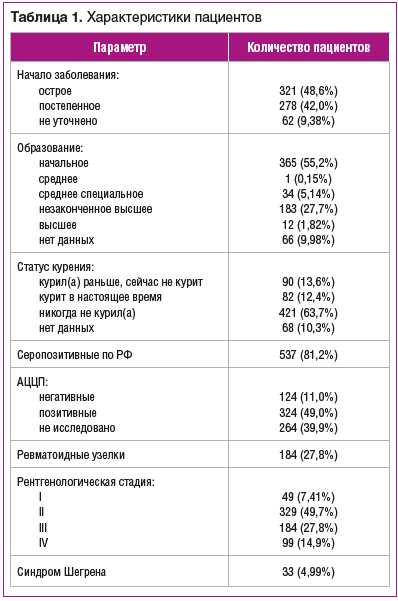
Серопозитивных пациентов по ревматоидному фактору (РФ) было 537 (81,2%), позитивных по антителам к циклическому цитруллинсодержащему пептиду (АЦЦП) — 324 (49,0%) (см. табл. 1).
Было проанализировано 1217 эпизодов лечения ГИБП и тсБПВП. На момент начала анализа данных 540 (44,4%) эпизодов было завершено по разным причинам (неэффективность, НЯ, достижение ремиссии и др.), 617 (55,6%) были незавершенными.
Данные о частоте нежелательных событий у наблюдаемых пациентов приведены в таблице 2. Так, у пациентов чаще всего наблюдались НЯ из группы болезней органов дыхания — 275 случаев (12,0 на 100 пациенто-лет), что составило 32,0% от всех побочных явлений. Второй по частоте категорией оказались заболевания костно-мышечной системы и соединительной ткани — 109 случаев (4,76 на 100 пациенто-лет). В данную группу вошли: остеоартроз, остеопороз, спондилопатия и др. Третьей по численности группой НЯ были болезни системы кровообращения — 105 случаев (4,59 на 100 пациенто-лет). Среди них наиболее часто выявляемым явилось повышение артериального давления (АД), также отмечены ишемическая болезнь сердца (ИБС) и цереброваскулярная болезнь (ЦВБ). Группу других болезней системы кровообращения составили: нарушения ритма сердца, аортальная недостаточность, атеросклероз и варикозная болезнь вен нижних конечностей. Многочисленной оказалась группа болезней органов пищеварения — 86 событий (3,76 на 100 пациенто-лет).
При анализе сообщений пациентов о развитии инфекционных заболеваний большинство составили инфекции дыхательных путей. Среди других инфекционных заболеваний зафиксированы обострение пиелонефрита, цистит, флегмона и абсцесс, простая герпетическая инфекция, опоясывающий герпес и воспалительные болезни женских тазовых органов. Таким образом, общая частота инфекционных осложнений составила 14,5 на 100 пациенто-лет.
Среди инфекционных заболеваний было 15 серьезных НЯ: абсцесс кожи — 2 (0,60%) случая, рожистое воспаление — 1 (0,30%), флегмона — 2 (0,60%), пневмония — 9 (2,70%) (см. табл. 2).

Основными НЯ, послужившими причиной отмены препаратов в нашем исследовании, были инфекционные заболевания, аллергические реакции на введение препаратов, лекарственный гепатит, значимые изменения показателей крови, стоматиты и др.
При анализе частоты различных событий на фоне лечения различными ГИБП и тсБПВП выявлено, что чаще всего НЯ возникали у пациентов, получавших ритуксимаб и адалимумаб: 20,0 и 18,5 случая на 100 пациенто-лет соответственно (табл. 3). В первом случае преобладали НЯ со стороны органов дыхания, костно-мышечной и сердечно-сосудистой систем. На фоне лечения адалимумабом чаще наблюдались события, связанные с органами дыхания, костно-мышечной системой и органами пищеварения.
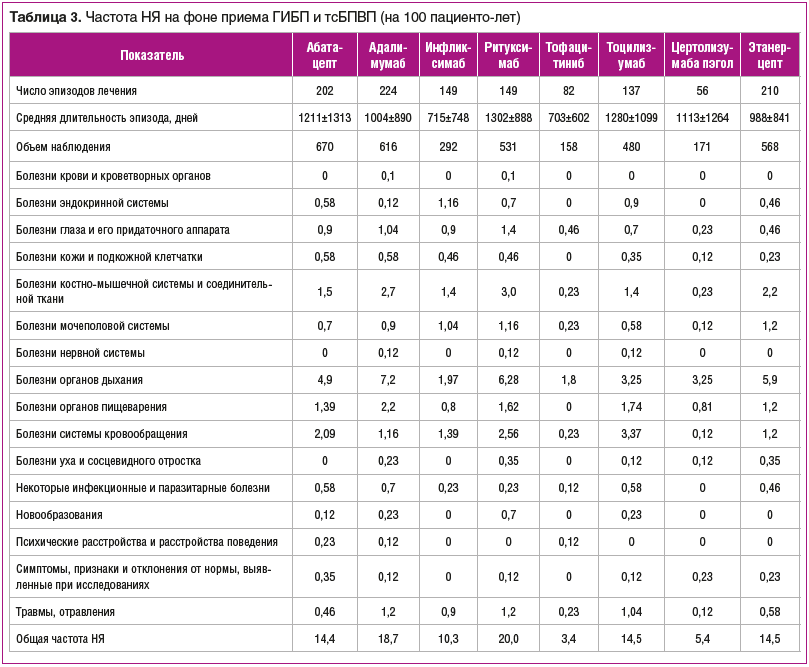
Нежелательные явления, относящиеся к болезням системы кровообращения, чаще всего наблюдались у пациентов, принимающих тоцилизумаб, — 3,37 (27,6%) на 100 пациенто-лет. Среди этих 29 событий было повышение АД — 13 случаев, стенокардия напряжения (впервые установленный диагноз) — 5 случаев.
На втором месте по частоте регистрации НЯ со стороны системы органов кровообращения был ритуксимаб — 2,56 на 100 пациенто-лет. Наибольшее количество нарушений ритма сердца — по 5 эпизодов зафиксировано при лечении ритуксимабом и этанерцептом.
Обсуждение
Анализ современной медицинской литературы показывает, что НЯ, связанные с применением ГИБП и тсБПВП, являются клинически значимой проблемой. По данным рандомизированных клинических исследований (РКИ) и исследований реальной клинической практики [7, 8], наиболее серьезными и частыми среди этих НЯ оказываются инфекции. Средняя частота НЯ при приеме ГИБП, по данным различных регистров, составляет 35,5 на 100 пациенто-лет [9]. В нашей когорте она составила 37,46 на 100 пациенто-лет.
Инфекционные заболеванияИспользование ГИБП сопряжено с возрастанием риска серьезных инфекций (отношение шансов (ОШ) 1,30; 95% доверительный интервал (ДИ) 1,1–1,54, p=0,0028) [10]. A.L. Smitten et al. [11] показали, что пациенты с РА до назначения таргетных иммуносупрессоров демонстрировали примерно вдвое более высокий риск серьезных инфекций, чем в общей популяции. J. Singh et al. [12] проанализировали данные 106 РКИ относительно развития серьезных инфекций у пациентов, получающих ГИБП в комбинации с БПВП и монотерапию БПВП. Было отмечено значительное увеличение частоты серьезных инфекций у пациентов, принимающих ГИБП (ОШ 1,90; 95% ДИ 1,50–2,39). В метаанализе [13] также выявлен достоверный рост частоты серьезных инфекций при использовании ингибиторов фактора некроза опухоли α (иФНО-α). Анализ данных Шведского регистра [14] показал, что частота развития серьезных инфекций, потребовавших госпитализации при применении иФНО-α, значительно возрастает в сравнении с традиционной терапией БПВП. Относительный риск в первый год лечения составил 1,43 (95% ДИ 1,18–1,73).
Среди пациентов МЕРА наиболее частыми НЯ также были инфекционные заболевания. Нозологическая структура осложнений в целом и инфекционных осложнений в частности в изучаемой нами когорте существенно не отличалась от таковой в ранее опубликованных исследованиях. Так, в когортах, описанных L. Quartuccio et al. [15] и R.F. van Vollenhoven et al. [16], также преобладают инфекции верхних и нижних дыхательных путей, за ними следуют болезни желудочно-кишечного тракта, сепсис, инфекции кожи и подкожно-жировой клетчатки, инфекции мочевыделительной системы. В Международном регистре [17] среди серьезных инфекций также преобладают пневмонии, септический артрит, инфекции кожи.
Реакции гиперчувствительности и другие причины отмены препаратовРиск гиперчувствительной реакции значимо выше был при использовании препаратов с внутривенным путем введения (инфликсимаб, ритуксимаб, абатацепт, тоцилизумаб) в сравнении с подкожно вводимыми формами иФНО-α, ингибиторов интерлейкина-6 и абатацепта. В целом абсолютный риск реакции гиперчувствительности невысок и составляет <1% [18].
Развитие онкологических заболеванийДанные о влиянии ГИБП на риск развития злокачественных новообразований существенно разнятся. Так, на основании анализа отчетов о побочных эффектах, направленных в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, R. Hansen et al. [19] и F. Wolfe et al. [20] было показано, что назначение инфликсимаба увеличивает риск развития лимфом. В то же время анализ данных регистров ARTIS [21] и RATIO [22] не выявил связь между лечением иФНО-α и развитием лимфомы у пациентов с РА. Анализ, проведенный экспертами рабочей группы EULAR Британского общества ревматологов [23], также не подтвердил влияния иФНО-α на риск развития лимфом. По данным метаанализа, проведенного J.L. Wang в 2019 г. [24], в котором объединены данные более 123 000 пациентов с РА, было показано достоверное возрастание риска немеланомного рака кожи в связи с применением иФНО-α: относительный риск составил 1,18 (95% ДИ 1,05–1,31).
В нашем исследовании было выявлено 3 злокачественных новообразования (0,13 на 100 пациенто-лет), среди них 1 случай рака легких и 2 случая рака молочной железы, и 9 доброкачественных новообразований (0,39 на 100 пациенто-лет), среди них образования подкожно-жировой клетчатки, щитовидной железы, сигмовидной кишки, матки.
Сердечно-сосудистые заболеванияВ нескольких крупных исследованиях [25–27] были получены данные, свидетельствующие о том, что риск развития сердечно-сосудистых заболеваний снижается при приеме иФНО-α в сравнении с пациентами, получающими традиционные БПВП, что, вероятно, связано со снижением активности заболевания и эффективным контролем воспалительного процесса. По данным Кокрейновского метаанализа [28], возникновение новых случаев сердечной недостаточности статистически не отличалось в группе пациентов, получающих ГИБП, и в контрольной группе.
В нашей когорте было отмечено 105 случаев (4,59 на 100 пациенто-лет) болезней системы кровообращения. Среди них: повышение АД — 45 случаев, ИБС — 13, ЦВБ — 8, другие болезни кровообращения (нарушения ритма сердца, аортальная недостаточность, атеросклероз, варикозная болезнь вен нижних конечностей и др.) — 39 случаев.
Влияние ГИБП на развитие инфекционных заболеванийВ когортных исследованиях [29, 30], сравнивавших влияние таргетных препаратов на риск инфекционных осложнений, не выявлено достоверных различий между ними. Однако, по данным T.L. Michaud et al. [31], были обнаружены более высокие риски развития инфекционных осложнений у пациентов, принимающих адалимумаб, цертолизумаба пэгол и инфликсимаб по сравнению с этанерцептом.
Полученные нами данные в целом соответствуют результатам РКИ и данных международных регистров.
Заключение
Таким образом, в настоящее время не только в нашей стране, но и во всем мире происходит накопление и анализ данных как эффективности, так и безопасности ГИБП и тсБПВП в условиях реальной клинической практики. Согласно результатам проведенного нами исследования при использовании ГИБП и тсБПВП у пациентов с РА наиболее частыми НЯ являются инфекционные осложнения. К самым распространенным среди серьезных инфекций относятся пневмонии. Также нами не было выявлено увеличения частоты онкологических заболеваний и патологии со стороны сердечно-сосудистой системы. Дальнейшее накопление данных будет способствовать оптимизации лечения пациентов с РА.












