Введение
Биологическая терапия в лечении ревматических заболеваний активно используется с начала 2000-х гг. Исторически первым классом лекарственных средств, появившимся в арсенале ревматологов, были ингибиторы ФНО–a. Первый препарат данного класса для лечения ревматоидного артрита (РА) был зарегистрирован FDA в 1999 г. [1]. Спектр применения этого класса препаратов достаточно широк. Так, например, для инфликсимаба спектр показаний, зарегистрированных в РФ, включает РА, анкилозирующий спондилит (АС), воспалительные заболевания кишечника (болезнь Крона и язвенный колит), псориаз и ПА [2].В 2009 г. был зарегистрирован первый представитель нового класса – ингибиторов интерлейкина (ИЛ)-12 и ИЛ–23 – устекинумаб, применяемый для лечения псориаза и ПА [3]. В 2016 г. к списку антицитокиновых препаратов, используемых для лечения псориаза и ПА, добавился ингибитор ИЛ-6 – секукинумаб [4]. В сравнении с традиционной системной терапией биологическая терапия обладает рядом существенных преимуществ: большей эффективностью в лечении тяжелых и среднетяжелых форм заболеваний, меньшим спектром нежелательных лекарственных реакций. В то же время для генно-инженерных биологических препаратов (ГИБП) характерны специфические группы нежелательных явлений (НЯ), связанных с подавлением ими противоинфекционного и противоопухолевого иммунитета. У пациентов, получающих ГИБП, отмечено увеличение частоты инфекционных осложнений, особое место среди которых занимает туберкулезная инфекция. Также отмечается повышение числа новообразований. Кроме того, назначение ГИБП может быть причиной НЯ, связанных с механизмом их действия и особенностями молекулярной структуры.
В связи с этим всесторонняя оценка профиля безопасности отдельных ГИБП является абсолютно необходимой. Данные клинических исследований у пациентов с псориазом, получавших ГИБП, имеют ряд ограничений, связанных с их дизайном. В отличие от них, регистры пациентов предоставляют для анализа информацию из реальной клинической практики, что позволяет более объективно оценить безопасность отдельных ГИБП.
Целью данной работы явилось изучение безопасности различных ГИБП, применяемых для лечения пациентов с псориазом и ПА в реальной клинической практике, по данным международных регистров пациентов.
Материал и методы
Проводился систематический анализ литературы с использованием базы данных PubMed. 2 сентября 2016 г. был проведен поиск по запросу «psoriasis AND regist* NOT clinicaltrial». Дополнительные ограничения (по дате публикации и другим критериям) не использовались. Далее проводился последовательный анализ публикаций по релевантности по следующим 3 критериям: наличию в них описания регистра пациентов с псориазом/ПА, использованию биологической терапии у пациентов с псориазом и наличию данных о безопасности терапии. В результате для анализа были отобраны 17 оригинальных статей, содержащих данные о безопасности/выживаемости биологической терапии из 9 регистров пациентов с псориазом.Результаты
Общая характеристика отобранных для анализа регистров пациентов представлена в таблице 1. Большинство регистров содержит данные о пациентах, проживающих в странах Европы. Исключение составляет PSOLAR – международный регистр, который начинался в США, а в настоящий момент объединяет 12 стран Американского континента и Европы. Кроме того, сетевой регистр Psonet аккумулирует данные из различных национальных регистров (в основном из стран Западной Европы, а также Австралии и Израиля). Часть регистров посвящена анализу побочных эффектов проводимой терапии, другая часть направлена на изучение выживаемости отдельных видов генно-инженерной терапии и связи выживаемости терапии с ее безопасностью [5].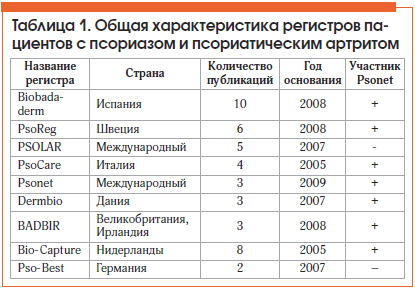
В публикациях по 8 регистрам содержатся данные о побочных эффектах ГИБП с частотой их встречаемости на 100 пациенто-лет (или возможностью расчета этой величины), публикации по регистру PsoReg носят описательный характер.
В таблице 2 суммированы данные по частоте серьезных НЯ из различных регистров.
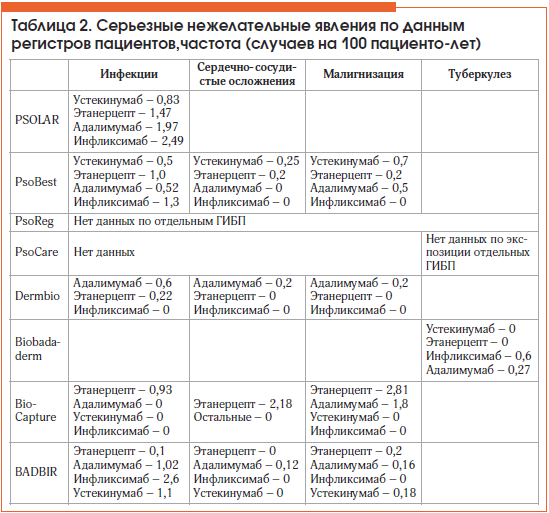
Серьезные инфекции
Наибольшее количество данных в регистрах пациентов касается развития серьезных инфекционных осложнений. В регистре PSOLAR [6, 7] проанализированы данные 11 466 пациентов с псориазом (22 311 пациенто-лет). Регистр показал относительные риски серьезных инфекций у пациентов, получающих различные виды системной терапии псориаза: небиологические методы лечения и ГИБП (инфликсимаб, адалимумаб, устекинумаб, этанерцепт). За время наблюдения в когорте пациентов, получающих биологическую терапию (и получавших ее до включения в регистр), зарегистрированы 323 серьезных инфекции, в т. ч. у 6 пациентов (0,1%, 0,03 на 100 пациенто-лет) они закончились летальным исходом. Кумулятивный некорригированный уровень серьезных инфекций составил 1,45 случая на 100 пациенто-лет, аналогичный уровень серьезных инфекций у бионаивных пациентов – 1,12 случая на 100 пациенто-лет. Наиболее частыми инфекциями были пневмония и воспаление подкожно-жировой клетчатки. Также были отмечены отдельные случаи некротизирующего фасциита (4), туберкулеза (2), гистоплазмоза (2), гепатита С (1) и сальмонеллезной бактериемии (1). Частота развития серьезных инфекционных осложнений для отдельных препаратов из расчета на 100 пациенто-лет составила для инфликсимаба 1,3, для адалимумаба – 0,52, для этанерцепта – 1,47, для устекинумаба – 0,83 (табл. 2).В когорте пациентов, получающих системную небиологическую терапию псориаза и ПА, уровень серьезных инфекций составил 1,28 на 100 пациенто-лет в группе больных, получающих метотрексат, и 1,05 на 100 пациенто-лет в группе больных, получающих другие виды системной терапии.
В регистр PsoBest [8] включено 2444 пациента, в т. ч. 908 пациентов, получающих ГИБП (адалимумаб, этанерцепт, инфликсимаб или устекинумаб). Общий уровень серьезных НЯ составил 1,3 на 100 пациенто-лет в когорте небиологической системной терапии и 1,5 в когорте ГИБП. Доля серьезных инфекций составила 0,33 на 100 пациенто-лет в группе традиционной небиологической системной терапии и 0,65 в группе ГИБП (р>0,05, разница клинически незначима) (доверительный интервал 0,13–0,54/0,35–0,98). Частота серьезных инфекционных осложнений составила 1,3 на 100 пациенто-лет в группе инфликсимаба, 1,0 – в группе этанерцепта, 0,52 – в группе адалимумаба, 0,5 – в группе устекинумаба (табл. 2).
В регистр Bio-Сapture [9] включены 173 пациента с псориазом и ПА, получавших ГИБП (этанерцепт, адалимумаб, инфликсимаб, устекинумаб, а также эфализумаб и ряд других не зарегистрированных в РФ препаратов). Представлены данные по частоте инфекций на фоне применения ГИБП: серьезные инфекции развивались только в группе пациентов, получающих терапию этанерцептом, частота их составила 0,93 на 100 пациенто-лет (табл. 2). У пациентов, получавших устекинумаб, инфликсимаб, адалимумаб и другие ГИБП, серьезные инфекции зарегистрированы не были. Один пациент с вирусным гепатитом В лечился этанерцептом и антиретровирусными препаратами, активации гепатита В у него не отмечено. Наиболее часто встречавшиеся в регистре Bio-Capture побочные эффекты – это инфекции респираторного тракта, кожи, зуд, боли в суставах, гриппоподобный синдром, жалобы со стороны ЖКТ, головная боль и слабость.
Целями регистра Biobadaderm [10] (1956 пациентов) были регистрация побочных эффектов у пациентов с псориазом и ПА на фоне лечения ГИБП (устекинумаб, этанерцепт, адалимумаб, инфликсимаб) и традиционной системной терапии, выявление возможных факторов риска развития НЯ. В регистре проведено сравнение профиля безопасности у пациентов старшей возрастной категории (более 65 лет), получающих стандартную или биологическую терапию. Количество серьезных побочных эффектов росло с возрастом пациентов, что может быть объяснено коморбидностью, а не самой терапией псориаза. У пациентов с псориазом и ПА старшей возрастной категории, получавших ГИБП, не возрос риск побочных эффектов, в т. ч. инфекционных [11].
В регистр Dermbio включено 715 пациентов, получающих ингибиторы ФНО-a: инфликсимаб, адалимумаб и этанерцепт. Побочные явления зафиксированы в 39,8% случаев терапии адалимумабом, в 39,2% – этанерцептом, в 38,2% – инфликсимабом. Наиболее частыми побочными эффектами были инфекции. В целом было зарегистрировано 9 серьезных побочных эффектов, 6 из которых, возможно, были связаны с проводимой терапией: 4 у пациентов, получавших терапию адалимумабом (1 случай рака яичников и 3 случая серьезных инфекций: пневмония, абсцесс, мочевые инфекции), и 2 у пациентов, получавших лечение этанерцептом (1 случай неврологических осложнений – головокружения, 1 случай сепсиса). Частота серьезных инфекционных осложнений составила 0,6 на 100 пациенто-лет для адалимумаба и 0,22 на 100 пациенто-лет для этанерцепта (табл. 2) [12].
Регистр BADBIR (3523 пациента, включение в регистр после инициации биологической терапии: этанерцепт, инфликсимаб, адалимумаб, устекинумаб). При выявлении причин прекращения биологической терапии проанализированы побочные явления ГИБП, в т. ч. инфекционные осложнения. Выявлено статистически значимое увеличение количества серьезных инфекций при применении инфликсимаба (2,6 на 100 пациенто-лет) (табл. 2) [13].
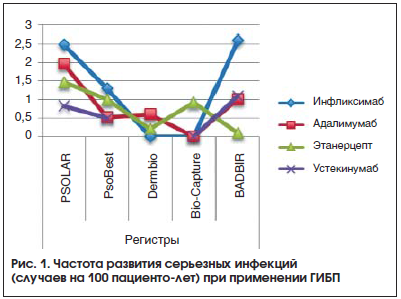 Сводные данные по частоте серьезных инфекций у пациентов, получавших биологическую терапию, представлены на рисунке 1.
Сводные данные по частоте серьезных инфекций у пациентов, получавших биологическую терапию, представлены на рисунке 1.Туберкулез
Данные о возможной активации латентного туберкулеза представлены в регистре Biobadaderm [14]. Заболеваемость туберкулезом у пациентов с псориазом, не получавших ГИБП, составила 107 на 100 пациенто-лет (95% ДИ: 40–287), в когорте получавших ГИБП, – 14 на 100 (95% ДИ: 55–389). У 9 пациентов (11,1%) на момент включения в регистр при рентгенографии грудной клетки были найдены изменения, расцененные как возможные посттуберкулезные. У 177 пациентов на момент включения в регистр отмечалась положительная или сомнительная туберкулиновая проба (у 163 – из-за латентной туберкулезной инфекции, у 14 – из-за ранее перенесенного туберкулеза). За время наблюдения еще у 8 пациентов, получавших ГИБП, развились положительные туберкулиновые кожные пробы без признаков активного туберкулеза (риск латентного туберкулеза составил 2,9 случая на 100 пациенто-лет (95% ДИ: 1,5–5,8).У 4-х пациентов развился активный туберкулез (2 из них получали терапию инфликсимабом, 2 – адалимумабом, частота развития туберкулезной инфекции составила 0,6 на 100 пациенто-лет для инфликсимаба и 0,27 на 100 пациенто-лет для адалимумаба) (табл. 2). У 1 пациента имели место 2 эпизода активации туберкулезной инфекции: один – во время терапии инфликсимабом, и рецидив через 3 года из-за не полностью проведенной терапии туберкулеза, через 8 мес. после прекращения терапии вторым ГИБП – устекинумабом.Малигнизация
Данные о частоте развития злокачественных опухолей у пациентов, получавших ГИБП, представлены на рисунке 2.
В регистре ProBest [8] общая доля малигнизации (исключая немеланомный рак кожи) составила 0,46 на 100 пациенто-лет в группе традиционной системной терапии и 0,49 на 100 пациенто-лет в группе ГИБП (р>0,05, разница статистически незначима). Статистически значимой разницы между различными препаратами (устекинумаб, этанерцепт, адалимумаб и инфликсимаб) в риске малигнизации (исключая немеланомный рак кожи), а также в риске возникновения немеланомного рака кожи или меланомы кожи, выявлено не было (табл. 2).
По данным регистра Bio-Сapture [9], у 9 пациентов наблюдалось 11 случаев малигнизации. У 48-летнего пациента во время терапии этанерцептом трижды зарегистрированы случаи развития злокачественных новообразований, а именно плоскоклеточного рака кожи и карциномы пищевода. У другого пациента развились 2 случая базальноклеточного рака кожи и 1 случай плоскоклеточного рака кожи в течение 6 мес. после начала терапии этанерцептом. У 66-летней женщины, получавшей терапию этанерцептом, был диагностирован рак молочной железы. Рак толстой кишки с метастазированием был выявлен у 76–летнего пациента, получавшего этанерцепт. Частота развития опухолей на фоне терапии отдельными ГИБП составила: 2,81 случая на 100 пациенто-лет для этанерцепта и 1,8 случая на 100 пациенто-лет для адалимумаба. У пациентов, получавших устекинумаб и инфликсимаб, случаев малигнизации не выявлено (табл. 2).
В регистре Dermbio описан 1 случай рака яичников у пациентки, получавшей адалимумаб (0,2 случая на 100 пациенто-лет) [12].
По данным регистра BADBIR, частота малигнизации на фоне терапии этанерцептом составила 0,2 на 100 пациенто-лет, на фоне терапии устекинумабом – 0,18 на 100 пациенто-лет, в группе адалимумаба – 0,16 на 100 пациенто-лет. Статистически значимых различий в частоте встречаемости малигнизации на фоне перечисленных препаратов не выявлено. В группе инфликсимаба случаев малигнизации не отмечено [13].
Сердечно-сосудистые осложнения
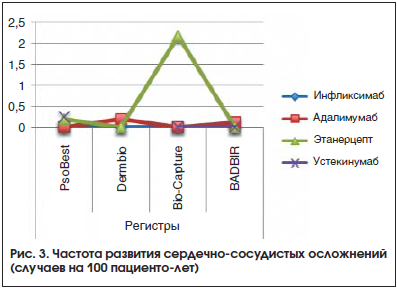
Данный вид побочных эффектов описан в регистрах PsoBest, Bio-Capture, BADBIR и Dermbio. В регистре PsoBest [8] частота сердечно-сосудистых событий значимо не отличалась в группах пациентов, получавших системную небиологическую терапию, и в когорте пациентов, получавших ГИБП (0,56 против 0,77 на 100 пациенто-лет). Также не наблюдалось различий в группах разных препаратов (табл. 2).В регистре Bio-Capture [9] среди 4-х серьезных побочных эффектов описаны 2 внезапные смерти от сердечно-сосудистых заболеваний (терапия этанерцептом, длительность терапии – 12 и 15 мес.). У одного из умерших пациентов в анамнезе были ОНМК и артериальная гипертензия, у другого – хроническая обструктивная болезнь легких. При этом смертельный исход не связывался авторами публикации с проводимой терапией. Еще у одного пациента на 4-й день терапии этанерцептом развился острый инфаркт миокарда, по мнению исследователей, возможно, связанный с приемом этанерцепта.
В регистре BADBIR описаны 3 случая сердечно-сосудистых осложнений на фоне терапии адалимумабом, что составило 0,12 пациенто-лет. В группах других ГИБП сердечно-сосудистых осложнений зарегистрировано не было [13].
В регистре Dermbio описан 1 случай осложнения со стороны сердечно-сосудистой системы в группе адалимумаба (0,2 на 100 пациенто-лет) [12].
Данные о частоте сердечно-сосудистых осложнений представлены на рисунке 3.
Выживаемость терапии ГИБП
Длительность проводимой различными препаратами терапии проанализирована в регистрах Dermbio и BADBIR.
В регистре Dermbio основными причинами прекращения терапии явились потеря эффекта (75%) и побочные эффекты (12%). Наилучшую выживаемость среди ингибиторов ФНО-альфа показал инфликсимаб – через 4 года его приема 70% пациентов остаются на данной терапии [12].
По данным регистра BADBIR, выживаемость биологической терапии первым ГИБП через 1 год составляла 77%, а к концу 3-го года терапии падала до 53%. Предикторами прекращения терапии ГИБП явились женский возраст, текущий статус курильщика, терапия этанерцептом или инфликсимабом. В противовес этому, наличие ПА или терапия устекинумабом явились предикторами длительности проводимой терапии. Прекращало терапию из-за развития побочных эффектов примерно одинаковое количество пациентов во всех 4-х группах ГИБП. Устекинумаб, назначенный в качестве первого ГИБП, продемонстрировал наибольшую выживаемость терапии у пациентов с псориазом [13].
Обсуждение
Псориаз широко распространен среди населения. Так, псориазом страдают 0,73–2,9% европейцев всех возрастных категорий, распространенность ПА в популяции составляет 0,06–1,4%. Традиционная системная терапия псориаза и ПА может приводить к регрессу симптомов, однако эффективна не для всех пациентов, и зачастую ее применение ограниченно токсичностью препаратов. Использование ГИБП дало новый инструмент для борьбы с хроническими заболеваниями, улучшения качества жизни пациентов. Но, без сомнения, при применении этих препаратов возрос риск различных побочных эффектов, в т. ч. туберкулеза [15].Регистры пациентов с псориазом и ПА – это обширная база данных, позволяющая проанализировать длительное ведение пациентов в реальной клинической практике. Целью ведения регистров является изучение безопасности, переносимости и исходов терапии пациентов, возможных предикторов эффективности препаратов. В данной статье проанализированы данные по безопасности из 9 различных национальных и международных регистров пациентов с псориазом и ПА.
Безусловно, количество серьезных побочных эффектов при проведении любой системной терапии, в т. ч. биологической, статистически достоверно повышается с возрастом [16, 17]. Кроме того, наличие сопутствующих заболеваний также является предиктором эффективности и безопасности. Так, например, пациенты с сопутствующим РА чаще прекращают терапию из-за неэффективности и развития побочных эффектов, чем пациенты с АС [18].
Данные о безопасности ГИБП, полученные при анализе различных регистров, достаточно вариабельны. Это может быть связано с различными факторами. Так, в разных странах используются различные стандарты ведения пациентов. Кроме того, в регистрах группы пациентов, получающих те или иные ГИБП, безусловно, неоднородны, что также влияет на полученные результаты. Таким образом, на основании данных, полученных из регистров, мы не можем проводить прямые сравнения между различными препаратами. Данные, полученные при анализе безопасности применения тех или иных видов системной терапии для пациентов с псориазом и ПА, не могут быть перенесены на пациентов с другими заболеваниями [19]. Также следует отметить, что большинство пациентов, находящихся на терапии ГИБП, ранее получали другие виды традиционной системной и/или биологической терапии псориаза и ПА, поэтому зачастую трудно определить, связан ли тот или иной побочный эффект с текущей терапией либо препаратами, которые пациент получал ранее.
В регистре PSOLAR среди пациентов, получавших ГИБП (как в группе больных, включенных в регистр уже на фоне биологической терапии, так и в группе бионаивных пациентов), наблюдалась одинаковая тенденция – самый низкий уровень серьезных инфекций зарегистрирован для устекинумаба и этанерцепта, более высокий – для инфликсимаба и адалимумаба.
Связь между терапией ингибиторами ФНО-a и инфекциями при лечении псориаза и других воспалительных заболеваний широко известна. Адалимумаб и инфликсимаб – это моноклональные АТ с похожим механизмом действия. В противовес им этанерцепт (ингибитор рецепторов ФНО–a) не увеличивал риск инфекционных осложнений ни в одной из популяций. Использование устекинумаба (ингибитора ИЛ-12 и -23) по сравнению с небиологическими препаратами не увеличивало риска серьезных инфекций.
В противовес этому, в регистре Bio-Capture наибольший процент серьезных инфекций зарегистрирован у группы пациентов, получавших этанерцепт. Это может быть связано с тем, что для этанерцепта количество пациенто-лет наблюдения было наибольшим (319 пациенто-лет), т. к. это был первый биологический препарат, зарегистрированный для лечения псориаза. В регистре BADBIR среди препаратов, вызывающих серьезные инфекционные осложнения, лидировал инфликсимаб.
В регистре ProBest общий уровень серьезных НЯ составил 1,3 на 100 пациенто-лет в когорте традиционной терапии и 1,5 в когорте ГИБП. Причем в группе инфликсимаба также отмечалось некоторое увеличение уровня серьезных инфекций, в группах адалимумаба и устекинумаба количество серьезных инфекций было минимально, однако разница между группами статистически недостоверна.
В отношении возможной малигнизации данные также противоречивы. Все пациенты с раком кожи ранее получали интенсивную терапию УФ-В и/или ПУВА-терапию, а также иммуносупрессивную терапию. Поэтому трудно соотнести случаи малигнизации только с применением ГИБП [9]. Регистр Biobadaderm показал, что риск развития опухолей больше в когорте пациентов, получающих небиологическую терапию, чем в когорте пациентов, леченных биологическими агентами.
Важной представляется также возможность активации латентной туберкулезной инфекции (ЛТИ) на фоне терапии псориаза и ПА. Недавние исследования показали, что частота развития ЛТИ у пациентов с псориазом составляет 2–22% в Италии, 10% – в Лондоне, 11% – на Тайване и 20–29% – в Испании [14]. Анализ обострений туберкулезной инфекции проведен в регистре Biobadaderm. Опубликованные данные по туберкулезу позволяют заключить, что все его случаи наблюдались на фоне терапии ингибиторами ФНО-a (инфликсимаб и адалимумаб), несколько – на фоне терапии этанерцептом и ни одного – на фоне терапии устекинумабом. Данные неравнозначны для разных биологических агентов – наиболее часто и наиболее рано туберкулезная инфекция развивается на фоне терапии инфликсимабом (относительный риск – 5,2, средняя продолжительность терапии – 16,2 нед.) и адалимумабом (относительный риск – 2,5, среднее время терапии – 59,6 нед.). Отдельно стоит устекинумаб, в отношении которого описаны только случаи реактивации туберкулезной инфекции [20]. Скрининг на ЛТИ также обязателен для всех кандидатов на проведение терапии ГИБП, как и дальнейший мониторинг получающих ее пациентов.
Создается общее впечатление о том, что количество побочных эффектов больше у пациентов, получающих терапию инфликсимабом и, возможно, адалимумабом, и меньше в группе устекинумаба. Данные о безопасности терапии этанерцептом неоднозначны, что связано со значительными различиями, полученными при анализе различных регистров.
Интересные данные получены при анализе выживаемости терапии. В регистре Dermbio среди ингибиторов ФНО–a наилучшая выживаемость терапии показана для инфликсимаба, у адалимумаба и этанерцепта показатели выживаемости терапии значительно хуже. Анализ выживаемости терапии важен, т. к. длительность лечения тем или иным препаратом зависит не только от первичной или вторичной неэффективности проводимой терапии, но и от безопасности препарата и возможных побочных эффектов. В регистре BADBIR наибольшая выживаемость выявлена у пациентов, получавших устекинумаб, что коррелировало с относительно низким уровнем инфекционных осложнений и других побочных эффектов.
Выводы
Биологические агенты играют все большую роль в терапии псориаза и ПА. Данные о безопасности применения ГИБП получают в основном из рандомизированных контролируемых исследований (РКИ) или из продленных фаз РКИ. Пациенты, участвующие в РКИ, выбираются в соответствии с критериями включения и исключения, при этом многие уязвимые группы пациентов (с сопутствующими заболеваниями и пр.) не включаются в исследования из соображений безопасности. В реальной клинической практике ГИБП назначаются шире и гораздо большему контингенту больных, в т. ч. тем, которые могли бы не пройти по критериям в РКИ и для кого, таким образом, результаты РКИ неприменимы. Соответственно, частота и спектр НЯ, полученных в РКИ и при наблюдении пациентов в регистрах, различаются между собой.Регистры пациентов обладают большими возможностями в изучении всех аспектов назначения биологической терапии, в т. ч. и в выявлении рисков и осложнений терапии в реальной клинической практике. Вместе с тем разнородность данных, связанная с различиями в дизайне регистров, не позволяет проводить прямое сравнение безопасности отдельных препаратов. В условиях наличия большого числа терапевтических опций профиль безопасности отдельных ГИБП становится одним из ключевых факторов выбора терапии псориаза/ПА для каждого конкретного пациента. Для оценки профиля безопасности отдельных ГИБП необходимо оценивать всю совокупность имеющихся данных.












