Одной из наиболее значимых для патогенеза ЮА мишеней является фактор некроза опухоли–альфа (ФНО–α) [1,3,5–11]. ФНО–α – цитокин, выполняющий очень важные функции в формировании системного воспалительного процесса. Первично он регулирует рост, выживаемость и функции клеток иммунной системы [3,7–9]. Биологические функции ФНО–α включают индукцию провоспалительных цитокинов, таких как интерлейкин–1 (ИЛ–1) и интерлейкин–6 (ИЛ–6), увеличение подвижности лейкоцитов и их миграции из кровеносного русла в ткани путем повышения проницаемости эндотелиального слоя кровеносных сосудов микроциркуляторного русла и усиления экспрессии молекул клеточной адгезии. ФНО–α способен индуцировать гибель клеток путем апоптоза, запускать каскад воспалительных реакций, ингибировать канцерогенез и репликацию вирусов. ФНО–α играет очень важную роль в генезе деструктивных процессов при ревматических заболеваниях, в которые вовлечены остеокласты, синовиальные фибробласты и хондроциты, и с его гиперпродукцией связаны такие клинические проявления, как боль, отек, формирование костных эрозий и сужение суставной щели. Из системных клинических эффектов при ревматоидном воспалении наиболее ярко действие ФНО–α проявляется в феномене потери массы тела, что давало основание называть этот цитокин «кахектином». Ингибиция действия ФНО–α позволяет рассчитывать на устранение указанных патологических процессов и обеспечить предупреждение необратимых структурных изменений суставов.
Среди ингибиторов ФНО, зарегистрированных в РФ к настоящему времени (2010 г.), имеется 3 ГИБП – этанерцепт, инфликсимаб, адалимумаб. Их сравнительная характеристика представлена в таблице 1. Среди всех биологических агентов, используемых в ревматологии, наиболее обширный в мире опыт применения у детей с ювенильным артритом накоплен в отношении этанерцепта. Этанерцепт (Энбрел®) по своей структуре представляет собой белок, состоящий из двух рецепторов ФНО (рФНО2/75) с добавлением Fc–фрагмента человеческого IgG1. Таким образом, он состоит из человеческих компонентов, но в целом представляет собой искусственную молекулу, не существующую в природе. Этанерцепт связывается с молекулой ФНО, блокируя тем самым ее взаимодействие с рецепторами на клеточной поверхности. В отличие от антител к ФНОα (инфликсимаб, адалимумаб), этанерцепт не вызывает лизиса клеток, вовлеченных в процесс воспаления, и способен нейтрализовать только свободный ФНО, не оказывая влияния на ФНО, представленный в связанной с рецептором форме. Хотя клиническое значение подобных различий полностью не установлено, оно может объяснять ряд отличий в действии этих агентов, как в плане развития терапевтического эффекта, так и формирования побочных реакций. Этанерцепт, воспроизводя ингибирующий эффект природно существующих растворимых рецепторов к ФНО отличается от них более продолжительным периодом выведения и, следовательно, обладает более выраженным и длительно сохраняющимся эффектом, чем естественные растворимые рецепторы ФНО.
Свое действие этанерцепт начинает реализовать вскоре после инъекции, однако клинически явный эффект обнаруживается примерно через 2–3 недели или даже ранее [12,13]. Впрочем, у больных ЮА, по–видимому, из–за сложного взаимодействия компонентов цитокиновой сети в патогенезе заболевания возможны и индивидуальные особенности ответа на терапию этанерцептом со значительной отсрочкой в достижении эффекта, что не исключает возможности дальнейшего успешного лечения. Так, например, в недавно опубликованном мультицентровом педиатрическом исследовании, выполненном в Нидерландах [14], из 179 пациентов с ювенильным идиопатическим артритом (ЮИА) у 34 детей (20%) в первые 3 месяца приема этанерцепта клинически значимого ответа не было получено. Несмотря на видимую неэффективность терапии, в данном исследовании лечение было продолжено и обнаружено, что в половине из рефрактерных наблюдений достигнуто потенцирование эффекта в более поздние сроки. Из представленных авторами данных можно отметить, что на достижение эффекта влияет клинический вариант ЮИА, впрочем, как и на эффективность в целом. Ниже всего процент «ответчиков» на терапию ингибиторами ФНО наблюдается среди пациентов с системным вариантом ЮА. В обсуждаемом Нидерландском исследовании [14] 30% уровня улучшения клинически важных показателей активности ЮИА в первые 3 месяца лечения достигли только 62% больных системным вариантом ЮИА в отличие от 85–90% пациентов с другими клиническими вариантами ЮИА. Пролонгация терапии этанерцептом более 3–х месяцев ненамного улучшило показатели эффективности при системном варианте, увеличив процент «ответчиков» с 62 до 67%. При серопозитивном полиартикулярном ЮИА продолжение терапии этанерцептом более 3 месяцев также не способствовало увеличению доли «ответчиков» на терапию, хотя этот показатель в данной когорте изначально был существенно выше, чем при системном ЮИА (85% против 62%). Напротив, при клинических вариантах ЮИА, относящихся к группе ювенильных спондилоартропатий (псориатический артрит, артрит с энтезитом), эффективность терапии этанерцептом констатирована у 100% пациентов, причем в пределах первых 3 месяцев лечения – у 90% больных ювенильным псориатическим артритом и у 83% больных, относящихся к категории «артрит с энтезитом». Таким образом, у 10% и 17% этих пациентов соответственно достигнутый эффект был отсрочен более, чем на 3 месяца.
Приведенное исследование может служить наглядной иллюстрацией того, что результаты рандомизированных клинических исследований (РКИ), выполненных на предрегистрационной стадии изучения фармакологического препарата, не дают исчерпывающей информации о вызываемых им эффектах в силу «рафинированной» популяционной выборки пациентов.
РКИ этанерцепта положило начало большой серии РКИ, выполненных за последние 10–12 лет Международной педиатрической ревматологической организацией по клиническим исследованиям (PRINTO – the Pediatric Rheumatology International Trials Organisation) и Педиатрической ревматологической объединенной исследовательской группы (PRCSG – Pediatric Rheumatology Collaborative Study Group). Тщательно проработанная методология выполнения исследования по изучению эффективности и безопасности этанерцепта послужила прототипом для проведения РКИ других ГИБП в педиатрической ревматологии [1,2,4,6,10,11].
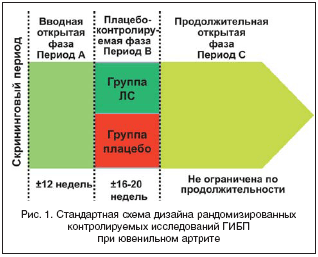
Особенности «педиатрического» дизайна РКИ (особенно применительно к ГИБП) заключаются в том, что первой фазой исследования является не плацебо–контролируемая фаза, как это принято при ревматоидном артрите взрослых, а применение изучаемого препарата в открытом режиме, обычно в течение 3 месяцев (рис. 1). Если достигается 30%–е улучшение стандартных показателей активности заболевания, так называемых «ACRpedi»–критериев, то пациент вступает во вторую фазу РКИ и рандомизируется в одну из групп (группу исследуемого лекарственного средства «study medication» или группу плацебо). Этические принципы проведения клинических исследований в педиатрии предусматривают строгое соблюдение интересов ребенка, поэтому в случае обострения заболевания в плацебо–контролируемой фазе РКИ пациент преждевременно выбывает из этой фазы и в случае согласия пациента и родителей включается в 3–й этап исследования – продолжительную открытую фазу, длительность которой может составлять несколько лет. Такой вид дизайна РКИ называют «дизайн с выбыванием», а данная методика, кроме доказательств эффективности исследуемого препарата, дает дополнительную информацию о том, как долго сохраняется эффект применяемого ГИБП после его отмены, что имеет важное значение для клинической практики.
Для оценки результатов клинических исследований в педиатрической ревматологии (при ЮА), кроме особого дизайна, используется и специфический инструмент оценки эффективности терапии [10,11] в виде критериев ACR pedi 30,50,70 («педиатрические» критерии Американской коллегии ревматологов 30, 50 и 70% ответа на терапию), включающие 6 показателей: 1) число «активных» суставов (из 75 суставов); 2) число суставов с ограничением функции (из 75 суставов); 3) СОЭ и/или СРБ; 4) общая оценка активности болезни, по мнению врача (ВАШ); 5) оценка общего самочувствия (активности болезни), по мнению пациента или его родителей (ВАШ); 6) оценка функциональной способности с помощью Опросника Childhood Health Assesment Quesionnare – CHAQ. Динамика перечисленных показателей в процессе лечения дает основание судить о степени эффективности: 30%–е улучшение показателей позволяет считать эффект умеренно положительным, 50% – хорошим; 70% – очень хорошим. После получения первых результатов РКИ этанерцепта с учетом отличного клинического эффекта, критерии ACRpedi были дополнены понятием 90 и 100%–й эффективности (ACRpedi90 и ACRpedi100) [1,15–18].
Этанерцепт явился первым ГИБП в педиатрической ревматологии, эффект которого был изучен в ходе многоцентрового РКИ [11,15–18], и закономерно, что этанерцепт стал первым ГИБП, зарегистрированным для лечения полиартикулярного варианта ювенильного ревматоидного артрита (ЮРА)/ЮИА в США (май 1999) и странах Европейского Союза (февраль 2000).
РКИ этанерцепта, первые результаты которого были опубликованы в 2000 г. [12], было продолжено в открытом режиме приема этанерцепта вплоть до настоящего времени. Опубликованные в 2008 г. результаты охватывают 8–летний период непрерывного применения этанерцепта у детей с полиартикулярным вариантом течения ЮРА. В это исследование изначально было включено 69 пациентов, у 74% из которых к окончанию 3 месяцев применения этанерцепта в открытом режиме было достигнуто 30%–е улучшение по критериям ACR pedi. В плацебо–контролируемой фазе исследования было показано, что процент больных, достигших 30%–го улучшения, увеличился до 80% у пациентов, рандомизированных в группу этанерцепта по сравнению со снижением этого показателя до 35% в группе плацебо. В период плацебо–контролируемой фазы у 21 (81%) из 26 пациентов, получавших плацебо, отмечено обострение заболевания, тогда как среди получавших этанерцепт обострение наблюдалось у 7 (28%) из 25 пациентов (р<0,03). Пролонгация терапии этанерцептом в рамках дальнейшего открытого исследования вплоть до 8 лет непрерывного приема показала неизменное нарастание эффекта, как это представлено на диаграмме (рис. 2). Так, среди пациентов, закончивших 8–летний период непрерывного применения этанерцепта (таковых осталось 11), было отмечено достижение всеми 100% больных критериев 30, 50 и 70%–го улучшения, а у 18% – 100% улучшения [18].
Результаты, полученные по данным РКИ, могут существенно отличаться от условий реальной клинической практики. Сложная процедура организации РКИ в педиатрии обусловливает ограниченное число РКИ педиатрической ревматологии: как правило, только одно международное многоцентровое исследование для каждого ГИБП с включением относительно небольшого числа пациентов (для этанерцепта – 69; инфликсимаба – 122; адалимумаба – 171; абатацепта – 190 пациентов). Это обстоятельство резко контрастирует с опытом аналогичных РКИ при ревматоидном артрите (РА) взрослых, которые включают несколько тысяч пациентов и несколько отдельных РКИ различного дизайна. Предполагалось, что данные, полученные на популяции взрослых пациентов, могут составить доказательную базу эффективности и безопасности ГИБП и для пациентов детского возраста. По–видимому, именно поэтому все РКИ ингибиторов ФНО при ЮА включали пациентов с полиартикулярным вариантом ЮРА/ЮИА, который из всех клинических вариантов ЮА обнаруживает максимальное сходство с РА взрослых. С иммунологической точки зрения полиартикулярный ЮА не может являться эквивалентом РА, как минимум, вследствие того обстоятельства, что полиартикулярный ЮА в подавляющем большинстве случаев серонегативен по ревматоидному фактору. В реальной клинической практике максимальные трудности для курации представляют пациенты с клиническими вариантами ЮА, не имеющими эквивалентов во взрослом возрасте: системный вариант; ЮА, ассоциированный с увеитом; высокоактивным HLA–B27–ассоциированным олиго/полиартритом без вовлечения аксиального скелета.
Условия РКИ предусматривают строгое соблюдение протокола с жесткими критериями включения/исключения, направленными на формирование гомогенных групп, с однотипной базисной терапией (преимущественно только метотрексат), ограничениями по включению в исследование пациентов с опытом предшествующей терапии ГИБП, ограничениями по дозе получаемых пациентом глюкокортикоидов (не более 0,2 мг/кг или 10 мг в сутки по преднизолону), существенными ограничениями по коморбидной патологии. Например, как правило, не допускается включение в РКИ пациентов с положительной реакцией Манту, пациентов, имеющих в анамнезе указания на инфекцию мочевыводящих путей, синуситы, грибковое поражение слизистых оболочек и т.д. На практике среди пациентов с рефрактерными вариантами ЮА, нуждающихся в применении ГИБП, подавляющее большинство составляют пациенты, получающие различные базисные препараты и их комбинации, в т.ч. лефлуномид, прием которого является безусловным критерием исключения для рекрутирования пациента в РКИ. Как следствие активной иммуносупрессивной терапии, у пациентов с рефрактерными вариантами ЮА высока частота коморбидных инфекций, по крайней мере, в анамнезе. Рефрактерность к терапии обусловливает невозможность снижения ниже «физиологической» дозы глюкокортикоидов, и «гормонозависимость» чаще всего выступает в качестве ведущей причины для интенсификации терапии за счет назначения ГИБП.
Значительные трудности для педиатрической практики в ситуациях, требующих назначения ГИБП, представляет интерпретация данных реакции Манту и отсутствие взаимопонимания по этому вопросу детских ревматологов и детских фтизиатров. Общепринятая в педиатрии процедура разграничения понятий «тубинфицированность» и «поствакцинальная аллергия» не всегда пригодна для пациентов с ЮА, получающих многолетнюю иммуносупрессивную терапию. С другой стороны, риск активации латентного туберкулеза и его неконтролируемого течения на фоне терапии ГИБП, особенно ингибиторами ФНО, исключительно высок, поскольку ФНО является обязательным структурным компонентом туберкулезной гранулемы. Применение ингибиторов ФНО, особенно моноклональных антител (инфликсимаб, адалимумаб), которые не только инактивируют ФНО, но и подавляют его продукцию (табл. 1), создает условия для активации туберкулезной инфекции и ее диссеминации. Этим обстоятельством объясняется, что в каждом долгосрочном наблюдении больших групп пациентов, получающих ингибиторы ФНО, зарегистрировано несколько единичных случаев развития туберкулеза. За 8 лет опыта применения инфликсимаба и адалимумаба в детской клинике НИИР РАМН у 92 пациентов детского возраста с ЮА наблюдался всего один случай развития диссеминарованного туберкулеза – через 4 месяца после начала терапии инфликсимабом у 17–летней девочки с отрицательными туберкулиновыми пробами до начала применения ГИБП (рис. 3). Вследствие специфического механизма действия, отличного от действия моноклональных антител, применение этанерцепта более безопасно в отношении риска развития туберкулеза по сравнению с инфликсимабом и адалимумабом, что подтверждается многочисленными данными регистров пациентов [19].
Уникальный для педиатрической ревматологии обширный опыт применения ГИБП накоплен за 10 лет применения этанерцепта. Этот опыт обобщен и опубликован в данных национальных регистров Германии [20,21], США [22], Нидерландов [23], а также в многочисленных данных серии открытых исследований этанерцепта при различных вариантах ЮА, отраженных в обзорах [10,11,15]. Согласно постмаркетинговым данным к февралю 2009 г., около 13 850 детей были пролечены этанерцептом, что составило приблизительно 44 600 пациенто–лет. Солидный опыт применения этанерцепта в мировой клинической практике позволил сформулировать показания к назначению этанерцепта и условия мониторирования его безопасности.
Показанием к назначению этанерцепта служит полиартикулярный вариант заболевания тяжелого или средней тяжести течения в случае неэффективности, как минимум, 3–месячного курса базисной терапии 1–2 препаратами (в т.ч. обязательно метотрексат) в адекватной терапевтической дозе и/или при невозможности применения метотрексата из–за развития побочных реакций. Следует отметить, что комбинация этанерцепта с метотрексатом представляется более предпочтительной по сравнению с монотерапией этанерцептом в отношении долгосрочной эффективности.
Этанерцепт используется дважды в неделю в дозе 0,4 мг/кг массы тела (доза вводится дважды в неделю с интервалом 72–96 часов; максимальная доза 25 мг). В США зарегистрированные показания для лечения ЮА допускают возможность однократного в неделю применения этанерцепта в дозе 0,8 мг/кг/нед; при этом максимально допустимая доза препарата 50 мг/нед, а максимальная доза одномоментно вводимого препарата в одно место инъекции составляет 25 мг. Однократный в неделю способ введения препарата был апробирован и показал сопоставимые результаты по сравнению с 2–кратным в неделю введением [21,24].
Мониторирование безопасности препарата подразумевает, помимо рутинных гематологических и биохимических показателей, тщательное обследование на наличие туберкулезной инфекции, вирусных гепатитов, очагов активной инфекции до начала терапии этанерцептом и, как минимум, каждые полгода в процессе лечения либо по клиническим показаниям.
При назначении этанерцепта в условиях реальной клинической практики следует иметь в виду относительные ограничения и необходимость более взвешенного и осторожного подхода к применению этанерцепта при системном ЮА [25–28], а также у пациентов с увеитом или риском развития ревматоидного поражения глаз [29–36].
Сенсацией в педиатрической ревматологии стало сообщение в июне 2008 г. Федерального агентства, регулирующего оборот лекарственных средств в США (FDA) о 30 случаях злокачественных опухолей у детей, подростков и молодых людей с ревматическими заболеваниями, которые лечились ингибиторами ФНО [37]. В последующем в августе 2009 г. FDA дополнила сообщение 18 дополнительными наблюдениями [38]. Таким образом, FDA были получены 48 сообщений о злокачественных опухолях в педиатрии более чем за 8–летний период (2001–2008) [39]. Анализ этих публикаций позволяет сделать вывод о том, что преимущественно онкологические заболевания развивались у пациентов с воспалительными заболеваниями кишечника (25 случаев), получавших ингибиторы ФНО: как правило, инфликсимаб в сочетании с такими иммуносупрессивными препаратами, как азатиоприн, 6–меркаптопурин или глюкокортикоиды, реже – в сочетании с метотрексатом. Только 6 из 48 пациентов получали ингибиторы ФНО в качестве монотерапии. Наиболее примечательно, что в 10 из 48 случаев развилась редкая и очень злокачественная гепатолиенальная Т–клеточная лимфома (HSTCL) [40], причем все 10 пациентов с HSTCL страдали воспалительным заболеванием кишечника и лечились анти–ФНО моноклональными антителами, 9 из 10 – инфликсимабом, 1–адалимумабом. Несмотря на то, что зарегистрированные наблюдения онкологических заболеваний на фоне лечения ингибиторами ФНО у детей превышают популяционные значения, к настоящему времени пока не сформулировано обоснованного заключения о прямой связи применения ГИБП с развитием опухолевых заболеваний.
В этой связи в клинической практике перед назначением ингибиторов ФНО следует учитывать наличие таких факторов риска, как семейные случаи онкологических заболеваний, заболевания с повышенным риском развития опухолей (болезнь Крона или синдром Дауна) или предшествующее лечение цитотоксическими препаратами, такими как циклофосфамид, азатиоприн, 6–меркаптопурин.
Из всего вышесказанного можно заключить, что появление в арсенале педиатра–ревматолога препарата этанерцепт существенно увеличивает терапевтические возможности в лечении рефрактерных вариантов ЮА при приемлемом профиле безопасности и позволяет надеяться на успешность лечения и прогноза этого заболевания в будущем.

![Рис. 2. Нарастание эффекта терапии в результате 8-летнего периода применения в рамках продолжительной открытой фазы РКИ у больных ЮРА [18]](/data/articles/Image/t18/n27/1686-3.gif)

Литература
1. Cassidy JT, Petty RE., Laxer R.M., Lindsley C.B. Textbook of pediatric rheumatology. 6th ed. Philadelphia: Saunders Elsevier; 2010; 794 p.
2. Szer I.S., Kimura Y., Malleson P.N., Southwood T.R. Arthritis in children and adolescents: Juvenile idiopathic arthritis. Oxford university press. 456 p.
3. Алексеева Е.И., Литвицкий П.Ф. Ювенильный ревматоидный артрит: этиология, патогенез, клиника, алгоритмы диагностики и лечения. Рук. Для врачей, преподавателей, научных сотрудников. /Под общ. Ред. А.А.Баранова. – М.: ВЕДИ, 2007; 308 с.
4. Carrasco R., Smith J.A., Lovell D. Biologic agents for the treatment of juvenile rheumatoid arthritis: current status. Paediatr Drugs 2004;6:137–146.
5. Wilkinson N., Jackson G., Gardner–Medwin J. Biologic therapies for juvenile arthritis. Arch Dis Child 2003; 88: 186–191
6. Klein A., Hornef G. Treatment strategies for juvenile idiopathic arthritis. Expert Opin Pharmacother. 2009; 10 (18); 3049–3060.
7. Beutler BA. The role of tumor necrosis factor in health and disease. J Rheumatol Suppl 1999; 57:16–21.
8. McDevitt H, Munson S, Ettinger R, Wu A. Multiple roles for tumor necrosis factor–alpha and lymphotoxin alpha/beta in immunity and autoimmunity. Arthritis Res 2002; 4 Suppl 3:S141–S152.
9. Sfikakis PP, Kollias G. Tumor necrosis factor biology in experimental and clinical arthritis. Curr Opin Rheumatol 2003; 15(4):380–6.
10. Hayward K., Wallace C. Recent developments in anti–rheumatic drugs in pediatrics: treatment of juvenile idiopathic arthritis. Arthr.Res. & Ther. 2009, 11:216 (doi:10.1186/ar2619).
11. Breda L., Del Torto M., De Sanctis S., Chiarelli F. Biologics in children’s autoimmune disorders: efficacy and safety. Eur J Pediatr. DOI 10.1007/s00431–010–1238–z
12. Lovell D.J., Giannini E.H., Reiff A., et al. Etanercept in children with polyarticular juvenile rheumatoid arthritis. N. Engl. J. Med., 2000, 16, 342(11), 763–769.
13. Kietz D.A., Pepmueller P.H., Moore T.L. Clinical response to etanercept in polyarticular course juvenile rheumatoid arthritis. J Rheumatol 2001;28: 360–362.
14. Otten M., Prince F., Twilt M. et al. Delaed clinical response in patients with juvenile idiopathic arthritis treated with etanercept. J.Rheumatol. 2010; 37: 665–667.
15. Pain C., McCann L. Challenges in the management of juvenile idiopathic arthritis with etanercept. Biologics: Targets & Therapy 2009:3 127–139.
16. Lovell D.J., Giannini E.H., Reiff A., Jones O.Y., Schneider R., Olson J.C., et al. Long–term efficacy and safety of etanercept in children with polyarticular–course juvenile rheumatoid arthritis: interim results from an ongoing multicenter, open–label, extended–treatment trial. Arthritis Rheum 2003; 48: 218–226.
17. Lovell D.J., Reiff A., Jones O.Y., Schneider R., et al. Long–term safety and efficacy of etanercept in children with polyarticular–course juvenile rheumatoid arthritis. Arthritis Rheum 2006; 54: 1987–1994.
18. Lovell D.J., Reiff A., Ilowite N.T., Wallace C.A. et al. Safety and efficacy of up to eight years of continuous Etanercept therapy in patients with Juvenile rheumatoid arthritis. Arthritis Rheum 2008; 58; 5: 1496–1504.
19. Raychaudhuri S.P., Nguen C.T., Raychaudhuri S.K., Gershwin M.E. Incidence and nature of infectious disease in patients treated with anti–TNF agents. Autoimmuniti reviews 2009; 67–81; www elsevier.com.
20. Horneff G, Schmeling H, Biedermann T, Foeldvari I, Ganser G, Girschick HJ et al. The German etanercept registry for treatment of juvenile idiopathic arthritis. Ann Rheum Dis 2004; 63(12):1638–44.
21. Horneff G, De Bock F, Foeldvari I, Girschick HJ, Michels H, Moebius D et al. Safety and efficacy of combination of etanercept and methotrexate compared to treatment with etanercept only in patients with juvenile idiopathic arthritis (JIA): preliminary data from the German JIA Registry. Ann Rheum Dis 2009; 68(4):519–25.
22. Giannini EH, Ilowite NT, Lovell DJ, Wallace CA, Rabinovich CE, Reiff A et al. Long–term safety and effectiveness of etanercept in children with selected categories of juvenile idiopathic arthritis. Arthritis Rheum 2009; 60(9):2794–804.
23. Prince F.H.M., Twilt M., ten Cate R., Van Rossum M.A.J., et al. Long–term follow–up on effectiveness and safety of etanercept in JIA: the Dutch national register. Ann Rheum Dis published online 15 Apr 2008 doi:10.1136/ard.2007.087411
24. Horneff G., Ebert A., Fitter S.,et al. Safety and efficacy of once weekly etanercept 0.8 mg/kg in a multicentre 12 week trial in active polyarticular course juvenile idiopathic arthritis. Rheumatology 2009;48:916–919
25. Quartier P, Taupin P, Bourdeaut F, Lemelle I, Pillet P, Bost M et al. Efficacy of etanercept for the treatment of juvenile idiopathic arthritis according to the onset type. Arthritis Rheum 2003; 48(4):1093–101.
26. Eberhard BA, Ilowite NT. Response of systemic onset juvenile rheumatoid arthritis to etanercept: is the glass half full or half empty? J Rheumatol 2005; 32(5):763–765.
27. Kimura Y, Pinho P, Walco G, Higgins G, Hummell D, Szer I et al. Etanercept treatment in patients with refractory systemic onset juvenile rheumatoid arthritis. J Rheumatol 2005; 32(5):935–42.
28. Russo RA, Katsicas MM, Zelazko M. Etanercept in systemic juvenile idiopathic arthritis. Clin Exp Rheumatol 2002; 20(5):723–6. Reiff A, Takei S, Sadeghi S, Stout A, Shaham B, Bernstein B et al. Etanercept therapy in children with treatment–resistant uveitis. Arthritis Rheum 2001; 44(6):1411–5.
29. Reddy AR, Backhouse OC. Does etanercept induce uveitis? Br J Ophthalmol 2003; 87(7):925.
30. Schmeling H, Horneff G. Etanercept and uveitis in patients with juvenile idiopathic arthritis. Rheumatology (Oxford) 2005; 44(8):1008–11.
31. Smith JA, Thompson DJ, Whitcup SM, Suhler E, Clarke G, Smith S et al. A randomized, placebo–controlled, double–masked clinical trial of etanercept for the treatment of uveitis associated with juvenile idiopathic arthritis. Arthritis Rheum 2005; 53(1):18–23.
32. Galor A, Perez VL, Hammel JP, Lowder CY. Differential effectiveness of etanercept and infliximab in the treatment of ocular inflammation. Ophthalmology 2006; 113(12):2317–23.
33. Foeldvari I, Nielsen S, Kummerle–Deschner J, Espada G, Horneff G, Bica B et al. Tumor necrosis factor–alpha blocker in treatment of juvenile idiopathic arthritis–associated uveitis refractory to second–line agents: results of a multinational survey. J Rheumatol 2007; 34(5):1146–50.
34. Lim LL, Fraunfelder FW, Rosenbaum JT. Do tumor necrosis factor inhibitors cause uveitis? A registry–based study. Arthritis Rheum 2007; 56(10):3248–52.
35. Tynjala P, Lindahl P, Honkanen V, Lahdenne P, Kotaniemi K. Infliximab and etanercept in the treatment of chronic uveitis associated with refractory juvenile idiopathic arthritis. Ann Rheum Dis 2007; 66(4):548–50.
36. 3Lim LL. Uveitis following the use of tumor necrosis factor alpha inhibitors: Reply on comments. Arthritis Rheum 2008; 58:1556–7.
37. U.S.Food and Drug Administration. Information for Healthcare Professionals: Tumor Necrosis Factor (TNF) Blockers (marketed as Remicade, Enbrel, Humira, Cimzia, and Simponi). http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/DrugSafetyInformationforHeathcareProfessionals/ucm174474.htm 2009.
38. U.S.Food and Drug Administration. Early Communication About an Ongoing Safety Review of Tumor Necrosis Factor (TNF) Blockers (marketed as Remicade, Enbrel, Humira, and Cimzia). CDER Homepage. http://www.fda.gov/cder/drug/early_comm/TNF_blockers.htm 2008.
39. U.S.Food and Drug Administration. Follow–up to the June 4, 2008 Early Communication about the Ongoing Safety Review of Tumor Necrosis Factor (TNF) Blockers (marketed as Remicade, Enbrel, Humira, Cimzia, and Simponi). http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/DrugSafetyInformationforHeathcareProfessionals/ucm174449.htm 2009.
40. Diak P., Siegel J., Grenade L. Malignancy in children and TNF blockers: forty eight cases reported to the Food and Drug administration. Arthr. Rheum 2010; 61;8; 2517–2524.












