–Я–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –≥–µ–њ–∞—А–Є–љ–∞ –Є–ї–Є –і—А—Г–≥–Є—Е –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤–Њ–Ј–љ–Є–Ї–∞—О—В –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є –Є–ї–Є –і–ї—П –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –∞–Ї—В–Є–≤–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —В—А–Њ–Љ–±–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –≤ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–Љ –Є/–Є–ї–Є –≤–µ–љ–Њ–Ј–љ–Њ–Љ —А—Г—Б–ї–µ. –Т —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ –њ–µ—А–≤–Њ–Љ –Љ–µ—Б—В–µ —Б—В–Њ–Є—В –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–є —Б–Є–љ–і—А–Њ–Љ.
–Р–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–є —Б–Є–љ–і—А–Њ–Љ (–Р–§–°) – —Б–Є–Љ–њ—В–Њ–Љ–Њ–Ї–Њ–Љ–њ–ї–µ–Ї—Б, –≤–Ї–ї—О—З–∞—О—Й–Є–є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–µ —В—А–Њ–Љ–±–Њ–Ј—Л (–∞—А—В–µ—А–Є–∞–ї—М–љ—Л–є –Є/–Є–ї–Є –≤–µ–љ–Њ–Ј–љ—Л–є), –∞–Ї—Г—И–µ—А—Б–Ї—Г—О –њ–∞—В–Њ–ї–Њ–≥–Є—О (—З–∞—Й–µ —Б–Є–љ–і—А–Њ–Љ –њ–Њ—В–µ—А–Є –њ–ї–Њ–і–∞), –Є —Б–≤—П–Ј–∞–љ —Б —Б–Є–љ—В–µ–Ј–Њ–Љ –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л—Е –∞–љ—В–Є—В–µ–ї (–∞–§–Ы): –∞–љ—В–Є–Ї–∞—А–і–Є–Њ–ї–Є–њ–Є–љ–Њ–≤—Л—Е –∞–љ—В–Є—В–µ–ї (–∞–Ъ–Ы) –Є/–Є–ї–Є –≤–Њ–ї—З–∞–љ–Њ—З–љ–Њ–≥–Њ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞ (–Т–Р), –Є/–Є–ї–Є –∞–љ—В–Є—В–µ–ї –Ї b2––≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ—Г I (–∞–љ—В–Є–b2––У–Я I). –Р–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–є —Б–Є–љ–і—А–Њ–Љ (–Р–§–°) –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ—Л–Љ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–Љ («–≥–Є–њ–Њ–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Њ–љ–љ—Л–Љ») —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є—П–Љ, –Ї–Њ—В–Њ—А—Л–µ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Б–≤–µ—А—В—Л–≤–∞–љ–Є–µ–Љ –Ї—А–Њ–≤–Є [1,2,3].
–Т –ї–Є—В–µ—А–∞—В—Г—А–µ –Љ–Њ–ґ–љ–Њ –≤—Б—В—А–µ—В–Є—В—М –Є –і—А—Г–≥–Є–µ –љ–∞–Ј–≤–∞–љ–Є—П: —Н—В–Њ –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ–Њ–µ – –∞–љ—В–Є–Ї–∞—А–і–Є–Њ–ї–Є–њ–Є–љ–Њ–≤—Л–є —Б–Є–љ–і—А–Њ–Љ. –Т—Л—П–≤–ї–µ–љ–Є–µ –њ—А–Є —Н—В–Њ–Љ —Б–Є–Љ–њ—В–Њ–Љ–Њ–Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ –∞–љ—В–Є—В–µ–ї –Ї –њ–ї–∞–Ј–Љ–µ–љ–љ—Л–Љ –±–µ–ї–Ї–∞–Љ –Є–ї–Є —Д–∞–Ї—В–Њ—А–∞–Љ —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є –њ–Њ—Б–ї—Г–ґ–Є–ї–Њ –њ–Њ–≤–Њ–і–Њ–Љ –і–ї—П –њ—А–µ–і–ї–Њ–ґ–µ–љ–Є—П –µ—Й–µ –Њ–і–љ–Њ–≥–Њ –љ–∞–Ј–≤–∞–љ–Є—П – –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і/–Ї–Њ—Д–∞–Ї—В–Њ—А–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. –Т –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ –Р–§–° –Љ–Њ–ґ–љ–Њ –≤—Б—В—А–µ—В–Є—В—М –њ–Њ–і –љ–∞–Ј–≤–∞–љ–Є–µ–Љ «—Б–Є–љ–і—А–Њ–Љ–∞ —З–µ—А–љ–Њ–≥–Њ –ї–µ–±–µ–і—П» [4]. –Т 1994 –≥. –љ–∞ VI –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–Љ –°–Є–Љ–њ–Њ–Ј–Є—Г–Љ–µ –њ–Њ –∞–§–Ы –±—Л–ї–Њ –њ—А–µ–і–ї–Њ–ґ–µ–љ–Њ –љ–∞–Ј—Л–≤–∞—В—М –Р–§–° —Б–Є–љ–і—А–Њ–Љ–Њ–Љ Hughes, –њ–Њ –Є–Љ–µ–љ–Є –∞–љ–≥–ї–Є–є—Б–Ї–Њ–≥–Њ —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–∞, –≤–њ–µ—А–≤—Л–µ –Њ–њ–Є—Б–∞–≤—И–µ–≥–Њ —Н—В–Њ—В —Б–Є–љ–і—А–Њ–Љ –Є –≤–љ–µ—Б—И–µ–≥–Њ –љ–∞–Є–±–Њ–ї—М—И–Є–є –≤–Ї–ї–∞–і –≤ —А–∞–Ј—А–∞–±–Њ—В–Ї—Г —Н—В–Њ–є –њ—А–Њ–±–ї–µ–Љ—Л [3–6]. –Э–∞ –• –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–Љ –Ї–Њ–љ–≥—А–µ—Б—Б–µ –њ–Њ –∞–§–Ы Y. Shoenfeld –Є–Ј––Ј–∞ —З–∞—Б—В–Њ–≥–Њ –њ–Њ–ї–Є–Њ—А–≥–∞–љ–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ—А–Є –Р–§–° –њ—А–µ–і–ї–Њ–ґ–Є–ї –љ–∞–Ј—Л–≤–∞—В—М —Б–Є—Б—В–µ–Љ–љ—Л–Љ –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –њ–Њ –∞–љ–∞–ї–Њ–≥–Є–Є —Б —Б–Є—Б—В–µ–Љ–љ–Њ–є –Ї—А–∞—Б–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–Њ–є.
–Ф–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ –Ї—А–Є—В–µ—А–Є–Є –±—Л–ї–Є –њ—А–Є–љ—П—В—Л –≤ 1999 –≥. –≤ —П–њ–Њ–љ—Б–Ї–Њ–Љ –≥–Њ—А–Њ–і–µ –°–∞–њ–њ–Њ—А–Њ [6] –љ–∞ –Њ—З–µ—А–µ–і–љ–Њ–є –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є –Ї–Њ–љ—Д–µ—А–µ–љ—Ж–Є–Є –њ–Њ –∞–§–Ы –Є –Њ–±–љ–Њ–≤–ї–µ–љ—Л –≤ 2006 [3] (—В–∞–±–ї. 1).
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —А–∞–±–Њ—В, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –њ–∞—В–Њ–≥–µ–љ–µ–Ј—Г –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ –Р–§–°, –њ—Г–±–ї–Є–Ї–∞—Ж–Є–є –њ–Њ –њ—А–Њ–±–ї–µ–Љ–∞–Љ –ї–µ—З–µ–љ–Є—П —В—А–Њ–Љ–±–Њ–Ј–Њ–≤, –Є—Е –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –љ–µ —В–∞–Ї –Љ–љ–Њ–≥–Њ. –Х–і–Є–љ–Є—З–љ—Л –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б–њ—Л—В–∞–љ–Є—П, –љ–∞ –Ї–Њ—В–Њ—А—Л—Е –Њ—Б–љ–Њ–≤—Л–≤–∞–ї–Є—Б—М –±—Л —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ —А–µ—И–µ–љ–Є—П. –Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Є –ї–µ—З–µ–љ–Є–µ –њ–Њ–≤—В–Њ—А–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –њ—А–Є –Р–§–° –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–ї–Њ–ґ–љ—Г—О –њ—А–Њ–±–ї–µ–Љ—Г. –≠—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–Њ—Б—В—М—О –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤, –ї–µ–ґ–∞—Й–Є—Е –≤ –Њ—Б–љ–Њ–≤–µ –Р–§–°, –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–Њ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є, –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є—Е –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞—В—М —А–µ—Ж–Є–і–Є–≤—Л —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є. –Я—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤–Њ –Љ–љ–µ–љ–Є–µ –Є –њ–Њ –њ–Њ–≤–Њ–і—Г –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Р–§–°, –љ–Њ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –≤ –Ї—А–Њ–≤–Є –∞–§–Ы, –∞ —В–∞–Ї–ґ–µ –њ–Њ—Б–ї–µ –њ–µ—А–≤–Њ–≥–Њ —Н–њ–Є–Ј–Њ–і–∞ —В—А–Њ–Љ–±–Њ–Ј–∞ –Є–ї–Є –Њ–і–љ–Њ–≥–Њ —Б–ї—Г—З–∞—П –њ–Њ—В–µ—А–Є –њ–ї–Њ–і–∞. –Я—А–Є –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–Љ –Њ–њ—А–Њ—Б–µ –≤—А–∞—З–µ–є —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ—Б—В–µ–є –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є–Ј –љ–Є—Е —Б—З–Є—В–∞–ї–Є, —З—В–Њ –њ—А–Є –љ–∞–ї–Є—З–Є–Є —В–Њ–ї—М–Ї–Њ —Б–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–∞—А–Ї–µ—А–Њ–≤ –±–Њ–ї–µ–Ј–љ–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –њ–µ—А–≤–Є—З–љ—Л–Љ –Є –≤—В–Њ—А–Є—З–љ—Л–Љ –Р–§–° –љ–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ [7]. –†–Є—Б–Ї —А–µ—Ж–Є–і–Є–≤–∞ —В—А–Њ–Љ–±–Њ–Ј–∞ –Њ—Б–Њ–±–µ–љ–љ–Њ –≤—Л—Б–Њ–Ї –≤ —Б–ї–µ–і—Г—О—Й–Є—Е —Б–ї—Г—З–∞—П—Е:
• —Г –±–Њ–ї—М–љ—Л—Е –Љ–Њ–ї–Њ–і–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Б –њ–Њ—Б—В–Њ—П–љ–љ–Њ –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –∞–љ—В–Є–Ї–∞—А–і–Є–Њ–ї–Є–њ–Є–љ–Њ–≤—Л—Е –∞–љ—В–Є—В–µ–ї (–∞–Ъ–Ы) (b2––≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ I (b2––У–Я I)––Ј–∞–≤–Є—Б–Є–Љ–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –∞–љ—В–Є—В–µ–ї), –≤–Њ–ї—З–∞–љ–Њ—З–љ–Њ–≥–Њ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞ (–Т–Р) –Є–ї–Є –∞–љ—В–Є—В–µ–ї –Ї b2––У–Я I;
• –њ—А–Є –Њ–і–љ–Њ–Љ–Њ–Љ–µ–љ—В–љ–Њ–Љ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є–Є –∞–Ъ–Ы –Є –Т–Р;
• –њ—А–Є –љ–∞–ї–Є—З–Є–Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –Є/–Є–ї–Є –∞–Ї—Г—И–µ—А—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ;
• –њ—А–Є –љ–∞–ї–Є—З–Є–Є –і—А—Г–≥–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є (–∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–Њ–љ–Є—П, –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є—П, –Ї—Г—А–µ–љ–Є–µ, –њ—А–Є–µ–Љ –Њ—А–∞–ї—М–љ—Л—Е –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–Њ–≤), –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ (–њ—А–Є –°–Ъ–Т), –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Љ—Г—В–∞—Ж–Є–є —Д–∞–Ї—В–Њ—А–Њ–≤ —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є;
• –њ—А–Є –±—Л—Б—В—А–Њ–є –Њ—В–Љ–µ–љ–µ –љ–µ–њ—А—П–Љ—Л—Е –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤;
• –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є –≤—Л—Б–Њ–Ї–Є—Е —Г—А–Њ–≤–љ–µ–є –∞–§–Ы —Б –і—А—Г–≥–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Љ—Г—В–∞—Ж–Є–µ–є —Д–∞–Ї—В–Њ—А–∞ V —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є, –∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –Є –і–µ—Д–Є—Ж–Є—В–Њ–Љ –і—А—Г–≥–Є—Е –Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Њ–љ–љ—Л—Е –±–µ–ї–Ї–Њ–≤ (–∞–љ—В–Є—В—А–Њ–Љ–±–Є–љ III, –±–µ–ї–Њ–Ї –° –Є–ї–Є –±–µ–ї–Њ–Ї S), –≥–Є–њ–µ—А–≥–Њ–Љ–Њ—Ж–Є—Б—В–µ–Є–љ–µ–Љ–Є–Є.
–Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Г –±–Њ–ї—М–љ—Л—Е —Б –љ–∞–ї–Є—З–Є–µ–Љ –≤ –Ї—А–Њ–≤–Є –∞–§–Ы —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –≤—Л—Б–Њ–Ї. –Т –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Ј–і–Њ—А–Њ–≤—Л—Е –Љ—Г–ґ—З–Є–љ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ –∞–§–Ы––њ–Њ–Ј–Є—В–Є–≤–љ–Њ—Б—В—М –≤–µ–ї–∞ –Ї 5 –Ї—А–∞—В–љ–Њ–Љ—Г —Г–≤–µ–ї–Є—З–µ–љ–Є—О —А–Є—Б–Ї–∞ —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –Є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–Є –ї–µ–≥–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є (–Ґ–≠–Ы–Р) [1,8–10]. –Я–Њ–≤—Л—И–µ–љ–љ—Л–є —А–Є—Б–Ї —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–ї—Б—П –Є —Г –ґ–µ–љ—Й–Є–љ —Б –∞–§–Ы, —Г –Ї–Њ—В–Њ—А—Л—Е –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ –±—Л–ї–Є —В–Њ–ї—М–Ї–Њ –∞–Ї—Г—И–µ—А—Б–Ї–Є–µ –њ—А–Њ–±–ї–µ–Љ—Л (—З–Є—Б–ї–Њ —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 15,7 –љ–∞ 100 —З–µ–ї–Њ–≤–µ–Ї–Њ––ї–µ—В –Ј–∞ —Б—А–µ–і–љ–Є–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П 3 –≥–Њ–і–∞) [9]. –†–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞–±–ї—О–і–µ–љ–Є—П –≤ —В–µ—З–µ–љ–Є–µ 10 –ї–µ—В –Ј–∞ –±–Њ–ї—М–љ—Л–Љ–Є –°–Ъ–Т —Б –∞–§–Ы, –љ–Њ –±–µ–Ј —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Г –њ–Њ–ї–Њ–≤–Є–љ—Л —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е (52%) —А–∞–Ј–≤–Є–ї—Б—П –Р–§–° [10]. –Ґ–Њ—В —Д–∞–Ї—В, —З—В–Њ —Ж–Є—А–Ї—Г–ї—П—Ж–Є—П –∞–§–Ы –≤ –Ї—А–Њ–≤–Є —П–≤–ї—П–µ—В—Б—П —Б–µ—А—М–µ–Ј–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ–Ј–Њ–≤, –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ–Њ—Б–њ–Њ—А–Є–Љ. –°–ї–µ–і—Г–µ—В –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –µ—Й–µ –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –њ–Њ—Н—В–Њ–Љ—Г –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –њ—А–Є –Р–§–° –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Є—Б–Ї–ї—О—З–Є—В—М –Є–ї–Є —Б–љ–Є–Ј–Є—В—М –і—А—Г–≥–Є–µ –њ—А–Є—З–Є–љ—Л, –Њ—Б–ї–Њ–ґ–љ—П—О—Й–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ. –Т –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Н—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –Њ—В–Ї–∞–Ј–∞ –Њ—В –Ї—Г—А–µ–љ–Є—П, —Г –ґ–µ–љ—Й–Є–љ – –Є—Б–Ї–ї—О—З–µ–љ–Є–µ –њ—А–Є–µ–Љ–∞ —Н—Б—В—А–Њ–≥–µ–љ–—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –њ—А–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є – –њ–Њ–і–±–Њ—А –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –њ—А–Є –≤—В–Њ—А–Є—З–љ–Њ–Љ –Р–§–° – –Њ—Ж–µ–љ–Ї–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—А–Њ–њ—А–Є—П—В–Є—П, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –љ–∞ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Ш–љ—Д–µ–Ї—Ж–Є—П, –Ї–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, —П–≤–Є–ї–∞—Б—М –њ—А–Њ–≤–Њ—Ж–Є—А—Г—О—Й–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Ї–∞—В–∞—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–§–° (–Ъ–Р–§–°) –≤ 22–30% —Б–ї—Г—З–∞–µ–≤ [11,12]. –Р–ї–≥–Њ—А–Є—В–Љ –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є –Р–§–° –Є —Г—А–Њ–≤–µ–љ—М –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ—Б—В–Є —Н—В–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –њ—А–Є–≤–µ–і–µ–љ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1.
–Р–§–° –њ–Њ—А–∞–ґ–∞–µ—В —З–∞—Й–µ –ґ–µ–љ—Й–Є–љ –Љ–Њ–ї–Њ–і–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞. –°—А–µ–і–Є –њ—А–Є—З–Є–љ –љ–µ–≤—Л–љ–∞—И–Є–≤–∞–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –∞–§–Ы –Ј–∞–љ–Є–Љ–∞—О—В –Њ–і–љ–Њ –Є–Ј –Ј–љ–∞—З–Є–Љ—Л—Е –Љ–µ—Б—В. 25% –ґ–µ–љ—Й–Є–љ —Б —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –њ–Њ—В–µ—А–Є –њ–ї–Њ–і–∞ –Є–Љ–µ—О—В –Р–§–°, –Є –±–Њ–ї–µ–µ —З–µ–Љ —Г –њ–Њ–ї–Њ–≤–Є–љ—Л –Є–Ј –љ–Є—Е –і–µ–±—О—В –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–∞—З–Є–љ–∞–µ—В—Б—П —Б –њ–Њ—В–µ—А–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є [13,14,15].
–Э–∞ —Б–µ–≥–Њ–і–љ—П —Б—В–∞–љ–і–∞—А—В–Њ–Љ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є—Е –њ–Њ—В–µ—А—М –њ–ї–Њ–і–∞ —П–≤–ї—П—О—В—Б—П –Љ–∞–ї—Л–µ –і–Њ–Ј—Л –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–Р–°–Ъ) (50–100 –Љ–≥), –љ–∞—З–Є–љ–∞—П —Б–Њ –≤—А–µ–Љ–µ–љ–Є –і–Њ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Є –њ—А–Њ–і–Њ–ї–ґ–∞—П –і–Њ —А–Њ–ґ–і–µ–љ–Є—П —А–µ–±–µ–љ–Ї–∞, –Є –≤ –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤–Њ–Љ –њ–µ—А–Є–Њ–і–µ. –С–Њ–ї—М–љ—Л–Љ —Б –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –∞–§–Ы –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ, –љ–Њ –±–µ–Ј –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Р–§–° (–≤ —В–Њ–Љ —З–Є—Б–ї–µ —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –ґ–µ–љ—Й–Є–љ –±–µ–Ј –∞–Ї—Г—И–µ—А—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ) —Б–ї–µ–і—Г–µ—В –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—В—М—Б—П –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –љ–µ–±–Њ–ї—М—И–Є—Е –і–Њ–Ј –Р–°–Ъ (75–100 –Љ–≥/—Б—Г—В.) [15,16]. –Ю–і–љ–∞–Ї–Њ —Н—В–Є –±–Њ–ї—М–љ—Л–µ —В—А–µ–±—Г—О—В —В—Й–∞—В–µ–ї—М–љ–Њ–≥–Њ –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П, —В–∞–Ї –Ї–∞–Ї —А–Є—Б–Ї —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –љ–Є—Е –≤–µ—Б—М–Љ–∞ –≤—Л—Б–Њ–Ї. –†–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Г –∞–§–Ы––њ–Њ–Ј–Є—В–Є–≤–љ—Л—Е –±–Њ–ї—М–љ—Л—Е –њ—А–Є–≤–µ–і–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 2.
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ—А–Є–µ–Љ–∞ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј –Р–°–Ъ —Б —Ж–µ–ї—М—О –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Г –∞–§–Ы––њ–Њ–Ј–Є—В–Є–≤–љ—Л—Е –±–Њ–ї—М–љ—Л—Е –±–µ–Ј –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Р–§–°, —Н—В–∞ —В–µ—А–∞–њ–Є—П, –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –љ–∞—И–µ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–∞ –њ—А–Є –≤—Л—Б–Њ–Ї–Њ–њ–Њ–Ј–Є—В–Є–≤–љ—Л—Е —Г—А–Њ–≤–љ—П—Е –∞–Ъ–Ы. –Р–љ—В–Є–Љ–∞–ї—П—А–Є–є–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (–Р–Я), –Ї–Њ—В–Њ—А—Л–µ —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –і–ї—П –ї–µ—З–µ–љ–Є—П –°–Ъ–Т –Є –і—А—Г–≥–Є—Е –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –љ–∞—А—П–і—Г —Б –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –Њ–±–ї–∞–і–∞—О—В –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–є (–њ–Њ–і–∞–≤–ї—П—О—В –∞–≥—А–µ–≥–∞—Ж–Є—О –Є –∞–і–≥–µ–Ј–Є—О —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, —Г–Љ–µ–љ—М—И–∞—О—В —А–∞–Ј–Љ–µ—А —В—А–Њ–Љ–±–∞) –Є –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О. –Ш–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ —Б–љ–Є–ґ–µ–љ–Є–Є —З–∞—Б—В–Њ—В—Л —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –±–Њ–ї—М–љ—Л—Е –Р–§–°, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –≥–Є–і—А–Њ–Ї—Б–Є—Е–ї–Њ—А–Њ—Е–Є–љ (–У–•) [17,18]. –Р–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –У–• –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –њ—А–Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–Љ –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–Є —В—А–Њ–Љ–±–Њ–Ј–∞ —Г –Љ—Л—И–µ–є, –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є–µ–Љ –∞–§–Ы —З–µ–ї–Њ–≤–µ–Ї–∞ [19]. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —Е–Њ—А–Њ—И–Є–є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–є –њ—А–µ–њ–∞—А–∞—В –Њ–±–ї–∞–і–∞–µ—В –Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –£—А–Њ–≤–µ–љ—М –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ (–Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–∞ 10 –Є —Д–∞–Ї—В–Њ—А–∞ –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є) —Г –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –њ–ї–∞–Ї–≤–µ–љ–Є–ї 3 –Љ–µ—Б—П—Ж–∞ –Є –±–Њ–ї–µ–µ, –±—Л–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–Є–ґ–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–Њ–є.
–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –і–µ—Б—П—В–Є–ї–µ—В–Є–µ —Б—В–∞–ї –∞–Ї—В–Є–≤–љ–Њ –Њ–±—Б—Г–ґ–і–∞—В—М—Б—П –≤–Њ–њ—А–Њ—Б –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Є–µ–Љ–∞ –Р–Я –њ—А–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –У–• –њ—А–Њ–љ–Є–Ї–∞–µ—В —З–µ—А–µ–Ј –њ–ї–∞—Ж–µ–љ—В–∞—А–љ—Л–є –Ї—А–Њ–≤–Њ—В–Њ–Ї. –Ш–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –і–ї—П –Ї–Њ–љ—В—А–Њ–ї—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –°–Ъ–Т –Є –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –ґ–µ–љ—Й–Є–љ [19,20]. –Ю–і–љ–Њ –Є–Ј –љ–Є—Е –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –≤ –Ъ–∞–љ–∞–і–µ. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Њ—И–ї–Є –і–µ—В–Є (n=21), –Љ–∞—В–µ—А–Є –Ї–Њ—В–Њ—А—Л—Е —Б—В—А–∞–і–∞–ї–Є —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –Є –≤ –њ–µ—А–Є–Њ–і —Б 1991 –њ–Њ 2000 –≥–≥. –њ—А–Є–љ–Є–Љ–∞–ї–Є –У–• –Є —Е–ї–Њ—А–Њ—Е–Є–љ –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –°—А–µ–і–љ–Є–µ –і–Њ–Ј—Л –њ–ї–∞–Ї–≤–µ–љ–Є–ї–∞ –Є —Е–ї–Њ—А–Њ—Е–Є–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–ї–Є 317 –Љ–≥/—Б—Г—В. –Є 332 –Љ–≥/—Б—Г—В. —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–Є–µ–Љ–∞ –≤–Њ –≤—А–µ–Љ—П –≥–µ—Б—В–∞—Ж–Є–Є – 7,2±2,9 –Љ–µ—Б. –Я—А–Є–Ј–љ–∞–Ї–Њ–≤ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –љ–Є —Г –Ї–Њ–≥–Њ –Є–Ј –і–µ—В–µ–є –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ, —З–∞—Б—В–Њ—В–∞ –≤—А–Њ–ґ–і–µ–љ–љ—Л—Е –∞–љ–Њ–Љ–∞–ї–Є–є –≤ –і–∞–љ–љ–Њ–є –Ї–Њ–≥–Њ—А—В–µ –љ–µ –њ—А–µ–≤—Л—И–∞–ї–∞ —В–∞–Ї–Њ–≤—Г—О –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є [19].
–Т—В–Њ—А–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ [20] –≤–Ї–ї—О—З–∞–ї–Њ 35 –і–µ—В–µ–є –Њ—В 34 –ґ–µ–љ—Й–Є–љ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –і–Є–∞–≥–љ–Њ–Ј–∞–Љ–Є (–°–Ъ–Т – 19, —Б–Є—Б—В–µ–Љ–љ–Њ–є —Б–Ї–ї–µ—А–Њ–і–µ—А–Љ–Є–µ–є – 3, –љ–µ–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є – 2, —Б–Љ–µ—И–∞–љ–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є – 4, –і–µ—А–Љ–∞—В–Њ–Љ–Є–Њ–Ј–Є—В–Њ–Љ – 1, –њ–µ—А–≤–Є—З–љ—Л–Љ –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ – 4, —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–Љ –∞—А—В—А–Є—В–Њ–Љ – 1). –Ц–µ–љ—Й–Є–љ—Л –њ–Њ–ї—Г—З–∞–ї–Є –У–• –≤ –і–Њ–Ј–µ 200 –Љ–≥/—Б—Г—В. –љ–µ –Љ–µ–љ–µ–µ –Њ–і–љ–Њ–≥–Њ –≥–Њ–і–∞ –і–Њ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Є –≤—Б—О –≥–µ—Б—В–∞—Ж–Є—О. –Я—П—В—М –і–µ—В–µ–є (11%) –±—Л–ї–Є –љ–µ–і–Њ–љ–Њ—И–µ–љ–љ—Л–Љ–Є (—А–Њ–і—Л –љ–∞ —Б—А–Њ–Ї–µ 33–36 –љ–µ–і–µ–ї—М). –У—А—Г–і–љ–Њ–µ –≤—Б–Ї–∞—А–Љ–ї–Є–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ 8 —Б–ї—Г—З–∞—П—Е –і–Њ 3–6 –Љ–µ—Б—П—Ж–µ–≤. –£ 3 –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –∞–љ–∞–ї–Є–Ј–∞—Е –њ—А–Є –Њ—Ж–µ–љ–Ї–µ —Д—Г–љ–Ї—Ж–Є–Є –њ–µ—З–µ–љ–Є –Є –њ–Њ—З–µ–Ї, –Њ–і–љ–∞–Ї–Њ –Ї 1 –≥–Њ–і—Г –ґ–Є–Ј–љ–Є –і–∞–љ–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –Є—Б—З–µ–Ј–ї–Є. –Я—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є 16 –і–µ—В–µ–є —Б—А–∞–Ј—Г –њ–Њ—Б–ї–µ —А–Њ–ґ–і–µ–љ–Є—П, —З–µ—А–µ–Ј 6 –Љ–µ—Б—П—Ж–µ–≤ –Є —З–µ—А–µ–Ј –≥–Њ–і –Ї–∞–Ї–Є—Е––ї–Є–±–Њ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —В–µ—А–∞–њ–Є–Є –У–• —Г –Љ–∞—В–µ—А–Є –љ–∞–є–і–µ–љ–Њ –љ–µ –±—Л–ї–Њ [20].
–С–Њ–ї–µ–µ —В–Њ–≥–Њ, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –У–• –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –њ–Њ –Љ–љ–µ–љ–Є—О –љ–µ–Ї–Њ—В–Њ—А—Л—Е –∞–≤—В–Њ—А–Њ–≤, –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј–∞—В—М—Б—П –њ–Њ–ї–µ–Ј–љ—Л–Љ. –Ґ–∞–Ї, R.A. Levy –Є —Б–Њ–∞–≤—В. [21] –≤ 2001 –≥. —Б–Њ–Њ–±—Й–Є–ї–Є –Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤ –Ї–Њ—В–Њ—А–Њ–µ –≤–Њ—И–ї–Є 20 –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –°–Ъ–Т –Є –і–Є—Б–Ї–Њ–Є–і–љ–Њ–є –Ї—А–∞—Б–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–Њ–є. –С–Њ–ї—М–љ—Л–µ –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 2 –≥—А—Г–њ–њ—Л: –њ–Њ–ї–Њ–≤–Є–љ–∞ –њ–Њ–ї—Г—З–∞–ї–∞ –У–•, –∞ –Њ—Б—В–∞–≤—И–Є–µ—Б—П 10 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї – –њ–ї–∞—Ж–µ–±–Њ. –Т –љ–∞—З–∞–ї–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≥—А—Г–њ–њ—Л –±—Л–ї–Є —Б—Е–Њ–і–љ—Л –њ–Њ –Њ—Б–љ–Њ–≤–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ –Є —В–µ—А–∞–њ–Є–Є, –∞ –≤ –Ї–Њ–љ—Ж–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –°–Ъ–Т (–≤ –±–∞–ї–ї–∞—Е –њ–Њ —И–Ї–∞–ї–µ SLEDAI, –Љ–Њ–і–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –і–ї—П –±–µ—А–µ–Љ–µ–љ–љ—Л—Е) –±—Л–ї–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ, —В–∞–Ї–ґ–µ –Ї–∞–Ї –Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–∞—П –і–Њ–Ј–∞ –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞. –С—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ —В–Њ–ї—М–Ї–Њ –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ —А–∞–Ј–≤–Є–≤–∞–ї–Є—Б—М –≥–µ—Б—В–Њ–Ј—Л, –≤ –Њ–і–љ–Њ–Љ —Б–ї—Г—З–∞–µ –Є–Ј 20–—В–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М –Ј–∞–Ї–Њ–љ—З–Є–ї–∞—Б—М —Б–Љ–µ—А—В—М—О –њ–ї–Њ–і–∞. –°—А–Њ–Ї —А–Њ–і–Њ—А–∞–Ј—А–µ—И–µ–љ–Є—П –Є –Њ—Ж–µ–љ–Ї–∞ –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ –њ–Њ —И–Ї–∞–ї–µ –Р–њ–≥–∞—А –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –±–Њ–ї—М—И–µ –≤ –≥—А—Г–њ–њ–µ —Б —В–µ—А–∞–њ–Є–µ–є –У–•. –Э–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л–µ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –љ–µ –Є–Љ–µ–ї–Є –≤—А–Њ–ґ–і–µ–љ–љ—Л—Е –∞–љ–Њ–Љ–∞–ї–Є–є. –Э–µ–є—А–Њ––Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б–ї—Г—Е–∞ —Н—В–Є—Е –і–µ—В–µ–є –≤ –±–Њ–ї–µ–µ –њ–Њ–Ј–і–љ–µ–Љ –≤–Њ–Ј—А–∞—Б—В–µ (1,5–3,0 –≥–Њ–і–∞) —В–∞–Ї–ґ–µ –љ–µ –≤—Л—П–≤–Є–ї–Є –Ї–∞–Ї–Є—Е––ї–Є–±–Њ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–є –Њ—В –љ–Њ—А–Љ—Л.
–Х—Й–µ –Њ–і–љ–∞ —А–∞–±–Њ—В–∞, –Ї–∞—Б–∞—О—Й–∞—П—Б—П –≤–ї–Є—П–љ–Є—П –У–• –љ–∞ –Є—Б—Е–Њ–і—Л –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –њ—А–Є –°–Ъ–Т, –±—Л–ї–∞ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–∞ –≤ 2006 –≥. Clowse M.E. –Є —Б–Њ–∞–≤—В. [22] –њ—А–Є–≤–µ–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –±–µ—А–µ–Љ–µ–љ–љ—Л–µ, –њ–Њ—Б—В—Г–њ–Є–≤—И–Є–µ –≤ –Ї–ї–Є–љ–Є–Ї—Г –Љ–µ–ґ–і—Г 1987 –Є 2002 –≥–≥., –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 3 –≥—А—Г–њ–њ—Л: 1–—П –≥—А—Г–њ–њ–∞ –≤–Ї–ї—О—З–∞–ї–∞ 163 –ґ–µ–љ—Й–Є–љ, –љ–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –У–• –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, 2–—П – 56 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, –њ—А–Њ–і–Њ–ї–ґ–Є–≤—И–Є—Е –њ—А–Є–µ–Љ –У–•, 3–—П – 38 –±–Њ–ї—М–љ—Л—Е, –њ—А–µ–Ї—А–∞—В–Є–≤—И–Є—Е –њ—А–Є–µ–Љ –У–• –љ–µ —А–∞–љ–µ–µ, —З–µ–Љ –Ј–∞ 3 –Љ–µ—Б—П—Ж–∞ –і–Њ –Ј–∞—З–∞—В–Є—П –Є–ї–Є –≤ –њ–µ—А–≤–Њ–Љ —В—А–Є–Љ–µ—Б—В—А–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –І–∞—Б—В–Њ—В–∞ –≤—Л–Ї–Є–і—Л—И–µ–є, –њ–Њ—В–µ—А—М –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –Љ–µ—А—В–≤–Њ—А–Њ–ґ–і–µ–љ–Є–Є –Є –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–∞—Б—М –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є. –°—В–µ–њ–µ–љ—М –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –°–Ъ–Т (–њ–Њ –≤–Є–Ј—Г–∞–ї—М–љ–Њ–є –∞–љ–∞–ї–Њ–≥–Њ–≤–Њ–є —И–Ї–∞–ї–µ –Є –њ–Њ —И–Ї–∞–ї–µ SLEDAI) –Є —З–∞—Б—В–Њ—В–∞ –Њ–±–Њ—Б—В—А–µ–љ–Є–є –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –±—Л–ї–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ —Г –±–Њ–ї—М–љ—Л—Е, –њ—А–µ–Ї—А–∞—В–Є–≤—И–Є—Е –њ—А–Є–µ–Љ –У–•, —Е–Њ—В—П —Б–µ—А—М–µ–Ј–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П, —В–∞–Ї–Є–µ –Ї–∞–Ї –њ—А–Њ—В–µ–Є–љ—Г—А–Є—П –Є–ї–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П, –≤—Б—В—А–µ—З–∞–ї–Є—Б—М —Б –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М—О –≤–Њ –≤—Б–µ—Е –≥—А—Г–њ–њ–∞—Е. –Ц–µ–љ—Й–Є–љ–∞–Љ, –њ—А–Њ–і–Њ–ї–ґ–∞–≤—И–Є–Љ –њ—А–Є–µ–Љ –У–•, –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є —В—А–µ–±–Њ–≤–∞–ї–Є—Б—М –Љ–µ–љ—М—И–Є–µ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–Є–µ –і–Њ–Ј—Л –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞. –Т—Б–µ —Н—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –∞–≤—В–Њ—А–∞–Љ –њ—А–Є–є—В–Є –Ї –≤—Л–≤–Њ–і—Г –Њ –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –њ—А–µ—А—Л–≤–∞–љ–Є—П –ї–µ—З–µ–љ–Є—П –У–• –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є.
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —Б—В–Њ–ї—М —Е–Њ—А–Њ—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л, –≤ –†–Њ—Б—Б–Є–Є –У–• –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –°–Ъ–Т –Є —Б –Р–§–° –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, —В–∞–Ї –Ї–∞–Ї –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ —Н—В–Њ—В –њ–µ—А–Є–Њ–і –і–Њ —Б–Є—Е –њ–Њ—А –Њ—Д–Є—Ж–Є–∞–ї—М–љ–Њ –љ–µ —А–∞–Ј—А–µ—И–µ–љ–Њ.
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤–∞—А—Д–∞—А–Є–љ–∞ –Є –і—А—Г–≥–Є—Е –љ–µ–њ—А—П–Љ—Л—Е –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ —А–∞–љ–љ–Є–µ —Б—А–Њ–Ї–Є, –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Њ, —В–∞–Ї –Ї–∞–Ї —Н—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –≤–∞—А—Д–∞—А–Є–љ–Њ–≤–Њ–є —Н–Љ–±—А–Є–Њ–њ–∞—В–Є–Є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–µ–є—Б—П –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —А–Њ—Б—В–∞ —Н–њ–Є—Д–Є–Ј–Њ–≤ –Є –≥–Є–њ–Њ–њ–ї–∞–Ј–Є–µ–є –љ–Њ—Б–Њ–є –њ–µ—А–µ–≥–Њ—А–Њ–і–Ї–Є, –∞ —В–∞–Ї–ґ–µ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є. –†–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤–µ–ї–Є–Ї –љ–µ —В–Њ–ї—М–Ї–Њ –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –љ–Њ –Є –≤ –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤–Њ–Љ –њ–µ—А–Є–Њ–і–µ. –Я—А–Є —А–Њ–і–Њ—А–∞–Ј—А–µ—И–µ–љ–Є–Є –Ї–µ—Б–∞—А–µ–≤—Л–Љ —Б–µ—З–µ–љ–Є–µ–Љ –≤–≤–µ–і–µ–љ–Є–µ –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –≥–µ–њ–∞—А–Є–љ–Њ–≤ –Њ—В–Љ–µ–љ—П–µ—В—Б—П –Ј–∞ 2–3 –і–љ—П –Є –≤–Њ–Ј–Њ–±–љ–Њ–≤–ї—П–µ—В—Б—П –≤ –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤–Њ–Љ –њ–µ—А–Є–Њ–і–µ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –њ–µ—А–µ—Е–Њ–і–Њ–Љ –љ–∞ –њ—А–Є–µ–Љ –љ–µ–њ—А—П–Љ—Л—Е –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤. –Я—А–Є —А–Њ–і–Њ—А–∞–Ј—А–µ—И–µ–љ–Є–Є –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–Љ –њ—Г—В–µ–Љ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –≤–Њ–Ј–Њ–±–љ–Њ–≤–ї–µ–љ–Є–µ –ї–µ—З–µ–љ–Є—П –Э–Ь–У –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤–Њ–Љ –њ–µ—А–Є–Њ–і–µ.
–Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —В–µ—А–∞–њ–Є—П –Њ—Б—В—А—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –њ—А–Є –Р–§–° – —Н—В–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤: –Њ–±—Л—З–љ–Њ–≥–Њ –≥–µ–њ–∞—А–Є–љ–∞ –Є–ї–Є –Э–Ь–У –≤ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Є–ї–Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –≤–∞—А—Д–∞—А–Є–љ–Њ–Љ —З–µ—А–µ–Ј 4–8 –і–љ–µ–є. –У–µ–њ–∞—А–Є–љ—Л –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –≤–∞—А—Д–∞—А–Є–љ–Њ–Љ –Њ—В–Љ–µ–љ—П—О—В—Б—П –њ—А–Є –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є –Ь–Э–Ю 2,0, —В.–µ. —З–µ—А–µ–Ј 3–4 –і–љ—П –њ–Њ—Б–ї–µ —Б–Њ—З–µ—В–∞–љ–љ–Њ–≥–Њ –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П. –£—Б–њ–µ—И–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –≤–Љ–µ—Б—В–µ —Б –њ—А—П–Љ—Л–Љ–Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞–Љ–Є –њ—А–Є –Њ—Б—В—А—Л—Е —В—А–Њ–Љ–±–Њ–Ј–∞—Е –Є —Д–Є–±—А–Є–љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П –≤ —А–∞–љ–љ–Є–µ —Б—А–Њ–Ї–Є —В—А–Њ–Љ–±–Њ–Ј–∞.
–Р–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л – –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –і–ї—П –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤. –Ю–љ–Є –і–µ–ї—П—В—Б—П –љ–∞ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л –њ—А—П–Љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П, –Ї–Њ—В–Њ—А—Л–µ —В–Њ—А–Љ–Њ–Ј—П—В –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Д–∞–Ї—В–Њ—А–Њ–≤ —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є, –Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л –љ–µ–њ—А—П–Љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П, —В–Њ—А–Љ–Њ–Ј—П—Й–Є–µ —Б–Є–љ—В–µ–Ј —Н—В–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –≤ –њ–µ—З–µ–љ–Є. –Т —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –њ—А—П–Љ—Л–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л –њ–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Г –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —В—А–Љ–Њ–±–Є–љ–∞ –і–µ–ї—П—В—Б—П –љ–∞ –њ—А—П–Љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л —В—А–Њ–Љ–±–Є–љ–∞ (–≥–Є—А—Г–і–Є–љ –Є –і—А.), –Є –љ–µ–њ—А—П–Љ—Л–µ, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –њ—Г—В–µ–Љ –љ–µ–њ—А—П–Љ–Њ–≥–Њ —Г–≥–љ–µ—В–µ–љ–Є—П —В—А–Њ–Љ–±–Є–љ–∞, –Ї –Ї–Њ—В–Њ—А—Л–Љ –Њ—В–љ–Њ—Б—П—В—Б—П –≥–µ–њ–∞—А–Є–љ—Л. –У–µ–њ–∞—А–Є–љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –≥–ї–Є–Ї–Њ–Ј–∞–Љ–Є–љ–Њ–≥–ї–Є–Ї–∞–љ, —Б–Њ—Б—В–Њ—П—Й–Є–є –Є–Ј –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ –Ј–∞—А—П–ґ–µ–љ–љ—Л—Е –Љ—Г–Ї–Њ–њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і–Њ–≤ [23–25]. –Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –≥–µ–њ–∞—А–Є–љ–∞ –Њ—Б–љ–Њ–≤–∞–љ –љ–∞ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Б–≤—П–Ј—Л–≤–∞—В—М –∞–љ—В–Є—В—А–Њ–Љ–±–Є–љ III (–Р–Ґ), —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —В–Њ—А–Љ–Њ–ґ–µ–љ–Є—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —В—А–Њ–Љ–±–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є –Ї–∞—В–∞–ї–Є–Ј–Є—А—Г–µ—В –њ—А–µ–≤—А–∞—Й–µ–љ–Є–µ —Д–Є–±—А–Є–љ–Њ–≥–µ–љ–∞ –≤ —Д–Є–±—А–Є–љ. –Я—А–Є –≤—Л—Б–Њ–Ї–Њ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–Є –≤ –Ї—А–Њ–≤–Є –≥–µ–њ–∞—А–Є–љ–∞, –њ–Њ—Б–ї–µ–і–љ–Є–є –љ–µ–є—В—А–∞–ї–Є–Ј—Г–µ—В —В—А–Њ–Љ–±–Є–љ —З–µ—А–µ–Ј «–Ї–Њ—Д–∞–Ї—В–Њ—А –≥–µ–њ–∞—А–Є–љ–∞ II». –Ъ–Њ–Љ–њ–ї–µ–Ї—Б –≥–µ–њ–∞—А–Є–љ––Р–Ґ —Г–≥–љ–µ—В–∞–µ—В –і—А—Г–≥–Є–µ —Д–∞–Ї—В–Њ—А—Л —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П IXa, Xa, XIa, XIIa. –§–∞—А–Љ–Њ–Ї–Є–љ–µ—В–∞–Ї–∞ –≥–µ–њ–∞—А–Є–љ–Њ–≤ –Ј–∞–≤–Є—Б–Є—В –Њ—В –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–≥–Њ –≤–µ—Б–∞, —Б–њ–Њ—Б–Њ–±–∞ –≤–≤–µ–і–µ–љ–Є—П –Є –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞. –Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –Њ—В–Ї—А—Л—В–∞ –µ—Й–µ –Њ–і–љ–∞ —Д—Г–љ–Ї—Ж–Є—П –≥–µ–њ–∞—А–Є–љ–Њ–≤ – –њ—А–Є —Д–Є–Ї—Б–∞—Ж–Є–Є –љ–∞ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞—В—М –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –≤ –Ї—А–Њ–≤—М –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –≤–љ–µ—И–љ–µ–≥–Њ –њ—Г—В–Є —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П, –Ј–∞–њ—Г—Б–Ї–∞–µ–Љ–Њ–≥–Њ —В–Ї–∞–љ–µ–≤—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ (TFPI), –Ї–Њ—В–Њ—А—Л–є, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –±–ї–Њ–Ї–Є—А—Г–µ—В –њ—А–Њ—В—А–Њ–Љ–±–Є–љ–∞–Ј–љ—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б. –У–µ–њ–∞—А–Є–љ –љ–∞–Љ–љ–Њ–≥–Њ —Б–ї–∞–±–µ–µ –±–ї–Њ–Ї–Є—А—Г–µ—В —В—А–Њ–Љ–±–Є–љ –Є —Д–∞–Ї—В–Њ—А –•–∞, –µ—Б–ї–Є –њ–Њ—Б–ї–µ–і–љ–Є–µ —Б–≤—П–Ј–∞–љ—Л —Б —Д–Є–±—А–Є–љ–Њ–Љ (—В—А–Њ–Љ–±–Њ–Љ). –≠—В–Є–Љ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –±–Њ–ї—М—И–µ–є –і–Њ–Ј—Л –≥–µ–њ–∞—А–Є–љ–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П —В—А–Њ–Љ–±–Њ–Ј–Њ–≤, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і–Њ–Ј–Њ–є, –њ—А–Є–Љ–µ–љ—П–µ–Љ–Њ–є –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є. –Я—А–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –≥–µ–њ–∞—А–Є–љ–∞ –±–Њ–ї—М—И–∞—П –µ–≥–Њ —З–∞—Б—В—М —Б–≤—П–Ј—Л–≤–∞–µ—В—Б—П –≤ –Ї—А–Њ–≤–Є –Ї—А—Г–њ–љ–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–Љ–Є –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Љ–Є – —Д–Є–±—А–Є–љ–Њ–≥–µ–љ–Њ–Љ, —Д–Є–±—А–Њ–љ–µ–Ї—В–Є–љ–Њ–Љ –Є –і—А. (–≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Њ—Б—В—А–Њ—Д–∞–Ј–Њ–≤—Л–Љ–Є –±–µ–ї–Ї–∞–Љ–Є). –Я–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Н—В–Є—Е –±–µ–ї–Ї–Њ–≤ –њ—А–Є —А—П–і–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Њ—Б–ї–∞–±–ї—П–µ—В –і–µ–є—Б—В–≤–Є–µ –≥–µ–њ–∞—А–Є–љ–∞. –Ю—Б–ї–∞–±–ї–µ–љ–Є–µ –і–µ–є—Б—В–≤–Є—П –≥–µ–њ–∞—А–Є–љ–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Є –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є —Г—А–Њ–≤–љ—П –Р–Ґ –њ—А–Є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–Љ –µ–≥–Њ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–Є –і–ї—П –Є–љ–∞–Ї—В–Є–≤–∞—Ж–Є–Є —Д–∞–Ї—В–Њ—А–Њ–≤ —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П. –≠—В–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –≥–µ–њ–∞—А–Є–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –љ–µ—Д—А–Њ—В–Є—З–µ—Б–Ї–Є–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –Є –і—А—Г–≥–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є—Е—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Р–Ґ –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Њ—Б—В—А–Њ—Д–∞–Ј–Њ–≤—Л—Е –±–µ–ї–Ї–Њ–≤. –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –≥–µ–њ–∞—А–Є–љ–∞ –Є–Ј–Љ–µ—А—П–µ—В—Б—П –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ–Њ–µ —З–∞—Б—В–Є—З–љ–Њ–µ —В—А–Њ–Љ–±–Њ–њ–ї–∞—Б—В–Є–љ–Њ–≤–Њ–µ –≤—А–µ–Љ—П (–Р–І–Ґ–Т). –£–і–ї–Є–љ–µ–љ–Є–µ –Р–І–Ґ–Т –≤ 1,5–2,5 —А–∞–Ј–∞ –њ—А–Є –≤–≤–µ–і–µ–љ–Є–Є –≥–µ–њ–∞—А–Є–љ–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ —В–Њ—А–Љ–Њ–Ј–Є—В —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ —В—А–Њ–Љ–±–∞ [25].
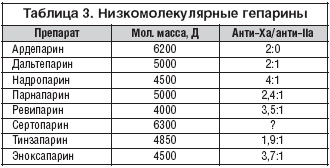
–Т 70––µ –≥–Њ–і—Л XX –≤–µ–Ї–∞ –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –њ—А–Є –і–µ–њ–Њ–ї–Є–Љ–µ—А–Є–Ј–∞—Ж–Є–Є –≥–µ–њ–∞—А–Є–љ–∞ –≥–µ–њ–∞—А–Є–љ–∞–Ј–Њ–є —Б–љ–Є–ґ–∞–µ—В—Б—П –µ–≥–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Г–і–ї–Є–љ—П—В—М –Р–І–Ґ–Т, –љ–Њ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Є–љ–∞–Ї—В–Є–≤–Є—А–Њ–≤–∞—В—М —Д–∞–Ї—В–Њ—А –•–∞. –Ю–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б—Л –≥–µ–њ–∞—А–Є–љ–∞ –≤–µ–ї–Њ –Ї —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –ї–Є—И—М –Є–љ–∞–Ї—В–Є–≤–Є—А–Њ–≤–∞—В—М —Д–∞–Ї—В–Њ—А –•–∞. –Э–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –≥–µ–њ–∞—А–Є–љ—Л (–Э–Ь–У) – –љ–Њ–≤—Л–є –Ї–ї–∞—Б—Б –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤. –°–µ–≥–Њ–і–љ—П –Ј–∞–Љ–µ–љ—П—О—В –љ–µ—Д—А–∞–Ї—Ж–Є–Њ–љ–љ—Л–є –≥–µ–њ–∞—А–Є–љ (–Э–У) –њ—А–Є –ї–µ—З–µ–љ–Є–Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤, –∞ —В–∞–Ї–ґ–µ –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е, —В—А–µ–±—Г—О—Й–Є—Е –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤. –•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –Э–Ь–У –њ—А–Є–≤–µ–і–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 3. –Ъ–∞–Ї –Є –≥–µ–њ–∞—А–Є–љ, –Э–Ь–У —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –њ–Њ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б–µ –Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є. –≠—В–Њ—В –Ї–ї–∞—Б—Б –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥–µ–њ–∞—А–Є–љ–Њ–Љ –Є–Љ–µ–µ—В –Њ—В–ї–Є—З–Є—В–µ–ї—М–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ – –Ј–∞ —Б—З–µ—В –Є–Ј–Љ–µ–љ–µ–љ–Є—П —А–∞–Ј–Љ–µ—А–∞ –Љ–Њ–ї–µ–Ї—Г–ї—Л –Є —Б—В–µ–њ–µ–љ–Є —Б–≤—П–Ј—Л–≤–∞–љ–Є—П —Б –±–µ–ї–Ї–∞–Љ–Є –Є –Ї–ї–µ—В–Ї–∞–Љ–Є –Ї—А–Њ–≤–Є [23,25].
–°–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –∞–љ—В–Є––•–∞/–∞–љ—В–Є–IIa —Г –Њ–±—Л—З–љ–Њ–≥–Њ –≥–µ–њ–∞—А–Є–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 1:1, —Г –Э–Ь–У –Ј–∞–≤–Є—Б–Є—В –Њ—В –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є—П –≤ –љ–Є—Е —Ж–µ–њ–µ–є —Б –љ–Є–Ј–Ї–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б–Њ–є –Љ–µ–љ—М—И–µ 5400 –і–∞–ї—М—В–Њ–љ. –≠—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –Њ—В 2:1 (—Г –і–∞–ї—М—В–µ–њ–∞—А–Є–љ–∞, —В–Є–љ–Ј–∞–њ–∞—А–Є–љ–∞) –і–Њ 3:1 —Г —Н–љ–Њ–Ї—Б–Є–њ–∞—А–Є–љ–∞ –Є 4:1 —Г –љ–∞–і—А–Њ–њ–∞—А–Є–љ–∞. –Ю—В –Њ—В–љ–Њ—И–µ–љ–Є—П –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –Ї –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–Љ—Г –≤ –љ–µ–Ї–Њ—В–Њ—А–Њ–є —Б—В–µ–њ–µ–љ–Є –Ј–∞–≤–Є—Б–Є—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –≤—Л–Ј—Л–≤–∞—В—М –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П. –Ф–Њ –љ–µ–і–∞–≤–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Э–Ь–У —Б–≤—П–Ј—Л–≤–∞–ї–Є —Б –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ–Љ –∞–љ—В–Є––•–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–∞–і –∞–љ—В–Є–IIa. –Ю–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –Њ–Ї–Њ–ї–Њ 70% –њ—А–Њ—В–Є–≤–Њ—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П —З–µ—А–µ–Ј —Н—Д—Д–µ–Ї—В—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ–Љ –Э–Ь–У –Є —Н–љ–і–Њ—В–µ–ї–Є—П, –њ—А–Є–≤–Њ–і—П—Й–Є–µ –Ї –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—О –Є–Ј —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —В–Ї–∞–љ–µ–≤–Њ–≥–Њ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –≤–љ–µ—И–љ–µ–≥–Њ –њ—Г—В–Є —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П (TFPI) –Є –њ—А–Њ—Б—В–∞—Ж–Є–Ї–ї–Є–љ–∞ [23]. –° —Г—З–µ—В–Њ–Љ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П —Н—В–Є—Е –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –Э–Ь–У:
• ?—Г–≥–љ–µ—В–µ–љ–Є–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е –њ—А–Њ—В–µ–∞–Ј
• ?–њ—А—П–Љ–Њ–µ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ —Д–∞–Ї—В–Њ—А–∞ –•–∞ –Є —Н–ї–∞—Б—В–∞–Ј—Л
• ?—Г–≥–љ–µ—В–µ–љ–Є–µ –∞–Ї—В–Є–≤–∞—Ж–Є–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –Є –Љ–∞–Ї—А–Њ—Д–∞–≥–Њ–≤?
• ? –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ —Б –Ы–Я–Э–Я —Б –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–µ–є –Є—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤
• ?–≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ —Б —Б–Њ—Б—Г–і–Є—Б—В—Л–Љ —Н–љ–і–Њ—В–µ–ї–Є–µ–Љ
• ? –Љ–Њ–і—Г–ї–Є—А–Њ–≤–∞–љ–Є–µ —Н–љ–і–Њ–≥–µ–љ–љ—Л—Е –≥–ї–Є–Ї–Њ–Ј–∞–Љ–Є–љ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤
• ?–љ–µ–є—В—А–∞–ї–Є–Ј–∞—Ж–Є—П —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ —В–Ї–∞–љ–µ–≤–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞.
–°—В–µ–њ–µ–љ—М «–≥–µ–Љ–Њ—А—А–∞–≥–Є—З–љ–Њ—Б—В–Є» —Г –Э–Ь–У —А–∞–Ј–ї–Є—З–∞–µ—В—Б—П –Є –≤–∞—А—М–Є—А—Г–µ—В –≤ —И–Є—А–Њ–Ї–Є—Е –њ—А–µ–і–µ–ї–∞—Е, –Њ–і–љ–∞–Ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ –Њ–љ–Є –Љ–µ–љ–µ–µ –Њ–њ–∞—Б–љ—Л –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Э–У –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –≥–µ–Љ–Њ—А—А–∞–≥–Є–є, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –і–Њ–Ј–∞—Е, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤. –Я–Њ–і–±–Њ—А –і–Њ–Ј—Л –Э–Ь–У –Ј–∞—В—А—Г–і–љ–µ–љ –њ—А–Є –њ–Њ—А–∞–ґ–µ–љ–Є–Є –њ–Њ—З–µ–Ї, –Є –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –њ–Њ –њ—А–µ–і—Б–Ї–∞–Ј—Г–µ–Љ–Њ—Б—В–Є —Н—Д—Д–µ–Ї—В–∞ –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ —Б–ї–µ–і—Г–µ—В –Њ—В–і–∞–≤–∞—В—М –Э–У. –Э–Ь–У –Є–Љ–µ—О—В —А—П–і –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –њ–µ—А–µ–і –Э–У [25]:
1. –•–Њ—А–Њ—И–∞—П –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –Є –≤—Б–∞—Б—Л–≤–∞–µ–Љ–Њ—Б—В—М –њ—А–Є –њ–Њ–і–Ї–Њ–ґ–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є. –С–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –Э–Ь–У –њ–Њ—Б–ї–µ –њ–Њ–і–Ї–Њ–ґ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 90%, —В–Њ–≥–і–∞ –Ї–∞–Ї —Г –Э–У – 15–20%, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–∞–Ј–љ–∞—З–∞—В—М –Э–Ь–У –љ–µ —В–Њ–ї—М–Ї–Њ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤, –љ–Њ –Є –і–ї—П –ї–µ—З–µ–љ–Є—П –Є—Е.
2. –С–Њ–ї–µ–µ –њ—А–µ–і—Б–Ї–∞–Ј—Г–µ–Љ–Њ–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ. –Э–Є–Ј–Ї–Њ–µ —Б—А–Њ–і—Б—В–≤–Њ –Э–Ь–У –Ї –≥–µ–њ–∞—А–Є–љ–љ–µ–є—В—А–∞–ї–Є–Ј—Г—О—Й–Є–Љ –±–µ–ї–Ї–∞–Љ –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є –Њ–±—К—П—Б–љ—П–µ—В –Є—Е –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –≤ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј–∞—Е –Є –±–Њ–ї—М—И—Г—О –њ—А–µ–і—Б–Ї–∞–Ј—Г–µ–Љ–Њ—Б—В—М –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –њ—А–Є —В–µ—А–∞–њ–Є–Є –≤—Л—Б–Њ–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є.
3. –Ю—В—Б—Г—В—Б—В–≤–Є–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є —А–µ–≥—Г–ї—П—А–љ–Њ–≥–Њ –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –ї–µ—З–µ–љ–Є—П.
4. –£—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М –Ї –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ—Г –і–µ–є—Б—В–≤–Є—О —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤. –Ю–љ–Є –Є–Љ–µ—О—В –Љ–µ–љ—М—И–µ–µ —Б—А–Њ–і—Б—В–≤–Њ –Ї –∞–љ—В–Є–≥–µ–њ–∞—А–Є–љ–Њ–≤–Њ–Љ—Г —Д–∞–Ї—В–Њ—А—Г —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, –њ–Њ—Н—В–Њ–Љ—Г —А–µ–ґ–µ –≤—Л–Ј—Л–≤–∞—О—В –≥–µ–њ–∞—А–Є–љ––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Г—О —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—О.
5. –Ф–ї–Є—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≤–≤–µ–і–µ–љ–Є—П 1–2 —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є.
6. –Т –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, —З–µ–Љ –Э–У, –≤—Л–Ј—Л–≤–∞—О—В –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј, —З—В–Њ –і–µ–ї–∞–µ—В –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–Љ —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е, –≤ —Б—В–∞—А—З–µ—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ, –њ–Њ—Б–ї–µ —В—А–∞–≤–Љ –Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤, –њ—А–Є –Љ–љ–Њ–≥–Є—Е —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е (–≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –њ—А–Є –†–Р –Є –°–Ъ–Т).
7. –Ю–љ–Є –Љ–µ–љ–µ–µ –∞—В–µ—А–Њ–≥–µ–љ–љ—Л –Є–Ј––Ј–∞ –Љ–µ–љ—М—И–µ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–Є–њ—А–Њ—В–µ–Є–љ–ї–Є–њ–∞–Ј—Л, –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –ї–µ—З–µ–љ–Є—П –љ–µ –њ—А–Њ–≤–Њ—Ж–Є—А—Г—О—В –љ–∞—А—Г—И–µ–љ–Є—П —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞ –≤ —Б–≤—П–Ј–Є —Б –Љ–µ–љ—М—И–Є–Љ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≤ –Ї—А–Њ–≤–Є –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В.
–Т—Б–µ –≤—Л—И–µ–Њ–њ–Є—Б–∞–љ–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –Э–Ь–У, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, —Б—В–∞–≤—П—В —Н—В—Г –≥—А—Г–њ–њ—Г –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –њ–µ—А–≤—Л–µ —А—П–і—Л —В–µ—А–∞–њ–Є–Є –∞–Ї—Г—И–µ—А—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –њ—А–Є –Р–§–°, –∞ —В–∞–Ї–ґ–µ –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –Р–§–° –Є –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤–Њ–Љ –њ–µ—А–Є–Њ–і–µ.
–°—В–∞–љ–і–∞—А—В–љ–∞—П —В–µ—А–∞–њ–Є—П –Р–§–° –≤–Ї–ї—О—З–∞–µ—В —В–µ—А–∞–њ–Є—О –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞–Љ–Є. –Э–Ь–У, –љ–∞—А—П–і—Г —Б –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–∞–Љ–Є —П–≤–ї—П—О—В—Б—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –њ—А–Є —В–µ—А–∞–њ–Є–Є –Ї–∞—В–∞—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–§–°. –° 1986 –≥. –≤ –У–£ –Ш–љ—Б—В–Є—В—Г—В–µ –†–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є –†–Р–Ь–Э –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є —Б–Є—Б—В–µ–Љ–љ—Л—Е —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (—А—Г–Ї–Њ–≤–Њ–і–Є—В–µ–ї—М – –њ—А–Њ—Д–µ—Б—Б–Њ—А –Ч.–°. –Р–ї–µ–Ї–±–µ—А–Њ–≤–∞) –њ—А–Њ–≤–Њ–і—П—В—Б—П –љ–∞—Г—З–љ–Њ––Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ —А–∞–Ј–ї–Є—З–љ—Л–Љ –∞—Б–њ–µ–Ї—В–∞–Љ –Р–§–°. –° 1995 –≥., —Б –Љ–Њ–Љ–µ–љ—В–∞ –њ–Њ—П–≤–ї–µ–љ–Є—П –Э–Ь–У, –љ–∞–Ї–Њ–њ–ї–µ–љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–є –Њ–њ—Л—В –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Э–Ь–У –њ—А–Є –њ–µ—А–≤–Є—З–љ–Њ–Љ –Є –≤—В–Њ—А–Є—З–љ–Њ–Љ –Р–§–°.
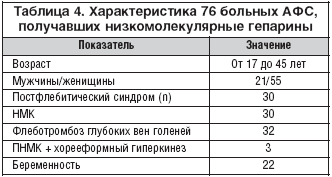
–Т –љ–∞—И–µ–Љ –∞—А—Б–µ–љ–∞–ї–µ –Є–Љ–µ–ї–Є—Б—М —А–∞–Ј–ї–Є—З–љ—Л–µ –Э–Ь–У (–љ–∞–і—А–Њ–њ–∞—А–Є–љ, –і–∞–ї—М—В–µ–њ–∞—А–Є–љ, —Н–љ–Њ–Ї—Б–Є–њ–∞—А–Є–љ, —В—А–Њ–њ–∞—А–Є–љ), –љ–Њ –Љ—Л –љ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Т —В–∞–±–ї–Є—Ж–µ 4 –њ—А–Є–≤–µ–і–µ–љ–∞ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ 76 –±–Њ–ї—М–љ—Л—Е –Р–§–°, –Є–Ј –Ї–Њ—В–Њ—А—Л—Е 28 –±—Л–ї–Є —Б –њ–µ—А–≤–Є—З–љ—Л–Љ –Р–§–° –Є –Њ—Б—В–∞–≤—И–Є–µ—Б—П —Б –≤—В–Њ—А–Є—З–љ—Л–Љ –Р–§–° –љ–∞ —Д–Њ–љ–µ –°–Ъ–Т. –Э–Ь–У –њ–Њ–ї—Г—З–∞–ї–Є –µ—Й–µ 15 –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т —Б –љ–µ—Д—А–Њ—В–Є—З–µ—Б–Ї–Є–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ (—Г—А–Њ–≤–µ–љ—М –Ї—А–µ–∞—В–Є–љ–Є–љ–∞–Є –љ–µ –њ—А–µ–≤—Л—И–∞–ї 150 –Љ–Ї–Љ–Њ–ї—М/–ї –Є –Ї–ї—Г–±–Њ—З–Ї–Њ–≤–∞—П —Д–Є–ї—М—В—А–∞—Ж–Є—П –љ–µ –љ–Є–ґ–µ 60 –Љ–ї/–Љ–Є–љ), 8 –±–Њ–ї—М–љ—Л—Е —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–Љ –∞—А—В—А–Є—В–Њ–Љ —Б –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ –Ї–Њ–ґ–љ—Л–Љ –≤–∞—Б–Ї—Г–ї–Є—В–Њ–Љ –Є –Ф–Т–° —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤. –Ъ—А–Њ–Љ–µ –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤ –Њ—Ж–µ–љ–Ї—Г –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –≤—Е–Њ–і–Є–ї–∞ —А–µ–≥–Є—Б—В—А–∞—Ж–Є—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є, —А–∞–Ј–Љ–µ—А–∞ –њ–ї–Њ—Й–∞–і–Є –Є –≥–ї—Г–±–Є–љ—Л —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е —П–Ј–≤, –Ї–Њ–љ—В—А–Њ–ї—М —Г—А–Њ–≤–љ—П –Р–Ґ III, –њ—А–Њ–і—Г–Ї—В–Њ–≤ –і–µ–≥—А–∞–і–∞—Ж–Є–Є —Д–Є–±—А–Є–љ–Њ–≥–µ–љ–∞ (–Я–Ф–§) –Є–ї–Є –Ф––і–Є–Љ–µ—А–Њ–≤. –°–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –≤–љ—Г—В—А–Є—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є (–њ—А–Њ–і—Г–Ї—В–Њ–≤ –і–µ–≥—А–∞–і–∞—Ж–Є–Є —Д–Є–±—А–Є–љ–Њ–≥–µ–љ–∞ –Є —А–∞—Б—В–≤–Њ—А–Є–Љ—Л—Е –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤ –Љ–Њ–љ–Њ–Љ–µ—А–Њ–≤ —Д–Є–±—А–Є–љ–∞) —Г 16 –±–Њ–ї—М–љ—Л—Е (5 – —Б –†–Р, 5 – —Б –°–Ъ–Т –Є 6 – —Б –Р–§–°) –њ—А–Є —В–µ—А–∞–њ–Є–Є –Э–Ь–У –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1. –£ 8 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –Ј–∞–ґ–Є–≤–ї–µ–љ–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е —П–Ј–≤ –Ї–Њ–ґ–Є (—Б–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ —В—А–Њ–µ –Є–Ј –љ–Є—Е –њ–Њ–ї—Г—З–∞–ї–Є –Э–Ь–У –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б—П—Ж–µ–≤). –С–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є —Г 19 –Є–Ј 22 –ґ–µ–љ—Й–Є–љ —Б –Р–§–°, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Э–Ь–У —Б 6–12 –љ–µ–і–µ–ї—М –≥–µ—Б—В–∞—Ж–Є–Є, –Њ–Ї–Њ–љ—З–Є–ї–Є—Б—М —А–Њ–ґ–і–µ–љ–Є–µ–Љ –ґ–Є–≤—Л—Е –і–µ—В–µ–є. –£ 8 –Є–Ј 22 –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –ґ–µ–љ—Й–Є–љ –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Љ—Г—В–∞—Ж–Є–Є: —Г 3 – –≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ–∞—П –Љ—Г—В–∞—Ж–Є—П Leiden –Є –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–∞—П –Љ—Г—В–∞—Ж–Є—П –≤ –≥–µ–љ–µ –Љ–µ—В–Є–ї–µ–љ—В–µ—В—А–Њ—Д–Њ–ї–∞—В—А–µ–і—Г–Ї—В–∞–Ј—Л (–Ь–Ґ–У–§–†), —Г 2 – –≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ–∞—П –Љ—Г—В–∞—Ж–Є—П –≤ –≥–µ–љ–µ –њ—А–Њ—В—А–Њ–Љ–±–Є–љ–∞, —Г –Њ–і–љ–Њ–є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ–Њ–є –Љ—Г—В–∞—Ж–Є–µ–є –≤ –≥–µ–љ–µ –Ь–Ґ–У–§–† –Є —Г 3 – –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–∞—П –Љ—Г—В–∞—Ж–Є—П –≤ –≥–µ–љ–µ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –∞–Ї—В–Є–≤–∞—В–Њ—А–∞ –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞ 1 (–†–РI 1), —Г –Њ–і–љ–Њ–є –Є–Ј –љ–Є—Е –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ–Њ–є –Љ—Г—В–∞—Ж–Є–µ–є –Ь–Ґ–У–§–†. –£ —В—А–µ—Е –ґ–µ–љ—Й–Є–љ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Њ–Ї–Њ–љ—З–Є–ї–Є—Б—М –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–є –≥–Є–±–µ–ї—М—О –њ–ї–Њ–і–∞ –љ–∞ —Б—А–Њ–Ї–∞—Е 18, 22 –Є 24 –љ–µ–і–µ–ї–Є –≥–µ—Б—В–∞—Ж–Є–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Т—Б–µ —В—А–Є –ґ–µ–љ—Й–Є–љ—Л —Б –њ–Њ—В–µ—А–µ–є –њ–ї–Њ–і–∞ –±—Л–ї–Є —Б –њ–µ—А–≤–Є—З–љ—Л–Љ –Р–§–° –Є –Є–Љ–µ–ї–Є –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї–Є–µ —Г—А–Њ–≤–љ–Є IgG––∞–Ъ–Ы (–≤—Л—И–µ 100 GPL), –њ–Њ–Ј–Є—В–Є–≤–љ—Л–µ –њ–Њ –Т–Р –Є –∞–љ—В–Є—В–µ–ї–∞–Љ –Ї IgG–b2––У–Я 1 –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П, –∞ —В–∞–Ї–ґ–µ —Б –Љ—Г—В–∞—Ж–Є–µ–є –≤ –†–РI 1. –Э–Є–Ї—В–Њ –Є–Ј –±–Њ–ї—М–љ—Л—Е, –ї–µ—З–µ–љ–љ—Л—Е –Э–Ь–У, –љ–µ —А–∞–Ј–≤–Є–ї –±–Њ–ї—М—И–Є—Е –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Х–і–Є–љ–Є—З–љ—Л–µ –≥–µ–Љ–∞—В–Њ–Љ—Л –љ–∞ –Љ–µ—Б—В–µ –Є–љ—К–µ–Ї—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –±—Л–ї–Є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ—Л —Г 18 –Є–Ј 76 –±–Њ–ї—М–љ—Л—Е.
–Ю—Б–љ–Њ–≤–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Э–Ь–У –њ—А–Є –Р–§–° –Ї–∞—Б–∞—О—В—Б—П —В–µ—А–∞–њ–Є–Є –њ—А–Є –Њ—Б—В—А—Л—Е —В—А–Њ–Љ–±–Њ–Ј–∞—Е, —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –Љ–∞–љ–Є–њ—Г–ї—П—Ж–Є—П—Е, –∞ —В–∞–Ї–ґ–µ –≤–µ–і–µ–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ—Л—Е [7,16,24].
–†–Њ–ї—М –∞–§–Ы –≤ —А–∞–Ј–≤–Є—В–Є–Є –∞–Ї—Г—И–µ—А—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є (–°–Я–Я) —П–≤–ї—П–µ—В—Б—П –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–Љ —Д–∞–Ї—В–Њ–Љ, –Є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ–њ—А–∞–≤–і–∞–љ–∞ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–∞—П —В–µ—А–∞–њ–Є—П —Б —Б–∞–Љ–Є—Е —А–∞–љ–љ–Є—Е —Б—А–Њ–Ї–Њ–≤ –≥–µ—Б—В–∞—Ж–Є–Є. –Ф–µ—Д–µ–Ї—В –≥–ї—Г–±–Є–љ—Л –Є–љ–≤–∞–Ј–Є–Є —В—А–Њ—Д–Њ–±–ї–∞—Б—В–∞, –љ–∞—А—Г—И–µ–љ–Є–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –њ–ї–∞—Ж–µ–љ—В—Л —Б –ї–Њ–Ї–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є –≤–љ—Г—В—А–Є—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є —З–∞—Б—В–Њ –љ–µ —Г–ї–∞–≤–ї–Є–≤–∞–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є –≤ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–µ —Б—А–Њ–Ї–Є, –∞ —Г–ґ–µ –≤ –њ–Њ–Ј–і–љ–Є–µ –ї–µ—З–µ–±–љ—Л–µ –Љ–µ—А–Њ–њ—А–Є—П—В–Є—П –±—Л–≤–∞—О—В —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є [27].
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –њ—А–Є –Р–§–° —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–∞—П –∞–љ—В–Є–≥–µ–љ–љ–∞—П —А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–§–Ы —П–≤–ї—П–µ—В—Б—П –Ї–ї—О—З–µ–≤–Њ–є –≤ –Љ–µ—Е–∞–љ–Є–Ј–Љ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є, –њ–∞—В–Њ–≥–µ–љ–µ–Ј –∞–§–Ы––Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–є –∞–Ї—Г—И–µ—А—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –і–Њ –Ї–Њ–љ—Ж–∞ –љ–µ —П—Б–µ–љ. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –Љ–Њ–і–µ–ї—П—Е –∞–љ—В–Є—В–µ–ї–Њ––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–Њ—В–µ—А—М –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П —В–Ї–∞–љ–µ–є –Є–Ј––Ј–∞ —В—А–Њ–Љ–±–Њ–Ј–∞ –і–∞—О—В –Њ—Б–љ–Њ–≤–∞–љ–Є–µ —Б—З–Є—В–∞—В—М, —З—В–Њ –°3 –Є –°5 –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞ —П–≤–ї—П—О—В—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –Љ–µ–і–Є–∞—В–Њ—А–∞–Љ–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П —В–Ї–∞–љ–Є [28]. –Ф–ї—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞ —Б–Њ–≤–µ—А—И–µ–љ–љ–∞—П —А–µ–≥—Г–ї—П—Ж–Є—П –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞. –С–ї–Њ–Ї–∞–і–∞ –Ї–∞—Б–Ї–∞–і–∞ –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞ in vivo –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞ –°3 –Є –°5 –∞–љ–љ—Г–ї–Є—А–Њ–≤–∞–ї–∞ –њ–Њ—В–µ—А—О –њ–ї–Њ–і–∞ –Є –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ —А–Њ—Б—В–∞ —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –Љ—Л—И–µ–є, –Ї–Њ—В–Њ—А—Л–Љ –≤–≤–Њ–і–Є–ї–Є—Б—М —З–µ–ї–Њ–≤–µ—З–µ—Б–Ї–Є–µ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ—Л —Б –∞–§–Ы. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –Љ—Л—И–Є —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞ –°3, –°5 –Є–ї–Є —А–µ—Ж–µ–њ—В–Њ—А–∞ –°5–∞ –±—Л–ї–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ–Є –Ї –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—О –њ–ї–Њ–і–∞, –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –∞–§–Ы. –Т —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –∞–Ї—В–Є–≤–∞—Ж–Є—П –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞ –≤–Њ–≤–ї–µ–Ї–∞–µ—В –Є –∞–Ї—В–Є–≤–Є—А—Г–µ—В –љ–µ–є—В—А–Њ—Д–Є–ї—Л, –Љ–Њ–љ–Њ—Ж–Є—В—Л, –Ї–Њ—В–Њ—А—Л–µ —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П. –У–µ–њ–∞—А–Є–љ, –Ї–∞–Ї –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –µ—Й–µ –≤ 1929 –≥., –Њ–±–ї–∞–і–∞–µ—В –∞–љ—В–Є–Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞—А–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –Є, –Ї—А–Њ–Љ–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П, —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –Љ—Л—И–µ–є —Б –∞–§–Ы –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–ї –∞–Ї—В–Є–≤–∞—Ж–Є—О –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞ –Є —В–µ–Љ —Б–∞–Љ—Л–Љ –њ–Њ—В–µ—А—О –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є [29–31]. –Ф—А—Г–≥–Є–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л –љ–µ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–ї–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –њ—А–Њ–і—Г–Ї—В–Њ–≤ —А–∞—Б—Й–µ–њ–ї–µ–љ–Є—П –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞. –≠—В–Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В—Л –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є, —З—В–Њ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П—Ж–Є—П –љ–µ —П–≤–ї—П–µ—В—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–є –≤ –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –≤—Л–Ј—Л–≤–∞–µ–Љ—Л—Е –∞–§–Ы —Г –Љ—Л—И–µ–є [31] –Є —В–µ—А–∞–њ–Є—П –≥–µ–њ–∞—А–Є–љ–Њ–Љ –Є–ї–Є –Э–Ь–У —П–≤–ї—П–µ—В—Б—П –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є.
J. Balasch –Є R. Cervera [32] —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–ї–Є –ї–Є—В–µ—А–∞—В—Г—А–љ—Л–µ –і–∞–љ–љ—Л–µ, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П –≤–µ–і–µ–љ–Є—П –Є –Є—Б—Е–Њ–і–∞ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є —Г –∞–§–Ы––њ–Њ–Ј–Є—В–Є–≤–љ—Л—Е –ґ–µ–љ—Й–Є–љ. –Ъ–∞–Ї —Б–ї–µ–і—Г–µ—В –Є–Ј —В–∞–±–ї–Є—Ж—Л 5, —Г—Б–њ–µ—И–љ—Л–µ –Є—Б—Е–Њ–і—Л –≥–µ—Б—В–∞—Ж–Є–Є –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –њ—А–Є —В–µ—А–∞–њ–Є–Є —В–Њ–ї—М–Ї–Њ –≥–µ–њ–∞—А–Є–љ–Њ–Љ –Є–ї–Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є –µ–≥–Њ —Б –љ–Є–Ј–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є –Р–°–Ъ. –° –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Э–Ь–У –њ–Њ—П–≤–Є–ї–Є—Б—М —Б–Њ–Њ–±—Й–µ–љ–Є—П –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А–Є –Р–§–°, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –њ—А–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є [33–36]. G. Triolo –Є —Б–Њ–∞–≤—В. [37] –Њ—Ж–µ–љ–Є–ї–Є –Є—Б—Е–Њ–і—Л –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є —Г 40 –∞–§–Ы––њ–Њ–Ј–Є—В–Є–≤–љ—Л—Е –ґ–µ–љ—Й–Є–љ, –Є–Љ–µ–≤—И–Є—Е –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ 3 –Є –±–Њ–ї–µ–µ —Б–ї—Г—З–∞–µ–≤ –њ–Њ—В–µ—А–Є –њ–ї–Њ–і–∞. –° –Љ–Њ–Љ–µ–љ—В–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –ґ–µ–љ—Й–Є–љ—Л –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ –љ–∞ –і–≤–µ –≥—А—Г–њ–њ—Л: –Њ–і–љ–∞ –њ–Њ–ї—Г—З–∞–ї–∞ —В–Њ–ї—М–Ї–Њ –≤/–≤ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ, –≤—В–Њ—А–∞—П – –Э–Ь–У –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –љ–Є–Ј–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є –Р–°–Ъ. –Я–∞—Ж–Є–µ–љ—В–Ї–Є, –њ–Њ–ї—Г—З–∞–≤—И–Є–µ –Э–Ь–У –Є –Р–°–Ъ, –Є–Љ–µ–ї–Є –±–Њ–ї—М—И–Є–є –њ—А–Њ—Ж–µ–љ—В –ґ–Є–≤–Њ—А–Њ–ґ–і–µ–љ–Є—П –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–µ–Љ–Є, –Ї—В–Њ –њ–Њ–ї—Г—З–∞–ї –≤/–≤ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ. A Ruffati. –Є —Б–Њ–∞–≤—В. [35] –≤ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ—Ж–µ–љ–Є–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Э–Ь–У —Г 30 –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ –Р–§–°. –Т —Б–≤—П–Ј–Є —Б –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ–Љ –њ–∞–і–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є –≤ –њ–µ—А–≤–Њ–Љ —В—А–Є–Љ–µ—Б—В—А–µ –≥–µ—Б—В–∞—Ж–Є–Є –Є–Ј 30 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 3 –±—Л–ї–Є –њ–µ—А–µ–≤–µ–і–µ–љ—Л –љ–∞ –і—А—Г–≥—Г—О —В–µ—А–∞–њ–Є—О –Є –Є—Б–Ї–ї—О—З–µ–љ—Л –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Я–Њ—В–µ—А—П –њ–ї–Њ–і–∞ –±—Л–ї–∞ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–∞ —Г 2 –Є–Ј –Њ—Б—В–∞–≤—И–Є—Е—Б—П 27 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї (7,4%), –Є —Г 25 –Є–Ј –љ–Є—Е –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М –Ј–∞–Ї–Њ–љ—З–Є–ї–∞—Б—М —А–Њ–і–∞–Љ–Є –ґ–Є–≤—Л–Љ –њ–ї–Њ–і–Њ–Љ –≤ —Б—А–Њ–Ї–Є –Љ–µ–ґ–і—Г 32 –Є 40 –љ–µ–і–µ–ї—П–Љ–Є –≥–µ—Б—В–∞—Ж–Є–Є. –£ 19 —А–Њ–і–Њ—А–∞–Ј—А–µ—И–µ–љ–Є–µ –Ј–∞–≤–µ—А—И–Є–ї–Њ—Б—М –Ї–µ—Б–∞—А–µ–≤—Л–Љ —Б–µ—З–µ–љ–Є–µ–Љ. –Э–Є —Г –Ї–Њ–≥–Њ –Є–Ј —А–Њ–ґ–і–µ–љ–љ—Л—Е –Љ–ї–∞–і–µ–љ—Ж–µ–≤ –љ–µ –±—Л–ї–Њ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–є –≤ –Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–Є. –£ –і–≤—Г—Е –Є–Ј 25 —А–Њ–ґ–µ–љ–Є—Ж –±—Л–ї–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П: —Г –Њ–і–љ–Њ–є – –њ—А–µ—Н–Ї–ї–∞–Љ–њ—Б–Є—П –Є —Г –і—А—Г–≥–Њ–є – —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П –≤ —В—А–µ—В—М–µ–Љ —В—А–Є–Љ–µ—Б—В—А–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Э–Ь–У —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –Р–§–°. Rodney D. –Є —Б–Њ–∞–≤—В. [34] in vitro –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –±–Њ–ї—М–љ—Л—Е —Б –∞–§–Ы –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–≤—П–Ј—Л–≤–∞—О—Й–µ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є Ig – –∞–Ъ–Ы –Є IgG –∞–љ—В–Є—В–µ–ї –Ї —Д–Њ—Б—Д–∞—В–Є–і–Є–ї—Б–µ—А–Є–љ—Г –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –≥–µ–њ–∞—А–Є–љ–∞ –Є–ї–Є –µ–≥–Њ –і–µ—А–Є–≤–∞—В–Њ–≤ –Х—Й–µ –≤ –Њ–і–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є [39] –њ–Њ –≤–µ–і–µ–љ–Є—О –∞–§–Ы––∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е –≥–µ—Б—В–∞—Ж–Є–є –ґ–µ–љ—Й–Є–љ—Л –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –∞–Ї—Г—И–µ—А—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Є –љ–∞–ї–Є—З–Є—П –Р–§–° –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 3 –≥—А—Г–њ–њ—Л: 1–—П –≥—А. –≤–Ї–ї—О—З–∞–ї–∞ –ґ–µ–љ—Й–Є–љ –±–µ–Ј –Њ—В—П–≥–Њ—Й–µ–љ–љ–Њ–≥–Њ –∞–Ї—Г—И–µ—А—Б–Ї–Њ–≥–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞, –±–µ–Ј –°–Ъ–Т –Є –±–µ–Ј –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–Є—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤; 2–—П – —В–µ—Е, —Г –Ї–Њ–≥–Њ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –±—Л–ї–Є –њ–Њ–≤—В–Њ—А–љ—Л–µ —Б–ї—Г—З–∞–Є —А–∞–љ–љ–Є—Е –њ–Њ—В–µ—А—М –њ–ї–Њ–і–∞ (–Љ–Є–љ–Є–Љ—Г–Љ – 1) –±–µ–Ј –°–Ъ–Т –Є–ї–Є –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞, –Є 3–—П –≥—А—Г–њ–њ–∞ – –ґ–µ–љ—Й–Є–љ—Л —Б —З–∞—Б—В—Л–Љ–Є —Б–ї—Г—З–∞—П–Љ–Є –њ–Њ—В–µ—А—М –њ–ї–Њ–і–∞, —Б –°–Ъ–Т, —Б —В—А–Њ–Љ–±–Њ–Ј–∞–Љ–Є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, —Б –ї—О–±—Л–Љ –Є–Ј –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Є–ї–Є –Є—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є. –Т –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –∞–≤—В–Њ—А—Л, –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–≤ —З–µ—В—Л—А–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П [39], –њ—А–Є—И–ї–Є –Ї –Љ–љ–µ–љ–Є—О, —З—В–Њ —Н—В–∞ –≥—А—Г–њ–њ–∞ –ґ–µ–љ—Й–Є–љ –љ–µ —В—А–µ–±—Г–µ—В —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, —В–∞–Ї –Ї–∞–Ї –Є—Б—Е–Њ–і—Л –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є: —В–Њ–ї—М–Ї–Њ –Р–°–Ъ –Є–ї–Є –±–µ–Ј –љ–µ–µ. –Ф–ї—П –≤—В–Њ—А–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –ґ–µ–љ—Й–Є–љ —А–µ–Ј—Г–ї—М—В–∞—В—Л —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Є–≤–µ–ї–Є –Ї –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–∞–Љ–Є –і–ї—П —Г–ї—Г—З—И–µ–љ–Є—П –Є—Б—Е–Њ–і–Њ–≤ –≥–µ—Б—В–∞—Ж–Є–Є —Г –ґ–µ–љ—Й–Є–љ —Б –∞–§–Ы. –Ю–і–љ–∞–Ї–Њ –і–ї—П –≤—В–Њ—А–Њ–є –Є —В—А–µ—В—М–µ–є –≥—А—Г–њ–њ—Л –∞–§–Ы –њ–Њ–Ј–Є—В–Є–≤–љ—Л—Е –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —А–∞–љ–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј –Р–°–Ъ –Є –≥–µ–њ–∞—А–Є–љ–∞ —Б –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ–Љ —Н—В–Њ–є —В–µ—А–∞–њ–Є–Є –≤ –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤–Њ–Љ –њ–µ—А–Є–Њ–і–µ –љ–µ –Љ–µ–љ–µ–µ 6 –љ–µ–і–µ–ї—М. –Ю—В—Б—Г—В—Б—В–≤–Є–µ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞, –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–µ –Љ–µ—Б—В–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є –≤ –≤–Є–і–µ –Љ–∞–ї—Л—Е –≥–µ–Љ–∞—В–Њ–Љ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Э–Ь–У —Б–і–µ–ї–∞–ї–Њ –Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤—Л–±–Њ—А–∞ –і–ї—П —В–µ—А–∞–њ–Є–Є –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –∞–§–Ы. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –∞–љ—В–Є––•–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–ї–∞–Ј–Љ—Л —Г –ґ–µ–љ—Й–Є–љ, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Э–Ь–У –њ–µ—А–µ–і —А–Њ–і–Њ—А–∞–Ј—А–µ—И–µ–љ–Є–µ–Љ, –Є –њ–ї–∞–Ј–Љ—Л –Є–Ј –њ—Г–њ–Њ—З–љ–Њ–є –≤–µ–љ—Л –Є—Е –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –љ–µ –≤—Л—П–≤–Є–ї —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–љ—В–Є––•–∞ —Г –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї–µ–Љ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Ж–µ—А—В–Њ–њ–∞—А–Є–љ–∞ –≤ 25 –њ—А–Њ–±–∞—Е –Љ–∞—В–µ—А–Є–љ—Б–Ї–Њ–≥–Њ –Љ–Њ–ї–Њ–Ї–∞ —В—А–µ–Љ—П –љ–µ–Ј–∞–≤–Є–Љ—Л–Љ–Є —В–µ—Б—В–∞–Љ–Є –њ–Њ–Ї–∞–Ј–∞–ї–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Ж–µ—А—В–Њ–њ–∞—А–Є–љ–∞ –≤ —Н—В–Є—Е –њ—А–Њ–±–∞—Е [40]. –≠—В–Є –і–∞–љ–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Э–Ь–У –Љ–Њ–≥—Г—В –≤–≤–Њ–і–Є—В—М—Б—П –±–µ—А–µ–Љ–µ–љ–љ—Л–Љ –Є –Є—Е –≤–≤–µ–і–µ–љ–Є–µ –љ–µ —Б–≤—П–Ј–∞–љ–Њ —Б —А–Є—Б–Ї–Њ–Љ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –њ–ї–Њ–і. –Я—А–µ–і–ї–∞–≥–∞–µ–Љ—Л–є —А–µ–ґ–Є–Љ —В–µ—А–∞–њ–Є–Є –≥–µ–њ–∞—А–Є–љ–∞–Љ–Є –њ—А–Є–≤–Њ–і–Є—В—Б—П –≤ —В–∞–±–ї–Є—Ж–µ 6, –≤ —В–∞–±–ї–Є—Ж–µ 7 —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ—Л–є —А–µ–ґ–Є–Љ —В–µ—А–∞–њ–Є–Є –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є—П—Е –Р–§–° [39].
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л —Б—В–∞–ї–Є –њ—А–Є–Љ–µ–љ—П—В—М –≤–∞—А—Д–∞—А–Є–љ –њ–Њ—Б–ї–µ 15–16 –љ–µ–і–µ–ї—М –≥–µ—Б—В–∞—Ж–Є–Є. Rachel P. –Є —Б–Њ–∞–≤—В. [35] –±—Л–ї–Є –Њ—Ж–µ–љ–µ–љ—Л –Є—Б—Е–Њ–і—Л 57 –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–µ–є —Г –ґ–µ–љ—Й–Є–љ —Б –Р–§–°, –Ї–Њ—В–Њ—А—Л–µ –≤ —В–µ—З–µ–љ–Є–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –њ–Њ–ї—Г—З–∞–ї–Є —Н–љ–Њ–Ї—Б–Є–њ–∞—А–Є–љ —Б –љ–Є–Ј–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є –Р–°–Ъ. 14 –Є–Ј –љ–Є—Е –±—Л–ї –љ–∞–Ј–љ–∞—З–µ–љ –≤–∞—А—Д–∞—А–Є–љ —Б 15––є –і–Њ 34––є –љ–µ–і–µ–ї–Є –≥–µ—Б—В–∞—Ж–Є–Є. –Р–≤—В–Њ—А–∞–Љ–Є –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –љ–Є —Г –Љ–∞—В–µ—А–Є, –љ–Є —Г –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —В–µ—А–∞–њ–Є–Є —В–Њ–ї—М–Ї–Њ —Н–љ–Њ–Ї—Б–Є–њ–∞—А–Є–љ–Њ–Љ –Є –Р–°–Ъ –Є–ї–Є –≤ –≥—А—Г–њ–њ–µ –љ–∞ —В–µ—А–∞–њ–Є–Є –≤–∞—А—Д–∞—А–Є–љ–Њ–Љ. –Р–ї–≥–Њ—А–Є—В–Љ –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є –Р–§–° —Б —Г—А–Њ–≤–љ–µ–Љ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ –њ—А–Є–≤–µ–і–µ–љ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1 [40].
–Э–Њ–≤—Л–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л
–≤ —В–µ—А–∞–њ–Є–Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–љ—Л –љ–Њ–≤—Л–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л [41]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤—Л–і–µ–ї–µ–љ—Л —В—А–Є –Ї–∞—В–µ–≥–Њ—А–Є–Є –љ–Њ–≤—Л—Е –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤. –Ъ –њ–µ—А–≤–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –Њ—В–љ–Њ—Б—П—В—Б—П –≤–µ—Й–µ—Б—В–≤–∞, –і–µ–є—Б—В–≤—Г—О—Й–Є–µ –љ–∞ —Н—В–∞–њ–µ –Ј–∞–њ—Г—Б–Ї–∞ –≤–љ–µ—И–љ–µ–≥–Њ –њ—Г—В–Є —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є – –њ—А–µ–њ–∞—А–∞—В—Л, –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—О—Й–Є–µ —Б –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–Љ —В–Ї–∞–љ–µ–≤–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞/—Д–∞–Ї—В–Њ—А–∞ VIIa –Є–ї–Є –µ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ–Є. –Ъ –љ–Є–Љ –Њ—В–љ–Њ—Б—П—В—Б—П –њ—А–µ–њ–∞—А–∞—В—Л: –Є–љ–≥–Є–±–Є—В–Њ—А –њ—Г—В–Є —В–Ї–∞–љ–µ–≤–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ (tissue factor pathway inhibitor, TFPI) –Є —А–µ–Ї–Њ–Љ–±–Є–љ–∞–љ—В–љ—Л–є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ—Л–є –±–µ–ї–Њ–Ї –љ–µ–Љ–∞—В–Њ–і —Б2 (recombinant nematode anticoadulant protein c2, rNAPc2). –Т—В–Њ—А—Г—О –≥—А—Г–њ–њ—Г —Б–Њ—Б—В–∞–≤–ї—П—О—В –њ—А–µ–њ–∞—А–∞—В—Л, –і–µ–є—Б—В–≤—Г—О—Й–Є–µ –љ–∞ –±–Њ–ї–µ–µ –њ–Њ–Ј–і–љ–Є—Е —Н—В–∞–њ–∞—Е —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є, –∞ –Є–Љ–µ–љ–љ–Њ –Є–љ–≥–Є–±–Є—В–Њ—А—Л —Д–∞–Ї—В–Њ—А–Њ–≤ IX, X, XI –Є–ї–Є –Є—Е –Ї–Њ—Д–∞–Ї—В–Њ—А–Њ–≤. –°—А–µ–і–Є –љ–Є—Е –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –і–µ–є—Б—В–≤—Г—О—Й–Є–µ –љ–∞ –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ—Л–є —Д–∞–Ї—В–Њ—А –• – –њ–µ–љ—В–∞—Б–∞—Е–∞—А–Є–і—Л: —Д–Њ–љ–і–∞–њ–∞—А–Є–љ—Г–Ї—Б –Є –Є–і—А–∞–њ–∞—А–Є–љ—Г–Ї—Б, –Є–љ–≥–Є–±–Є—А—Г—О—Й–Є–µ –• —Д–∞–Ї—В–Њ—А –њ—А–Є –њ–Њ—Б—А–µ–і—Б—В–≤–µ –∞–љ—В–Є—В—А–Њ–Љ–±–Є–љ–∞ III, –∞ —В–∞–Ї–ґ–µ DX9065a, –њ—А—П–Љ–Њ–є –Є–љ–≥–Є–±–Є—В–Њ—А –• —Д–∞–Ї—В–Њ—А–∞. –Ъ —В—А–µ—В—М–µ–є –≥—А—Г–њ–њ–µ –Њ—В–љ–Њ—Б—П—В—Б—П –њ—А—П–Љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л —В—А–Њ–Љ–±–Є–љ–∞ – –Ї—Б–Є–Љ–µ–ї–∞–≥–∞—В—А–∞–љ. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –∞–Ї—В–Є–≤–љ–Њ –≤–љ–µ–і—А—П—О—В—Б—П –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г –Ї—Б–Є–Љ–µ–ї–∞–≥–∞—В—А–∞–љ, –њ–µ–љ—В–∞—Б–∞—Е–∞—А–Є–і—Л —Д–Њ–љ–і–∞–њ–∞—А–Є–љ—Г–Ї—Б –Є –Є–і—А–∞–њ–∞—А–Є–љ—Г–Ї—Б.
–§–Њ–љ–і–∞–њ–∞—А–Є–љ—Г–Ї—Б (Fondaparinux sodium) —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –љ–Њ–≤—Л—Е –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ –±–ї–Њ–Ї–Є—А—Г—О—Й–Є—Е –• —Д–∞–Ї—В–Њ—А —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є. –Т–≤–µ–і–µ–љ–Є–µ –њ–Њ–і–Ї–Њ–ґ–љ–Њ –≤ –і–Њ–Ј–µ 2,5 –Љ–≥/—Б—Г—В. –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Э–У –Є –Э–Ь–У –Є–Ј––Ј–∞ –њ—А–µ–і—Б–Ї–∞–Ј—Г–µ–Љ–Њ—Б—В–Є –і–µ–є—Б—В–≤–Є—П, –Њ—В—Б—Г—В—Б—В–≤–Є—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П. –Ь–Њ–ї–µ–Ї—Г–ї–∞ —Н—В–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ —Б–≤—П–Ј—Л–≤–∞–µ—В—Б—П –њ–ї–∞–Ј–Љ–µ–љ–љ—Л–Љ–Є –±–µ–ї–Ї–∞–Љ–Є, –≤—А–µ–Љ—П –њ–Њ–ї—Г–ґ–Є–Ј–љ–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 17 —З–∞—Б–Њ–≤ –Є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –љ–µ –Ј–∞–≤–Є—Б–Є—В –Њ—В –≤–≤–Њ–і–Є–Љ–Њ–є –і–Њ–Ј—Л. –•–Є–Љ–Є—З–µ—Б–Ї–Њ–є –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–µ–є –Љ–Њ–ї–µ–Ї—Г–ї—Л —Д–Њ–љ–і–∞–њ–∞—А–Є–љ—Г–Ї—Б–∞ —П–≤–Є–ї—Б—П –µ—Й–µ –Њ–і–Є–љ –њ–µ–љ—В–∞—Б–∞—Е–∞—А–Є–і – –Є–і—А–∞–њ–∞—А–Є–љ—Г–Ї—Б (idraparinux); –≤ —Б–≤—П–Ј–Є —Б –љ–∞–ї–Є—З–Є–µ–Љ –і–Њ–±–∞–≤–Њ—З–љ–Њ–є –Љ–µ—В–Є–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л —Г–і–ї–Є–љ–µ–љ–Њ –≤—А–µ–Љ—П –њ–Њ–ї—Г–ґ–Є–Ј–љ–Є –њ—А–µ–њ–∞—А–∞—В–∞ (80 —З–∞—Б–Њ–≤), —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤–≤–Њ–і–Є—В—М –њ—А–µ–њ–∞—А–∞—В 1 —А–∞–Ј –≤ –љ–µ–і–µ–ї—О. –Ф–∞–љ–љ—Л–µ III —Д–∞–Ј—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ—В–Љ–µ—В–Є–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–Њ—Б—В—М –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Є–і—А–∞–њ–∞—А–Є–љ—Г–Ї—Б–∞ –≤ –і–Њ–Ј–µ 2,5–5,0–7,5 –Љ–≥ –Њ–і–Є–љ —А–∞–Ј –≤ –љ–µ–і–µ–ї—О –≤ —В–µ—З–µ–љ–Є–µ 3 –Љ–µ—Б—П—Ж–µ–≤ —Б —Н—Д—Д–µ–Ї—В–Њ–Љ —В–µ—А–∞–њ–Є–Є –≤–∞—А—Д–∞—А–Є–љ–Њ–Љ. –Э–∞ –і–Њ–±—А–Њ–≤–Њ–ї—М—Ж–∞—Е –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —А–µ–Ї–Њ–Љ–±–Є–љ–∞–љ—В–љ—Л–є —Д–∞–Ї—В–Њ—А VII–∞ —П–≤–ї—П–µ—В—Б—П –∞–љ—В–Є–і–Њ—В–Њ–Љ —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Ф–∞–љ–љ—Л—Е –њ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –њ–µ–љ—В–∞—Б–∞—Е–∞—А–Є–і–Њ–≤ –њ—А–Є –Р–§–° –љ–µ—В.
–Х—Й–µ –Њ–і–љ–Є–Љ –Љ–Њ—Й–љ—Л–Љ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ –њ—А—П–Љ—Л–Љ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–Љ —В—А–Њ–Љ–±–Є–љ–∞ (—В—А–Є–њ–µ–њ—В–Є–і) —П–≤–ї—П–µ—В—Б—П –∞—А–≥–Њ—В—А–Њ–±–∞–љ (argotroban). –Т 2000 –≥. FDA (Federal Drug Administration) —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–ї–∞ –µ–≥–Њ –Ї–∞–Ї –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В –њ—А–Є –≥–µ–њ–∞—А–Є–љ––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П—Е.
–С–Њ–ї—М—И–Є–µ –љ–∞–і–µ–ґ–і—Л –≤–Њ–Ј–ї–∞–≥–∞—О—В—Б—П –µ—Й–µ –љ–∞ –Њ–і–Є–љ –љ–Њ–≤—Л–є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–є –њ—А–µ–њ–∞—А–∞—В – –Ї—Б–Є–Љ–µ–ї–∞–≥–∞—В—А–∞–љ (ximelagatran). –Ъ—Б–Є–Љ–µ–ї–∞–≥–∞—В—А–∞–љ – –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–µ –њ—А–Њ–ї–µ–Ї–∞—А—Б—В–≤–Њ, —Б–Њ–і–µ—А–ґ–∞—Й–µ–µ –∞–Ї—В–Є–≤–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В –Љ–µ–ї–∞–≥–∞—В—А–∞–љ. –Ь–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П –Ї—Б–Є–Љ–µ–ї–∞–≥–∞—В—А–∞–љ–∞ —П–≤–ї—П–µ—В—Б—П –њ—А—П–Љ–Њ–µ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ —В—А–Њ–Љ–±–Є–љ–∞, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–µ–њ–∞—А–∞—В—Г –Є–љ–∞–Ї—В–Є–≤–Є—А–Њ–≤–∞—В—М –Ї–∞–Ї —Б–≤–Њ–±–Њ–і–љ—Л–є, —В–∞–Ї –Є —Б–≤—П–Ј–∞–љ–љ—Л–є —Б —Д–Є–±—А–Є–љ–Њ–Љ —В—А–Њ–Љ–±–Є–љ. –Я—А–µ–і—Б–Ї–∞–Ј—Г–µ–Љ—Л–є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ—Л–є –Њ—В–≤–µ—В, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Є–Ј–≤–µ—Б—В–љ—Л—Е –њ–Є—Й–µ–≤—Л—Е –Є–ї–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–є –Њ—Б–≤–Њ–±–Њ–ґ–і–∞–µ—В –±–Њ–ї—М–љ–Њ–≥–Њ –Є –≤—А–∞—З–∞ –Њ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є —З–∞—Б—В–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –Ј–∞ —Г—А–Њ–≤–љ–µ–Љ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є –Є –Њ—В —З–∞—Б—В–Њ–≥–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –і–Њ–Ј—Л. –С—Л—Б—В—А–Њ–µ –љ–∞—З–∞–ї–Њ –і–µ–є—Б—В–≤–Є—П –Ї—Б–Є–Љ–µ–ї–∞–≥–∞—В—А–∞–љ–∞ –Є—Б–Ї–ї—О—З–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–Љ –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ –≤ –љ–∞—З–∞–ї–µ –ї–µ—З–µ–љ–Є—П; —И–Є—А–Њ–Ї–Є–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–є –Є–љ–і–µ–Ї—Б –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Г—О –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤—Л—П–≤–ї–µ–љ–љ–Њ–µ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –ї–µ—З–µ–љ–Є—П –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –∞–Љ–Є–љ–Њ—В—А–∞–љ—Б—Д–µ—А–∞–Ј —В—А–µ–±—Г–µ—В –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ–≥–Њ –Є—Е –љ–∞–Ј–љ–∞—З–µ–љ–Є—П.
–Э–µ—В –і–∞–љ–љ—Л—Е –Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –Р–§–°, –∞ —В–∞–Ї–ґ–µ –Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ—А–Є —В—А–Њ–Љ–±–Њ–Ј–µ —Г –±–Њ–ї—М–љ—Л—Е –Р–§–°. –Ш–Љ–µ–µ—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Њ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–Њ–љ–і–∞–њ–∞—А–Є–љ—Г–Ї—Б–∞ –љ–∞ –Љ—Л—И–Є–љ–Њ–є –Љ–Њ–і–µ–ї–Є –њ—А–Є –∞–§–Ы––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –њ–Њ—В–µ—А–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є [29]. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –і—А—Г–≥–Є—Е –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ – –њ—А—П–Љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ —В—А–Њ–Љ–±–Є–љ–∞ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ —Б–ї—Г—З–∞—П—Е —А–∞–Ј–≤–Є—В–Є—П –≥–µ–њ–∞—А–Є–љ––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б–Њ–≤—А–µ–Љ–µ–љ–љ–∞—П –Љ–µ–і–Є—Ж–Є–љ–∞ –Є–Љ–µ–µ—В –≤ —Б–≤–Њ–µ–Љ –∞—А—Б–µ–љ–∞–ї–µ —А—П–і –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л—Е –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л–µ –Ј–≤–µ–љ—М—П –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –Є –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≥–µ–Љ–Њ—Б—В–∞–Ј–∞. –Э–Њ –њ—А–Є –≤—Л–±–Њ—А–µ —В–∞–Ї—В–Є–Ї–Є —В–µ—А–∞–њ–Є–Є –і–Њ–ї–ґ–љ—Л —Г—З–Є—В—Л–≤–∞—В—М—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ –і–µ–є—Б—В–≤–Є—П –Є –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П —В—Й–∞—В–µ–ї—М–љ—Л–є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–є –Ї–Њ–љ—В—А–Њ–ї—М –љ–µ —В–Њ–ї—М–Ї–Њ –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, –љ–Њ –Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б–≤–µ—А—В—Л–≤–∞—О—Й–µ–є –Є —Д–Є–±—А–Є–љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —Б–Є—Б—В–µ–Љ.







–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы. –Р–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–є —Б–Є–љ–і—А–Њ–Љ: –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Є –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞. –Ъ–ї–Є–љ.–Љ–µ–і. 1989; вДЦ1: 5–13.
2. –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы., –С–∞—А–∞–љ–Њ–≤ –Р.–Р., –®–Є–ї–Ї–Є–љ–∞ –Э.–Я., –Р–ї–µ–Ї–±–µ—А–Њ–≤–∞ –Ч.–°. –Я–∞—В–Њ–ї–Њ–≥–Є—П —Б–Њ—Б—Г–і–Њ–≤ –њ—А–Є –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ (–Ї–ї–Є–љ–Є–Ї–∞, –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞, –ї–µ—З–µ–љ–Є–µ). –Ь–Њ—Б–Ї–≤–∞––ѓ—А–Њ—Б–ї–∞–≤–ї—М. 1995; 161 —Б—В—А
3. Myakis S., Lockshin M.D., Atsumi T. et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome. J. Thromb. Haemost 2006; 4: 295–306.
4. Harris E.N. Syndrome of black swan. Br.J.Rheumatol., 1987; 26:324–26
5. Harris E.N., Gharavi A.E., Hughes G.R.V. Antiphospholipid antibodies. Clin. Rheum.Dis. 1985;11: 591–609.
6. Wilson A, Gharavi AE, Koike T, et al. International consensus statement on preliminary classification criteria for definite antiphospholipid syndrome. Arthritis. Rheum 1999; 42: 1309–1311.
7. McCrae K.R. Antiphospholipid antibody associated thrombosis: a consensus for treatment? Special article. Lupus. 1996; 5: 560–570.
8. Ginsburg K.S., LiangM.H., Newcomer L., et al. Anticardiolipin antibodies and the risk for ischemic stroke and venous thrombosis. Ann Intern Med. 1992; 177: 997–1002.
9. Silver R.M., Draper M.I., Scott J.R., et al. Clinical consequences of antiphospholipid antibodies: as historic cohort study. Obstet Gynecol 1994; 83: 372–377
10. Shah N., Khamashta M.A., Atsumi T., Hughes GRV. Outcome of patients with anticardiolipin antibodies: a 10 year follow–up of 52 patients. Lupus 1998; 7: 3–6
11. Asherson RA, Cervera R. Catastrophic antiphospholipid syndrome. Current Rheum Reports 2003;5:395–400.
12. Asherson RA, Cervera R, de Groot PG, et al. Catastrophic antiphospholipid syndrome: international consensus statement on classification criteria and treatment guidelines. Lupus.2003;12:530–534.
13. Cervera R, Piette JC, Font J, et al. Antiphospholipid syndrome: clinical and immunological manifestations and patterns of disease expression in a cohort of 1000 patients. Arthritis Rheum 2002; 46:1019–1027.–
14. Kutteh WH. Antiphospholipid syndrome associated recurrent pregnancy loss: treatment with heparin and low–dose aspirin is superior to low–dose aspirin alone. Am J Obstet Gynecol 1996;174:1584–1589.
15. Rai R, Cohen H, Dave M, et al. Randomized controlled trial of aspirin and aspirin plus heparin in pregnant women with recurrent miscarriages associated with phospholipids antibodies. Br Med J 1997;314:253–257.
16. Meroni P.L., Moia M., Derksen R.H.W.M. et al. Venous thromboembolism in the antiphospholipid syndrome: management guidelines for secondary prophylaxis. Lupus. 2003; 12: 504–507
17. Rudnicki RD, Gresham GE, Rothfield NF. The efficacy of antimalarials in systemic lupus erythematosus.J.Rheumatol.1975; 2: 323–330.
18. Wallace DJ, Linker–Israeli M, Metzger AL, Stecher VJ.The relevance of antimalarial therapy with regard to thrombosis, hypercholesrolemia and cytokines in SLE. Lupus. 1993; 2 9 Suppl1) S13–15
19. Klinger G., Morad Y., Westall C.A. et al. Ocular toxicity and antenatal exposure to chloroquine or hydroxychloroquine for rheumatic diseases. Lancet, 2001, 358, 813–814
20. Motta M., Tincani A., Faden D. et al. Antimalarial agents in pregnancy. Lancet, 2002, 359, 524–525
21. Levy R.A., Vilela V.S., Cataldo M.J. et al. Hydroxychloroquine (HCQ) in lupus pregnancy: double–blind and placebo–controlled study. Lupus. 2001, 10 (6), 401–404
22. Clowse M.E., Magder L., Witter F., Petri M. Hydroxychloroquine in lupus pregnancy. Arthritis Rheum., 2006, 54(11), 3640–3647
23. –°–Є–і–Њ—А–µ–љ–Ї–Њ –С.–Р., –Я—А–µ–Њ–±—А–∞–ґ–µ–љ—Б–Ї–Є–є –Ф.–Т. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Ь–Њ—Б–Ї–≤–∞ 1997. 175 —Б—В—А.
24. Bates S.M., Weitz J.I. Emerging anticoagulants drugs. Arterioscl. Thromb Vasc. Boil. 2003; 23: 1491–1500
25. Hirsh J. Low molecular weight heparins. Fouth edtition. 2007. BC Decker Inc. Hamilton. 111.
26. Branch DW, Khamashta MA. Antiphospholipid syndrome: obstetric diagnosis, management, and controversies. Obstet Gynecol 2003;101:1333–1344.
27. SIMONE N. DI, LUIGI M. P.,. MARCO D et al. Pregnancies Complicated with Antiphospholipid Syndrome: The Pathogenic Mechanism of Antiphospholipid Antibodies: A Review of the Literature
Ann. N.Y. Acad. Sci., 2007; 1108(1): 505 – 514.
28. Giannakopoulos B, Passam F, Rahgozar S, Krilis SA. Current concepts on the pathogenesis of the antiphospholipid syndrome. Blood. 2007 (Jan 15);109(2):422–30. [Medline].
29. Girardi G, Redecha P, Salmon JE. Heparin prevents antiphospholipid antibody–induced fetal loss by inhibiting complement activation. Nat Med. 2004;10(11):1222–6. [Medline].
30. Lockshin M.D. Update on antiphospholipid syndrome. Bull NYU Hosp Jt Dis. 2006;64(1–2):57–59.[Medline].
31. Girardi G, Lockshin M.D. Salmon J.E. The antiphospholipid syndrome as disorder initiated by inflammation: implications for the therapy of pregnant patients. Nat. Clin Pract.Rheumatol. 2007; 3(3): 140–147.
32. Balasch J., Cervera R. Reflections on the management of reproductive failure in the antiphospholipid syndrome – the clinician’s perspective. Lupus 2002; 11: 467–477
33. Makatsaria A.D., Bitsadze V.O, Dolgushina N.V. Use of the low–molecular weight heparin nadroparin during pregnancy. A review. Curr.Med.Res.Opin. 2003; 19: 4–12
34. Rodney D. Franklin and William H. Kutteh, Effects of Unfractionated and Low Molecular Weight Heparin on Antiphospholipid Antibody Binding In Vitro Obstetrics & Gynecology 2003;101:455–462
35. Rachel P., Mordechai D., Pnina L. et al. Low molecular weight heparin and warfarin in the treatment of patients with antiphospholipid syndrome during pregnancy. Thromb. Hem.2001;86(6):1379–1384.
36. Ruffatti A, Favaro M, Tonello M et al. Efficacy and safety of nadroparin in the treatment of pregnant women with antiphospholipid syndrome: a prospective cohort study. Lupus, 2005; 14(2): 120 – 128.
37. Ganapathy G.,. Whitley G. S. J, Cartwright J.E. et al. Effect of heparin and fractionated heparin on trophoblast invasion. Hum. Reprod., September 1, 2007; 22(9): 2523 – 2527.
38. Triolo G., Ferrante A., Ciccia F. et al. Randomized study of subcutaneous low molecular weight heparin plus aspirin versus intravenous immunoglobulin in the treatment of recurrent fetal loss associated with antiphospholipid antibodies. Arthritis Rheumatism. 2003; 48; 728– 731.
39. Derksen R., Khamashta M.A, Branch D.W. Management of the obstetric antiphospholipid syndrome. Arthritis Rheum. 2004; 50; 1028–1–39
40. Richter C, Sitzmann J, Lang P, et al. Excretion of low molecular weight heparin in human milk . Br J Clin Pharmacol. 2001 Dec;52(6):708–10
41. Lim W., Crowther M.A., Eikelboom J.W. Management of antiphospholipid antibody syndrome. JAMA. 2006; 295: 1050–1057
42. Pengo V. New trends in anticoagulant treatment. Lupus. 2005; 14: 789–793.












