–Т–≤–µ–і–µ–љ–Є–µ
–Ф–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –њ–Њ–ї–љ–Њ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–µ –і–µ–є—Б—В–≤–Є—П –Є–Ј—Г—З–∞–µ–Љ–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—Л –≤–∞–ґ–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –≤–ї–Є—П–љ–Є–µ —Н—В–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—Л –љ–∞ –≥–µ–љ–Њ–Љ, —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ, –њ—А–Њ—В–µ–Њ–Љ, –Љ–µ—В–∞–±–Њ–ї–Њ–Љ –Є —А–µ–∞–Ї—В–Њ–Љ [1вАУ3].–Т–Њ–Ј–і–µ–є—Б—В–≤–Є—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –љ–∞ –≥–µ–љ–Њ–Љ, —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ, –њ—А–Њ—В–µ–Њ–Љ –Є –Љ–µ—В–∞–±–Њ–ї–Њ–Љ –Є–Ј—Г—З–∞—О—В—Б—П –њ–Њ—Б—В–≥–µ–љ–Њ–Љ–љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–µ–є. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –ї–µ–Ї–∞—А—Б—В–≤, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—В –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —В–µ—Е –Є–ї–Є –Є–љ—Л—Е –±–µ–ї–Ї–Њ–≤ –њ—А–Њ—В–µ–Њ–Љ–∞, —З—В–Њ, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Њ–Љ, —А–µ–∞–Ї—В–Њ–Љ –Є, –љ–∞–Ї–Њ–љ–µ—Ж, —Б–Њ—Б—В–Њ—П–љ–Є–µ –≥–µ–љ–Њ–Љ–∞.
–Я–Њ–Є—Б–Ї –≤ –±–∞–Ј–µ –і–∞–љ–љ—Л—Е —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є GEO [4] –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –≤—Б–µ–≥–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ 2721 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Н—Д—Д–µ–Ї—В–Њ–≤ 725 –ї–µ–Ї–∞—А—Б—В–≤ –Є –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤ –і–ї—П —В–µ—Е –Є–ї–Є –Є–љ—Л—Е –≤–Є–і–Њ–≤ –Ї–ї–µ—В–Њ–Ї. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –Є–Ј–≤–µ—Б—В–љ–Њ –±–Њ–ї–µ–µ 9335 –ї–µ–Ї–∞—А—Б—В–≤ [5], –∞ —З–Є—Б–ї–Њ –≤–Є–і–Њ–≤ –Ї–ї–µ—В–Њ–Ї –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —З–µ–ї–Њ–≤–µ–Ї–∞ –њ—А–µ–≤—Л—И–∞–µ—В 200. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–∞–љ–љ—Л–µ –Њ —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–µ –і–Њ—Б—В—Г–њ–љ—Л –Љ–µ–љ–µ–µ —З–µ–Љ –і–ї—П 10% –ї–µ–Ї–∞—А—Б—В–≤.
–Т –љ–∞—И–Є—Е –њ—А–µ–і—Л–і—Г—Й–Є—Е —А–∞–±–Њ—В–∞—Е –±—Л–ї –њ—А–Њ–≤–µ–і–µ–љ –њ—А–Њ—В–µ–Њ–Љ–љ—Л–є [1] –Є —Е–µ–Љ–Њ—А–µ–∞–Ї—В–Њ–Љ–љ—Л–є [2] –∞–љ–∞–ї–Є–Ј —Н—Д—Д–µ–Ї—В–Њ–≤ –Љ–Њ–ї–µ–Ї—Г–ї—Л –Ї—А–Є—Б—В–∞–ї–ї–Є—З–µ—Б–Ї–Њ–є —Б—Г–±—Б—В–∞–љ—Ж–Є–Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–∞ —Б—Г–ї—М—Д–∞—В–∞ (–У–°), –њ—А–µ–њ–∞—А–∞—В–∞ –°—Г—Б—В–∞–≥–∞—А–і¬Ѓ –Р—А—В—А–Њ (–њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–∞ –Ї–Њ–Љ–њ–∞–љ–Є–Є ¬Ђ–С–Є–Њ–Є–±–µ—А–Є–Ї–∞, –°.–Р.–£.¬ї, –Ш—Б–њ–∞–љ–Є—П). –Я—А–Њ—В–µ–Њ–Љ–љ—Л–є –∞–љ–∞–ї–Є–Ј –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –і–µ–є—Б—В–≤–Є—П –У–° вАФ –і–µ–є—Б—В–≤—Г—О—Й–µ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –°—Г—Б—В–∞–≥–∞—А–і¬Ѓ –Р—А—В—А–Њ вАФ –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –У–° –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г–µ—В —Б —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є CD44, TLR4 –Є ICAM1 –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Е–Њ–љ–і—А–Њ—Ж–Є—В–Њ–≤, –Є–љ–≥–Є–±–Є—А—Г–µ—В –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Њ–љ–љ—Л–є —П–і–µ—А–љ—Л–є —Д–∞–Ї—В–Њ—А ¬Ђ–Ї–∞–њ–њ–∞-–±–Є¬ї (nuclear factor kappa-light-chain-enhancer of activated B cells, NF-ќЇ–Т), —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤—Л–є —Б–Є–≥–љ–∞–ї—М–љ—Л–є –њ—Г—В—М JAK/STAT, —А–µ–≥—Г–ї–Є—А—Г–µ—В —Б–Є–љ—В–µ–Ј –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ A –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ, –Љ–Є–≥—А–∞—Ж–Є—О –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤, –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≥–µ–Љ–∞—В–Њ–њ–Њ—Н—В–Є–љ–∞ –Є –Є–љ—В–µ—А—Д–µ—А–Њ–љ–Њ–≤. –Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Л–є —Е–µ–Љ–Њ—А–µ–∞–Ї—В–Њ–Љ–љ—Л–є –∞–љ–∞–ї–Є–Ј –У–° –Є —А—П–і–∞ –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Э–Я–Т–Я) –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –і–µ–Ї—Б–Ї–µ—В–Њ–њ—А–Њ—Д–µ–љ –Є, –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, –Ї–µ—В–Њ—А–Њ–ї–∞–Ї –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –і–Њ–њ–Њ–ї–љ—П—О—В –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –У–° [1, 2].
–Т –њ–Њ—Б—В–≥–µ–љ–Њ–Љ–љ–Њ–є –њ–∞—А–∞–і–Є–≥–Љ–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –ї–µ–Ї–∞—А—Б—В–≤ —П–≤–ї—П—О—В—Б—П –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –±–µ–ї–Ї–Њ–≤ –Є –Њ–Ї–∞–Ј—Л–≤–∞—О—В –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–µ (–Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±—Л—Б—В—А–Њ–µ), ¬Ђ—В–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ¬ї –і–µ–є—Б—В–≤–Є–µ (–Љ–Є–љ—Г—В—Л-—З–∞—Б—Л) –Є–Љ–µ–љ–љ–Њ –Ј–∞ —Б—З–µ—В –Љ–Њ–і—Г–ї—П—Ж–Є–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—Е –Є–ї–Є –Є–љ—Л—Е –Ї–Њ–љ–Ї—А–µ—В–љ—Л—Е –±–µ–ї–Ї–Њ–≤ –њ—А–Њ—В–µ–Њ–Љ–∞. –Э–∞–њ—А–Є–Љ–µ—А, –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ –Є –Э–Я–Т–Я –Є–љ–≥–Є–±–Є—А—Г—О—В —Д–µ—А–Љ–µ–љ—В —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Г-2 (–¶–Ю–У-2), —З—В–Њ —Б–љ–Є–ґ–∞–µ—В —Б–Є–љ—В–µ–Ј –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –±–µ–ї–Ї–Є —Б–Є–љ—В–µ–Ј–Є—А—Г—О—В—Б—П –љ–∞ –Њ—Б–љ–Њ–≤–µ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є, –Ј–∞–Ї–Њ–і–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤ –≥–µ–љ–Њ–Љ–љ–Њ–є –Ф–Э–Ъ. –Я–µ—А–≤—Л–Љ —И–∞–≥–Њ–Љ –≤ —Б–Є–љ—В–µ–Ј–µ –ї—О–±–Њ–≥–Њ –±–µ–ї–Ї–∞ —П–≤–ї—П–µ—В—Б—П —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–≥–Њ –≥–µ–љ–∞, —В. –µ. —Б–Є–љ—В–µ–Ј –Љ–∞—В—А–Є—З–љ–Њ–є –†–Э–Ъ, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–є –≥–µ–љ—Г. –Я–Њ—Б–ї–µ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –≥–µ–љ–∞ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–љ–∞—П –Љ–∞—В—А–Є—З–љ–∞—П –†–Э–Ъ —В—А–∞–љ—Б–ї–Є—А—Г–µ—В—Б—П —А–Є–±–Њ—Б–Њ–Љ–∞–Љ–Є, —В. –µ. –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ —Б–Є–љ—В–µ–Ј –±–µ–ї–Ї–∞. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –ї–µ–Ї–∞—А—Б—В–≤–∞ –љ–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—О –≥–µ–љ–Њ–≤ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –±–Њ–ї–µ–µ –і–Њ–ї–≥–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л —Н—В–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ (—З–∞—Б—Л-–і–љ–Є). –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –ї–µ–Ї–∞—А—Б—В–≤ –љ–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—О –Ї–∞–Ї –±—Л –њ–Њ–і–≥–Њ—В–∞–≤–ї–Є–≤–∞–µ—В –Ї–ї–µ—В–Ї—Г –Ї –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –њ—А–Є–≤–љ–µ—Б–µ–љ–Є—П –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е ¬Ђ—Б—В—А–∞—В–µ–≥–Є—З–µ—Б–Ї–Є—Е¬ї –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –≤—Б–µ–≥–Њ –≥–µ–љ–Њ–Љ–∞ [6, 7].
–Э–∞–Ї–Њ–њ–ї–µ–љ–љ—Л–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Њ–њ—Л—В –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В, —З—В–Њ –і–∞–ї–µ–Ї–Њ –љ–µ –і–ї—П –≤—Б—П–Ї–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ —Е–∞—А–∞–Ї—В–µ—А–љ–∞ —Б–Є–љ–µ—А–≥–Є—П –≤ —В–Њ–Љ —Б–Љ—Л—Б–ї–µ, —З—В–Њ –Љ–Њ–ї–µ–Ї—Г–ї–∞ —Н—В–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞–і–ї–µ–ґ–∞—Й–µ–µ ¬Ђ—В–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ¬ї –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –њ—А–Њ—В–µ–Њ–Љ –Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–µ ¬Ђ—Б—В—А–∞—В–µ–≥–Є—З–µ—Б–Ї–Њ–µ¬ї –і–µ–є—Б—В–≤–Є–µ –љ–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ. –Э–∞–њ—А–Є–Љ–µ—А, –љ–µ–Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤—Л–µ —Б—А–µ–і—Б—В–≤–∞ –Є–љ–≥–Є–±–Є—А—Г—О—В —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—О –≥–µ–љ–Њ–≤, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б —А–Њ—Б—В–Њ–Љ –Њ–њ—Г—Е–Њ–ї–µ–є (—З—В–Њ –Є –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –Њ—Б–љ–Њ–≤–љ–Њ–µ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Љ–Њ–ї–µ–Ї—Г–ї). –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —В–µ –ґ–µ —Б–∞–Љ—Л–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л –Є–љ–≥–Є–±–Є—А—Г—О—В –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –±–µ–ї–Ї–Є –њ—А–Њ—В–µ–Њ–Љ–∞ (—З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —В—П–ґ–µ–ї—Л–Љ –њ–Њ–±–Њ—З–љ—Л–Љ —Н—Д—Д–µ–Ї—В–∞–Љ). –Я–Њ—Н—В–Њ–Љ—Г –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –±–Є–Њ–Љ–µ–і–Є—Ж–Є–љ–µ –≤–∞–ґ–љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ –Є –љ–∞ –њ—А–Њ—В–µ–Њ–Љ, –Є –љ–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ.
–Т –±–∞–Ј–µ –і–∞–љ–љ—Л—Е GEO [4] –љ–∞–Ї–Њ–њ–ї–µ–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –±–Њ–ї–µ–µ —З–µ–Љ 160 —В—Л—Б. —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (–≤—Б–µ–≥–Њ –±–Њ–ї–µ–µ 50 —В—Л—Б. —В–µ—А–∞–±–∞–є—В –і–∞–љ–љ—Л—Е). –° –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –љ–Њ–≤–µ–є—И–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є–љ—В–µ–ї–ї–µ–Ї—В–∞ –і–ї—П –∞–љ–∞–ї–Є–Ј–∞ ¬Ђ—Б–≤–µ—А—Е–±–Њ–ї—М—И–Є—Е –і–∞–љ–љ—Л—Е¬ї (big data) –≤ –Ш–љ—Б—В–Є—В—Г—В–µ —Д–∞—А–Љ–∞–Ї–Њ–Є–љ—Д–Њ—А–Љ–∞—В–Є–Ї–Є –њ—А–Є –§–Ш–¶ –Ш–£ –†–Р–Э –±—Л–ї —А–∞–Ј—А–∞–±–Њ—В–∞–љ –Љ–µ—В–Њ–і —Е–µ–Љ–Њ—В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —Н—Д—Д–µ–Ї—В–Њ–≤ –Љ–Њ–ї–µ–Ї—Г–ї, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л–є –љ–∞ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –Љ–µ—В–Њ–і–∞—Е –Љ–∞—И–Є–љ–љ–Њ–≥–Њ –Њ–±—Г—З–µ–љ–Є—П [8вАУ14].
–¶–µ–ї—М –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П вАФ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —Е–µ–Љ–Њ—В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –У–° –љ–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—О 12 700 –∞–љ–љ–Њ—В–Є—А–Њ–≤–∞–љ–љ—Л—Е –≥–µ–љ–Њ–≤ —З–µ–ї–Њ–≤–µ–Ї–∞ –≤ —Д–Є–±—А–Њ–±–ї–∞—Б—В–∞—Е –ї–Є–љ–Є–Є FIBRNPC.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Ь–µ—В–Њ–і–Є–Ї–Є –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—П —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ –њ—А–Є–≤–µ–і–µ–љ—Л –≤ —А–∞–±–Њ—В–µ A. Subramanian et al. (2017) [15]. –†–µ–Ј—Г–ї—М—В–∞—В—Л —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ—Л—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–Њ–≤ –≤ –±–∞–Ј–µ –і–∞–љ–љ—Л—Е GEO –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ –≤–Є–і–µ —В–∞–±–ї–Є—Ж, —Б—В–Њ–ї–±—Ж–∞–Љ –Ї–Њ—В–Њ—А—Л—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—В –≥–µ–љ—Л, –∞ —Б—В—А–Њ–Ї–∞–Љ вАФ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –Ї–ї–µ—В–Ї—Г (–љ–∞–њ—А–Є–Љ–µ—А, —В–µ –Є–ї–Є –Є–љ—Л–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л). –≠–ї–µ–Љ–µ–љ—В–∞–Љ–Є —В–∞–±–ї–Є—Ж —П–≤–ї—П—О—В—Б—П –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–∞ –њ—А–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є. –Ъ–∞–ґ–і–Њ–є —В–∞–Ї–Њ–є —В–∞–±–ї–Є—Ж–µ —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ–Њ–≥–Њ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—В: 1) —В–Є–њ –Ї–ї–µ—В–Њ–Ї, –і–ї—П –Ї–Њ—В–Њ—А—Л—Е –Є–Ј—Г—З–∞–ї–Є—Б—М –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є; 2) –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—Й–Є—Е –Љ–Њ–ї–µ–Ї—Г–ї); 3) –≤—А–µ–Љ—П –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П (6, 12, 24 —З –Є —В. –і.). –Ш–Ј–Љ–µ–љ–µ–љ–Є—П —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –Њ—Ж–µ–љ–Є–≤–∞—О—В—Б—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л—Е –Њ–±—А–∞–Ј—Ж–Њ–≤ (–Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –і–Є–Љ–µ—В–Є–ї—Б—Г–ї—М—Д–Њ–Ї—Б–Є–і) [15].–Я—А–Є –Ј–∞–і–∞–љ–Є–Є (1) —В–Є–њ–∞ –Ї–ї–µ—В–Њ–Ї (–љ–∞–њ—А–Є–Љ–µ—А, —Д–Є–±—А–Њ–±–ї–∞—Б—В—Л), (2) –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Є (3) –≤—А–µ–Љ–µ–љ–Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –Ї–∞–ґ–і—Л–є —Б—В–Њ–ї–±–µ—Ж —В–∞–Ї–Њ–є —В–∞–±–ї–Є—Ж—Л —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —А–µ–∞–Ї—Ж–Є–Є ¬Ђ–У–µ–љi вЖТ –Љ–†–Э–Ъi¬ї, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ї–Њ—В–Њ—А–Њ–є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П —Б–Є–љ—В–µ–Ј i-–є –Љ–Њ–ї–µ–Ї—Г–ї—Л –Љ–†–Э–Ъi, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–є i-–Љ—Г –≥–µ–љ—Г (–У–µ–љi). –Ф–∞–љ–љ—Л–µ, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ—Б—П –≤ —В–∞–Ї–Њ–Љ —Б—В–Њ–ї–±—Ж–µ —В–∞–±–ї–Є—Ж—Л 1 —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ–Њ–≥–Њ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞, –≤–Ї–ї—О—З–∞—О—Й–µ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О –Њ–± –Є–Ј–Љ–µ–љ–µ–љ–Є–Є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є N –≥–µ–љ–Њ–≤ –њ—А–Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є n –Љ–Њ–ї–µ–Ї—Г–ї, –Љ–Њ–≥—Г—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М—Б—П –Ї–∞–Ї –Њ–њ–Є—Б–∞–љ–Є–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ —Н–ї–µ–Љ–µ–љ—В–∞ —А–µ–∞–Ї—В–Њ–Љ–∞ (—Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–Є –≤—Б–µ—Е —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є). –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, —Б—В–∞–љ–Њ–≤–Є—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —В–µ–Њ—А–Є–Є —Е–µ–Љ–Њ–≥—А–∞—Д–Њ–≤ [8, 9], –Љ–µ—В–Њ–і–Њ–ї–Њ–≥–Є–Є —Е–µ–Љ–Њ–Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ [10] –Є —Е–µ–Љ–Њ—А–µ–∞–Ї—В–Њ–Љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ [11вАУ14] –і–ї—П –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є—П —Е–µ–Љ–Њ—В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ–Њ–≥–Њ –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П.
–•–µ–Љ–Њ—В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ—Л–є –∞–љ–∞–ї–Є–Ј
–Ф–∞–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –Љ–µ—В–Њ–і–∞–Љ–Є, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л–Љ–Є –љ–∞ –Ї–Њ–Љ–±–Є–љ–∞—В–Њ—А–љ–Њ–є —В–µ–Њ—А–Є–Є —А–∞–Ј—А–µ—И–Є–Љ–Њ—Б—В–Є [7вАУ9, 14, 16]. –†–µ—И–∞—О—В—Б—П –Ј–∞–і–∞—З–Є —А–∞—Б–њ–Њ–Ј–љ–∞–≤–∞–љ–Є—П –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–Њ–љ—Б—В–∞–љ—В (–Њ—Ж–µ–љ–Є–≤–∞–µ–Љ—Л—Е –≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є—П—Е –Љ–∞—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–ґ–Є–і–∞–љ–Є—П –Є –і–Є—Б–њ–µ—А—Б–Є–Є —Д—Г–љ–Ї—Ж–Є–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П). –Э–∞ —В—А–µ—В—М–µ–Љ —Н—В–∞–њ–µ –∞–љ–∞–ї–Є–Ј–∞ –і–ї—П –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—Л –і–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –≥–µ–љ–∞ –≤—Л—З–Є—Б–ї—П–ї–Є—Б—М –Њ—Ж–µ–љ–Ї–Є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є–ї–Є –і–µ–њ—А–Є–≤–∞—Ж–Є–Є –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—Л. –Ь–µ—В–Њ–і–∞–Љ–Є —А–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Њ–њ—А–µ–і–µ–ї—П–ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є (0,01вАУ10 –Љ–Ї–Љ–Њ–ї—М/–ї). –Ф–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –Є–Ј –Њ—В–Њ–±—А–∞–љ–љ—Л—Е —В—А–µ–љ–і–Њ–≤ —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї—Б—П –Ј–љ–∞–Ї –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є i-–≥–Њ –≥–µ–љ–∞ (¬Ђ+¬ї-—В—А–µ–љ–і вАФ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –њ—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –У–°, ¬Ђ-¬ї-—В—А–µ–љ–і вАФ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є i-–≥–Њ –≥–µ–љ–∞ –њ—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –У–°, –і–µ–є—Б—В–≤—Г—О—Й–µ–≥–Њ –љ–∞—З–∞–ї–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –°—Г—Б—В–∞–≥–∞—А–і¬Ѓ –Р—А—В—А–Њ) –Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–µ —В—А–µ–љ–і–∞–Љ –≥–µ–љ—Л –њ–Њ–і—А–∞–Ј–і–µ–ї—П–ї–Є—Б—М –љ–∞ —Б–њ–Є—Б–Њ–Ї –≥–µ–љ–Њ–≤, –і–ї—П –Ї–Њ—В–Њ—А—Л—Е –њ–Њ–Ї–∞–Ј–∞–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є (¬Ђ–°–њ–Є—Б–Њ–Ї+¬ї) –Є —Б–љ–Є–ґ–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є (¬Ђ–°–њ–Є—Б–Њ–Ї-¬ї).
–°–Є—Б—В–µ–Љ–љ–Њ-–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј
–°–њ–Є—Б–Ї–Є –≥–µ–љ–Њ–≤ —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Є–ї–Є —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Њ–њ–Є—Б–∞–љ–љ–Њ–≥–Њ –≤—Л—И–µ —Е–µ–Љ–Њ—В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞, –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є—Б—М –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –Љ–µ—В–Њ–і–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–≤—П–Ј—Л–≤–∞–љ–Є—П [3]. –Р–љ–∞–ї–Є–Ј –њ—А–Њ–≤–Њ–і–Є–ї—Б—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А—Л Gene Ontology (GO), –Њ–њ–Є—Б—Л–≤–∞—О—Й–µ–є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –≥–µ–љ–Њ–≤ –Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –±–µ–ї–Ї–Њ–≤. –Ф–∞–љ–љ—Л–є –Љ–µ—В–Њ–і –Њ—Б–љ–Њ–≤–∞–љ –љ–∞ —Б–Є—Б—В–µ–Љ–љ–Њ–Љ —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–Є–Є –Њ—А–≥–∞–љ–Њ–≤, —В–Ї–∞–љ–µ–є, –Ї–ї–µ—В–Њ–Ї –Є –Є—Е –Љ–µ–ї—М—З–∞–є—И–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ (–±–µ–ї–Ї–Њ–≤, –Ф–Э–Ъ, –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤) –≤ —А–∞–Љ–Ї–∞—Е —Д—Г–љ–і–∞–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Њ—Б–љ–Њ–≤ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –±–Є–Њ–ї–Њ–≥–Є–Є –Є –±–Є–Њ—Е–Є–Љ–Є–Є. –Ґ–∞–Ї, –љ–∞ –Њ—Б–љ–Њ–≤–µ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –≥–µ–љ–Њ–Љ–љ–Њ–є –Ф–Э–Ъ —Б–Є–љ—В–µ–Ј–Є—А—Г–µ—В—Б—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–є –±–µ–ї–Њ–Ї, –≤—Л–њ–Њ–ї–љ—П—О—Й–Є–є —Б—В—А–Њ–≥–Њ –Њ—З–µ—А—З–µ–љ–љ—Л–є –Ї—А—Г–≥ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е —Д—Г–љ–Ї—Ж–Є–є. –Ъ–∞–Ї –Љ—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞, —В–∞–Ї –Є –і–µ—Д–Є—Ж–Є—В—Л –Ї–Њ—Д–∞–Ї—В–Њ—А–Њ–≤ –±–µ–ї–Ї–∞ (–Є–Њ–љ–Њ–≤ –Љ–µ—В–∞–ї–ї–Њ–≤ вАФ –Ї–∞–ї—М—Ж–Є—П, –Љ–∞–≥–љ–Є—П, —Ж–Є–љ–Ї–∞; –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –≥—А—Г–њ–њ—Л B –Є –і—А.) –±—Г–і—Г—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї –њ–∞–і–µ–љ–Є—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—Е –Є–ї–Є –Є–љ—Л—Е –±–µ–ї–Ї–Њ–≤ –Є –њ—А–Њ—П–≤–ї–µ–љ–Є—О —В–Њ–є –Є–ї–Є –Є–љ–Њ–є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є [3].–Ь–µ—В–Њ–і –∞–љ–∞–ї–Є–Ј–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–µ–є, —Б–Њ–µ–і–Є–љ—П—П –і–∞–љ–љ—Л–µ —А–∞–Ј–ї–Є—З–љ—Л—Е —Г—А–Њ–≤–љ–µ–є (–і–∞–љ–љ—Л–µ –Њ –Љ–Њ–љ–Њ–≥–µ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е, –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –Њ –Ї–Њ—Д–∞–Ї—В–Њ—А–∞—Е –±–µ–ї–Ї–Њ–≤, –і–∞–љ–љ—Л–µ –Њ –Ї–ї–µ—В–Њ—З–љ–Њ–є —А–Њ–ї–Є –±–µ–ї–Ї–Њ–≤, —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї—Г –Є –Ї—А–Є—В–µ—А–Є–Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є —В. –і.), –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є —А–∞—Б—Б–Љ–Њ—В—А–µ—В—М –≤—Б–µ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –У–° –љ–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—О –Ї–∞–ґ–і–Њ–≥–Њ –Є–Ј –≥–µ–љ–Њ–≤. –Т —Ж–µ–ї–Њ–Љ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Љ–µ—В–Њ–і–∞ –∞–љ–∞–ї–Є–Ј–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–µ–є –і–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –≥–µ–љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В—Б—П –∞–љ–љ–Њ—В–Є—А–Њ–≤–∞–љ–љ–∞—П —В–∞–±–ї–Є—Ж–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤, –≤–Ї–ї—О—З–∞—О—Й–∞—П —Б–ї–µ–і—Г—О—Й–Є–µ –Њ–њ–Є—Б–∞–љ–Є—П:
—Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–є –≥–µ–љ—Г –±–µ–ї–Њ–Ї;
—Б–њ–Є—Б–Њ–Ї –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л—Е —Н—Б—Б–µ–љ—Ж–Є–∞–ї—М–љ—Л—Е –Ї–Њ—Д–∞–Ї—В–Њ—А–Њ–≤ –±–µ–ї–Ї–∞ (–≤ —В. —З. —Б —Г–Ї–∞–Ј–∞–љ–Є–µ–Љ –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –Є–Њ–љ–Њ–≤ –Ї–∞–ї—М—Ж–Є—П –і–ї—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–≥–Њ –±–µ–ї–Ї–∞);
—Б–њ–Є—Б–Њ–Ї –Љ–Њ–љ–Њ–≥–µ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –њ–Њ–ї–љ–Њ–є –Є–ї–Є —З–∞—Б—В–Є—З–љ–Њ–є –њ–Њ—В–µ—А–µ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—В–Њ–≥–Њ –±–µ–ї–Ї–∞;
—Б–њ–Є—Б–Њ–Ї –Ї–ї–µ—В–Њ—З–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є –±–µ–ї–Ї–∞ (–њ–Њ –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А–µ GO –Є –і—А.);
—Б–њ–Є—Б–Њ–Ї –Њ—В–і–µ–ї—М–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —Б–њ–Є—Б–Њ–Ї –і–Є–∞–≥–љ–Њ–Ј–Њ–≤ –њ–Њ –Ь–Ъ–С-10 –Є –і—А—Г–≥—Г—О –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О –Є–Ј –±–∞–Ј –і–∞–љ–љ—Л—Е.
–Ф–∞–ї–µ–µ –≤ –њ–Њ–ї—Г—З–µ–љ–љ–Њ–є —В–∞–±–ї–Є—Ж–µ –≤—Л–і–µ–ї—П—О—В—Б—П –≥–µ–љ—Л, —З–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Њ–њ–Є—Б–∞–љ–Є–є –Ї–Њ—В–Њ—А—Л—Е —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Њ—В–ї–Є—З–∞–µ—В—Б—П –њ—А–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–Љ –њ–Њ–≤—Л—И–µ–љ–Є–Є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є, –Є –њ—А–Њ–≤–Њ–і–Є—В—Б—П –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–є –∞–љ–∞–ї–Є–Ј –Є—Е —Д—Г–љ–Ї—Ж–Є–є –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є—Е –Ї—А–Є—В–µ—А–Є–µ–≤. –Ф–ї—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –Љ–µ—В–Њ–і—Л –Љ–∞—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —Б—В–∞—В–Є—Б—В–Є–Ї–Є, –≤–Ї–ї—О—З–∞—О—Й–Є–µ —А–∞—Б—З–µ—В —З–Є—Б–ї–Њ–≤—Л—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї —Б–ї—Г—З–∞–є–љ—Л—Е –≤–µ–ї–Є—З–Є–љ, –њ—А–Њ–≤–µ—А–Ї—Г —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є—Е –≥–Є–њ–Њ—В–µ–Ј —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –Є –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –Ї—А–Є—В–µ—А–Є–µ–≤, –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Є –і–Є—Б–њ–µ—А—Б–Є–Њ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞. –°—А–∞–≤–љ–µ–љ–Є–µ –њ—А–Њ–≥–љ–Њ–Ј–Є—А—Г–µ–Љ—Л—Е –Є –љ–∞–±–ї—О–і–∞–µ–Љ—Л—Е —З–∞—Б—В–Њ—В –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ—А–Њ–≤–Њ–і–Є—В—Б—П —Б –њ–Њ–Љ–Њ—Й—М—О –Ї—А–Є—В–µ—А–Є—П ѕЗ2, T-–Ї—А–Є—В–µ—А–Є—П –Т–Є–ї–Ї–Њ–Ї—Б–Њ–љ–∞ вАФ
–Ь–∞–љ–љ–∞ вАФ –£–Є—В–љ–Є –Є —В–µ—Б—В–∞ –°—В—М—О–і–µ–љ—В–∞.
–†–µ–Ј—Г–ї—М—В–∞—В—Л
–•–µ–Љ–Њ—В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ—Л–є –∞–љ–∞–ї–Є–Ј —Н—Д—Д–µ–Ї—В–Њ–≤ –Љ–Њ–ї–µ–Ї—Г–ї—Л –У–° –љ–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ –ї–Є–љ–Є–Є FIBRNPC (–Є–љ–Ї—Г–±–∞—Ж–Є—П –≤ —В–µ—З–µ–љ–Є–µ 24 —З) –њ–Њ–Ї–∞–Ј–∞–ї –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –У–° –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є 6535 –Є–Ј 12 700 –∞–љ–љ–Њ—В–Є—А–Њ–≤–∞–љ–љ—Л—Е –≥–µ–љ–Њ–≤ —З–µ–ї–Њ–≤–µ–Ї–∞. –Ф–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є (p<0,05 –њ–Њ t-—В–µ—Б—В—Г, –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –±–Њ–ї–µ–µ 0,50, –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –±–Њ–ї–µ–µ 5% –љ–∞ 1 –Љ–Ї–Љ–Њ–ї—М –У–°) –±—Л–ї–Є –њ–Њ–Ї–∞–Ј–∞–љ—Л –і–ї—П 4431 –≥–µ–љ–∞: —Н–Ї—Б–њ—А–µ—Б—Б–Є—П 2634 –≥–µ–љ–Њ–≤ —Б–љ–Є–Ј–Є–ї–∞—Б—М (¬Ђ–°–њ–Є—Б–Њ–Ї-¬ї), –∞ —Н–Ї—Б–њ—А–µ—Б—Б–Є—П 1797 –≥–µ–љ–Њ–≤ –њ–Њ–≤—Л—Б–Є–ї–∞—Б—М (¬Ђ–°–њ–Є—Б–Њ–Ї+¬ї).–Т —Е–Њ–і–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Б–Є—Б—В–µ–Љ–љ–Њ-–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —Н—В–Є—Е –і–≤—Г—Е —Б–њ–Є—Б–Ї–Њ–≤ –≥–µ–љ–Њ–≤ (¬Ђ–°–њ–Є—Б–Њ–Ї-¬ї –Є ¬Ђ–°–њ–Є—Б–Њ–Ї+¬ї) –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л: —А–∞–Ј–ї–Є—З–Є—П –≤ —З–∞—Б—В–Њ—В–µ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –Ї–ї—О—З–µ–≤—Л—Е —Б–ї–Њ–≤ –≤ –Њ–њ–Є—Б–∞–љ–Є—П—Е –≥–µ–љ–Њ–≤ (–і–∞–љ–љ—Л–µ UNIPROT), —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Ї–∞—В–µ–≥–Њ—А–Є–є –≥–µ–љ–Њ–≤/–±–µ–ї–Ї–Њ–≤ –њ–Њ –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А–µ GO (Gene Ontology), –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–Њ—Д–∞–Ї—В–Њ—А–Њ–≤, –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–Є–і–∞—Е —В–Ї–∞–љ–µ–є; –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–µ —Б –≥–µ–љ–∞–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є —Н–ї–µ–Љ–µ–љ—В—Л —А–µ–∞–Ї—В–Њ–Љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞. –Ф–ї—П —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –і–µ—В–∞–ї—М–љ—Л—Е –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ—Б—В–µ–є –≤ –≥—А—Г–њ–њ–∞—Е –≥–µ–љ–Њ–≤, —Н–Ї—Б–њ—А–µ—Б—Б–Є—П –Ї–Њ—В–Њ—А—Л—Е –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ –њ–Њ–≤—Л—И–∞–ї–∞—Б—М –Є–ї–Є —Б–љ–Є–ґ–∞–ї–∞—Б—М –њ—А–Є –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –У–°, –±—Л–ї –њ—А–Њ–≤–µ–і–µ–љ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л–є —Б–Є—Б—В–µ–Љ–љ–Њ-–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –і–≤—Г—Е —Б–њ–Є—Б–Ї–Њ–≤ –≥–µ–љ–Њ–≤ (¬Ђ–°–њ–Є—Б–Њ–Ї-¬ї –Є ¬Ђ–°–њ–Є—Б–Њ–Ї+¬ї). –° –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї–∞—В–µ–≥–Њ—А–Є–є –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А—Л GO, –Њ–њ–Є—Б—Л–≤–∞—О—Й–µ–є —Д—Г–љ–Ї—Ж–Є–Є –≥–µ–љ–Њ–≤ –Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –±–µ–ї–Ї–Њ–≤, –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –њ–Њ –Љ–µ–љ—М—И–µ–є –Љ–µ—А–µ
47 –Ї–∞—В–µ–≥–Њ—А–Є–є GO, —З–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –Ї–Њ—В–Њ—А—Л—Е –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Њ—В–ї–Є—З–∞–µ—В—Б—П –Љ–µ–ґ–і—Г –і–≤—Г–Љ—П —Б–њ–Є—Б–Ї–∞–Љ–Є.
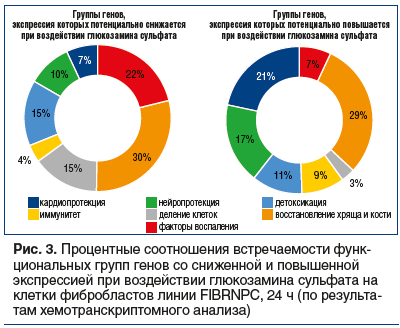
–≠–Ї—Б–њ–µ—А—В–љ—Л–є –∞–љ–∞–ї–Є–Ј, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л–є –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –∞–љ–∞–ї–Є–Ј–∞ –Ї–ї—О—З–µ–≤—Л—Е —Б–ї–Њ–≤, –њ–Њ–Ј–≤–Њ–ї–Є–ї —А—Г–±—А–Є—Ж–Є—А–Њ–≤–∞—В—М —Н—В–Є 47 –Ї–∞—В–µ–≥–Њ—А–Є–є –≤ 7 —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –≥—А—Г–њ–њ –≥–µ–љ–Њ–≤, –і–ї—П –Ї–Њ—В–Њ—А—Л—Е –Њ—В–Љ–µ—З–µ–љ—Л –≤—Л—А–∞–ґ–µ–љ–љ—Л–µ –Њ—В–ї–Є—З–Є—П –≤ —З–∞—Б—В–Њ—В–µ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є: ¬Ђ–§–∞–Ї—В–Њ—А—Л –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П¬ї, ¬Ђ–Т–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Е—А—П—Й–∞ –Є –Ї–Њ—Б—В–Є¬ї, ¬Ђ–Ф–µ–ї–µ–љ–Є–µ –Ї–ї–µ—В–Њ–Ї¬ї, ¬Ђ–Р–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–є/–∞–љ—В–Є–≤–Є—А—Г—Б–љ—Л–є –Є–Љ–Љ—Г–љ–Є—В–µ—В¬ї, ¬Ђ–Ф–µ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є—П¬ї, ¬Ђ–Э–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—Ж–Є—П¬ї –Є ¬Ђ–Ъ–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—Ж–Є—П¬ї (—В–∞–±–ї. 1). –Э–∞ —А–Є—Б—Г–љ–Ї–µ 1–∞ –Њ—В—А–∞–ґ–µ–љ—Л –њ—А–Њ—Д–Є–ї–Є —З–∞—Б—В–Њ—В –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –≥–µ–љ–Њ–≤ —Н—В–Є—Е 7 —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –≥—А—Г–њ–њ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є (–љ–∞ 1 –Љ–Ї–Љ–Њ–ї—М –У–°).

–Э–∞ —А–Є—Б—Г–љ–Ї–µ 2 –Њ—В—А–∞–ґ–µ–љ—Л —З–Є—Б–ї–∞ –≥–µ–љ–Њ–≤ ¬Ђn-¬ї –Є ¬Ђn+¬ї, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ –Ї–∞—В–µ–≥–Њ—А–Є—П–Љ –≥–µ–љ–Њ–≤, –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–Љ –≤ —В–∞–±–ї–Є—Ж–µ 1. –Р–љ–∞–ї–Є–Ј –ї–Є–љ–µ–є–љ—Л—Е –∞–њ–њ—А–Њ–Ї—Б–Є–Љ–∞—Ж–Є–є –њ—А–Њ—Д–Є–ї–µ–є —З–∞—Б—В–Њ—В –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –≥–µ–љ–Њ–≤ 7 —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –≥—А—Г–њ–њ (—А–Є—Б. 1–±) –Є –і–∞–љ–љ—Л—Е —А–Є—Б—Г–љ–Ї–∞ 2 –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Г—В–≤–µ—А–ґ–і–∞—В—М –Њ—З–µ–≤–Є–і–љ–Њ–µ —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤ –Є–Ј –≥—А—Г–њ–њ ¬Ђ–§–∞–Ї—В–Њ—А—Л –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П¬ї –Є ¬Ђ–Ф–µ–ї–µ–љ–Є–µ –Ї–ї–µ—В–Њ–Ї¬ї. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—П –≥–µ–љ–Њ–≤ –Є–Ј –≥—А—Г–њ–њ ¬Ђ–Р–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–є/–∞–љ—В–Є–≤–Є—А—Г—Б–љ—Л–є –Є–Љ–Љ—Г–љ–Є—В–µ—В¬ї, ¬Ђ–Ф–µ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є—П¬ї, ¬Ђ–Э–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—Ж–Є—П¬ї –Є ¬Ђ–Ъ–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—Ж–Є—П¬ї —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є –≤–Њ–Ј—А–∞—Б—В–∞–µ—В.

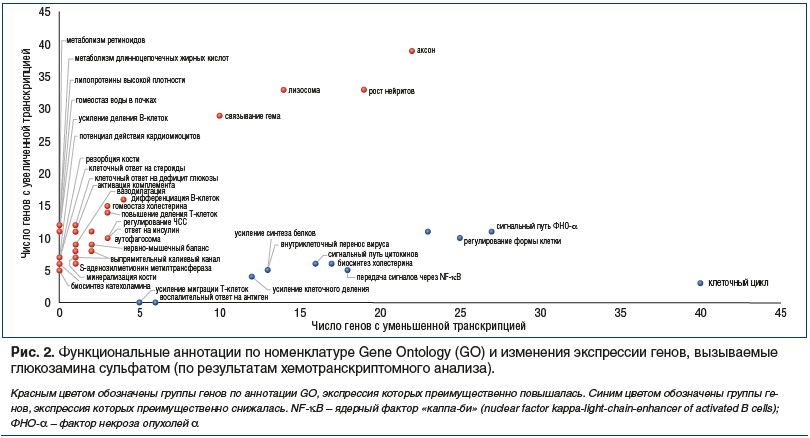
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≥–µ–љ—Л, —Н–Ї—Б–њ—А–µ—Б—Б–Є—П –Ї–Њ—В–Њ—А—Л—Е –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –њ—А–Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є –У–°, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Њ—В–ї–Є—З–∞—О—В—Б—П –њ–Њ —Б–≤–Њ–Є–Љ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Д—Г–љ–Ї—Ж–Є—П–Љ –Њ—В –≥–µ–љ–Њ–≤, —Н–Ї—Б–њ—А–µ—Б—Б–Є—П –Ї–Њ—В–Њ—А—Л—Е –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ –њ–Њ–љ–Є–ґ–∞–µ—В—Б—П (—А–Є—Б. 1, 3, —В–∞–±–ї. 1). –Э–∞ –љ–∞—И –≤–Ј–≥–ї—П–і, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –Є–Љ–µ—О—В –≤–∞–ґ–љ—Г—О —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є—О.
–Э–∞–Љ–Є –±—Л–ї–Є –њ—А–Є–Љ–µ–љ–µ–љ—Л –Є –њ—А–Њ—З–Є–µ –њ–Њ–і—Е–Њ–і—Л –Ї —Б–Є—Б—В–µ–Љ–љ–Њ-–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ—Г –∞–љ–∞–ї–Є–Ј—Г –і–≤—Г—Е –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —Б–њ–Є—Б–Ї–Њ–≤ –≥–µ–љ–Њ–≤ (¬Ђ–°–њ–Є—Б–Њ–Ї-¬ї –Є ¬Ђ–°–њ–Є—Б–Њ–Ї+¬ї), –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є –њ—А–Є–≤–µ–і–µ–љ–љ—Л–µ –≤—Л—И–µ –≤—Л–≤–Њ–і—Л –Њ–± –Њ–±—Й–µ–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –У–°. –Э–∞–њ—А–Є–Љ–µ—А, –∞–љ–∞–ї–Є–Ј –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –±–µ–ї–Ї–Њ–≤—Л—Е –Ї–Њ—Д–∞–Ї—В–Њ—А–Њ–≤ –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –У–° —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–Љ—Г –њ–Њ–≤—Л—И–µ–љ–Є—О —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –Ї–Њ–і–Є—А—Г—О—В –±–µ–ї–Ї–Є —Б —В–∞–Ї–Є–Љ–Є –Ї–Њ—Д–∞–Ї—В–Њ—А–∞–Љ–Є, –Ї–∞–Ї –≥–µ–Љ (64 –≥–µ–љ–∞, p=5,58√Ч10вАУ5), —Д–ї–∞–≤–Є–љ–∞–і–µ–љ–Є–љ–і–Є–љ—Г–Ї–ї–µ–Њ—В–Є–і (69 –≥–µ–љ–Њ–≤, p=0,005949) –Є –Є–Њ–љ Mg2+ (232 –≥–µ–љ–∞, p=0,046239). –Т—Б–µ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ –Ї–Њ—Д–∞–Ї—В–Њ—А—Л –Є–≥—А–∞—О—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –і—Л—Е–∞–љ–Є—П –Є —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ –Є –і—А—Г–≥–Є—Е –≤–Є–і–Њ–≤ –Ї–ї–µ—В–Њ–Ї.
–§–Є–±—А–Њ–±–ї–∞—Б—В—Л —Б–Є–љ—В–µ–Ј–Є—А—Г—О—В —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ—В–Ї–∞–љ–љ—Г—О –Њ—Б–љ–Њ–≤—Г —А–∞–Ј–ї–Є—З–љ—Л—Е —В–Ї–∞–љ–µ–є –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤–Њ –≤—Б–µ—Е —В–Ї–∞–љ—П—Е. –Р–љ–∞–ї–Є–Ј –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–Є–і–∞—Е —В–Ї–∞–љ–µ–є –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В, —З—В–Њ –У–° —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—О –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ ¬Ђ—Н–љ–µ—А–≥–Њ–µ–Љ–Ї–Є—Е¬ї —В–Ї–∞–љ–µ–є. –Я—А–Њ–≤–µ–і–µ–љ–љ—Л–є –љ–∞–Љ–Є –∞–љ–∞–ї–Є–Ј –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –У–° —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–Љ—Г –њ–Њ–≤—Л—И–µ–љ–Є—О —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤ –≤ –≥–Њ–ї–Њ–≤–љ–Њ–Љ –Љ–Њ–Ј–≥–µ (458 –≥–µ–љ–Њ–≤, p=3,04√Ч10вАУ5), –њ–µ—З–µ–љ–Є (345 –≥–µ–љ–Њ–≤, p=0,00259), –њ–Њ—З–Ї–∞—Е (363 –≥–µ–љ–∞, p=1,35√Ч10вАУ5), –Љ—Л—И—Ж–∞—Е (314 –≥–µ–љ–Њ–≤, p=0,054343), –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–∞—Е (45 –≥–µ–љ–Њ–≤, p=0,00177) –Є —Б–µ—В—З–∞—В–Ї–µ –≥–ї–∞–Ј–∞ (45 –≥–µ–љ–Њ–≤, p=0,000231), –≤ —В. —З. –≤ –Ї–ї–µ—В–Ї–∞—Е-—Д–Њ—В–Њ—А–µ—Ж–µ–њ—В–Њ—А–∞—Е (9 –≥–µ–љ–Њ–≤, p=0,00267).
–Ґ–∞–Ї–ґ–µ –Љ—Л –њ—А–Њ–≤–µ–ї–Є –∞–љ–∞–ї–Є–Ј –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —Б–њ–Є—Б–Ї–Њ–≤ –≥–µ–љ–Њ–≤ —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Њ—В–љ–Њ—И–µ–љ–Є—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е —Н—В–Є–Љ –≥–µ–љ–∞–Љ –±–µ–ї–Ї–Њ–≤ –Ї —А–∞–Ј–ї–Є—З–љ—Л–Љ –Ї–∞—Б–Ї–∞–і–∞–Љ —А–µ–∞–Ї—В–Њ–Љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞. –Р–љ–∞–ї–Є–Ј –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –У–° –њ—А–Є–≤–Њ–і–Є—В –Ї –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤, –Ї–Њ–і–Є—А—Г—О—Й–Є—Е –±–µ–ї–Ї–Є 229 –Ї–∞—Б–Ї–∞–і–Њ–≤ —А–µ–∞–Ї—В–Њ–Љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞. –Ф–µ—В–∞–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј —Б–њ–Є—Б–Ї–∞ —Н—В–Є—Е 229 –Ї–∞—Б–Ї–∞–і–Њ–≤ –њ–Њ–і—В–≤–µ—А–і–Є–ї, —З—В–Њ –У–° –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤, —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ –њ—А–Њ—Ж–µ—Б—Б–∞—Е –і–µ–ї–µ–љ–Є—П –Ї–ї–µ—В–Ї–Є –Є —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –Ф–Э–Ъ (¬Ђ–†–∞–Ј–Љ–∞—В—Л–≤–∞–љ–Є–µ –Ф–Э–Ъ¬ї, ¬Ђ–Ъ–Њ–љ–і–µ–љ—Б–∞—Ж–Є—П –њ—А–Њ–Љ–µ—В–∞—Д–∞–Ј–љ—Л—Е —Е—А–Њ–Љ–Њ—Б–Њ–Љ¬ї, ¬Ђ–£—Б—В—А–∞–љ–µ–љ–Є–µ –љ–µ–Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞—А–љ–Њ—Б—В–Є –≤ –Ф–Э–Ъ –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ MSH2: MSH3¬ї, ¬Ђ–Ъ–Њ—А—А–µ–Ї—Ж–Є—П D-–њ–µ—В–ї–µ–≤—Л—Е —Б—В—А—Г–Ї—В—Г—А –≤ –†–Э–Ъ¬ї, ¬Ђ–Ш–љ–Є—Ж–Є–Є—А–Њ–≤–∞–љ–Є–µ —А–µ–њ–ї–Є–Ї–∞—Ж–Є–Є –Ф–Э–Ъ¬ї, ¬ЂPTK6 —А–µ–≥—Г–ї–Є—А—Г–µ—В –Ї–ї–µ—В–Њ—З–љ—Л–є —Ж–Є–Ї–ї¬ї –Є –і—А.), –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—Ж–Є–µ–є (¬ЂRUNX3 —А–µ–≥—Г–ї–Є—А—Г–µ—В —Б–Є–≥–љ–∞–ї–Є–Ј–∞—Ж–Є—О WNT¬ї, ¬Ђ–Ъ–∞—В–∞–±–Њ–ї–Є–Ј–Љ —Д–µ–љ–Є–ї–∞–ї–∞–љ–Є–љ–∞ –Є —В–Є—А–Њ–Ј–Є–љ–∞¬ї, ¬Ђ–Я–µ—А–µ–і–∞—З–∞ —Б–Є–≥–љ–∞–ї–Њ–≤ MAPK6/MAPK4¬ї, ¬Ђ–Ъ–Є—Б–ї–Њ—А–Њ–і–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ–µ –њ—А–Њ–ї–Є–љ-–≥–Є–і—А–Њ–Ї—Б–Є–ї–Є—А–Њ–≤–∞–љ–Є–µ —Д–∞–Ї—В–Њ—А–∞, –Є–љ–і—Г—Ж–Є—А—Г–µ–Љ–Њ–≥–Њ –≥–Є–њ–Њ–Ї—Б–Є–µ–є¬ї, ¬ЂNRAGE —Б–Є–≥–љ–∞–ї–Є–Ј–Є—А—Г–µ—В –Њ–± –∞–њ–Њ–њ—В–Њ–Ј–µ —З–µ—А–µ–Ј JNK¬ї, ¬Ђ–¶–Є–Ї–ї –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—В—В–µ—А–∞ —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞¬ї, ¬Ђ–¶–Є–Ї–ї –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П –∞—Ж–µ—В–Є–ї—Е–Њ–ї–Є–љ–∞¬ї, ¬Ђ–¶–Є–Ї–ї –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ–∞¬ї –Є –і—А.), –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ (—Б–љ–Є–ґ–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤ –≤ —Н–ї–µ–Љ–µ–љ—В–∞—Е —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–∞ ¬ЂDectin-1 –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–∞—П –љ–µ–Ї–∞–љ–Њ–љ–Є—З–µ—Б–Ї–∞—П –њ–µ—А–µ–і–∞—З–∞ —Б–Є–≥–љ–∞–ї–Њ–≤ NF-kB¬ї, ¬ЂNIK вАФ –љ–µ–Ї–∞–љ–Њ–љ–Є—З–µ—Б–Ї–∞—П –њ–µ—А–µ–і–∞—З–∞ —Б–Є–≥–љ–∞–ї–Њ–≤ NF-kB¬ї, ¬ЂFCERI –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–ї –∞–Ї—В–Є–≤–∞—Ж–Є—О NF-kB¬ї, ¬Ђ–•–µ–Љ–Њ–Ї–Є–љ–Њ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л —Б–≤—П–Ј—Л–≤–∞—О—В —Е–µ–Љ–Њ–Ї–Є–љ—Л¬ї, ¬Ђ–Я–µ—А–µ–і–∞—З–∞ —Б–Є–≥–љ–∞–ї–Њ–≤ –Њ—В —А–µ—Ж–µ–њ—В–Њ—А–∞ TCR¬ї –Є –і—А.).
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤
–Ю–њ–Є—Б–∞–љ–љ—Л–µ –≤—Л—И–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ј–≤–Њ–ї—П—О—В —Б–і–µ–ї–∞—В—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≤–∞–ґ–љ—Л—Е –≤—Л–≤–Њ–і–Њ–≤ –Њ —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ—Л—Е —Н—Д—Д–µ–Ї—В–∞—Е –У–°. –Т–Њ-–њ–µ—А–≤—Л—Е, –У–° –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —Б–љ–Є–ґ–µ–љ–Є—О —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –≥–µ–љ–Њ–≤ –Є–Ј —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –≥—А—Г–њ–њ ¬Ђ–§–∞–Ї—В–Њ—А—Л –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П¬ї –Є ¬Ђ–Ф–µ–ї–µ–љ–Є–µ –Ї–ї–µ—В–Њ–Ї¬ї. –°–љ–Є–ґ–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤, –≤–Њ–≤–ї–µ—З–µ–љ–љ—Л—Е –≤ –њ–Њ–і–і–µ—А–ґ–Ї—Г —Д–∞–Ї—В–Њ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –Њ—З–µ–≤–Є–і–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ —Б–Є–љ–µ—А–≥–Є–і–љ–Њ —Б –Њ–њ–Є—Б–∞–љ–љ—Л–Љ —А–∞–љ–µ–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –У–° –љ–∞ –њ—А–Њ—В–µ–Њ–Љ [1, 2]. –°–љ–Є–ґ–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥—А—Г–њ–њ—Л –≥–µ–љ–Њ–≤ –њ–Њ–і —А—Г–±—А–Є–Ї–Њ–є ¬Ђ–Ф–µ–ї–µ–љ–Є–µ –Ї–ї–µ—В–Њ–Ї¬ї —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –њ–µ—А–µ—Е–Њ–і—Г –Ї–ї–µ—В–Ї–Є –≤ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Н–љ–µ—А–≥–Њ—Б–±–µ—А–µ–ґ–µ–љ–Є—П (—В. –Ї. –њ—А–Њ—Ж–µ—Б—Б—Л –і–µ–ї–µ–љ–Є—П –Ї–ї–µ—В–Њ–Ї –≤–µ—Б—М–Љ–∞ —Н–љ–µ—А–≥–Њ–µ–Љ–Ї–Є –Є –љ–∞ –Є—Е –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ —А–∞—Б—Е–Њ–і—Г–µ—В—Б—П –±√≥–ї—М—И–∞—П —З–∞—Б—В—М —Б–Є–љ—В–µ–Ј–Є—А—Г–µ–Љ–Њ–≥–Њ –≤ –Ї–ї–µ—В–Ї–µ –Р–Ґ–§). –Ю—З–µ–≤–Є–і–љ–Њ, —З—В–Њ —А–µ–ґ–Є–Љ —Н–Ї–Њ–љ–Њ–Љ–Є–Є –Р–Ґ–§ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—О —Н–љ–µ—А–≥–Њ–Њ–±–µ—Б–њ–µ—З–µ–љ–љ–Њ—Б—В–Є —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є–ї–Є –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞. –Ш–љ–∞—З–µ –≥–Њ–≤–Њ—А—П, –У–° —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–µ—А–µ—Е–Њ–і—Г –Ї–ї–µ—В–Њ–Ї –≤ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б–≤–Њ–µ–≥–Њ —А–Њ–і–∞ ¬Ђ—Б—В–∞–Ј–Є—Б–∞¬ї, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ –њ–Њ–≤—Л—И–∞–µ—В—Б—П.–Т–Њ-–≤—В–Њ—А—Л—Е, –У–° –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ–Њ–≤—Л—И–∞–µ—В —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –≥–µ–љ–Њ–≤, –≤–Њ–≤–ї–µ—З–µ–љ–љ—Л—Е –≤ —Б–Є–љ—В–µ–Ј –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ (–њ–Њ–≤—Л—И–∞–µ—В—Б—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—П 167 –≥–µ–љ–Њ–≤, —Б–љ–Є–ґ–∞–µ—В—Б—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—П 132 –≥–µ–љ–Њ–≤). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –У–° —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—О —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤, –≤–Њ–≤–ї–µ—З–µ–љ–љ—Л—Е –≤ –Љ–Є–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є—О –Ї–Њ—Б—В–Є (p=0,033717) –Є –Ї–ї–µ—В–Њ—З–љ—Л–є –Њ—В–≤–µ—В –љ–∞ —Б—В–µ—А–Њ–Є–і—Л (p=0,008095). –Я–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О —Е—А—П—Й–∞ –Є –Ї–Њ—Б—В–Є.
–Т-—В—А–µ—В—М–Є—Е, –У–° —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—О —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤ –Є–Ј —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –≥—А—Г–њ–њ ¬Ђ–Р–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–є/–∞–љ—В–Є–≤–Є—А—Г—Б–љ—Л–є –Є–Љ–Љ—Г–љ–Є—В–µ—В¬ї, ¬Ђ–Ф–µ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є—П¬ї, ¬Ђ–Э–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—Ж–Є—П¬ї –Є ¬Ђ–Ъ–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—Ж–Є—П¬ї. –Я–Њ–≤—Л—И–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є —Н—В–Є—Е –≥—А—Г–њ–њ –≥–µ–љ–Њ–≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –ґ–µ–ї–∞—В–µ–ї—М–љ—Л–Љ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ —Н—Д—Д–µ–Ї—В–∞–Љ –У–°, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –±—Л—В—М –≤–µ—Б—М–Љ–∞ –њ–Њ–ї–µ–Ј–љ—Л –≤ —В–µ—А–∞–њ–Є–Є –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є–є (–і–∞–љ–љ—Л–є –≤–Њ–њ—А–Њ—Б –±–Њ–ї–µ–µ –њ–Њ–і—А–Њ–±–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –≤ –Њ—В–і–µ–ї—М–љ–Њ–є —Б—В–∞—В—М–µ [17]).
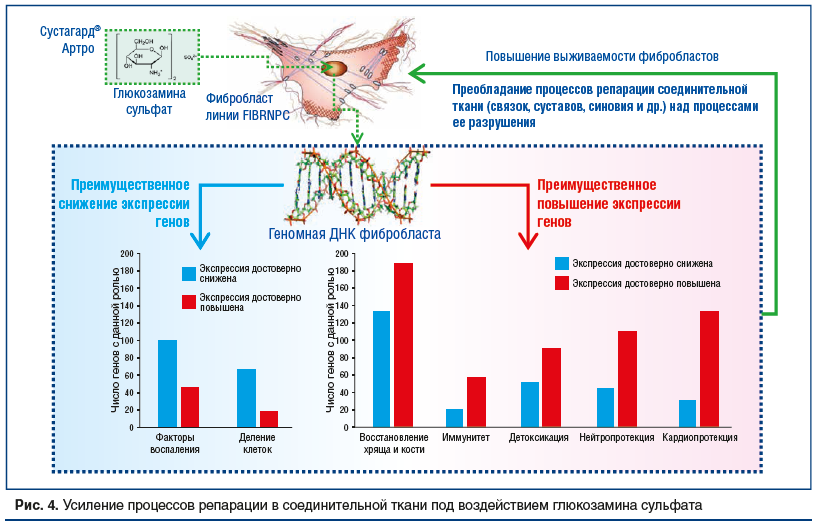
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Е–µ–Љ–Њ—В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ—Л–є –∞–љ–∞–ї–Є–Ј —Н—Д—Д–µ–Ї—В–Њ–≤ –У–° –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ —Г–Ї–∞–Ј–∞–ї –љ–∞ —Е–∞—А–∞–Ї—В–µ—А–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –≥–µ–љ–Њ–≤, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є–µ —Н–љ–µ—А–≥–Њ—Б–±–µ—А–µ–ґ–µ–љ–Є—О, –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–Љ—Г –і–µ–є—Б—В–≤–Є—О –Є –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—Ж–Є–Є. –Т–∞–ґ–љ—Л–Љ –Њ—В–ї–Є—З–Є–µ–Љ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ—В –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е —А–∞–љ–µ–µ —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–∞, –љ–∞–њ—А–Є–Љ–µ—А, —А–∞–±–Њ—В—Л J.N. Gouze et al. (2006) [18], —П–≤–ї—П–µ—В—Б—П —Г—Б–ї–Њ–≤–Є–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ –±–µ–Ј –Ї–∞–Ї–Њ–є-–ї–Є–±–Њ –≤–љ–µ—И–љ–µ–є —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є (–Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ-1 –Є —В. –њ.) –њ—А–Є —А–∞–Ј–љ—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞. –Т –љ–∞—Б—В–Њ—П—Й–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –У–° –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–∞–ї —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –≥–µ–љ–Њ–≤, —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї –њ–µ—А–µ—Е–Њ–і—Г –Ї–ї–µ—В–Ї–Є –≤ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Н–љ–µ—А–≥–Њ—Б–±–µ—А–µ–ґ–µ–љ–Є—П, –њ–Њ–≤—Л—И–∞–ї —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –≥–µ–љ–Њ–≤, –≤–Њ–≤–ї–µ—З–µ–љ–љ—Л—Е –≤ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Е—А—П—Й–∞ –Є –Ї–Њ—Б—В–Є, –Є –≤ —Ж–µ–ї–Њ–Љ –њ–Њ–≤—Л—И–∞–ї –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ (—А–Є—Б. 4).
–Т –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ —Б–ї–µ–і—Г–µ—В –Њ–±—А–∞—В–Є—В—М –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ –Њ–і–Є–љ –≤–∞–ґ–љ—Л–є –Љ–Њ–Љ–µ–љ—В. –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –њ—А–Њ—Д–Є–ї—М (–њ–∞—В—В–µ—А–љ) —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤ —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–∞ –Њ—В—А–∞–ґ–∞–µ—В —Б–Њ—Б—В–Њ—П–љ–Є–µ —Д–Є–±—А–Њ–±–ї–∞—Б—В–∞ –≤ —Ж–µ–ї–Њ–Љ. –Ф–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –њ—А–Њ—Ж–µ—Б—Б—Л —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –Є —Б–Є–≥–љ–∞–ї—М–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –≤–љ—Г—В—А–Є –ї—О–±–Њ–є –Ї–ї–µ—В–Ї–Є –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–∞–љ—Л. –° –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Є–Ј–Љ–µ–љ–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л—Е —Б–Є–≥–љ–∞–ї—М–љ—Л—Е –Ї–∞—Б–Ї–∞–і–Њ–≤ –њ—А–Є–≤–Њ–і—П—В –Ї –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ –≤ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В –Є–Ј–Љ–µ–љ–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б–Є–≥–љ–∞–ї—М–љ—Л—Е –Ї–∞—Б–Ї–∞–і–Њ–≤ [15].
–І—В–Њ –ґ–µ –Љ–Њ–ґ–µ—В —П–≤–ї—П—В—М—Б—П —Д–Є–Ј–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–µ, –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Е–µ–Љ–Њ—В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Љ–Њ–ї–µ–Ї—Г–ї—Л –У–°? –ѓ–≤–ї—П—О—В—Б—П –ї–Є –Њ–њ–Є—Б–∞–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –У–° –љ–∞ –љ–µ–Ї–Њ—В–Њ—А—Л–µ, –µ—Й–µ –љ–µ–Є–Ј–≤–µ—Б—В–љ—Л–µ, —В–∞—А–≥–µ—В–љ—Л–µ –±–µ–ї–Ї–Є, –Ї–Њ—В–Њ—А—Л–µ –≤—Л—Б—В—Г–њ–∞—О—В —Д–∞–Ї—В–Њ—А–∞–Љ–Є —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є? –Ш–ї–Є –ґ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –У–° –Њ—В—А–∞–ґ–∞—О—В –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ–Љ –У–° –љ–∞ –Њ–њ–Є—Б–∞–љ–љ—Л–µ —А–∞–љ–µ–µ —В–∞—А–≥–µ—В–љ—Л–µ –±–µ–ї–Ї–Є (—А–µ—Ж–µ–њ—В–Њ—А CD44, –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ –¶–Ю–У-2 –Є 5-–ї–Є–њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л, –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ –§–Э–Ю-ќ±, NF-kB –Є –і—А. [1])? –Ф–∞–љ–љ—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б –≤–Њ–њ—А–Њ—Б–Њ–≤ –≤–µ—Б—М–Љ–∞ —Б–ї–Њ–ґ–µ–љ –Є –љ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–і–љ–Њ–Ј–љ–∞—З–љ–Њ —А–∞–Ј—А–µ—И–µ–љ –≤ —А–∞–Љ–Ї–∞—Е –љ–∞—Б—В–Њ—П—Й–µ–є —Б—В–∞—В—М–Є.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–†–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –љ–∞–Љ–Є —Е–µ–Љ–Њ—В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Љ–Њ–ї–µ–Ї—Г–ї—Л –У–° (—П–≤–ї—П—О—Й–µ–є—Б—П –і–µ–є—Б—В–≤—Г—О—Й–Є–Љ –љ–∞—З–∞–ї–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –°—Г—Б—В–∞–≥–∞—А–і¬Ѓ –Р—А—В—А–Њ –Є–Ј —Б—Г–±—Б—В–∞–љ—Ж–Є–Є –Ї–Њ–Љ–њ–∞–љ–Є–Є ¬Ђ–С–Є–Њ–Є–±–µ—А–Є–Ї–∞ –°.–Р.–£.¬ї, –Ш—Б–њ–∞–љ–Є—П) –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤ –≤ —Д–Є–±—А–Њ–±–ї–∞—Б—В–∞—Е —З–µ–ї–Њ–≤–µ–Ї–∞ (–ї–Є–љ–Є—П FIBRNPC) —Г–Ї–∞–Ј–∞–ї–Є –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≤–∞–ґ–љ—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –Є–Ј—Г—З–∞–µ–Љ–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—Л. –У–° –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–∞–ї —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –≥–µ–љ–Њ–≤, —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї –њ–µ—А–µ—Е–Њ–і—Г –Ї–ї–µ—В–Ї–Є –≤ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Н–љ–µ—А–≥–Њ—Б–±–µ—А–µ–ґ–µ–љ–Є—П –Ј–∞ —Б—З–µ—В —Б–љ–Є–ґ–µ–љ–Є—П —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤, —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ –Ї–ї–µ—В–Њ—З–љ–Њ–Љ –і–µ–ї–µ–љ–Є–Є (–Љ–Є—В–Њ–Ј–µ), —З—В–Њ —Г–і–ї–Є–љ—П–ї–Њ –ґ–Є–Ј–љ–µ–љ–љ—Л–є —Ж–Є–Ї–ї —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤. –Ґ–∞–Ї–ґ–µ –У–° –њ–Њ–≤—Л—И–∞–ї —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –≥–µ–љ–Њ–≤, –≤–Њ–≤–ї–µ—З–µ–љ–љ—Л—Е –≤ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Е—А—П—Й–∞ –Є –Ї–Њ—Б—В–Є, –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–Љ—Г –њ–Њ–≤—Л—И–µ–љ–Є—О —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –≥—А—Г–њ–њ –≥–µ–љ–Њ–≤, –≤–Њ–≤–ї–µ—З–µ–љ–љ—Л—Е –≤ –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—Ж–Є—О (134 –≥–µ–љ–∞), –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—Ж–Є—О (110 –≥–µ–љ–Њ–≤), –і–µ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є—О (91 –≥–µ–љ) –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ –∞–љ—В–Є–≤–Є—А—Г—Б–љ–Њ–≥–Њ –Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞ (58 –≥–µ–љ–Њ–≤).–£—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –і–µ–є—Б—В–≤–Є—П –Љ–Њ–ї–µ–Ї—Г–ї—Л –У–° –љ–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—В–Њ–Љ —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ –≤–∞–ґ–љ—Л –і–ї—П –њ–Њ–љ–Є–Љ–∞–љ–Є—П –Ї–∞–Ї –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ (—Е–Њ–љ–і—А–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ–Њ–≥–Њ) –і–µ–є—Б—В–≤–Є—П –У–°, —В–∞–Ї –Є –і–ї—П –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–Є—П —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –У–° —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Б—В—А–∞–і–∞—О—Й–Є—Е –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є —Е—А—П—Й–∞, –Є –і—А—Г–≥–Є–Љ–Є –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є (–Ш–С–°, –∞—А–Є—В–Љ–Є–Є, —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П, –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–µ—З–µ–љ–Є –Є –њ–Њ—З–µ–Ї –Є –і—А.). –Ф–∞–љ–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –У–° –Є–Љ–µ—О—В –±–Њ–ї—М—И–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–Њ–Љ –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В —А–∞–Ј–ї–Є—З–љ—Л–µ –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л–µ —Б–Њ—Б—В–Њ—П–љ–Є—П, –≤–ї–Є—П—О—Й–Є–µ –љ–∞ —В–µ—З–µ–љ–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ —Б—Г—Б—В–∞–≤–µ –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є [19].
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤—Л–њ–Њ–ї–љ–µ–љ–Њ –њ—А–Є —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –њ–Њ–і–і–µ—А–ґ–Ї–µ –≥—А–∞–љ—В–∞ –†–§–§–Ш вДЦ 17-07-01419












