–Ъ–∞–ї—М—Ж–Є–є –Є –≤–Є—В–∞–Љ–Є–љ D —П–≤–ї—П—О—В—Б—П —Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ–Є —Б–Њ–µ–і–Є–љ–µ–љ–Є—П–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–љ–Є–Љ–∞—О—В —Г—З–∞—Б—В–Є–µ –≤ —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є –Љ–љ–Њ–ґ–µ—Б—В–≤–∞ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–Є—Е –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ. –Ъ–∞–ї—М—Ж–Є–є – —Н—В–Њ –Љ–∞–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В, 99% –µ–≥–Њ —Б–Њ–і–µ—А–ґ–Є—В—Б—П –≤ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –≤ —Д–Њ—А–Љ–µ –≥–Є–і—А–Њ–Ї—Б–Є–∞–њ–њ–∞—В–Є—В–∞, –∞ –Њ–Ї–Њ–ї–Њ 1% –љ–∞—Е–Њ–і–Є—В—Б—П –≤–Њ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –Є –Љ—П–≥–Ї–Є—Е —В–Ї–∞–љ—П—Е, –≥–і–µ –Ї–∞–ї—М—Ж–Є–є —Г—З–∞—Б—В–≤—Г–µ—В –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –≤–∞–ґ–љ–µ–є—И–Є—Е —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е –Њ—Б–љ–Њ–≤—Г —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ–Ї –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞. –≠—В–Є –њ—А–Њ—Ж–µ—Б—Б—Л –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Б–≤—П–Ј–∞–љ—Л —Б —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ–Є –Ї–∞–ї—М—Ж–Є–µ–≤—Л–Љ–Є –Ї–∞–љ–∞–ї–∞–Љ–Є – —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ—Л–Љ–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ–Є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ–Љ–±—А–∞–љ —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї. –Ґ–∞–Ї, —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –±–∞–ї–∞–љ—Б–Њ–Љ –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ –≤–љ—Г—В—А–Є– –Є –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Ї–∞–ї—М—Ж–Є—П, –њ—А–Є —Н—В–Њ–Љ –≤ –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є —Б —В—А–Њ–њ–Њ–љ–Є–љ–Њ–Љ –Ї–∞–ї—М—Ж–Є–є —Г—З–∞—Б—В–≤—Г–µ—В –≤ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–Є –Є —А–∞—Б—Б–ї–∞–±–ї–µ–љ–Є–Є —Б–Ї–µ–ї–µ—В–љ–Њ–є –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А—Л, –њ—А–Є–љ–Є–Љ–∞–µ—В —Г—З–∞—Б—В–Є–µ –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є —Б–µ–Ї—А–µ—Ж–Є–Є —А—П–і–∞ –Ї–ї—О—З–µ–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤, —Д–µ—А–Љ–µ–љ—В–Њ–≤ –Є –±–µ–ї–Ї–Њ–≤.
–С–∞–ї–∞–љ—Б –Ї–∞–ї—М—Ж–Є—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞–µ—В—Б—П –Є —А–µ–≥—Г–ї–Є—А—Г–µ—В—Б—П –і–≤—Г–Љ—П –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –≥–Њ—А–Љ–Њ–љ–∞–Љ–Є – –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–Њ–Љ (–∞–Ї—В–Є–≤–љ—Л–Љ –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D) –Є –њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–љ—Л–Љ –≥–Њ—А–Љ–Њ–љ–Њ–Љ (–Я–Ґ–У). –Т –Ї–Є—И–µ—З–љ–Є–Ї–µ –≤–Є—В–∞–Љ–Є–љ D –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В —А–µ–≥—Г–ї—П—Ж–Є—О –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –њ–Њ—Б—В—Г–њ–∞—О—Й–µ–≥–Њ —Б –њ–Є—Й–µ–є –Ї–∞–ї—М—Ж–Є—П – –њ—А–Њ—Ж–µ—Б—Б–∞, –њ–Њ—З—В–Є –њ–Њ–ї–љ–Њ—Б—В—М—О –Ј–∞–≤–Є—Б—П—Й–µ–≥–Њ –Њ—В –і–µ–є—Б—В–≤–Є—П —Н—В–Њ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞: –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ 1,25(–Ю–Э)2––≤–Є—В–∞–Љ–Є–љ–∞ D —Б –µ–≥–Њ —А–µ—Ж–µ–њ—В–Њ—А–Њ–Љ –њ–Њ–≤—Л—И–∞–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Є—И–µ—З–љ–Њ–є –∞–±—Б–Њ—А–±—Ж–Є–Є –Ї–∞–ї—М—Ж–Є—П –љ–∞ 30–40% [1–4]. –Т –њ–Њ—З–Ї–∞—Е, –љ–∞—А—П–і—Г —Б –і—А—Г–≥–Є–Љ–Є –≥–Њ—А–Љ–Њ–љ–∞–Љ–Є, –Њ–љ —А–µ–≥—Г–ї–Є—А—Г–µ—В —А–µ–∞–±—Б–Њ—А–±—Ж–Є—О –Ї–∞–ї—М—Ж–Є—П –≤ –њ–µ—В–ї–µ –У–µ–љ–ї–µ [5].
–С–ї–∞–≥–Њ–і–∞—А—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ –њ–Њ—Б–ї–µ–і–љ–Є—Е –ї–µ—В –Љ—Л —Е–Њ—А–Њ—И–Њ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ–Љ, —З—В–Њ –±–∞–ї–∞–љ—Б –Ї–∞–ї—М—Ж–Є—П –Є –≤–Є—В–∞–Љ–Є–љ–∞ D —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–Њ–є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Ј–і–Њ—А–Њ–≤–Њ–є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є. –Ю–і–љ–∞–Ї–Њ –Є–Љ–µ–љ–љ–Њ —Н—В–Њ—В —В–∞–љ–і–µ–Љ –і–Њ–ї–≥–Є–µ –≥–Њ–і—Л —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–Њ–є –і–ї—П —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е –≥–Є–њ–Њ—В–µ–Ј –Є –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–є –Є –Њ–± –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–Љ –≤–ї–Є—П–љ–Є–Є —Н—В–Є—Е –≤–µ—Й–µ—Б—В–≤ –љ–∞ –Њ—А–≥–∞–љ–Є–Ј–Љ. –Т—Б–µ –Љ—Л —Б–ї—Л—И–∞–ї–Є –≤–Њ–њ—А–Њ—Б—Л –Є –і–∞–ґ–µ —Г—В–≤–µ—А–ґ–і–µ–љ–Є—П, —З—В–Њ –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –њ—А–Њ–і—Г–Ї—В–Њ–≤, –±–Њ–≥–∞—В—Л—Е –Ї–∞–ї—М—Ж–Є–µ–Љ, –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Ї–∞–ї—М—Ж–Є–є –≤—Л–Ј—Л–≤–∞–µ—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –Ї–∞–Љ–љ–µ–є –≤ –њ–Њ—З–Ї–∞—Е, —Г—Е—Г–і—И–∞–µ—В —В–µ—З–µ–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –њ—А–Њ—З–Є–µ. –Ґ–∞–Ї –ї–Є —Н—В–Њ? –Ч–љ–∞—П –Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –њ–Њ–ї—М–Ј–µ —Н—В–Є—Е –љ—Г—В—А–Є–µ–љ—В–Њ–≤ –і–ї—П –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –љ–µ –љ–∞–љ–Њ—Б–Є–Љ –ї–Є –Љ—Л –≤—А–µ–і –і—А—Г–≥–Є–Љ –Њ—А–≥–∞–љ–∞–Љ –Є —Б–Є—Б—В–µ–Љ–∞–Љ –њ—А–Є –Є—Е –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є?
–Ч–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –±—Л–ї–Њ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–Њ –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –љ–∞—Г—З–љ—Л—Е —А–∞–±–Њ—В, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –Є–Ј—Г—З–µ–љ–Є—О –≤–ї–Є—П–љ–Є—П –Ї–∞–ї—М—Ж–Є—П –Є –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л–µ –Њ—А–≥–∞–љ—Л –Є —Б–Є—Б—В–µ–Љ—Л, –∞ —В–∞–Ї–ґ–µ –љ–∞ —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Є –њ—А–Њ–≥–љ–Њ–Ј –Љ–љ–Њ–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ–Њ–Ї–∞–Ј–∞–≤—И–Є–µ, —З—В–Њ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —В–Ї–∞–љ–µ–є –Є –Ї–ї–µ—В–Њ–Ї –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –µ—Б—В—М —А–µ—Ж–µ–њ—В–Њ—А—Л –Ї –≤–Є—В–∞–Љ–Є–љ—Г D –Є —А—П–і –Є–Ј –љ–Є—Е –Њ–±–ї–∞–і–∞–µ—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –Ї –њ—А–µ–≤—А–∞—Й–µ–љ–Є—О –њ–µ—А–≤–Є—З–љ–Њ–є —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–µ–є —Д–Њ—А–Љ—Л –≤–Є—В–∞–Љ–Є–љ–∞ D – 25(–Ю–Э)––≤–Є—В–∞–Љ–Є–љ–∞ D –≤ –∞–Ї—В–Є–≤–љ—Г—О —Д–Њ—А–Љ—Г 1,25(–Ю–Э)2––≤–Є—В–∞–Љ–Є–љ D (–Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї, D––≥–Њ—А–Љ–Њ–љ), –Њ—В–Ї—А—Л–ї–Є –љ–Њ–≤—Л–є –≤–Ј–≥–ї—П–і –љ–∞ —Д—Г–љ–Ї—Ж–Є–Є —Н—В–Є—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є [6].
–Ш—Б—В–Њ—З–љ–Є–Ї–Є –Ї–∞–ї—М—Ж–Є—П –Є –≤–Є—В–∞–Љ–Є–љ–∞ D
–≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ
–Ю–±–∞ —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –≤–µ—Й–µ—Б—В–≤–∞ –њ–Њ—Б—В—Г–њ–∞—О—В –≤ –љ–∞—И –Њ—А–≥–∞–љ–Є–Ј–Љ –Є–Ј –≤–љ–µ—И–љ–µ–≥–Њ –Љ–Є—А–∞, –љ–Њ —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –њ—Г—В—П–Љ–Є. –Х–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –Ї–∞–ї—М—Ж–Є—П —П–≤–ї—П–µ—В—Б—П –њ–Є—Й–∞. –Я—А–Є —Н—В–Њ–Љ –љ–∞–Є–±–Њ–ї–µ–µ –±–Њ–≥–∞—В—Л –Є–Љ –Љ–Њ–ї–Њ—З–љ—Л–µ –њ—А–Њ–і—Г–Ї—В—Л, —А—Л–±–∞ (–≤—П–ї–µ–љ–∞—П, –Ї–Њ–љ—Б–µ—А–≤—Л), –Њ—А–µ—Е–Є, —Б—Г—Е–Њ—Д—А—Г–Ї—В—Л, –Ј–µ–ї–µ–љ—М. –Ю–і–љ–∞–Ї–Њ –Є–Ј –њ–Њ—Б—В—Г–њ–∞—О—Й–µ–≥–Њ —Б –њ–Є—Й–µ–є –Ї–∞–ї—М—Ж–Є—П —Г –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П –Љ–µ–љ—М—И–µ –њ–Њ–ї–Њ–≤–Є–љ—Л. –£ –і–µ—В–µ–є –≤ –њ–µ—А–Є–Њ–і –±—Л—Б—В—А–Њ–≥–Њ —А–Њ—Б—В–∞, –Ї–∞–Ї –Є —Г –ґ–µ–љ—Й–Є–љ –њ—А–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Є –ї–∞–Ї—В–∞—Ж–Є–Є, –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П, –∞ —Г –њ–Њ–ґ–Є–ї—Л—Е –ї—О–і–µ–є —Б–љ–Є–ґ–∞–µ—В—Б—П. –≠—В–Њ—В –њ—А–Њ—Ж–µ—Б—Б –љ–∞—Е–Њ–і–Є—В—Б—П –њ–Њ–ї–љ–Њ—Б—В—М—О –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–ї–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П —Б –њ–Є—Й–µ–є. –Т–Њ –≤—Б–µ–Љ –Љ–Є—А–µ –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л —А–µ–∞–ї—М–љ–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П —Б –њ–Є—Й–µ–є —Б–љ–Є–ґ–∞–µ—В—Б—П: –љ–∞–њ—А–Є–Љ–µ—А, –≤ –°–®–Р –Њ–љ–Њ —Г–Љ–µ–љ—М—И–Є–ї–Њ—Б—М —Б 840 –Љ–≥ –≤ 1977 –≥–Њ–і—Г –і–Њ 634 –Љ–≥ –≤ 1992 –≥–Њ–і—Г [7]. –Я—А–Є –Є–Ј—Г—З–µ–љ–Є–Є –њ–Њ–њ—Г–ї—П—Ж–Є–Є —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ —Б—А–µ–і–љ–µ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –µ–≥–Њ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 705±208 –Љ–≥ [8]. –Т –†–Њ—Б—Б–Є–є—Б–Ї–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е [9] –њ—А–Є–≤–Њ–і—П—В—Б—П –љ–Њ—А–Љ—Л –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –Ї–∞–ї—М—Ж–Є—П –≤ —А–∞–Ј–ї–Є—З–љ—Л–µ –њ–µ—А–Є–Њ–і—Л –ґ–Є–Ј–љ–Є (—В–∞–±–ї. 1). –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є –Њ—Д–Є—Ж–Є–∞–ї—М–љ–Њ —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л –љ–Њ—А–Љ—Л —В–Њ–ї—М–Ї–Њ –і–ї—П –і–µ—В–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –і–Њ 2–—Е –ї–µ—В.
–Ю—Б–љ–Њ–≤–љ–∞—П —З–∞—Б—В—М –≤–Є—В–∞–Љ–Є–љ–∞ D –њ–Њ—Б—В—Г–њ–∞–µ—В –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ –њ—Г—В–µ–Љ —Б–Є–љ—В–µ–Ј–∞ –≤ –Ї–Њ–ґ–µ –њ—А–Є —Г–ї—М—В—А–∞—Д–Є–Њ–ї–µ—В–Њ–≤–Њ–Љ –Њ–±–ї—Г—З–µ–љ–Є–Є (–£–§–Ю). –Ш–Ј—Г—З–µ–љ–Є–µ —Б–≤—П–Ј–Є —Б–Њ–ї–љ–µ—З–љ–Њ–≥–Њ –Є–Ј–ї—Г—З–µ–љ–Є—П –Є –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–∞—З–∞–ї–Њ—Б—М –≤ –°–µ–≤–µ—А–љ–Њ–є –Х–≤—А–Њ–њ–µ. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ —Б–Њ–ї–љ–µ—З–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є–≤–Њ–і–Є—В –Ї —Н–њ–Є–і–µ–Љ–Є–Є —А–∞—Е–Є—В–∞ —Б —В—П–ґ–µ–ї—Л–Љ–Є –Ј–∞–і–µ—А–ґ–Ї–∞–Љ–Є —А–Њ—Б—В–∞ –Є –Ї–Њ—Б—В–љ—Л–Љ–Є –і–µ—Д–Њ—А–Љ–∞—Ж–Є—П–Љ–Є [10]. –Т 1919 –≥–Њ–і—Г Huldschinsky —Б–Њ–Њ–±—Й–Є–ї –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П —А–∞—Е–Є—В–∞ —Г–ї—М—В—А–∞—Д–Є–Њ–ї–µ—В–Њ–≤—Л–Љ–Є –ї—Г—З–∞–Љ–Є, –∞ –≤ 1930 –≥–Њ–і—Г –±—Л–ї–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ –њ—А–Є—А–Њ–і–∞ —Н—В–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞: –њ—А–Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є —Б–Њ–ї–љ–µ—З–љ—Л—Е –ї—Г—З–µ–є –≤ –Ї–Њ–ґ–µ –Њ–±—А–∞–Ј—Г–µ—В—Б—П —Б—Г–±—Б—В–∞–љ—Ж–Є—П, –љ–∞–Ј–≤–∞–љ–љ–∞—П –≤–Є—В–∞–Љ–Є–љ–Њ–Љ D. –Ч–∞—В–µ–Љ –±—Л–ї–Є –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–љ—Л –і–≤–µ —Д–Њ—А–Љ—Л –≤–Є—В–∞–Љ–Є–љ–∞ D: D2 (—Н—А–≥–Њ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї) –Є D3 (—Е–Њ–ї–µ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї), —З—В–Њ –і–∞–ї–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤–Є—В–∞–Љ–Є–љ–∞ D –і–ї—П –Њ–±–Њ–≥–∞—Й–µ–љ–Є—П –њ—А–Њ–і—Г–Ї—В–Њ–≤ –Є –њ–Њ–ї—Г—З–µ–љ–Є—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –° —В–µ—Е –њ–Њ—А –њ—А–Њ–±–ї–µ–Љ–∞ —А–∞—Е–Є—В–∞ –Ї–∞–Ј–∞–ї–∞—Б—М —А–µ—И–µ–љ–љ–Њ–є. –Ю–і–љ–∞–Ї–Њ —Б–њ—Г—Б—В—П –≥–Њ–і—Л —Б—В–∞–ї–Њ –њ–Њ–љ—П—В–љ–Њ, —З—В–Њ —А–∞—Е–Є—В – —Н—В–Њ —В–Њ–ї—М–Ї–Њ –≤–µ—А—Е—Г—И–Ї–∞ –∞–є—Б–±–µ—А–≥–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л—Е –љ–µ—Е–≤–∞—В–Ї–Њ–є –і–∞–љ–љ–Њ–≥–Њ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П.
–Ш—В–∞–Ї, —З–µ–ї–Њ–≤–µ–Ї –њ–Њ–ї—Г—З–∞–µ—В –≤–Є—В–∞–Љ–Є–љ D –њ—А–Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є —Б–Њ–ї–љ–µ—З–љ—Л—Е –ї—Г—З–µ–є, –љ–µ–±–Њ–ї—М—И—Г—О —З–∞—Б—В—М – —Б –њ–Є—Й–µ–є, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ [1–3,11]. –£–ї—М—В—А–∞—Д–Є–Њ–ї–µ—В–Њ–≤—Л–µ –≤–Њ–ї–љ—Л –Т –і–ї–Є–љ–Њ–є 290–315 –љ–Љ –њ—А–Є –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–Є –≤ –Ї–Њ–ґ—Г –њ—А–µ–≤—А–∞—Й–∞—О—В 7––і–µ–≥–Є–і—А–Њ—Е–Њ–ї–µ—Б—В–µ—А–Њ–ї –≤ –њ—А–Њ–≤–Є—В–∞–Љ–Є–љ D3, –Ї–Њ—В–Њ—А—Л–є –±—Л—Б—В—А–Њ –Ї–Њ–љ–≤–µ—А—В–Є—А—Г–µ—В—Б—П –≤ –≤–Є—В–∞–Љ–Є–љ D3. –Я—А–Є —Н—В–Њ–Љ –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є, —Б–≤—П–Ј–∞–љ–љ–Њ–є —Б –Є–Ј–±—Л—В–Ї–Њ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D –њ—А–Є –Ј–∞–≥–∞—А–µ, –љ–µ –±—Л–≤–∞–µ—В, —В.–Ї. –њ—А–Є –њ—А–µ–≤—Л—И–µ–љ–Є–Є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –њ—А–Њ–≤–Є—В–∞–Љ–Є–љ–∞ –Є–ї–Є –≤–Є—В–∞–Љ–Є–љ–∞ D3 –≤ –Ї–Њ–ґ–µ –Њ–љ–Є —А–∞–Ј—А—Г—И–∞—О—В—Б—П —Б–∞–Љ–Є–Љ–Є —Б–Њ–ї–љ–µ—З–љ—Л–Љ–Є –ї—Г—З–∞–Љ–Є [1]. –Ф—А—Г–≥–Є–Љ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D —П–≤–ї—П–µ—В—Б—П –њ–Є—Й–∞, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –ґ–Є—А–љ—Л–µ —Б–Њ—А—В–∞ —А—Л–±—Л, –≤—Л–ї–Њ–≤–ї–µ–љ–љ–Њ–є –≤ –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е. –°–Є–љ—В–µ–Ј –Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D —А–µ–≥—Г–ї–Є—А—Г—О—В—Б—П –Ї–∞–ї—М—Ж–Є–µ–Љ, —Д–Њ—Б—Д–Њ—А–Њ–Љ –Є –Ї–Њ—Б—В–љ—Л–Љ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–Њ–Љ. –Т–Є—В–∞–Љ–Є–љ D, —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–љ–љ—Л–є –≤ –Ї–Њ–ґ–µ –Є–ї–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л–є —Б –њ–Є—Й–µ–є, –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В—Б—П –≤ –њ–µ—З–µ–љ–Є –≤ 25(–Ю–Э)––≤–Є—В–∞–Љ–Є–љ D, —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –Є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –і–ї—П –Њ—Ж–µ–љ–Ї–Є —Б—В–∞—В—Г—Б–∞ –њ–∞—Ж–Є–µ–љ—В–∞ –њ–Њ –≤–Є—В–∞–Љ–Є–љ—Г D.
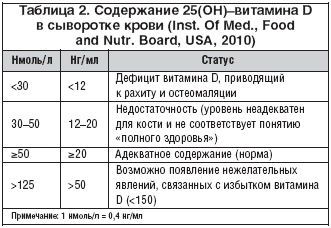
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ—В –Њ–±—Й–µ–≥–Њ –Ї–Њ–љ—Б–µ–љ—Б—Г—Б–∞ –њ–Њ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–Љ—Г —Б–Њ–і–µ—А–ґ–∞–љ–Є—О 25(–Ю–Э)––≤–Є—В–∞–Љ–Є–љ–∞ D –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, –Њ–і–љ–∞–Ї–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ–Љ —Н–Ї—Б–њ–µ—А—В–Њ–≤ (—В–∞–±–ї. 2) –і–µ—Д–Є—Ж–Є—В –µ–≥–Њ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –њ—А–Є —Г—А–Њ–≤–љ–µ –Љ–µ–љ–µ–µ 20 –љ–≥/–Љ–ї (50 –љ–Љ–Њ–ї—М/–ї) [12–15]. –Ш–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є—П –≤–Є—В–∞–Љ–Є–љ–Њ–Љ D –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Є –њ–Њ–≤—Л—И–µ–љ–Є–Є –µ–≥–Њ —Г—А–Њ–≤–љ—П –≤ –Ї—А–Њ–≤–Є –±–Њ–ї–µ–µ 150 –љ–≥/–Љ–ї (374 –љ–Љ–Њ–ї—М/–ї).
–Х—Б–ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —В–∞–Ї—Г—О –≥—А–∞–і–∞—Ж–Є—О, —В–Њ –Њ—В 40 –і–Њ 100% –њ–Њ–ґ–Є–ї—Л—Е –ї—О–і–µ–є –≤ –°–®–Р –Є –Х–≤—А–Њ–њ–µ, –њ—А–Њ–ґ–Є–≤–∞—О—Й–Є—Е –і–Њ–Љ–∞, –Є–Љ–µ—О—В –і–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D; –±–Њ–ї–µ–µ 50% –ґ–µ–љ—Й–Є–љ, –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В—Л –і–ї—П –ї–µ—З–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞, –Є–Љ–µ—О—В —Б—Г–±–Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є 25(–Ю–Э) –≤–Є—В–∞–Љ–Є–љ–∞ D, —В.–µ. –љ–Є–ґ–µ 30 –љ–≥/–Љ–ї (75 –љ–Љ–Њ–ї—М/–ї) [16,17]. –Я–Њ –і–∞–љ–љ—Л–Љ –Љ–љ–Њ–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [18–21], –і–µ—В–Є –Є –њ–Њ–і—А–Њ—Б—В–Ї–Є —В–∞–Ї–ґ–µ –Є–Љ–µ—О—В –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D –≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—В—А–∞–љ—Л –њ—А–Њ–ґ–Є–≤–∞–љ–Є—П (–і–∞–ґ–µ –њ—А–Є —Е–Њ—А–Њ—И–µ–є —Б–Њ–ї–љ–µ—З–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є). –Ґ–∞–Ї, –љ–∞–њ—А–Є–Љ–µ—А, –≤ –°–∞—Г–і–Њ–≤—Б–Ї–Њ–є –Р—А–∞–≤–Є–Є, –Ю–Р–≠, –Р–≤—Б—В—А–∞–ї–Є–Є –і–Њ 30–50% –і–µ—В–µ–є –Є–Љ–µ—О—В –і–µ—Д–Є—Ж–Є—В –і–∞–љ–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞. –®–Є—А–Њ–Ї–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ D––і–µ—Д–Є—Ж–Є—В –Є —Б—А–µ–і–Є –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –Є –Ї–Њ—А–Љ—П—Й–Є—Е –ґ–µ–љ—Й–Є–љ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б –≤–Є—В–∞–Љ–Є–љ–Њ–Љ D –Є –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Љ–Њ–ї–Њ—З–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ –Є —А—Л–±—Л: —Г 73% –ґ–µ–љ—Й–Є–љ –Є 80% –Є—Е –і–µ—В–µ–є –Њ–њ—А–µ–і–µ–ї—П–ї—Б—П –і–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–∞ –Љ–Њ–Љ–µ–љ—В —А–Њ–і–Њ–≤ [22]. –Т –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є –і–∞–љ–љ—Л–µ –њ–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—О –≤–Є—В–∞–Љ–Є–љ–∞ D —В–∞–Ї–ґ–µ –љ–µ—Г—В–µ—И–Є—В–µ–ї—М–љ—Л: —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –љ–Њ—А–Љ–∞–ї—М–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –ї–Є—И—М —Г 3,2% –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, –і–µ—Д–Є—Ж–Є—В –Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Њ—В–Љ–µ—З–∞–ї–Є—Б—М —Г 70,3% –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е [23].
–Ъ–∞–ї—М—Ж–Є–є, –≤–Є—В–∞–Љ–Є–љ D –Є –Ї–Њ—Б—В–љ–∞—П —В–Ї–∞–љ—М
–Ъ–∞–ї—М—Ж–Є–є —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є. –Ч–љ–∞—З–Є—В–µ–ї—М–љ—Л–є –і–µ—Д–Є—Ж–Є—В –Ї–∞–ї—М—Ж–Є—П –≤ –њ–Є—Й–µ –Є–ї–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –µ–≥–Њ –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –Љ–Њ–≥—Г—В –њ—А–µ–і—К—П–≤–ї—П—В—М –Ї –Ї–∞–ї—М—Ж–Є–µ–≤–Њ–Љ—Г –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј—Г —В–∞–Ї–Є–µ —В—А–µ–±–Њ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –љ–µ —Г–і–∞—Б—В—Б—П –Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞—В—М –Ј–∞–і–µ—А–ґ–Ї–Њ–є –Ї–∞–ї—М—Ж–Є—П –њ–Њ—З–Ї–∞–Љ–Є, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–Љ—Г –Ї–∞–ї—М—Ж–Є–µ–≤–Њ–Љ—Г –±–∞–ї–∞–љ—Б—Г. –Я—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П –≤–Њ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є —Б–њ–Њ—Б–Њ–±–љ–∞ —Г—Б–Є–ї–µ–љ–љ–∞—П –Ї–Њ—Б—В–љ–∞—П —А–µ–Ј–Њ—А–±—Ж–Є—П, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ–Љ –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є.
–≠—Д—Д–µ–Ї—В—Л –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–∞ –Ї–Њ—Б—В—М –Љ–љ–Њ–≥–Њ–≥—А–∞–љ–љ—Л. –Я–Њ–ї—Г—З–µ–љ—Л –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ [24–27] –љ–∞–ї–Є—З–Є—П —Г –і–∞–љ–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –∞–љ–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б–Ї–µ–ї–µ—В–∞: D––≥–Њ—А–Љ–Њ–љ —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В —Н–Ї—Б–њ—А–µ—Б—Б–Є—О —В—А–∞–љ—Б—Д–Њ—А–Љ–Є—А—Г—О—Й–µ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ —А–Њ—Б—В–∞–β –Є –Ш–§–†–2, –∞ —В–∞–Ї–ґ–µ –њ–Њ–≤—Л—И–∞–µ—В –њ–ї–Њ—В–љ–Њ—Б—В—М —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Ш–§–†–1, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –Њ—Б—В–µ–Њ–±–ї–∞—Б—В–Њ–≤ –Є –Є—Е –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї—Г. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Г—Б–Ї–Њ—А–µ–љ–Є–µ —Б–Є–љ—В–µ–Ј–∞ –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ I —В–Є–њ–∞ –Є –±–µ–ї–Ї–Њ–≤ –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ (–Њ—Б—В–µ–Њ–Ї–∞–ї—М—Ж–Є–љ–∞ –Є –Њ—Б—В–µ–Њ–њ–Њ–љ—В–Є–љ–∞), –Ї–Њ—В–Њ—А—Л–µ –Є–≥—А–∞—О—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Љ–Є–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є [28,29]. –Э–∞—А—П–і—Г —Б —Н—В–Є–Љ —Б–Є–љ—В–µ–Ј –Љ–Є–љ–Њ—А–љ–Њ–≥–Њ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D – 24,25(OH)2D –Є–Љ–µ–µ—В –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П —Г—Б–Ї–Њ—А–µ–љ–Є—П –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П –Љ–Є–Ї—А–Њ–њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є—Е –Ї–Њ—Б—В–љ—Л—Е –Љ–Њ–Ј–Њ–ї–µ–є, —З—В–Њ –њ–Њ–≤—Л—И–∞–µ—В –њ–ї–Њ—В–љ–Њ—Б—В—М –Ї–Њ—Б—В–µ–є [30]. D––≥–Њ—А–Љ–Њ–љ – –Њ–і–Є–љ –Є–Ј –Ї–ї—О—З–µ–≤—Л—Е —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –њ–∞—А–∞—В–≥–Њ—А–Љ–Њ–љ–∞ (–Я–Ґ–У), –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є–є –њ—А—П–Љ–Њ–µ —Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –µ–≥–Њ —Б–Є–љ—В–µ–Ј –Є –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ, –∞ —В–∞–Ї–ґ–µ –њ–Њ–і–∞–≤–ї—П—О—Й–Є–є –µ–≥–Њ —Н—Д—Д–µ–Ї—В—Л –љ–∞ –Ї–Њ—Б—В—М. –Я—А–Є –Ј–љ–∞—З–µ–љ–Є—П—Е 25(–Ю–Э)––≤–Є—В–∞–Љ–Є–љ D –Љ–µ–љ–µ–µ 30 –љ–≥/–Љ–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –∞–±—Б–Њ—А–±—Ж–Є–Є –Ї–∞–ї—М—Ж–Є—П –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Б–µ–Ї—А–µ—Ж–Є–Є –Я–Ґ–У [16,31,32]. –Я—А–Є —Н—В–Њ–Љ –Я–Ґ–У —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –Ї–∞–љ–∞–ї—М—Ж–Є–µ–≤—Г—О —А–µ–∞–±—Б–Њ—А–±—Ж–Є—О –Ї–∞–ї—М—Ж–Є—П –Є —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –њ—А–Њ–і—Г–Ї—Ж–Є—О –≤ –њ–Њ—З–Ї–∞—Е 1,25(–Ю–Э)––≤–Є—В–∞–Љ–Є–љ–∞ D [1–3,33], –∞ —В–∞–Ї–ґ–µ —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –Њ—Б—В–µ–Њ–±–ї–∞—Б—В—Л, –Ї–Њ—В–Њ—А—Л–µ –∞–Ї—В–Є–≤–Є—А—Г—О—В —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є—О –њ—А–µ–Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–Њ–≤ –≤ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В—Л, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Њ—Б—В–µ–Њ–њ–µ–љ–Є–Є –Є –њ–Њ–≤—Л—И–µ–љ–Є—О —А–Є—Б–Ї–∞ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ [12,13,32,34–39].
–Ф–µ—Д–Є—Ж–Є—В –Ї–∞–ї—М—Ж–Є—П –Є –≤–Є—В–∞–Љ–Є–љ–∞ D —П–≤–ї—П–µ—В—Б—П –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ [9]. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Ї–∞–ї—М—Ж–Є—П, –њ–Њ—Б—В—Г–њ–∞—О—Й–µ–≥–Њ —Б –њ–Є—Й–µ–є, —Г–Љ–µ–љ—М—И–∞–µ—В —А–Є—Б–Ї –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ [40], —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—О –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, —Г—Б–Є–ї–Є–≤–∞–µ—В –∞–љ—В–Є—А–µ–Ј–Њ—А–±—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –љ–∞ –Ї–Њ—Б—В–Є –Є —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ–Њ–є —Б–Њ—Б—В–∞–≤–љ–Њ–є —З–∞—Б—В—М—О –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ [40–45]. –Я—А–Є —Н—В–Њ–Љ –љ–Є–Ј–Ї–∞—П –∞–±—Б–Њ—А–±—Ж–Є—П –Ї–∞–ї—М—Ж–Є—П –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ –Є —Б–љ–Є–ґ–µ–љ–Є–µ –µ–≥–Њ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –∞—Б—Б–Њ—Ж–Є–Є—А—Г—О—В—Б—П —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ [40]. –Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –µ—Б–ї–Є —Г —З–µ–ї–Њ–≤–µ–Ї–∞ –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ –Є –≤ —А–∞–љ–љ–µ–Љ –і–µ—В—Б—В–≤–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –і–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D, —Н—В–Њ –Љ–Њ–ґ–µ—В –њ–Њ–≤—Л—Б–Є—В—М —А–Є—Б–Ї –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –±–µ–і—А–∞ –≤–њ–Њ—Б–ї–µ–і—Б—В–≤–Є–Є. –Я–Њ –і–∞–љ–љ—Л–Љ –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–∞ 7 —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Є–µ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D –≤ –і–Њ–Ј–µ 700–800 –Ь–Х —Б–љ–Є–ґ–∞–µ—В —А–Є—Б–Ї –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –±–µ–і—А–∞ –љ–∞ 26% (RR=0,74; 95% Cl 0,61–0,88), –∞ –љ–µ–≤–µ—А—В–µ–±—А–∞–ї—М–љ—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –љ–∞ 23% (RR=0,77; 95% Cl 0,68–0,87) [13].
–Т—Л—П–≤–ї–µ–љ–∞ –≤—Л—Б–Њ–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –Ї–∞–ї—М—Ж–Є—П –Є –≤–Є—В–∞–Љ–Є–љ–∞ D –≤ –Ј–∞–Љ–µ–і–ї–µ–љ–Є–Є —Б–Ї–Њ—А–Њ—Б—В–Є –њ–Њ—В–µ—А–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Є —Б–љ–Є–ґ–µ–љ–Є–Є —З–∞—Б—В–Њ—В—Л –њ–µ—А–µ–ї–Њ–Љ–Њ–≤. –Ґ—А–µ—Е–ї–µ—В–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П –Є –≤–Є—В–∞–Љ–Є–љ–∞ D3 —Г –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ—Л—Е –ґ–µ–љ—Й–Є–љ –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї —Б–љ–Є–ґ–µ–љ–Є—О –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ –њ–µ—А–µ–ї–Њ–Љ–∞ —И–µ–є–Ї–Є –±–µ–і—А–∞ –љ–∞ 27% (–ЮR 0,73, 95% Cl 0,23–0,99) [46]. –Т 3––ї–µ—В–љ–µ–Љ —А–Њ—Б—Б–Є–є—Б–Ї–Њ–Љ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –≤–Ї–ї—О—З–∞–≤—И–µ–Љ 350 –ґ–µ–љ—Й–Є–љ —Б—В–∞—А—И–µ 45 –ї–µ—В, –±—Л–ї–Њ –њ–Њ–ї—Г—З–µ–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П (1000 –Љ–≥/—Б—Г—В) –Є –≤–Є—В–∞–Љ–Є–љ–∞ D (400 –Ь–Х/—Б—Г—В) –Ј–∞–Љ–µ–і–ї—П–µ—В –њ–Њ—В–µ—А–Є –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л –≤ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–µ –Є —И–µ–є–Ї–µ –±–µ–і—А–∞, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–љ–Є–ґ–µ–љ–Є—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Й–µ–ї–Њ—З–љ–Њ–є —Д–Њ—Б—Д–∞—В–∞–Ј—Л –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ [47].
–Т–Є—В–∞–Љ–Є–љ D –Є –Љ—Л—И–µ—З–љ–∞—П —Б–Є—Б—В–µ–Љ–∞
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ D––≥–Њ—А–Љ–Њ–љ —А–µ–≥—Г–ї–Є—А—Г–µ—В –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –Ї–∞–ї—М—Ж–Є—П –≤ –Љ—Л—И–µ—З–љ–Њ–є —В–Ї–∞–љ–Є, –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г—П —В–µ–Љ —Б–∞–Љ—Л–Љ –∞–Ї—В —Б–Њ–Ї—А–∞—Й–µ–љ–Є—П –Є —А–∞—Б—Б–ї–∞–±–ї–µ–љ–Є—П –Љ—Л—И—Ж [48]. –°–Ї–µ–ї–µ—В–љ—Л–µ –Љ–Є–Њ—Ж–Є—В—Л —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г—О—В —А–µ—Ж–µ–њ—В–Њ—А—Л D––≥–Њ—А–Љ–Њ–љ–∞, –њ—А–Є —Н—В–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–µ –Њ—Б–ї–∞–±–ї–µ–љ–Є–µ –Љ—Л—И–µ—З–љ–Њ–є —Б–Є–ї—Л (–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –Є –њ–Њ–≤—Л—И–µ–љ–љ–∞—П —Б–Ї–ї–Њ–љ–љ–Њ—Б—В—М –Ї –њ–∞–і–µ–љ–Є—П–Љ) –Њ–±—К—П—Б–љ—П–µ—В—Б—П –Ї–∞–Ї —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –њ–ї–Њ—В–љ–Њ—Б—В–Є —Н—В–Є—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є–ї–Є –Є—Е –∞—Д—Д–Є–љ–љ–Њ—Б—В–Є, —В–∞–Ї –Є –њ–∞–і–µ–љ–Є–µ–Љ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є D––≥–Њ—А–Љ–Њ–љ–∞ –≤ –Ї—А–Њ–≤–Є [49]. –Э–∞—А—П–і—Г —Б —Н—В–Є–Љ —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –≤—Л—П–≤–ї–µ–љ–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –Љ–µ–ґ–і—Г –Љ—Л—И–µ—З–љ–Њ–є —Б–Є–ї–Њ–є –Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є D––≥–Њ—А–Љ–Њ–љ–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є [50,51]. –Ґ–∞–Ї, —Б–Ї–Њ—А–Њ—Б—В—М —Е–Њ–і—М–±—Л –Є —Б–Є–ї–∞ –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –Љ—Л—И—Ж –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –њ—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є 25(–Ю–Э)––≤–Є—В–∞–Љ–Є–љ–∞ D —Б 4 –і–Њ 16 –љ–≥/–Љ–ї –Є –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В –њ–Њ–≤—Л—И–∞—В—М—Б—П –і–Њ —Г—А–Њ–≤–љ—П –±–Њ–ї–µ–µ 40 –љ–≥/–Љ–ї. –Ь–µ—В–∞––∞–љ–∞–ї–Є–Ј 5 —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –≤–Є—В–∞–Љ–Є–љ–∞ D –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ —Б–љ–Є–ґ–∞–µ—В —А–Є—Б–Ї –њ–∞–і–µ–љ–Є–є –љ–∞ 22% (OR 0,78, 95% Cl 0,64–0,92) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–Є–µ–Љ–Њ–Љ —В–Њ–ї—М–Ї–Њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ї–∞–ї—М—Ж–Є—П –Є–ї–Є –њ–ї–∞—Ж–µ–±–Њ [13].
–Ъ–∞–ї—М—Ж–Є–є, –≤–Є—В–∞–Љ–Є–љ D
–Є –і—А—Г–≥–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П
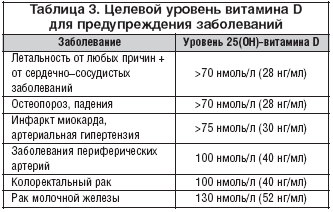
–†–µ—Ж–µ–њ—В–Њ—А—Л –Ї –∞–Ї—В–Є–≤–љ–Њ–Љ—Г –≤–Є—В–∞–Љ–Є–љ—Г D –≤—Л—П–≤–ї–µ–љ—Л –≤ –Ї–ї–µ—В–Ї–∞—Е —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤: –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, –Ї–Є—И–µ—З–љ–Є–Ї–∞, –≤ –Є–Љ–Љ—Г–љ–Њ–Ї–Њ–Љ–њ–µ—В–µ–љ—В–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е, –њ—А–Є —Н—В–Њ–Љ —А—П–і –Є–Ј –љ–Є—Е –њ—А–Њ–і—Г—Ж–Є—А—Г—О—В —Д–µ—А–Љ–µ–љ—В, —Г—З–∞—Б—В–≤—Г—О—Й–Є–є –≤ —Б–Є–љ—В–µ–Ј–µ D––≥–Њ—А–Љ–Њ–љ–∞ [1,2,11,33]. –Х—Б—В—М –і–∞–љ–љ—Л–µ –Њ –љ–∞–ї–Є—З–Є–Є —Ж–µ–ї–µ–≤—Л—Е —Г—А–Њ–≤–љ–µ–є 25(–Ю–Э)––≤–Є—В–∞–Љ–Є–љ–∞ D –і–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —А—П–і–∞ –Њ—Б–љ–Њ–≤–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —З–µ–ї–Њ–≤–µ–Ї–∞ (—В–∞–±–ї. 3). –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –љ–∞–њ—А—П–Љ—Г—О –Є–ї–Є –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ, 1,25(–Ю–Э)2––≤–Є—В–∞–Љ–Є–љ D —А–µ–≥—Г–ї–Є—А—Г–µ—В—Б—П –±–Њ–ї–µ–µ —З–µ–Љ 200 –≤–Є–і–∞–Љ–Є –≥–µ–љ–Њ–≤, –≤–Ї–ї—О—З–∞—П –≥–µ–љ—Л, –Њ—В–≤–µ—З–∞—О—Й–Є–µ –Ј–∞ –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О, –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї—Г, –∞–њ–Њ–њ—В–Њ–Ј –Є –∞–љ–≥–Є–Њ–≥–µ–љ–µ–Ј [1,11,52]. –Ф–∞–љ–љ—Л–є –≤–Є—В–∞–Љ–Є–љ —Б–љ–Є–ґ–∞–µ—В –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Є –Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї, –∞ —В–∞–Ї–ґ–µ —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –Є—Е –Ї–Њ–љ–µ—З–љ—Г—О –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї—Г [1,2,11,33,52]. –С—Л–ї–Њ –≤—Л—Б–Ї–∞–Ј–∞–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ, —З—В–Њ –µ—Б–ї–Є –Ї–ї–µ—В–Ї–∞ –Љ–∞–ї–Є–≥–љ–Є–Ј–Є—А—Г–µ—В—Б—П, 1,25(–Ю–Э)2––≤–Є—В–∞–Љ–Є–љ D –Љ–Њ–ґ–µ—В –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞—В—М –∞–њ–Њ–њ—В–Њ–Ј –Є –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—В—М –∞–љ–≥–Є–Њ–≥–µ–љ–µ–Ј, —В–µ–Љ —Б–∞–Љ—Л–Љ —Б–љ–Є–ґ–∞—П –µ–µ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М [1,2,12,53].
–Ш–љ—В–µ—А–µ—Б–љ–Њ, —З—В–Њ –ї—О–і–Є, –ґ–Є–≤—Г—Й–Є–µ –љ–∞ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є—Е —И–Є—А–Њ—В–∞—Е, –Є–Љ–µ—О—В –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —А–Є—Б–Ї –ї–Є–Љ—Д–Њ–Љ –•–Њ–і–ґ–Ї–Є–љ–∞, –∞ —В–∞–Ї–ґ–µ —А–∞–Ї–∞ –Ї–Є—И–µ—З–љ–Є–Ї–∞, –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є, –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є, –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј, —А–∞–Ї–∞ —П–Є—З–љ–Є–Ї–Њ–≤ –Є –Њ–њ—Г—Е–Њ–ї–µ–є –і—А—Г–≥–Є—Е –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –ї—О–і—М–Љ–Є, –ґ–Є–≤—Г—Й–Є–Љ–Є –љ–∞ –љ–Є–Ј–Ї–Є—Е —И–Є—А–Њ—В–∞—Е. –Я—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ –Є —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)––≤–Є—В–∞–Љ–Є–љ–∞ D –Љ–µ–љ–µ–µ 20 –љ–≥/–Љ–ї –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є —А–∞–Ї–Њ–Љ –Ї–Є—И–µ—З–љ–Є–Ї–∞, –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –Є –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј, –∞ —В–∞–Ї–ґ–µ —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О –Њ—В –љ–Є—Е [54–58].
–Р–љ–∞–ї–Є–Ј –Ї–Њ–≥–Њ—А—В—Л –Є–Ј Nurses Health Study (32 826 —З–µ–ї–Њ–≤–µ–Ї) –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ —А–Є—Б–Ї –Ї–Њ–ї–Њ—А–µ–Ї—В–∞–ї—М–љ–Њ–≥–Њ —А–∞–Ї–∞ –±—Л–ї –Њ–±—А–∞—В–љ–Њ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ —Б –Љ–µ–і–Є–∞–љ–Њ–є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П 25(–Ю–Э)––≤–Є—В–∞–Љ–Є–љ–∞ D (OR –њ—А–Є 16,2 –љ–≥/–Љ–ї –±—Л–ї —А–∞–≤–µ–љ 1,09, –∞ –њ—А–Є 39,9 –љ–≥/–Љ–ї – 0,53, —А<0,01) [57]. –£—З–∞—Б—В–љ–Є–Ї–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П Women’s Health Initiative, –Є–Љ–µ–≤—И–Є–µ –љ–∞ –љ–∞—З–∞–ї–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О 25(–Ю–Э)––≤–Є—В–∞–Љ–Є–љ–∞ D –Љ–µ–љ–µ–µ 12 –љ–≥/–Љ–ї, –Є–Љ–µ–ї–Є —А–Є—Б–Ї –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —А–∞–Ї–Њ–Љ –Ї–Є—И–µ—З–љ–Є–Ї–∞ –Ј–∞ 8––ї–µ—В–љ–Є–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П –љ–∞ 253% –≤—Л—И–µ [59]. –Я—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—О –≤–Є—В–∞–Љ–Є–љ–∞ D –Є —А–Є—Б–Ї—Г –Ї–Њ–ї–Њ—А–µ–Ї—В–∞–ї—М–љ–Њ–≥–Њ —А–∞–Ї–∞ —Г 1954 –Љ—Г–ґ—З–Є–љ –њ–Њ–Ї–∞–Ј–∞–ї–Њ –њ—А—П–Љ—Г—О –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Љ–µ–ґ–і—Г –і–∞–љ–љ—Л–Љ–Є —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є–Љ–Є: RR=1,0 –њ—А–Є –њ–Њ—В—А–µ–±–ї–µ–љ–Є–Є –≤–Є—В–∞–Љ–Є–љ–∞ D –Њ—В 6 –і–Њ 94 –Ь–Х –≤ —Б—Г—В–Ї–Є, RR=0,53 – –њ—А–Є –њ–Њ—В—А–µ–±–ї–µ–љ–Є–Є 233–652 –Ь–Х –≤ —Б—Г—В–Ї–Є, p<0,05 [54]. –Ф–µ—В–Є –Є –Љ–Њ–ї–Њ–і—Л–µ –≤–Ј—А–Њ—Б–ї—Л–µ, –±–Њ–ї—М—И–µ –±—Л–≤–∞—О—Й–Є–µ –љ–∞ —Б–Њ–ї–љ—Ж–µ, –Є–Љ–µ–ї–Є –љ–∞ 40% –љ–Є–ґ–µ —А–Є—Б–Ї –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –љ–µ—Е–Њ–і–ґ–Ї–Є–љ—Б–Ї–Є—Е –ї–Є–Љ—Д–Њ–Љ –Є —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ —Б–Љ–µ—А—В–Є –Њ—В –Љ–µ–ї–∞–љ–Њ–Љ—Л –њ—А–Є –µ–µ —А–∞–Ј–≤–Є—В–Є–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–µ–Љ–Є, —Г –Ї–Њ–≥–Њ –±—Л–ї–∞ –Љ–∞–ї–∞—П —Н–Ї—Б–њ–Њ–Ј–Є—Ж–Є—П —Б–Њ–ї–љ–µ—З–љ—Л—Е –ї—Г—З–µ–є [60].
–Т–Є—В–∞–Љ–Є–љ D —П–≤–ї—П–µ—В—Б—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Л–Љ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–Љ: –Љ–Њ–љ–Њ—Ж–Є—В—Л –Є –Љ–∞–Ї—А–Њ—Д–∞–≥–Є, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–µ –ї–Є–њ–Њ–њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і—Л –Є–ї–Є –Љ–Є–Ї–Њ–±–∞–Ї—В–µ—А–Є–Є —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞, –љ–∞—Е–Њ–і—П—В—Б—П –њ–Њ–і —А–µ–≥—Г–ї—П—Ж–Є–µ–є –≥–µ–љ–Њ–≤ VDR –Є α1––≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј—Л. –Я–Њ–≤—Л—И–µ–љ–Є–µ –њ—А–Њ–і—Г–Ї—Ж–Є–Є 1,25(–Ю–Э)2––≤–Є—В–∞–Љ–Є–љ–∞ D –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–Є–љ—В–µ–Ј—Г –Ї–∞—В–µ–ї–Є—Ж–Є–і–Є–љ–∞ – –±–µ–ї–Ї–∞, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ј–∞ —А–∞–Ј—А—Г—И–µ–љ–Є–µ –Љ–Є–Ї–Њ–±–∞–Ї—В–µ—А–Є–є —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ –Є –і—А—Г–≥–Є—Е –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –∞–≥–µ–љ—В–Њ–≤. –Ъ–Њ–≥–і–∞ —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)––≤–Є—В–∞–Љ–Є–љ–∞ D –Љ–µ–љ–µ–µ 20 –љ–≥/–Љ–ї, –і–∞–љ–љ—Л–є –Є–Љ–Љ—Г–љ–љ—Л–є –Њ—В–≤–µ—В –љ–µ –Є–љ–Є—Ж–Є–Є—А—Г–µ—В—Б—П. –≠—В–Њ –Њ–±—К—П—Б–љ—П–µ—В —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –∞–Љ–µ—А–Є–Ї–∞–љ—Ж—Л –љ–µ–≥—А–Њ–Є–і–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П —З–∞—Й–µ –Є–Љ–µ—О—В –і–µ—Д–Є—Ж–Є—В –њ–Њ –≤–Є—В–∞–Љ–Є–љ—Г D, –±–Њ–ї–µ–µ –њ–Њ–і–≤–µ—А–ґ–µ–љ—Л —В—Г–±–µ—А–Ї—Г–ї–µ–Ј—Г –Є –Є–Љ–µ—О—В –±–Њ–ї–µ–µ –∞–≥—А–µ—Б—Б–Є–≤–љ—Л–µ —Д–Њ—А–Љ—Л –і–∞–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [61].
–Я–Њ–ї—Г—З–µ–љ—Л —В–∞–Ї–ґ–µ –і–∞–љ–љ—Л–µ –Њ —В–Њ–Љ, —З—В–Њ –і–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї —В–∞–Ї–Є—Е –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Ї–∞–Ї –±–Њ–ї–µ–Ј–љ—М –Ъ—А–Њ–љ–∞, –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–є —Б–Ї–ї–µ—А–Њ–Ј, —Б–Є—Б—В–µ–Љ–љ–∞—П –Ї—А–∞—Б–љ–∞—П –≤–Њ–ї—З–∞–љ–Ї–∞, —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є –∞—А—В—А–Є—В (–†–Р) [62]. –С–Њ–ї–µ–Ј–љ—М –Ъ—А–Њ–љ–∞ —З–∞—Й–µ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –њ—А–Є –њ—А–Њ–ґ–Є–≤–∞–љ–Є–Є –ї—О–і–µ–є –≤ —Б–µ–≤–µ—А–љ—Л—Е —И–Є—А–Њ—В–∞—Е [63–65], –њ—А–Є —Н—В–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤—И–Є–µ –Є–Љ–µ–ї–Є –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)––≤–Є—В–∞–Љ–Є–љ–∞ D [66,67]. –Я–Њ–і–Њ–±–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–ї—Г—З–µ–љ—Л –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —Б–Є—Б—В–µ–Љ–љ–Њ–є –Ї—А–∞—Б–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–Є (–°–Ъ–Т): –≤ –°–®–Р –∞—Д—А–Њ–∞–Љ–µ—А–Є–Ї–∞–љ—Ж—Л –Є–Љ–µ—О—В –≤ —В—А–Є —А–∞–Ј–∞ –±–Њ–ї—М—И–Є–є —А–Є—Б–Ї –і–∞–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —З–µ–Љ –ї—О–і–Є –±–µ–ї–Њ–є —А–∞—Б—Л, –Њ–љ–Њ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤ –±–Њ–ї–µ–µ –Љ–Њ–ї–Њ–і–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –Є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –±–Њ–ї—М—И–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О. –Я—А–Є —Н—В–Њ–Љ –і–∞–љ–љ—Л–є —Д–∞–Ї—В –љ–µ–ї—М–Ј—П –Њ–±—К—П—Б–љ–Є—В—М –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є, —В–∞–Ї –Ї–∞–Ї –°–Ъ–Т –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Г –ґ–Є—В–µ–ї–µ–є –Ч–∞–њ–∞–і–љ–Њ–є –Р—Д—А–Є–Ї–Є [68]. –°—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ъ–Т —В–∞–Ї–ґ–µ –≤—Л—П–≤–ї–µ–љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –≤–Є—В–∞–Љ–Є–љ–∞ D –Ї–∞–Ї —Г –≤–љ–Њ–≤—М –Ј–∞–±–Њ–ї–µ–≤—И–Є—Е, —В–∞–Ї –Є —Г –і–ї–Є—В–µ–ї—М–љ–Њ –±–Њ–ї–µ—О—Й–Є—Е [69–72]. –Э–Є–Ј–Ї–Є–µ —Г—А–Њ–≤–љ–Є 1,25 (–Ю–Э)2––≤–Є—В–∞–Љ–Є–љ–∞ D –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ—Л —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–≥–Њ –∞—А—В—А–Є—В–∞. –≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ –±–Њ–ї–µ–µ 60% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –†–Р –Є–Љ–µ—О—В —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)––≤–Є—В–∞–Љ–Є–љ–∞ D –Љ–µ–љ–µ–µ 50 –љ–Љ–Њ–ї—М/–ї –Є 16% – –Љ–µ–љ–µ–µ 12,5 –љ–Љ–Њ–ї—М/–ї [73].
–Э–µ—Б–Ї–Њ–ї—М–Ї–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞ (–°–Ф) 1 —В–Є–њ–∞ —Г –і–µ—В–µ–є –њ—А–Є —А–µ–≥—Г–ї—П—А–љ–Њ–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –≤–Є—В–∞–Љ–Є–љ–∞ D. –Ґ–∞–Ї, 10 366 –і–µ—В–µ–є –≤ –§–Є–љ–ї—П–љ–і–Є–Є, –њ–Њ–ї—Г—З–∞–≤—И–Є–µ 2000 –Ь–Х –µ–ґ–µ–і–љ–µ–≤–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞ –ґ–Є–Ј–љ–Є, –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –≤ —В–µ—З–µ–љ–Є–µ 31 –≥–Њ–і–∞: —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –°–Ф 1 —В–Є–њ–∞ —Г –љ–Є—Е —Б–љ–Є–Ј–Є–ї—Б—П –љ–∞ 80% (RR=0,22; 95%Cl 0,05–0,89) [74]. –°—А–µ–і–Є –і–µ—В–µ–є —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D —Н—В–Њ—В —А–Є—Б–Ї –±—Л–ї –њ–Њ–≤—Л—И–µ–љ –љ–∞ 200% (RR=3,0; 95%Cl 1,0–9,0).
–Ю—В–Љ–µ—З–µ–љ–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П –Є –≤–Є—В–∞–Љ–Є–љ–∞ D –Є –љ–∞ —В–µ—З–µ–љ–Є–µ —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞ 2 —В–Є–њ–∞ –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ [75]. –Т –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –љ–Є–Ј–Ї–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П –Њ–±—А–∞—В–љ–Њ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–Њ—Б—М —Б –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М—О –°–Ф 2 —В–Є–њ–∞ –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ, —А–Є—Б–Ї –°–Ф —Б–љ–Є–ґ–∞–ї—Б—П –љ–∞ 18% (OR=0,82, 95% Cl0,72–0,93) –њ—А–Є –≤—Л—Б–Њ–Ї–Њ–Љ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–Є –Ї–∞–ї—М—Ж–Є—П (661–1200 –Љ–≥ –≤ —Б—Г—В–Ї–Є) –њ—А–Њ—В–Є–≤ –љ–Є–Ј–Ї–Њ–≥–Њ (219–660 –Љ–≥) [76,77]. –Т –і—А—Г–≥–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –і–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D –њ–Њ–≤—Л—И–∞–ї –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М, —Б–љ–Є–ґ–∞–ї –њ—А–Њ–і—Г–Ї—Ж–Є—О –Є–љ—Б—Г–ї–Є–љ–∞, —З—В–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–Њ—Б—М —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ [78] –Є –°–Ф 2 —В–Є–њ–∞ [76,79]. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ Women’s Health Initiative Study –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П –±—Л–ї–Њ –Њ–±—А–∞—В–љ–Њ –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–Њ —З–∞—Б—В–Њ—В–µ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ [79]. –Ф—А—Г–≥–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П [76] –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П 1200 –Љ–≥ –Є 800 –Ь–Х –≤–Є—В–∞–Љ–Є–љ–∞ D —Б–љ–Є–ґ–∞–ї–Њ —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –°–Ф 2 —В–Є–њ–∞ –љ–∞ 33% (RR=0,67; 95%Cl 0,49–0,90) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ–Љ –Ї–∞–ї—М—Ж–Є—П –Љ–µ–љ–µ–µ 600 –Љ–≥ –Є –≤–Є—В–∞–Љ–Є–љ–∞ D –Љ–µ–љ–µ–µ 400 –Ь–Х.
–Т —Е–Њ–і–µ —А—П–і–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [80,81] –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–Њ–ґ–Є–≤–∞–љ–Є–µ –љ–∞ –±–Њ–ї–µ–µ —Б–µ–≤–µ—А–љ—Л—Е —И–Є—А–Њ—В–∞—Е –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є –Є –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ —Г–ї—М—В—А–∞—Д–Є–Њ–ї–µ—В–Њ–≤—Л–Љ–Є –ї—Г—З–∞–Љ–Є –±–Њ–ї–µ–µ 3 —А–∞–Ј –≤ –љ–µ–і–µ–ї—О –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 3 –Љ–µ—Б—П—Ж–µ–≤, —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)––≤–Є—В–∞–Љ–Є–љ–∞ D –њ–Њ–≤—Л—И–∞–ї—Б—П –њ—А–Є–Љ–µ—А–љ–Њ –љ–∞ 180%, –Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ —Б—В–∞–љ–Њ–≤–Є–ї–Њ—Б—М –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ (—Б–љ–Є–ґ–∞–ї–Њ—Б—М –Ї–∞–Ї —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ, —В–∞–Ї –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ –љ–∞ 6 –Љ–Љ —А—В.—Б—В.) [82]. –Я—А–Є —Н—В–Њ–Љ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –≤–Є—В–∞–Љ–Є–љ–∞ D —Б–≤—П–Ј–∞–љ–∞ —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Є –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, –≤–Ї–ї—О—З–∞—П –°–†–С –Є –Ш–Ы–10 [80,83]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ 1,25(–Ю–Э)2––≤–Є—В–∞–Љ–Є–љ D –Є–љ–≥–Є–±–Є—А—Г–µ—В —Б–Є–љ—В–µ–Ј —А–µ–љ–Є–љ–∞ [84].
–Ъ–∞–ї—М—Ж–Є–є –Є –Љ–Њ—З–µ–Ї–∞–Љ–µ–љ–љ–∞—П –±–Њ–ї–µ–Ј–љ—М
–Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П —Б –њ–Є—Й–µ–є –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Ї–∞–Љ–љ–µ–є –≤ –њ–Њ—З–Ї–∞—Е [85]. –Т –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –≤—Л—П–≤–ї–µ–љ–∞ –Њ–±—А–∞—В–љ–∞—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Љ–µ–ґ–і—Г –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –њ–Њ—В—А–µ–±–ї—П–µ–Љ–Њ–≥–Њ –Ї–∞–ї—М—Ж–Є—П –Є —А–Є—Б–Ї–Њ–Љ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Ї–∞–Љ–љ–µ–є. –Ґ–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤–Ї–ї—О—З–∞–≤—И–µ–≥–Њ 45 —В—Л—Б. –Љ—Г–ґ—З–Є–љ, —Б—А–µ–і–Є –ї–Є—Ж, –њ–Њ—В—А–µ–±–ї—П–≤—И–Є—Е –≤ —Б—А–µ–і–љ–µ–Љ 1326 –Љ–≥ –Ї–∞–ї—М—Ж–Є—П –≤ —Б—Г—В–Ї–Є, –Њ—В–Љ–µ—З–∞–ї—Б—П –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Ї–∞–Љ–љ–µ–є (–Ю–†=0,56 95% –Ф–Ш 0,43; 0,73, —А<0,001) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –Љ–µ–љ—М—И–µ–≥–Њ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –Ї–∞–ї—М—Ж–Є—П (516 –Љ–≥/–і–µ–љ—М) [86]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б–ї—Г—З–∞–є––Ї–Њ–љ—В—А–Њ–ї—М [87] –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –љ–Є–Ј–Ї–Њ–µ (683 –Љ–≥/—Б—Г—В–Ї–Є) –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ —П–≤–ї—П–µ—В—Б—П —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ї–∞–Љ–љ–µ–є –≤ –њ–Њ—З–Ї–∞—Е. –Я—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –Ї–∞–ї—М—Ж–Є—П, –њ–Њ –Љ–љ–µ–љ–Є—О —А—П–і–∞ –∞–≤—В–Њ—А–Њ–≤ [7,88,89], –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ–Љ –Є–Љ –Њ–Ї—Б–∞–ї–∞—В–Њ–≤ –Є —Д–Њ—Б—Д–∞—В–Њ–≤ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ, —З—В–Њ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В –Є—Е –Є–Ј–±—Л—В–Њ—З–љ—Г—О —Н–Ї—Б–Ї—А–µ—Ж–Є—О —Б –Љ–Њ—З–Њ–є, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й—Г—О –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—О –Ї–Њ–љ–Ї—А–µ–Љ–µ–љ—В–Њ–≤. –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤—Г –ґ–µ–љ—Й–Є–љ –њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ –Є—Б—Е–Њ–і–љ–Њ–Љ —Г—А–Њ–≤–љ–µ –Ї–∞–ї—М—Ж–Є—П –≤ –Ї—А–Њ–≤–Є –і–Њ–±–∞–≤–Ї–Є –Ї–∞–ї—М—Ж–Є—П –Є –≤–Є—В–∞–Љ–Є–љ–∞ D –Љ–Њ–≥—Г—В –±–µ–Ј–Њ–њ–∞—Б–љ–Њ –љ–∞–Ј–љ–∞—З–∞—В—М—Б—П –љ–∞ –љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ –і–Њ–ї–≥–Є–є —Б—А–Њ–Ї. –Я—А–Є —Н—В–Њ–Љ –µ—Б—В—М –і–∞–љ–љ—Л–µ, —З—В–Њ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –љ–∞–ї–Є—З–Є–µ–Љ –Љ–Њ—З–µ–Ї–∞–Љ–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Ж–Є—В—А–∞—В–∞ –Ї–∞–ї—М—Ж–Є—П, –љ–µ –≤–ї–Є—П—О—Й–µ–≥–Њ –љ–∞ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –љ–µ—Д—А–Њ–ї–Є—В–Є–∞–Ј–∞ [7,88,89].
–Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б
–Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б – –њ—А–µ–њ–∞—А–∞—В, —Б–Њ–і–µ—А–ґ–∞—Й–Є–є –≤ –Њ–і–љ–Њ–є —В–∞–±–ї–µ—В–Ї–µ —Н–ї–µ–Љ–µ–љ—В–∞—А–љ–Њ–≥–Њ –Ї–∞–ї—М—Ж–Є—П 500 –Љ–≥ (–≤ –≤–Є–і–µ –Ї–∞—А–±–Њ–љ–∞—В–∞ – 1312 –Љ–≥ –Є —Ж–Є—В—А–∞—В–∞ – 217 –Љ–≥), –Є –љ–∞—В–Є–≤–љ—Л–є –≤–Є—В–∞–Љ–Є–љ D (—Е–Њ–ї–µ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї) –≤ –і–Њ–Ј–µ 200 –Ь–Х. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –і–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ —П–≤–ї—П–µ—В—Б—П –љ–∞–ї–Є—З–Є–µ –≤ —Б–Њ—Б—В–∞–≤–µ –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–Њ–≤ (—Ж–Є–љ–Ї – 7,5 –Љ–≥, –Љ–µ–і—М – 1 –Љ–≥, –Љ–∞—А–≥–∞–љ–µ—Ж – 1,8 –Љ–≥, –±–Њ—А – 250 –Љ–Ї–≥, –Љ–∞–≥–љ–Є–є – 40 –Љ–≥). –Я–Њ –Љ–љ–µ–љ–Є—О —А—П–і–∞ –∞–≤—В–Њ—А–Њ–≤ [90], —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П –Є –љ–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ—Л—Е –Њ—Б—В–µ–Њ—В—А–Њ–њ–љ—Л—Е –Љ–Є–љ–µ—А–∞–ї–Њ–≤ (Zn, Cu, B, Mn) –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Г–ї—Г—З—И–∞—В—М –Ї–∞–Ї –Љ–Є–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є—О –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, —В–∞–Ї –Є –њ—А–Њ—В–µ–Є–љ–Њ–≤—Л–є –Љ–∞—В—А–Є–Ї—Б –Ї–Њ—Б—В–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≤ –њ—А–µ–њ–∞—А–∞—В–µ —Ж–Є—В—А–∞—В–љ–Њ–є —Б–Њ–ї–Є –Ї–∞–ї—М—Ж–Є—П –і–µ–ї–∞–µ—В –µ–≥–Њ –±–Њ–ї–µ–µ –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–∞–ї–Є—З–Є–µ–Љ –Љ–Њ—З–µ–Ї–∞–Љ–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є, –∞ —Б–Њ–і–µ—А–ґ–∞—Й–Є–є—Б—П –≤ –њ—А–µ–њ–∞—А–∞—В–µ –Љ–∞–≥–љ–Є–є —П–≤–ї—П–µ—В—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –њ–Њ–≤—Л—И–µ–љ–Є—П –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є –Ї–∞–ї—М—Ж–Є—П.
–Я–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –њ—А–µ–њ–∞—А–∞—В–∞ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ (—Г –ґ–µ–љ—Й–Є–љ –≤ –њ–µ—А–Є–Њ–і –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л (–µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–є –Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–є); —Г –ї–Є—Ж, –і–ї–Є—В–µ–ї—М–љ–Њ –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і—Л –Є –Є–Љ–Љ—Г–љ–Њ–і–µ–њ—А–µ—Б—Б–∞–љ—В—Л). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ї–∞–ї—М—Ж–Є—П –Є –≤–Є—В–∞–Љ–Є–љ–∞ D, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ–∞ –Р–і–≤–∞–љ—Б, —П–≤–ї—П–µ—В—Б—П –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –ї—О–±–Њ–≥–Њ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞. –Ф—А—Г–≥–Є–Љ–Є –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є —П–≤–ї—П—О—В—Б—П: —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–Њ–љ—Б–Њ–ї–Є–і–∞—Ж–Є–Є —В—А–∞–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤, –∞ —В–∞–Ї–ґ–µ –≤–Њ—Б–њ–Њ–ї–љ–µ–љ–Є–µ –і–µ—Д–Є—Ж–Є—В–∞ –Ї–∞–ї—М—Ж–Є—П –Є –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–Њ–≤ —Г –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤.
–Т –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є –±—Л–ї –њ—А–Њ–≤–µ–і–µ–љ —А—П–і –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ–∞ –Р–і–≤–∞–љ—Б —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ [91,92]. –С—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –і–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –і–Њ–Ј–µ 2 —В–∞–±–ї–µ—В–Ї–Є –≤ —Б—Г—В–Ї–Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М –Ї–Њ—Б—В–љ—Л–µ –њ–Њ—В–µ—А–Є –њ—А–Є —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є. –Ю–і–љ–∞–Ї–Њ –і–Њ–Ј–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —Г –ї–Є—Ж —Б—В–∞—А—И–µ 65 –ї–µ—В –Є –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і—Л, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D, –і–Њ–ї–ґ–љ–∞ –±—Л—В—М –љ–µ –Љ–µ–љ–µ–µ 800 –Ь–Х –≤ —Б—Г—В–Ї–Є [9,93,94,95]. –Я—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ –Р–і–≤–∞–љ—Б –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —В—А–µ–±—Г–µ–Љ–Њ–є –і–Њ–Ј–Є—А–Њ–≤–Ї–Є —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–є –њ—А–Є–µ–Љ –љ–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ D (–Њ–і–љ–∞ –Ї–∞–њ–ї—П –≤ —Б—Г—В–Ї–Є – 500 –Ь–Х).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ї–∞–ї—М—Ж–Є—П –Є –≤–Є—В–∞–Љ–Є–љ–∞ D —П–≤–ї—П–µ—В—Б—П –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–є —Б–Њ—Б—В–∞–≤–љ–Њ–є —З–∞—Б—В—М—О –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –Ї–Њ—Б—В–µ–є, –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞, –∞ —В–∞–Ї–ґ–µ –≤–∞–ґ–љ–Њ–є —Б–Њ—Б—В–∞–≤–ї—П—О—Й–µ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П —А—П–і–∞ –і—А—Г–≥–Є—Е —В—П–ґ–µ–ї—Л—Е —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Holick MF, Garabedian M. Vitamin D: photobiology, metabolism, mechanism of action, and clinical applications. In: Favus MJ, ed. Primer on the metabolic bone diseases and disorders of mineral metabolism. 6th ed. Washington, DC: American Society for Bone and Mineral Research, 2006:129-37.
2. Bouillon R. Vitamin D: from photosynthesis, metabolism, and action to clinical applications. In: DeGroot LJ, Jameson JL, eds. Endocrinology. Philadelphia: W.B.Saunders, 2001:1009-28.
3. DeLuca HF. Overview of general physiologic features and functions of vitamin D. Am J Clin Nutr 2004;80:Suppl:1689S-1696.
4. Heaney RP, Dowell MS, Hale CA, Bendich A. Calcium absorption varies within the reference range for serum 25-hydroxyvitamin D. J Am Coll Nutr 2003;22:142-6.
5. –У.–ѓ.–®–≤–∞—А—Ж- –§–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞-–Ь., –Ь–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–µ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Њ–љ–љ–Њ–µ –∞–≥–µ–љ—В—Б—В–≤–Њ,2002–≥.-—Б.239-284,315-324.
6. Holick MF. Vitamin D Deficiency. N Engl J Med 2007; 357:266-281July 19, 2007.
7. –†—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ –њ–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј—Г. –Я–Њ–і —А–µ–і. –Ы.–Ш. –С–µ–љ–µ–≤–Њ–ї–µ–љ—Б–Ї–Њ–є. –Ь.: –С–Ш–Э–Ю–Ь. –Ы–∞–±–Њ—А–∞—В–Њ—А–Є—П –Ј–љ–∞–љ–Є–є, 2003. – 524—Б., –°.263.
8. –Э.–Т.–Ґ–Њ—А–Њ–њ—Ж–Њ–≤–∞, –Ы.–Ш. –С–µ–љ–µ–≤–Њ–ї–µ–љ—Б–Ї–∞—П «–†–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—П вДЦ5», 2006.
9. –Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј: –Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Є –ї–µ—З–µ–љ–Є–µ. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ–і —А–µ–і. –Ю.–Ь. –Ы–µ—Б–љ—П–Ї, –Ы.–Ш. –С–µ–љ–µ–≤–Њ–ї–µ–љ—Б–Ї–Њ–є, 2-–µ –Є–Ј–і., –Ь.:–У–≠–Ю–Ґ–Р–†-–Ь–µ–і–Є–∞, 2008. - 272 —Б.
10. Michael F. Holick et al. Vitamin D status: Measurment, interpretation and clinical application. Ann Epidemiol. 2009 February; 19 (2): 73-78.
11. Holick MF. Resurrection of vitamin D deficiency and rickets. J Clin Invest 2006; 116:2062-72.
12. Holick MF. High prevalence of vitamin D inadequacy and implications for health. Mayo Clin Proc 2006;81:353-73.
13. Bischoff-Ferrari HA, Giovannucci E, Willett WC, Dietrich T, Dawson-Hughes B. Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiplehealth outcomes. Am J Clin Nutr 2006;84:18-28. Erratum, Am J Clin Nutr 2006;84:1253.
14. Malabanan A, Veronikis IE, Holick MF. Redefining vitamin D insufficiency. Lancet 1998;351:805-6.
15. Thomas KK, Lloyd-Jones DM, Thadhani RI, et al. Hypovitaminosis D in medical inpatients. N Engl J Med 1998;338:777- 83.
16. Holick MF, Siris ES, Binkley N, et al. Prevalence of vitamin D inadequacy among postmenopausal North American women receiving osteoporosis therapy. J Clin Endocrinol Metab 2005;90:3215-24.
17. Lips P, Hosking D, Lippuner K, et al. The prevalence of vitamin D inadequacy amongst women with osteoporosis: an international epidemiological investigation. J Intern Med 2006;260:245-54.
18. Sedrani SH. Low 25-hydroxyvitamin D and normal serum calcium concentrations in Saudi Arabia: Riyadh region. Ann Nutr Metab 1984;28:181-5.
19. Marwaha RK, Tandon N, Reddy D, et al. Vitamin D and bone mineral density status of healthy schoolchildren in northern India. Am J Clin Nutr 2005;82:477-82.
20. El-Hajj Fuleihan G, Nabulsi M, Choucair M, et al. Hypovitaminosis D in healthy schoolchildren. Pediatrics 2001;107:E53.
21. McGrath JJ, Kimlin MG, Saha S, Eyles DW, Parisi AV. Vitamin D insufficiency in south-east Queensland. Med J Aust 2001; 174:150-1.
22. Lee JM, Smith JR, Philipp BL, Chen TC, Mathieu J, Holick MF. Vitamin D deficiency in a healthy group of mothers and newborn infants. Clin Pediatr (Phila) 2007;46:42-4.
23. –Ґ–Њ—А–Њ–њ—Ж–Њ–≤–∞ –Э.–Т., –С–µ–љ–µ–≤–Њ–ї–µ–љ—Б–Ї–∞—П –Ы.–Ш. –£—А–Њ–≤–µ–љ—М –≤–Є—В–∞–Љ–Є–љ–∞ –Ф –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ // –°–±–Њ—А–љ–Є–Ї —В–µ–Ј–Є—Б–Њ–≤ 2-–≥–Њ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –Ї–Њ–љ–≥—А–µ—Б—Б–∞ –њ–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј—Г, 29 —Б–µ–љ—В—П–±—А—П – 1 –Њ–Ї—В—П–±—А—П 2005 –≥., –ѓ—А–Њ—Б–ї–∞–≤–ї—М, –°. 97-98.
24. Shiraishi A, Takeda S, Masaki T, Higuchi Y, Uchiama Y, Kubodera N, Sato K, Ikeda K, Nakamura T, Matsumoto T, Ogata E. Alfacalcidol inhibits bone resorption and stimulates formation in an ovariectomized rat model of osteoporosis: distinct action from estrogen. J Bone Miner Res 2000; 15:770-779.
25. Wong M. Raloxifene does not affect neuromuscularrelated risk factors for falling or the incidence of falls in postmenopausal women with osteoporosis. J Am Geriatr Soc 2000; 48:S44.
26. Seino Y, Ishizuka S, Shima M, Tanaka H. Vitamin D in bone formation. Osteoporos Int 1993; 3:196-198.
27. van Driel M, Pols HAP, van Leeuwen JPTM. Osteoblast differentiation and control by vitamin D and vitamin D metabolites. Curr Pharm Des 2004; 10:2535- 2555.
28. Lau KHW, Baylink DJ. Treatment of 1,25(OH)2D3(Dhormone) deficiency/resistance with D-hormone and analogs. Osteologie 2001; 10:28-39.
29. Schacht E. Rationale for treatment of involutional osteoporosis in women and for prevention and treatment of corticosteroid-induced osteoporosis with alfacalcidol. Calcif Tissue Int 1999; 65:317-327.
30. Yamato H, Okazaki R, Ishii T, Ogata E, Sato T, Kumegawa M, Akaogi K, Taniguchi N, Matsumoto T. Effect of 24R, 25-dihydroxyvitamin D3 on the formation and function of osteoclastic cells. Calcif Tissue Int 1993; 52:255-260.
31. Thomas KK, Lloyd-Jones DM, Thadhani RI, et al. Hypovitaminosis D in medical inpatients. N Engl J Med 1998;338:777- 83.
32. Chapuy MC, Preziosi P, Maamer M, et al. Prevalence of vitamin D insufficiency in an adult normal population. Osteoporos Int 1997;7:439-43.
33. Dusso AS, Brown AJ, Slatopolsky E. Vitamin D. Am J Physiol Renal Physiol 2005;289:F8-F28.
34. Boonen S, Bischoff-Ferrari HA, CooperC, et al. Addressing the musculoskeletal components of fracture risk with calcium and vitamin D: a review of the evidence. Calcif Tissue Int 2006;78:257- 70.
35. Lips P. Vitamin D deficiency and secondary hyperparathyroidism in the elderly: consequences for bone loss and fractures and therapeutic implications. Endocr Rev 2001;22:477-501.
36. Bakhtiyarova S, Lesnyak O, Kyznesova N, Blankenstein MA, Lips P. Vitamin D status among patients with hip fracture and elderly control subjects in Yekaterinburg, Russia. Osteoporos Int 2006;17:441- 6.
37. McKenna MJ. Differences in vitaminD status between countries in young adults and the elderly. Am J Med 1992;93:69-77.
38. Larsen ER, Mosekilde L, Foldspang A.Vitamin D and calcium supplementation prevents osteoporotic fractures in elderly community dwelling residents: a pragmatic population-based 3-year intervention study. J Bone Miner Res 2004;19:370-8.
39. Chapuy MC, Arlot ME, Duboeuf F, et al. Vitamin D3 and calcium to prevent hip fractures in elderly women. N Engl J Med 1992;327:1637-42.
40. Institute for Clinical Systems Improvement (ICSI) Health Care Guideline: Diagnosis and Treatment of Osteoporosis, 3rd edition, July 2004.
41. –Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј: –Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Є –ї–µ—З–µ–љ–Є–µ (–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ–і —А–µ–і. –Ы.–Ш. –С–µ–љ–µ–≤–Њ–ї–µ–љ—Б–Ї–Њ–є, –Ю.–Ь. –Ы–µ—Б–љ—П–Ї).–Ь.: –У–≠–Ю–Ґ–Р–†-–Ь–µ–і–Є–∞, 2005. - 176 —Б.
42. American association of endocrinologists (AACE) medical guidelines for the prevention and treatment of postmenopausal osteoporosis: 2001 edition, with selected updates for 2003 // Endocrine Practice, 2003, vol. 9, No 6, p. 544-564
43. Brown J.P., Josse R.G. 2002 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada. CMAJ, 2002, 167 (10 suppl) pp. S1-S34
44. Kanis J.A., Burlet N., Cooper C., Delmas P.D., Reginster J.Y., Borgstrom F., Rizzoli R. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int, 2008;19:399-428.
45. Scottish Intercollegiate Guidelines Network (SIGN) # 71: Management of osteoporosis: a national clinical guideline, June 2003. www.sign.ac.uk.
46. Chapuy M.C., Arlot M.E., Delmas P.D. Meunier P.J. Effect of calcium and cholecalciferol treatment for three years on hip fractures in elderly women. BMJ. 1994. 308:1081-1082.
47. –Ґ–Њ—А–Њ–њ—Ж–Њ–≤–∞ –Э.–Т., –Э–Є–Ї–Є—В–Є–љ—Б–Ї–∞—П –Ю.–Р., –Ф–µ–Љ–Є–љ –Э.–Т., –С–µ–љ–µ–≤–Њ–ї–µ–љ—Б–Ї–∞—П –Ы.–Ш. –Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞: —А–µ–Ј—Г–ї—М—В–∞—В—Л 3-—Е –≥–Њ–і–Є—З–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П. –Э–∞—Г—З–љ–Њ-–њ—А–∞–Ї—В–Є—З–µ—Б–Ї–∞—П —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—П, вДЦ5, 2006, –°. 25-32.
48. Boland R. Role of vitamin D in skeletal muscle function. Endocr Rev 1986; 784:434-448.
49. Bischoff HA, Borchers M, Gudat F, Duermueller U, Theiler R, Stahelin HB, Dick W. In situ detection of 1,25-dihydroxyvitamin D receptor in human skeletal muscle tissue. Histochem 2001; 33:19-24.
50. Bischoff HA, Stahelin HB, Urscheler N, Ehrsam R, Vontheim R, Perrig-Chiello P, Tyndall A, Theiler R. Muscle strength in the elderly: its relation to vitamin D metabolites. Arch Phys Med Rehabil 1999; 80:54-58.
51. Dukas L, Schacht E, Bischoff HA. Better functional mobility in community dwelling elderly is related to Dhormone serum levels and to a daily calcium intake. Accepted for publication in Journal on Nutrition, Health and Aging 2005.
52. Nagpal S, Na S, Rathnachalam R. Noncalcemic actions of vitamin D receptor ligands. Endocr Rev 2005;26:662-87.
53. Mantell DJ, Owens PE, Bundred NJ, Mawer EB, Canfield AE. 1α,25-dihydroxyvitamin D3 inhibits angiogenesis in vitro and in vivo. Circ Res 2000;87:214-20.
54. Gorham ED, Garland CF, Garland FC, et al. Vitamin D and prevention of colorectal cancer. J Steroid Biochem Mol Biol 2005; 97:179-94.
55. Giovannucci E, Liu Y, Rimm EB, et al. Prospective study of predictors of vitamin D status and cancer incidence and mortality in men. J Natl Cancer Inst 2006;98: 451-9.
56. Ahonen MH, Tenkanen L, Teppo L, Hakama M, Tuohimaa P. Prostate cancer risk and prediagnostic serum 25-hydroxyvitamin D levels (Finland). Cancer Causes Control 2000;11:847-52.
57. Feskanich D, Ma J, Fuchs CS, et al. Plasma vitamin D metabolites and risk of colorectal cancer in women. Cancer Epidemiol Biomarkers Prev 2004;13:1502-8.
58. Garland CF, Garland FC, Gorham ED, et al. The role of vitamin D in cancer prevention. Am J Public Health 2006;96:252-61.
59. Holick MF. Calcium plus vitamin D and the risk of colorectal cancer. N Engl J Med 2006;354:2287-8.
60. Berwick M, Armstrong BK, Ben-Porat L, et al. Sun exposure and mortality from melanoma. J Natl Cancer Inst 2005;97:195-9.
61. Liu PT, Stenger S, Li H, et al. Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response. Science 2006;311:1770-3.
62. ArnsonY., Amital H., Shoenfeld Y. Vitamin D and autoimmunity: new aetiological and therapeutic considerationsAnn Rheum Dis 2007;66:1137–1142. doi: 10.1136/ard.2007.069831.
63. Cantorna MT. Vitamin D and its role in immunology: multiple sclerosis, and inflammatory bowel disease. Prog Biophys Mol Biol 2006;92:60–4.
64. Podolsky DK. Inflammatory bowel disease (1). N Engl J Med 1991;325:928–37.
65. Sonnenberg A, Wasserman IH. Epidemiology of inflammatory bowel disease among U.S. military veterans. Gastroenterology 1991;101:122–30.
66. Jahnsen J, Falch JA, Mowinckel P, Aadland E. Vitamin D status, parathyroid hormone and bone mineral density in patients with inflammatory bowel disease. Scand J Gastroenterol 2002;37:192–9.
67. Lamb EJ, Wong T, Smith DJ, Simpson DE, Coakley AJ, Moniz C, et al. Metabolic bone disease is present at diagnosis in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2002;16:1895–902.
68. Alarcon GS, Friedman AW, Straaton KV, Moulds JM, Lisse J, Bastian HM, et al. Systemic lupus erythematosus in three ethnic groups: III. A comparison of characteristics early in the natural history of the LUMINA cohort. LUpus in MInority populations: NAture vs, Nurture. Lupus 1999;8:197–209.
69. Kamen DL, Cooper GS, Bouali H, Shaftman SR, Hollis BW, Gilkeson GS. Vitamin D deficiency in systemic lupus erythematosus. Autoimmun Rev 2006;5:114–7.
70. O’Regan S, Chesney RW, Hamstra A, Eisman JA, O’Gorman AM, DeLuca HF. Reduced serum 1,25-(OH)2 vitamin D3 levels in prednisone-treated adolescents with systemic lupus erythematosus. Acta Paediatr Scand 1979;68:109–11.
71. Huisman AM, White KP, Algra A, Harth M, Vieth R, Jacobs JW, et al. Vitamin D levels in women with systemic lupus erythematosus and fibromyalgia. J Rheumatol 2001;28:2535–9.
72. Muller K, Kriegbaum NJ, Baslund B, Sorensen OH, Thymann M, Bentzen K. Vitamin D3 metabolism in patients with rheumatic diseases: low serum levels of 25-hydroxyvitamin D3 in patients with systemic lupus erythematosus. Clin Rheumatol 1995;14:397–400.
73. Aguado P, del Campo MT, Garces MV, Gonzalez-Casaus ML, Bernad M, Gijon- Banos J, et al. Low vitamin D levels in outpatient postmenopausal women from a rheumatology clinic in Madrid, Spain: their relationship with bone mineral density. Osteoporos Int 2000;11:739–44.
74. Hypponen E, Laara E, Reunanen A, Jarvelin M-R, Virtanen SM. Intake of vitamin D and risk of type 1 diabetes: a birthcohort study. Lancet 2001;358:1500-3.
75. –Р.G. Pittas et al. The Role of Vitamin D and Calcium in type 2 diabetes. A systematic Review and Meta-Analysis* J Clin Endocrinol Metab. 2007 June ; 92(6): 2017–2029.
76. Pittas AG, Dawson-Hughes B, Li T, Van Dam RM, Willett WC, Manson JE, Hu FB. Vitamin D and calcium intake in relation to type 2 diabetes in women. Diabetes Care 2006;29:650–656.
77. van Dam RM, Hu FB, Rosenberg L, Krishnan S, Palmer JR. Dietary calcium and magnesium, major food sources, and risk of type 2 diabetes in U.S. black women. Diabetes Care 2006;29:2238–2243.
78. Chiu KC, Chu A, Go VLW, Saad MF. Hypovitaminosis D is associated with insulin resistance and β cell dysfunction.Am J Clin Nutr 2004;79:820-5.
79. Liu S, Song Y, Ford ES, Manson JE, Buring JE, Ridker PM. Dietary calcium, vitamin D, and the prevalence of metabolic syndrome in middle-aged and older U.S. women. Diabetes Care 2005;28:2926–2932.
80. Zittermann A. Vitamin D and disease prevention with special reference to cardiovascular disease. Prog Biophys Mol Biol 2006;92:39-48.
81. Rostand SG. Ultraviolet light may contribute to geographic and racial blood pressure differences. Hypertension 1997;30:150-6.
82. Krause R, Buhring M, Hopfenmuller W, Holick MF, Sharma AM. Ultraviolet B and blood pressure. Lancet 1998;352:709- 10.
83. Zittermann A, Schleithoff SS, Tenderich G, Berthold HK, Korfre R, Stehle P. Low vitamin D status: a contributing factor in the pathogenesis of congestive heart failure? J Am Coll Cardiol 2003;41:105-12.
84. Li YC. Vitamin D regulation of the renin- angiotensin system. J Cell Biochem 2003;88:327-31.
85. Heller HJ., The role of calcium in the prevention of kidney stones., J Am Coll Nutr. 1999 Oct;18(5 Suppl):373S-378S.
86. Curban G.C., Willett W.C., Rimm E.B. et al. A prospective study of dietary calcium and other nutrients and risk symptomatic kidney stones. New Engl.J.Med. 1993;328:833-838.
87. Hall WD, Pettinger M, Oberman A, Watts NB, Johnson KC, Paskett ED, Limacher MC, Hays J. Risk factors for kidney stones in older women in the southern United States. Am J Med Sci. 2001 Jul;322(1):12-8.
88. Sakhaee K., Poindexter J.R., Griffith C.S. –Stone forming risk of calcium citrate supplementation in healthy postmenopausal women. J.Urol. 2004;172(3):958-961.
89. Domrongkitchaiporn S. Risk of calcium oxalate nephrolithiasis after calcium or combined calcium and calcitriol supplementation in postmenopausal women. Osteoporosis Int. 2000;11(6):486-492.
90. Saltman PD, Strause LG. The role of trace minerals in osteoporosis. J Am Coll Nutr. 1993 Aug;12(4):384-9.
91. –Э–Є–Ї–Є—В–Є–љ—Б–Ї–∞—П –Ю.–Р., –Ґ–Њ—А–Њ–њ—Ж–Њ–≤–∞ –Э.–Т., –С–µ–љ–µ–≤–Њ–ї–µ–љ—Б–Ї–∞—П –Ы.–Ш. –§–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞. –†–Ь–Ц, 2008, —В–Њ–Љ 16, вДЦ6: 55-60.
92. –Ы–Є–ї–∞ –Р.–Ь., –Ь–∞–Ј—Г—А–Њ–≤ –Т.–Ш. –†–Њ–ї—М –Ъ–∞–ї—М—Ж–µ–Љ–Є–љ–∞ –Р–і–≤–∞–љ—Б –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ (—А–µ–Ј—Г–ї—М—В–∞—В—Л 12-–Љ–µ—Б—П—З–љ–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П),- –†–Ь–Ц,2009, вДЦ26: 2-7.
93. Scottish Intercollegiate Guidelines Network (SIGN) вДЦ 71: Management of osteoporosis: a national clinical guideline, June 2003.
94. Kanis J.A., Burlet N., Cooper C., Delmas P.D., Reginster J.Y., Borgstrom F., Rizzoli R. European guidance for the diagnosis and management of osteoporosis in postmenopausal women // Osteoporos Int, 2008;19:399-428.
95. Chapuy M.C., Arlot M.E., Delmas P.D. Meunier P.J. Effect of calcium and cholecalciferol treatment for three years on hip fractures in elderly women. BMJ. 1994. 308:1081–1082.












