Ревматоидный артрит (РА) – распространенное (около 1% населения планеты) аутоиммунное ревматическое заболевание, характеризующееся симметричным эрозивным артритом (синовитом) и широким спектром внесуставных (системных) проявлений [3]. Характерными проявлениями РА являются боли, нарушение функции суставов и неуклонно прогрессирующая деформация суставов, необратимое поражение внутренних органов, приводящие к ранней потере трудоспособности (около трети пациентов становятся инвалидами в течение 20 лет от начала болезни) и сокращению продолжительности жизни пациентов (в среднем на 5–15 лет). Преждевременная летальность во многом связана с высокой частотой сопутствующих заболеваний (инфекции, атеросклеротическое поражение сосудов, артериальная гипертензия, остеопоротические переломы костей скелета и др.) [4].
Современная концепция фармакотерапии РА основана на следующих основных принципах [1,5–12]:
• Целью лечения является достижение полной (или хотя бы частичной) ремиссии.
• Для достижения этой цели лечение базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), должно начинаться как можно раньше, желательно в течение первых 3–х месяцев от начала болезни.
• Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ до 20–25 мг/нед. и последующим изменением (при необходимости) схемы лечения в течение 2–4 мес. для достижения максимально возможного терапевтического эффекта.
• В случае недостаточной эффективности терапии БПВП – назначение генно–инженерных биологических препаратов (ГИБП).
Напомним, что к ГИБП относится широкий спектр препаратов, полученных с помощью методов генной инженерии: моноклональные антитела против определенных детерминант иммунокомпетентных клеток или «провоспалительных» цитокинов, «анти–воспалительные» цитокины и ингибиторы цитокинов (растворимые рецепторы, антагонисты) [13,14]. Все они обладают высокой специфичностью, обеспечивающей селективное воздействие на определенные звенья иммунопатогенеза, в минимальной степени затрагивая нормальные механизмы функционирования иммунной системы. Это позволяет существенно снизить риск «генерализованной» иммуносупрессии, которая характерна для других лекарственных препаратов (в первую очередь глюкокортикоидов и цитотоксиков). Более того, изучение клинических и иммунологических эффектов этих препаратов позволяет получить новые данные о механизмах патогенеза заболеваний человека. Наиболее изученной и широко применяемой при РА группой ГИБП являются ингибиторы ФНО–a (инфликсимаб, адалимумаб и этанерцепт), однако примерно у 40% пациентов с тяжелым активным РА они недостаточно эффективны или вызывают побочные эффекты, являющиеся основанием для прекращения лечения [15–17]. Это диктует необходимость совершенствования подходов к фармакотерапии РА.
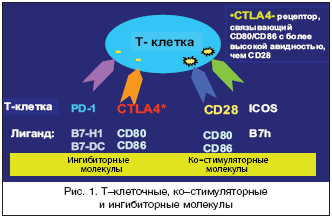
Поскольку по современным представлениям Т–клетки имеют фундаментальное значение в развитии РА [18], одним из важных направлений в лечении этого заболевания является подавление патологической активации Т–лимфоцитов [19]. Установлено, что для оптимальной активации Т–лимфоцитов требуется, как минимум, 2 сигнала (рис. 1). Один из них реализуется в процессе взаимодействия Т–клеточных рецепторов (ТКР) с молекулами главного комплекса гистосовместимости (ГКГ), экспрессирующимся на мембране антиген–презентирующих клеток (АПК), другой – за счет взаимодействия так называемых «ко–стимулирующих» рецепторов на Т–клетках и соответствующих лигандов на АПК [20,21]. Ключевой «ко–стимуляторный» сигнал обеспечивается за счет взаимодействия CD28 на Т–лимфоцитах и СD80/СD86 на АПК. CD28 постоянно экспрессируется на наивных CD4+ и CD8+ Т клетках, а CD80 и CD86 – только после стимуляции АПК. При наличии обоих сигналов Т–лимфоциты подвергаются пролиферации и синтезируют цитокины, которые, в свою очередь, активируют другие клетки иммунной системы, и прежде всего макрофаги. В отсутствие «ко–стимуляторного» сигнала Т–лимфоциты теряют способность эффективно «отвечать» на антигенные стимулы и подвергаются апоптозу. Наиболее мощным физиологическим ингибитором взаимодействия CD28–CD80/CD86 является CTLA4 (cytotoxic T–lymphocyte–associated antigen 4) – рецептор для CD80/CD86, который экспрессируется после активации АПК и взаимодействует с этими лигандами с более высокой авидностью (примерно в 500–2500 раз выше), чем CD28. Эта молекула рассматривается, как негативный регуляторный рецептор, который ограничивает неконтролируемую активацию Т–клеток в процессе иммунного ответа.
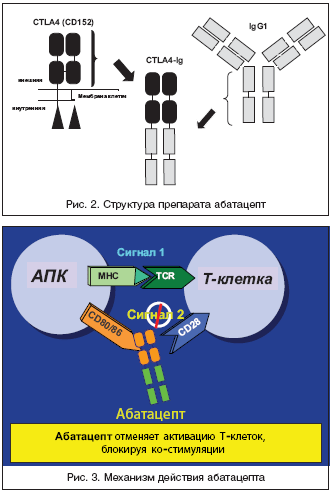
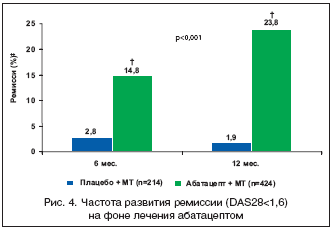
Это послужило основанием для разработки препарата абатацепт (Abatacept, Orencia, Bristol Myers Squibb), который представляет собой растворимую гибридную белковую молекулу, состоящую из двух компонентов – внеклеточного домена CTLA4 человека и модифицированного Fc (CH2 и CH3 области) фрагмента IgG1 (рис. 2). Модификация Fc фрагмента обеспечивает низкую способность абатацепта индуцировать комплемент–зависимые и антитело–зависимые клеточные цитотоксические реакции. Как и нативный CTLA4, этот белок связывается с более высокой авидностью с CD80/86, чем с CD28, и блокирует активацию Т–клеток (рис. 3).
По данным экспериментальных исследований, абатацепт подавляет развитие коллагенового артрита (классическая лабораторная модель РА у человека) при введении препарата во время иммунизации лабораторных животных коллагеном и замедляет прогрессирование артрита при введении на фоне его развития [22].
Абатацепт разрешен к применению для лечения РА в США (декабрь 2005), Канаде (июнь 2006) и Европе (май 2007) и проходит клиническую апробацию для лечения рассеянного склероза, псориаза и системной красной волчанки.
Лечение абатацептом проводится путем внутривенной инфузии препарата в дозе 10 мг/кг (500 мг при весе пациента менее 60 кг; 750 мг при весе 60–100 кг и 1000 мг при весе более 100 кг), затем через 2 и 4 нед., ежемесячно.
Эффективность
Клинические испытания, в которых была продемонстрирована высокая эффективность и безопасность абатацепта при РА, начались еще в конце прошлого века [23–25]. В дальнейшем была проведена серия рандомизированных плацебо–контролируемых исследований (РКПИ) в рамках фазы III клинических испытаний, которые соответствовали современным стандартам исследования современных БПВП [26–36].
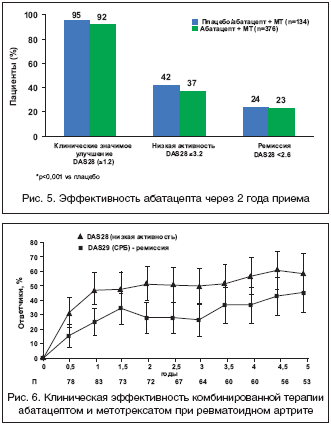
Целью исследования AIM (Abatacept in Inadequate responders to Methotrexate) [26] являлось изучение клинической эффективности и влияния на прогрессирование деструкции суставов комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ у пациентов с активным РА с неадекватным ответом на МТ. В этом исследовании установлена более высокая эффективность комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ (рис. 4). Результаты 2–летнего наблюдения за пациентами продемонстрировали длительное сохранение эффекта комбинированной терапии: ACR20/50/70 наблюдался соответственно у 80,3, 55,6 и 34,3% пациентов, низкая активность по DAS28 – у 56,1%, а ремиссия – у 30,9% (рис. 5). Установлено: в целом комбинированная терапия оказывает более выраженное влияние, чем монотерапия на прогрессирование деструкции суставов (1,07 ед. по сравнению с 2,4 ед.), в первую очередь за счет влияния насчет эрозий, но не на сужение суставной щели. Эффект в отношении замедления деструкции суставов сохранялся в течение двух лет терапии [31]. У тех пациентов, которые в течение второго года терапии вместо плацебо получали лечение абатацептом, наблюдалось замедление прогрессирования деструкции суставов (2,4 ед. через год лечения плацебо и 3,1 через год лечения абатацептом). В группе больных, получавших абатацепт в течение 2 лет, этот показатель составил 1,07 ед. в конце первого года и только 1,5 ед. в течение второго года. Эти данные указывают на нарастание эффективности абатацепта в отношении замедления деструктивного процесса в суставах в процессе длительного лечения препаратом.
В открытой фазе исследования [25], в котором была установлена более высокая эффективность комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ, было показано, что лечение абатацептом и МТ эффективно в течение 5 лет терапии (рис. 6) и не сопровождается нарастанием частоты побочных эффектов [36].
ATTEST (Abatacept or infliximab versus placebo, A Trial for Tolerability, Efficacy and Safety in Treating RA) – первое и пока единственное исследование, в котором сравнивалась эффективность и безопасность двух ГИБП – абатацепта и ингибитора ФНО–a инфликсимаба [29] (рис. 7). Через 6 мес. пациенты, получавшие плацебо, переключались на лечение абатацептом. Через 6 мес. все анализируемые параметры эффективности (критерии ACR и EULAR) в группе пациентов, получавших абатацепт и инфликсимаб, были достоверно лучше, чем у пациентов, получавших плацебо (рис. 8 и 9). Отмечена определенная тенденция к более высокой эффективности и длительности сохранения эффекта у абатацепта по сравнению с инфликсимабом (рис. 8). Однако следует подчеркнуть: в группе пациентов, получавших инфликсимаб, не допускалась эскалация дозы препарата (более 3 мг/кг). Это не позволяет сделать заключение о более высокой эффективности абатацепта по сравнению с инфликсимабом.
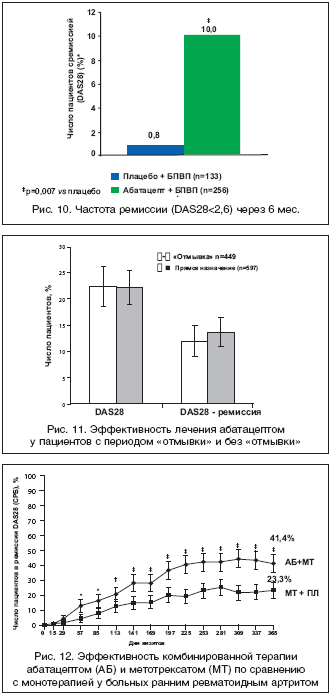
Исследование ATTAIN (Abatacept Trial in Treatment of Anti–TNF Inadequate Responders) было посвящено оценке эффективности абатацепта у пациентов с неэффективностью ингибиторов ФНО–a [27]. Через 6 мес. эффективность абатацепта (ACR20) была существенно выше (50,4%), чем в группе плацебо (19,5%). Сходные данные получены при анализе числа пациентов с низкой активностью и достигших ремиссии по критерию EULAR (p<0,001) (рис. 10). Данные 18–месячной открытой фазы этого исследования свидетельствуют о длительном сохранении эффекта (ACR20 – 56,2%).
Важные результаты получены в открытом исследовании ARRIVE (Abatacept Researched in RA patients with an Inadequete anti–TNF response to Validate Effectiveness), в которое вошло 1046 больных с активным РА, несмотря на лечение ингибиторами ФНО–a [28]. Основной целью исследования было получение данных об эффективности и безопасности абатацепта у пациентов с РА в условиях, максимально приближенных к реальной клинической практике. В исследование были включены пациенты с побочными эффектами (или плохой переносимостью) ингибиторов ФНО–a и пациенты, которым проводилось профилактическое лечение по поводу латентного туберкулеза (положительная туберкулиновая проба, но отсутствие изменений при рентгенологическом исследовании легких). Кроме того, допускались прием любых БПВП и монотерапия абатацептом и возможность прямого перехода на лечение абатацептом без периода предварительной «отмывки» после завершения лечения ингибиторами ФНО–a. Было выделено 2 группы пациентов. В первую вошли 449 пациентов, которым проводилась «отмывка» перед назначением абатацепта, и 597 пациентов, которым лечение назначалось сразу после прекращения лечения ингибиторами ФНО–a. Установлено, что схема перехода на лечение абатацептом не влияет на эффективность (рис. 11) и, что самое важное – на безопасность терапии, по крайней мере, в течение первых 6 мес. наблюдения за пациентами. Так, частота ПЭ составила в сравниваемых группах 78% vs. 79,2%, тяжелых ПЭ – 11,1 и 9,9%, а частота прерывания лечения из–за побочных эффектов 3,8% vs. 4/0%.
Как уже отмечалось, современные принципы фармакотерапии РА основаны на ранней агрессивной терапии в дебюте болезни. Особый интерес представляют данные недавно завершенного исследования [34], целью которого было изучение эффективности комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ у пациентов с ранним РА, впервые начавших получать МТ. При этом пациенты с РА страдали прогностически неблагоприятной формой заболевания, характеризующейся высокими титрами ревматоидного фактора (РФ) и антител к циклическому цитруллинированному пептиду (аЦЦП), которые рассматриваются, как маркер агрессивного течения РА [37]. Установлено, что комбинированная терапия абатацептом и МТ существенно превосходит по эффективности монотерапию МТ, в том числе по частоте развития ремиссии (рис. 12). Интересно, что сходные данные получены в процессе исследования COMET, в котором сравнивалась эффективность комбинированной терапии ингибитором ФНО–a – этанерцептом по сравнению с монотерапией МТ у пациентов с ранним РА [38]. Эти данные свидетельствуют о потенциальной возможности применения не только ингибиторов ФНО–a, но и абатацепта при раннем РА.
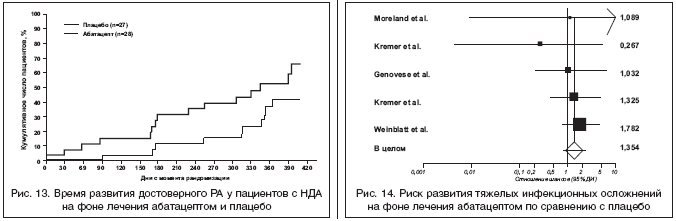
В недавних исследованиях было показано, что назначение МТ у пациентов с недифференцированным артритом (НДА) позволяет замедлить (и в некоторых случаях предотвратить) трансформацию НДА в достоверный РА [39], причем эффективность МТ ассоциировалась с обнаружением аЦЦП в сыворотках крови пациентов. Возникает вопрос: может ли агрессивная терапия ГИБД на стадии НДА приостановить развитие РА на самой ранней стадии болезни? Это послужило основанием для проведения специального РКПИ (фаза II) [35], в которое вошли 55 аЦЦП–позитивных пациентов с НДА ( ≥ 2 припухших суставов), которые были рандомизированы на 2 группы. Первая группа (п=28) получала монотерапию абатацептом (10 мг/кг), вторая (п=27) плацебо в течение 6 мес. Допускался прием НПВП и низких доз ГК (<10 мг/сут.), но не БПВП. Через год лечения достоверный РА развился у 46% пациентов группы, получавшей абатацепт, и у 67% пациентов, получавших плацебо. Эти данные свидетельствуют о том, что монотерапия абатацептом позволяет замедлить прогрессирование НДА в РА, причем этот эффект сохранялся в течение 6 мес. после прекращения лечения абатацептом (рис. 13). Примечательно, что лечение ингибиторами ФНО–a (инфликсимаб) хотя и приводило к положительной динамике некоторых показателей активности НДА, не предотвращало прогрессирование НДА в достоверный РА [46]
Нежелательные явления (НЯ)
Анализ результатов 5 основных РКИ (п=2944), касающихся применения абатацепта при РА (в целом лечение абатацептом получили 1995 пациентов, что составило 1687 пациентов–год), свидетельствует о достаточной высокой безопасности препарата [40,41].
Частота всех зарегистрированных НЯ на фоне лечения абатацептом и в контрольной группе была сходной и составила соответственно 88,8%, и 85,1%. Частота прерывания лечения из–за НЯ также не различалась (5,8% и 3,9%). При этом частота НЯ, непосредственно связанных с лечением, составила соответственно 52,2% и 46,1%, а прерывания лечения в связи с НЯ – 3,4% и 2,2%. Наиболее частыми НЯ в обеих группах пациентов были головные боли, ОРВИ, фарингит, диарея, тошнота, головокружение. Гипертензия и диспепсия несколько чаще (примерно на 2%) имели место на фоне лечения абатацептом, чем в контрольной группе. Наиболее частыми инфекционными осложнениями в обеих группах были респираторная и мочевая инфекции. Их частота была несколько выше (1%) на фоне лечения абатацептом. Частота НЯ в открытой фазе исследований в целом не отличалась от их встречаемости в контролируемой фазе. Тяжелые НЯ развились у 14,0% пациентов, получавших абатацепт, и у 12,5% пациентов в контроле, и привели к прерыванию лечения, соответственно в 2,8% и 1,6% случаев.
Общая частота тяжелых инфекционных осложнений была низкой и составила 3% в группе пациентов, получавших абатацепт и 1,9% в контроле, а инфекций, связанных с лечением, соответственно – 1,8% и 1%. Наиболее частыми инфекциями в обеих группах была пневмония (0,5%). Развития гепатита В и С, ВИЧ–инфекции и прогрессирующей мультифокальной лейкоэнцефалопатии не зарегистрировано. На фоне лечения абатацептом выявлено развития одного случая легочного аспергиллеза, приведшего к летальному исходу.
Особый интерес представляет оценка риска туберкулезной инфекции, которая является важным осложнением лечения ингибиторами ФНО–a [42,43]. Следует подчеркнуть, что при включении в РКПИ абатацепта все пациенты скринировались в отношении латентной туберкулезной инфекции. Пациенты с положительной туберкулиновой пробой или имевшие активной туберкулез в течение последних 3 лет не включались в испытание. Имеются сообщения о развитии только 2 случаев вероятного туберкулеза (2 в основной и 1 – в контрольной группе). По данным экспериментальных исследований, абатацепт (в отличие от мышиных антител к ФНО–a) не ослабляет противотуберкулезный иммунитет у мышей C57BL/6 с хронической инфекцией M. tuberculosis [44].
Материалы исследования ATTEST [29] свидетельствуют о более низкой частоте развития тяжелых инфекционных осложнений на фоне лечения абатацептом (1,3%), чем инфликсимабом (4,2%) и плацебо (2,7%), и инфузионных реакций по сравнению с инфликсимабом (7,1% vs 24,8% соответственно).
В целом материалы недавно проведенного мета–анализа основных РКИ абатацепта при РА свидетельствуют об отсутствии достоверного увеличения риска тяжелых инфекционных осложнений на фоне лечения препаратом по сравнению с плацебо [45] (рис. 14).
Безопасность применения абатацепта в ситуации, максимально приближенной к реальной клинической практике, анализировалась в 1–годичном исследовании ASSURE [32], в которое вошли пациенты с различными коморбидными заболеваниями, включая сахарный диабет (7%), бронхиальную астму (6%), ХОБЛ (4%), застойную сердечную недостаточность (1%). В целом частота НЯ у пациентов, получавших комбинированную терапию абатацептом и БПВП (90%), не отличалась от пациентов, получавших плацебо и БПВП (87%). Частота тяжелых НЯ (12,8 и 12,2%) и тяжелых/очень тяжелых (16 и 15%) НЯ также была сходной. Прерывание лечения из–за НЯ имело место у 5,4% пациентов, получавших абатацепт, и у 4,1% в контроле. Частота инфекционных осложнений – 56,0 и 54,1%, включая тяжелые инфекции (2,9 и 1,9%). Развития туберкулеза, ВИЧ–инфекции, гепатита В и С и цитомегаловирусной инфекции не отмечено. Частота злокачественных новообразований составила 3,5% в обеих группах, случаев развития лимфом не описано.
Особый интерес представляет анализ небольшой группы пациентов, получавших комбинированную терапию абатацептом и другими ГИБП. Ранее в многоцентровом РКИ, в котором сравнивались эффективность и безопасность комбинированной терапии абатацептом (2 мг/кг) и ингибитором ФНО–a – этанерцептом у пациентов с недостаточным эффектом последнего, было обнаружено нарастание частоты инфекционных осложнений на фоне комбинированной терапии (16 и 2,8% соответственно) [33]. При этом тяжелые инфекции (3,5%) имели место только у получавших абатацепт и этанерцепт, а у 3 пациентов развились злокачественные новообразования. Сходные данные получены в исследовании ASSURE. У пациентов, получавших комбинированную терапию абатацептом и ГИБП, частота НЯ (95,1 и 89,1%) и особенно тяжелых НЯ (22,3 и 12,5%) была достоверно выше, чем в контроле. Кроме того, на фоне лечения абатацептом отмечено нарастание частоты НЯ и тяжелых побочных эффектов у пациентов, страдающих ХОБЛ.
Анализ всей совокупности имеющихся в настоящее время данных, суммированных в Международном консенсусе, касающемся применения ГИБП в ревматологии [17], позволяет сделать следующие заключения о месте абатацепта в лечении РА:
1. Абатацепт эффективно подавляет клинические проявления РА и улучшает физическую активность у пациентов с умеренно тяжелым/тяжелым РА с неадекватным ответом на БПВП (включая МТ) и ингибиторы ФНО–a (категория А).
2. Улучшение обычно развивается в течение 16 нед. и иногда нарастает в течение 3 лет (категория D).
3. При отсутствии значимого улучшения в течение 16 нед. продолжение терапии нецелесообразно.
4. Абатацепт в комбинации с МТ ингибирует прогрессирование деструкции суставов по данным рентгенологического исследования (категория А).
5. Поскольку у пациентов РА с сопутствующей ХОБЛ на фоне лечения абатацептом отмечено нарастание частоты НЯ, у этой категории больных препарат должен назначаться с особой осторожностью.
6. Хотя по данным РКИ реактивации туберкулезной инфекции на фоне лечения абатацептом не отмечено, истинный риск туберкулезной инфекции на фоне лечения абатацептом пока не известен, и перед началом лечения пациенты должны быть обследованы для исключения наличия латентного туберкулеза.
7. Лечение абатацептом ассоциируется с умеренным риском развития тяжелых бактериальных инфекций (категория А).
8. Не рекомендуется комбинированная терапия абатацептом и ингибиторами ФНО (категория А).
9. На фоне лечения абатацептом противопоказана иммунизация живыми вакцинами.
Таким образом, абатацепт является новым весьма перспективным препаратом для лечения РА и, вероятно, некоторых других аутоиммунных заболеваний (псориаз, рассеянный склероз, системная красная волчанка, бронхиальная астма и др.). Его широкое внедрение в клиническую практику может иметь существенное значение для максимальной индивидуализации терапии этого заболевания.

Литература
1. Autoimmune rheumatic disease. Ed. J. Morrow., L. Nelson, R. Watts, D. Isenberg. Secong Ed. 1999. Oxford University Press
2. Насонов Е.Л. Каратеев Д.Е. Ревматология. Национальное руководство. Ревматоидный артрит. Под редакцией Е.Л. Насонова, В.А. Насоновой.. Москва. Издательство ГЭОТАР–Медиа. 2008. стр 852
3. Насонов Е.Л. Ревматоидный артрит как общемедицинская проблема. Терапевт. Архив 2004; 5: 5–7
4. Pincus T, Sokka T. Mortality in rheumatic diseases: introduction. Clin Exp Rheumatol 2008; 26 (Suppl. 51): S35–S61
5. Насонов Е.Л. Лечение ревматоидного артрита. Клинические рекомендации. Издательство «Алмаз», Москва, 2006, 118 стр
6. Насонов ЕЛ. Лечение ревматоидного артрита: современное состояние проблемы. РМЖ 2006; 14 (8); 573–577
7. Насонов ЕЛ. Фармакотерапия ревматоидного артрита в эру генно–инженерных биологических препаратов. Терапевтический Архив , 2007, 5, 5–8
8. Насонов Е.Л. Фармакотерапия ревматоидного артрита – взгляд в 21 век. Клин. медицина 2005; 6: 8–12
9. Luqmani R, Hennel S, Estrach C, et al., on Behalf of the British Society for Rheumatology and British Health Professionals in Rheumatology Standarts, Guidelines and Audit Working Group. British Society for Rheumatology and British Health Professionals in Rheumatology Guideline for the Management of Rheumatoid Arthritis (The first 2 years). Rheumatology 2006; 45:1167–1169
10. Luqmani R, Hennel S, Estrach C, et al., on Behalf of the British Society for Rheumatology and British Health Professionals in Rheumatology Standarts, Guidelines and Audit Working Group. British Society for Rheumatology and British Health Professionals in Rheumatology Guideline for the Management of Rheumatoid Arthritis (after the first 2 years). Rheumatology 2009; on line/
11. Combe B., Landewe R., Lukas C. et al. EULAR recommendations for the management of early arthritis: report of task force of the European Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann. Rheum. Dis., 2007, 66: 34–45
12. Saag KG, Teng GG, Patkar NM, et al. American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease–modifying ant rheumatic drugs in rheumatoid arthritis. Arthritis Rheum. 2008; 59: 762–784
13. Kuek A, Hazleman BL, Ostor AJK. Immune mediated inflammatory diseases (IMIDs) and biologic therapy: a medical revolution. Postgrad Med J 2007; 83: 251–260
14. Smolen JS, Aletaha D, Koeller M, Weisman M, Emery P. New therapies for treatment of rheumatoid arthritis. Lancet 2007; 370: 1861–1874
15. Tracey D, Klareskog L, Sasso EH, et al. Tumor necrosis factor antagonist mechanisms of action: a comprehensive review. Pharmacol Therapeut 2008; 117:244–279
16. Насонов Е.Л. Фактор некроза опухоли–a – новая мишень для противовоспалительной терапии ревматоидного артрита. Клин. Фармакол. Терапия 2001;1:64–70
17. Furst DE, Keystone EC, Kirkham B, et al. Update consensus statement on biological agents for the treatment of rheumatic disease, 2008. Ann Rheum Dis 2008; 67: iii2–iii25
18. Isaacs JD. Therapeutic T–cell manipulation in rheumatoid arthritis: past, present and future. Rheumatology 2008; 47: 1461–1468
19. Weyand C, Goronzy JJ. T–cell–tergeted therapies in rheumatoid arthritis. Nat Clin Pract Rheumatol 2006; 2: 201–210
20. Egen JG, Kuhns MS, Allison JP (2002) CTLA–4: new insights into its biological function and use in tumor immunotherapy. Nature Immunology 3: 611–618
21. Yamada A, Salama AD, Sayegh MH. The role of novel T–cell co–stimulation pathways in autoimmunity and transplantation. J Am Soc Nephrol 2002; 13: 559–575
22. Webb LM, Walmsley MJ, Feldmann M: Prevention and amelioration of collagen–induced arthritis by blockade of the CD28 co–stimulatory pathway: requirement for both B7–1 and B7–2. Eur J Immunol 1996, 26:2320–2328.
23. Moreland LW, Alten R, Bosch F, Appelboom T, Leon M, Emery P, Cohen S, Luggen M, Shergy W, Nuamah I, Becker JC: Costimulatory blockade in patients with rheumatoid arthritis: a pilot, dose–finding, double–blind, placebo–controlled clinical trial evaluating CTLA–4Ig and LEA29Y eighty–five days after the first infusion. Arthritis Rheum 2002, 46:1470–1479.
24. Kremer JM, Westhovens R, Leon M, Di Giorgio E, Alten R, Steinfeld S, Russell A, Dougados M, Emery P, Nuamah IF, Williams GR, Becker JC, Hagerty DT, Moreland LW: Treatment of rheumatoid arthritis by selective inhibition of T–cell activation with fusion protein CTLA4Ig. N Engl J Med 2003, 349:1907–1915.
25. Kremer JM, Dougados M, Emery P, Durez P, Sibilia J, Shergy W, Steinfeld S, Tindall E, Becker JC, Li T, Nuamah IF, Aranda R, Moreland LW: Treatment of rheumatoid arthritis with the selective costimulation modulator abatacept: twelve–month results of a phase iib, double–blind, randomized, placebo–controlled trial. Arthritis Rheum 2005, 52:2263–2271.
26. Kremer JM, Genant HK, Moreland LW, Russell AS, Emery P, Abud–Mendoza C, Szechinski J, Li T, Ge Z, Becker JC, Westhovens R: Effects of abatacept in patients with methotrexate–resistant active rheumatoid arthritis: a randomized trial. Ann Intern Med 2006, 144:865–876.
27. Genovese MC, Becker JC, Schiff M, Luggen M, Sherrer Y, Kremer J, Birbara C, Box J, Natarajan K, Nuamah I, Li T, Aranda R, Hagerty DT, Dougados M: Abatacept for rheumatoid arthritis refractory to tumor necrosis factor alpha inhibition. N Engl J Med 2005, 353:1114–1123.
28. Schiff MH, Pritchard C, Huffstutter JE, et al. The 6–month safety and efficacy of abatacept in patients with rheumatoid arthritis who underwent a washout after anti–TNF therapy or were directly switched to abatacept: the ARRIVE trial. Ann Rheum Dis 2009; 15 Dec, on line.
29. Schiff M, Keiserman M, Codding C, Songcharoen S, Berman A, Nayiager S, Saldate C, Li T, Aranda R, Becker J–C, Lin C, Cornet PLN, Dougados M: Efficacy and safety of abatacept or infliximab vs placebo in ATTEST: a phase III, multi–centre, randomised, double–blind, placebo–controlled study in patients with rheumatoid arthritis and an inadequate response to methotrexate. Ann Rheum Dis 2008, 67:1096–1103.
30. Kremer JM, Genant HK, Moreland LW, Russell AS, Emery P, Abud–Mendoza C, Szechinski J, Li T, Teng J, Becker JC, Westhovens R: Results of a two–year followup study of patients with rheumatoid arthritis who received a combination of abat–acept and methotrexate. Arthritis Rheum 2008, 58:953–963.
31. Genant HK, Peterfy CG, Westhovens R, Becker JC, Aranda R, Vratsanos G, Teng J, Kremer JM: Abatacept inhibits structural damage progression in rheumatoid arthritis: results from the long–term extension of the AIM trial. Ann Rheum Dis 2007, in press.
32. Weinblatt M, Combe B, Covucci A, Aranda R, Becker JC, Keystone E: Safety of the selective costimulation modulator abat–acept in rheumatoid arthritis patients receiving background biologic and nonbiologic disease–modifying antirheumatic drugs: a one–year randomized, placebo–controlled study. Arthritis Rheum 2006, 54:2807–2816.
33. Weinblatt M, Schiff M, Goldman A, Kremer J, Luggen M, Li T, Chen D, Becker JC: Selective costimulation modulation using abatacept in patients with active rheumatoid arthritis while receiving etanercept: a randomised clinical trial. Ann Rheum Dis 2007, 66:228–234.
34. Westhovens R, Robles M, Ximenes AD, et al. Clinical efficacy and safety of abatacept in methotrexate–naive patients with early rheumatoid arthritis. And poor prognostic factors. Ann Rheum Dis 2009l 5 Jan, online.
35. Emery P, Durez P, Dougados M, et al. Efficacy of abatacept in delaying the development of rheumatoid arthritis (RA) in adult patients with undifferentiated inflammatory arthritis at high risk of developing RA. Ann Rheum Dis 2008; 67 (Suppl II):89.
36. Westhoven R, Kremer J, Moreland L, et al. Durable impact on disease activity and consistent saferty through 5 years in abatacept–treated RA patients background methotrexate. Ann Rheum Dis 2008; 67 (Suppl II): 341.
37. Avouac J, Gossec L, Dougados M. Diagnostic and predictive value of anti–cyclic citrullinated protein antibodies in rheumatoid arthritis: a systemic literature review. Ann Rheum Dis 2006; 65: 845–851.
38. Emery P, Breedveld FC, Hall S, et al. Comparison of methotrexate monotherapy with a combination of methotrexate and etanercept in active early, moderate to severe rheumatoid arthritis (COMET): a randomized, double–blind, parallel treatment trial. Lancet 2008; July 16, on line.
39. van Donger H, van Aken J, Lard LR et al. Efficacy of methotrexate treatment in patients with probable rheumatoid arthritis. A double–blind, randomized, placebo controlled trial. Arthritis Rheum 2007; 56: 1424–1432.
40. Sibilia J, Westhovens R. Safety of T–cell co–stimulation modulation with abatacept in patients with rheumatoid arthritis. Clin Exp Eheumatol 2007; 25 (Suppl 46): S46–S56.
41. Bristol–Myers Squibb: Summary of product characteristic.2007.http://www.emea.europa.eu/humandocs/PDFs/EPAR/orencia?H–701–PI–en.pdf.
42. Wintrop KL. Risk and prevention of tuberculosis and other serious opportunistic infections associated with the inhibition of tumor necrosis factor. Nature Clin Pract Rheumatol 2006; 2: 602–610.
43. Козлов РС, Якушин СБ, Насонов ЕЛ. Инфекционные осложнения терапии блокаторами фактора некроза опухоли: предупрежден – значит вооружен. Клиническая Микробиология и антимикробная химиотерапия, 2006, 8:314–324.
44. Bigbee CL, Gonchoroff DG, Vratsanos G, et al. Abatacept treatment does not exacerbate chronic Mycobacterium tuberculosis infection in mice. Arthritis Rheum 2007; 56: 2557–2565.
45. Salliot C, Dougados M, Gossec L. Risk of serious infections during rituximab, abatacept and anakinra therapies for rheumatoid arthritis: meta–analysis of randomized placebo–controlled trials. Ann Rheum Dis, Jan 18, 2008, on line.
46. Salem B, Mackie S, Quinn M, et al. Does the use оf tumor necrosis factor antagonist therapy in poor prognosis, undifferentiated arthritis prevent progression to rheumatoid arthritis? Ann Rheum Dis 2008; 67: 1178–1180.












